REGISTRO DOI: 10.69849/revistaft/ra10202501290855
Juliana Araujo Arrais1
Bruna Gomes Vasconcelos2
Orientador: Romerito Fonseca Neiva3
RESUMO
Introdução: Os GISTs do duodeno são raros tumores mesenquimais originados das células intersticiais de Cajal, frequentemente associados a mutações nos genes KIT ou PDGFRA. Representam uma pequena parcela dos casos de GISTs, predominando em homens mais velhos e localizando-se, em sua maioria, na segunda porção do duodeno. Os sintomas mais comuns incluem dor abdominal e sangramento gastrointestinal, e o tratamento principal é a ressecção cirúrgica, com bom prognóstico após a ressecção curativa. No entanto, o acompanhamento a longo prazo é crucial devido ao risco de recidivas tardias.
Relato de caso: Este artigo expõe um caso de uma paciente do sexo masculino, que apresentava o diagnóstico de GIST de duodeno, sugestivo por ressonância e com diagnóstico imunohistoquímico por endoscopia digestiva alta.
Conclusão: O manejo dos GISTs duodenais requer uma abordagem individualizada, com ressecção cirúrgica como pilar principal, complementada por terapias adjuvantes em casos selecionados. O acompanhamento deve focar na avaliação das funções pancreáticas e na gestão de complicações, integrando equipes multidisciplinares. A educação dos pacientes é essencial para mitigar riscos e melhorar os resultados a longo prazo. Esse cuidado visa otimizar a qualidade de vida e os desfechos clínicos.
PALAVRAS-CHAVE: GIST. Tumores de Duodeno. Duodenopancreatectomia. Tumores Periampulares.
INTRODUÇÃO
Os tumores estromais gastrointestinais (GISTs) do duodeno constituem uma forma rara de neoplasia mesenquimal, originada a partir das células intersticiais de Cajal. Sua fisiopatologia está comumente relacionada a mutações ativadoras nos genes KIT ou PDGFRA, que codificam tirosina quinase receptoras. Essas mutações resultam na ativação permanente das vias de sinalização celular, contribuindo para o crescimento tumoral (WANG et al., 2021).
Epidemiologicamente, os GISTs duodenais são menos frequentes em relação aos GISTs gástricos e do intestino delgado, representando uma pequena parcela dos casos. Esses tumores apresentam leve predominância em indivíduos do sexo masculino, ocorrendo principalmente em adultos mais velhos. A segunda porção do duodeno é a localização mais comum desses tumores (YANG et al., 2013; LIU et al., 2018).
Os sintomas clínicos são, em sua maioria, inespecíficos, destacando-se o sangramento gastrointestinal e a dor abdominal como as manifestações mais recorrentes. O sangramento pode ser evidente ou oculto, enquanto a dor, frequentemente, está associada à obstrução ou ulceração tumoral (MARANO et al., 2015; JOHNSTON et al., 2012).
Em relação ao manejo, a ressecção cirúrgica é a principal estratégia terapêutica nos casos não metastáticos. A escolha entre a ressecção local e a duodenopancreatectomia depende das características do tumor, como tamanho e localização. A ressecção local é geralmente suficiente, mas a duodenopancreatectomia pode ser necessária em tumores maiores ou situados em áreas de maior complexidade anatômica (LIU et al., 2018; JOHNSTON et al., 2012). A sobrevida livre de recorrência é, em geral, favorável após ressecção curativa, embora uma alta atividade mitótica seja um fator preditivo relevante para desfechos adversos (YANG et al., 2013).
Estudos de séries de casos sugerem que a recorrência dos GISTs duodenais está mais relacionada às características biológicas do tumor do que à técnica cirúrgica empregada. Apesar disso, a sobrevida global dos pacientes é, em geral, satisfatória, sendo essencial um acompanhamento de longo prazo devido ao risco de recidiva tardia (JOHNSTON et al., 2012).
RELATO DE CASO
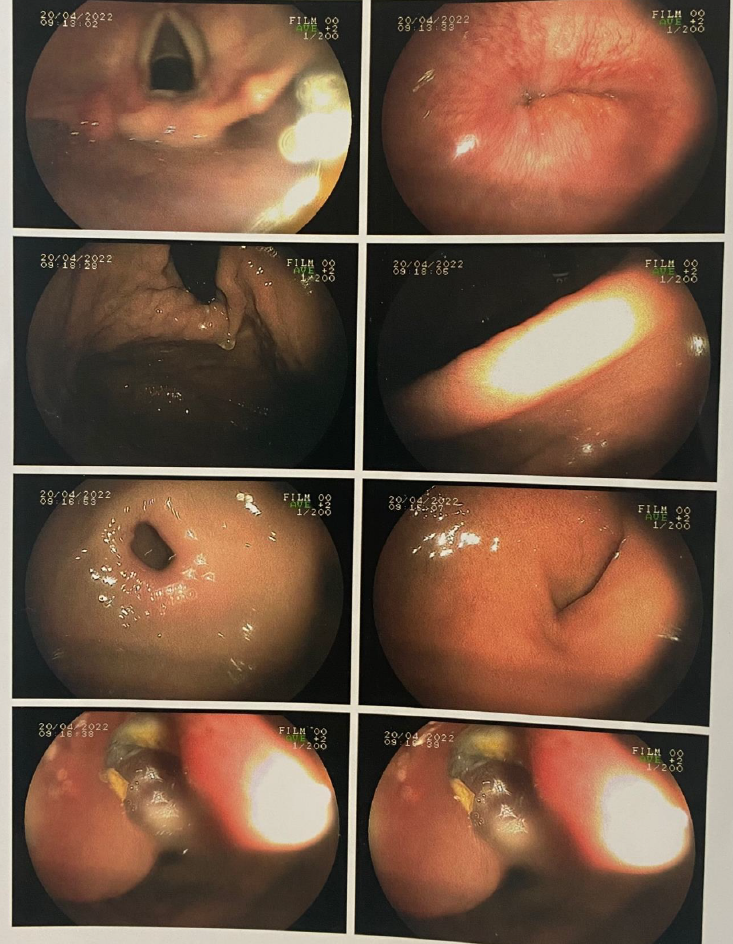
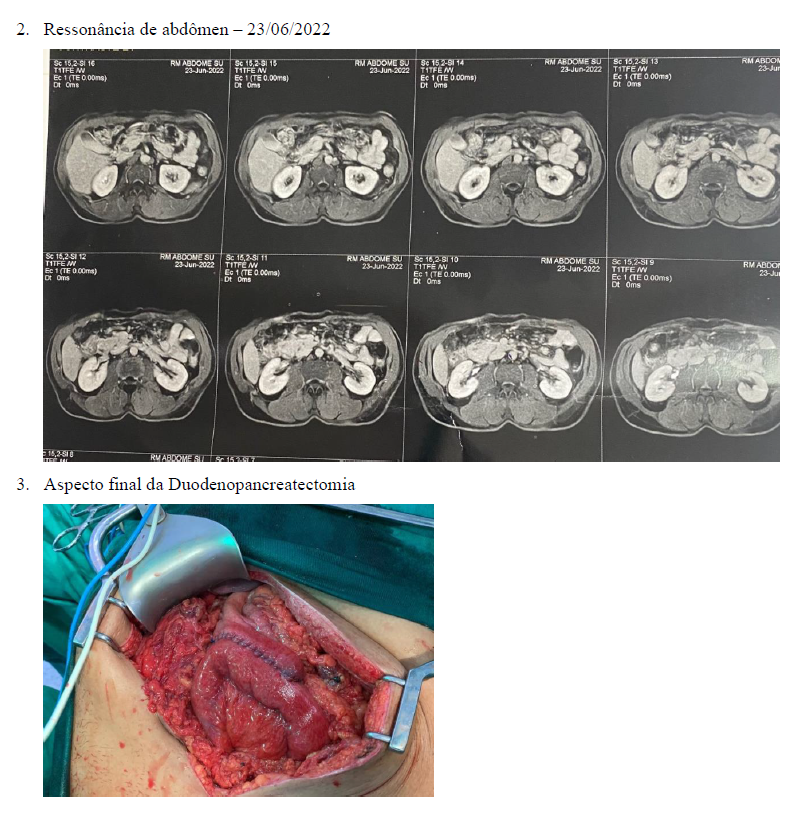
Paciente do sexo masculino, 56 anos, sem história de etilismo ou tabagismo prévias, iniciou quadro de melena e astenia em março de 2022, seguido de entrada em serviço de pronto atendimento de cirurgia geral com exames laboratoriais os quais evidenciavam queda importante de hemoglobina (28/03/2022 – 8,2 dL/mL). Realizou endoscopia digestiva alta que evidenciava angioectasia de fundo gástrico, sem sinais de sangramento e úlcera duodenal na transição da primeira para a segunda porção duodenal, Forrest 1b, sendo realizado esclerose com adrenalina. Realizou novo exame de endoscopia em 20/04/2022, que evidenciava em segunda porção duodenal, em parede anterior, lesão de bordos elevados, estreitando a luz, centro ulcerado com densa fibrina, medindo 1 cm, sem sangramento ativo (anexo 1), sugestiva de GIST. Em investigação diagnostica, realizou ressonância magnética de abdome superior, que mostrava formação expansiva nodular heterogênea com predomínio de hipersinal em T2 e hipossinal em T1, com contornos irregulares, em topografia de segunda porção do duodeno, medindo 3,6×3,1 cm, apresentando realce heterogêneo e hipervascular pelo meio de contraste e sinais de restrição a difusão da água; a lesão apresentava intimo contato com a cabeça pancreática e determinava redução da luz duodenal, sem sinais de obstrução, sugestiva de GIST (anexo 2). No estudo microscópico do material coletado na endoscopia, demonstrava GIST duodenal sem áreas de necrose, ausência de mitoses em 10 campos de grande aumento, ao estudo imunohistoquímico, apresentava CD 117 positivo, Kl 67 inferior a 1%.
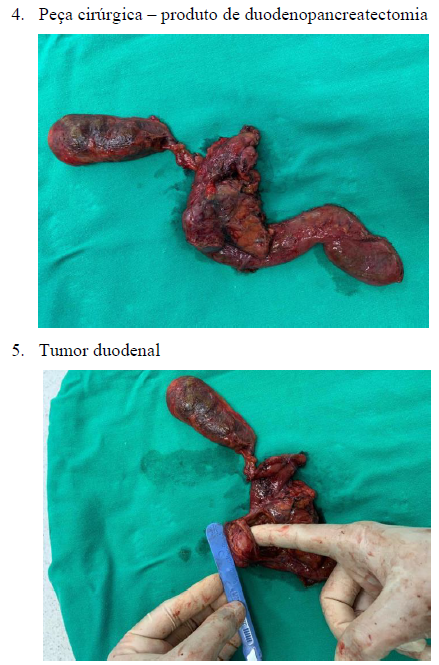
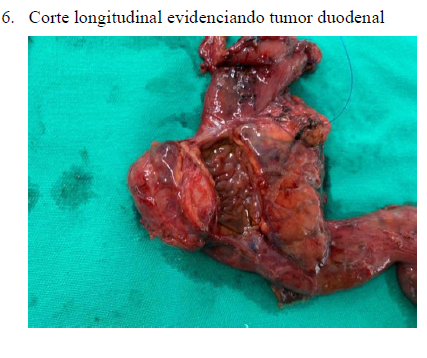
Após análise clínica e discussão do caso, foi considerado a ressecção local, porém pelo risco de estenose duodenal, foi optado pela realização de gastroduodenopancreatectomia. O referido paciente internou no dia 19/08/2022 para realização do procedimento. Após a realização de 1 grama de cefoxitina endovenosa como antibioticoprofilaxia cirúrgica, o paciente foi submetido sob anestesia multimodal (geral venosa balanceada associada à peridural) e posicionado em decúbito dorsal horizontal. Realizada incisão mediana supra umbilical se estendendo para região infra umbilical, seguido da diérese por planos até a cavidade abdominal, com ressecção da gordura pré-peritoneal. Realizado inventário da cavidade abdominal, evidenciando lesão duodenal restrita de órgãos, sem metástase ou ascite. Realizado o descolamento intercolon-epiplóico até a visualização de borda pancreática inferior e início da manobra de Warren usando pinça bipolar avançada, seguido de manobra de Kocher estendida com visualização de veia renal esquerda e liberação do duodeno no ângulo de Treitz. Por tratar-se de um tumor GIST confirmado histologicamente não fora feito linfadenectomia retroperitoneal, realizada a linfadenectomia do hilo hepático, com isolamento do ducto hepático comum e secção do mesmo. Realizada a secção gástrica supra-pilórica com grampeador linear 75mm, seguida da secção do jejuno a 10 cm do ângulo de Treitz. Concluída a manobra de Warren e reparo do pâncreas, de consistência normal, com secção fria no ducto pancreático de calibre normal (0,4 cm). Realizada a liberação do mesopâncreas e da artéria mesentérica superior, seguida da retirada da peça cirúrgica. Realizada anastomose pancreato-jejunal (Heidelberg) término-lateral tipo ducto mucosa com prolene 5-0, anastomose hepático-jejunal término-lateral com prolene 5-0 e anastomose gastro-jejunal antecólica em plano único total com prolene 3-0 em alça única. Realizado fechamento de brechas mesentéricas, revisão da hemostasia e alocado dreno tubular em região subhepática (anexo 3-6).
O paciente evoluiu no primeiro dia pós-operatório em regular estado geral, sem aminas vasoativas, eupneico em ar ambiente, em dieta zero, 500ml de resíduo gástrico, abdome distendido, flácido, discretamente doloroso a palpação, dreno abdominal de aspecto serohemático, com amilase do dreno de 264 U/dL (anexo 7). No segundo dia pós-operatório apresentava persistência de resíduo gástrico aumentado, contudo, no terceiro dia pós-operatório apresentou melhora substancial de gastroparesia, sendo optado por início de dieta líquida restrita, com boa aceitação, recebendo alta da Unidade de Terapia Intensiva, com boa progressão de dieta para liquida completa no quarto dia e líquida pastosa no quinto dia, sem episódios de náuseas ou vômitos, e sem alterações ao exame físico. Coletada nova amilase do dreno no quarto dia, com queda expressiva, para 38 U/dL (sérica: 34 U/dL). Evolui com boa aceitação da dieta pastosa no sexto dia e branda no sétimo dia, com amilase do dreno 21 U/dL (sérica 36 U/dL, sendo retirado o dreno abdominal e alta hospitalar.
O paciente retornou no 13º dia pós-operatório, apresentando disglicemia, contudo, negando dor abdominal, náuseas ou vômitos. Eliminações fisiológicas presentes dentro da normalidade, ferida operatória de adequado aspecto; realizado o devido encaminhamento para o serviço de endocrinologia, com melhora substancial. O resultado histopatológico da peça cirúrgica compatível com GIST de duodeno, de baixo grau histológico, com maior diâmetro neoplásico de 25mm, evidenciando células fusocelulares de elevada celularidade em arquitetura estoriforme de baixo grau. O mesmo foi encaminhado para oncologia clínica, sem necessidade de terapia adjuvante. O paciente evolui com boa sobrevida, com endoscopia digestiva alta de 30/09/2024 demonstrando apenas gastrite alcalina, sem sinais de recidiva da doença através de exames de controle, evoluiu ainda com hérnia incisional de pequenas dimensões em região umbilical.
DISCUSSÃO
Os tumores estromais gastrointestinais (GISTs) localizados no duodeno são neoplasias raras que demandam uma abordagem cirúrgica criteriosa devido à complexidade anatômica da região. O tratamento padrão consiste na ressecção cirúrgica completa com margens negativas, sem necessidade de dissecção linfonodal, considerando que a disseminação linfática é rara (CROWN; BIEHL; ROCHA, 2016; FU et al., 2022). No caso do paciente em estudo, não houve invasão linfonodal pela biópsia, o que reforça o que há na literatura.
As principais estratégias cirúrgicas para GISTs duodenais incluem ressecção local, ressecção segmentar, duodenectomia com preservação da cabeça do pâncreas e duodenopancreatectomia. A escolha do procedimento depende do tamanho e da localização do tumor, bem como do comprometimento de estruturas adjacentes, como a ampola de Vater e a cabeça do pâncreas (LIANG et al., 2013; LEE et al., 2017).
1. Ressecção Local e Segmentar: Estas abordagens são indicadas para tumores que não invadem estruturas críticas, como a ampola de Vater ou a cabeça do pâncreas. A ressecção local, como a técnica em cunha, é menos invasiva e resulta em menor morbidade e recuperação mais rápida (OJIMA et al., 2020).
2. Duodenopancreatectomia: Recomendada para tumores que comprometem a ampola de Vater ou a cabeça do pâncreas, essa técnica busca alcançar ressecção completa (R0). No entanto, é um procedimento de alta complexidade, com maior tempo cirúrgico, perda sanguínea significativa e maior risco de complicações (VASOS et al., 2021). No caso apresentado, o paciente apresentava a lesão em íntimo contato com o pâncreas, com risco de invasão adjacente, sendo a abordagem cirúrgica escolhida.
3. Abordagens Minimamente Invasivas: Técnicas laparoscópicas e robóticas têm sido exploradas como alternativas menos invasivas, especialmente em tumores menores e localizados em áreas de fácil acesso. Essas abordagens mostram-se eficazes em casos selecionados (MARANO et al., 2020).
Além da cirurgia, inibidores de tirosina quinase (TKIs), como o imatinibe, desempenham papel fundamental no tratamento adjuvante em casos de alto risco de recorrência ou quando a cirurgia inicial não é viável. O imatinibe também pode ser usado em contexto neoadjuvante, visando reduzir o tamanho tumoral antes da ressecção (VON MEHREN; JOENSUU, 2018). Não foi realizada terapia neoadjuvante no caso relatado devido ao bom status performance do paciente no pré-operatório e pelas dimensões do tumor.
A duodenopancreatectomia, também conhecida como procedimento de Whipple, é uma intervenção cirúrgica de alta complexidade, frequentemente indicada para tumores estromais gastrointestinais (GISTs) localizados no duodeno que apresentam invasão de estruturas adjacentes.
Apesar de sua eficácia, este procedimento está relacionado a diversas complicações, tanto no período pós-operatório imediato quanto em longo prazo.
No curto prazo, as principais complicações observadas incluem:
1. Fístula Pancreática: Uma das complicações mais frequentes, com incidência de até 25%, especialmente em pacientes com tecido pancreático de consistência macia e ducto pancreático de pequeno calibre (SIMON, 2021). Apesar do aumento da amilase do dreno no primeiro dia, interpretou-se como extravasamento bioquímico do intraoperatório, devido à sua normalização nos dias seguintes.
2. Esvaziamento Gástrico Retardado: Problema comum, que pode prolongar significativamente a recuperação pós-operatória (MALLEO; VOLLMER, 2016). O paciente do caso apresentou gastroparesia nos primeiros dias cirúrgicos subsequentes.
3. Hemorragia Pós-operatória: Ocorre em aproximadamente 7% dos casos, muitas vezes exigindo intervenções adicionais.
4. Infecções do Sítio Cirúrgico: Complicação frequente que requer manejo adequado para prevenir complicações secundárias.
5. Insuficiência Pancreática: Tanto a insuficiência exócrina quanto a endócrina são preocupações importantes. A insuficiência exócrina pode surgir em decorrência da redução da capacidade digestiva, enquanto a insuficiência endócrina frequentemente resulta no desenvolvimento de diabetes mellitus de novo (BEGER et al., 2018). Já no longo prazo, destacam-se as seguintes complicações:
1. Diabetes Mellitus de Novo: A incidência varia entre 14% e 22%, dependendo do tipo de tumor e da extensão da ressecção realizada (BEGER; POCH; MAYER, 2018). Em concordância com a literatura, o paciente evoluiu com quadro de diabetes mellitus no pós-operatório, necessitando de acompanhamento e tratamento com a endocrinologia.
2. Insuficiência Pancreática Exócrina Persistente: Esta complicação afeta até 49% dos pacientes, prejudicando a digestão e a absorção de nutrientes (BEGER et al., 2022).
3. Estenose Biliar e Colangite: Observada em cerca de 8% dos casos, pode demandar intervenções adicionais (BROWN et al., 2020).
4. Hérnia Incisional: Presente em aproximadamente 17,7% dos pacientes, muitas vezes necessitando de correção cirúrgica (BROWN et al., 2020). No caso relatado, o paciente evoluiu com hérnia em região umbilical no pós-operatório tardio.
5. Obstrução Intestinal e Úlcera Péptica: Embora menos frequentes, essas complicações podem comprometer significativamente a qualidade de vida.
O seguimento e o prognóstico de pacientes submetidos à duodenopancreatectomia para o tratamento de tumores estromais gastrointestinais (GISTs) duodenais exigem monitoramento rigoroso das complicações em curto e longo prazo.
Em curto prazo, uma das complicações mais relevantes é a fístula pancreática, que pode aumentar o risco de insuficiência pancreática exócrina severa. Esta complicação não apenas prolonga o tempo de internação, mas também pode impactar negativamente a recuperação inicial dos pacientes (KANWAT et al., 2023).
Já no longo prazo, os pacientes apresentam risco elevado de desenvolver insuficiência pancreática, tanto endócrina quanto exócrina, como foi no caso apresentado. Estudos indicam que a incidência de diabetes mellitus de novo após a duodenopancreatectomia varia entre 14% e 34%. Adicionalmente, a insuficiência pancreática exócrina é uma condição ainda mais prevalente, com taxas de ocorrência que podem chegar a 87,5%, de acordo com algumas análises. Esta última exige, frequentemente, suplementação enzimática para controle de sintomas como a esteatorreia (KATO et al., 2024).
O impacto dessas complicações na qualidade de vida dos pacientes é significativo. A insuficiência pancreática, tanto endócrina quanto exócrina, está associada a limitações físicas e emocionais, redução da energia e percepção geral de saúde. Além disso, a atrofia pancreática pós-operatória e a dilatação do ducto pancreático principal são identificadas como fatores de risco que agravam a insuficiência pancreática (KANWAT et al., 2023; KATO et al., 2024).
CONSIDERAÇÕES FINAIS
O manejo dos GISTs duodenais deve ser individualizado, considerando fatores como localização, envolvimento de estruturas adjacentes e a viabilidade de ressecção completa com margens negativas. A cirurgia permanece como o pilar do tratamento, complementada por terapias adjuvantes em casos específicos. O manejo das complicações cirúrgicas exige uma abordagem multidisciplinar que envolva equipe cirúrgica, especialistas em gastroenterologia e suporte nutricional. Esse cuidado integrado é essencial para otimizar os resultados a longo prazo e promover a melhor qualidade de vida possível aos pacientes.
O seguimento dos pacientes deve incluir avaliações regulares das funções pancreáticas e intervenções direcionadas para mitigar os efeitos dessas complicações. A educação dos pacientes sobre os riscos associados à insuficiência pancreática e a importância do acompanhamento contínuo são essenciais para melhorar os desfechos a longo prazo.
REFERÊNCIAS
BEGER, H. G.; MAYER, B. Early postoperative and late metabolic morbidity after pancreatic resections: an old and new challenge for surgeons – a review. American Journal of Surgery, v.216, n. 1, p. 131-134, 2018.
BEGER, H. G.; MAYER, B.; VASILESCU, C.; POCH, B. Long-term metabolic morbidity and steatohepatosis following standard pancreatic resections and parenchyma-sparing, local extirpations for benign tumor: a systematic review and meta-analysis. Annals of Surgery, v. 275, n. 1, p. 54-66, 2022.
BEGER, H. G.; POCH, B.; MAYER, B.; SIECH, M. New onset of diabetes and pancreatic exocrine insufficiency after pancreaticoduodenectomy for benign and malignant tumors: a systematic review and meta-analysis of long-term results. Annals of Surgery, v. 267, n. 2, p. 259-270, 2018.
BROWN, J. A.; ZENATI, M. S.; SIMMONS, R. L.; et al. Long-term surgical complications after pancreatoduodenectomy: incidence, outcomes, and risk factors. Journal of Gastrointestinal Surgery, v. 24, n. 7, p. 1581-1589, 2020.
CROWN, A.; BIEHL, T. R.; ROCHA, F. G. Local resection for duodenal gastrointestinal stromal tumors. American Journal of Surgery, v. 211, n. 5, p. 867-870, 2016.
FU, X.; WANG, X.; XIONG, J.; et al. Surgical strategies for duodenal gastrointestinal stromal tumors. Langenbeck’s Archives of Surgery, v. 407, n. 2, p. 835-844, 2022.
JOHNSTON, F. M.; KNEUERTZ, P. J.; CAMERON, J. L.; et al. Presentation and management of gastrointestinal stromal tumors of the duodenum: a multi-institutional analysis. Annals of Surgical Oncology, v. 19, n. 11, p. 3351-3360, 2012.
KANWAT, S.; SINGH, H.; SHARMA, A. K.; et al. Pancreatic dysfunction and reduction in quality of life is common after pancreaticoduodenectomy. Digestive Diseases and Sciences, v. 68, n. 7, p.3167-3173, 2023.
KATO, T.; WATANABE, Y.; OSHIMA, Y.; et al. Long-term outcomes and risk factors of pancreatic insufficiency after a pancreatoduodenectomy: a retrospective study. Surgery, v. 176, n.3, p. 880-889, 2024.
LEE, S. Y.; GOH, B. K.; SADOT, E.; et al. Surgical strategy and outcomes in duodenal gastrointestinal stromal tumor. Annals of Surgical Oncology, v. 24, n. 1, p. 202-210, 2017.
LIANG, X.; YU, H.; ZHU, L. H.; WANG, X. F.; CAI, X. J. Gastrointestinal stromal tumors of the duodenum: surgical management and survival results. World Journal of Gastroenterology, v. 19, n. 36, p. 6000-6010, 2013.
LIU, Z.; ZHENG, G.; LIU, J.; et al. Clinicopathological features, surgical strategy and prognosis of duodenal gastrointestinal stromal tumors: a series of 300 patients. BMC Cancer, v. 18, n. 1, p. 563, 2018.
MALLEO, G.; VOLLMER, C. M. Postpancreatectomy complications and management. The Surgical Clinics of North America, v. 96, n. 6, p. 1313-1336, 2016.
MARANO, A.; ALLISIARDI, F.; PERINO, E.; et al. Robotic treatment for large duodenal gastrointestinal stromal tumor. Annals of Surgical Oncology, v. 27, n. 4, p. 1101-1102, 2020.
MARANO, L.; BOCCARDI, V.; MARRELLI, D.; ROVIELLO, F. Duodenal gastrointestinal stromal tumor: from clinicopathological features to surgical outcomes. European Journal of Surgical Oncology, v. 41, n. 7, p. 814-822, 2015.
OJIMA, T.; NAKAMURA, M.; HAYATA, K.; et al. Laparoscopic limited resection for duodenal gastrointestinal stromal tumors. Journal of Gastrointestinal Surgery, v. 24, n. 10, p. 2404-2408, 2020.
SIMON, R. Complications after pancreaticoduodenectomy. The Surgical Clinics of North America, v. 101, n. 5, p. 865-874, 2021.
VASOS, N.; PERRAKIS, A.; HOHENBERGER, W.; CRONER, R. S. Surgical approaches and oncological outcomes in the management of duodenal gastrointestinal stromal tumors (GIST). Journal of Clinical Medicine, v. 10, n. 19, p. 4459, 2021.
VON MEHREN, M.; JOENSUU, H. Gastrointestinal stromal tumors. Journal of Clinical Oncology, v. 36, n. 2, p. 136-143, 2018.
WANG, M. X.; DEVINE, C.; SEGARAN, N.; GANESHAN, D. Current update on molecular cytogenetics, diagnosis and management of gastrointestinal stromal tumors. World Journal of Gastroenterology, v. 27, n. 41, p. 7125-7133, 2021.
YANG, F.; JIN, C.; DU, Z.; et al. Duodenal gastrointestinal stromal tumor: clinicopathological characteristics, surgical outcomes, long term survival and predictors for adverse outcomes.American Journal of Surgery, v. 206, n. 3, p. 360-367, 2013.
ANEXOS
- Endoscopia digestiva alta. Lesão na terceira porção duodenal – 20/04/2022
1médica pela Universidade Federal do Maranhão, Cirurgiã Geral pelo HCM, São Luís, Maranhão, julianaarrais1@hotmail.com
3e-mail: romerito_n@yahoo.com.br
