NUTRITIONAL TREATMENT IN IRRITABLE BOWEL SYNDROME
REGISTRO DOI: 10.69849/revistaft/th102411081713
Larissa Mariana Pereira dos Anjos[1]
Jayne Miranda Ramos Dourado[2]
Vanessa Maria Machado Menezes[3]
Steffany Almeida Santos[4]
Thalyta de Souza Miranda[5]
Larissa Torres de Almeida[6]
Maria Eduarda Veloso Lima[7]
Graziela Campos de Almeida[8]
Sabrina Silva de Oliveira[9]
Danielle da Silva Galeno[10]
Marcus Vinicius Santos do Nascimento[11]
Resumo
A Síndrome do Intestino Irritável (SII) é um distúrbio da interação intestino-cérebro, que traz ao portador sintomas gastrointestinais crônicos juntamente com modificação da rotina intestinal e do formato das fezes. Até hoje não existe nenhum exame que seja capaz de realizar o diagnóstico, delineado através da sintomatologia, com a eliminação de outras possíveis causas compatíveis com os sintomas. O trabalho teve o objetivo de demonstrar a eficácia de protocolos nutricionais para o controle da doença e melhora de qualidade de vida desses pacientes. Existem alguns tratamentos nutricionais que podem ser adotados a depender da individualidade do paciente, como adição de probióticos, que podem estabilizar a permeabilidade intestinal, os prebióticos, em especial as fibras solúveis, melhorando o quadro de Síndrome do Intestino Irritável com presença de constipação, na quantidade de 25-30g de fibras totais e o protocolo Low FODMAP, constituindo-se por três fases: restrição, reintrodução e manutenção, visando a diminuição de carboidratos fermentáveis na dieta do paciente e ao final, após no máximo oito semanas, espera-se que o paciente consiga identificar os alimentos que acarretam maiores desconfortos e sua tolerância a cada um, trazendo uma melhor qualidade de vida, com alívio intestinal, sendo este o protocolo mais importante e eficaz, conforme trazem a maioria dos estudos trazem, sendo necessário o acompanhamento com nutricionista em todas as fases com a avaliação do estado nutricional, para que não haja carências.
Palavras-chave: Síndrome do intestino irritável. Tratamento nutricional. Microbioma gastrointestinal. Dieta FODMAP.
ABSTRACT
Irritable bowel syndrome (IBS) is a disorder of the intestine-brain interaction, which brings chronic gastrointestinal symptoms to the sufferer along with changes in intestinal routine and the shape of feces. To date, there is no test that is capable of making the diagnosis, outlined through symptoms, with the elimination of other possible causes compatible with the symptoms. The aim of the work was to demonstrate the effectiveness of nutritional protocols for controlling the disease and improving the quality of life of these patients. There are some nutritional treatments that can be adopted depending on the patient’s individuality, such as the addition of probiotics, which can stabilize intestinal permeability, prebiotics, especially soluble fibers, improving the condition of Irritable Bowel Syndrome with the presence of constipation, in amount of 25-30g of total fiber and the Low FODMAP protocol, consisting of three phases: restriction, reintroduction and maintenance, aiming to reduce fermentable carbohydrates in the patient’s diet and at the end, after a maximum of eight weeks, it is expected that the patient is able to identify the foods that cause the greatest discomfort and their tolerance to each one, bringing a better quality of life, with intestinal relief, this being the most important and effective protocol, as shown in most studies, requiring monitoring with a nutritionist at all stages with the assessment of nutritional status, so that there are no deficiencies.
Key words: Irritable bowel syndrome. Nutritional treatment. Gastrointestinal microbiome. FODMAP diet.
A Síndrome do Intestino Irritável (SII) é um distúrbio da interação intestino-cérebro, caracterizado por sintomas gastrointestinais crônicos e conforme explica o Instituto da Faculdade Americana de Gastroenterologia (IFAG) de Pesquisa Clínica e Educação, provoca um desconforto ou dor abdominal, associado a hábitos intestinais alterados (Ford et al., 2014). Essa síndrome é identificada por meio de uma anamnese detalhada, considerando as características dos sintomas que inclusive, podem ser vagos e transitórios, caracterizando-se como um diagnóstico de exclusão (Krause; Mahan, 2012).
Presume-se que a síndrome do intestino irritável afeta 1 a cada 10 pessoas em todo o mundo. No Brasil, o Sistema Único de Saúde (SUS) contabilizou nos últimos 10 anos, cerca de 50.000 internações por doenças intestinais inflamatórias, das quais mais de 75% foram classificadas como de caráter urgente (De nadaiet al., 2017).
O tratamento da doença é variável e depende dos sintomas apresentados. Sua origem ainda não está bem definida para os diferentes subtipos. As intervenções nutricionais são personalizadas e variam conforme a classificação da SII, que divide-se em constipação (SII-C), diarreia (SII-D) e padrão misto de constipação e diarreia (SII-M). Modificações na dieta podem ajudar a aliviar os sintomas da SII. A primeira estratégia é o Protocolo Low FODMAP, que consiste em três fases que possibilitam ao indivíduo identificar quais alimentos fermentáveis podem causar sintomas, evitando, assim, a ingestão de desencadeantes mal absorvidos pelo organismo e que provocam desconforto intestinal (Bonetto et al., 2021; (Krause; Mahan, 2012).
A relevância desta revisão é evidente para identificar os efeitos da Síndrome do Intestino Irritável (SII) no indivíduo, considerando a qualidade de vida e o bem-estar, o que contribui para uma efetiva prestação de cuidados à saúde. Serão apresentadas opções e estratégias nutricionais específicas para cada caso, além de uma discussão sobre as possíveis implicações futuras para a eficácia do tratamento. Assim, o presente estudo tem como objetivo explicar a fisiopatologia e os protocolos nutricionais destinados ao controle da SII e das patologias associadas que causam dismotilidade intestinal e supercrescimento bacteriano.
2 METODOLOGIA
Trata-se de uma revisão de literatura narrativa. Para a elaboração desse estudo, foram realizadas pesquisas no período de janeiro a novembro de 2023, tendo como tema o tratamento nutricional na Síndrome do Intestino Irritável, com o objetivo de demonstrar a eficácia de protocolos nutricionais para o controle da doença e a melhoria da qualidade de vida.
Os métodos utilizados para a busca e localização das informações consistiram nas análises de artigos científicos publicados na íntegra, presentes nas seguintes bases de dados PubMed (11 artigos), Scientific Electronic Library Online (SciELO) (16 artigos) e Google Acadêmico (14 artigos). Foram utilizados Descritores em Ciência da Saúde (DeCs), como: Síndrome do Intestino Irritável; Microbioma Gastrointestinal; Dor Abdominal; Dieta FODMAP; Irritable Bowel Syndrome; FODMAP Diet.
Para selecionar os artigos foram adotadas estratégias com critérios específicos, permitindo a filtragem de informações relevantes. Os critérios incluíram idiomas português e inglês e palavras-chaves associadas ao tema, como o objetivo de obter dados mais precisos.
Diante das buscas foram selecionados 67 artigos para a realização da leitura de forma minuciosa. Destes, 30 artigos foram excluídos por falta de objetividade. Sendo assim, obteve 41 artigos selecionados para composição do trabalho.
3 FISIOPATOLOGIA DA SÍNDROME DO INTESTINO IRRITÁVEL
A fisiopatologia exata da SII não é completamente compreendida, mas há evidências de que múltiplos fatores podem contribuir para seu desenvolvimento e manutenção. Alterações nas áreas do cérebro responsáveis pela modulação da dor são observadas, assim como a desregulação do eixo cérebro-intestino. Além disso, o sistema nervoso autônomo, que controla a função do sistema digestivo, e sua comunicação com o intestino, mediada pelo sistema nervoso entérico uma rede complexa de neurônios na parede do trato gastrointestinal também desempenham papeis críticos (Krause; Mahan, 2012).
Na etiologia da SII, acredita-se que fatores genéticos e ambientais, hipersensibilidade visceral, alterações na microbiota intestinal, a comunicação entre intestino e cérebro (cross-talk intestino-cérebro) e fatores psicológicos estejam envolvidos (Ford et al., 2017). Essa interação multifatorial sugere que a SII não é uma condição única, mas sim um espectro de distúrbios que se manifestam de maneiras diferentes em cada indivíduo.
Estudos indicam que a hipersensibilidade visceral pode resultar em respostas exageradas a estímulos normais, enquanto alterações na microbiota podem influenciar tanto a função intestinal quanto a resposta imune. A contribuição de fatores psicológicos, como estresse e ansiedade, é evidente, pois esses elementos podem agravar os sintomas e influenciar a percepção da dor (Black; Ford, 2020).
3.1 Alterações de áreas do cérebro responsáveis pela modulação da dor
Estudos de neuroimagem indicam que pacientes com SII apresentam maior ativação de regiões cerebrais relacionadas ao processamento da dor (Mertzet al., 2000; Bonaz et al., 2000). Dessa forma, acredita-se que a dor abdominal na SII esteja associada à hipersensibilidade visceral, resultante da sensibilização anormal do sistema nervoso central (Araujo, 2022). Os espasmos ou contrações dolorosas são mecanismos que contribuem para a dor associada à SII (Paiz et al., 2014; Spiller et al., 2007).
As alterações mais significativas na hipersensibilidade visceral ocorrem devido à diminuição do limiar de dor, junto ao fenômeno de alodinia, que caracteriza uma dor neuropática resultante do aumento da sensibilidade a estímulos normalmente inócuos. Por exemplo, um indivíduo com SII pode pode sentir dor intensa ao estímulo normal de evacuação (Tillisch & Mayer, 2005).
Além disso, a hiperalgesia visceral (aumento da sensação de dor no intestino) observada em pessoas com SII pode ser modulada por fatores emocionais como ansiedade, depressão e raiva (Barbosa et al., 2021). Nos casos de motilidade gastrointestinal anormal, essa alteração ocorre devido a uma falha na sinalização de serotonina através das aferências do Sistema Nervoso Entérico (SNE), mediada por células enterocromafins na mucosa intestinal. Isso resulta na inativação dos receptores das prostaglandinas, prejudicando a motilidade gastrointestinal. (Jadallah et al., 2014; Camilleri, 2009).
3.2 Alterações do sistema nervoso autônomo e central
A Síndrome do Intestino Irritável (SII) é considerada um distúrbio multifatorial, no qual a desregulação do eixo intestino-cérebro desempenha um papel crucial, levando a anormalidades no sistema nervoso entérico, autônomo e/ou central, resultado em diferentes alterações nesses sistemas (Moraes-filho; Mm Quigley et al., 2015).
O cross-talk entre o sistema nervoso central (SNC) e o microbioma intestinal, conhecido como eixo microbiota intestinal-cérebro, é coordenado em vários níveis anatômicos (Fung; Olson; Hsiao, 2017). Esse eixo funciona como um meio de comunicação bidirecional entre o SNC e o trato gastrointestinal (TGI), abrangendo diversas vias essenciais do corpo. Em condições fisiológicas normais, esse eixo atua na modulação dos processos digestivos, na função imunológica e na percepção e resposta emocional aos estímulos viscerais, com o SNC controlando a função do sistema digestivo (O’mahony, 2017).
3.3 Como a disbiose causaria as alterações da síndrome do intestino irritável
A interação entre fatores psicológicos e a fisiologia intestinal, onde as alterações psicológicas e do intestino influenciam a resposta um do outro, sugere que os fatores que desencadeiam o estresse sejam responsáveis por alguns estados de disbiose (Costa, 2021). Dessa forma, a disbiose causa alterações da SII visto que a microbiota intestinal é sensível ao stress. As bactérias presentes no intestino respondem à libertação de mediadores neuroquímicos, influenciando numa resposta a um agente invasor (Cresci; Bawden, 2015).
A disbiose favorece a invasão e o crescimento de bactérias patogénicas levando à presença de citoquinas inflamatórias aumentando a permeabilidade intestinal, causando assim alterações na SII, visto que a disbiose torna os mecanismos de defesa desequilibrados, agravando as infecções gastrointestinais contribuindo com as deslocações das bactérias ao longo do trato gastrointestinal (Rinninella et al., 2019; Costa, 2021).
3.4 O sistema nervoso entérico e sua comunicação com o intestino
O sistema nervoso entérico (SNE) está envolvido na regulação metabólica do intestino, além de neurônios entéricos e neurotransmissores intestinais, que desempenham um papel importante na regulação do SNE (Braz; Araújo, 2020).
Esse sistema é uma rede de neurônios localizada na parede do trato gastrointestinal e a SII pode trazer anormalidades (Krause; Mahan, 2012). Esse fato ocorre por meio dos mecanismos de inflamação da mucosa intestinal, devido a liberação de citocinas, e moléculas com ação regulatória sobre as terminações neuronais do sistema nervoso entérico (Collins, 1992). Estas substâncias podem então ser liberadas da mucosa intestinal por estímulos dietéticos ou infecciosos, em que, em muitos casos de SII o início dos sintomas segue-se a um episódio de gastroenterite aguda (Weston et al., 1993).
O SNE possui entre sua comunicação com o SNC a via do nervo vago, que explana um impacto notável na regulação das funções do trato gastrointestinal, e no comportamento alimentar (Hilz, 2022). Por ser o principal componente do sistema nervoso parassimpático, pois além de regular funções cardiovasculares, regula também a resposta imune e o sistema digestório (Chang et al., 2015).
O nervo vago é constituído em 80% de fibras aferentes e 20% de fibras eferentes (Hilz, 2022). Essas fibras estabelecem uma relação entre o SNE e o eixo hipotálamo-hipófise-adrenal. Dessa forma, o conectoma intestinal engloba as vias de sinalização neuroendócrinas, enteroendócrinas, neuroimunes e metabólicas, responsáveis pela regulação de funções associadas à digestão, motilidade do trato e desenvolvimento cerebral (Powell et al., 2017).
As fibras aferentes, formam o sistema sensorial conduzindo assim o estímulo da periferia para o sistema nervoso central, dessa maneira, essas fibras se encarregam de processar as informações e efetuar uma resposta captando informações sensoriais de regiões periféricas do organismo transferi-las até centros integradores, localizados no bulbo cerebral, incluindo o núcleo do trato solitário (NTS), onde as funções referentes, incluem o envio de sinais colinérgicos parassimpáticos de núcleos cerebrais para os órgãos-alvo (Ribeiro filho, 2015; Butt et al.,2020; Hilz, 2022). Assim, a disbiose intestinal está conectada ao desenvolvimento das vias neuroimunes que são impulsionadas por subtipos específicos de células T, citocinas pró-inflamatórias, comprometimento da barreira endotelial e neurodegeneração (Colpitts; Kasper, 2017).
Dessa forma, a existência de disbiose, irá causar a quebra da permeabilidade intestinal, levando assim a um quadro inflamatório não restrito ao intestino, uma vez que as citocinas pró-inflamatórias podem entrar na corrente sanguínea e atingir o cérebro (Luca, et al., 2019).
4 DISCUSSÕES E RESULTADO
Desse modo, ao realizar a leitura dos artigos selecionados para o devido estudo, o protocolo para o tratamento nutricional da SII, apresentou três condutas expostas à discussão, foram elas: Protocolo Low FODMAPs; Probióticos e os Prebióticos.
4.1 Protocolo Low FODMAPs
Devido à percepção do próprio paciente de que a SII se agrava após o consumo de determinados alimentos, é importante identificar quais deles, em cada caso concreto, devem ser evitados, visando ao abrandamento dos sintomas e, consequentemente, impactando positivamente sua qualidade de vida. Nesse sentido, o papel da redução dos FODMAPs na sintomatologia da SII precisa ser melhor compreendido, tendo em vista que esses nutrientes são comumente apontados pelos portadores dessa síndrome como causadores de desconfortos (Hayes et al., 2014; Chey et al., 2022).
Dessa forma, a terapia nutricional utilizando a dieta de exclusão de FODMAPs, “Fermentable Oligosaccharides, Disaccharides, Monosaccharides, and Polyols” (Tabela 1), deve ser uma consideração primária para a SII, sendo a mais estudada e com maior respaldo científico. Gibson (2017), observou que a evidência de alta qualidade para a dieta de eliminação de FODMAPs apoia seu uso como tratamento de primeira linha para a SII.
Os FODMAPs são um conjunto de carboidratos osmóticos fermentáveis de cadeia curta, mal absorvidos no intestino delgado: oligossacarídeos (frutanos/galactanos), dissacarídeos (lactose), monossacarídeos (frutose) e polióis fermentáveis (sorbitol/manitol). Devido às irregularidades ocasionadas pela metabolização das bactérias intestinais, esses alimentos aumentam a produção de gases e causam dismotilidade. Além disso, aumentam o conteúdo de água luminal e o estado hídrico no sistema gastrointestinal. Assim, quando são limitados ou eliminados, os sintomas também são reduzidos ou anulados em 70% das pessoas com SII (Gibson, 2017).
Tabela 1 – Classificação dos alimentos de acordo com a quantidade de FODMAPs.
QUANTIDADE DE FODMAP TIPOS DE ALIMENTOS ALTO Soja, trigo, cuscuz, cebola, cogumelo, milho, amora, manga, castanha-de-caju, pistache, carnes processadas, maionese, ketchup, iogurte, leite de vaca, mel, sorbitol, xilitol. INTERMEDIÁRIO Aveia, pão sovado, abóbora, brócolis, batata-doce, tomate, abacate, romã, uva passa, amêndoas, linhaça, avelã, manteiga, leite de coco, leite de arroz. BAIXO Tapioca, quinoa, arroz, abobrinha, berinjela, cenoura, couve, rúcula, pepino, abacaxi, banana, carambola, morango, laranja, uva, amendoim, nozes, semente de girassol, carnes não processadas, ovos, frutos do mar, queijo parmesão, vinho, azeite, açúcar mascavo.
Fonte: Active Caldic (2023)
4.2 Probióticos
A Organização para Alimentação e Agricultura (FAO) e a Organização Mundial da Saúde (OMS) definem os probióticos como microrganismos vivos que, quando administrados em quantidades adequadas, conferem um benefício à saúde do hospedeiro e de sua microbiota (Hotel, Amerian Córdoba Park et al., 2021).
Quando consumidos em quantidades apropriadas, os probióticos podem ajudar a aumentar as defesas do organismo, combatendo problemas digestivos e prevenindo o desenvolvimento de doenças infecciosas e inflamatórias, como diarreia e úlceras (Butel, 2014).
A maioria das bactérias probióticas são bactérias lácticas (bactérias produtoras de ácido láctico), que incluem Lactobacillus, Lactococcus, Bifidobacterium e Streptococcus. O trato digestivo é o habitat natural dessas bactérias; elas conseguem fermentar os açúcares da dieta sem oxigênio e produzir ácido láctico (Sarowska et al., 2013).
Os probióticos têm sido amplamente estudados, e sua eficácia, em maior ou menor grau, tem sido demonstrada em diversos distúrbios intestinais. Eles podem inibir o crescimento bacteriano por meio da produção de bacteriocinas ou biossurfactantes com atividade antimicrobiana, ou pela elaboração de metabólitos que induzem a diminuição do pH luminal, criando um ambiente menos favorável ao crescimento de determinadas bactérias (Butel, 2014).
Além disso, os probióticos amplificam as junções estreitas do intestino e estabilizam a permeabilidade. Eles também estimulam as células caliciformes a produzir muco para melhorar a função da barreira intestinal, normalizar os movimentos intestinais e reduzir a hipersensibilidade do sistema visceral em pacientes pediátricos e adultos, regulando o ritmo das evacuações e diminuindo a sensibilidade excessiva do sistema nervoso que controla o intestino (Gareau, 2010).
Figura 2 – Ação das bactérias probióticas na parede intestinal.
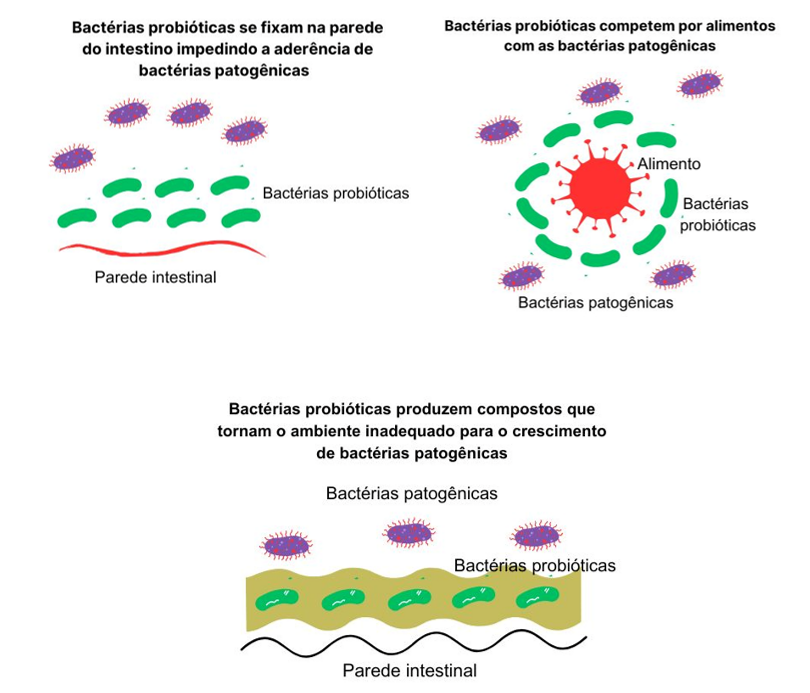
Fonte: Elaborada pelos autores.
4.3 Prebióticos
Mais um dos protocolos recomendados para pacientes com SII é o aumento da ingestão de fibra alimentar, que nada mais é do que um carboidrato não absorvido e digerido no intestino delgado, funcionando como um prebiótico, que serve de “alimento” para as bactérias intestinais benéficas através do processo de fermentação, causando mudanças na composição e/ou na atividade da microbiota. A maioria dos alimentos que contêm fibras possui concomitantemente os dois tipos de fibras existentes: um terço de fibras solúveis e dois terços de fibras insolúveis (Bernaud; Rodrigues, 2013).
As fibras solúveis, como as pectinas, gomas, inulina e algumas hemiceluloses, podem se dissolver em água, formando geis viscosos que não são digeridos pelo intestino delgado, sendo fermentados pela microbiota do intestino grosso. Já as fibras insolúveis, como a lignina, celulose e algumas hemiceluloses, não formam geis, apresentando uma fermentação limitada (Bernaud; Rodrigues, 2013).
A Food and Drug Administration dos EUA recomenda o consumo diário de 25 a 35 g de fibras totais para regular as fezes e reduzir a dor abdominal. Já a Diretriz sobre o Manejo da SII do American College of Gastroenterology, de 2021, recomendou o uso de suplementação de fibra alimentar solúvel para pacientes com SII com predominância de constipação (SII-C), como psyllium, semente de ispagula, fibra de milho, metilcelulose, farelo de aveia e polpa de frutas e vegetais, observando melhora nos sintomas globais da SII, além de menores efeitos adversos (El-salhy et al., 2017; Chey et al., 2022).
Ratificando essa informação, uma meta-análise recente que avaliou 14 ensaios clínicos randomizados envolvendo 906 pacientes com SII concluiu que a suplementação de fibra dietética de cadeia longa, viscosa intermediária, solúvel e moderadamente fermentável, especialmente o psyllium, melhorou os sintomas globais da SII em comparação com o placebo (Moayyedi et al., 2014).
Por outro lado, a fibra insolúvel presente no farelo de trigo, grãos integrais, cascas e sementes de frutas e vegetais não apresentou, nos estudos, benefícios na sintomatologia da síndrome, mas sim a possibilidade de aumento de inchaço e dor abdominal (Chey et al., 2022). A inclusão de fibras deve, portanto, ser iniciada de forma gradual, com um aumento não superior a 5 g/dia por semana, já que pode ocorrer um período transitório de desconforto e distensão abdominal, concomitantemente a mudanças nos hábitos intestinais, sendo importante a adoção dessa estratégia (El-salshy et al., 2017).
Após a análise e revisão das três condutas como tratamento nutricional para a SII, compreende-se que o Protocolo Low FODMAPs apresenta o quantitativo maior de resultados positivos, com base nos artigos selecionados para estudo. Estes, apontam que o protocolo Low FODMAPs possui um percentual maior (70%) de redução ou anulação dos sintomas provenientes da SII, quando comparado com o uso de prebióticos e probióticos, que apresentam um percentual menor de alívio das manifestações, onde essa melhora sintomática pode ocorrer após 24 a 48 horas do início do protocolo Low FODMAPs. Se valendo lembrar que ele não é compatível por um longo intervalo de tempo, por ser um protocolo restritivo.
5 CONCLUSÃO
A síndrome do intestino irritável é um distúrbio gastrointestinal comum, crônico, recidivante e remitente, cujo principal foco da intervenção nutricional, bem acompanhado por um nutricionista competente, é a redução da frequência e gravidade dos sintomas, com a consequente melhora na qualidade de vida do paciente. Sua fisiopatologia ainda não está completamente elucidada, sendo considerada um diagnóstico de exclusão.
O tratamento nutricional pode abranger diversos protocolos, como a adição de probióticos, que podem estabilizar a permeabilidade intestinal, e de prebióticos, especialmente fibras solúveis, melhorando o quadro de Síndrome do Intestino Irritável com predominância de constipação. Além disso, o protocolo low FODMAPs apresenta uma maior quantidade de resultados positivos, segundo estudos. O nutricionista deve avaliar o estado nutricional a cada consulta e, por meio de exames bioquímicos, observar a necessidade de suplementação de micronutrientes essenciais para o bom funcionamento do organismo, evitando deficiências e, consequentemente, outras doenças, o que resulta em uma maior qualidade de vida para o paciente.
REFERÊNCIAS
ARAUJO, Karla Priscilla Carvalho de Azevedo. Fisiopatologia da síndrome do intestino irritável: uma revisão narrativa. 11 nov. 2022.
BARBOSA, Edilma Fiel Barbosa Fiel et al. PREVALÊNCIA E FATORES DE RISCO DA SÍNDROME DO INTESTINO IRRITÁVEL EM ADOLESCENTES DE PALMAS/TOCANTINS. Multidebates, v. 5, n. 2, p. 250-262, 2021.
BERNAUD, Fernanda Sarmento Rolla; RODRIGUES, Ticiana C. Fibra alimentar: ingestão adequada e efeitos sobre a saúde do metabolismo. Arquivos brasileiros de endocrinologia & metabologia, v. 57, p. 397-405, 2013.
BLACK, Christopher J.; FORD, Alexander C. Global burden of irritable bowel syndrome: trends, predictions and risk factors. Nature reviews Gastroenterology & hepatology, v. 17, n. 8, p. 473-486, 2020.
BRAZ, Isadora; ARAÚJO, Maria Olivia. A influência das comorbidades psiquiátricas no desenvolvimento da síndrome do intestino irritável: uma revisão da literatura.
BONAZ, Bruno L. et al. Central processing of rectal pain in IBS patients: an fMRI study. Gastroenterology, v. 4, n. 118, p. A615, 2000.
BONETTO, Silvia et al. Recent advances in the treatment of irritable bowel syndrome. Polish Archives of Internal Medicine, v. 131, n. 7-8, p. 709-715, 2021.
BUTEL, M.-J. Probiotics, gut microbiota and health. Médecine et maladies infectieuses, v. 44, n. 1, p. 1-8, 2014.
BUTT, Mohsin F. et al. The anatomical basis for transcutaneous auricular vagus nerve stimulation. Journal of anatomy, v. 236, n. 4, p. 588-611, 2020.
CAMILLERI, Michael. Serotonin in the gastrointestinal tract. Current Opinion in Endocrinology, Diabetes and Obesity, v. 16, n. 1, p. 53-59, 2009.
CHANG, Rui B. et al. Vagal sensory neuron subtypes that differentially control breathing. Cell, v. 161, n. 3, p. 622-633, 2015.
CHEY, William D. et al. AGA clinical practice update on the role of diet in irritable bowel syndrome: expert review. Gastroenterology, v. 162, n. 6, p. 1737-1745. e5, 2022.
COLLINS, S. M. Is the irritable gut an inflamed gut?. Scandinavian Journal of Gastroenterology, v. 27, n. sup192, p. 102-105, 1992.
COLPITTS, Sara L.; KASPER, Lloyd H. Influence of the gut microbiome on autoimmunity in the central nervous system. The Journal of Immunology, v. 198, n. 2, p. 596-604, 2017.
COSTA, Carla Sofia Gonçalves da. A importância da microbiota intestinal na saúde e em estados de disbiose – revisão narrativa. set. 2021. http://hdl.handle.net/10284/10461
CRESCI, Gail A.; BAWDEN, Emmy. Gut microbiome: what we do and don’t know. Nutrition in Clinical Practice, v. 30, n. 6, p. 734-746, 2015.
DE NADAI, Rafaella et al. Transplante de microbiota fecal no tratamento da síndrome do intestino irritável: uma revisão sistemática/Fecal microbiota transplant in the treatment of irritable bowel syndrome: a systematic review. Arquivos Médicos dos Hospitais e da Faculdade de Ciências Médicas da Santa Casa de São Paulo, p. 156-159, 2017.
EL-SALHY, Magdy et al. Dietary fiber in irritable bowel syndrome. International journal of molecular medicine, v. 40, n. 3, p. 607-613, 2017.
FORD, Alexander C. et al. American College of Gastroenterology monograph on the management of irritable bowel syndrome and chronic idiopathic constipation. Official journal of the American College of Gastroenterology| ACG, v. 109, p. S2-S26, 2014.
FORD, A. C.; LACY, B. E.; TALLEY, N. J. Irritable bowel syndrome. The New England journal of medicine, v. 376, n. 26, p. 2566–2578, 2017.
FUNG, Thomas C.; OLSON, Christine A.; HSIAO, Elaine Y. Interactions between the microbiota, immune and nervous systems in health and disease. Nature neuroscience, v. 20, n. 2, p. 145-155, 2017.
GAREAU, Mélanie G.; SHERMAN, Philip M.; WALKER, W. Allan. Probiotics and the gut microbiota in intestinal health and disease. Nature reviews Gastroenterology & hepatology, v. 7, n. 9, p. 503-514, 2010.
GIBSON, Peter R. The evidence base for efficacy of the low FODMAP diet in irritable bowel syndrome: is it ready for prime time as a first‐line therapy?. Journal of gastroenterology and hepatology, v. 32, p. 32-35, 2017.
HAYES, Paula A.; FRAHER, Marianne H.; QUIGLEY, Eamonn MM. Irritable bowel syndrome: the role of food in pathogenesis and management. Gastroenterology & hepatology, v. 10, n. 3, p. 164, 2014.
HILZ, Max J. Transcutaneous vagus nerve stimulation-a brief introduction and overview. Autonomic Neuroscience, v. 243, p. 103038, 2022.
HOTEL, Amerian Córdoba Park et al. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. Prevention, v. 5, n. 1, p. 1-10, 2001.
JADALLAH, Khaled A.; KULLAB, Susan M.; SANDERS, David S. Constipation-predominant irritable bowel syndrome: a review of current and emerging drug therapies. World Journal of Gastroenterology: WJG, v. 20, n. 27, p. 8898, 2014.
KRAUSE, Marie V.; MAHAN, L. Kathleen. Alimentos, nutrição e dietoterapia. In: Alimentos, nutrição e dietoterapia. 2012. p. 1052-1052.
LUCA, Maria et al. Gut microbiota in Alzheimer’s disease, depression, and type 2 diabetes mellitus: The role of oxidative stress. Oxidative medicine and cellular longevity, v. 2019, n. 1, p. 4730539, 2019.
MERTZ, Howard et al. Regional cerebral activation in irritable bowel syndrome and control subjects with painful and nonpainful rectal distention. Gastroenterology, v. 118, n. 5, p. 842-848, 2000.
MOAYYEDI, Paul et al. The effect of fiber supplementation on irritable bowel syndrome: a systematic review and meta-analysis. Official journal of the American College of Gastroenterology| ACG, v. 109, n. 9, p. 1367-1374, 2014.
MORAES-FILHO, Joaquim Prado; QUIGLEY, Eamonn MM. The intestinal microbiota and the role of probiotics in irritable bowel syndrome: a review. Arquivos de gastroenterologia, v. 52, n. 4, p. 331-338, 2015.
O’MAHONY, Siobhain M. et al. Irritable bowel syndrome and stress-related psychiatric co-morbidities: focus on early life stress. Gastrointestinal Pharmacology, p. 219-246, 2017.
PAIZ, Luis Aguilar et al. Guía latinoamericana de dispepsia funcional. Acta Gastroenterol Latinoam, v. 44, n. Sup 2, 2014.
POWELL, Byron J. et al. Methods to improve the selection and tailoring of implementation strategies. The journal of behavioral health services & research, v. 44, p. 177-194, 2017.
RIBEIRO FILHO, Helder Veras. Efeitos cardiorrespiratórios do β-citronelol: envolvimento de fibras aferentes vagais e ação direta em músculos liso e cardíaco. 2015.
RINNINELLA, Emanuele et al. What is the healthy gut microbiota composition? A changing ecosystem across age, environment, diet, and diseases. Microorganisms, v. 7, n. 1, p. 14, 2019.
SAROWSKA, Jolanta et al. The therapeutic effect of probiotic bacteria on gastrointestinal diseases. Adv Clin Exp Med, v. 22, n. 5, p. 759-66, 2013.
SPILLER, Robin et al. Guidelines for the management of Irritable Bowel Syndrome. Gut, 2007.
TILLISCH, K., & Mayer, E. A. (2005). Pain perception in irritable bowel syndrome. CNS Spectrometry, 10(11), 877-882.
WESTON, Allan P. et al. Terminal ileal mucosal mast cells in irritable bowel syndrome. Digestive diseases and sciences, v. 38, p. 1590-1595, 1993.
[1]Graduada em Nutrição pela Universidade Tiradentes Campus Farolândia e-mail: laris_mari@hotmail.com
[2]Graduada em Nutrição pela Universidade Tiradentes Campus Farolândia e-mail: vanessa.mmachado@souunit.com.br
[3]Graduada em Nutrição pela Universidade Tiradentes Campus Farolândia e-mail: jayne.ramos@souunit.com.br
[4]Graduada em Nutrição pela Universidade Tiradentes Campus Farolândia e-mail: nutristeffanyalmeida@gmail.com
[5]Graduada em Nutrição pela Universidade Salgado de Oliveira e-mail: thalyta_nutri@hotmail.com
[6]Graduada em Nutrição pela Faculdade Bezerra de Araújo e-mail: larissatorresnutricao@gmail.com
[7]Graduada em Nutrição pela Universidade Federal do Pará e-mail: meduardavelosolima@gmail.com
[8]Graduada em Nutrição pela Universidade Federal de Goiás e-mail: grazielacamposnutri@gmail.com
9 Discente em Nutrição pela Universidade Federal de Viçosa e-mail: nutrioliveirasabrina@gmail.com
10Graduada em Nutrição pelo Centro Universitário Maurício de Nassau Campus Parnaíba e-mail: danielleg.nutricionista@gmail.com
11 Mestre em Educação Física pela Universidade Federal de Sergipe Campus São Cristóvão e-mail: marcusnascimentone@gmail.com
