REGISTRO DOI: 10.69849/revistaft/th10248191414
Joab Gabriel do Nascimento Santos1
Louise Bárbara Azevedo da Silva2
Wesley Soares Holanda Silva3
Jefferson Henrique dos Santos Silva4
Luiz Alcino Monteiro Gueiros5
José Ricardo Dias Pereira6
Karina Alexsandra da Silva Brito7
Flavia Garcia de Aquino8
Matheus Henrique Albuquerque de Lima9
Fabiana Santos Cerqueira10
Maurício Alves Martins11
Amanda Santos Oliveira do Carmo12
Jacqueline Feliciano Fusussi13
Pio Moerbeck Filho14
RESUMO
Os queloides ocorrem devido a uma resposta exagerada do processo de cicatrização, onde há produção excessiva de colágeno, uma proteína essencial na reparação dos tecidos. Em alguns pacientes, ao invés de parar quando a lesão é curada, essa produção continua, resultando em uma cicatriz. Diferente de cicatrizes normais, que tendem a ser discretas e niveladas com a superfície da pele, os queloides são elevados, espessos e podem se estender além da área da ferida original. O tratamento de queloides por remoção cirúrgica envolve a excisão do tecido cicatricial anormal. No entanto, a cirurgia isolada apresenta uma alta taxa de recorrência, por isso, frequentemente é combinada com outras terapias para minimizar esse risco. O principal objetivo desse trabalho é relatar um caso clínico de um paciente do sexo masculino de 27 anos com lesão na região do lobo da orelha. No exame físico foi observado aumento de volume, formato irregular e com consistência endurecida. Esse caso foi conduzido no Hospital da Restauração, e a conduta terapêutica foi escolhida conforme as condições possíveis visando a saúde e a estética do indivíduo. Como os queloides não regridem naturalmente, o tratamento pode incluir injeções de corticosteróides, cirurgia, entre outras abordagens. No entanto, mesmo com tratamento, há uma alta chance de recorrência por isso se faz necessário um acompanhamento frequente do cirurgião com o paciente. A observação contínua é essencial para detectar sinais de recidiva precoce e ajustar o tratamento conforme necessário. Se o queloide reaparecer, pode ser necessário um tratamento adicional, como injeções de corticosteróides ou terapias a laser.
Palavras-chave: Queloide. Orelha Externa. Bucomaxilofacial.
1 INTRODUÇÃO
O queloide é definido como um tumor intradérmico, caracterizado por um tipo de cicatriz que se desenvolve quando o tecido fibroso cresce de forma excessiva durante o processo de cicatrização de uma lesão cutânea. Diferentemente das cicatrizes normais, que param de crescer uma vez que a ferida está fechada, os queloides continuam a se expandir além da área original da lesão (Mouhari-Toure et al., 2012).
Eles podem surgir após cortes, queimaduras, picadas de insetos, cirurgias, acne grave ou até mesmo perfurações e tatuagens, embora a formação espontanea possa ocorrer, e podem variar em cor, de rosa a vermelho ou até marrom escuro, dependendo do tom de pele da pessoa. Surgem, em geral, cerca de três meses após o trauma, não diminuem por conta própria e são exclusivos dos seres humanos (Yong; Afshar; Macneily; Arneja, 2013)
A prevalência de queloides em pessoas com pele negra varia de 4 a 16%, sendo cerca de 15 vezes mais comum do que em pessoas de pele branca. A maior incidência se dá entre os 10 e 30 anos de idade, sem distinção de sexo (Urioste; Arndt; Dover, 1999).
O processo de cicatrização envolve a produção de colágeno, uma proteína que ajuda a reparar a pele danificada. No caso dos queloides, o corpo produz colágeno em excesso, resultando em um crescimento anormal de tecido, resultando em uma massa elevada e fibrosa que se estende além da área da lesão inicial. Embora a razão exata para essa superprodução não seja completamente compreendida, fatores genéticos desempenham um papel significativo no surgimento dos queloide (Kreisner; Oliveira; Weismann, 2005).
A formação de queloides está fortemente associada a fatores genéticos. Pessoas com histórico familiar de queloides têm uma maior probabilidade de desenvolvê-los. Estudos sugerem que certos genes podem predispor indivíduos à formação do queloide, influenciando a maneira como o corpo reage a lesões cutâneas e como o colágeno é produzido durante o processo de cicatrização (Halim; Emami; Salahshourifar; Thrirumulu, 2012).
2 RELATO DE CASO
Paciente do sexo masculino, 27 anos, procurou atendimento no Hospital da Restauração (HR) devido a um aumento de volume na região do lobulo da orelha, após cinco meses do aparecimento da lesão. Esse paciente relatou queixa estética e dor na região da lesao, com isso foi encaminhado para o Serviço de Cirurgia e Traumatologia Bucomaxilofacial. Paciente classificado como ASA I, sem alergias medicamentosas ou doenças de base.
De acordo, com o hemograma completo os eritrócitos, hematócrito e hemoglobina estavam com o valor de referência considerado normal, assim como, o TGO e TGP. Com base nisso, a cirurgia foi realizada.
Então, o paciente foi submetido ao exame físico, de acordo com a avaliaçao da palpação percebeu-se uma lesão de consistência endurecida, com elevaçoes irregulares. Mas, as estruturas da orelha ainda se apresentavam preservadas.
Figura 1 – Imagem pós-operatória do exame físico extraoral do paciente, em norma frontal (A), caudo-cranial (B).
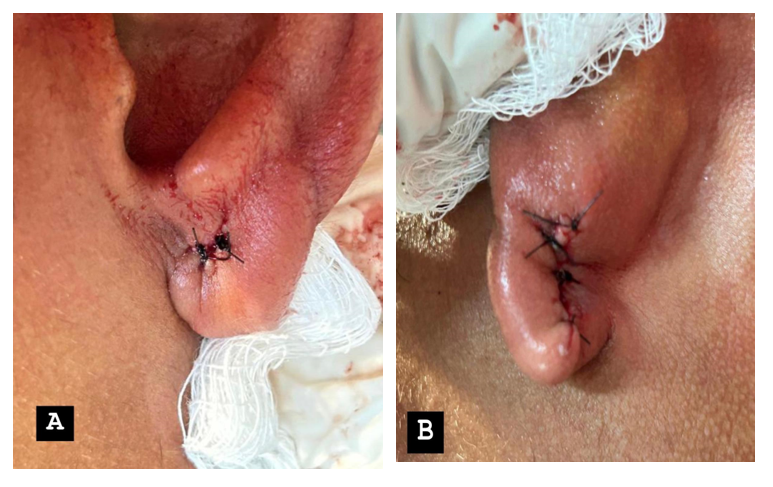
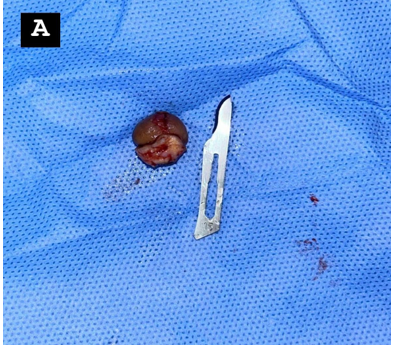
Figura 2 – Imagem da lesão, em norma frontal (A) que foi encaminhada para biópsia e a partir disso se confirmou a hipótese diagnóstica de quelóide.
No pós-operatório imediato foi observado, clinicamente, melhora na anatomia da região do lóbulo da orelha e na projeção dos contornos dessa região, contribuindo assim com a questão estética. Apesar, de apresentar leve edema na região, o paciente apresentou ausência de queixas álgicas. E depois da alta clínica, o paciente não retornou para avaliação de controle.
3 METODOLOGIA
Esta revisão científica foi realizada com base em artigos científicos dispostos nas bases de dados MEDLINE via PubMed (Medical Literature Analysis and Retrieval System Online), LILACS (Literatura Latino-Americana e do Caribe em Ciências da Saúde) e Biblioteca Virtual em Saúde (BVS).
Para a seleção dos estudos foram utilizados, como critérios de inclusão, artigos que estivessem dentro da abordagem temática, disponíveis na íntegra e de forma gratuita, nos idiomas inglês, português e espanhol. Como parâmetros de exclusão foram retirados artigos duplicados e que fugiam do tema central da pesquisa. Para busca dos artigos foram utilizadas as palavras-chave “Queloide”, “Orelha Externa” e “Bucomaxilofacial” indexadas aos Descritores em Ciência da Saúde (DeCS).
4 DISCUSSÕES
A formação de queloides está associada a variações em vários genes. Um dos genes mais estudados nesse contexto é o gene do fator de crescimento transformador beta 1 (TGF-β1). Além do TGF-β1, outros genes e loci genéticos têm sido implicados na predisposição ao desenvolvimento de queloides (FIGUEIREDO et al., 2008).
O TGF-β1 desempenha um papel crucial na cicatrização de feridas e na formação de cicatrizes. Ele regula a produção de colágeno e a resposta inflamatória, ambos fundamentais no processo de cicatrização. Variações genéticas no gene TGF-β1 podem levar a uma produção excessiva de colágeno, resultando em queloides. O fator de crescimento transformador beta 1 (TGF-β1) é uma citocina multifuncional que desempenha um papel central na regulação da cicatrização de feridas e na homeostase tecidual. Ele exerce suas funções biológicas por meio da modulação da proliferação, diferenciação e migração celular, além da produção e degradação da matriz extracelular (MEC) (CAMPANER et al., 2006).
No contexto da formação de queloides, o TGF-β1 é reconhecido como um dos principais mediadores. Os queloides são cicatrizes que estão, frequentemente, associados a uma desregulação nas vias de sinalização do TGF-β1. Este fator de crescimento promove a síntese de colágeno e outros componentes da MEC pelos fibroblastos, células-chave na cicatrização. Além disso, o TGF-β1 inibe a degradação da MEC ao suprimir a atividade das metaloproteinases de matriz (MMPs) e aumentar a expressão dos inibidores teciduais das metaloproteinases (TIMPs) (CANADY et al., 2013).
Em pacientes com tendência à formação de queloides, há uma superexpressão de TGF-β1, levando a uma produção excessiva de colágeno tipo I e III, fibronectina e outras proteínas da MEC. Esse desequilíbrio entre a síntese e a degradação da matriz resulta em uma acumulação progressiva de tecido fibroso, característico dos queloides. Além disso, o TGF-β1 estimula a transdiferenciação de fibroblastos em miofibroblastos, células que têm um papel crucial na contração da ferida e na deposição de colágeno, exacerbando ainda mais a formação do tecido cicatricial anômalo (GAUGLITZ et al., 2017).
Devido à ligação genética na formação de queloides, a hereditariedade exerce um papel fundamental na predisposição para o desenvolvimento de queloides. Pessoas com familiares próximos que têm queloides apresentam maior risco de desenvolver essas cicatrizes. Estudos de agregação familiar sugerem que a predisposição para formar queloides pode ser transmitida geneticamente (BROWN; BAYAT, 2009).
Os queloides podem causar uma série de sintomas e impactos na vida de uma pessoa, trazendo conseqüências estéticas, desconforto, restrição de movimento e complicações psicológicas. A aparência de um queloide pode ser um grande incômodo estético, especialmente quando se forma em áreas visíveis como o rosto, pescoço ou mãos. Eles geralmente têm uma cor mais escura do que a pele circundante e podem ter uma textura elevada e firme. Muitos queloides causam desconforto físico. Eles podem ser pruriginosos (causar coceira) e, em alguns casos, dolorosos. Algumas pessoas relatam sensações de queimação ou sensibilidade aumentada na área afetada (FERREIRA; D’ASSUMPÇÃO, 2006).
A primeira linha de tratamento para quelóides em região de lóbulo geralmente envolve a aplicação de corticosteroides, como a triamcinolona, diretamente na lesão. Esse tipo de injeção tem como objetivo reduzir a inflamação e a proliferação de fibroblastos, promovendo a diminuição do tamanho do quelóide ao longo do tempo. O tratamento costuma ser realizado em várias sessões, com intervalos de algumas semanas entre as aplicações (WOLWACZ et al., 2000).
Além disso, o uso de placas de silicone, tanto no formato de gel quanto em fita, é uma abordagem não invasiva que auxilia na hidratação e na compressão do tecido cicatricial, promovendo a remodelação da cicatriz e reduzindo sua elevação. Esse método é particularmente eficaz quando utilizado como tratamento adjuvante em combinação com outras terapias (WOLWACZ et al., 2000).
Em casos onde o quelóide é resistente aos tratamentos clínicos, a excisão cirúrgica pode ser considerada. No entanto, essa abordagem deve ser realizada com cautela, uma vez que há um risco significativo de recorrência da lesão, muitas vezes em tamanho maior do que o original. Para mitigar esse risco, a cirurgia é frequentemente combinada com tratamentos adjuvantes, como a radioterapia pós-operatória ou a aplicação de corticosteroides (OLIVEIRA et al., 2013).
A radioterapia de baixa dose, aplicada logo após a excisão cirúrgica, tem mostrado resultados promissores na prevenção da recorrência de quelóides. Este tratamento atua inibindo a proliferação excessiva de fibroblastos na região afetada. Outra alternativa é o uso de laser de CO2 fracionado, que pode ser utilizado tanto para reduzir o volume do quelóide quanto para melhorar a textura da pele ao redor (OLIVEIRA et al., 2013).
Embora os queloides possam se desenvolver em qualquer parte do corpo, certas áreas são mais propensas devido à tensão da pele, traumas repetidos e características anatômicas específicas. Compreender essas áreas e os fatores de risco associados é essencial para prevenir e tratar eficazmente os queloides.
5 CONCLUSÃO/CONSIDERAÇÕES FINAIS
A remoção cirúrgica de quelóides no lóbulo auricular é um procedimento desafiador devido à alta taxa de recorrencia no entando, a associação da corticoterapia com triancinolona e a remoção cirúrgica de queloides mostra-se um tratamento eficaz. A combinação dessas abordagens terapêuticas proporciona uma significativa redução no tamanho e na recorrência dos queloides, melhorando a qualidade de vida dos pacientes. A corticoterapia com triancinolona atua eficazmente na modulação da resposta inflamatória e na redução da síntese de colágeno, enquanto a remoção cirúrgica elimina a massa queloidiana, possibilitando uma cicatrização mais controlada. Ainda asssim, é essencial um acompanhamento pós-operatório rigoroso para monitorar a resposta ao tratamento e intervir prontamente em casos de recidiva. Assim, a abordagem combinada surge como uma opção promissora e robusta no manejo dos queloides, contribuindo para avanços significativos na prática clínica dermatológica.
REFERÊNCIAS
Anelisa B. Campaner, Lydia M. Ferreira, Alfredo Gragnani, Jan M. Bruder, Jennifer L. Cusick, Jeffrey R. Morgan, Upregulation of TGF-β1 Expression May Be Necessary but Is Not Sufficient for Excessive Scarring, Journal of Investigative Dermatology, volume 126, Issue 5, 2006, Pages 1168-1176, ISSN 0022-202X,
Brown JJ, Bayat A. Genetic susceptibility to raised dermal scarring. Br J Dermatol. 2009 Jul;161(1):8-18. doi: 10.1111/j.1365-2133.2009.09258.x. Epub 2009 Jun 8. PMID: 19508304.
Figueiredo JCA, Oliveira Junior FC, Zampar AG, Mélega JM. Quelóide: fatores de influência prognóstica. Rev Bras Cir Plást. 2008;23(4):274-80.
Ferreira, CM e D’Assumpção, EA (2006) Cicatrizes Hipertróficas e Quelóides. Revista da Sociedade Brasileira de Cirurgia Plástica, 21, 40-48.
Gauglitz GG, Korting HC, Pavicic T, Ruzicka T, Jeschke MG. Hypertrophic scarring and keloids: pathomechanisms and current and emerging treatment strategies. Mol Med. 2011 Jan-Feb;17(1-2):113-25. doi: 10.2119/molmed.2009.00153. Epub 2010 Oct 5. PMID: 20927486; PMCID: PMC3022978.
Kreisner, PE; Oliveira MG ; Weismann R. Cicatrização hipertrófica e quelóides: revista de literatura e estratégias de tratamento. Rev. Cir. Traumatol. Buco-Maxilo-Fac., Camaragibe v.5, n.1, p. 9 – 14, jan./mar. 2005
Lonsdale, J., Thomas, J., Salvatore, M., Phillips, R., Lo, E., Shad, S., … & Moore, HF (2013). O projeto de expressão genótipo-tecido (GTEx). Nature genetics , 45 (6), 580-585.
Mouhari-Toure A, Saka B, Kombaté K, Akakpo S, Egbohou P, Tchangaï-Walla K, Pitche P. Is There an Association between Keloids and Blood Groups? ISRN Dermatol. 2012;2012:750908. doi: 10.5402/2012/750908. Epub 2012 Dec 6. PMID: 23259072; PMCID: PMC3521402.
Oliveira Junior B, Schellini SA, Lastória JC, Carvalho LR, Stolf HO, Oliveira P. Tratamento de queloides usando radioterapia pós-operatória com elétrons: estudo comparativo e planejado com dois esquemas. Surg Cosmet Dermatol. 2013;5(1):16-26.
Souza, PG de, Castro, MS de, & Silva, LP da. (2021). A Biologia da proliferação fibroblástica: a excessiva deposição extracelular de colágeno durante o reparo de lesões na pele / A Biologia da proliferação fibrobástica: deposição excessiva de colágeno extracelular durante o reparo de lesões cutâneas. Revista Brasileira de Desenvolvimento , 7 (3), 28989–29010.
Urioste SS, Arndt KA, Dover JS. Keloids and hypertrophic scars: review and treatment strategies. Semin Cutan Med Surg. 1999 Jun;18(2):159-71.
Wolwacz A, César EO, Ciufo MR, Wolwacz Júnior I, Kuyven CR, Deos MF. Opções terapêuticas nas cicatrizes queloidianas. Rev Bras Cir Plást. 2000;15(1):21-4.
Yong, M., Afshar, K., MacNeily, A., & Arneja, JS (2013). Tratamento do queloide peniano pediátrico. Canadian Urological Association Journal , 7 (9-10), e618–20.
1 Discente do curso superior de Odontologia do Centro Universitário Maurício de Nassau (UNINASSAU) – Campus Graças, Recife – PE, Brasil. E-mail: gabriel1999nsm@gmail.com;
2 Discente do curso superior de Odontologia do Centro Universitário Maurício de Nassau (UNINASSAU) – Campus Graças, Recife – PE, Brasil. E-mail: louiseazevedo.odonto@gmail.com;
3 Discente do curso superior de Odontologia da Universidade Federal de Alagoas (UFAL) – Campus A.C Simões, Maceió – AL, Brasil. E-mail: wesleysoaresholandasilva20@gmail.com;
4 Discente do curso superior de Odontologia da Universidade Federal de Pernambuco (UFPE) – Campus Recife, Recife – PE, Brasil. E-mail: jefferson.henriquesilva@ufpe.br;
5 Formado no curso superior de Odontologia pela Universidade Federal de Pernambuco (UFPE) – Campus Recife, Recife – PE, Brasil. E-mail: luiz.mgueiros@ufpe.br;
6 Formado no curso superior de Odontologia pela Universidade de Pernambuco (UPE) – Campus Recife, Recife – PE, Brasil. E-mail: jose.dpereira@ufpe.br;
7 Discente do curso superior de Odontologia do Centro Universitário Maurício de Nassau (UNINASSAU) – Campus Graças, Recife – PE, Brasil. E-mail: karinabrito_@outlook.com;
8 Formado no curso superior de Odontologia pela Universidade da Amazônia (UNAMA) – Campus Alcindo Cancela, Belém – PA, Brasil. E-mail: garciaaquino81@gmail.com;
9 Discente no curso superior de Odontologia do Centro Universitário Maurício de Nassau (UNINASSAU) – Campus Graças, Recife – PE, Brasil. E-mail: matheus00henriquelima@gmail.com;
10 Discente no curso superior de Odontologia do Centro Universitário Maurício de Nassau (UNINASSAU) – Campus Pituba, Salvador – Bahia , Brasil. E-mail: fsccerqueira@gmail.com;
11 Discente no curso superior de Odontologia da Universidade Federal de Pernambuco (UFPE) – Campus Recife, Recife – PE, Brasil. E-mail: mauricio.martins@ufpe.br;
12 Discente no curso superior de Odontologia na Universidade Federal de Sergipe (UFS) – Campus Universitário professor Antonio Garcia Filho, Lagarto – SE, Brasil. E-mail: amanda.santosoliveirac@gmail.com
13 Discente no curso superior de Odontologia na Universidade Federal Fluminense (UFF) – Campus Valonguinho, Niterói – RJ, Brasil. Email: jacquelineffusussi@gmail.com
14 PHD em Implantodontia pela Universidade Estadual Paulista Júlio de Mesquita Filho (UNESP) – Campus São Paulo, São Paulo – SP, Brasil. E-mail: piomoerbeck@hotmail.com
