OBESITY TREATMENT WITH SEMAGLUTIDE: A LITERATURE REVIEW
REGISTRO DOI: 10.69849/revistaft/pa10202502262002
Wilson Souza Neto1
Isabela Silveira de Oliveira Carballal2
Resumo
A semaglutida é um análogo humano do GLP-1 atualmente em desenvolvimento para o tratamento de Diabetes mellitus tipo 2, com uma estrutura semelhante à liraglutida e recentemente foi aprovado para controle de peso crônico. Diante do exposto, este estudo objetivou destacar do papel da semaglutida no tratamento da obesidade, juntamente com seus benefícios e, por outro lado, considerar possíveis efeitos colaterais que podem impactar a decisão de incluir este medicamento no tratamento do paciente. Realizou-se uma revisão de literatura, na modalidade sistemático, através de consulta nos bancos de dados do LILCAS e PUBMED. Totalizando 11 artigos para discussão. As pesquisas analisadas demonstraram que a semaglutida é um fármaco muito promissor, sobretudo para pacientes que sofrem de complicações da obesidade, visto que, esse medicamenrto se destaca por seus efeitos pleiotrópicos, dos quais os mais desejados são a diminuição do nível de glicose e perda de peso. Apesar que a semaglutida apresente alguns efeitos colaterais, sendo os mais conhecidos são aqueles do sistema gastrointestinal, como náusea, vômito, constipação. Conclui-se que a magnitude da perda de peso relatada pelos os estudos selecionados oferece o potencial para melhora clinicamente relevante para indivíduos com doenças relacionadas à obesidade.
Palavras-chave: Obesidade. Tratamento Farmacológico. Depressores do Apetite.
Abstract
Semaglutide is a human analogue of GLP-1 currently under development for the treatment of type 2 diabetes mellitus, with a structure similar to liraglutide and was recently approved for chronic weight control. Given the above, this study aimed to highlight the role of semaglutide in the treatment of obesity, along with its benefits and, on the other hand, consider possible side effects that may impact the decision to include this drug in the patient’s treatment. A systematic literature review was carried out through consultation in the LILCAS and PUBMED databases, totaling 11 articles for discussion. The research analyzed demonstrated that semaglutide is a very promising drug, especially for patients suffering from complications of obesity, since this drug stands out for its pleiotropic effects, of which the most desired are the reduction of glucose levels and weight loss. Although semaglutide has some side effects, the best known are those of the gastrointestinal system, such as nausea, vomiting, and constipation. It is concluded that the magnitude of weight loss reported by the selected studies offers the potential for clinically relevant improvement for individuals with obesity-related diseases.
Keywords: Obesity. Pharmacological Treatment. Appetite Suppressants.
1 INTRODUÇÃO
A obesidade é um problema de saúde pública, tanto brasileira como mundialmente. Devido à falta de ações de intervenções, dados tem estimado que no 2035, triplicará o número de pessoas obesas, ou seja, na população americana 90% dos indivíduos serão sobrepeso ou obeso. No Brasil, de acordo com a Associação Brasileira para o Estudo da Obesidade (ABESO) 40% dos brasileiros são obesos (Neta et al., 2019).
De acordo com a Organização Mundial da Saúde (OMS), sobrepeso e obesidade são acúmulo excessivo de tecido adiposo e tem como consequência problemas para a saúde. A obesidade é pertence ao grupo de Doenças Crônicas Não-Transmissíveis (DCNT’s), que não possui uma denominação especifica, podendo ser também denominada de doenças não-infecciosas, doenças crônicas-degenerativas (Aprelini et al., 2023)
A obesidade apresenta diversas consequências a curto prazo e principalmente as consequências – tanto psicológicas quanto sociais – deterioram muito a qualidade de vida de pacientes obesos. Crianças obesas têm de morte prematura e incapacidade na idade adulta. Além desses maiores riscos futuros, as crianças obesas têm maiores dificuldades respiratórias, maior risco de fraturas e hipertensão e marcadores precoces de doenças cardiovasculares, resistência à insulina, diabetes mellitus tipo 2 e efeitos psicológicos deletérios (Castanha et al., 2018).
O tratamento, a prevenção, e alteração no estilo de vida através da intervenção dietética e realização de atividade física, em alguns casos torna-se ineficaz para os pacientes. Neste contexto o tratamento medicamentoso torna-se eficiente no combate a obesidade, visto que o paciente obeso passa a atingir melhores resultados a longo prazo (Gomes; Trevisan, 2021).
Os medicamentos antiobesidade (AOM) ajudam a facilitar o controle de peso quando usados em conjunto com uma dieta de calorias reduzidas e aumento da atividade física por indivíduos com um índice de massa corporal (IMC) ≥30 kg/m2 ou ≥27 kg/ m2 com uma comorbidade relacionada à obesidade, como diabetes tipo 2, hipertensão ou dislipidemia. Cinco medicamentos são atualmente aprovados para controle de peso crônico nos EUA (liraglutida, orlistate, naltrexona/bupropiona, fentermina/topiramato e semaglutida), três na Europa (liraglutida, orlistate e naltrexona/bupropiona) e um na China (orlistate). Esses medicamentos têm vários mecanismos de ação que visam diversas vias relacionadas à regulação do peso (Chao et al., 2023).
No Brasil, inicialmente eram cinco medicamentos registrados para o tratamento da obesidade: anfepramona (dietilpropiona), femproporex, mazindol, sibutramina e orlistate, contudo, no ano de 2011, a Agência Nacional de Vigilância Sanitária (Anvisa) retirou do mercado três fármacos inibidoras de apetite do tipo anfetamínicos, sendo eles: mazindol, femproporex e anfepramona. Os laboratórios que apresentaram registro desses medicamentos no país, contudo não tinham pesquisas de eficácia e segurança dentro dos padrões exigidos pela Anvisa, além de demonstrarem os riscos associados a utilização de inibidores de apetite do tipo anfetamínicos eram maiores que o seu benefício (Brasil, 2022).
Nesse contexto, destaca-se a semaglutida, que é um potente análogo do peptídeo semelhante ao glucagon-1 (GLP-1) de ação prolongada (Bergmann et al., 2023). O peptídeo semelhante ao glucagon (GLP)-1, um hormônio incretina secretado pelas células L no intestino delgado, estimula a insulina e inibe as secreções de glucagon das ilhotas pancreáticas de forma dependente da glicose, levando a níveis mais baixos de glicose no sangue (Bluendell et al., 2017).
Nos Estados Unidos, a semaglutida subcutânea semanal de 1,0 mg foi aprovada pela primeira vez em 2017 para uso em adultos com diabetes tipo 2 (DT2), seguida pela aprovação de uma formulação oral em 2020. A aprovação foi baseada na ação dos agonistas do receptor GLP-1 (GLP-1RAs) para reduzir os níveis de hemoglobina glicada (HbA1c) aumentando a liberação de insulina dependente de glicose, reduzindo a secreção de glucagon e retardando o esvaziamento gástrico (Aroda et al., 2019). No entanto, os GLP-1RAs também têm efeitos separados na regulação do apetite mediados por ações nos centros do sistema nervoso central que resultam em perda de peso. Atualmente, a administração subcutânea de 2,4 mg de semaglutida, uma vez por semana, é aprovada para controle crônico de peso em adultos com obesidade ou sobrepeso e com pelo menos uma comorbidade (Marett et al., 2025).
De acordo com Lexchin e Mintzes (2023) ensaios clínicos randomizados patrocinados pelo fabricante mostraram uma perda de quase 12% do peso corporal em um período de 68 semanas, no entanto, uma vez que a medicação é interrompida, as pessoas recuperam a maior parte do peso anterior ao tratamento. Além disso, o grande hype na mídia social resultou em aumento da demanda por semaglutida, levando a problemas de fornecimento em vários produtos licenciados, incluindo aqueles usados para tratamento de diabetes. Portanto, o conhecimento e a informação sobre o tema são de relevância para a comunidade.
Nesse sentido, O objetivo desta revisão é destacar do papel da semaglutida no tratamento da obesidade, juntamente com seus benefícios e, por outro lado, considerar possíveis efeitos colaterais que podem impactar a decisão de incluir este medicamento no tratamento do paciente.
2 METODOLOGIA
Realizou-se uma revisão de literatura, na modalidade sistemático, através dos seguintes bancos de dados: Literatura Latino-Americana e do Caribe (LILACS) e Literatura Internacional em Ciências da Saúde (PUBMED), considerando artigos publicados entre 2015 e 2025 (10 anos). Para o estudo, foram aplicados os seguintes Descritores em Ciências da Saúde (DeCs) em português: obesidade, tratamento farmacológico e depressores do apetite em inglês: obesity, Drug Therapy and Appetite Depressants, combinados entre si com a utilização do operador booleano AND. Esta revisão baseia-se no Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA Statement) que foi útil para a avaliação crítica dos estudos publicados.
O idioma limitado foi português e inglês, estudos que os sujeitos tinham índice de massa corporal (IMC) ≥25, ambos os sexos, com ou sem diabetes tipo 2. Critérios de exclusão: publicações repetidas, experimentos com animais, ensaios controlados não randomizados, literatura para a qual os dados não puderam ser extraídos ou baixados, artigos de conferência, revisão, combinação ou administração não única de outros medicamentos hipoglicêmicos.
Realizou-se a leitura dos títulos e resumos dos artigos selecionados. Dentre dos resumos analisados, selecionou-se os que apresentaram até dois descritores e se o conteúdo apresentado no resumo estava abordando o objetivo proposto. Ressalta-se que foram múltiplas as combinações dos termos escolhidos para a busca dos artigos, todavia manteve-se a preocupação de respeitar os critérios de inclusão e exclusão citados anteriormente. Os dados extraídos foram organizados em quadros que abrangeu a caracterização da amostra e a descrição do principal resultado.
3 RESULTADOS E DISCUSSÕES
Foram identificados 268 estudos relevantes das bases de dados pesquisadas, destes, foram excluídos 70 após a verificação dos títulos e, 198 dos restantes artigos foram analisados com base no título e na sua compatibilidade com os critérios de inclusão e exclusão. Estes tiveram seus resumos lidos, sendo 60 deles selecionados para avaliação de texto completo para elegibilidade e posterior inclusãona análise qualitativa, como demonstra a figura abaixo.
A figura 1, abaixo, mostra como ocorreu a seleção dos artigos.
Figura 1 – Fluxograma da seleção dos artigos
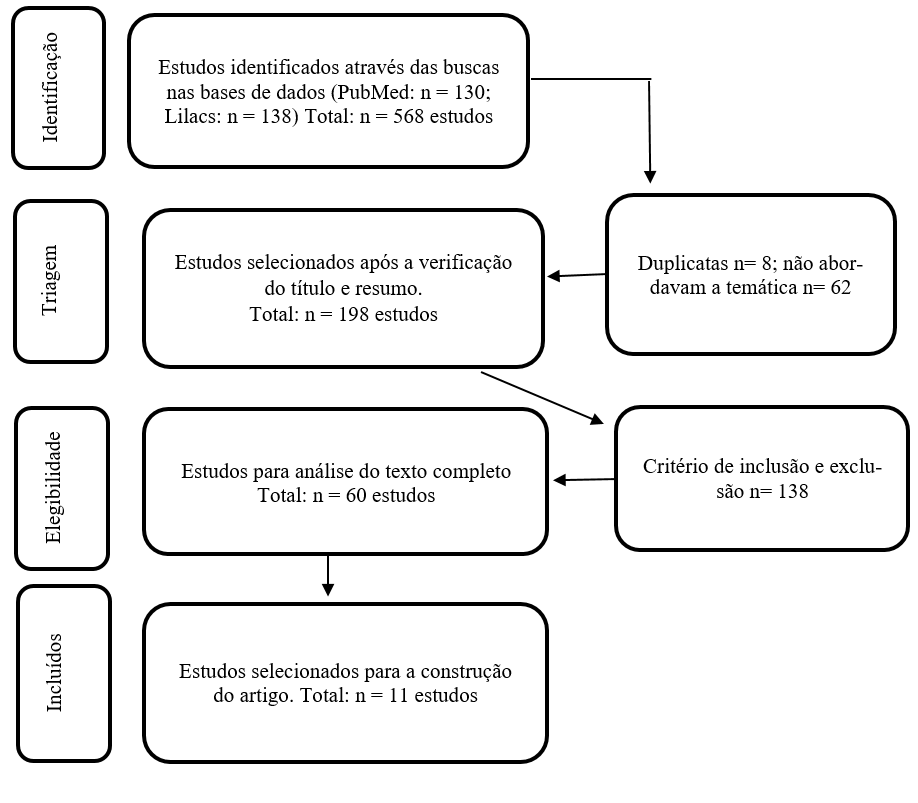
A amostra final foi constituída por 11 artigos. A pesquisa não ocasionou riscos por se tratar de pesquisa de revisão bibliográfica. Irá contribuir para o aprofundamento do conhecimento do tema investigado, trazendo subsídios para uma assistência de qualidade prestada pelos profissionais de saúde ao paciente com obesidade. Os dados extraídos por estudo, ano de publicação, amostra, idade, intervenção, forma de dosagem e tempo de utilização estão contidas no quadro 1.
Quadro 1 – Características dos estudos incluídos.
N. Estudo Amostra Idade Intervenção (Dose) Forma de dosagem Tempo de utilização 1 Weghuber et al. (2022) 201 participantes adolescentes (12 a <18 anos de idade) Semaglutida de 0,25 mg para 2,4 mg e placebo Injeção subcutânea, uma vez por semana 68 semanas 2 Ruseva et al. (2024) 343 pacientes 48,0 (±10,5) anos Semaglutida 2,4 mg Injeção subcutânea, uma vez por semana 6 meses 3 Blundell et al. (2017) 30 indivíduos ≥18 anos de idade semaglutida (1,34 mg/mL) e placebo Injeção subcutânea, uma vez por semana 12 meses 4 Garvey et al. (2022) 304 participantes ≥18 anos de idade semaglutida 2,4 mg versus placebo Injeção subcutânea, uma vez por semana 104 semanas 5 Jamal et al. (2024) 115 pacientes Idade média de 38,8 semaglutida ou tirzepetida – – 6 Kanai et al. (2024) 29 pacientes 47,2 ± 8,7 semaglutida Injeção subcutânea, uma vez por semana – 7 Wharton et al. (2022) 803 participantes ≥18 anos de idade semaglutida 2,4 mg ou placebo Injeção subcutânea, uma vez por semana 20 semanas 8 Billings et al., (2023) 01 participante 47 anos semaglutida 17 mg Injeção subcutânea, uma vez por semana – 9 Lincoff et al. (2023) 17.604 pacientes 45 anos ou mais semaglutida de 2,4 mg ou placebo Injeção subcutânea, uma vez por semana Duração média (±DP) da exposição à semaglutida ou placebo foi de 34,2±13,7 meses 10 Li et al. (2023) 02 pacientes 40 anos e 54 anos Semaglutida De 0,5 mg Injeção subcutânea, uma vez por semana 4 semanas 11 Hathaway et al., (2024) 979 pacientes 47 anos ou mais Semaglutida Injeção subcutânea, uma vez por semana –
De acordo os estudos selecionados, verifica-se que todos (100%) são estrangeiros. Também observou-se que maiorias das pesquisas dos anos de 2023 e 2024. Um total de 20.411 participantes foram incluídos nos onze estudos. Referente ao sexo, observa-se na maioria dos estudos observou-se uma predominância da população de 40 ou mais idade.
Referente aos resultados principais, os estudos na sua maioria enfatizaram resultados positivos no tratamento de obesidade com semaglutida, como demonstra o quadro 2.
Quadro 2 – Tipo de pesquisa e resultados principais.
N. Estudos Método Principais resultados 1 Weghuber et al. (2022) Estudo duplo-cego, randomizado Entre adolescentes com obesidade, o tratamento uma vez por semana com uma dose de 2,4 mg de semaglutida mais intervenção no estilo de vida resultou em uma redução maior no IMC do que a intervenção no estilo de vida sozinha. 2 Ruseva et al. (2024) Estudo observacional e retrospectivo Este estudo demonstrou a eficácia do semaglutido 2,4 mg na redução do peso corporal e na melhora dos parâmetros cardiometabólicos em adultos com sobrepeso ou obesidade em um ambiente de prática clínica do mundo real, mostrando uma redução significativa do peso corporal médio e melhorias em biomarcadores como pressão arterial e HbA1c ao longo de um período de 6 meses. 3 Blundell et al. (2017) Ensaio randomizado, duplo-cego Após 12 semanas de tratamento, a ingestão de energia ad libitum foi substancialmente menor com semaglutida versus placebo, com uma perda correspondente de peso corporal observada com semaglutida. Além da ingestão de energia reduzida, os mecanismos prováveis para perda de peso induzida por semaglutida incluíram menos apetite e desejos por comida, melhor controle da alimentação e menor preferência relativa por alimentos gordurosos e densos em energia. 4 Garvey et al. (2022) Estudo observacional e retrospectivo Adultos com sobrepeso (com pelo menos uma comorbidade relacionada ao peso) ou obesidade, o tratamento com semaglutida levou a perda de peso substancial e sustentada ao longo de 104 semanas versus placebo. 5 Jamal et al. (2024) Pesquisa retrsopectiva Neste estudo, o tratamento com semaglutida e tirzepatida para recorrência de peso após cirurgia bariátrica produziu perda de peso significativa em curto prazo nesta coorte. Pacientes que receberam semaglutida tiveram perda média de peso de 10,3% em 6 meses do peso pré-tratamento, enquanto aqueles que receberam tirzepatida alcançaram uma perda média de peso maior de 15,5% em 6 meses. 6 Kanai et al. (2024) Pesquisa retropectiva Semaglutida após cirurgia bariátrica em pacientes com obesidade e DT2 resultou em redução de peso adicional e melhorou o controle glicêmico , mas piorou as métricas nutricionais medidas. 7 Wharton et al. (2022) Estudo randomizado Os eventos adversos gastrointestinais foram mais comuns com semaglutida 2,4 mg do que com placebo, mas tipicamente leves a moderados e transitórios. 8 Billings et al., (2023) Estudo de caso Paciente com mialgias, fraqueza e creatina quinase elevada associada à terapia com semaglutida prescrita para perda de peso. Seus sintomas e marcadores laboratoriais eram consistentes com rabdomiólise e resolvidos após a descontinuação da semaglutida. Após a nova administração em uma dose menor, os sintomas recorreram e a urinálise foi consistente com mioglobinúria. Os sintomas novamente resolveram-se rapidamente após a descontinuação da medicação. 9 Lincoff et al. (2023) Estudo multicêntrico, duplo-cego, randomizado Em pacientes com doença cardiovascular preexistente e sobrepeso ou obesidade, mas sem diabetes, a semaglutida subcutânea semanal na dose de 2,4 mg foi superior ao placebo na redução da incidência de morte por causas cardiovasculares, infarto do miocárdio não fatal ou acidente vascular cerebral não fatal em um acompanhamento médio de 39,8 meses. 10 Li et al. (2023) Relato de caso Relata-se dois casos de depressão associada à semaglutida. Um é um homem de meia-idade sem histórico prévio de depressão que desenvolveu sintomas depressivos cerca de 1 mês após tomar semaglutida. A outra é uma mulher de meia-idade com transtorno depressivo recorrente cujos sintomas também recorreram cerca de 1 mês após o tratamento com semaglutida. A depressão foi melhorada ou aliviada após a descontinuação da semaglutida em ambos os casos. 11 Hathaway et al., (2024) Estudo retrospectivo Os resultados sugerem um risco potencial de neuropatia óptica isquêmica anterior não arterítica associado às prescrições de semaglutida, sobretudo em pacientes obesos.
Conforme os estudos pesquisados, as farmacoterapias evoluíram ao longo dos anos e são aprovadas para o tratamento de longo prazo da obesidade em combinação com a modificação do estilo de vida, como a semaglutida. Existe evidências crescentes de que, em comparação com a cirurgia revisional, a recorrência de peso após procedimentos bariátricos, pode ser efetivamente tratada com farmacoterapia, com benefícios de perda de peso a longo prazo, menores riscos de eventos adversos e está associada à resolução de comorbidades como hipertensão e dislipidemia (Jamal et al, 2024).
A capacidade da semaglutida de reduzir o peso corporal está relacionada ao aumento da saciedade, à regulação do apetite, ao melhor controle hedônico e homeostático da alimentação e à redução da ingestão de energia, mediada por efeitos diretos e indiretos no sistema nervoso central, particularmente no hipotálamo e no rombencéfalo (Wharton et al., 2022).
Weghuber et al. (2022) ressaltam que a semaglutida foi associada a melhorias com relação aos fatores de risco cardiometabólico, além de apresentar segurança tanto para a população adolescente como para adultos com sobrepeso ou obesidade. Os autores afirmam que o fármaco estudado também é clinicamente relevante, dado que os níveis de IMC, triglicerídeos e colesterol total são fatores de risco para o público infanto-juvenil associados a eventos cardiovasculares subsequentes na idade adulta. Ruseva et al. (2024) reforçam os resultados do estudo dos autores supracitados, visto que utilização semaglutida apresenta uma redução significativa do peso corporal médio, bem como uma melhora significativa em vários biomarcadores cardiometabólicos, incluindo PA, HbA1c, triglicerídeos e colesterol.
Os estudos selecionados demonstraram que a semaglutida reduz os desejos por comida, sugerindo ser um mecanismo de regulação da ingestão de energia (Ruseva et al., 2024; Weghuber et al., 2022). Nesse contexto, Blundell et al. (2017) relatam que a menor ingestão de comida e a perda de peso corporal com semaglutida está relacionada ao efeito geral nos sistemas homeostático e hedônico de controle do apetite, em vez de uma resposta causada por náusea ou aversão alimentar. No geral, a semaglutida é considerado bem tolerada. Portanto, conforme os autores supracitados o fármaco possibilita melhorias no controle da alimentação, menos desejos por comida e uma menor preferência relativa por alimentos gordurosos e densos em energia.
Garvey et al. (2022) afirmam que o medicamento possui um efeito benéfico na saúde geral do paciente. Além disso, ocorre a redução dos níveis de proteína C-reativa, sendo esse um marcador de inflamação sistêmica que é conhecido por ser elevado em pacientes com obesidade. Também ocorre a redução da glicose em jejum, um indicativo de um aumento na sensibilidade à insulina, sendo que esse achado sugere um potencial vantagem da semaglutida no estado glicêmico, mas se o tratamento com medicamento atrasa ou previne a progressão para diabetes tipo 2, isso requer mais estudos para sua confirmação.
Lincoff et al. (2023) citam seu efeito benéfico para pacientes com doença cardiovascular, pois a perda de peso em um espectro de IMCs elevados produz não apenas melhorias nos níveis de glicose e nos fatores de risco cardiovascular intermediários tradicionais, mas também reduções nos depósitos de tecido adiposo ectópico que podem contribuir para a aterosclerose e disfunção miocárdica. O tecido adiposo perivascular e epicárdico impõe efeitos adversos diretos no endotélio vascular e no miocárdio. Além disso, as reduções no excesso de gordura corporal anormal melhoram o meio pró-inflamatório e pró-trombótico sistêmico associado à obesidade.
Estudos (Jamal et al, 2024; Kanai et al, 2024) também demonstram que a semaglutida pode ser eficaz no tratamento da recorrência de peso após cirurgia bariátrica. Os autores afirmam que com a utilização da semaglutida, essa redução no peso corporal é considerada um limiar clinicamente significativo para o sucesso da perda de peso e está associada à melhoria da qualidade de vida e do controle glicêmico, além de ser eficaz no controle de outras comorbidades associadas à obesidade, incluindo hipertensão, apneia obstrutiva do sono, síndrome do ovário policístico e depressão.
Por outro lado, a administração de semaglutida é frequentemente acompanhada por efeitos adversos associados ao sistema gastrointestinal. Eles também são frequentemente o motivo da descontinuação do medicamento. Os mais comuns são: náusea, diarreia, vômito, dor abdominal e constipação, como náusea, constipação e doença do refluxo gastroesofágico. Outros exemplos de problemas gastrointestinais após tomar semaglutida incluem: esvaziamento gástrico prejudicado, gastrite, desconforto orofaríngeo, boca seca, soluços, fezes anormais e muito mais (Wharton et al., 2022).
Estudos mostraram que a idade e o peso corporal de um paciente têm uma conexão com uma maior ocorrência dos eventos mencionados acima. Por outro lado, o sexo do paciente não parece ter impacto nesse assunto. A prevalência de efeitos adversos gastrointestinais é significativamente maior no grupo de meia-idade do que no grupo de idosos (>65 anos). Além disso, desafiando a teoria de que eventos adversos gastrointestinais aumentam o efeito da perda de peso, foi provado que eles não têm uma grande contribuição nessa questão (Wharton et al., 2022).
Kanai et al, (2024) reforça ainda que demonstram que a redução de peso pelo tratamento com semaglutida uma vez por semana foi acompanhada por reduções significativas na albumina sérica , vitamina B12 e zinco, bem como efeito adverso no músculo esquelético, em comparação com as alterações após cirurgia bariátrica. Portanto, sua aplicação pode afetar não apenas a ingestão total de energia, mas também a preferência alimentar e o equilíbrio de nutrientes, como também afetar adversamente as métricas nutricionais medidas e a composição corporal.
Além disso, há pesquisas que conscientizam a sociedade médica sobre o possível perigo de complicações da retinopatia diabética que podem ser potencializadas pelo medicamento, no qual pode ocorre em até 5% dos pacientes (Hathaway et al., 2024). Outro grupo de eventos adversos, menos frequentes, são questões relacionadas à psiquiatria, como a ocorrência de depressão. Associado a sintomas de fadiga, recaída do sono, concentração e tomada de decisão perturbadas apareceram após cerca de um mês de tratamento com semaglutida. Suspeita-se que esse efeito seja causado pela interferência da semaglutida na atividade do neurônio dopaminérgico (Li et al., 2023). De acordo com Billings et al., (2023) em casos raros, pode ocorrer rabdomiólise, que está relacionado à lesão muscular, incluindo dor muscular, fraqueza e urina escura. Cumpre ressaltar que as causas da rabdomiólise variam, e vários medicamentos e substâncias foram observados possíveis risco dessa condição.
4 CONCLUSÃO
De acordo os artigos analisados, a semaglutida é um fármaco muito promissor, sobretudo para pacientes que sofrem de complicações da obesidade, visto que, esse medicamenrto se destaca por seus efeitos pleiotrópicos, dos quais os mais desejados são a diminuição do nível de glicose e perda de peso. Apesar que a semaglutida apresente alguns efeitos colaterais, sendo os mais conhecidos são aqueles do sistema gastrointestinal, como náusea, vômito, constipação.
A limitação desta revisão foi a utilização de apenas dois bancos de dados, então é possível que tenhamos perdido alguns estudos, o que pode reduzir a validade e a confiabilidade subsequente dos resultados. Além disso, observa-se a escassez de estudos voltados para temática no Brasil, portanto, sugere-se a realização de mais pesquisas com esse tema, sobretudo pesquisas retrospectivas de cunho nacional, visando uma ampliação do conhecimento sobre benefícios e efeito adversos desse medicamento em pessoas obesas.
REFERÊNCIAS
APRELINI, Carla Moronari de Oliveira et al. Tendência da prevalência do sobrepeso e obesidade no Espírito Santo: estudo ecológico, 2009-2018. Epidemiologia e Serviços de Saúde, v. 30, p. e2020961, 2021.
ARODA, Vanita R. et al. Comparative efficacy, safety, and cardiovascular outcomes with once-weekly subcutaneous semaglutide in the treatment of type 2 diabetes: insights from the SUSTAIN 1–7 trials. Diabetes & metabolism, v. 45, n. 5, p. 409-418, 2019.
BERGMANN, Natasha Chidekel et al. Semaglutide for the treatment of overweight and obesity: a review. Diabetes, Obesity and Metabolism, v. 25, n. 1, p. 18-35, 2023.
BILLINGS, Sabrina A. et al. Rhabdomyolysis Associated With Semaglutide Therapy: A Case Report. Cureus, v. 15, n. 12, 2023.
BLUNDELL, John et al. Effects of once‐weekly semaglutide on appetite, energy intake, control of eating, food preference and body weight in subjects with obesity. Diabetes, Obesity and Metabolism, v. 19, n. 9, p. 1242-1251, 2017.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (Anvisa). Sibutramina e remédios para emagrecer: entenda. 2022. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/noticias-anvisa/2018/sibutramina-e-remedios-para-emagrecer-entenda Acesso em: 01 fev. 2025.
CASTANHA, Christiane Ramos et al. Avaliação da qualidade de vida, perda de peso e comorbidades de pacientes submetidos à cirurgia bariátrica. Revista do Colégio Brasileiro de Cirurgiões, v. 45, n. 3, 2018.
CHAO, Ariana M. et al. Semaglutide for the treatment of obesity. Trends in cardiovascular medicine, v. 33, n. 3, p. 159-166, 2023.
GARVEY, W. Timothy et al. Two-year effects of semaglutide in adults with overweight or obesity: the STEP 5 trial. Nature medicine, v. 28, n. 10, p. 2083-2091, 2022.
GOMES, Hyorranna Karine Batista Carneiro; TREVISAN, Márcio. O uso do ozempic (semaglutida) como medicamento off label no tratamento da obesidade e como auxiliar na perda de peso. Revista Artigos. Com, v. 29, p. e7498-e7498, 2021.
HATHAWAY, Jimena Tatiana et al. Risk of nonarteritic anterior ischemic optic neuropathy in patients prescribed semaglutide. JAMA ophthalmology, v. 142, n. 8, p. 732-739, 2024.
JAMAL, Mohammad et al. Semaglutide and tirzepatide for the management of weight recurrence after sleeve gastrectomy: a retrospective cohort study. Obesity Surgery, v. 34, n. 4, p. 1324-1332, 2024.
KANAI, Rieko et al. Once-weekly semaglutide administered after laparoscopic sleeve gastrectomy: Effects on body weight, glycemic control, and measured nutritional metrics in Japanese patients having both obesity and type 2 diabetes. Obesity pillars, v. 9, p. 100098, 2024.
LEXCHIN, Joel; MINTZES, Barbara. Semaglutide: a new drug for the treatment of obesity. Drug and therapeutics bulletin, v. 61, n. 12, p. 182-188, 2023.
LI, Jia-Rui et al. Case Report: Semaglutide-associated depression: a report of two cases. Frontiers in Psychiatry, v. 14, p. 1238353, 2023.
LINCOFF, A. Michael et al. Semaglutide and cardiovascular outcomes in obesity without diabetes. New England Journal of Medicine, v. 389, n. 24, p. 2221-2232, 2023.
MARETTY, Lasse et al. Proteomic changes upon treatment with semaglutide in individuals with obesity. Nature medicine, p. 1-11, 2025.
NETA, Marta Batista de Souza et al. Cirurgia bariátrica: fatores emocionais e culturais. Revista Científica Multidisciplinar Núcleo do Conhecimento, v. 3, n. 2, p. 108-116, 2019.
RUSEVA, Aleksandrina et al. Semaglutide 2.4 mg clinical outcomes in patients with obesity or overweight in a real‐world setting: A 6‐month retrospective study in the United States (SCOPE). Obesity Science & Practice, v. 10, n. 1, p. e737, 2024.
WHARTON, Sean et al. Gastrointestinal tolerability of once‐weekly semaglutide 2.4 mg in adults with overweight or obesity, and the relationship between gastrointestinal adverse events and weight loss. Diabetes, Obesity and Metabolism, v. 24, n. 1, p. 94-105, 2022.
WEGHUBER, Daniel et al. Once-weekly semaglutide in adolescents with obesity. New England Journal of Medicine, v. 387, n. 24, p. 2245-2257, 2022.
1 Médico-residente do Programa de Residência da Clínica Médica do Hospital Regional de Taguatinga – SES/DF. Email: wilsouzan@gmail.com
2 Orientadora. Docente do Programa de Residência da Clínica Médica do Hospital Regional de Taguatinga – SES/DF.
