INDUCTION THERAPY IN HIV/AIDS COINFECTED PATIENTS WITH CRYPTOCOCCAL MENINGOENCEPHALITIS: A HISTORICAL PERSPECTIVE
REGISTRO DOI:10.5281/zenodo.10934326
Gislaine Silva-Rodrigues1
Paulo Henrique Guilherme Borges1
Guilherme Ferreira Correia1
Isabela Madeira de Castro1
Barbara Gregio1
Bruna Marcela de Lima1
Joyce Marinho de Souza2
Resumo
A criptococose, uma infecção fúngica oportunista comum em pacientes com HIV/SIDA, representa um desafio significativo no tratamento devido à limitada disponibilidade e acessibilidade dos antifúngicos em países com recursos limitados. A terapia padrão, anfotericina B (AmB) e flucitosina (FLC), tem sido associada a altas taxas de toxicidade e mortalidade, especialmente em ambientes com recursos limitados. Novas formulações, como a AmB lipossomal (AmB-L) e a AMB em nanocristais lipídicos (AmB-LNC), demonstraram eficácia semelhante à AmB convencional, mas com menor toxicidade. Além disso, estudos têm investigado terapias adjuvantes, como a sertralina e nanopartículas de alginato com miltefosina, como possíveis alternativas terapêuticas. Apesar dos avanços na pesquisa, o acesso aos antifúngicos permanece uma questão crítica, com barreiras como a ausência de inclusão de medicamentos essenciais nas listas nacionais de muitos países, escassez de registros, alto custo e falta de interesse dos fabricantes. Promover a competição entre fabricantes para produzir genéricos de FLC pode ajudar a reduzir os custos e aumentar a acessibilidade a esse medicamento essencial. Portanto, embora haja progressos promissores no desenvolvimento de novas opções terapêuticas para a criptococose, a melhoria do acesso aos antifúngicos continua sendo uma prioridade para garantir melhores resultados para os pacientes em todo o mundo.
Palavras-chave: Meningoencefalite criptocócica tratamento de indução, Cryptococcus neoformans, antifúngicos, anfotericina B.
Abstract
The cryptococcosis, an opportunistic fungal infection common in HIV/AIDS patients, represents a significant challenge in treatment due to the limited availability and accessibility of antifungals in resource-limited countries. The standard therapy, amphotericin B (AmB) and flucytosine (FLC), has been associated with high rates of toxicity and mortality, especially in resource-limited settings. New formulations, such as liposomal AmB (AmB-L) and lipid nanocrystal AmB (AmB-LNC), have demonstrated similar efficacy to conventional AmB but with lower toxicity. Additionally, studies have investigated adjunctive therapies such as sertraline and alginate nanoparticle with miltefosine as potential therapeutic alternatives. Despite advances in research, access to antifungals remains a critical issue, with barriers such as the absence of essential drugs inclusion in many countries’ national lists, shortage of registrations, high cost, and lack of manufacturer interest. Promoting competition among manufacturers to produce generic FLC could help reduce costs and increase accessibility to this essential medication. Therefore, while there are promising advances in the development of new therapeutic options for cryptococcosis, improving access to antifungals remains a priority to ensure better outcomes for patients worldwide.
Keywords: Cryptococcal meningoencephalitis, induction therapy, Cryptococcus neoformans, antifungals, amphotericin B.
Introdução
A criptococose humana é uma doença fúngica causada após a inalação de esporos ou leveduras do complexo Cryptococcus neoformans/Cryptococcus gattii, e foi por muitos anos considerada de pouca importância clínica. Após o surgimento do Vírus da Imunodeficiência Humana (HIV) na década de 80, que causa a Síndrome da Imunodeficiência Humana Adquirida (SIDA), a criptococose se tornou importante no campo da medicina, sendo hoje uma das infecções com maior prevalência mundial. Por ser uma micose sistêmica oportunista, os principais pacientes acometidos são os imunodeprimidos, em sua grande maioria portadores do HIV/SIDA (Lahiri et al., 2020; Alves et al., 2022; Nascimento et al., 2020).
A criptococose é a terceira doença oportunista que mais acomete o Sistema Nervoso Central (SNC) em imunodeprimidos, sendo Cryptococcus neoformans var. neoformans o principal agente etiológico dessa infecção. Nestes pacientes, a principal manifestação clínica é a meningoencefalite criptocócica (MC), presente em até 90% dos casos da infecção. Sua taxa de mortalidade nesse grupo varia de 10 a 73% e taxa de letalidade de 22,2 a 76,9% (Nascimento et al., 2020; Alves et al., 2022). No passado, o acompanhamento da supressão imunológica e o tratamento antirretroviral (TARV) corretamente eram os métodos de prevenção para pacientes HIV/SIDA. Porém, mesmo com a cobertura global da TARV, os números de MC nesses pacientes permanecem altos, sugerindo que um diagnóstico precoce e esquema terapêutico bem definido são cruciais para o aumento da sobrevida do paciente (Rajasingham et al., 2017).
O diagnóstico da criptococose pode ser realizado através da junção de diferentes métodos, como os exames de imagem, cultura, exame micológico direto, hemocultura, histopatologia e por meio de exames imunológicos, como ELISA e aglutinação do látex (Queiroz et al., 2008; Almeida, Machado, 2014; Setianingrum, Rautemaa-Richardson, Denning, 2018). O tratamento é dividido em três etapas, iniciando com a 1) fase de indução, onde objetiva reduzir ou negativar a carga fúngica em um período mínimo de duas semanas, seguida da 2) consolidação, cujo objetivo é manter a negativação e alcançar estabilidade dos parâmetros clínicos-laboratoriais, por aproximadamente oito semanas, e por fim, a 3) fase de manutenção, também chamada de supressão, onde depende diretamente do estado imunológico do paciente, compreendendo um período mínimo de um ano (Srichatrapimuk, Sungkanuparph, 2016; Boyer-Chammard et al., 2019).
É possível observar que nas últimas décadas houve evoluções significativas, porém essas permaneceram restritas ao campo do diagnóstico da MC, com a criação de testes altamente sensíveis e específicos, capazes de trazer resultados em até 10 minutos. No entanto, do ponto de vista terapêutico, nenhum novo medicamento foi introduzido no mercado, apesar das diversas pesquisas que vêm sendo realizadas visando redução de toxicidade e aumento da sobrevida dos pacientes HIV/SIDA (Lu et al., 2005; Temfack et al., 2021).
Atualmente há apenas três antifúngicos disponíveis para tratar a MC: a Anfotericina B (AmB) e seus derivados lipossomais (disponível apenas para administração intravenosa), a flucitosina (FLC) disponível na forma oral e Fluconazol (FLZ) disponível para administração oral e intravenosa. O tratamento recomendado atualmente para o tratamento da MC é dose única de Anfotericina B lipossomal (AmB-L) 10 mg/kg, seguidos de quatorze dias de FLC 10 mg/kg/dia dividido em quatro doses por dia, e FLZ 1.200 mg para adultos e 800 mg para crianças e adolescentes, sendo estes capazes de garantir ação fungicida mais rápida e maior chance de sobrevivência do paciente, porém seu estado clínico e a condição imunológica, devem ser levados em consideração durante o tratamento, para garantir sua eficácia (Molloy et al., 2018, WHO, 2022).
Devido a AmB ser um fármaco com propriedades nefrotóxicas e FLC apresentar alto custo para sua produção e distribuição, muitos locais com recursos limitados realizam apenas monoterapia de FLZ no tratamento de indução da MC, o que nem sempre é eficaz. Isto faz com que o aumente a taxa de mortalidade, especialmente para pacientes HIV/SIDA, ressaltando a principal problemática no tratamento da MC. Além disso, o alto custo dos principais medicamentos envolvidos no tratamento, a falta de antifúngicos para potencializar o tratamento de indução da MC e a escassez de fabricantes de genéricos interessados em desenvolver os medicamentos essenciais para o tratamento, potencializam o problema terapêutico da MC. Um novo esquema terapêutico com menor custo e maior distribuição, deve ser proposto para a fase de indução, visto que é o período do tratamento com maior letalidade (Loyse et al., 2013).
Portanto, o presente estudo visa fazer um levantamento bibliográfico dos principais estudos e atualizações no tratamento de indução na MC em indivíduos com HIV/SIDA ao redor do mundo nos últimos 60 anos.
Metodologia
O presente estudo, trata-se de uma revisão integrativa de literatura, com estabelecimento de critérios de inclusão e exclusão dos estudos. As informações selecionadas foram organizadas em formato de tabela no Microsoft Excel. A pergunta norteadora da presente revisão foi: Houve alguma evolução no tratamento de indução da MC nos últimos 60 anos?
A partir da pergunta, foram realizados a busca em bancos de dados de pesquisas científicas consolidados, como PubMed, SciELO, Lilacs e BVS, com os seguintes descritores: “Cryptococcal meningoencephalitis induction” com filtros selecionados “ensaio clínico randomizado”, “língua inglesa”, “língua portuguesa”. Como critérios de inclusão foram considerados ensaios clínicos, disponíveis gratuitamente que respondessem ao objetivo do estudo. Os descritores relacionados ao objetivo e seus sinônimos foram feitas de acordo com Descritores em Ciências da Saúde (DeCS) e palavras correlacionadas com os termos também foram selecionadas. As buscas aconteceram durante os meses de janeiro e março de 2024.
A primeira etapa consistiu na busca de artigos nas bases de dados selecionadas, resultando em 474 artigos e na sequência 287 foram excluídos por duplicidade. Após a leitura do título e resumo dos 187 artigos restantes e destes, 79 artigos foram selecionados para leitura completa e análise da elegibilidade. Após explorar o conteúdo e identificar os principais resultados, foram selecionados 30 manuscritos para compor a presente revisão.
A última etapa, consistiu em um segundo membro validar a etapa anterior, procedendo com uma nova leitura dos artigos participantes e organizando os resultados principais.
Figura 1. Fluxograma da seleção dos artigos, Londrina (PR) 2024
Fonte: Autores (2024)
Resultados
Evolução dos estudos iniciais: surgimento de combinações terapêuticas para fase de indução da MC
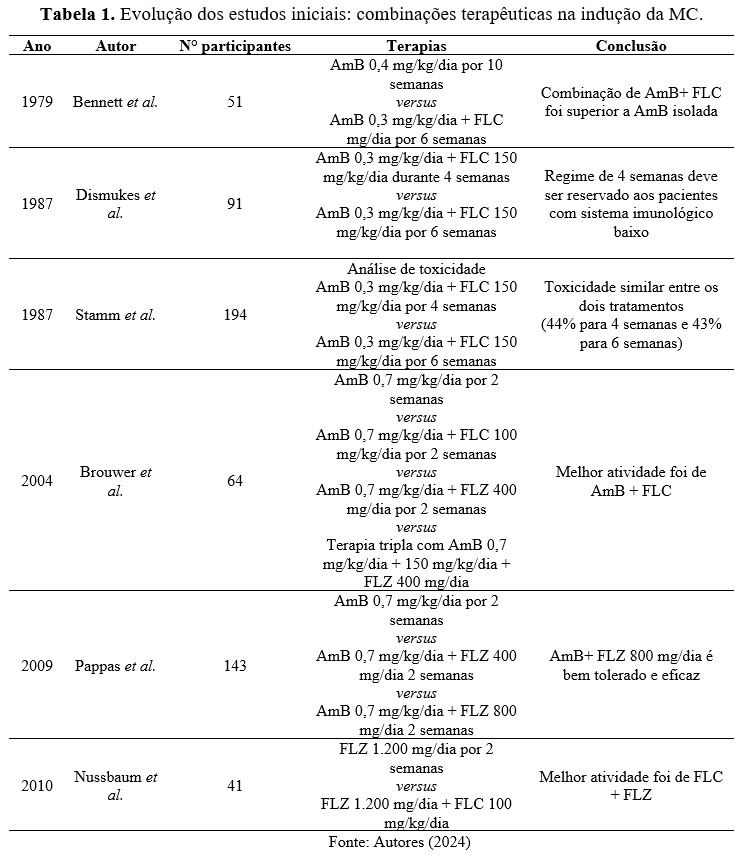
Na década de 1970, a busca por aprimoramento na eficácia do tratamento de MC teve início com Bennett et al. (1979) com a implementação da FLC associada com AmB e observaram que a combinação curou de forma mais eficiente os pacientes. Posteriormente, estudos realizados por Dismukes e colaboradores (1987) e Stamm et al. (1987) investigaram a eficácia e toxicidade da combinação em diferentes regimes.
Com objetivo de criar grupos adicionais para análise do tratamento, Brouwer et al. (2004) analisaram além da combinação recomenda, a eficácia de FLZ associada com AmB, e concluíram que a combinação de AmB + FLC apresentou eliminação do fungo no líquido cefalorraquidiano (LCR) mais rápido. A fim de estudar alternativas viáveis para serem aplicadas em países com recursos limitados, Pappas e colaboradores (2009) conduziram estudos clínicos para avaliar a eficácia de AmB isolada em comparação a AmB com FLZ. Os autores observaram que a administração da combinação foi bem tolerada e eficaz para os pacientes, em comparação com AmB isolada.
Com o mesmo intuito, Nussbaum et al. (2010) conduziram uma investigação comparativa entre terapia combinada de FLC + FLZ e a utilização de FLZ isolado. A combinação testada demonstrou uma taxa de eliminação fúngica mais acelerada em comparação com a monoterapia com FLZ. As doses testadas por todos os pesquisadores, podem ser observadas na tabela 1.
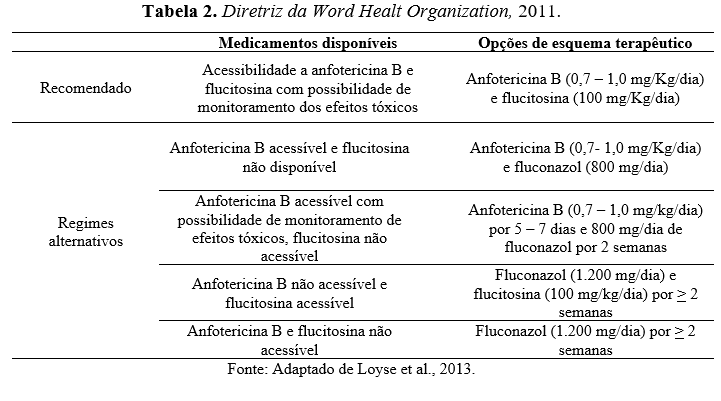
Diante dos resultados apresentados pelos estudos e pela necessidade de melhorias no protocolo terapêutico, especialmente em áreas com recursos limitados, a WHO apresentou em 2011 uma nova diretriz, com a inclusão de um esquema terapêutico extra “Anfotericina B acessível com possibilidade de monitoramento de efeitos tóxicos, flucitosina não acessível”. Os regimes terapêuticos definidos para o tratamento de MC em 2011, estão disponíveis com detalhes na tabela 2.
A efetividade das terapias de indução, evidenciam que a combinação de AmB + FLC durante a fase de indução demonstrou ser eficaz no tratamento de MC especialmente em pacientes HIV/SIDA, os estudos mostraram que a combinação resultou em uma taxa de eliminação mais rápida do fungo no LCR em comparação com a monoterapia com AmB ou FL (Pappas et al. 2010; Nussbaum et al., 2010).

Avanços nos ensaios clínicos: Redução da toxicidade e aumento da sobrevida no tratamento de indução da MC
Além da questão central relacionada à busca por associações terapêuticas eficazes no tratamento de indução da MC, diversos autores ressaltam os desafios enfrentados em relação à acessibilidade aos principais medicamentos utilizados para esse propósito. Em países com recursos limitados, como muitas regiões da África e Ásia, onde o FLC não está disponível e a administração de AmB é complicada devido à necessidade de hospitalização e monitoramento laboratorial dos seus efeitos adversos, a terapia mais comum para tratar pacientes com MC é a monoterapia com FLZ (Ibe et al., 2023). No entanto, esse regime terapêutico apresenta altas taxas de mortalidade durante o tratamento. As principais questões associadas aos medicamentos disponíveis atualmente incluem o custo elevado, a toxicidade e a distribuição limitada da AmB, o alto custo e a escassez de registro do FLC e, por fim, o FLZ, que, embora seja o mais acessível dentre os mencionados, enfrenta sérios desafios em termos de manutenção de estoque nos locais onde é utilizado (Loyse et al., 2013).
Estudos posteriores, observaram que doses elevadas de AmB (1 mg/kg/dia) em combinação com FLC, apresentou resultados promissores em termos de sobrevida dos pacientes HIV/SIDA com MC, porém apesar dos diversos regimes avaliados a alta toxicidade da AmB impactou diretamente no desfecho dos pacientes.
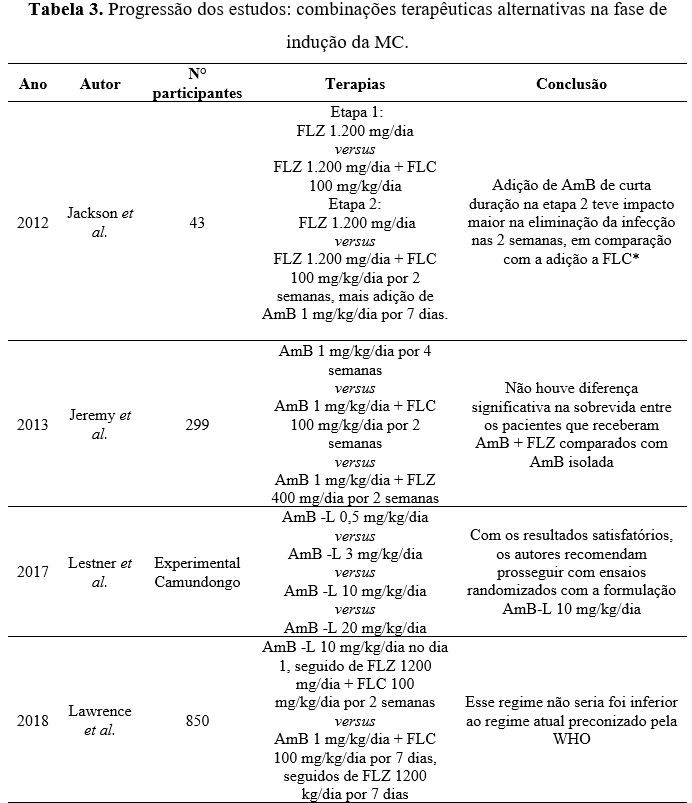

Diante da necessidade de desenvolver alternativas para reduzir a toxicidade da AmB convencional, diminuir os custos e efeitos adversos, a formulação de AmB-L foi introduzida no mercado.
Isso ocorreu após estudos clínicos observarem que a administração rápida de AmB-L não apresentava toxicidade em modelos experimentais e que a combinação com FLC resultava em uma redução mais rápida da carga fúngica. Além disso, foi observado que a AMB-L possui uma meia-vida prolongada e penetra efetivamente no tecido cerebral (Lestner et al., 2017).
Lawrence et al. (2018) conduziram um ensaio clínico de fase III para comparar a terapia preconizada pela WHO 2018 versus dose única de 10 mg/kg de AmB-L, administrada em conjunto com 14 dias de FLZ 1.200 mg/dia e FLC 100 mg/kg/dia. Os autores demonstraram que o regime com AmB-L não é inferior ao tratamento com AMB. Os regimes avaliados neste período até a implementação da WHO 2018, podem ser analisados na tabela 3.
Com base nos resultados obtidos nos ensaios clínicos realizados, em 2018 a WHO atualizou as diretrizes de tratamentos para pacientes com HIV/SIDA com MC. Os esquemas terapêuticos podem ser visualizados na tabela 4.

Atualizações para maximizar a sobrevida e reduzir a toxicidade no tratamento de indução da MC: atualizações nas diretrizes atuais
Uma revisão sistemática e meta-análise realizada por Tenforde et al. (2018), abrangeu 13 estudos e 2.426 pacientes para investigar as opções terapêuticas de indução da MC. Os autores compararam 21 intervenções diferentes utilizadas nesse contexto. Concluíram que, em ambientes com recursos limitados, a terapia combinada de AmB e FLC por uma semana é provavelmente mais eficaz do que outros regimes para o tratamento inicial da MC em pacientes com HIV/SIDA. Além disso, observaram que um regime de tratamento com FLZ em doses elevadas por duas semanas pode ser uma boa alternativa em locais onde a AmB não está disponível ou sua administração não é segura. É importante destacar que a maioria dos estudos analisados foi conduzida em ambientes com recursos limitados, o que limita a aplicabilidade dos resultados em ambientes com melhor disponibilidade de recursos para o manejo clínico de pacientes com HIV/SIDA e criptococose.
Atualmente, no Brasil, o protocolo terapêutico para o tratamento da criptococose inclui a administração de AmB (0,7-1 mg/kg – máximo de 50 mg/dia) ou AmB-L considerando a função renal do paciente, em combinação com FLZ (800 mg/dia por pelo menos 14 dias). Na fase de consolidação, é recomendada a administração de FLZ (200-400 mg) ao longo de 8 semanas. Por fim, na fase de manutenção, o tratamento envolve a administração de FLZ (200-400 mg) ao longo de 1 ano. Estes esquemas terapêuticos estão resumidos na Tabela 5 (Santos et al., 2019).

Após análises e recomendação favorável da Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde, a FLC foi incorporado ao SUS em 2021 para tratamento de MC. Após o processo de aquisição, o medicamento foi disponibilizado aos estados e municípios no segundo semestre de 2023. Infelizmente não é possível saber se a implementação foi finalizada em todo território nacional ou se houve redução da mortalidade em território nacional, devido à ausência da integração da doença na lista nacional de doenças de notificação compulsória no Brasil (Ministério da saúde 2023).
Na busca de melhorias no tratamento, Jarvis et al. (2019) conduziram um ensaio clínico de fase II, onde a AmB-L em alta dose (10 mg/kg) e de curta duração apresentou resultados positivos para o tratamento da criptococose.
Anos depois, Jarvis et al. (2022) conduziram um estudo comparando dois tratamentos: dose única de AmB-L de 10 mg/kg, FLC e FLZ, versus tratamento padrão recomendado pela WHO. A análise mostrou que a mortalidade em 10 semanas foi semelhante entre os grupos, com menos eventos adversos no grupo que recebeu AmB-L. Assim, concluiu-se que a monoterapia de AmB-L ou a combinação de AmB-L com FLC ou FLZ não foi inferior ao tratamento padrão e foi associada a menos efeitos adversos.
Recentemente, Lalloo e colaboradores (2023) conduziram um estudo clínico com 160 pacientes, demonstrando que doses de FLZ baseadas no peso entre 1.600 mg/dia ou 2.000 mg/dia são seguras, bem toleradas e eficazes na fase inicial da MC. Devido à ausência de diferença estatística entre as duas doses testadas, os autores recomendam uma dose de 1.600 mg/dia de FLZ quando a AmB não está disponível. Os regimes avaliados pelos autores, estão descritos na tabela 6.
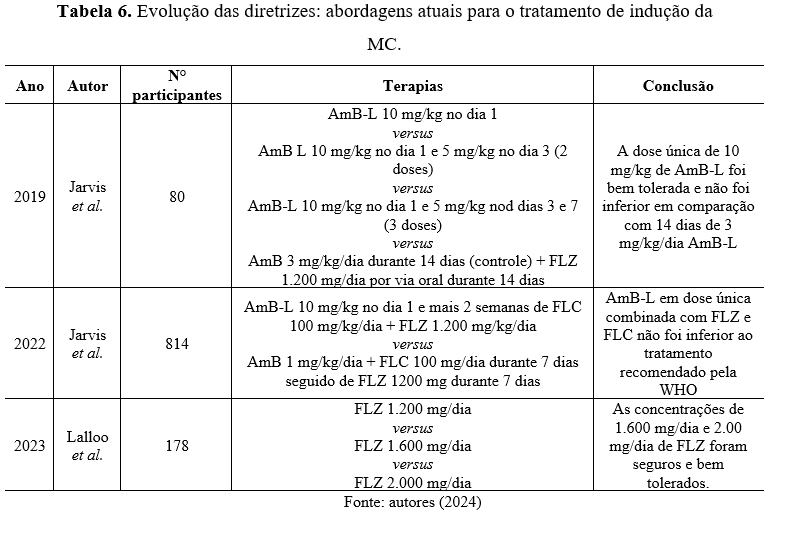
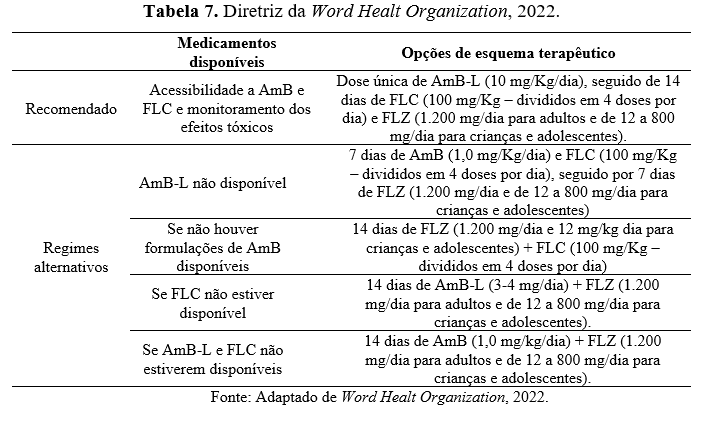
Devido aos resultados satisfatórios obtidos nos estudos demonstrados anteriormente, em 2022 a WHO atualizou as diretrizes terapêuticas para indução da MC em pacientes com HIV/SIDA. Os dados atualizados podem ser observados na tabela 7.
Desenvolvimento de novos adjuvantes terapêuticos e formulações alternativas para estratégias terapêuticas para o tratamento de indução da MC
Em busca de alternativas aos medicamentos convencionais, vários estudos foram conduzidos visando o reposicionamento ou novas formulações para auxiliar no tratamento da MC. Rhein et al. (2016) investigaram a eficácia da sertralina como adjuvante no tratamento da MC associada ao HIV. O estudo envolveu 172 pacientes distribuídos para análise do tratamento de AmB + sertralina (SER). Os autores observaram que a adição de SER à terapia combinada com AmB para MC pode melhorar a eliminação fúngica do LCR.
Estudos clínicos randomizados de fase 3 demonstraram que a SER não proporcionou melhorias na sobrevida ou nos resultados microbiológicos como terapia adjuvante (Rhein et al., 2019). Boulware et al. (2020) investigaram a SER como adjuvante para antigemia criptocócica assintomática. Os autores administraram uma dose maior do que a dose utilizada no tratamento da depressão devido às interações medicamentosas com os antirretrovirais, porém o ensaio foi interrompido antes do prazo final devido à alta incidência de efeitos adversos neuropsiquiátricos no grupo da SER. Devido ao tamanho reduzido da amostra (21 participantes), os autores não puderam avaliar adequadamente a possível eficácia da sertralina no tratamento.
Spadari et al. (2019) investigou o uso de nanopartículas de alginato com miltefosina (MFS-ALG) para tratar infecções fúngicas como criptococose, visando reduzir a toxicidade do fármaco. A atividade antifúngica foi avaliada em modelos in vitro e in vivo usando larvas de Galleria mellonella. Os resultados mostraram que as nanopartículas MFS-ALG foram eficazes, não apresentando efeitos tóxicos significativos e reduzindo a carga fúngica, sugerindo seu potencial como uma opção terapêutica promissora para infecções fúngicas.
Ngan e colaboradores (2021) conduziram um ensaio clínico aberto utilizando tamoxifeno (300 mg/dia) em combinação com AmB (1 mg/kg/dia) e FLZ (800 mg/dia) para o tratamento da MC. Setenta pacientes foram divididos em grupo de intervenção e grupo controle. No entanto, ao término do estudo, os autores concluíram que a adição do medicamento não teve impacto significativo no agente, não justificando a realização de ensaios clínicos em larga escala. Uma das possíveis razões apontadas pelos autores foi a dose utilizada do medicamento.
Na busca por reduzir a nefrotoxicidade e oferecer novas opções terapêuticas como alternativa à AmB administrada via intravenosa, a Matinas Biopharma® desenvolveu uma nova formulação oral de AmB utilizando nanocristais lipídicos (LNC). O LNC é composto por três componentes: AmB, cálcio e fosfatidilserina, um fosfolipídio natural derivado da soja. Ao ser administrado, o LNC é transportado por células como macrófagos até o local da infecção (Boulware et al., 2023), Estudos prévios conduzidos por Lu et al. (2019) demonstraram que a AmB-LNC apresentou eficácia equivalente ao tratamento padrão ouro (AmB + FLC) em um modelo de criptococose murina.
Posteriormente, Skipper e colaboradores (2020) realizaram um estudo de fase I que evidenciou a boa tolerabilidade e segurança da AmB -LNC, sendo os efeitos adversos mais comuns náuseas (dose-dependente) e dor abdominal leve. Em um estudo conduzido por Boulware et al. (2023), 205 participantes foram randomizados em quatro grupos diferentes para avaliar a atividade antifúngica da AmB-LNC oral na criptococose associada ao HIV. Os detalhes dos grupos de tratamento podem ser observados na Tabela 8.

Os pesquisadores constataram que a atividade antifúngica no LCR da combinação de AmB-LNC + FLC foi comparável aos resultados obtidos com a dose padrão de AmB + FLC. Além disso, observaram que a administração de duas doses de ataque de AmB intravenosa, seguidas de AmB-LNC oral resultou em uma taxa de sobrevida de 90% em 18 semanas, com apenas uma morte nos primeiros 30 dias. Os dados dos estudos sugerem que a AmB-LNC apresentou eficácia semelhante à AmB convencional, porém com menor incidência de toxicidade (Boulware et al., 2023).
Apesar dos esforços empreendidos em diversas pesquisas e ensaios clínicos para aprimorar a terapia de indução da MC em pacientes com HIV/SIDA, o acesso a um dos antifúngicos mais eficazes para o tratamento da doença em países com recursos limitados ainda é uma questão premente que requer correção urgente. Essa necessidade é ainda mais crucial considerando o aumento contínuo nos casos de HIV/SIDA e criptococose a cada ano. É imprescindível que novas pesquisas sejam conduzidas para o desenvolvimento de antifúngicos específicos para a criptococose, uma vez que os estudos atuais e anteriores se baseiam em fármacos existentes e esquemas terapêuticos alternativos utilizando os mesmos, o que pode ser problemático em países com recursos limitados. Além disso, é essencial promover a competição entre fabricantes por meio da produção de genéricos do FLC, o que poderia reduzir seu custo e torná-la mais acessível (Loyse et al., 2013; Loyse et al., 2018).
Considerações finais/ Conclusões
Com base na presente revisão, houve uma evolução no tratamento de indução da MC nos últimos 60 anos. Inicialmente, a terapia era limitada à administração de AmB, que apresentava eficácia, mas também considerável toxicidade. Ao longo do tempo, novos antifúngicos foram sendo inseridos como estratégias terapêuticas, e as combinações foram exploradas para aumentar a eficácia e reduzir os efeitos adversos. A introdução de FLC e AmB-L representou avanços significativos, proporcionando opções terapêuticas mais seguras e eficazes. Além disso, estudos recentes investigaram adjuvantes potenciais e terapias alternativas para complementar ou substituir os tratamentos convencionais. Esses avanços destacam uma mudança substancial no paradigma de tratamento de indução da MC ao longo das últimas décadas, refletindo uma busca contínua por melhores estratégias terapêuticas para melhorar os resultados clínicos e reduzir a morbidade e mortalidade associadas a essa condição. No entanto, são necessários mais estudos e esforços para superar os desafios de acesso e garantir que as terapias mais eficazes estejam disponíveis para todos que delas necessitam.
REFERÊNCIAS
ALMEIDA, R. L. G.; MACHADO, E. R. Cryptococcus spp. em Pacientes com HIV/SIDA: Revisão da Literatura. Brasilia: Ensaios Cienc., Cienc. Biol. Agrar. Saúde, 2014.
ALVES, M. J. et al. Cryptococcosis in HIV/AIDS patients in northern Brazil: Clinical aspects, molecular types and isolation of agents from environmental samples associated with patients. Tropical Medicine & International Health, v. 27, n. 4, p. 387-396, 2022.
BENNETT, J. E. et al. A comparison of amphotericin B alone and combined with flucytosine in the treatment of cryptoccal meningitis. New England Journal of Medicine, v. 301, n. 3, p. 126-131, 1979.
BOULWARE, D. R. et al. Adjunctive sertraline for asymptomatic cryptococcal antigenemia: A randomized clinical trial. Medical mycology, v. 58, n. 8, p. 1037-1043, 2020.
BOULWARE, D. R. et al. Oral lipid nanocrystal amphotericin B for cryptococcal meningitis: a randomized clinical trial. Clinical Infectious Diseases, v. 77, n. 12, p. 1659-1667, 2023.
BOYER-CHAMMARD, T. et al. Recent advances in managing HIV-associated cryptococcal meningitis. F1000Research, v. 8, 2019.
BROUWER, A. E. et al. Combination antifungal therapies for HIV-associated cryptococcal meningitis: a randomised trial. The Lancet, v. 363, n. 9423, p. 1764-1767, 2004.
DISMUKES, W. E. et al. Treatment of cryptococcal meningitis with combination amphotericin B and flucytosine for four as compared with six weeks. New England Journal of Medicine, v. 317, n. 6, p. 334-341, 1987.
GARCIA, M. M. et al. Funding and Service Organization to Achieve Universal Health Coverage for Medicines: An Economic Evaluation of the Best Investment and Service Organization for the Brazilian Scenario. Frontiers in pharmacology, v. 11, p. 498775, 2020.
IBE, C. et al. Cryptococcosis in Africa: What the data tell us. Medical Mycology, v. 61, n. 6, p. myad049, 2023.
JACKSON, A. T. et al. A phase II randomized controlled trial adding oral flucytosine to high-dose fluconazole, with short-course amphotericin B, for cryptococcal meningitis. Aids, v. 26, n. 11, p. 1363-1370, 2012.
JARVIS, J. N. Short-course High-dose Liposomal Amphotericin B for Human Immunodeficiency Virus–associated Cryptococcal Meningitis: A Phase 2 Randomized Controlled Trial. Londres: Clinical Infectious Diseases, 2019.
JARVIS, J. N. et al. Single-dose liposomal amphotericin B treatment for cryptococcal meningitis. New England Journal of Medicine, v. 386, n. 12, p. 1109-1120, 2022.
JEREMY, N. et al. Combination Antifungal Therapy for Cryptococcal Meningitis. Massachusetts: The New England Journal of Medicine, 2013
KANYAMA, C. et al. One-year Mortality Outcomes From the Advancing Cryptococcal Meningitis Treatment for Africa Trial of Cryptococcal Meningitis Treatment in Malawi. Londres: Clinical Infectious Diseases, 2020.
LAHIRI, S. et al. Clinical insights and epidemiology of central nervous system infection due to Cryptococcus neoformans/gattii species complexes: A prospective study from South India. Medical mycology, v. 58, n. 5, p. 600-608, 2020.
LALLOO, U. G. et al. Higher Dose Oral Fluconazole for the Treatment of AIDS-related Cryptococcal Meningitis (HIFLAC)—report of A5225, a multicentre, phase I/II, two-stage, dose-finding, safety, tolerability and efficacy randomised, amphotericin B-controlled trial of the AIDS Clinical Trials Group. PloS one, v. 18, n. 2, p. e0281580, 2023.
LARSON, B. et al. Induction-phase treatment costs for cryptococcal meningitis in high HIV-burden African countries: New opportunities with lower costs. Wellcome Open Research, v. 6, 2021.
LAWRENCE, D. S. et al. AMBIsome Therapy Induction OptimisatioN (AMBITION): high dose ambisome for cryptococcal meningitis induction therapy in sub-Saharan Africa: study protocol for a phase 3 randomised controlled non-inferiority trial. Trials, v. 19, p. 1-13, 2018.
LESTNER, J. et al. Experimental Models of Short Courses of Liposomal Amphotericin B for Induction Therapy for Cryptococcal Meningitis. Washington, DC: American Society for Microbiology, 2017.
LOYSE, A. et al. Cryptococcal meningitis: improving access to essential antifungal medicines in resource-poor countries. Reino Unido: The Lancet, 2013.
LOYSE, A. et al. Leave no one behind: response to new evidence and guidelines for the management of cryptococcal meningitis in low-income and middle-income countries. Reino Unido: The Lancet, 2018.
LU, H. et al. Cryptococcal antigen test revisited: significance for cryptococcal meningitis therapy monitoring in a tertiary Chinese hospital. Journal of clinical microbiology, v. 43, n. 6, p. 2989-2990, 2005.
LU, R. et al. Efficacy of oral encochleated amphotericin B in a mouse model of cryptococcal meningoencephalitis. MBio, v. 10, n. 3, p. 10.1128/mbio. 00724-19, 2019.
MINISTÉRIO DA SAÚDE. Ministério da Saúde disponibilizará antifúngicos para tratar micoses endêmicas em pessoas vivendo com HIV/AIDS. 2023
MOLLOY, S. F. et al. Antifungal Combinations for Treatment of Cryptococcal Meningitis in Africa. Massachusetts: The New England Journal of Medicine, 2018.
MUZOORA, C. K. et al. Short course amphotericin B with high dose fluconazole for HIV-associated cryptococcal meningitis. Reino Unido: Journal of Infection, 2011.
NASCIMENTO, M. A. et al. Perfil de pacientes com criptococose em hospital regional do interior de São Paulo. Vargem Grande Paulista: Research, Society and Development, 2020.
NGAN, N. T. T. et al. An open label randomized controlled trial of tamoxifen combined with amphotericin B and fluconazole for cryptococcal meningitis. Elife, v. 10, p. e68929, 2021.
NUSSBAUM, J. C. Combination flucytosine and high dose fluconazole is superior to fluconazole monotherapy for cryptococcal meningitis: a randomized trial in Malawi. San Francisco: Clin Infect Dis, 2010.
O’CONNOR, L. et al. Antifungal susceptibility does not correlate with fungal clearance or survival in AIDS-associated cryptococcal meningitis. Clinical Infectious Diseases, v. 73, n. 7, p. e2338-e2341, 2021.
PAPPAS, P. G. et al. A phase II randomized trial of amphotericin B alone or combined with fluconazole in the treatment of HIV-associated cryptococcal meningitis. Clinical infectious diseases, v. 48, n. 12, p. 1775-1783, 2009.
PEREIRA, A. S. et al. Metodologia da pesquisa científica. 2018.
PETT, S. L. et al. Benefits of enhanced infection prophylaxis at antiretroviral therapy initiation by cryptococcal antigen status. AIDS, v. 35, n. 4, p. 585-594, 2021.
QUEIROZ, J. P. A. F. et al. Criptococose – Uma revisão bibliográfica. Brasília: Acta Veterinaria Brasilica, 2008.
RAJASINGHAM, R. et al. Global burden of disease of HIV-associated cryptococcal meningitis: an updated analysis. The Lancet infectious diseases, v. 17, n. 8, p. 873-881, 2017.
RHEIN, J. et al. Adjunctive sertraline for HIV-associated cryptococcal meningitis: a randomised, placebo-controlled, double-blind phase 3 trial. The Lancet infectious diseases, v. 19, n. 8, p. 843-851, 2019.
RHEIN, J. et al. Efficacy of adjunctive sertraline for the treatment of HIV-associated cryptococcal meningitis: an open-label dose-ranging study. The Lancet infectious diseases, v. 16, n. 7, p. 809-818, 2016.
SANTOS, D. A. S. et al. Diretrizes Clínicas Protocolos Clínicos. Minas Gerais: Fundação Hospitalar do Estado de Minas Gerais, 2019.
SETIANINGRUM, F.; RAUTEMAA-RICHARDSON, R.; DENNING, D. W. Pulmonary cryptococcosis: a review of pathobiology and clinical aspects. Medical mycology, v. 57, n. 2, p. 133-150, 2019.
SHIRI, T. et al. Addition of flucytosine to fluconazole for the treatment of cryptococcal meningitis in Africa: a multicountry cost-effectiveness analysis. Clinical infectious diseases, v. 70, n. 1, p. 26-29, 2020.
SKIPPER, C. P. et al. Phase I EnACT trial of the safety and tolerability of a novel oral formulation of amphotericin B. Antimicrobial agents and chemotherapy, v. 64, n. 10, p. 10.1128/aac. 00838-20, 2020.
SPADARI, C. de C. et al. Alginate nanoparticles as non-toxic delivery system for miltefosine in the treatment of candidiasis and cryptococcosis. International journal of nanomedicine, p. 5187-5199, 2019.
SRICHATRAPIMUK, S.; SUNGKANUPARPH, S. Integrated therapy for HIV and cryptococcosis. AIDS research and therapy, v. 13, p. 1-15, 2016.
STAMM, A M. et al. Toxicity of amphotericin B plus flucytosine in 194 patients with cryptococcal meningitis. The American journal of medicine, v. 83, n. 2, p. 236-242, 1987.
TEMFACK, E. et al. Cryptococcal antigen in serum and cerebrospinal fluid for detecting cryptococcal meningitis in adults living with human immunodeficiency virus: systematic review and meta-analysis of diagnostic test accuracy studies. Clinical Infectious Diseases, v. 72, n. 7, p. 1268-1278, 2021.
TENFORD, M. W. et al. treatment for HIV- associated cryptococcal meningitis. Londres: Cochrane Library, 2018.
WORD HEALTH ORGANIZATION. Rapid Advice Diagnosis, Prevention and Management of Cryptococc al Disease in HIV -infected Ad ults, Adolescents and Children. 2011.
WORD HEALTH ORGANIZATION. The Diagnosis, Prevention And Management Of Cryptococcal Disease In Hiv-Infected Adults, Adolescents And Children. 2018.
WORD HEALTH ORGANIZATION. Diagnosis, Prevention And Managing cryptococcal didease among adults, adolescentes and children living with HIV. 2022
1 gislaine.srodrigues@uel.br; https://orcid.org/0000-0002-4372-088X
1 paulo.guilhermeph@uel.br; https://orcid.org/0000-0002-5412-053X
1 guilhermeferreiracorreia@gmail.com; https://orcid.org/0000-0002-6127-1475
1 isabela.mcastro@uel.br; https://orcid.org/0009-0008-2933-5783
1 barbara.gregio@uel.br; https://orcid.org/0009-0002-7747-184X
1 bmberga@gmail.com; https://orcid.org/0009-0003-7722-220X
2 joycesouza@unoeste.br; https://orcid.org/0000-0003-4405-2534
1Depertamento de Microbiologia, Universidade Estadual de Londrina, Londrina, PR, Brasil.
2Faculdade de Ciências da Saúde, Biomedicina, Universidade do Oeste Paulista, Presidente Prudente, SP, Brasil.
