REGISTRO DOI: 10.69849/revistaft/ra10202503112332
Carla Karine Figueiredo Lopes1; Orientador: Prof. Dr. Hudson de Sousa Buck; Co autores: Caroline Jordana Azevedo dos Santos2; Raimundo Nonato Cardoso Miranda Júnior3; Hálmisson D’árley Santos Siqueira4; Cirley Pinheiro Ferreira5; Rodolfo Ritchelle Lima dos Santos6; Emigdio Nogueira7; Kelly Pereira Rodrigues dos Santos8; Natércia Ohana Araujo Silva9; Márcia Sousa Santos10.
RESUMO
Figueiredo CK. Toxoplasmose e gravidez: prevalência da infecção e de sua transmissão vertical em gestantes no município de São Luis-MA. Dissertação de Mestrado. Curso de Pós-graduação em Ciências da Saúde, área de concentração em Ciências da Saúde. Faculdade de Ciências Médicas da Santa Casa de São Paulo. São Paulo, 2018.
Objetivo. Avaliar a prevalência da toxoplasmose em gestantes no município de São Luis, capital do Estado do Maranhão, e verificar a prevalência de transmissão vertical no grupo de grávidas acometidas por primo-infecção de toxoplasmose. Métodos. A casuística que utilizamos para o estudo da prevalência da toxoplasmose e de sua transmissão vertical consistiu em 79 gestantes atendidas no serviço de pré-natal do Hospital e Maternidade Marly Sarney da cidade de São Luís, capital do Estado do Maranhão. Tais gestantes foram detectadas por meio de rastreamento de 14.698 grávidas atendidas no pré-natal dessa maternidade durante o ano de 2016. Por meio de entrevista das 79 gestantes, procurou-se verificar eventual presença das condições de risco de contágio por T. gondii. Para a verificação de infecção adquirida na gravidez utilizou-se o teste laboratorial da avidez da imunoglobulina IgG, assim como para o rastreamento da toxoplasmose congênita. Resultados. Por meio do rastreamento das 14.698 grávidas constatamos que em 79 o teste de avidez da imunoglobulinas IgG mostrou-se positivo. Dessa forma, em nosso estudo o índice de soroprevalência foi de 0,54% Por meio de avaliação sorológica dos recém-nascidos das 79 gestantes acometidas pela toxoplasmose verificamos que 12 dos mesmos se apresentavam com infecção congênita. Sendo 7,5 casos para cada 10.000 NVno ano de 2016. Um dos recém-nascidos apresentou-se com microcefalia e três com hidrocefalia. Conclusão. O índice de frequência para toxoplasmose congênita com acometimento fetal foi significativamente elevado em pacientes com toxoplasmose na gestação.
Palavras chave: Toxoplasmose e gravidez. Infecção Congênita. Prevalência.
ABSTRACT
The objective of this work was to evaluate the prevalence of toxoplasmosis in pregnant women at São Luis city, MA, Brazil, and to verify the prevalence of vertical transmission in the group of pregnant women affected by a first infection of toxoplasmosis. The casuistry of this study consisted of 79 pregnant women attended at the prenatal service of the Hospital and Maternity Marly Sarney at São Luís city, MA, Brazil. These pregnant women were detected by the screening of 14,698 pregnant women attending the maternity clinic during the year of 2016. Through interviews of 79 pregnant women, we sought to verify the possible presence of T. gondii risk of contagion. In order to verify the infection acquired during pregnancy, the laboratory test of the avidity of immunoglobulin IgG was used, as well as for the detection of congenital toxoplasmosis. By screening the 14,698 pregnant women we found that in 79 the IgG immunoglobulins avidity test was positive. Thus, in our study, the seroprevalence index was 0.5%. Through the serological evaluation of the newborns of the 79 pregnant women affected by toxoplasmosis, we verified that 12 of them presented with congenital infection, being 7.5 cases per 10,000 NV in the year 2016. One of the newborns presented with microcephaly and three with hydrocephaly. In conclusion, the frequency index for congenital toxoplasmosis with fetal involvement was significantly elevated in patients with toxoplasmosis during pregnancy.
Key words: Toxoplasmosis and pregnancy. Congenital infection. Prevalence.
1. INTRODUÇÃO
O Toxoplasma gondii (T. gondii) foi primeiramente descrito em 1908, no norte da África por Nicolle e Manceauxnos tecidos de um roedor, o Ctenodoactylusgundi, enquanto pesquisavam Leishmaniose no instituto Pasteur. A denominação foi baseada em sua morfologia (Toxon: arco, plasma: forma) e seu hospedeiro (gundi). No mesmo ano, no Brasil, mais precisamente em São Paulo, o T. gondii foi identificado nos tecidos de um coelho, por Splendore (1-4). Essa é uma infecção ubíqua, que ocorre em todo o mundo e atualmente, estima-se, que infecta um terço da população humana mundial (2,5).
A infecção por T. gongii é mais prevalente em climas quentes e úmidos. A prevalência aumenta com a idade e não difere significativamente entre homens e mulheres (6). A classe sócio econômica está relacionada com a toxoplasmose, como exemplo, em uma cidade localizada no norte do estado do Rio de Janeiro, a soroprevalência ajustada por idade foi de 84% para o grupo de nível socioeconômico mais baixo, comparada às soroprevalências de 62% e 23% para os grupos nível socioeconômico médio e superior, respectivamente (7).
Um declínio significativo na soroprevalência foi observado na Europa, por exemplo, na Holanda, onde caiu de 35,2% em 1996 para 18,5% em 2006. Na França, a proporção de gestantes soropositivas diminuiu de 80% na década de 1960 para 44% em 2003 e 37% em 2010, a taxa de prevalência de toxoplasmose congênita no nascimento, em 2007 foi estimada em 2,9 a cada 10.000 nascidos vivos. Nos Estados Unidos, a soroprevalência da toxoplasmose entre mulheres em idade fértil (15-44 anos) também diminuiu de 14,9% nos anos de 1988-1994 para 9,1% em uma pesquisa de 2009-2010, atualmente, estima-se em 0,5 casos a cada 10.000 nascidos vivos. Atribui-se essa queda nos países ocidentais a produção industrializada de carne mantendo o rebanho isolado, utilizando alimentos esterilizados e mantendo os estábulos livres de roedores e gatos. O oposto ocorre nas regiões com forte crescimento populacional e tendências de urbanização, isto é, grande parte da Ásia. O risco de infecção por alimentos parece muito maior, por exemplo, na China, onde uma média de 31% de soroprevalência de T. gondii foi encontrada em suínos para abate. Também foi observado na Rússia e Indonésia um risco significativamente maior de adquirir uma infecção por T. gondii (8,9).
Antigamente acreditava-se que os parasitas apresentavam três genótipos com pouca diferença entre cada um, e que era dividido em três linhagens distintas, tipo I, II e III, porém, com técnicas mais recentes de genética, se diferenciou uma grande diversidade de genótipos. Do norte ao sul da Europa, a estrutura populacional do T. gondii tem predomínio de cepas pertencentes à linhagem do tipo II, porém também se encontra a linhagem do tipo III no sul da Europa. Na América do Norte, encontra-se predominância de cepas do tipo II, porém há dados recentes que sugerem maior prevalência de cepas atípicas na América do Norte tanto em animais silvestres quanto domésticos. A América do Sul é uma área com um alto nível de diversidade para T. gondii. Embora linhagens clonais adicionais, conhecidas como os haplogrupos BR I a IV, possam ser comuns e endêmicas no Brasil, as trocas genéticas frequentes geraram uma ampla variedade de genótipos diferentes, novos genótipos estão continuamente sendo identificados em diferentes espécies animais, indicando um nível extremamente elevado de diversidade de T. gondii no país. Porém, das três cepas mais conhecidas o tipo II parece ser muito raro na América do Sul. Na África, também há uma variação das linhagens clonais conhecidas como haplogrupos África 1 a 3, coexistem com linhagens tipo II e III. Na China há uma variedade menor, com uma linhagem clonal generalizada no país (7,10).
Os gatos ou outros felinos são os hospedeiros definitivos onde o parasita intracelular obrigatório se replica sexualmente em seus intestinos. Os oocistos são excretados nas fezes e após a esporulação no ambiente, os esporozoítos tornam-se infecciosos. Os humanos e muitos outros vertebrados homeotérmicos, por exemplo, roedores e aves, servem como hospedeiros intermediários para o parasita que nesse contexto sofrem reprodução sexuada. A infecção do hospedeiro intermediário pode ocorrer pela ingestão oral de oocistos eliminados por felinos ou por cistos teciduais que persistem nos músculos e no sistema nervoso de outros hospedeiros intermediários. Nos gatos o parasita além de realizar a reprodução sexuada pode realizar a reprodução assexuada, por isso encontramos também a denominação de hospedeiro integral atribuída aos felinos (4,11,12).
No hospedeiro humano, após a ingestão os parasitas invadem as células epiteliais intestinais para se transformarem em taquizoítos de replicação rápida. Esses taquizoítos se multiplicam intracelularmente em um vacúolo parasitóforo, que separa o parasita do citoplasma da célula hospedeira. A replicação irrestrita do parasita resulta, finalmente, na ruptura da célula hospedeira, na liberação de taquizoítos e na infecção de células vizinhas. A forma de taquizoítos causa destruição tecidual e, portanto, é responsável pelas manifestações clínicas da doença. Devido à resposta imune resultante e à produção de moléculas efetoras intracelulares antiparasitárias pelas células infectadas, os taquizoítos podem ser eliminados ou transformados em bradizoítos, de replicação lenta, que formam cistos intracelulares que persistem durante toda a vida do hospedeiro. Esses cistos podem conter centenas de parasitas e terem afinidade preferencialmente por neurônios e células da retina, bem como nas células musculares. Nesta fase crônica da infecção, o sistema imunitário desempenha um papel crítico no controle ou agravamento da doença, particularmente no olho (11-13).
Nos humanos, a maior fonte de transmissão da toxoplasmose é o contato com fezes infectadas de gatos, porém ele não é a única fonte de transmissão. Outros animais de estimação também podem transmitir a doença assim como de alimentos contaminados, por exemplo, carne crua ou mal passada de suínos, bovinos, ovinos, carne de caça ou coelhos, ostras, moluscos ou mexilhões crus, leite, frutas e vegetais crus não lavados, água, transfusão sanguínea, transplantes, sêmen, contato com solo contaminado e outras inúmeras causas podem levar um indivíduo a se contaminar. Um estudo multicêntrico europeu sugeriu que 30-63% das infecções primárias em mulheres grávidas resultam do consumo de produtos crus ou mal cozidos. Nos Estados Unidos a carne contaminada com bradizoítas persistentes também foi identificada como um fator de risco significativo para a aquisição de uma infecção por T. Gondii, a segunda causa de mortalidade alimentar após a salmonelose e a quarta causa de hospitalização após infecções alimentares por salmonela, campilobacteriose e norovírus (11,14,15).
Acredita-se que o impacto epidemiológico da disseminação do T. gondii pela água é subestimado, pois os oocistos podem permanecer viáveis por um longo período de tempo na água e, além disso, são resistentes aos processos de desinfecção da água, como cloração, ozonização e radiação ultravioleta. Preocupantemente, em São Paulo, foram coletadas amostras de dez pontos de coleta de águas superficiais em áreas de captação para o consumo humano e o parasita foi encontrado em três dos dez pontos analisados (16).
As manifestações da toxoplasmose adquirida ao longo da vida normalmente são assintomáticas, porém alguns indivíduos podem apresentar manifestações clínicas (15). Em 1983, pela primeira vez no Brasil e na América Latina, o T. gondii foi isolado de um olho de um paciente afetado, indicando que a lesão ocular sofrida por ele era originária da infecção pelo parasita. Nesse momento começou-se a entender que a toxoplasmose poderia trazer complicações em pacientes que adquirissem a doença ao longo da vida. No ano de 1989 se concluiu que a doença pode aparecer no olho muitos anos após o episódio primário de infecção, podendo se manifestar até 13 anos após a infecção primária, denominando-se de toxoplasmose ocular adquirida de início tardio. A toxoplasmose ocular adquirida no período pós-natal ocorre em aproximadamente dois a cada 100 indivíduos soropositivos, sugerindo que 1 em cada 400 pessoas em todo o mundo terá uveíte posterior devido ao T.gondii (3,9).
As manifestações oculares da doença ocorrem de diferentes formas, caracterizando-as em dois tipos principais de lesões: as típicas, encontradas em cerca de 80% dos casos, e as atípicas, que correspondiam a aproximadamente 20% dos casos. As manifestações típicas são lesões focais de retinite ou retinocoroidite amarelo-esbranquiçadas, tipicamente adjacentes a uma lesão pigmentada cicatricial antiga e com vitrine associada, sendo mais comum em imunocopetentes se comportam classicamente evoluindo favoravelmente em termos de cura e recorrência, já as atípicas são bilaterais, extensas ou multifocais e que tendem a ocorrer em imunocomprometidos (3,17).
No sistema nervoso central (SNC), os taquizoítos de T. gondii infectam microglia, astrócitos e neurônios. Estes tipos de células só podem controlar o agente patogênico após estimulação pelo sistema imunitário, especialmente pelas células T. Considerando que astrócitos e microglia infectados conseguem eliminar os parasitas, os parasitas se convertem em bradizoítos formadores de cistos intraneuronais evitando a eliminação pelo sistema imunológico, pois os neurônios não conseguem eliminá-los. Os regimes de tratamento atualmente disponíveis eliminam eficazmente os taquizoitos de toxoplasma das células residentes em cérebro infectadas. No entanto, nenhum agente terapêutico é capaz de erradicar completamente os cistos ebradizoítos do Toxoplasma do SNC (13).
A imunidade mediada por células aos antígenos de T. gondii envolve respostas inflamatórias agudas inatas e imunidade adaptativa antígeno-específica. A resistência central ao hospedeiro é a geração de interferon (IFN) – γ por células “naturalkillers” linfócitos T CD4 e CD8 adaptativos. A Interleucina-12 é considerada crítica para a produção rápida de IFN‐γ e a diferenciação adequada de linfócitos T helper (Th)1 durante a resposta imune ao Toxoplasma. Deficiência na produção da interleucina-12 pelas células dendríticas pode ser um fator complicador da resposta imune ao T. gondii(18).
Na maioria das vezes a manifestação da doença em indivíduos imunocompetentes se dá através da forma ocular, porém, em indivíduos com imunodeficiência, como no caso da AIDS, a fase latente do parasita (bradizoíto), que reside no sistema nervoso central (SNC), reativa, resultando na encefalite por toxoplasma (18).Na Colômbia, estima-se que anualmente ocorrem entre 7.000 a 10.000 novos casos de toxoplasmose em pacientes HIV positivos,tendo a toxoplasmose cerebral como principal complicação (19).
Em 1948 houve um grande avanço no campo da toxoplasmose com o desenvolvimento do teste de corante Sabin-Feldman, é um teste sorológico baseado na lise parasitária por anticorpos séricos na presença de complemento, altamente sensível e específico, sem evidência de resultados falsos em humanos e foi o que naquela época evidenciou que as infecções por T. gondii são amplamente prevalentes em humanos em muitos países, foi considerado padrão ouro por muitos anos, mas agora é realizado por poucos laboratórios (7,20).
Atualmente, a maioria dos laboratórios clínicos usam ELISA para a triagem de rotina de IgG e IgM específicos, sabe-se que a presença de anticorpo IgM no sangue representa uma infecção recente, porém a toxoplasmose tem uma particularidade de permanecer com IgM detectável por mais de um ano na maioria dos pacientes infectados. Quando um exame mostrar positivo para IgM, deve-se realizar um segundo teste para descartar um falso positivo de infecção recente de Toxoplasmose. Esse segundo teste é de avidez do IgG, onde se adiciona um passo na reação de ELISA. Com a colocação de uréia, que remove o anticorpo de baixa avidez que representa uma infecção adquirida recentemente, assim a alta avidez permite a exclusão de uma infecção aguda (7).
Também, há a detecção do T Gondii pelo DNA, a partir de um único taquizoíto consegue-se a detecção pela técnica da reação em cadeia da polimerase (PCR). Métodos moleculares são usados além dos métodos sorológicos convencionais para o diagnóstico de toxoplasmose. Os métodos convencionais são limitados quando empregados em pré-natais ou em pacientes imunocomprometidos. Por exemplo, uma mãe pode ser diagnosticada com toxoplasmose com precisão por sorologia durante a gravidez. Neste caso, seu bebê estará potencialmente em risco de infecção congênita, mas os resultados da sorologia não podem confirmar se o parasita foi transferido para o bebê. No entanto, as técnicas de diagnóstico molecular podem demonstrar se o parasita foi transferido ao bebê (10,14,20).
A infecção congênita ocorre quando uma mulher é infectada durante a gestação, causando uma transmissão vertical ao feto. Se a toxoplasmose for adquirida durante o primeiro trimestre da gravidez é mais grave que nos outros trimestres. O risco de infecção aguda com repercussões fetais é maior em mulheres sem exposição anterior à gestação. A transmissão vertical ocorre frequentemente entre o primeiro e o quarto mês após a infecção aguda, mas a placenta abriga organismos viáveis durante toda a gestação. Muitas manifestações clínicas podem ocorrer em crianças infectadas congenitamente. A doença leve consiste em visão levemente diminuída, enquanto que crianças gravemente doentes podem ter comprometimento maior da visão, hematoencefalite, hidrocefalia, convulsões e calcificações intracerebrais (5, 21, 22).
Recém-nascidos em que suas mães foram tratadas durante a gestação podem apresentar dificuldades de serem diagnosticados devido à baixa sensibilidade dos marcadores laboratoriais, por isso os resultados negativos não excluem a possibilidade da infecção congênita (1). Além disso, as manifestações podem aparecer tardiamente, por isso essas crianças, normalmente, são tratadas por 12 meses com altas doses de ácido folínico e pirimetamina (23).
Um estudo americano comparou achados clínicos em bebês cujas mães foram diagnosticadas com toxoplasmose e tratadas durante a gestação, com bebês de mães que não foram tratadas durante a gestação. Foi observada menor prevalência de achados oculares (62,5%) e hidrocefalia (38,5%) no grupo de bebês nascidos de mães tratadas quando comparado ao outro grupo (92,2% e 67,7%, respectivamente). Uma diferença significativa também foi observada quanto à presença de achados oculares, calcificações e hidrocefalia concomitantemente, com uma frequência de 27,3% no grupo de bebês nascidos de mães tratadas versus 61,6% na coorte não tratada (24). Na França há um programa de rastreamento de toxoplasmose em todos os meses da gestação, enquanto nos Estados Unidos o exame é realizado no início da gestação e caso ocorra alguma suspeita em ecografias. Observa-se que as crianças francesas em que as mães são infectadas nascem com problemas muito mais leves que as americanas, devido ao início precoce do tratamento (8).
Um estudo na Alemanha no qual as gestantes foram tratadas na 16ª semana de gestação com espiramicina seguida de pelo menos 4 semanas de terapia combinada com pirimetamina, sulfadiazina e ácido folínico, independentemente do estado de infecção do feto, com tratamento subsequente determinado de acordo com o status da infecção do feto, foram relatadas taxas muito baixas de toxoplasmose congênita, 4,8% que equivale a 33 casos em 685 mulheres grávidas (25).
O procedimento padrão ouro para constatar a presença de infecção fetal pelo T. gondii consiste na pesquisa do DNA desse protozoário por PCR, que é realizada em amostra de líquido amniótico, obtido por meio de amniocentese. Alguns ensaios têm evidenciado que esse método apresenta índices de sensibilidade variando entre 64% e 98,8%. A sensibilidade tem-se mostrado maior quando o procedimento é realizado entre a 17ª e a 21ª semanas da gestação (26,27).
No ano de 2008 foram analisados 3037 pacientes que realizaram a sorologia para toxoplasmose, no Hospital Universitário Unidade Materno Infantil de São Luís – MA, no período de Janeiro a Dezembro. Incluíram-se neste estudo, pacientes de ambos os sexos com idades que variaram de 0 a 50 anos e 11 pacientes com idade superior a 50 anos. Os resultados mostraram que 33,03% dos pacientes são susceptíveis à toxoplasmose, 66,38% pacientes imunes e 3,39% pacientes com infecção recente. A faixa etária que apresentou maior imunidade à doença está entre 21 a 30 anos (28).
Visto a importância da infecção em gestantes na saúde pública, há a necessidade de avaliar a prevalência da toxoplasmose em grávidas no município de São Luís e verificar a prevalência de transmissão vertical.
2. OBJETIVOS
O presente estudo teve os seguintes objetivos:
- Avaliar a prevalência da toxoplasmose em gestantes no município de São Luís, capital do Estado do Maranhão.
- Verificar a prevalência de transmissão vertical no grupo de grávidas acometidas por primo-infecção de toxoplasmose.
3. CASUÍSTICA E MÉTODO
3.1 Casuística
A casuística utilizada para o estudo da prevalência da toxoplasmose e de sua transmissão vertical consistiu em 79 gestantes acometidas por toxoplasmose, atendidas no serviço de pré-natal do Hospital e Maternidade Marly Sarney da cidade de São Luís, capital do Estado do Maranhão. Tais gestantes foram detectadas por meio de rastreamento de 14.698 grávidas atendidas no pré-natal dessa maternidade durante o ano de 2016.
De todas as gestantes ou de seus representantes legais obteve-se assinatura de Termo de Consentimento Livre e Esclarecido (apêndice 1).
O estudo obteve aprovação do Comitê de Ética e Pesquisa da Irmandade da Santa Casa de Misericórdia de São Paulo (ISCMSP), através do parecer da plataforma Brasil sobregistro 2023244 (anexo 1).
3.2 Método
3.2.1 Pesquisa de dados epidemiológicos
Por meio de entrevista das 79 gestantes, realizada após a obtenção do diagnóstico da toxoplasmose, procurou-se verificar eventual presença das condições de risco de contágio por T. gondii, particularmente convívio com gato e ingestão de carnes cruas ou mal cozidas.
A situação de moradia, envolvendo saneamento básico assim como cuidados higiênicos relacionados com o preparo de verduras, legumes e outros alimentos e contato com o solo não foram, igualmente, arguidas nessas entrevistas.
3.2.2 Diagnóstico de primo-infecção
Para a verificação de infecção adquirida na gravidez utilizou-se o teste laboratorial da avidez da imunoglobulina IgG.
A categoria diagnóstica e critérios para diagnóstico de infecção primária na gestação e toxoplasmose fetal e congênita encontram-se demonstradas na tabela 1.
Tabela 1. Categorias diagnósticas e critérios de definição de casos de toxoplasmose na gestação, fetal e congênita

Fonte: Varella (29)
3.2.3 Diagnóstico de toxoplasmose congênita
Pelo fato da maternidade não dispor de tecnologia para realizar a detecção de toxoplasmose fetal por meio de técnica de PCR, esse diagnóstico foi rastreado nos recém-nascidos com a metodologia empregada no diagnóstico da primo-infecção materna.
3.3 Análise estatística
Foi realizada através do software SPSS versão 13.0, com variáveis qualitativas constituídas por gráficos e tabelas. Foram utilizadas frequências absolutas (N) e relativas (%). Os intervalos de confiança foram de 95%.
4. RESULTADOS
Os resultados obtidos no que se relaciona com prevalência da toxoplasmose e com a transmissão vertical da mesma são os que se seguem.
4.1 Prevalência de toxoplasmose
Por meio do rastreamento das 14.698 grávidas constatamos que em 79 o teste de avidez da imunoglobulinas IgG mostrou-se positivo. Dessa forma, em nosso estudo o índice de soroprevalência foi de 0,54% considerando-se um intervalo de confiança (IC) de 95%conforme a tabela 2.
Tabela 2: Prevalência das variáveis gestantes para toxoplasmose

Fonte: Prontuários médicos e entrevista – Ambulatório de Ginecologia e Obstetrícia , 2017.
4.1.1 Variáveis quanto aos fatores sociais e demográficos
Na tabela 3 expomos os percentis relacionados com idade, raça, escolaridade, ocupação, procedência e renda familiar.
Tabela 3: Descrição das variáveis relacionadas aos fatores sociais e demográficos.

Como se pode verificar, a maior prevalência quanto à idade foi entre 21 e 30 anos (53,2%), seguida pela faixa etária inferior a 20 anos (34,2%) e superior a 31 anos (12,7%). Referente à raça, predominou a raça parda (86,1%), seguida pela branca (13,9%).No que tange à escolaridade, 67,1% relatou ter mais de nove anos de estudo.Quanto à ocupação e procedência, 48,1% das mulheres são do lar e 70,9% residem na zona rural/periferia da capital.Por fim, no que diz respeito à renda 53,3% tem renda acima de um salário mínimo.
4.1.2 Condições de risco
Dentre essas condições, somente foi possível analisar convívio com gatos (69,6%) e consumo de carnes cruas ou mal cozidas (1,3%) (tabela 4). Quanto aos cuidados higiênicos relacionados com lavagem de verduras e a contato com o solo não foi possível obter informações consistentes.
Tabela 4. Condições de risco.

4.1.3 Idade da gestação do diagnóstico e início do pré-natal
No que tange à idade da gestação do diagnóstico e início do pré-natal a IG no pré-natal que predominou foi o 1º trimestre (55,7%) e a IG do diagnóstico foi o segundo trimestre (58,2%) (Tabela 5). Este é um dado relevante, pois, após a infecção materna, o início de tratamento precoce (idealmente em até 3 semanas), reduz os riscos de infecção fetal. Neste estudo percebe-se que a maioria dos diagnósticos foi feita no segundo semestre.
Tabela 5. Idade Gestacional

4.2 Teste de avidez
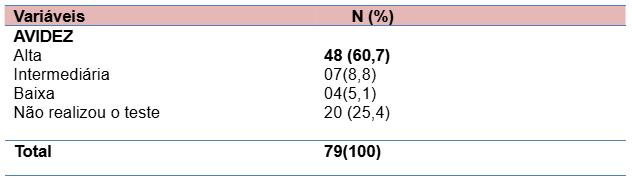
Com relação ao teste de avidez 74,6% das gestantes realizaram o teste. Os resultados apontaram 60,7% com alta avidez, 8,8% com avidez intermediária e 5,1% com baixa avidez. A alta avidez, até 16 semanas de gestação, significa que a infecção foi adquirida antes da gestação. A partir de 16 semanas, a avidez não possibilita exclusão de infecção atual. A baixa avidez significa que é possível que a infecção tenha sido adquirida na gestação, o que requer maiores cuidados.
Tabela 6. Teste de avidez
4.3 Prevalência de toxoplasmose congênita
Por meio de avaliação sorológica dos recém-nascidos das 79 gestantes acometidas pela toxoplasmose verificamos que 12 dos mesmos apresentavam com infecção congênita (15,2%). Sendo 7,5 casos para cada 10.000 NV no ano de 2016 (N=15.833).
Um dos recém-nascidos apresentou-se com microcefalia e três com hidrocefalia. Nos demais não se constatou complicação que pudesse ser relacionada com a toxoplasmose.
Tabela 7: Prevalência da variável de acometimento fetal para toxoplasmose

Fonte:Prontuários médicos e entrevista – Ambulatório de Ginecologia e Obstetrícia , 2017.
4.4 Acometimento fetal
Com relação ao acometimento fetal foram encontrados os seguintes: toxoplasmose (26,6%), prematuridade (20%), hidrocefalia (13,8%), hidrocefalia + malformação + óbito fetal (6,6%), crescimento intrauterino restrito (CIUR) + toxoplasmose (6,6%), icterícia (6,6%), microcefalia (6,6%), atraso neurológico (6,6%) e feto natimorto (6,6%) (Tabela 8).
Tabela 8. Acometimento fetal

5. DISCUSSÃO
A toxoplasmose é uma doença causada pelo parasita protozoário intracelular Toxoplasma gondii (1-5). A maioria dos indivíduos imunocompetentes que contraem o parasita não desenvolve sintomas ou pode apresentar sintomas semelhantes aos da gripe, incluindo febre, dor de cabeça, dor muscular e linfadenopatia (29). Embora um terço da população mundial esteja infectada com o parasita, ele muitas vezes não é reconhecido, já que a maioria dos pacientes não apresenta sintomas. Criticamente, quando uma infecção por T gondii é adquirida na gravidez, o parasita pode ser transmitido através da placenta para o feto, resultando em toxoplasmose congênita, que pode ter consequências graves (5,21,22).
Assim, alguns aspectos relacionados com o binômio toxoplasmose e gravidez, que foram assinalados na introdução deste estudo, merecem especial atenção dos poderes públicos e da atuação dos obstetras, frente às potenciais graves complicações da transmissão vertical dessa infecção ocasionada pelo T. gondii.
O Estado tem grande responsabilidade no que se relaciona com uma das mais importantes condições de risco para o contágio, isto é, na deficiência ou até mesmo ausência de saneamento básico. As pesquisas epidemiológicas acerca da soroprevalência da toxoplasmose apontam de forma muito clara os elevadíssimos índices de infecção antiga e recente nas regiões de outros países e do nosso em que as condições de habitabilidade são precárias (30-33).
Nesse sentindo, a epidemiologia da região, considerando-o como aspecto importante é a partir destes resultados auxiliará a aquisição de programas educativos com medidas de prevenção primária contra a infecção por este parasito (34-35).
A assistência ao pré-natal deve ser iniciada logo que a gravidez for confirmada e representa papel fundamental na prevenção e/ou detecção de doenças maternas e congênitas, é durante a consulta que a gestante e o obstetra trocam informações com esclarecimentos dúvidas e anseios promovendo um melhor prognóstico da gestação (36).
É durante as consultas ao pré-natal e o acompanhamento sistemático a identificação das gestantes no momento que ocorre a infecção materna (37). Dessa forma, a confirmação diagnóstica de forma precoce permite a redução na gravidade da infecção intrauterina, do tratamento materno e da virulência do parasita ativo.
Em nosso estudo, considerando a categoria diagnóstica e critérios para diagnóstico de infecção primária durante a gestação (29), 60,7% do teste diagnóstico realizado apontou alta avidez (infecção pregressa); 8,8% apontou avidez intermediária (inconclusivo) e 5,1% com baixa avidez (infecção recente, ≤ 3 meses).
Um número relevante das pacientes estudadas iniciou o pré-natal tardiamente, logo também o diagnóstico da infecção foi tardio (> 16 semanas) não sendo possível precisar o momento em que foi contraída a infecção. Olariu e colaboradores (38) identificaram oito gestantes com infecção primária com diagnóstico durante o terceiro trimestre e receberam apenas algumas semanas de tratamento e no momento do parto.
O maior desafio no diagnóstico da toxoplasmose é estabelecer a infecção aguda (primária) e distingui-la da infecção passada (crônica). A infecção por Toxoplasma gondii pode ser diagnosticada através de testes sorológicos, ultrassonografia e amniocentese. Os resultados dos testes sorológicos que medem a imunoglobulina (Ig) M e IgG são muitas vezes difíceis de interpretar quando se diferenciam entre infecções agudas e crônicas. Após a infecção aguda, os títulos de anticorpos IgM aumentam a partir do dia 5 e atingem o nível máximo em 1 a 2 meses. Neste ponto, os anticorpos IgM diminuem mais rapidamente que os anticorpos IgG (39). No entanto, em muitos casos, os anticorpos IgM persistem por anos após a infecção aguda. Em contraste, os anticorpos IgG são geralmente detectáveis dentro de 1 a 2 semanas após a infecção aguda, atingem o pico em 12 semanas a 6 meses e geralmente permanecem detectáveis ao longo da vida (40). A ausência de anticorpos IgG e IgM antes ou no início da gestação não indica infecção prévia e identifica mulheres em risco de contrair a infecção durante a gravidez (41). A detecção de anticorpos IgG e a ausência de anticorpos IgM indicam uma infecção antiga. No entanto, se os resultados dos testes forem positivos para IgG e IgM, a interpretação é difícil, pois os resultados positivos podem ser devidos a uma infecção recente ou a baixos níveis de anticorpos IgM de uma infecção anterior (42). Se houver suspeita de infecção aguda, recomenda-se repetir o teste dentro de 2 a 3 semanas (42). Um aumento de 4 vezes no título de anticorpos IgG entre os testes indica uma infecção recente (43).
A confirmação da infecção primária é de extrema importância na avaliação do risco de transmissão fetal, no início de antibióticos e no aconselhamento adequado. Para determinar com maior precisão a probabilidade de uma infecção recentemente adquirida, testes mais específicos, como testes de avidez de anticorpos IgG, são úteis (44). O ensaio de avidez de IgG mede a força de ligação de IgG a T gondii (43). Na maioria dos casos, a avidez de IgG muda de um índice baixo para um alto, cerca de 5 meses após a infecção. Assim, pacientes com infecção aguda exibem um baixo índice de avidez, sugerindo que a infecção ocorreu dentro de 5 meses após o teste, enquanto aqueles com infecção prévia têm um alto índice de avidez de IgG (45).
Do mesmo modo que em outras doenças, no que se relaciona com a toxoplasmose existem falsas informações, que trazem prejuízos para os pacientes. No que se relaciona com a toxoplasmose, a informação incorreta é de que a transmissão vertical pode ocorrer em gestantes que apresentaram esse evento em gravidez anterior.
Ainda que existam publicações em que essa informação é veiculada (46,47), existe consenso de que toxoplasmose congênita somente ocorre em filhos de mães acometidas por primo-infecção (48).
Nossa pesquisa apresentou-se a prevalência para gestantes com toxoplasmose (0,5%). Achados similares foram encontrados por Câmara et al (49), na cidade de Caxias-MA, encontrando 0,9% de infecção ativa, outros estados do Nordeste semelhou-se, em Fortaleza, Ceará (0,5%) (50), em Natal, Rio Grande do Norte (0,5%) (51), e em Goiânia, Goiás (0,7%) (52).
Por outro lado, a infecção congênita demonstrou um expressivo resultado na exposição acometimento fetal (12%), sendo 7,5 casos para cada 10.000 nascidos vivos, incluindo doenças decorrentes da T.gondii, tais como prematuridade, feto natimorto, icterícia, atraso neurológico, hidrocefalia e microcefalia. O presente estudo identificou as doenças citadas no período pós-natal, rastreados através da imunoglobulinas IgG utilizados como marcadores sorológicos de infecção congênita.
A toxoplasmose congênita esteve presente em outros estudos, no Estado de Minas Gerais (53) apontam a elevada prevalência da infecção, 13 casos em cada 10 mil recém-nascidos, concentrados em municípios com menores índices socioeconômicos. Além desse, no mesmo estado em triagem neonatal, cerca de 190 crianças foram infectadas, sendo que 95% apresentavam-se assintomáticas ao nascimento (54). Capobiango e col. (55) identificaram 31 gestantes, obtendo o diagnóstico de toxoplasmose congênita em 7 crianças, destas, 4 sintomáticas ao nascimento, 4 apresentaram coriorretinite e 3 calcificação cerebral.
Bischoff e col. (56) em estudo recente também observaram o número de casos de toxoplasmose congênita que variou de 0-14,06:10.000 nascidos vivos, com uma média de incidência de 5,97:10.000, os achados foram coriorretinite (65,7%), calcificações intracranianas (48,6%) e LCR alterado (28,5%) .
Foi encontrado também maior índice de contaminação em gestantes que mantinham contato com gatos (69,6%) (4,11,12,14,15). Apesar de em alguns estudos (57, 58) o contato com gatos não ter demonstrado associação significativa com a infecção pelo T. gondii, Lopes et al. (35) e Avelino et al. (59) encontraram associação entre a infecção pelo T. gondii e presença de gatos errantes.
Já a associação entre a ingestão de alimentos crus ou mal cozidos encontrados nesta pesquisa foi de 1,3%, índice este bastante reduzido se comparado ao encontrado na literatura que chegou a até 63% (11,14,15, 60-63).
Martins (64) e Breganó e col. (65) ressaltam algumas das doenças decorrentes da transmissão placentária quando não diagnosticados precocemente nos recém-nascidos, podem vir a apresentar um risco elevado de adquirirem sequelas que permanecem em longo prazo, tais como: macro ou microcefalia (em 50% dos casos), acentuada destruição da retina, retinocoroidite (em 90% dos pacientes com infecção), calcificações cerebrais (em 69%) e retardo mental ou perturbações neurológicas (em 60% dos casos), com sinais de encefalite com convulsões. Diante das lesões oculares e do sistema nervoso central, podem evoluir e agravar-se durante os dois primeiros anos de vida.
Além disso, a ocorrência de doenças relacionadas à T.gondii, apontam elevados índices com 75 a 90% dos recém-nascidos na qual se manifestaram de forma assintomática durante o período neonatal (65). Melamed e col. (66) apresentaram lesões de retinocoroidite em população com idade média de 4,2 meses de idade e lesões ativas com 1,4 meses de idade. Kieffer et al.(67) demonstraram a infecção por T.gondii como um dos principais fatores de risco relacionados à retinocoroidite nos primeiros dois anos de vida.
Outros achados clínicos e sorológicos recentes apresentaram características diagnósticas evidentes, com 19 de 24 (79%) crianças com toxoplasmose congênita indicando um ou mais sintomas.As lesões mais comuns foram no olho, sendo cório-retinite 11/19 (46%), maculopatias 2/19 (8%) e estrabismo 1/19 (4%) (67). Nos Estados Unidos relatou-se alta frequência de sinais e sequelas e uma ou mais manifestações clínicas graves de toxoplasmose congênita. Foram relatadas em 84% dos neonatos infectados e incluíram doença ocular (92,2%), calcificações cerebrais (79,6%) e hidrocefalia (67,7%). Estes números foram elevados, devido à inexistência do tratamento para o parasita durante a gestação (38).
Contudo é grande a importância do seguimento ambulatorial das crianças infectadas ao longo prazo, tendo em vista a viabilidade de ocorrer coriorretinite com dano visual, atraso de desenvolvimento neuropsicomotor, hidrocefalia, convulsões e/ou surdez, no transcurso de anos após o nascimento (38,68). No caso da experiência em nosso estudo, para o fechamento do diagnóstico na criança, este foi fundamentado através de dados clínicos disponibilizados na pesquisa até o primeiro ano de vida, dessa forma sugerem-se estudos futuros que permitirão avaliar outros desfechos durante o seguimento.
6. CONCLUSÃO
A frequência de infecção aguda por toxoplasma gondii durante a gestação foi semelhante aos dados encontrados na literatura e constatou-se um número considerável de pacientes estudadas iniciou o pré-natal tardiamente, e, também, o diagnóstico da infecção foi tardio não sendo possível precisar o momento em que foi contraída a infecção, o que, conseqüente, reduz as chances de tratamento precoce e transmissão fetal. Tais achados apontam para a necessidade de medidas educativas e um bom acompanhamento pré-natal, tendo em vista a relevância da gravidade da doença acometida no binômio materno fetal.
REFERÊNCIAS
1. Paquet C, Yudin MH, Society of Obstetricians and Gynaecologists of Canada. Toxoplasmosis in pregnancy: prevention, screening, and treatment. J Obstet Gynaecol Can. 2013;14(1).
2. Weiss LM, Dubey JP. Toxoplasmosis: A history of clinical observations. Int J Parasitol. 2009;39(8):895–901.
3. Melamed J. Contributions to the history of ocular toxoplasmosis in Southern Brazil. Mem Inst Oswaldo Cruz [Internet]. março de 2009 [citado 28 de março de 2019];104(2):358–63. Available at: http://www.scielo.br/scielo.php?script=sci_ arttext&pid=S0074-02762009000200032&lng=en&tlng=en
4. Rouatbi M, Amairia S, Amdouni S, Boussaadoun M, Ayadi O, Al-Hosary A, et al. Toxoplasma gondii infection and toxoplasmosis in North Africa: a review. Parasite [Internet]. 2019;26(6). Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/ PMC6376878/pdf/parasite-26-6.pdf
5. Khoshnood B, De Vigan C, Goffinet F, Leroy V. Prenatal screening and diagnosis of congenital toxoplasmosis: A review of safety issues and psychological consequences for women who undergo screening. Prenat Diagn. 2007;27(5):395–403.
6. Saadatnia G, Golkar M. A review on human toxoplasmosis. Scand J Infect Dis. 2012;44(11):805–14.
7. Robert-Gangneux F, Dardé ML. Epidemiology of and diagnostic strategies for toxoplasmosis. Clin Microbiol Rev. 2012;25(2):264–96.
8. Peyron F, Mc Leod R, Ajzenberg D, Contopoulos-Ioannidis D, Kieffer F, Mandelbrot L, et al. Congenital Toxoplasmosis in France and the United States: One Parasite, Two Diverging Approaches. PLoS Negl Trop Dis. 2017;11(2).
9. Pleyer U, Schlüter D, Mänz M. Ocular toxoplasmosis: Recent aspects of pathophysiology and clinical implications. Ophthalmic Res. 2014;52:116–23.
10. Liu Q, Wang ZD, Huang SY, Zhu XQ. Diagnosis of toxoplasmosis and typing of Toxoplasma gondii. Parasites and Vectors. 2015;8(1).
11. Schlüter D, Däubener W, Schares G, Groß U, Pleyer U, Lüder C. Animals are key to human toxoplasmosis. Int J Med Microbiol. 2014;304(7):917–29.
12. Schlüter D, Barragan A. Advances and Challenges in Understanding Cerebral Toxoplasmosis. Front Immunol [Internet]. 2019;10(242). Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6401564/
13. Blanchard N, Dunay IR, Schlüter D. Persistence of Toxoplasma gondii in the central nervous system: A fine-tuned balance between the parasite, the brain and the immune system. Parasite Immunol. 2015;37(3):150–8.
14. Amairia S, Rouatbi M, Rjeibi MR, Nouasri H, Sassi L, Mhadhbi M, et al. Molecular prevalence of Toxoplasma gondii DNA in goats’ milk and seroprevalence in Northwest Tunisia. Vet Med Sci. 2016;2(3):154–60.
15. Flegr J, Prandota J, Sovičková M, Israili ZH. Toxoplasmosis – A global threat. Correlation of latent toxoplasmosis with specific disease burden in a set of 88 countries. PLoS One. 2014;9(3).
16. Galvani AT, Christ APG, Padula JA, Barbosa MRF, de Araújo RS, Sato MIZ, et al. Real-time PCR detection of Toxoplasma gondii in surface water samples in São Paulo, Brazil. Parasitol Res. 2019;118(2):631–40.
17. Marques A, Portelinha J, Isidro F, Picoto M, Guedes M. Diagnóstico e Tratamento da Toxoplasmose Ocular em Casos Atípicos. Oftalmologia. 2013;37(4):265–72.
18. Gaddi PJ, Yap GS. Cytokine regulation of immunopathology in toxoplasmosis. Immunol Cell Biol. 2007;85(2):155–9.
19. Cañón-Franco WA, López-Orozco N, Gómez-Marín JE, Dubey JP. An overview of seventy years of research (1944 – 2014) on toxoplasmosis in Colombia, South America. Parasites and Vectors. 2014;7(1).
20. Dubey JP. The history of Toxoplasma gondii – The first 100 years. J Eukaryot Microbiol. 2008;55(6):467–75.
21. Lykins J, Wang K, Wheeler K, Clouser F, Dixon A, El Bissati K, et al. Understanding toxoplasmosis in the United States through “large data” analyses. Clin Infect Dis. 2016;63(4):468–75.
22. Polese JC, Tonial A, Jung FK, Mazuco R, de Oliveira SG, Schuster RC. Avaliação da funcionalidade de indivíduos acometidos por acidente vascular encefálico. Rev Neurociências. 2008;16(3):175–8.
23. Stagni L, Romano MA, Romano A, Magli A, Briganti F, del Pezzo MA, et al. Prenatal screening for congenital toxoplasmosis in Campania: Preliminary report on activities and results. Mem Inst Oswaldo Cruz. 2009;104(2):374–7.
24. Olariu T, Press C, Talucod J, Olson K, Montoya J. Congenital toxoplasmosis in the United States: clinical and serologic findings in infants born to mothers treated during pregnancy. Parasite. 2019;26(13).
25. Batista G, Galdino M. Diagnosis, treatment and prevention of congenital toxoplasmosis in the United States of America. Residência Pediátrica. 2017;7(2):78–9.
26. Hohlfeld P, Daffos F, Costa JM, Thulliez P, Forestier F, Vidaud M. Prenatal diagnosis of congenital toxoplasmosis with a polymerase-chain-reaction test on amniotic fluid. Obstet Gynecol Surv. 1995;
27. Romand S, Wallon M, Franck J, Thulliez P, Peyron F, Dumon H. Prenatal diagnosis using polymerase chain reaction on amniotic fluid for congenital toxoplasmosis. Obstet Gynecol. 2001.
28. Costa MA dos S, Bezelga AL, Trindade CD, Neto JA de F. Soroprevalência da toxoplasmose no Hospital Universitário Materno-Infantil de São Luís – MA, em 2008. Cad Pesq, São Luís,. 2010;17(3):62–6.
29. Varella IRS. Prevalência de toxoplasmose aguda em gestantes, incidência de toxoplasmose congênita e desempenho de testes diagnósticos em toxoplasmose congênita. 206 f. 2007. Tese (Doutorado em epidemiologia). Universidade Federal do Rio Grande do Sul, Porto Alegre, 2007.
30. Guimarães AC, Kawarabayashi M, Borges MM, Tolezano E, Andrade Jr HF. Regional variation in toxoplasmosis sérum negativity in the São Paulo metropolitan region. Rev Inst Med Trop São Paulo, 1993;35:479:83
31. Bahia-Oliveira IM, Jones JL, Azevedo Silva J, Alves CC, Hardis DG. Highly endemic waterborn toxoplasmosis in north Rio de Janeiro state, Brasil. Emerg Infect Dis, 2003;9:55-62.
32. Garcia JL, Navarro IT, Ogawa L, Oliveira RC, Kobilka E. Soroprevalência, epidemiologia e avaliação ocular da toxoplasmose humana na zona rural de Jaguapitã (Paraná). Bras. Rev Panam Salud Públ, 1999;6:157-63.
33. Foschiera AIC, Cartonilho G, Teles CBG. Prevalência da toxoplasmose em pacientes atendidos no laboratório central de saúde pública de Porto Velho-RO. RESC, 2009;2:92-103.
34. Pavan AA, Merlini lS, Betanin V et al. Soroepidemiologia da toxoplasmose em gestantes do município de Medianeira, Paraná, Brasil. Arq. Cienc. Saúde UNIPAR, Umuarama, v. 20, n. 2, p, 131-135, maio/ago. 2016.
35. Lopes-Mori FMR et al. Programas de controle da toxoplasmose congênita. Londrina: Editora Elsevier, 2011.
36. Corrêa S. PAISM: uma história sem fim. Recife: SOS Corpo. 1993.
37. Mitsuka BR. Programa de Vigilância em Saúde da Toxoplasmose Gestacional e Congênita: elaboração, implantação e avaliação no município de Londrina, Paraná. Londrina: Universidade Estadual de Londrina; 2009.
38. Olariu TR, Remington JS, McLeod R, Alam A, Montoya J G. Toxoplasmose congênita grave nos Estados Unidos: achados clínicos e sorológicos em neonatos não tratados. Pediatr Infect Dis J 2011; 30 (12): 1056-61.
39. Stray-Pedersen B. Toxoplasmosis in pregnancy. Baillieres Clin Obstet Gynaecol. 1993;7(1):107–37.
40. Stray-Pedersen B. Toxoplasmosis in pregnancy. Baillieres Clin Obstet Gynaecol. 1993;7(1):107–37.
41. Liesenfeld O, Press C, Montoya JG, Gill R, Isaac-Renton JL, Hedman K, et al. False-positive results in immunoglobulin M (IgM) toxoplasma antibody tests and importance of confirmatory testing: the Platelia Toxo IgM test. J Clin Microbiol. 1997;35(1):174–8.
42. Iqbal J, Khalid N. Detection of acute Toxoplasma gondii infection in early pregnancy by IgG avidity and PCR analysis. J Med Microbiol. 2007;56(Pt 11):1495–9.
43. Montoya JG. Laboratory diagnosis of Toxoplasma gondii infection and toxoplasmosis. J Infect Dis. 2002;185(Suppl 1):S73–82.
44. Petersen E, Borobio MV, Guy E, Liesenfeld O, Meroni V, Naessens A, et al. European multicenter study of the LIAISON automated diagnostic system for determination of Toxoplasma gondii-specific immunoglobulin G (IgG) and IgM and the IgG avidity index. J Clin Microbiol. 2005;43(4):1570–4.
45. Pour Abolghasem S, Bonyadi MR, Babaloo Z, Porhasan A, Nagili B, Gardashkhani OA, et al. IgG avidity test for the diagnosis of acute Toxoplasma gondii infection in early pregnancy. Iran J Immunol. 2011;8(4):251–5.IJIv8i4A8
46. Garcia AGP. Congenital toxoplasmosis in two sucessives childs. Arch Dis Child1968;43:705.
47. Andrade G.M.Q. et al. Toxoplasmose congênita em filho de mãe cronicamente infectada com reativação de retinocoroidite na gestação. J Pediatr,2010;86:85-8.
48. Eichenwald HF, Shinefield HR. A study of congenital toxoplasmosis. InSlim JC (ed). Human Toxoplasmosis. Copenhagen. Munksgaard, 1960 p 41.
49. Câmara JT, Silva MG, Castro AM. Prevalência de toxoplasmose em gestantes atendidas em dois centros de referência em uma cidade do Nordeste. Rev Bras Ginecol Obstet, 2015;37:64-70.
50. Barbosa IR, Holanda CM, Andrade-Neto VF. Toxoplasmosis screening and risk factors among pregnant females in Natal, northeastern Brazil. Trans R Soc Trop Med Hyg. 2009;103:377-82.
51. Sroka S, Bartelheimer N, Winter A, Heukelbach J, Ariza L, Ribeiro H, et al. Prevalence and risk factors for toxoplasmosis among pregnant women in Fortaleza, northeastern Brazil. Am J Trop Med Hyg 2010;83:528-33.
52. Sartori AL, Minamisava R, Avelino MM, Martins CA. [Prenatal screening for toxoplasmosis and factors associated with seropositivity of pregnant women in Goiânia, Goiás]. Rev Bras Ginecol Obstet. 2011;33(2):93-8. Portuguese.
53.Carellos EV et al. Congenital toxoplasmosis in the state of Minas Gerais, Brazil: a neglected infectious disease? Epidemiol Infect, João Pinheiro, v. 1, n. 12, p. 644-655, 2014.
54. Andrade GMQ, Carellos EVM. Toxoplasmose: controle da toxoplasmose congênita em Minas Gerais. Uberaba, 2012.
55.Capobiango JD.Toxoplasmose adquirida na gestação e toxoplasmose congênita: uma abordagem prática na notificação da doençaEpidemiol. Serv. Saúde, Brasília, 25(1):187-194, jan-mar 2016.
56. Bischoff AR, Friedrich L, Cattan JM, Uberti, FA. Incidência de toxoplasmose congênita no período de 10 anos em um hospital universitário e frequência de sintomas nesta população. Boletim Científico de Pediatria, 4(2), 2015.
57. Porto AM, Amorim MM, Coelho IC, Santos LC. [Serologic profile of toxoplasmosis in pregnant women attended at a teaching-hospital in Recife]. Rev Assoc Med Bras. 2008;54(3):242-8. Portuguese.
58. Cademartori BG, Farias NA, Brod CS. Soroprevalência e fatores de risco à infecção por Toxoplasma gondii em gestantes de Pelotas, sul do Brasil. Rev Panam Infectol. 2008;10(4):30-5.
59. Avelino MM, Campos D Jr, Parada JB, Castro AM. Risk factors for Toxoplasma gondii infection in women of childbearing age. Braz J Infect Dis. 2004;8(2):164-74.
60. Silva MG, Câmara JT, Vinaud MC, Castro AM. Epidemiological factors associated with seropositivity for toxoplasmosis in pregnant women from Gurupi, State of Tocantins, Brazil. Rev Soc Bras Med Trop. 2014;47(4):469-75.
61. Spalding SM, Amendoeira MR, Klein CH, Ribeiro LC. Serological screening and toxoplasmosis exposure factors among pregnant women in South of Brazil. Rev Soc Bras Med Trop. 2005;38(2):173-7.
62. Leão PR, Meirelles Filho J, Medeiros SF. [Toxoplasmosis: seroprevalence in postpartum women attended by SUS (Brazilian Public Health System)]. Rev Bras Ginecol Obstet. 2004;26(8):627-32. Portuguese.
63. Gilbert R, Gras L; European Multicentre Study on Congenital Toxoplasmosis. Effect of timing and type of treatment on the risk of mother to child transmission of Toxoplasma gondii. BJOG. 2003;110(2):112-20.
64. Martins C. Toxoplasmose na gravidez. Rev Port Clin Geral. 2002; 18:333-340
65. Breganó RM, Mori FMRL, Navarro IT. Toxoplasmose adquirida na gestação e congênita: vigilância em saúde, diagnóstico, tratamento e condutas. 2010; 62: 978-85.
66. Melamed J, Eckert GU, Spadoni VS, Lago EG, Uberti F. Ocular manifestations of congenital toxoplasmosis. Eye (Lond). 2010;24(4):528-34.
67. Kieffer F, Wallon M, Garcia P, Thulliez P, Peyron F, Franck J. Risk factors for retinochoroiditis during the first 2 years of life ininfants with treated congenital toxoplasmosis. Pediatr Infect Dis J. 2008;27(1):27-32.
68. Sáfadi MAP, Berezin EN, Farhat CK, Carvalho ES. Clinical presentation and follow up of children with congenital toxoplasmosis in Brazil. Braz J Infect Dis. 2003 Oct; 7(5):325-33.
1e-mail: karinefigueiredo13@hotmail.com
Enfermagem e odontologia. UNICEUMA E UNG
Mestre em Ciências da Saúde
2Enfermagem. UNICEUMA
dra.carolineazevedov@gmail.com
3Formação farmacêutico (UFPA)
Doutor Biologia do Agentes Infecciosos e Parasitários (UFPA)
E-mail jrfarmaceutico08@gmail.com
4Graduação: Farmácia (UFMA)
Pós graduação: Mestrado em Farmacologia (UFPI)
E-mail: halmissondss@gmail.com
5Educação Física, instituição: Universidade Federal do Piauí.
cirley@ufpi.edu.br
6Farmacêutico – Mestre em Farmacologia – UFPI
rodolforitchelle@gmail.com
7Doutorando em Engenharia Biomédica e Fisioterapeuta pela faculdade Santa Terezinha (CEST)
emigdio.coutinho@gamil.com
8Mestre em Geografia (UFPI) e Fisioterapeuta ( Faculdade de Ciências e Tecnologia do Maranhão – Facema) kelly.pereirageo@gmail.com
9Enfermeira formada pela Universidade Estadual do Maranhão (UEMA) Pós graduada Terapia Intensiva pelo Instituto Athenas
Arquiteta e Urbanista, formada pela Faculdade de Ciências e Tecnologia do Maranhão – (FACEMA)
naterciaohana@gmail.com
10Graduada em Enfermagem e obstetrícia UEMA
Mestre em Saúde da Família _ UniNovafapi
mssenfermeira@gmail.com
ANEXOS
ANEXO 1: PARECER CONSUBSTANCIADO DO CEP – PLATAFORMA BRASIL
APÊNDICES
Apêndice 1: TERMO DE CONSENTIMENTO LIRE E ESCLARECIDO – TCLE
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO
Eu, Carla Karine Figueiredo dos Santos, aluna de mestrado em Ciências da Saúde da Faculdade de Ciências Médicas da Santa Casa de São Paulo, estou realizando uma pesquisa com o título: AVALIAÇÃO SOROEPIDEMIOLÓGICA DA TOXOPLASMOSE EM GESTANTES EM SÃO LUÍS-MA. O trabalho tem uma finalidade científica, como objetivo de: Determinar a prevalência de soropositividade para toxoplasmose em gestantes atendidas na Maternidade Marly Sarney em São Luís-MA. A pesquisa é de extrema relevância e visa em caracterizar o perfil das participantes.
A Senhora está sendo convidada a participar da pesquisa e responder um questionário contendo algumas informações pessoais e perguntas relacionadas ao seu conhecimento em relação ao acompanhamento no pré-natal. Também será feita uma consulta de dados do prontuário relativos às suas consultas.Sua participação é totalmente voluntária, podendo você recusar-se a participar, ou mesmo desistir a qualquer momento sem que isto acarrete qualquer ônus ou prejuízo à sua pessoa. As informações serão utilizadas somente para esta pesquisa e serão tratadas com o mais absoluto sigilo e confidencialidade, de modo a preservar sua identidade. Não haverá despesas para você e também nenhum pagamento por sua participação.
Caso a Senhora Tenha dúvidas ou necessite de maiores esclarecimentos, pode me contratar: Carla Karine Figueiredo dos Santos – Tel.: (98) 99111-3091 ou por e-mail: karinefigueiredo13@hotmail.com ou através do endereço do CEP: Comitê de Ética em Pesquisa (CEP) – Rua: Santa Isabel, 305 – 4º andar – Fone: (11) 2176-7689 – E-mail: cepsc@santacasasp.org.br
Comprometemo-nos em assegurar a privacidade e confidencialidade na utilização dos dados obtidos do material acima referido, conforme a resolução 466/12 do Conselho Nacional de Saúde (CNS). As informações oriundas da participação neste estudo serão utilizadas apenas para fins propostos no Projeto de Pesquisa, conforme a resolução 466/12.
Eu__________________________________________________, Acredito ter sido suficientemente informado a respeito das informações deste estudo e autorizo a utilização das informações fornecidas por mim para realização desta pesquisa.
___________________________________ Data ___/___/___
Assinatura do participante
Declaro que fui convidada e obtive de forma apropriada e voluntária o Consentimento Livre e Esclarecido deste participante para a participação neste estudo.
___________________________________ Data __/___/___
Assinatura do responsável pelo estudo
Carla Karine Figueiredo dos Santos
CPF: 000.297.353-78
