CAR T THERAPY: IS IT THE NEW CURE FOR BLOOD CANCER?
REGISTRO DOI: 10.69849/revistaft/ra10202411142244
Beatriz Fernandes dos Santos1
Messias de Oliveira Pacheco2
RESUMO
A terapia CAR-T, uma abordagem inovadora no tratamento de cânceres sanguíneos, como leucemias e linfomas, tem mostrado resultados promissores em pacientes que não obtiveram sucesso com terapias convencionais. Essa técnica consiste em coletar células T do próprio paciente, modificá-las geneticamente em laboratório e reintroduzi-las no organismo para que combatam as células cancerígenas de maneira mais eficaz. Com a ajuda dos glóbulos brancos, as células modificadas atacam as células tumorais, tornando o tratamento menos invasivo e diminuindo os efeitos colaterais comumente associados à quimioterapia e radioterapia, como náuseas, cansaço, queda de cabelo e perda de apetite. Introduzida no Brasil em 2019, a terapia CAR-T está em desenvolvimento para ser oferecida gratuitamente pelo Sistema Único de Saúde (SUS), já que, fora do país, o custo pode chegar a cerca de US$ 1 milhão (aproximadamente R$ 4,8 milhões). Esse valor elevado faz com que muitos pacientes brasileiros, sem cobertura de planos de saúde, acabem desistindo do tratamento ou se endividando. A terapia CAR-T se destaca por ser menos agressiva ao organismo, proporcionando maior qualidade de vida aos pacientes, além de abrir novas perspectivas para o tratamento de cânceres hematológicos que não respondem às terapias convencionais. Com a expansão de seu uso e o desenvolvimento de políticas públicas, essa abordagem pode se tornar mais acessível e uma importante alternativa no combate ao câncer.
Descritores: Câncer, Leucemia, Linfoma, CART-T
ABSTRACT
CAR-T cell therapy, an innovative approach in the treatment of hematologic cancers such as leukemia and lymphoma, has shown promising results in patients who did not respond to conventional therapies. This technique involves collecting T cells from the patient’s own blood, genetically modifying them in the laboratory, and reintroducing them into the body to target and attack cancer cells more effectively. With the help of white blood cells, these modified T cells combat tumor cells, making the treatment less invasive and reducing the side effects commonly associated with chemotherapy and radiotherapy, such as nausea, fatigue, hair loss, and loss of appetite. Introduced in Brazil in 2019, CAR-T therapy is currently under development to be offered free of charge through the Brazilian Unified Health System (SUS). Internationally, the cost of this treatment can reach approximately US$ 1 million (around R$ 4.8 million), which forces many Brazilian patients to forgo the therapy or face significant financial burden, as many private health insurance plans do not cover it. CAR-T therapy stands out for being less aggressive to the body, providing patients with improved quality of life, and opening new avenues for the treatment of hematologic cancers that do not respond to standard therapies. As its use expands and public policies evolve, this approach has the potential to become more accessible and serve as a critical alternative in the fight against cancer.
Descriptors: Cancer, Leukemia, Lymphoma, CART-T
INTRODUÇÃO
A terapia feita com CAR T é uma novidade no mundo da medicina. Através dela, muitas pesquisas realizadas transformaram a vida de pacientes que lutam há anos contra o câncer e estão cansados de tanta quimioterapia, tratamentos e exames para combater as células cancerígenas e melhorar sua qualidade de vida. Afinal, o que são as células CAR-T? É a sigla em inglês para chimeric antigen receptor, onde o “T” pertence ao linfócito T, que é a classe de célula do sistema imunológico responsável por reconhecer antígenos de agentes externos e internos que podem trazer infecções ou tumores aos organismos, produzindo anticorpos para combater o hospedeiro e, assim, defendendo o organismo. 1
A terapia é feita através de modificação genética. O paciente que tem leucemia ou linfoma em estágio avançado tem uma de suas células T do sistema imunológico coletada e levada ao laboratório, onde é modificada e colocada novamente no organismo do paciente. 1
De acordo com médicos, os pacientes que optam por realizar a terapia com CAR-T como sua última alternativa de tratamento têm uma taxa de sucesso inicial de diminuição ou remissão dos tumores entre 30% e 40%. Nos últimos anos, esse tratamento alcançou uma eficácia de 80% nesses pacientes. Ou seja, os pacientes que possuem leucemia ou linfoma em estágio terminal e fazem esse tratamento podem viver uma vida saudável, como se não tivessem tido o câncer em seu organismo, com uma remissão completa dos tumores.1
O uso desse novo método na medicina traz esperança aos pacientes que lutam contra esse carcinoma. No Brasil, muitos pesquisadores estão buscando métodos que possam facilitar o tratamento dos pacientes e tentar adicionar ao Sistema Único de Saúde (SUS), para torná-lo mais acessível a toda a população brasileira e estrangeira que buscam uma nova qualidade de vida em um país com recursos e tratamento de saúde gratuito.1
No Brasil, esse tratamento pode custar até US$ 1 milhão por paciente, se realizado no exterior devido aos custos e ao fato de ser um insumo importado. Com isso, cerca de 5% do valor investido deve ser repassado ao governo de São Paulo, para que outros pacientes possam utilizar esse meio para combater a luta contra o câncer. 2
O estudo da terapia CAR-T tem como objetivo explicar como ela pode ser implantada no organismo humano, como pode agir sobre os tumores que o paciente possa ter e como é feito o tratamento, desde a modificação no laboratório até a implementação no paciente. 2
Muitas vezes, as cidades mais distantes das capitais não possuem o suporte necessário para o tratamento desses pacientes, e muitos deixam de se tratar devido à distância entre suas residências e os hospitais que realizam o tratamento, problemas financeiros ou medo de não terem ninguém para acompanhá-los nesse momento tão delicado e de tanta luta. O estudo da terapia CAR-T representa um avanço na medicina no tratamento do câncer. Muitos estudos e pesquisas mostram como essa terapia funciona em casos de leucemia linfoide e mieloide, respondendo de forma positiva em pacientes que tentaram outros meios de tratamento e não obtiveram os resultados esperados. Avaliar a terapia CAR-T como um método de tratamento mais rápido e eficaz na cura do câncer mieloide e linfoide.
MÉTODOS
O presente estudo trata-se de um artigo de revisão bibliográfica sobre o tratamento da leucemia mieloide e linfoide, com busca de artigos nos bancos de dados eletrônicos PUBMED (National Library of Medicine and The National Institute of Health), SciELO (Scientific Electronic Library Online) e consulta à plataforma Google Acadêmico para coleta de artigos.
CONSIDERAÇÕES GERAIS Hematopoese e sua função
O processo de hematopoese é crucial na produção constante de células sanguíneas, abrangendo renovação, proliferação, diferenciação e maturação. O sangue é composto por séries de células como eritrócitos, leucócitos e plaquetas. Em indivíduos saudáveis, o sangue tem 5 litros, com 2,1 litros ocupados por células e o restante pelo plasma. A hematopoese ocorre principalmente na medula óssea, proporcionando um ambiente propício para a proliferação celular. Nichos de células-tronco são criados para o desenvolvimento de células precursoras de cada linhagem sanguínea. Em resumo, a hematopoese é um processo essencial para o funcionamento adequado do organismo, ocorrendo principalmente na medula óssea 3.
Com o envelhecimento, as células-tronco hematopoiéticas podem abrigar mutações associadas à leucemia e se expandir no sangue periférico, chamado de hematopoese clonal. Isso está presente em 5-55% dos indivíduos saudáveis com mais de 70 anos e está associado a um maior risco de doenças hematológicas e cardiovasculares. É importante distinguir a hematopoese clonal de alto risco do envelhecimento fisiológico e desenvolver recomendações para o manejo clínico desses pacientes 4.
Células derivadas de linhagem mieloide
As células de linhagem mieloide surge através de uma proliferação de células idênticas na medula óssea, fazendo assim, a divisão celular, o que acaba gerando a insuficiência medular. Essas células por sua vez, faz com que o organismo tenha alterações genéticas e epigenéticas, que podem fazer células duplicadas anormais que se proliferam e não conseguem se diferenciar, o que acabando fazendo a morte celular 5.
Quando as células são originadas mieloides, podem sofrer bloqueio maturativo das células hematopoiéticas, pode haver sua divisão e se espalharem pelo organismo, através do sangue e podem se infiltrarem no fígado, baço, linfonodos e outros tecidos. Essas células fazem com que a produção de células sanguíneas seja insuficiente para o organismo, o que pode ocasionar sua substituição do tecido normal 6.
Células derivadas de linhagem linfoide
As células de linhagem linfoide são células que tiveram sua maturação celular, mas que não atingiram sua mutação genética, fazendo com que assim ela se torne uma célula anormal. As células consideradas anormais, se multiplicam de forma mais acelerada, e acabam morrendo de forma mais rápida do que uma célula considerada saudável 8.
A diferenciação na linfopoiese resulta na formação de várias linhagens celulares, como linfócitos T, linfócitos B, células NK e células dendríticas linfoides. Fatores de transcrição como Ikarus, Ayolos e Hélios são essenciais para o desenvolvimento da linhagem linfóide, agindo através da formação de dímeros e influenciando a expressão gênica na linfoipoiese. Eles são considerados genes mestres para essa linhagem 8.
Câncer
O câncer é o crescimento anormal de células, que podem surgir em qualquer parte do corpo. Geralmente, o câncer só é detectado quando atinge o tamanho de 1 cm ou um milhão de células. A transformação de uma célula normal em uma célula cancerosa não é o único fator no desenvolvimento do câncer; a falha do sistema imunológico em identificar e destruir as células cancerosas é crucial. Pessoas com o sistema imunológico suprimido, devido a fatores como estresse crônico, velhice, doenças debilitantes, quimioterapia anterior ou abuso de drogas, têm maior risco de desenvolver câncer. Além disso, a leucemia e os linfomas são exemplos de cânceres que podem não produzir uma massa, mas são detectados em exames laboratoriais 9,10.
Tipos de câncer derivados de progenitores mieloides e linfoides
Leucemia Linfoide Aguda (LLA)
A leucemia linfoblástica aguda (LLA) é uma doença maligna que surge de células linfoides indiferenciadas que se acumulam na medula óssea, timo e gânglios linfáticos. A doença ocorre com mais frequência em crianças de 2 a 5 anos ou mais. As leucemias agudas são diagnosticadas e classificadas principalmente por análises morfológicas e citoquímicas de células neoplásicas e, mais recentemente, por estudos imunofenotípicos utilizando citometria de fluxo e biologia molecular. Esses avanços ajudaram a compreender melhor a doença e a definir grupos de risco que orientam o tratamento e influenciam o prognóstico. O campo de diagnóstico e classificação das leucemias agudas está em constante evolução, com o objetivo de identificar o tipo celular associado à doença para direcionar o tratamento de forma mais eficaz 11.
Leucemia Linfoide Crônica (LLC)
A leucemia linfoide crônica, antes vista como uma doença homogênea devido à acumulação de linfócitos B monoclonais, agora é entendida de forma mais complexa.
Evidências recentes mostram que as células leucêmicas podem ser imunocompetentes e apresentar um aparato de apoptose intacto. Existem pelo menos dois subgrupos de LLC com características distintas, definidos por mutações somáticas em genes da região variável de imunoglobulina. A célula de origem da LLC é provavelmente um progenitor linfoide com características tanto de linfócitos B quanto de linfócitos T. A progressão para células tipicamente LLC depende de estimulação antigênica. A presença de telômeros mais curtos em células não mutadas sugere um maior número de divisões celulares e maior probabilidade de adquirir mutações. A expressão anômala de ZAP70 pode ser um indicador prognóstico relevante. Alterações citogenéticas são comuns, mas tardias e relacionadas ao prognóstico12.
Leucemia Mieloide Aguda (LMA)
A leucemia mieloide aguda (LMA) é caracterizada pelo crescimento descontrolado de células mieloides indiferenciadas chamadas blastos. A causa da doença é desconhecida na maioria dos casos, mas pode estar relacionada à exposição a produtos como benzeno e radiação ionizante. A anemia de Fanconi e a síndrome de Down também podem estar associadas ao desenvolvimento de LM. A doença ocorre em vários tipos de células da medula óssea e do sangue, e estas são divididas em oito subtipos. Os sintomas incluem fadiga, falta de ar, palidez, sangramento, febre e infecções. Além da análise citogenética, o diagnóstico é feito pela análise morfológica e imunofenotípica das células. O tratamento inicial é a quimioterapia para alcançar a remissão com medicamentos como citarabina e idarrubicina. O tratamento após a remissão varia de acordo com a idade e condição do paciente e pode incluir um transplante de medula óssea 13.
Leucemia Mieloide Crônica (LMC)
A leucemia mieloide crônica é uma doença da medula óssea com o cromossomo Philadelphia, que produz proteínas que estimulam o crescimento celular. Até os anos 80, o transplante de células-tronco era o tratamento padrão para pacientes mais jovens com um doador compatível. No entanto, com o surgimento de inibidores de tirosinoquinases, o tratamento mudou. Agora, o mesilato de imatinibe é a escolha principal de tratamento devido à sua eficácia e baixa toxicidade. Isso limitou as indicações para transplantes de células-tronco devido aos riscos associados a esse procedimento 14.
TERAPIAS
Quimioterapia
A quimioterapia é um tratamento essencial contra o câncer, que atua destruindo as células tumorais e evitando a disseminação da doença pelo corpo. O tipo de quimioterapia a ser aplicado depende do tipo e estágio do câncer, sendo personalizado para cada paciente após consulta e exames específicos. O tratamento é realizado em ciclos, com períodos de descanso para recuperação do corpo da toxicidade. Em alguns casos, é necessário a hospitalização do paciente, mas na maioria dos casos pode ser feito ambulatorialmente. Os efeitos colaterais da quimioterapia podem incluir queda de cabelo, diarreia ou prisão de ventre, feridas na boca, enjoo, vômito, hiperpigmentação na pele, fadiga e palidez. Para lidar com esses efeitos, é possível recorrer a tratamentos como o resfriamento do couro cabeludo, cuidados com a alimentação e hidratação, medicações preventivas indicadas pelo médico, proteção solar, repouso e atividade física supervisionada. É importante que o paciente comunique à equipe assistencial qualquer desconforto durante o tratamento, para que medidas possam ser tomadas para aliviar os sintomas. Caso ocorram sinais de toxicidade da quimioterapia, como febre e sangramentos, o paciente deve procurar assistência médica imediatamente para investigação e tratamento adequado. O acompanhamento multidisciplinar durante todo o processo de quimioterapia é essencial para o bem-estar e segurança do paciente, garantindo que o tratamento seja o mais eficaz possível 15.
Imunoterapia
A imunoterapia é um tipo de tratamento oncológico que visa restaurar a capacidade do sistema imunológico de combater as células cancerígenas e fortalecê-las. Várias maneiras de estimular a defesa natural do corpo contra o câncer têm sido tentadas há muito tempo, mas nem todas tiveram sucesso. A criação de vacinas é um exemplo de imunoterapia, mas muitas vezes são ineficazes contra o cancro. Outra abordagem é o transplante de medula óssea, que é particularmente útil para certos tipos de doenças hematológicas. Recentemente, novos medicamentos de imunoterapia como imunossupressores demonstraram eficácia significativa e menos efeitos colaterais. Esta abordagem revolucionária provou ser eficaz em vários tipos de tumores e está a tornar-se uma estratégia fundamental na luta contra o câncer. É importante informar o seu médico sobre quaisquer efeitos colaterais para obter o tratamento correto 16.
Radioterapia
A radioterapia é um tratamento que utiliza radiações ionizantes, como raios-x, para destruir ou impedir que as células do tumor se multipliquem. A maioria dos pacientes com câncer é tratada com radiação, e o resultado costuma ser positivo, podendo levar à cura da doença. Quando a cura não é possível, a radioterapia pode melhorar a qualidade de vida do paciente, diminuindo o tamanho do tumor e aliviando sintomas como dor e hemorragias. Em alguns casos, a radioterapia é combinada com quimioterapia para tratar o câncer. Durante o tratamento, o paciente terá consultas semanais com o médico e enfermeiro para monitorar os efeitos colaterais. Existem duas formas principais de radioterapia: a externa, em que a radiação é emitida por um aparelho direcionado para o corpo do paciente, e a braquiterapia, em que os aplicadores são colocados diretamente no local do tumor. O método de tratamento escolhido dependerá do tipo de tumor e da necessidade do paciente. Durante a radioterapia externa, o paciente pode precisar de máscaras ou marcações para manter a posição correta durante o tratamento 17.
Terapia com células CAR-T
A terapia com células CAR-T é uma forma inovadora de tratamento contra o câncer, que consiste na coleta de células T do paciente para modificar geneticamente e torná-las capazes de atacar as células cancerígenas, sem afetar as saudáveis. Essas células modificadas são reinseridas no organismo do paciente, onde se ligam às células do câncer e as destroem. Esta terapia reduz o consumo de medicamentos para a dor, diminui as sessões de quimioterapia e radioterapia, proporcionando um tratamento mais rápido e eficaz 18.
A terapia com células CAR-T já está disponível no Brasil, representando uma nova era na medicina. Ela traz benefícios tanto para os pacientes, oferecendo novas possibilidades de tratamento e potencial de cura, como também para a sociedade em geral, melhorando a qualidade de vida dos pacientes e de seus familiares. A coleta das células T do sistema imunológico do paciente é feita para a modificação genética em laboratórios especializados no exterior, antes da reinserção no organismo do paciente 18.
Esta terapia, aprovada para pacientes com linfoma difuso de grandes células B, leucemia linfoblástica aguda, linfoma folicular e mieloma múltiplo recidivado ou refratário, é feita com dose única por infusão intravenosa. Após a infusão, pode ocorrer uma reação inflamatória, sinal de que as células modificadas estão agindo contra o tumor. Nos dias seguintes, o paciente pode apresentar sintomas neurológicos leves, que podem ser controlados em centros especializados 19. Atualmente, existem três medicamentos CAR-T aprovados pela Anvisa no Brasil, sendo que apenas um recebeu precificação pela CMED e está disponível para comercialização no país. Esta terapia representa uma nova perspectiva no tratamento de tipos de câncer sem opções terapêuticas eficazes, sendo uma promissora modalidade de imunoterapia que utiliza células de defesa geneticamente modificadas para destruir tumores 19.
Em comparação com a quimioterapia, que atua destruindo células tumorais, e a imunoterapia, que estimula o sistema imunológico contra o câncer, as células CAR-T representam uma opção terapêutica avançada e personalizada. Os efeitos colaterais podem ser controlados em centros especializados, tornando esta terapia uma esperança para pacientes com câncer em busca de cura e qualidade de vida 20.
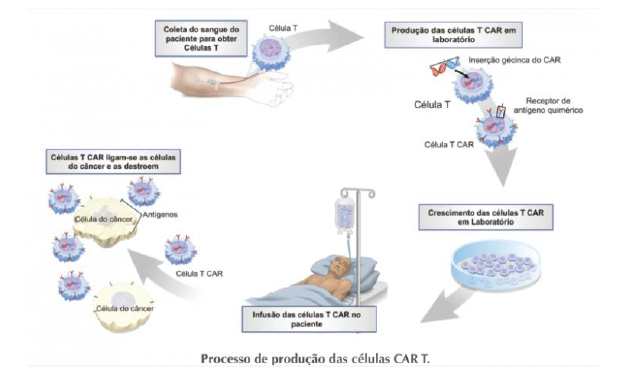
Figura 1. Terapia com CART-T20
CONSIDERAÇÕES FINAIS
A imunoterapia com células CAR-T representa um avanço significativo na engenharia de Biologia Molecular, proporcionando maior especificidade no tratamento de diversos tipos de câncer e reduzindo os efeitos colaterais associados às terapias convencionais. Embora a eficácia dessa abordagem seja promissora, especialmente no tratamento de neoplasias hematológicas como linfomas e leucemias, ainda existem desafios a serem superados. Entre eles estão a expansão para outros tipos de câncer e a necessidade de tornar a terapia mais acessível, considerando o alto custo e o conhecimento especializado necessário. Além disso, é crucial explorar mais a fundo sua eficácia em diferentes tipos de malignidades e no tratamento de doenças autoimunes. Apesar de estar em fase inicial, essa terapia tem o potencial de se tornar uma opção viável para o tratamento do câncer no futuro, superando a quimioterapia devido aos menores efeitos colaterais nos pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1. Magnani CF, Gaipa G, Lussana F, Belotti D, Gritti G, Napolitano S, Matera G, Cabiati B, Buracchi C, Borleri G, Fazio G, Zaninelli S, Tettamanti S, Cesana S, Colombo V, Quaroni M, Cazzaniga G, Rovelli A, Biagi E, Galimberti S, Calabria A, Benedicenti F, Montini E, Ferrari S, Introna M, Balduzzi A, Valsecchi MG, Dastoli G, Rambaldi A, Biondi A. Sleeping Beauty-engineered CAR T cells achieve antileukemic activity without severe toxicities. J Clin Invest. 2020 Nov 2;130(11):6021-6033. doi: 10.1172/JCI138473. PMID: 32780725; PMCID: PMC7598053.
2. José Eduardo Palacio Soares; Lorenzo Alvarenga Guerra; Ronaldo de Rezende Júnior; Fernanda Cardoso Parreiras, Terapia com células CAR-T: reprogramação celular para o combate de neoplasias malignas. 18 agosto 2022, Universidade José do Rosário Vellano (UNIFENAS), Belo Horizonte, MG, Brasil -, doi: https://dx.doi.org/10.5935/2238-3182.2022e32210
3. Labarba AA, Silvestre IS, Martins GCF, Sampaio KC. Hematpoese: uma importância para a homeostase. Braz. J. Hea. Rev. [Internet]. 2023, 10 de abril [citado em 27 de junho de 2024];6(2):7260-72. Disponível em: https://ojs.brazilianjournals.com.br/ojs/index.php/BJHR/article/view/58783 DOI:10.34119/bjhrv6n2-223
4. van Zeventer IA, Buisman SC, de Graaf AO, de Haan G, Jansen JH, Huls G. Klonale hematopoëse [Clonal hematopoiesis: a risk factor for leukemia and cardiovascular disease?]. Ned Tijdschr Geneeskd. 2020 Nov 5;164: D5205. Dutch. PMID: 33331716.
5. Arana-Luna LL, Alvarado-Ibarra M, Silva-Michel LG, Morales-Maravilla A, González-Rubio MDC, Chávez-Aguilar LA, Tena-Iturralde MF, Mojica-Balceras L, ZapataCanto N, Galindo-Delgado P, Miranda-Madrazo MR, Morales-Hernández AE, Silva-Vera K, Grimaldo-Gómez FA, Hernández-Caballero Á, Bates-Martin RA, Álvarez-Vera JL, TepepaFlores F, Teomitzi-Sánchez Ó, Fermín-Caminero DJ, Peña-Celaya JA, Salazar-Ramírez Ó, Flores-Villegas LV, Guerra-Alarcón LV, Leyto-Cruz F, Inclán-Alarcón SI, Milán-Salvatierra AI, Ventura-Enríquez Y, Pérez-Lozano U, Báez-Islas PE, Tapia-Enríquez AL, Palma-Moreno OG, Aguilar-Luévano J, Espinosa-Partida A, Pérez-Jacobo LF, Rojas-Castillejos F, Ruiz-Contreras JI, Loera-Fragoso SJ, Medina-Coral JE, Acosta-Maldonado BL, Soriano-Mercedes EJ, Saucedo-Montes EE, Valero-Saldana LM, González-Prieto SG, Nava-Villegas L, HernándezColin AK, Hernández-Alcántara AE, Zárate-Rodríguez PA, Ignacio-Ibarra G, Meillón-García LA, Espinosa-Bautista KA, Cruz CL, Barbosa-Loría DM, García-Castillo C, Balderas-Delgado C, Cabrera-García Á, Pérez-Zúñiga JM, Hernández-Ruiz E, Villela-Peña A, Cortés SCG, Romero-Rodelo H, Garzón-Velásquez KB, Serrano-Hernández C, Martínez-Ríos A, PedrazaSolís ML, Martínez-Coronel JA, Narváez-Davalos IM, García-Camacho AS, Merino-Pasaye LE, Aguilar-Andrade C, Aguirre-Domínguez JA, Guzmán-Mera PG, Rosa ED, López PEF, González-Aguirre LL, Ramírez-Alfaro EM, Vera-Calderón H, Meza-Dávalos ML, Murillo-Cruz J, Pichardo-Cepín YM, Ramírez-Romero EF. Consensus in acute myeloid leukemia in Mexico. Gac Med Mex. 2022;158(M3):M1-M48. English. doi: 10.24875/GMM.M21000598. PMID:35350063.
6. Graziele C. da Silva, Diogo A. Pilger, Simone M. de Castro, Sandrine C. Diagnóstico laboratorial das leucemias mielóides agudas, Medicina Laboratorial J. Bras. Patol. Med. Lab. 42 (2) Abr 2006. https://doi.org/10.1590/S1676-24442006000200004
7. Moreira FL, Pereira Ferreira IR, Rosário WR, Santos Pereira DM, Casarin JN, Silva Figueiredo CSS e. Avaliação dos aspectos citológicos e laboratoriais da leucemia linfoide aguda. REAS [Internet]. 20maio2021 [citado 27jun.2024];13(5):e7171. Available from: https://acervomais.com.br/index.php/saude/article/view/7171
8. Ruiz-Sánchez BP, Cruz-Zárate D, Estrada-García I, Wong-Baeza I. Las células linfoides innatas y su papel en la regulación de la respuesta inmune [Innate lymphoid cells and their role in immune response regulation]. Rev Alerg Mex. 2017 Jul-Sep;64(3):347-363. Spanish. doi: 10.29262/ram.v64i3.284. PMID: 29046031.
9. Roy PS, Saikia BJ. Cancer and cure: A critical analysis. Indian J Cancer. 2016 Jul-Sep;53(3):441-442. doi: 10.4103/0019-509X.200658. PMID: 28244479
10. Balachandran P, Govindarajan R. Câncer–uma perspectiva ayurvédica. Pharmacol Res. 2005 Jan;51(1):19-30. doi: 10.1016/j.phrs.2004.04.010. PMID: 15519531.
11. Mariela Granero Farias, Pontifícia Universidade Católica do Rio Grande do Sul, Rio Grande do Sul, Brazil Simone Martins de Castro, Universidade Federal do Rio Grande do Sul, Faculdade de Farmácia, Rio Grande do Sul, Brazil, Medicina Laboratorial, J. Bras. Patol. Med. Lab. 40 (2) Abr 2004, Diagnóstico laboratorial das leucemias linfóides agudas https://doi.org/10.1590/S1676-24442004000200008
12. Nelson Hamerschlak, Hospital Israelita Albert Einstein, Programa de Hematologia e Unidade de Transplantes de Medula Óssea, São Paulo, Brasil, Artigos de Revisão, J. Pediatr. (Rio J.) 84 (4 suppl) Ago 2008, https://doi.org/10.1590/S0021-75572008000500008
13. Francisco Pedrosa, Mecneide Lins, Leucemia linfóide aguda: uma doença curável, Instituto Materno Infantil de Pernambuco, Serviço de Oncologia Pediátrica, Recife, Brazil Rev. Bras. Saude Mater. Infant. 2 (1) Abr 2002, https://doi.org/10.1590/S1519-38292002000100010
14. Vaneuza M. Funke, Universidade Federal do Paraná, Curitiba, Paraná, Brazil,Henrique Bitencourt, Universidade Federal de Minas Gerais, Belo Horizonte, Minas Gerais, Brazil, Afonso Celso Vigorito, Universidade Estadual de Campinas, Campinas, São Paulo, Brazil, Francisco José Aranha, Leucemia mieloide crônica e outras doenças mieloproliferativas crônicas, Rev. Bras. Hematol. Hemoter. 32 (suppl1) Maio 2010 https://doi.org/10.1590/S1516-84842010005000045
15. Ana Paula Soares Fontes, Universidade Federal de Juiz de Fora, Instituto de Ciências Exatas, Departamento de Química, Juiz de Fora, Minas Gerais, Brasil; Sérgio Gama de Almeida, Universidade Federal de Juiz de Fora, Instituto de Ciências Exatas, Departamento de Química, Juiz de Fora, Minas Gerais, Brasil; Letícia de Andrade Nader, Compostos de platina em quimioterapia do câncer , Conjunto Hospitalar, Sorocaba, SP, Revisão Quím. Nova 20 (4) Ago 1997,; https://doi.org/10.1590/S0100-40421997000400010
16. Lúcia Silla, Faculdade de Medicina da Universidade Federal do Rio Grande do Sul – UFRGS. Head of the Technology and Cell Therapy Center of Hospital de Clínicas of Porto Alegre – HCPA, Porto Alegre – RS Hospital de Clínicas of Porto Alegre, Technology and Cell Therapy Center, Brasil; EDUCATIONAL ARTICLES AND UPDATES Rev. Assoc. Med. Bras. 62 (suppl 1) Oct 2016 https://doi.org/10.1590/1806-9282.62.Suppl1.23
17. L.F. Lopes, B. de Camargo, A. Bianchi, Os efeitos tardios do tratamento do câncer infantil, Artigos de Revisão Rev. Assoc. Med. Bras. 46 (3) Set 2000 • https://doi.org/10.1590/S0104-42302000000300014
18. Sánchez-Escamilla M, Yáñez San Segundo L, Urbano-Ispizua Á, Perales MÁ. CAR T cells: The future is already present. Med Clin (Barc). 2019 Apr 5;152(7):281-286. doi: 10.1016/j.medcli.2018.08.015. Epub 2018 Nov 2. PMID: 30392694; PMCID: PMC8129896.
19. Corral Sánchez MD, Fernández Casanova L, Pérez-Martínez A. Beyond CART cells: Natural killer cells immunotherapy. Med Clin (Barc). 2020 Feb 28;154(4):134-141. English, Spanish. doi: 10.1016/j.medcli.2019.08.008. Epub 2019 Nov 23. PMID: 31771858.
20. Mirones I, Moreno L, Patiño-García A, Lizeaga G, Moraleda JM, Toribio ML, Pérez-Martínez A; Grupo de Inmunoterapia y Terapias Avanzadas de la Sociedad Española de Hematología y Oncología Pediátricas; Grupo de Inmunoterapia y Terapias Avanzadas de la Sociedad Española de Hematología y Oncología Pediátricas. Inmunoterapia con células CAR-T en hematooncología pediátrica [Immunotherapy with CAR-T cells in paediatric haematology-oncology]. An Pediatr (Engl Ed). 2020 Jul;93(1):59. e1-59. e10. Spanish. doi: 10.1016/j.anpedi.2019.12.014. Epub 2020 Feb 24. PMID: 32107177.
1Graduanda do Curso de Biomedicina do Centro Universitário das Faculdades Metropolitanas Unidas – FMU, São Paulo, Brasil
2Biomédico, Docente do Curso de Biomedicina do Centro Universitário das Faculdades Metropolitanas Unidas – FMU, São Paulo, Brasil
