TECHNOLOGY AND FORMULATION OF PHYTOCOSMETIC BASED ON Moringa oleífera
REGISTRO DOI: 10.5281/zenodo.8047512
Stephany Maria Rocha Marques¹
Ludimyla Bezerra Souza²
Lucivânia de Paula Sá Martins³
Marcos Andrade Silva4
Lully Gabrielly Silva Alves5
Izabel Cristina Portela Bogéa Serra6
Saulo José Figueiredo Mendes7
Resumo
Desde a antiguidade o ser humano se preocupa com sua aparência externa, em especial com a pele, cada vez mais mulheres e homens buscam se cuidar, com isso, o consumo de cosméticos vem crescendo muito, e com o avanço da indústria, surgem novos produtos e novas linhas de tratamento, uma delas é a dermocosméticos que são produtos que atuam sobre a pele, com recomendações especificas, na qual, a indústria cosmética estabelece benefícios “semelhantes” ao dos medicamentos, onde inúmeras plantas são utilizadas na elaboração desses produtos, essa utilização vem aumentando a cada ano, contribuindo dessa forma para o crescimento e benefício de ambas as partes. Objetivo: Este trabalho teve como objetivo desenvolver uma formulação fitocosmética incorporada com o extrato hidroalcóolico das folhas da espécie vegetal Moringa oleífera. Métodos: Para a realização deste projeto, as folhas da espécie vegetal Moringa oleífera foram coletadas manualmente no município de Lago da Pedra-MA. Após a coleta as folhas foram limpas e passaram pelo processo de secagem a sombra. Para a obtenção do extrato bruto (extrato + solvente), foi utilizado o método de Maceração com Agitação Mecânica (MAM), obtido pela mistura da droga vegetal com solução etanólica (70:30 v/v) durante 7 dias sobre abrigo total da luz e agitação constante. Decorrido o período de maceração, os extratos foram filtrados e submetidos a rotaevaporador (Fisatom, modelo 801), com rotação de 40 RPM, na temperatura de 92-96°C, retirando-se o solvente com consequente concentração do extrato, o mesmo foi armazenado em vidro âmbar, ao abrigo da luz. Resultados: Foi constatado que o fitocosmético a base de Moringa oleífera demostrou características conforme preconiza a Farmacopeia Brasileira 12° edição. Conclusão: Constatou-se que o creme apresentou um bom perfil cosmetológico, com ausência de instabilidades, adequado aos padrões, que o torna ideal para adição de ativos e sua utilização para manipulação de cosméticos/medicamentos.
Palavras-chave: Moringa oleífera. Biotecnologia. Forma farmacêutica.
ABSTRACT
Since antiquity, human beings have been concerned with their external appearance, especially with the skin, more and more women and men seek to take care of themselves, with this, the consumption of cosmetics has been growing a lot, and with the advancement of the industry, new products appear. And new lines of treatment, one of them is dermocosmetics, which are products that act on the skin, with specific recommendations, in which the cosmetic industry establishes benefits “similar” to those of medicines, where numerous plants are used in the preparation of these products, this usage has been increasing every year, thus contributing to the growth and benefit of both parties. Objectives: This work aimed to develop a phytocosmetic formulation incorporated with the hydroethanolic extract of the leaves of the plant species Moringa oleífera. Methods: For the realization of this project, the leaves of the plant species Moringa oleífera were collected manually in the municipality of Lago da Pedra/MA. After collection, the leaves were cleaned and will undergo a drying process in the shade. To obtain the crude extract (extract + solvent), the Maceration with Mechanical Stirring (MAM) method will be used, obtained by mixing the plant drug with ethanolic solution (70:30 v/v) for 7 days under total shelter from light and constant agitation. After the maceration period, the extracts will be filtered and subjected to a rotary evaporator (Fisatom, model 801), with rotation of 40 RPM, at a temperature of 92-96°C, removing the solvent with consequent concentration of the extract, which will be stored in an amber glass, protected from light. Results: It was found that the phytocosmetic based on Moringa oleífera showed characteristics as recommended by the Brazilian Pharmacopoeia 12th edition. Conclusion: It was found that the cream had a good cosmetological profile, with no instabilities, adequate to the standards, which makes it ideal for adding actives and its use for handling cosmetics/medicines.
Keywords: Moringa oleífera. Biotechnology. Pharmaceutical form.
1 Introdução
O mercado brasileiro de produtos de higiene pessoal, perfumaria e cosméticos movimento bilhões de dólares por ano, uma das razões para um volume de mercado tão expressivo se dá em consequência das inovações que vem movimentando o setor, tais como a introdução de novos ingredientes nas formulações dos produtos, incluindo matérias primas vegetais de origem brasileira. Conhecida como a “natureza em extratos” a fito cosmética dedicada ao estudo e aplicação das substâncias de origem vegetal, livre de parabenos, petrolatos, formol e ftalatos, vem ganhando mais espaço na cosmetologia (ABIHPEC, 2008).
Portanto, os fitos cosméticos que são elaborados com matérias-primas vegetais vêm ganhando força no mercado de cosméticos naturais (DE LIMA, CHERUBIM et al., 2020). As plantas medicinais são utilizadas pela população há milhares de anos como alternativa terapêutica para o tratamento de diversas doenças e contra outros tipos de insatisfações do consumidor.
Dessa forma os consumidores buscam por produtos que apresentam elevada qualidade, os quais minimizam os fenômenos de oxidação durante as fases de processamento e armazenamento dos produtos, além dos conjuntos de processos que objetivam eliminar e minimizar a atividade oxidante (DE LIMA, CHERUBIM et al., 2020). Pois as maiores causas do envelhecimento cutâneo é a desorganização do mecanismo de defesa antioxidante, provocando doenças na pele, resultado das condições causadas por esse desequilíbrio como consequências de danos a estruturas nela presentes, como lipídios, proteínas e DNA. (BAUMANN; WOOLERY-LLOYD; FRIEDMAN, 2009).
Dentre as espécies vegetais está a Moringa oleífera que é uma planta crucífera que pertence à família Moringaceae, é comumente chamada de rábano ou árvore de baqueta pelos habitantes locais e é alimento popular em diferentes partes do mundo, crescem em todos os tipos de solo e são resistentes ás doenças e longos período de estiagem, desenvolvendo-se bem em regiões áridas e semiáridas. Devido essas características, são encontradas principalmente na região nordeste do Brasil, nos estados Maranhão, Piauí e Ceará, é consumida não apenas por seus valores nutricionais, mas também por seus benefícios médicos. Atualmente, M. oleífera é relatada para melhorar uma ampla gama de funções biológicas, diferentes partes dessa espécie vegetal, como casca, folhas, frutos e sementes, têm sido utilizadas popularmente em diversas regiões brasileiras, na forma de chás, decocções, infusões lambedores/xarope e maceração, para inúmeros fins terapêuticos como: anti-inflamatórias, anticancerígenas, hepatoprotetoras e neuro protetoras (SANTOS, 2020; KOU et al., 2018).
Estudos têm investigado a composição fitoquímica e bioatividade dessa espécie vegetal, e em termos de composição química existe uma diversidade de classes de metabólicos secundários e compostos: flavonoides, carotenoides, licopeno, ácido ascórbico e antocianinas nas folhas. Pesquisas revelam atividades terapêuticas de diferentes extratos preparados a partir da espécie vegetal Moringa oleífera, tais como: atividade antioxidante e anti-inflamatória (VAST; GUPTA, 2017, MA et al., 2020).
Estudos também sugerem uma diminuição da expressão gênica e a produção de marcadores inflamatórios no sistema celular de macrófagos RAW (WATERMAN et al., 2014). Especificamente, o extrato de M.o diminuiu expressão de iNOS E IL-1β e a produção de NO e TNF-α a 1 e 5 µM (WATERMAN et al., 2014).
Dessa forma, considerando que a espécie vegetal Moringa oleífera apresentou atividade antioxidante, foi realizado o desenvolvimento de uma formulação pela incorporação do extrato de Moringa oleífera, assim fornecendo um produto seguro e eficaz.
2 Métodos
2.1 Coleta, secagem e moagem
As folhas da Moringa oleífera foram devidamente coletadas manualmente no município de Lago da Pedra, Maranhão. Após a coleta as folhas foram limpas e passaram pelo processo de secagem à sombra. Para a obtenção do extrato bruto (extrato + solvente), foi utilizado o método de Maceração com Agitação Mecânica (MAM), obtido pela mistura da droga vegetal com solução etanólica (70:30 v/v) durante 7 dias sobre abrigo total da luz e agitação constante. Decorrido o período de maceração, os extratos foram filtrados e submetidos ao rotaevaporador (Fisatom, modelo 801), com rotação de 40 RPM, na temperatura de 92-96°C, retirando-se o solvente com consequente concentração do extrato. O extrato seco foi armazenado em um vidro âmbar, ao abrigo da luz.
2.2 Prospecção fitoquímica
A caracterização fitoquímica do extrato foi realizada com o intuito de estabelecer uma comparação entre os compostos presentes no extrato de M.o, relacionado principalmente aos metabólicos fenólicos aos quais são atribuídas as propriedades antioxidantes. Os resultados foram considerados positivos pela formação de precipitados e surgimento de coloração e espuma, sendo classificados em: positivo fraco (+), positivo moderado (++), positivo/forte (+++) e negativo (-) pela ausência dos mesmos. A metodologia utilizada seguiu Mattos (1997), Simões et al., (2014) e Miranda et al., (2013).
2.3 Estudo da atividade antioxidante
O potencial antioxidante do extrato hidroalcóolico foi determinado baseado na avaliação da atividade sequestrante de radical 1,1-difenil-2-picrilhidrazil (DPPH), descrito por Koleva et al., (2002). O DPPH é radical estável muito utilizado nos estudos antioxidantes, que apresenta máxima de absorção em 517nm, sendo este o comprimento de onda que foi utilizado para avaliar a ação das amostras.
2.4 Manipulação fitocosmética
O desenvolvimento da formulação fitocosmético considerou o caráter de hidratação emoliente e o poder de penetração no extrato córneo, uma vez que a proteção radicalar, é mais eficaz se ocorrer penetração das substâncias ativas com propriedades antioxidantes em camadas mais profundas do extrato córneo. Além disso, a formulação contou com óleo vegetal de coco babaçu, que é amplamente encontrado na flora Maranhense. A composição qualitativa do fito cosmético está representada na Tabela 1.
TABELA 1: Componentes da formulação do fito cosmético.
Componentes Função Cera de coco Emulsificante Óleo vegetal de coco babaçu Emoliente e Hidratante Óleo resina de alecrim Antioxidante Nipaguard SCE Conservante Extrato de M.o Ativo vegetal
Após a manipulação, o creme foi envasado em recipiente de plástico fosco e armazenado a temperatura ambiente ao abrigo da luz.
2.5 Estudo de estabilidade preliminar
A estabilidade preliminar é um estudo de triagem para orientar na escolha da formulação, empregando-se condições extremas de temperatura com objetivo de acelerar possíveis reações (BRASIL 2019). A formulação desenvolvida foi submetida aos testes de estabilidade preliminar, sendo eles: estresse térmico e centrifugação, todos foram realizados em triplicada (ISSAC et al., 2008).
2.5.1 Estresse térmico
Em embalagem adequada a amostra é acondicionada e deve ser submetida a condições de baixas e altas temperaturas por um tempo determinado em intervalo de tempo para detecção de sinais de instabilidades (ISSAC et al., 2008).
2.5.2 Centrifugação
Em tubo de ensaio para centrífuga, cônico, graduado, de 10g de capacidade, devem ser pesados em balança semi-analítica, a quantidade suficiente da amostra a ser analisada, os quais devem ser submetidos a rotações crescentes de 980, 1800 e 3000 RPM, em centrífuga, durante trinta minutos em cada rotação, a temperatura ambiente. A não ocorrência de separação de fases não assegura sua estabilidade, somente indica que o produto pode ser submetido, sem necessidade de reformulação aos testes de estabilidade (ISSAC et al., 2008).
2.6 Controle de qualidade físico-químico da formulação fitocoméstica
Após a formulação e durante os testes de estabilidade foram avaliados os parâmetros físico-químico da formulação, a saber, características organolépticas, pH, determinação da densidade e espalhabilidade (BRASIL, 2008).
2.6.1 Análise das características organolépticas
Após a manipulação os procedimentos utilizados para avaliar as características organolépticas do produto, detectáveis pelos órgãos dos sentidos foram: aspecto, cor, odor, sabor e textura. Onde fornecem parâmetros que permitem identificar qualquer instabilidade, alteração de cor, separação de fases, precipitação e turvação, seguindo o Guia de Controle de Qualidade de Produtos Cosméticos (BRASIL, 2008).
TABELA 2: Avaliação das características organolépticas.
(N) NORMAL, aspecto homogêneo, odor característico, coloração normal e textura lisa. (M) MODERADO, aspecto não totalmente heterogêneo, odor levemente modificado e pequenas presenças de grumos. (A) ALTERADO, aspecto heterogêneo, odor fortemente alterado, grumos aparentes, separação de fases e turvação.
Legenda: próprio autor. Fonte: próprio autor.
2.6.2 pH
É o logaritmo negativo da concentração molar de íons de hidrogênio. Representa convencionalmente a acidez ou a alcalinidade de uma solução, a escala de pH vai de 1 (ácido) a 14 (alcalino), sendo que o valor 7 é considerado pH neutro. O mesmo é determinado por potenciômetro, pela determinação da diferença de potencial entre dois eletrodos, o de referência e o de medida, imersos na amostra a ser analisada, e dependem da atividade dos íons de hidrogênio na solução. Antes do uso, deve-se verificar a limpeza e determinar a sensibilidade do eletrodo, utilizando-se soluções tampão de referência e, quando aplicável, ajustando-se o equipamento. Se o produto é um sólido ou semissólido, recomenda-se preparar uma solução/dispersão/suspensão aquosa da amostra em uma concentração preestabelecida e determinar o pH da mistura com o eletrodo apropriado. Em alguns casos, a medição pode ser feita diretamente na amostra (BRASIL, 2008).
2.6.3 Densidade
Densidade é a relação entre a massa e o volume, existem várias formas de densidade, no teste desta formulação foi utilizado a forma de densidade aparente que é a relação direta entre a massa de uma amostra e seu volume especifico. A mesma pode ser medida utilizando-se picnômetro metálico, picnômetro de vidro, densímetro e densímetro digital. Deve-se pesar uma quantidade da amostra e introduzi-la na proveta, tampando-a em seguida. Para os produtos na forma de pó, é necessário acomodar a amostra, eliminando o ar entre as partículas por meio de leves batidas em movimentos verticais, padronizados, com altura fixa, sobre uma superfície lisa, até obter volume constante (BRASIL, 2008).
A densidade, foi calculada através da fórmula 1:
Fórmula 1:

2.6.4 Espalhabilidade
A determinação da espalhabilidade foi realizada de acordo com metodologia descrita por Knorst (1991), onde uma placa molde circular de vidro com diâmetro 20 cm e 0,2 mm de espessura é colocada sobre a placa suporte de vidro (20 cm x 20 cm), sob estas placas posicionou-se uma folha de papel milimetrado. A amostra é introduzida no orifício da placa e a superfície é nivelada com uma espátula, a placa molde é cuidadosamente retirada, e sobre a amostra é colocada uma placa de acrílico de peso pré-determinado. Após um minuto é calculada a superfície abrangida, através da medição do diâmetro em duas posições opostas, com posterior cálculo do diâmetro médio. Este procedimento é repetido acrescentando-se novas placas em intervalos de minutos, registrando-se a cada determinação a superfície abrangida e o peso da placa adicionada até a obtenção de valores constantes (ZANIN et al., 2001).
A espalhabilidade (Ei), foi calculada através da fórmula 2:
Fórmula 2

3 Resultados
3.1 Preparação do extrato hidroalcóolico
O extrato hidroalcoólico da Moringa oleífera foi preparado, de acordo com as instruções de coleta, secagem, maceração, extração e filtração, fornecidas nos itens 2.1 e 2.2, apresentando: odor e aspecto característico e coloração verde claro.
3.2 Prospecção fitoquímica
A prospecção fitoquímica das folhas da espécie vegetal Moringa oleífera, foi realizada conforme a metodologia de Mattos (1997), e os resultados obtidos baseiam-se nas reações qualitativas de precipitação e mudança de coloração. Para determinação das classes de compostos fitoquímicas presentes, foram realizados os seguintes testes/reações: saponinas, alcaloide e antraquinona, a saponina apresentou-se em demasia e com presença de espuma e coloração leve, já a antraquinona teve presença moderada e coloração vermelho escuro e ausência de alcaloide. Conforme descrito na Tabela 3.
TABELA 3: Resultado da prospecção fitoquímica.
METABÓLITOS RESULTADO Fenóis – Taninos Hidrolisáveis – Flavonoides + Antocianidinas e Antocianinas + Flavonas e Xantonas + Chalconas e Auronas + Flavonóis + Leucoantocianidinas – Catequinas (taninos condensados) ++ Flavononas – Saponinas ++ Alcaloide – Antraquinona +
Legenda: (+) fraco; (++) moderado; (+++) forte; (-) ausente – Fontes: Mattos (1997)
3.3 Avaliação da atividade antioxidante
A atividade sequestradora do radical livre DPPH, dos extratos glicólicos e hidroalcoólicos foram obtidas conforme descrito por Brand- Williams et al., (1995), com modificações. Para a análise das amostras, adicionou-se 1,5 ml da solução metanólica de DPPH (6×10-5M), uma alíquota de 0,5 ml das amostras contendo diferentes concentrações de cada extrato. As leituras foram realizadas em espectrofotômetro 517nm, após 5; 10; 15; 30; 45; e 60 minutos do início da reação. Todas as determinações foram realizadas em triplicada e acompanhadas de um controle (sem antioxidante). Os cálculos foram realizados conforme a fórmula 3, e os resultados obtidos na Tabela 4, abaixo:
Fórmula 3:
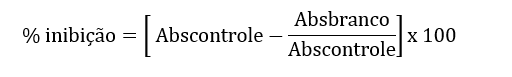
Tabela 4: Resultado da DPPH
EXTRATO % DE INIBIÇÃO EHA 71% ± 0,321 EG 10% 83% ± 0,431
Legenda: EHA= Extrato hidroalcoólico; EG 10%= Extrato glicólico 10%. Os resultados representaram a média ± erro padrão da média (n=3).
3.4 Formulação fito cosmética
Medir 52,14ml de agua destilada para quantidade suficiente e transferida para um béquer, junto a 1,8ml de glicerina bidestilada, em seguida, o béquer com os componentes da fase aquosa foi submetido ao aquecimento e a temperatura em torno de 60°C. Em um outro béquer foram adicionados os componentes da fase oleosa, a cera de coco 4,8g, óleo de coco babaçu 0,6 ml e o óleo de resina de alecrim 0,06ml, depois foram aquecidos e retirados da chapa aquecedora após total solubilização. A temperatura máxima a ser alcançada deve estar em 55°C a 60°C, pois a cera de coco não suporta temperaturas elevadas. Após a solubilização, e quando ambas as fases estiverem a mesma temperatura (aprox. 60°C) adiciona-se a fase aquosa sobre a fase oleosa. Ao final do processo de esfriamento, observar a temperatura para que em torno de 40°C seja adicionado 6 gotas de Nipaguard, conservante da fórmula. Assim que atingir a temperatura ambiente, 0,6ml do extrato da Moringa oleífera foram adicionados. Os cremes feitos com a cera emulsificante demoram aproximadamente 24 horas para mostrar a sua textura final. Contudo, após esse intervalo, é possível obter um creme leve e macio, na pele atuará como lubrificante da superfície, assim, conferindo a mesma uma aparência macia e suave. Processo do preparo da manipulação nas figuras (1-9) abaixo.

3.5 Estudos da estabilidade preliminar
A estabilidade preliminar é um estudo de triagem para orientar na escolha da formulação, consiste na realização do teste na fase inicial do desenvolvimento do produto (BRASIL, 2004).
3.5.1 Estresse térmico
Foi pesado aproximadamente 3g da amostra onde foram submetidas a aquecimento em banho maria à 40, 50, 60 e 70°C, mantiveram-se por trinta minutos em cada temperatura, apresentando-se estável ao final.
3.5.2 Centrifugação
Foi pesado aproximadamente 3g da amostra e submetida a 3000 RPM durante trinta minutos, a amostra permaneceu estável, onde não houve precipitação e nem separação de fases.
3.6 Controle de qualidade físico-químico da formulação cosmética
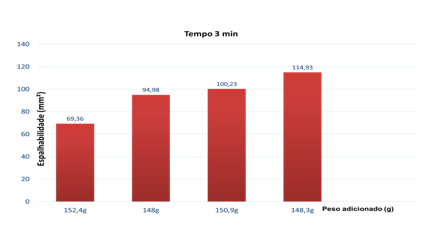
Os testes de pH, densidade, características organolépticas e espalhabilidade foram realizados após a manipulação do fito cosmético, os resultados estão expressos na Tabela 6 e no Gráfico 1.
TABELA 6: pH, densidade e características organolépticas do creme à base da M.o
CREME M.o pH DENSIDADE C.ORGANOLÉPTICAS Dia 0 6,0 1g/cm³ S/A Dia 07 6,0 1g/cm³ S/A Dia 15 6,0 1g/cm³ S/A Dia 30 6,0 1g/cm³ S/A
Legenda: S/A= sem alteração
Durante o processo do controle de qualidade físico-químico da formulação os testes acima se apresentaram dentro das normais exigidas.
GRÁFICO 1: Resultado da espalhabilidade
4 Discussão
Diversas plantas são utilizadas na elaboração de dermocosmético, pois são conhecidas pelas suas substâncias ativas, devido as suas presentes características antioxidantes e anti-inflamatórias. Portanto, os fito cosméticos que são elaborados com matérias-primas vegetais vem ganhando força no mercado de cosméticos naturais.
Os vegetais apresentam, em sua constituição, vários compostos com ação antioxidante, a quantidade e o perfil variam em função do tipo, da variedade e do grau de maturação do vegetal, bem como das condições climáticas e edáficas do cultivo. Para avaliar a capacidade antioxidante é necessária a extração desses compostos (SILVA et al., 2013). A Moringa oleífera, é uma planta crucífera, é alimento popular em diferentes partes do mundo, crescem em todos os tipos de solo e são resistentes às doenças e longos período de estiagem, desenvolvendo-se bem em regiões áridas e semiáridas é consumida não apenas por seus valores nutricionais, mas também por seus benefícios médicos para inúmeros fins terapêuticos como: anti-inflamatórias, anticancerígenas, hepatoprotetoras e neuro protetoras (SANTOS, 2020; KOU et al., 2018).
Nesse trabalho, buscou-se estudar a atividade antioxidante da espécie vegetal Moringa oleífera através de uma formulação cosmética e seus respectivos testes. O objetivo foi determinar os principais metabólicos secundários presentes nas folhas da Moringa oleífera e avaliar suas propriedades antioxidantes.
Em relação a prospecção fitoquímica pode-se evidenciar a presença dos seguintes metabólicos secundários no extrato de M.o: flavonoides, catequinas (taninos condensados) antocianidinas e antocianinas, flavonas e xantonas, chalconas e auronas e flavonóis, o que praticamente explica a atividade antioxidante, pelos seus compostos fenólicos, os quais podem apresentar bioativos com diferentes atividades farmacologias. Os constituintes fitoquímicas presentes no extrato foram detectados por reações colorimétricas e precipitações de maneira qualitativa. Embora, neste estudo tenha demonstrado ausência para fenóis, taninos hidrolisáveis, leucoantocianidinas, flavononas e alcaloides, outros estudos anteriores esses metabólicos foram identificados, ou seja, esses resultados negativos apresentados nessa pesquisa, não implicam na sua ausência, sendo provável que as quantidades dos mesmos estejam pequenas para detecção, ou seja, a concentração de princípios ativos na planta depende do controle genético e dos estímulos proporcionados pelo meio (SARAIVA et al., 2018). Portanto, dentre os metabólicos presentes na Moringa o. os flavonoides e os taninos em estudos e testes tem sido relatado como os principais responsáveis pela atividade antioxidante, ou seja, são propriedade-chave na prevenção e/ou redução de doenças crônicas e ligados ao envelhecimento, que estão relacionadas com estresse oxidativo, como doenças cardiovasculares, câncer e doenças neurodegenerativas (SARAIVA et al., 2018). Outros estudos, ainda, demostram, que nosso organismo possui substâncias que têm por objetivo estipular um equilíbrio harmônico entre a presença das moléculas oxidantes, antioxidantes e a pele, está última, por sua extensa área de função protetora do organismo ao meio, está exposta ao ataque radicalar, sendo a defesa antioxidante requisitada, desta forma, é preocupação consistente da cosmetologia prevenir e atenuar o envelhecimento cutâneo por meio de busca e estudo de substâncias antioxidantes eficazes, que são oferecidas em produtos de cosméticos aos consumidores (KOCH et al., 2019).
Neste presente estudo avaliamos a atividade antioxidante pelo método do DPPH (2,2-difenil-1-picrilhidrazil), onde é baseado na captura dos radicais livres DPPH por antioxidantes. O extrato hidroetanólico e glicólico apresentaram uma porcentagem de inibição do DPPH de 71% (EHA) e 83% (EG), ou seja, a planta apresentou uma boa atividade que pode ser atribuída a presença de compostos: flavonoides e catequinas (taninos condensados). Em outros estudos, as quantificações desses compostos fenólicos totais apresentaram resultados que foram obtidos do extrato hidroalcoólico com valores próximos aos resultados encontrados neste trabalho, esse resultado monstra que os fenólicos presentes em folha de Moringa oleífera são preferencialmente extraídos com solvente mais polares devido a maior afinidade, como no uso da extração com apenas água ou mistura de água+etanol. O uso de água e/ou etanol na extração de compostos fenólicos é responsável por extrair os metabólicos encontrados nos testes realizado nesse estudo (SILVA et al., 2020). Pesquisas recente do extrato da Moringa. o apresentaram maior concentração de compostos fenólicos totais, onde, também são responsáveis pela maior capacidade de sequestro do radical DPPH indicando um potencial antioxidante (SILVA et al., 2020). Com isso, observou-se que as folhas da espécie vegetal Moringa oleífera possuem atividade antioxidante, e por fim, outros estudos aprofundados devem ser feitos com essa planta para melhor avaliação de suas atividades biológicas.
Já a formulação demonstrou características conforme preconiza a Farmacopeia Brasileira 12° edição. Após a manipulação o creme manteve-se estável, com boas características visuais, e pode-se perceber uma cor verde claro, aspecto concentrado e firme, e odor característico da formulação.
O pH é o logaritmo negativo da concentração molar de íons de hidrogênio, representa convencionalmente a acidez ou alcalinidade de uma solução. A escala de pH vai de 1 (ácido) a 14 (alcalino), sendo que o valor 7 é considerado pH neutro. O creme à base da M.o apresentou pH constante 6,0 em todos os tempos, dessa forma, sendo estável em todos os testes que a amostras foi submetida. Sendo, assim, a pele apresenta pH levemente ácido, que contribui para que ocorra proteção bactericida e fúngica em sua superfície (MONTEIRO et al., 2013).
As características organolépticas fornecem parâmetros que permitem avaliar, de imediato, o estado em que se encontra a amostra por meio de análise comparativas, com objetivo de verificar alterações como: separação de fases, precipitação e turvação, permitindo o reconhecimento primário do produto. Utilizando sempre uma amostra de referência, recentemente elaborada, ou uma amostra do produto, armazenada a temperatura adequada, para evitar modificações nas propriedades organolépticas. Nossos resultados foram bem satisfatórios, pois em todas as temperaturas submetidas e nos tempos sugeridos pelo guia de controle de qualidade produtos cosméticos, a formulação não apresentou nenhuma das alterações citadas (GUIA DE CONTROLE DE QUALIDADE DE PRODUTOS COSMÉTICOS, 2008).
A densidade é a relação entre a massa e o volume, existem várias formas de densidade, no teste desta formulação foi utilizado a forma de densidade aparente, que é a relação direta entre a massa de uma amostra e seu volume específico, medido em proveta graduada. O teste de densidade pode indicar alguns problemas quanto a solubilidade de algum componente da fórmula ou a mal homogeneização que pode interferir nas determinações. Nos resultados apresentados na tabela 6, a densidade apresentou dentro dos valores de referências determinados e não apresentou alterações quando submetido aos testes (SILVA, LOPES, 2017).
A espalhabilidade é definida como a expansão de uma formulação semissólida sobre uma superfície após um determinado período (FELTKAMP et al., 1983), é uma das características essenciais das formas farmacêuticas destinadas à aplicação tópica (KNORST, 1991). O gráfico 1, acima, faz demonstração da avalição da espalhabilidade, conforme as formulações e condições de temperatura armazenada no período de 30 dias. O creme apresentou uma boa estabilidade e dentro dos valores de referências esperados.
5 Conclusão
O creme apresentou um bom perfil cosmetológico, com ausência de instabilidades, adequado aos padrões que o torna ideal para adição de ativos e sua utilização para manipulação de cosmético/medicamentos. Dessa forma, através desse estudo de pesquisa foi possível elucidar as composições fitoquímicas e propriedades antioxidantes do extrato de Moringa oleífera, bem como elaboração de um fito cosmético natural a base do extrato com propriedades antioxidantes, que possam beneficiar diretamente a população Ludovicense e ser distribuída gratuitamente pela Farmácia Universitária Drª. Terezinha Rêgo, Universidade Ceuma.
Referências
ABIHPEC (2008). PANORAMA DO SETOR DE HIGIENE PESSOAL, PERFUMARIA E COSMÉTICOS, ABIHPEC- Associação Brasileira da Indústria de Higiene Pessoal, Perfumaria e Cosméticos, 08 de Agosto de 2008, São Paulo, disponível em: www.abihpec.org.br acessado em 01/11/2019.
Agência Nacional de Vigilância Sanitária. Guia de Establidade de Produtos Cosméticos/ Agência Nacional de Vigilância Sanitária. 1. Ed. Brasília: ANVISA, 2004.
BAUMANN, L; WOOLERY-LLOYD, H.; FRIEDMAN, A. “Natural” ingredients in cosmetic dermatology. Jornal of drugs in dermatology: JDD, v.8, n. 6 Suppl, p. s5-9 2009.
Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Guia de Controle de Qualidade de Produtos Cosméticos: Uma abordagem sobre os Ensaios Físicos e Químicos. 2. Ed. 120.p. Brasília 2008.
Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. RDC n° 318, de Novembro de 2019. Diário Oficial da União Brasília, DF 2019.
DA SILVA, T. M.; LOPES, L. L. B. T. Caracterização físico-química de uma formulaçao anti-idade contendo ácido glicólico, produzida em farmácias de manipulação de Sete Lagoas- MG. Revista Brasileira de Ciências da Vida, v. 5, n. 5, 2017.
DE LIMA CHERUBIM, D. J.; MARTINS, C. V. B.; FARINA, L. O.; DE LUCCA, R. A. S. Polyphenols as natural antioxidants in cosmetics applications. Journal of Cosmetic Dermatology, v. 19, n. 1, p. 33-37, 2020.
FELTKAMP, H.; FUCHS, P.; SUCKER, H. (Ed.). Pharmazeutische qualitaetskontrolle. Thieme, 1983.
ISSAC, V. L. B.; CEFALI, L. C.; CHIARI, B. G.; OLIVEIRA, C. C. L. G.; SALGADO, H. R. N.; CORREA, M. A. Protocolo para ensaios físico-químicos de estabilidade de fitocosméticos. Journal of Basic and Applied Pharmaceutical Sciences, v. 29, n. 1, 2008.
KNORST, M. T. Densenvolvimento tecnológico de forma farmacêuticas plástica contendo extras concentrado de Achyrocline satureioides (Lam.) DC. Compositae (Marcela). 1991.
KOLEVA. I. I.; VAN BEEK, T. A.; LINSSEN, J. P. H.; GROOT, A.; EYSTATIEVA, L. N. Screening of plant extracts for antioxidant activity: a comparative study on three testing methods. Phytochemical Analysis, v. 13, n. 1, p. 8-17, 2002.
KOU, X.; LI, B.; OLAYANJU, B.; DRAKE, J. M.; CHEN, N. Nutraceutical or pharmacological potential of Moringa oleífera Lam. Nutrients, v. 10, n. 3, p. 343, 2018.
MA, Z. F.; AHMAD, J.; ZHANG, H.; KHAN, I.; MUHAMMAD, S. Evaluation of phytochemical and medicinal properties of Moringa (Moringa oleífera) as a potential functional food. South African Journal of Botany, v. 129, p. 40-46, 2020.
MATTOS, F. J. A. Introdução à Fitoquímica Experimental. 2. ed. Fortaleza: Edições UFC, 141p, 1997.
MIRANDA, G. S.; SANTANA, G. S.; MACHADO, B. B.; COELHO, F. P.; CARVALHO, C. A. Atividade antibacteriana in vitro de quarto espécies vegetais em diferentes graduações alcoólicas. Revista Brasileira de Plantas Medicinais, v. 15, n. 1, p. 104-111, 2013.
MONTEIRO, S. A.; VALARINI, M. F. C.; CHORILLI, M.; VENTURINI, A.; LEONARDI, G. R. Atividade Antioxidante do Extrato Seco de Cacau Orgânico (Theobroma cacao) – Estudo de Estabilidade e Teste de Aceitação de Cremes Acrescidos Deste Extrato. Revista de Ciências Farmacêuticas Básica e Aplicada, v. 34, n. 4, 2013.
SANTOS, L. M.; SILVA, P. M.; MOURA, M. C.; JUNIOR, A. C.; AMORIM, P. K.; PROCÓPIO, T. F.; COELHO, L. C. B. B.; SILVA, L. C. N.; PAIVA, P. M. G.; SANTOS, N. D. L.; NAPOLEÃO, T. H. Anti-Candida activity of the water-soluble lectin from Moringa oleífera seeds (WSMoL). Journal de Mycologie Médicale, p.101074, 2020.
SARAIVA, L. C. F.; MAIA, W. M. N.; LEAL, F. R.; MAIA FILHO, A. L. M.; FEITOSA, C. M. Triagem fitoquímica das folhas de Moringa olífera. Boletim Informativo Geum, v. 9, n. 2, p. 12, 2018.
SILVA, M.; ARAÚJO, M.C.; TORMEN, L.; FRANCISCO, C. T. P.; BAINY, E. M. Avaliação da capacidade antioxidante e antimicrobiana de extratos de folhas de Moringa olífera, 2020.
SILVA, I. C. A.; ALEIXO, Á. A.; ALEIXO, A. M.; FIGUEIREDO, A. P.; LEMUCHI, M. O.; LIMA, L. A. R. Análise fitoquímica e atividade antioxidante do extrados hidroetanólico das folhas de Psidium guajava L. (Goibeira). BBR- Biochemistry and Biotechnology Reports, 2 (2esp), 76-78, 2013.
SIMÕES, C. M. O.; SCHENKEL, E. P.; GOSMANN, G.; MELLO, J. C. P.; MENTZ, L. A.; PETROVICK, P. R. Farmacognosia: da planta ao medicamento. 5. ed. Porto Alegre/ Florianópolis: Editora da UFSC, 1102p, 2004.
VATS, S.; GUPTA, T. Evaluation of bioactive compounds and antioxidant potential of hydroethanolic extract of Moringa oleífera Lam. From Rajasthan, India. Physiology and molecular biology of plants, v. 23, n. 1, p. 239-248, 2017.
WATERMAN, C.; CHENG, D. M.; ROJAS-SILVA, P.; POULEV, A.; DREIFUS, J.; LILA, M. A.; RASKIN, I. Stable, water extractable isothiocyanates from Moringa oleífera leaves attenuate inflammation in vitro. Phytochemistry, v. 103, p. 114-122, 2014.
ZANIN, S. M. W.; MIGUEL, M. D.; CHIMELLI, M.; DALMAZ, A. C. Parâmetros físicos no estudo da estabilidade das emulsões. Visão Acadêmica, 2 (2). 2001.
1 Graduanda em Farmácia. Universidade Ceuma (UNICEUMA). R. Anapurus, 1, Renascença II, São Luís – MA, CEP: 65075-120. E-mail: stephanyrocha25@gmail.com
2 Graduanda em Farmácia. Universidade Ceuma (UNICEUMA). R. Anapurus, 1, Renascença II, São Luís – MA, CEP: 65075-120. E-mail: ludimyla.sousa.br@gmail.com
3 Graduanda em Farmácia. Universidade Ceuma (UNICEUMA). R. Anapurus, 1, Renascença II, São Luís – MA, CEP: 65075-120. E-mail: lucivaniamartins7@outlook.com
4 Graduando em Farmácia. Universidade Ceuma (UNICEUMA). R. Anapurus, 1, Renascença II, São Luís – MA, CEP: 65075-120. E-mail: marcosandradesilva68@gmail.com
5 Mestranda em Biologia Microbiana. Universidade Ceuma (UNICEUMA). R. Anapurus, 1, Renascença II, São Luís – MA, CEP: 65075-120. E-mail: lully021481@ceuma.com.br
6 Doutora em Biotecnologia. Universidade Ceuma (UNICEUMA). R. Anapurus, 1, Renascença II, São Luís – MA, CEP: 65075-120. E-mail: izabogea@uol.com.br
7 Doutor em Biotecnologia. Universidade Ceuma (UNICEUMA). R. Anapurus, 1, Renascença II, São Luís – MA, CEP: 65075-120. E-mail: saulo.mendes@ceuma.br
