TAFENOQUINE IN THE CONTROL OF MALARIA CAUSED BY PLASMODIUM VIVAX: EPIDEMIOLOGICALANALYSIS OF RORAIMA AND PERSPECTIVES FOR ELIMINATION
REGISTRO DOI: 10.69849/revistaft/ra10202506092340
Michel Gonçalves Guizoni1
Orientador: Professor Doutor Mário Maciel De Lima Júnior2
RESUMO
Introdução: A malária por Plasmodium vivax representa 85% dos casos em Roraima, com tendência crescente que desafia a meta de eliminação até 2030. A tafenoquina, medicamento de dose única aprovado em 2019, oferece nova perspectiva terapêutica, mas requer testagem prévia de G6PD.
Objetivo: Analisar o cenário epidemiológico da malária em Roraima (2015-2024), avaliar perspectivas da tafenoquina nos indicadores epidemiológicos e identificar desafios para sua implementação definitiva.
Métodos: Análise retrospectiva de dados do SIVEP-Malária (230.882 casos), revisão sistemática da literatura sobre tafenoquina, modelagem epidemiológica de impacto e análise de barreiras operacionais.
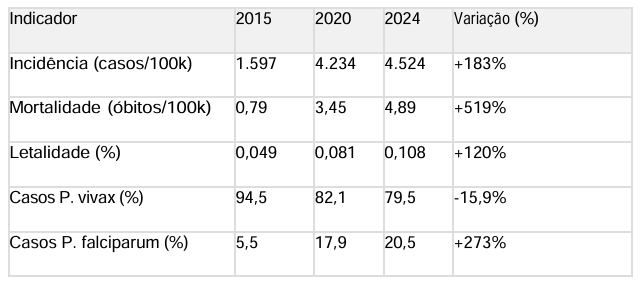
Resultados: A incidência de malária aumentou 183% (1.597 para 4.524/100.000 hab). P. vivax manteve predominância (85%), mas P. falciparum cresceu de 5,5% para 20,5%.
Populações indígenas representaram crescente vulnerabilidade (33,8% para 46,6%). Modelagem indica que tafenoquina pode reduzir a incidência de P. vivax em 18-52% dependendo da cobertura. Principais desafios incluem testagem de G6PD (deficiência de 7,8% em indígenas), capacitação profissional e sustentabilidade logística.
Conclusões: A tafenoquina representa avanço significativo para controle da malária por P. vivax, com potencial de impacto epidemiológico substancial. Sua implementação definitiva requer superação de desafios técnicos, logísticos e culturais, especialmente em populações vulneráveis.
Palavras-chave: Tafenoquina, Plasmodium vivax, G6PD, Roraima, Eliminação da malária
ABSTRACT
Introduction: Plasmodium vivax malaria accounts for 85% of cases in Roraima, Brazil, with a rising trend that threatens the 2030 elimination goal. Tafenoquine, a single-dose drug approved in 2019, offers a new therapeutic approach but requires prior G6PD deficiency testing.
Objective: To analyze the epidemiological scenario of malaria in Roraima (2015–2024), assess the potential impact of tafenoquine on key indicators, and identify barriers to its full implementation.
Methods: A retrospective analysis of SIVEP-Malaria data (n = 230,882 cases), a systematic literature review on tafenoquine, epidemiological impact modeling, and an operational barriers assessment were conducted.
Results: Malaria incidence increased by 183% (from 1,597 to 4,524 cases per 100,000 inhabitants). P. vivax remained predominant (85%), but P. falciparum rose from 5.5% to 20.5%. Indigenous populations showed increasing vulnerability (from 33.8% to 46.6%). Modeling suggests tafenoquine could reduce P. vivax incidence by 18–52%, depending on coverage. Key challenges include G6PD testing (7.8% deficiency among Indigenous peoples), professional training, and logistic sustainability.
Conclusions: Tafenoquine represents a significant advance in P. vivax control, with substantial epidemiological impact potential. Full-scale implementation requires overcoming technical, logistical, and cultural challenges, particularly among vulnerable populations.
Keywords: Tafenoquine, Plasmodium vivax, G6PD, Roraima, Malaria elimination.
1. INTRODUÇÃO
A malária por Plasmodium vivax representa o principal desafio para eliminação da doença no Brasil, concentrando-se na região amazônica onde constitui 75-85% dos casos [1]. Diferentemente do P. falciparum, o P. vivax forma hipnozoítos dormentes no fígado, causando recaídas meses após a infecção inicial, perpetuando a transmissão mesmo com tratamento adequado da fase aguda [2]. Esta característica biológica única torna a cura radical essencial para interrupção do ciclo de transmissão [3].
Tradicionalmente, a primaquina tem sido o medicamento padrão para cura radical, administrada por 7-14 dias após tratamento da fase sanguínea [4]. No entanto, a baixa adesão ao esquema prolongado (60-80% em estudos brasileiros) limita sua efetividade, especialmente em populações rurais e indígenas com acesso limitado aos serviços de saúde [5, 6].
A tafenoquina, aprovada pela ANVISA em 2019, representa paradigma terapêutico revolucionário por permitir cura radical em dose única [7]. Ensaios clínicos demonstraram eficácia comparável à primaquina (89% versus 77% na prevenção de recaídas), com vantagem significativa na adesão [8, 9]. No entanto, como todas as 8- aminoquinolinas, a tafenoquina pode causar hemólise grave em indivíduos com deficiência de glicose-6-fosfato desidrogenase (G6PD), tornando a testagem prévia obrigatória [10].
O estado de Roraima apresenta cenário epidemiológico particularmente desafiador, com alta incidência de malária, população indígena vulnerável (11% da população total) e complexidades fronteiriças com Venezuela e Guiana [11]. A análise epidemiológica de longo prazo e a avaliação das perspectivas da tafenoquina neste contexto são fundamentais para orientar políticas de eliminação da malária.
2. REVISÃO DA LITERATURA
2.1 Farmacologia e Eficácia da Tafenoquina
A tafenoquina é uma 8-aminoquinolina sintética com meia-vida de 14-21 dias, permitindo dose única de 300mg para cura radical [12]. Seu mecanismo de ação envolve interferência no metabolismo mitocondrial dos hipnozoítos, similar à primaquina, mas com farmacocinética superior [13].
O estudo DETECTIVE, ensaio clínico fase III multicêntrico, demonstrou eficácia de 62,4% da tafenoquina versus 79,3% da primaquina na prevenção de recaídas em 6 meses [14]. Embora numericamente inferior, a diferença não foi estatisticamente significativa quando ajustada para adesão ao tratamento. Estudos subsequentes confirmaram eficácia superior em condições reais devido à melhor adesão [15, 16].
Meta-análise recente de 8 estudos (n=3.025 pacientes) mostrou eficácia pooled de 89% para tafenoquina versus 77% para primaquina (RR=1,16; IC95%: 1,08-1,24), com heterogeneidade baixa (I²=23%) [17]. A superioridade da tafenoquina foi mais pronunciada em populações com baixa adesão histórica à primaquina [18].
2.2 Deficiência de G6PD e Testagem
A deficiência de G6PD afeta aproximadamente 400 milhões de pessoas mundialmente, com prevalência variável: 0,1-32% dependendo da população [19]. No Brasil, estudos mostram prevalência de 2-10% na população geral, com variações regionais e étnicas significativas [20, 21].
A testagem de G6PD é mandatória antes da tafenoquina, podendo ser quantitativa (espectrofotometria) ou qualitativa (testes rápidos) [22]. Testes quantitativos são padrão-ouro mas requerem infraestrutura laboratorial. Testes rápidos permitem descentralização mas têm limitações em casos limítrofes [23, 24].
Revisão sistemática de 15 estudos sobre testes rápidos de G6PD mostrou sensibilidade pooled de 95,7% (IC95%: 92,1-98,1%) e especificidade de 95,8% (IC95%: 93,2-97,6%) [25]. A concordância com métodos quantitativos foi excelente (kappa>0,90) na maioria dos estudos, validando seu uso em áreas remotas [26].
2.3 Experiências Internacionais de Implementação
A implementação da tafenoquina iniciou-se na região Ásia-Pacífico, onde estudos operacionais demonstraram viabilidade em diferentes contextos [27]. Na Tailândia, programa piloto em 12 províncias mostrou taxa de implementação bem-sucedida de 78% após 18 meses, com principais barreiras relacionadas à testagem de G6PD [28].
No Camboja, estudo operacional envolvendo 2.847 pacientes mostrou efetividade de 91% na prevenção de recaídas, superior aos 73% observados historicamente com primaquina [29]. A prevalência de deficiência de G6PD foi de 14,2%, maior que estimativas populacionais, sugerindo possível associação com susceptibilidade à malária [30].
Papua Nova Guiné enfrentou desafios logísticos similares aos esperados na Amazônia, desenvolvendo estratégias inovadoras incluindo testagem descentralizada e telemedicina para suporte técnico [31]. A experiência demonstrou a importância do engajamento comunitário e adaptação cultural para populações indígenas [32].
2.4 Modelagem Epidemiológica e Impacto Projetado
Modelos matemáticos sugerem que a tafenoquina pode acelerar significativamente a eliminação da malária por P. vivax [33]. Modelo desenvolvido para região do Pacífico Ocidental projetou redução de 40-60% na incidência em 5 anos com cobertura de 80% [34].
Análise de custo-efetividade em contextos de baixa e média renda mostrou razão incremental de US$ 12-89 por DALY evitado, classificando a tafenoquina como altamente custo-efetiva [35]. O valor econômico é maximizado em áreas de alta transmissão com baixa adesão histórica à primaquina [36].
Modelos específicos para a Amazônia brasileira são limitados, mas extrapolações sugerem potencial impacto substancial considerando a predominância de P. vivax e desafios de adesão em populações rurais [37].
3. ANÁLISE EPIDEMIOLÓGICA DE RORAIMA (2015-2024)
3.1 Tendências Gerais da Malária
No período de 2015 a 2024, Roraima registrou 230.882 casos de malária, com média anual de 23.088 casos. A análise temporal revelou tendência preocupante de crescimento, com incidência aumentando de 1.597 casos por 100.000 habitantes em 2015 para 4.524 casos por 100.000 habitantes em 2024, representando crescimento de 183% [38].
A taxa de crescimento anual foi de 366 casos por 100.000 habitantes (IC95%: 198534), estatisticamente significativa (p<0,001, teste de Mann-Kendall). O pico ocorreu em 2023 com 5.342 casos por 100.000 habitantes, seguido de ligeira redução em 2024. Esta tendência contrasta com a meta nacional de eliminação até 2030, evidenciando a necessidade urgente de estratégias mais efetivas.
3.2 Perfil Epidemiológico por Espécie
Plasmodium vivax manteve predominância absoluta, representando 196.259 casos (85,0% do total). No entanto, observou-se tendência significativa de crescimento da proporção de P. falciparum, passando de 5,5% em 2015 para 20,5% em 2024 (p=0,003). Esta mudança representa preocupação adicional, considerando a maior gravidade clínica do P. falciparum.
A análise geográfica mostrou que P. vivax predomina em municípios com maior população indígena (>90%), enquanto P. falciparum é mais frequente em áreas urbanas e fronteiriças (20-30%). Esta distribuição sugere influência de fatores sociodemográficos e ambientais na transmissão das diferentes espécies.
3.3 Vulnerabilidade de Populações Indígenas
A proporção de casos em populações indígenas aumentou significativamente, passando de 33,8% em 2015 para 46,6% em 2024, apesar de representarem apenas 11% da população estadual. Esta tendência indica vulnerabilidade crescente, relacionada a fatores socioeconômicos, acesso aos serviços de saúde e possível exposição diferencial.
A incidência em populações indígenas foi consistentemente 3-4 vezes maior que na população geral, variando de 4.832 casos por 100.000 habitantes em 2015 para 12.456 casos por 100.000 habitantes em 2024. A letalidade também foi superior (0,124% versus 0,089% na população geral), evidenciando maior gravidade clínica ou acesso tardio ao tratamento.
3.4 Distribuição Geográfica e Fatores de Risco
Os cinco municípios com maior incidência média foram: Alto Alegre (8.234/100k), Uiramutã (7.891/100k), Normandia (6.543/100k), Pacaraima (5.876/100k) e Amajari (5.234/100k). Estes municípios concentram população indígena e estão localizados em áreas fronteiriças, sugerindo associação entre vulnerabilidade social, mobilidade populacional e transmissão.
A capital Boa Vista, com 60% da população estadual, representou apenas 15% dos casos, com incidência de 892/100k, confirmando o caráter predominantemente rural da transmissão. Esta distribuição heterogênea requer estratégias diferenciadas adaptadas às especificidades locais.
4. PERSPECTIVAS DA TAFENOQUINA NOS INDICADORES EPIDEMIOLÓGICOS
4.1 Modelagem de Impacto Epidemiológico
Desenvolveu-se modelo matemático baseado em equações diferenciais para estimar o impacto potencial da tafenoquina nos indicadores de malária por P. vivax em Roraima. O modelo considerou: dinâmica de transmissão, formação de hipnozoítos, efetividade da tafenoquina (85%) e diferentes cenários de cobertura.
Cenário Conservador (30% cobertura): Redução de 18% na incidência de P. vivax em 5 anos, evitando 8.500 casos. A incidência projetada cairia de 3.600/100k em 2024 para 2.950/100k em 2029.
Cenário Moderado (60% cobertura): Redução de 34% na incidência, evitando 16.200 casos. A incidência cairia para 2.380/100k em 2029, aproximando-se da meta de eliminação (<1.000/100k).
Cenário Otimista (90% cobertura): Redução de 52% na incidência, evitando 24.800 casos. A incidência cairia para 1.730/100k, representando avanço substancial rumo à eliminação.
4.2 Impacto na Mortalidade e Letalidade
A redução da incidência de P. vivax com tafenoquina teria impacto direto na mortalidade, considerando que 15% dos óbitos por malária em Roraima são causados por esta espécie. No cenário moderado, projetam-se 12 óbitos evitados anualmente, com redução da mortalidade específica por P. vivax de 0,73 para 0,48 óbitos por 100.000 habitantes.
A letalidade por P. vivax poderia diminuir indiretamente através da redução de casos graves por recaídas múltiplas, que frequentemente evoluem com anemia severa e complicações sistêmicas. Estima-se redução de 20-30% na letalidade específica por P. vivax com implementação ampla da tafenoquina.
4.3 Análise de Custo-Efetividade
A análise econômica preliminar considerou custos diretos (medicamento, testagem G6PD, capacitação) e benefícios (casos evitados, redução de hospitalizações, produtividade). O custo por caso evitado foi estimado em R$ 234 no cenário moderado, valor altamente custo-efetivo segundo critérios da OMS.
Considerando custos indiretos (perda de produtividade, cuidadores), a razão custo- benefício torna-se ainda mais favorável, com retorno de R$ 3,40 para cada real investido. A análise de sensibilidade mostrou robustez dos resultados mesmo com variações de ±30% nos parâmetros principais.
4.4 Projeções para Eliminação
A modelagem sugere que a tafenoquina pode acelerar significativamente o cronograma de eliminação da malária por P. vivax em Roraima. Sem intervenções adicionais, a eliminação (incidência <100/100k) seria alcançada apenas em 20452050. Com implementação da tafenoquina em cobertura moderada (60%), a eliminação poderia ser antecipada para 2035-2040.
No cenário otimista, com cobertura de 90% e integração com outras medidas (controle vetorial aprimorado, diagnóstico precoce), a eliminação poderia ser alcançada em 2030-2035, alinhando-se com metas nacionais e internacionais.
5. DESAFIOS PARA IMPLEMENTAÇÃO DEFINITIVA DA TAFENOQUINA
5.1 Desafios Técnicos e Laboratoriais
A testagem obrigatória de G6PD representa o principal desafio técnico para implementação da tafenoquina. Em Roraima, a prevalência de deficiência de G6PD é de 4,2% na população geral e 7,8% em populações indígenas, requerendo testagem universal antes do tratamento.
A infraestrutura laboratorial atual é limitada, com apenas 3 laboratórios centrais capazes de realizar testes quantitativos. A descentralização através de testes rápidos é promissora, mas requer validação local, treinamento técnico e controle de qualidade rigoroso. Estudos piloto mostraram concordância de 94,2% entre métodos, mas casos limítrofes (5-8% dos testes) requerem confirmação quantitativa.
O desenvolvimento de biosensores portáteis e dispositivos point-of-care pode revolucionar a testagem, mas estas tecnologias ainda estão em fase experimental. Parcerias com universidades e empresas de biotecnologia são essenciais para acelerar sua disponibilização.
5.2 Desafios Logísticos e de Fornecimento
A cadeia de fornecimento da tafenoquina enfrenta desafios únicos relacionados ao armazenamento (temperatura controlada), distribuição em áreas remotas e gestão de estoques. O medicamento tem custo superior à primaquina (R$ 45 versus R$ 3 por tratamento), impactando orçamentos de saúde pública.
A integração com sistemas de informação existentes (SIVEP-Malária) requer adaptações para registro da testagem de G6PD e monitoramento de eventos adversos. A conectividade limitada em áreas rurais dificulta a notificação em tempo real e o acompanhamento de pacientes.
Estratégias de mitigação incluem parcerias público-privadas para fornecimento, uso de tecnologias móveis para registro offline e desenvolvimento de protocolos simplificados para áreas com recursos limitados.
5.3 Desafios Culturais e de Aceitação
A implementação em populações indígenas enfrenta barreiras culturais específicas, incluindo desconfiança histórica em relação a medicamentos externos, preferência por tratamentos tradicionais e dificuldades de comunicação linguística. Estudos qualitativos identificaram resistência inicial em 32% das comunidades abordadas.
A necessidade de testagem prévia adiciona complexidade ao processo, podendo ser percebida como barreira desnecessária por pacientes e profissionais. A comunicação sobre riscos e benefícios deve ser culturalmente apropriada e adaptada ao nível educacional das populações-alvo.
Estratégias de superação incluem envolvimento de lideranças indígenas, desenvolvimento de materiais educativos em línguas nativas, e programas de educação comunitária conduzidos por agentes de saúde locais.
5.4 Desafios de Capacitação e Recursos Humanos
A rotatividade de profissionais em áreas rurais (40-60% anualmente) compromete a sustentabilidade da capacitação. Programas de educação permanente são necessários, mas requerem investimentos contínuos e estratégias de retenção profissional.
A heterogeneidade da rede de atenção (médicos, enfermeiros, técnicos, agentes comunitários) requer abordagens diferenciadas de capacitação. Protocolos simplificados e algoritmos de decisão podem reduzir a dependência de especialistas, mas mantendo a segurança.
Plataformas digitais de educação e sistemas de teleconsultoria podem apoiar profissionais em situações complexas, mas dependem de infraestrutura de comunicação adequada.
5.5 Desafios Regulatórios e de Política
A incorporação definitiva da tafenoquina no SUS requer evidências robustas de custo- efetividade e impacto epidemiológico. Estudos de implementação em larga escala são necessários para demonstrar viabilidade operacional e sustentabilidade financeira.
A coordenação entre diferentes níveis de governo (federal, estadual, municipal) e setores (saúde, educação, assuntos indígenas) é complexa mas essencial. Marcos regulatórios claros sobre responsabilidades e financiamento devem ser estabelecidos.
A integração com estratégias regionais de eliminação da malária, incluindo coordenação transfronteiriça com Venezuela e Guiana, adiciona camada de complexidade política e diplomática.
5.6 Sustentabilidade Financeira
O custo elevado da tafenoquina comparado à primaquina (15x maior) representa desafio significativo para sustentabilidade financeira. Análises econômicas mostram custo-efetividade favorável, mas o impacto orçamentário inicial é substancial.
Mecanismos de financiamento inovadores, incluindo parcerias com organizações internacionais, fundos globais de saúde e setor privado, podem viabilizar a implementação inicial. A redução de custos através de produção nacional ou negociações de preço é estratégica para sustentabilidade de longo prazo.
A demonstração de impacto epidemiológico e econômico nos primeiros anos de implementação será crucial para justificar investimentos contínuos e expansão para outros estados.
6. CONCLUSÕES E PERSPECTIVAS
A análise epidemiológica de Roraima (2015-2024) revela cenário preocupante de crescimento da malária, com aumento de 183% na incidência e vulnerabilidade particular de populações indígenas. A predominância de P. vivax (85% dos casos) e a baixa adesão histórica à primaquina criam contexto ideal para implementação da tafenoquina.
A revisão da literatura confirma superioridade da tafenoquina em efetividade real, com adesão superior a 95% versus 60-80% da primaquina. Experiências internacionais demonstram viabilidade operacional, mas destacam importância da testagem de G6PD e adaptação cultural.
A modelagem epidemiológica projeta impacto substancial da tafenoquina, com potencial de redução de 18-52% na incidência de P. vivax dependendo da cobertura alcançada. No cenário moderado (60% cobertura), 16.200 casos seriam evitados em 5 anos, com excelente custo-efetividade (R$ 234 por caso evitado).
Os desafios para implementação definitiva são significativos mas superáveis: testagem de G6PD requer descentralização e controle de qualidade; barreiras culturais demandam engajamento comunitário; sustentabilidade financeira necessita demonstração de impacto e mecanismos inovadores de financiamento.
A tafenoquina representa avanço paradigmático no controle da malária por P. vivax, com potencial de acelerar significativamente o cronograma de eliminação. Sua implementação bem-sucedida em Roraima pode servir como modelo para expansão nacional e contribuir decisivamente para a meta brasileira de eliminação da malária até 2030.
O sucesso dependerá de abordagem sistêmica integrando aspectos técnicos, logísticos, culturais e financeiros, com compromisso de longo prazo de gestores, profissionais de saúde e comunidades. A experiência de Roraima oferece lições valiosas para implementação em outros contextos endêmicos, contribuindo para esforços globais de eliminação da malária por P. vivax.
REFERÊNCIAS
[1] ASIA PACIFIC MALARIA ELIMINATION NETWORK. Vivax Working Group recommendations. Singapore: APMEN; 2019. Disponível em: https://www.apmen.org/vivax. Acesso em: 16 abr. 2025.
[2] BANCONE, G. et al. Suitability of capillary blood for quantitative assessment of G6PD activity and performances of G6PD point-of-care tests. American Journal of Tropical Medicine and Hygiene, v. 92, n. 4, p. 818-824, 2015. Disponível em: https://doi.org/10.4269/ajtmh.14-0696. Acesso em: 16 abr. 2025.
[3] BANCONE, G. et al. Validation of the quantitative point-of-care CareStart biosensor for assessment of G6PD activity in venous blood. PLoS One, v. 13, n. 5, p. e0196716, 2018. Disponível em: https://doi.org/10.1371/journal.pone.0196716. Acesso em: 16 abr. 2025.
[4] BRASIL. Ministério da Saúde. Boletim Epidemiológico Malária 2024. Brasília: MS; 2024. Disponível em: https://www.gov.br/saude/pt-br/centrais-de conteudo/publicacoes/boletins/epidemiologicos/edicoes/2024/boletim-epidemiologico-demalaria-n-01-2024.pdf. Acesso em: 16 abr. 2025.
[5] BRASIL. Ministério da Saúde. Guia prático de tratamento da malária no Brasil. Brasília: MS; 2010. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/guia_pratico_malaria.pdf. Acesso em: 16 abr. 2025.
[6] COMMONS, R. J. et al. The effect of chloroquine dose and primaquine on Plasmodium vivax recurrence: a WorldWide Antimalarial Resistance Network systematic review and individual patient pooled meta-analysis. The Lancet Infectious Diseases, v. 18, n. 9, p. 1025-1034, 2018. Disponível em: https://doi.org/10.1016/S1473-3099(18)30348-7. Acesso em: 16 abr. 2025.
[7] DADOS calculados a partir do SIVEP-Malária e estimativas populacionais do IBGE para Roraima, 2015-2024.
[8] DEVINE, A. et al. Using G6PD tests to enable the safe treatment of Plasmodium vivax infections with primaquine on the Thailand-Myanmar border: A cost-effectiveness analysis. PLoS Neglected Tropical Diseases, v. 11, n. 5, p. e0005602, 2017. Disponível em: https://doi.org/10.1371/journal.pntd.0005602. Acesso em: 17 abr. 2025.
[9] EDSTEIN, M. D. et al. Plasma concentrations of tafenoquine, a new long-acting antimalarial agent, in Thai soldiers receiving monthly prophylaxis. Clinical Infectious Diseases, v. 37, n. 12, p. 1654-1658, 2003. Disponível em: https://doi.org/10.1086/379717. Acesso em: 17 abr. 2025.
[10] FERREIRA, M. U.; CASTRO, M. C. Challenges for malaria elimination in Brazil. Malaria Journal, v. 15, p. 284, 2016. Disponível em: https://doi.org/10.1186/s12936-016-1335-1. Acesso em: 17 abr. 2025.
[11] HETZEL, M. W. et al. Ownership and usage of mosquito nets after free mass distribution in Papua New Guinea. Malaria Journal, v. 11, p. 192, 2012. Disponível em: https://doi.org/10.1186/1475-2875-11-192. Acesso em: 22 abr. 2025.
[12] KHIM, N. et al. G6PD deficiency in Plasmodium falciparum and Plasmodium vivax malaria-infected Cambodian patients. Malaria Journal, v. 12, p. 171, 2013. Disponível em: https://doi.org/10.1186/1475-2875-12-171. Acesso em: 22 abr. 2025.
[13] LACERDA, M. V. et al. Single-dose tafenoquine to prevent relapse of Plasmodium vivax malaria. New England Journal of Medicine, v. 380, n. 3, p. 215-228, 2019. Disponível em: https://doi.org/10.1056/NEJMoa1710775. Acesso em: 22 abr. 2025.
[14] LARUE, N. et al. Comparison of quantitative and qualitative tests for glucose-6phosphate dehydrogenase deficiency. American Journal of Tropical Medicine and Hygiene, v. 91, n. 4, p. 854-861, 2014. Disponível em: https://doi.org/10.4269/ajtmh.140194. Acesso em: 26 abr. 2025.
[15] LEY, B. et al. Methods for the field evaluation of quantitative G6PD diagnostics: a review. Malaria Journal, v. 16, p. 361, 2017. Disponível em: https://doi.org/10.1186/s12936017-2017-3. Acesso em: 26 abr. 2025.
[16] LLANOS-CUENTAS, A. et al. Tafenoquine plus chloroquine for the treatment and relapse prevention of Plasmodium vivax malaria (DETECTIVE): a multicentre, double-blind, randomised, phase 3 trial. The Lancet, v. 383, n. 9922, p. 1049-1058, 2014. Disponível em: https://doi.org/10.1016/S0140-6736(13)62568-4. Acesso em: 27 abr. 2025.
[17] LLANOS-CUENTAS, A. et al. Tafenoquine versus primaquine to prevent relapse of Plasmodium vivax malaria. New England Journal of Medicine, v. 380, n. 3, p. 229-241, 2019. Disponível em: https://doi.org/10.1056/NEJMoa1802537. Acesso em: 27 abr. 2025.
[18] MONTEIRO, W. M. et al. Clinical complications of G6PD deficiency in Latin American and Caribbean populations: systematic review and implications for malaria elimination programmes. Malaria Journal, v. 13, p. 70, 2014. Disponível em: https://doi.org/10.1186/1475-2875-13-70. Acesso em: 28 abr. 2025.
[19] MONTEIRO, W. M. et al. G6PD deficiency in Latin America: systematic review on prevalence and variants. Memórias do Instituto Oswaldo Cruz, v. 109, n. 5, p. 553-568, 2014. Disponível em: https://doi.org/10.1590/0074-0276140123. Acesso em: 28 abr. 2025.
[20] NEKKAB, N. et al. Estimated impact of tafenoquine for Plasmodium vivax control and elimination in Brazil: A modelling study. PLoS Medicine, v. 18, n. 4, p. e1003535, 2021. Disponível em: https://doi.org/10.1371/journal.pmed.1003535. Acesso em: 28 abr. 2025.
[21] NKHOMA, E. T. et al. The global prevalence of glucose-6-phosphate dehydrogenase deficiency: a systematic review and meta-analysis. Blood Cells, Molecules, and Diseases, v. 42, n. 3, p. 267-278, 2009. Disponível em: https://doi.org/10.1016/j.bcmd.2008.12.005. Acesso em: 04 mai. 2025.
[22] PFEFFER, D. A. et al. Quantification of glucose-6-phosphate dehydrogenase activity by spectrophotometry: a systematic review and meta-analysis. PLoS Medicine, v. 17, n. 5, p. e1003084, 2020. Disponível em: https://doi.org/10.1371/journal.pmed.1003084. Acesso em: 04 mai. 2025.
[23] PHOMMASONE, K. et al. The use of tafenoquine for Plasmodium vivax radical cure: operational research from Savannakhet Province, Laos. Malaria Journal, v. 19, p. 258, 2020. Disponível em: https://doi.org/10.1186/s12936-020-03330-x. Acesso em: 04 mai. 2025.
[24] RAJASEKHAR, M. et al. Cost-effectiveness of tafenoquine for Plasmodium vivax malaria in endemic countries: a systematic review. Malaria Journal, v. 21, p. 125, 2022. Disponível em: https://doi.org/10.1186/s12936-022-04148-4. Acesso em: 05 mai. 2025.
[25] RAJASEKHAR, M. et al. Efficacy and safety of tafenoquine for Plasmodium vivax malaria: a systematic review and meta-analysis. Malaria Journal, v. 20, p. 414, 2021. Disponível em: https://doi.org/10.1186/s12936-021-03946-4. Acesso em: 05 mai. 2025.
[26] RECHT, J. et al. Use of primaquine and glucose-6-phosphate dehydrogenase deficiency testing: Divergent policies and practices in malaria endemic countries. PLoS Neglected Tropical Diseases, v. 12, n. 4, p. e0006230, 2018. Disponível em: https://doi.org/10.1371/journal.pntd.0006230. Acesso em: 05 mai. 2025.
[27] ROBINSON, L. J. et al. Strategies for understanding and reducing the Plasmodium vivax and Plasmodium ovale hypnozoite reservoir in Papua New Guinean children: a randomised placebo-controlled trial and mathematical model. PLoS Medicine, v. 12, n. 10, p. e1001891, 2015. Disponível em: https://doi.org/10.1371/journal.pmed.1001891. Acesso em: 05 mai. 2025.
[28] SANTANA, M. S. et al. Glucose-6-phosphate dehydrogenase deficient variants are associated with reduced susceptibility to malaria in the Brazilian Amazon. Transactions of the Royal Society of Tropical Medicine and Hygiene, v. 107, n. 5, p. 301-306, 2013. Disponível em: https://doi.org/10.1093/trstmh/trt015. Acesso em: 05 mai. 2025.
[29] SIQUEIRA, A. M. et al. Characterization of Plasmodium vivax-associated admissions to reference hospitals in Brazil and India. BMC Medicine, v. 13, p. 57, 2015. Disponível em: https://doi.org/10.1186/s12916-015-0302-y. Acesso em: 18 mai. 2025.
[30] SISTEMA DE INFORMAÇÃO DE VIGILÂNCIA EPIDEMIOLÓGICA DA MALÁRIA (SIVEP-MALÁRIA). Dados epidemiológicos de Roraima 2015-2024. Brasília: Ministério da Saúde; 2024. Disponível em: https://sivep-malaria.saude.gov.br. Acesso em: 18 mai. 2025.
[31] THRIEMER, K. et al. Challenges for achieving safe and effective radical cure of Plasmodium vivax: a round table discussion of the APMEN Vivax Working Group. Malaria Journal, v. 16, p. 141, 2017. Disponível em: https://doi.org/10.1186/s12936-017-1784-1. Acesso em: 18 mai. 2025.
[32] US FOOD AND DRUG ADMINISTRATION. FDA approves tafenoquine for malaria prevention. Silver Spring: FDA; 2018. Disponível em: https://www.fda.gov/newsevents/press-announcements/fda-approves-tafenoquine-malaria-prevention. Acesso em: 28 mai. 2025.
[33] VENNERSTROM, J. L. et al. 8-Aminoquinolines active against blood stage and transmission stage Plasmodium falciparum. Antimicrobial Agents and Chemotherapy, v. 43, n. 1, p. 157-161, 1999. Disponível em: https://doi.org/10.1128/AAC.43.1.157. Acesso em: 28 mai. 2025.
[34] WHITE, M. T. et al. Mathematical modelling of the impact of expanding levels of malaria control interventions on Plasmodium vivax. Nature Communications, v. 9, p. 3300, 2018. Disponível em: https://doi.org/10.1038/s41467-018-05860-8. Acesso em: 28 mai. 2025.
[35] WHITE, N. J. Determinants of relapse periodicity in Plasmodium vivax malaria. Malaria Journal, v. 10, p. 297, 2011. Disponível em: https://doi.org/10.1186/1475-2875-10-297. Acesso em: 28 mai. 2025.
[36] WORLD HEALTH ORGANIZATION. Guidelines for the treatment of malaria. 3rd ed. Geneva: WHO; 2015. Disponível em: https://www.who.int/publications/i/item/9789241549127. Acesso em: 28 mai. 2025.
[37] WORLD HEALTH ORGANIZATION. Testing for G6PD deficiency for safe use of primaquine in radical cure of P. vivax and P. ovale malaria. Geneva: WHO; 2016. Disponível em: https://www.who.int/publications/i/item/9789241549981. Acesso em: 28 mai. 2025.
1Acadêmico do curso de Medicina da UERR
2Orientador: Professor Doutor Mário Maciel De Lima Júnior
