REGISTRO DOI:10.5281/zenodo.10206512
¹Giovanna Martins Gonçalves
² Larissa Thainá Brito Dias
³Sabrinah Midori Simões Arai
4Rogério Argeri
RESUMO
A síndrome de Li-Fraumeni é uma síndrome genética, hereditária e autossômica causada por mutações no gene TP53. Esse gene é conhecido por ser supressor de tumor, que codifica a proteína p53, relacionada ao ciclo celular. Portadores desta mutação possuem predisposição ao câncer em idades precoces e até mesmo na infância. Os tipos de tumores mais prevalentes em pacientes diagnosticados com essa mutação são carcinomas adrenocorticais, câncer de mama, sarcomas de tecidos moles, osteosarcomas e tumores no sistema nervoso central. No Brasil a mutação R337H, relacionada ao aumento de carcinomas adrenocorticais em crianças, é identificada com maior prevalência, devido a um efeito fundador. O diagnóstico é feito através de testes genéticos para as variações patogênicas do gene TP53, porém existem portadores dessas mutações que não se encaixam nos critérios propostos para que estes testes genéticos sejam realizados. Dentro destes requisitos, temos os critérios de Chompret e os critérios clássicos da Síndrome de Li-Fraumeni. Até o momento, não existe tratamento para a síndrome, no entanto, é possível realizar o tratamento precoce do câncer, quando é descoberto em estágio inicial. Pensando nisso, foi criado o Protocolo de Toronto para realizar o rastreamento e diagnóstico precoce dos tumores. Este protocolo consiste no screening periódico de pacientes diagnosticados com Síndrome de Li-Fraumeni, através de testes bioquímicos e exames de imagem. Infelizmente, as estratégias recomendadas pelo protocolo são de alto custo, não sendo acessível à maior parte da população brasileira, o que leva a um diagnóstico tardio e um aumento na mortalidade relacionada a síndrome.
Atualmente, no Brasil, as disparidades socioeconômicas e demográficas influenciam diretamente na aplicação do Protocolo de Toronto, visto que o acesso às estratégias de vigilância propostas é acessível somente a uma pequena parcela da população. Mesmo com sua difícil aplicação, estudos demonstram que o protocolo obteria resultados positivos em relação a sua custo-efetividade, tanto para mulheres quanto para homens, caso fosse disponibilizado pelo SUS.
Palavras chaves: Câncer; Critérios de Chompret; Gene TP53; Protocolo de Toronto; Síndrome de Li-Fraumeni.
ABSTRACT
Li-Fraumeni syndrome is a genetic, hereditary, autosomal syndrome caused by mutations in the TP53 gene. This gene is known to be a tumor suppressor that encodes the p53 protein, related to the cell cycle. Individuals with this mutation have a predisposition to cancer at an early age, even in childhood. Among the most prevalent types of tumors in patients diagnosed with this mutation are adrenocortical carcinomas, breast cancer, soft tissue sarcomas, osteosarcomas, and central nervous system tumors. In Brazil, the R337H mutation, associated with an increased risk of adrenocortical carcinomas in children, is identified with higher prevalence due to a founder effect. Diagnosis is made through genetic tests for pathogenic variations in the TP53 gene, but there are carriers of these mutations who do not fit the proposed criteria for these genetic tests to be performed. Within these requirements, we have the Chompret and the classic Li-Fraumeni syndrome criteria. Currently, there is no treatment for the syndrome; however, early treatment of cancer is possible when discovered at an early stage. In light of this, the Toronto Protocol was created to screen and diagnose tumors early. This protocol consists of a periodic screening of patients diagnosed with Li-Fraumeni syndrome through biochemical tests and imaging exams. Unfortunately, the recommended strategies by the protocol are costly and not accessible to the majority of the population in Brazil, leading to late diagnosis and an increase in syndrome-related mortality. Currently, in Brazil, the socioeconomic and demographic disparities influence directly in the Toronto Protocol application, since the access to surveillance strategies is viable only for a small portion of the population. Even with its difficult application, studies have shown that the protocol would obtain a promising outcome regarding its cost-effectiveness, for either women or men, if available via SUS.
Keywords: Cancer; Chompret Criteria; TP53 Gene; Toronto Protocol; Li-Fraumeni Syndrome.
INTRODUÇÃO
A síndrome de Li-Fraumeni é uma síndrome genética hereditária causada por uma mutação rara no gene TP53. Devido a essas alterações, o indivíduo portador possui maior predisposição ao câncer, isto é, apresenta riscos elevados para um espectro diverso de malignidades durante a infância ou precocemente na fase adulta.
Aproximadamente, 5 tipos de câncer são os mais prevalentes entre os portadores da síndrome, que são: carcinomas adrenocorticais, câncer de mama, tumores no sistema nervoso central, osteossarcomas e sarcomas em tecidos moles. Além disso, pode ser associado ao aumento dos riscos em outros tipos de câncer, como: leucemia, linfoma, câncer gastrointestinal, câncer de cabeça e pescoço, rins, laringe, pulmões, pele, ovário, pâncreas, próstata, testículos e tireoide.
O diagnóstico da Síndrome de Li-Fraumeni é feito a partir do estabelecimento de critérios clínicos e/ou testes genéticos para variação patogênica do gene TP53. Nos últimos anos, tem sido registrada a existência de portadores da mutação TP53 c.1010G>A (p. Arg337His) que não se encaixam nos critérios de Chompret ou nos critérios clássicos da Síndrome de Li-Fraumeni, o que leva a uma deficiência no diagnóstico desta mutação, visto que os testes genéticos necessários para o estudo do gene TP53, principalmente antes do sequenciamento de nova geração, são limitados a pacientes que atendem aos critérios relacionados à síndrome. [2][3] Sendo assim, com esse trabalho buscamos discutir a importância da aplicação correta de protocolos relacionados ao diagnóstico precoce de tumores causados pela Síndrome de Li- Fraumeni, além de abordar e elucidar seus aspectos clínicos e moleculares, sua prevalência e histórico no Brasil e a relação com o gene TP53. Além disso, destacar a importância do screening genético na descoberta de variações patogênicas do gene TP53 em pacientes que não se encaixem nos critérios de testagem.
O Protocolo de Toronto foi criado com o intuito de rastrear e diagnosticar precocemente tumores relacionados à síndrome de Li-Fraumeni, e consequentemente àqueles com outras síndromes hereditárias que predispõem ao câncer. [13] Este protocolo foi desenvolvido no Canadá, na cidade de Toronto, pelo médico Dr. David Malkin, pediatra oncologista e pesquisador internacionalmente renomado sobre o tema [1]. O protocolo se baseia no screening periódico dos pacientes, usando uma série de testes bioquímicos, exames físicos e exames de imagem, como mamografia, colonoscopia, ultrassom abdominal e pélvico, e ressonância magnética de corpo inteiro (RMCI).
OBJETIVOS
Geral:
Apresentar os aspectos clínicos e moleculares da Síndrome de Li- Fraumeni.
Específicos:
Apresentar dados bibliográficos que citam a eficácia da aplicação do protocolo de Toronto em portadores da mutação.
METODOLOGIA
A metodologia utilizada neste estudo foi a coleta de dados da literatura e de bases de dados eletrônicas publicados entre 2016 e 2023 relacionados à Síndrome de Li Fraumeni, custo-efetividade do diagnóstico precoce e rastreamento de câncer, mutação do gene TP53 e Protocolo de Toronto, incluindo estudos de casos nos idiomas português e inglês. As bases de dados eletrônicos utilizados foram Scielo, NCBI, PubMed, Europe PMC, Nature, The Lancet e da Organização Living LFS (Li-Fraumeni Syndrome).
DESENVOLVIMENTO
Síndrome de Li-Fraumeni e o gene TP53
A Síndrome de Li-Fraumeni foi descrita pela primeira vez em 1969 por Frederick Pei Li e Joseph Fraumeni Jr, que observaram que, em algumas famílias, o desenvolvimento de alguns tipos de câncer aparecia com certa frequência, mesmo em integrantes de pouca idade. [4] Em 1990, David Malkin identificou uma mutação germinativa no gene TP53 intimamente associada a síndrome (Germ Line p53 Mutations in a Familial Syndrome of Breast Cancer, Sarcomas, and Other Neoplasms.), que posteriormente, foi identificada em cerca de 70% das famílias portadora da SLF (Síndrome de Li-Fraumeni).
Como critérios clássicos da síndrome temos: indivíduo diagnosticado com sarcoma antes dos 45 anos; parente de primeiro grau diagnosticado com qualquer tipo de câncer antes dos 45 anos; parente de primeiro ou segundo grau diagnosticado com qualquer tipo de câncer antes dos 45 anos ou sarcoma diagnosticado em qualquer idade. [1] Os critérios clássicos foram baseados na análise de 24 famílias, das quais os indivíduos herdaram tipos de câncer devido a mutação autossômica dominante.
Os critérios para teste genético relacionado à Síndrome de Li- Fraumeni, mais conhecidos como Critérios de Chompret, se dividem em duas categorias. Na categoria A se encaixam pacientes que tenham sido diagnosticados com câncer de mama, sarcoma de tecidos moles, osteossarcoma, tumores cerebrais ou carcinoma adrenocortical antes dos 46 anos de idade e que apresentem familiares de primeiro ou segundo grau que foram diagnosticados com tumores desta mesma gama antes dos 56 anos, ou pacientes que apresentam dois ou mais tumores desta mesma gama antes dos 46 anos de idade. Na categoria B se encaixam pacientes diagnosticados com carcinoma adrenocortical, carcinoma de plexo coroide, rabdomiossarcoma anaplásico, câncer de mama antes dos 31 anos de idade, osteosarcoma, LLA (leucemia linfóide aguda) hipodiploide durante a infância e meduloblastoma do subtipo SHH (Sonic hedgehog- medulloblastoma).
O gene TP53, também denominado “guardião do genoma”, é um gene classificado como supressor de tumor, responsável por codificar uma fosfoproteína nuclear, que tem relação com a parada do ciclo celular, reparo do DNA (Deoxyribonucleic acid) e indução da apoptose. Este gene está localizado no braço curto do cromossomo 17 (mais especificamente na região p13.1), que tem como produto de transcrição uma proteína nuclear de 53 KD, a proteína p53. A proteína p53 foi descrita pela primeira vez em 1979 como uma fosfoproteína nuclear, sendo inicialmente definida como proteína oncogênica e, em 1989, como gene supressor tumoral. Quando uma célula apresenta um alelo do gene TP53 mutado e outro normal, a função da proteína fica comprometida.
O termo “guardiã do genoma” se dá pelo fato da proteína monitorar a integridade do genoma e impedir a proliferação de células com o DNA mutado. Quando ocorre lesão no DNA, o gene TP53 é ativado, levando a transcrição da proteína p53. O acúmulo dessa proteína no núcleo da célula inibe o ciclo mitótico no início da fase G1 e ativa a transcrição de genes de reparo do DNA, impedindo a propagação do erro genético para as células filhas. Contudo, caso o reparo do DNA não tenha sido efetuado de forma satisfatória, a proteína aciona o mecanismo de apoptose. Nas células que apresentam mutação no gene TP53 (variantes patogênicas) há uma produção inadequada da proteína p53, portanto, não ocorre a parada do ciclo celular, reparo do DNA e indução da apoptose. Essas células, geneticamente instáveis, tendem a acumular mutações e rearranjos cromossômicos adicionais, levando a uma rápida proliferação de clones com DNA mutado e transformação neoplásica.
Pacientes diagnosticados com Síndrome de Li-Fraumeni, apresentam maior risco de desenvolvimento de cânceres por apresentarem mutação no gene TP53, provenientes de mutações germinativas, ou seja, é uma síndrome hereditária que leva à formação precoce de tumores.
No Brasil, foram identificados pacientes portadores dessa alteração genética relacionada ao fenômeno conhecido como efeito fundador, em que ocorre perda de variação genética quando uma nova população é estabelecida, resultando em um aumento da frequência de uma alteração genética. Por conta disso, foi identificada com uma maior prevalência a mutação R337H (p.Arg337His), relacionada com o aumento na frequência de carcinomas adrenocorticais em crianças. [9] A identificação de portadores desta mutação se mostra importante para o aconselhamento genético, visto que se apresenta como uma síndrome hereditária, e para a análise de cada paciente.
Estudos recentes demonstram a utilização de RNAs (Ribonucleic acid) não codificantes como marcadores clínicos para monitoramento de pacientes associados a Síndrome de Li-Fraumeni. Esses regulam genes relacionados com a proliferação celular e metabolismo, e podem ser classificados como microRNAs, RNAs longos não-codificantes e RNAs circulares.
Protocolo de Toronto Descrição do Protocolo
O protocolo de Toronto foi desenvolvido pelo médico, pediatra e oncologista, Dr. David Malkin, em Toronto, no Canadá, com o propósito de realizar o rastreio e diagnóstico precoce de tumores primários causados pela Síndrome de Li- Fraumeni. [10] O protocolo foi a primeira recomendação de rastreio para pacientes diagnosticados com a síndrome, devido à baixa exposição à radiação ionizante, e se baseia em uma série de testes bioquímicos, exames físicos e exames de imagem, incluindo ultrassom, mamografia, ressonância magnética do cérebro e ressonância magnética de corpo inteiro (RMCI).
A ressonância magnética de corpo inteiro (RMCI) tem sido utilizada como uma estratégia de vigilância para pacientes diagnosticados com SLF por seu método consistir na aquisição de uma sequência rápida de imagens de vários planos diferentes do corpo, apresentando alta sensibilidade e especificidade. O PET/CT 18F-FDG era a ferramenta de rastreio utilizada anteriormente a RMCI, porém seu uso não é mais recomendado devido à alta emissão de radiação, que pode levar a indução de novos tumores primários em pacientes portadores da mutação no gene TP53. [11] Estudos prévios mostram que a realização da RMCI permite diagnóstico de tumores malignos em 9% dos pacientes assintomáticos que são portadores da mutação, e que o rastreio em portadores da síndrome, seguindo o Protocolo de Toronto, auxilia no diagnóstico precoce e aumento da sobrevida.
Evidências científicas que sustentam o protocolo
Evidências recentes mostram o benefício na sobrevida do paciente quando realizado um rastreio intensivo, incluindo ressonância magnética de corpo inteiro, combinado com exames físicos, bioquímicos e outros exames de imagem, o que leva ao maior emprego desses protocolos internacionalmente.
Estudos prévios comprovam que a incidência de portadores da mutação do gene TP53 na população mundial está entre 1 a cada 5,000 e 1 a cada 20,000 pessoas. Porém, no Brasil, devido ao efeito fundador, a incidência aumenta para 1 a cada 300 pessoas nas regiões Sul e Sudeste do país.
Portadores do tipo de mutação p.R337H, apresentam um risco de desenvolver câncer durante a vida que varia de 50 a 60%. Dentro dessa porcentagem, 15 a 20% irão desenvolver algum tipo de câncer antes dos 30 anos de idade. Apesar de apresentar uma maior incidência, testes genéticos e o rastreamento de tumores para pacientes diagnosticados com SLF não são oferecidos pelo Sistema Único de Saúde, sendo acessíveis somente à pequena parcela da população que conta com um convênio médico ou que tenha condições financeiras para arcar com os custos dos testes genéticos em clínicas particulares. Assim, a falta de testagem e rastreio leva ao diagnóstico tardio, impacta a qualidade de vida dos portadores e diminui a sobrevida.
Um estudo realizado em 2022 comparou custos hipotéticos entre pacientes diagnosticados com a síndrome que estariam sobre uma estratégia de rastreio, utilizando o Protocolo de Toronto, e pacientes que não estariam sobre nenhum tipo de rastreio, a fim de determinar a custo- efetividade da aplicação do protocolo pelo Sistema Único de Saúde. Para realizar a análise foi calculada a Relação custo-efetividade incremental (RCEI), ou seja, o custo adicional por ano de vida ganho utilizando as estratégias de vigilância comparado ao custo da não vigilância, utilizando parâmetros de análises de sensibilidade, como o OWSA (One-way Sensitivity Analyses), que explora o impacto que a incerteza dos parâmetros individuais tem nos resultados do modelo e o PSA (Probabilistic Sensitivity Analysis), que explora o impacto da incerteza conjunta de todos os parâmetros nos resultados do modelo.
Como resultado deste estudo, foi previsto, para pacientes mulheres, pelo parâmetro OWSA, um custo de vida de R$ 84.771 quando utilizada as estratégias de rastreamento (Protocolo de Toronto) e de R$ 12.869 quando não utilizada nenhuma forma de vigilância. Já pelo parâmetro PSA, de R$ 88.080 e R$ 13.630, para vigilância e não vigilância, respectivamente. Quando calculado a RCEI, foi encontrado o valor de R$ 17.267 por ano de vida ganho, quando utilizado o parâmetro OWSA, e de R$ 15.908, quando utilizado o parâmetro PSA, valores esses que se encontram dentro do limiar WTP (willingness-to-pay). Também foi demonstrado que, considerando um limiar WTP de R$ 30.000, a probabilidade de a vigilância ser custo-efetiva é de 64%, e passo que, ao considerar um limiar de R$ 90.000, essa probabilidade aumenta para 82% (Figura 1).
Figura 1: Análise custo-efetividade para pacientes do sexo feminino sob estratégias de vigilância e sem estar sob estratégias de vigilância.
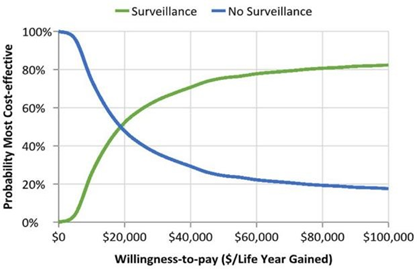
(Fonte: FRANKENTHAL et al., 2022)
Para pacientes homens, o valor calculado na RCEI é consideravelmente maior quando comparado a RCEI das pacientes mulheres, porém continua abaixo do limiar WTP. Foi previsto um custo de vida de R$ 74,596 quando utilizadas as estratégias de rastreamento, e de R$ 6,749 quando não utilizadas, pelo parâmetro OWSA, e de R$ 74,450 e R$ 7,401, para vigilância e não vigilância, respectivamente, pelo parâmetro PSA. Sendo calculado uma RCEI no valor de R$ 24,236 por ano de vida ganho, quando estimado pelo parâmetro OWSA, e no valor de R$ 21,841, pelo parâmetro PSA, foi demonstrado que, com um limiar WTP de R$ 30,000 a probabilidade de a vigilância ser custo- efetiva é de 45%, aumentando para 62% em um limiar de R$ 90,000 (Figura 2). Levando em consideração que as estratégias de vigilância aumentam a sobrevida em 4,7 e 3,2 anos, para mulheres e homens, respectivamente, a aplicação do Protocolo de Toronto foi considerada custo-efetiva, dentro do limiar WTP em ambos os casos.
Figura 2: Análise custo-efetividade para pacientes do sexo masculino sob estratégias de vigilância e sem estar sob estratégias de vigilância.
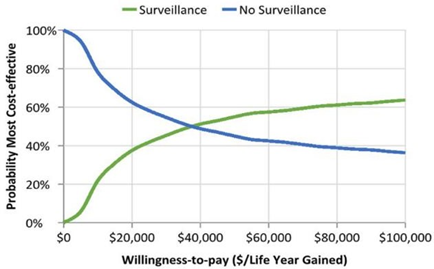
(Fonte: FRANKENTHAL et al., 2022)
Desafios na aplicação do Protocolo de Toronto no Brasil
Barreiras socioeconômicas e culturais
As barreiras socioeconômicas e culturais que afetam a saúde pública no Brasil são complexas e profundamente enraizadas. Essas barreiras se manifestam de várias maneiras e impactam na qualidade de vida e no acesso aos serviços de saúde para muitos brasileiros. Dentre elas, as principais são: desigualdade de renda, acesso limitado à serviços de saúde, dificuldades de acesso à educação, barreiras culturais, racismo estrutural, sistema de saúde fragmentado, corrupção, má nutrição e insegurança alimentar e desigualdades de gênero.
A desigualdade de renda é uma das principais barreiras socioeconômicas, o que resulta em acesso desigual aos cuidados de saúde. Além disso, essa desigualdade gera um acesso limitado aos serviços de saúde, no qual, populações de áreas rurais e remotas enfrentam dificuldades para acessar esses serviços devido à falta de infraestrutura e transporte adequado, devido a desigualdade geográfica no país. Também, a má nutrição e a insegurança alimentar contribuem para uma série de problemas, incluindo desnutrição e obesidade. A falta de educação formal pode prejudicar as escolhas de estilo de vida, em que os indivíduos estão mais propícios à falta de compreensão sobre práticas saudáveis, o que também gera uma falta de conscientização sobre saúde preventiva. Dessa forma, a falta de informações em relação à prevenção faz com que muitos brasileiros tenham diagnósticos tardios de doenças evitáveis e com possível tratamento quando diagnosticadas precocemente, como o câncer.
Além disso, alguns grupos podem resistir a tratamentos médicos convencionais devido às crenças culturais ou religiosas. Também, devido ao racismo estrutural, a população negra enfrenta desigualdades em todas as áreas da saúde, desde a falta de acesso a serviços até a discriminação em ambientes de cuidados. O mesmo ocorre em relação a desigualdade de gênero.
Para superar essas barreiras, é fundamental adotar uma abordagem multifacetada que inclua políticas de redução da desigualdade de renda, investimentos em educação e infraestrutura, combate ao racismo e preconceito, reformas no sistema de saúde, e uma maior conscientização sobre saúde preventiva.
Acesso aos serviços de saúde para o diagnóstico precoce do câncer no Brasil
A detecção precoce do câncer desempenha um papel crucial na gestão da saúde pública no Brasil, um país com uma população diversificada e vasto território. Nesse contexto, a Atenção Básica é a base do sistema de saúde e desempenha um papel vital nesse segmento, seguindo as diretrizes estabelecidas pela Política Nacional para Prevenção e Controle de Câncer (PNPCC) no Brasil. A PNPCC é uma iniciativa de saúde pública que tem como objetivo abordar a prevenção, a detecção precoce e o controle do câncer no país. Dessa forma, trata-se de uma política nacional abrangente projetada para lidar com o crescente ônus do câncer, uma das principais causas de morbidade e mortalidade no país. Também, está alinhada com estratégias internacionais de combate à essa enfermidade. Ela enfatiza a importância de uma abordagem multissetorial, combinando esforços do setor de saúde, órgãos governamentais, organizações não governamentais e do setor privado para reduzir o impacto do câncer na população brasileira.
De fato, a Atenção Básica é a porta de entrada preferencial no sistema de saúde, e seu papel vai muito além de ser o ponto de acesso para cuidados médicos. Ela coordena o cuidado e ordena a rede de atenção à saúde, proporcionando um local central para a detecção precoce do câncer. Organizada de forma regionalizada, a Atenção Básica visa atender às necessidades de saúde da população, integrando ações preventivas e curativas. Essa organização inclui a identificação de sinais e sintomas suspeitos de câncer, e o encaminhamento adequado dos pacientes para diagnóstico e tratamento. Além disso, conta-se com a Rede de Atenção à Saúde (RAS), que é um elemento-chave para garantir que a detecção precoce seja eficaz em um país de dimensões continentais como o Brasil. Essa rede é composta por pontos de atenção, sistemas de apoio, sistema logístico, centro de comunicação e governança. A Atenção Básica é a peça central da comunicação na Rede de Atenção à Saúde, garantindo que informações e pacientes fluam adequadamente entre diferentes pontos de atenção, como hospitais, clínicas e laboratórios.
Ademais, as diretrizes clínicas são ferramentas essenciais para orientar os profissionais de saúde na detecção precoce do câncer no Brasil. Elas oferecem orientações baseadas em evidências científicas e consideram o equilíbrio entre os riscos e benefícios das intervenções. Exemplos notáveis são as instruções para a detecção precoce do câncer de mama e colo do útero, que já possuem exames periódicos para rastreamento nas mulheres que, nesses casos, são a mamografia e o papanicolau. Os exames de rastreamento são fundamentais para garantir que as ações de detecção precoce sejam eficazes, eficientes e seguras.
Dificuldades no sistema público de saúde brasileiro
O Sistema Único de Saúde (SUS), que tem como objetivo promover a universalidade, integralidade e a equidade, logo, estes objetivos, são temas de recorrentes discussões no país, uma vez que enfrenta uma série de desafios que impactam negativamente a qualidade dos serviços prestados e o acesso da população à assistência médica. [19] Essas dificuldades abrangem uma série de aspectos, que vão desde as disparidades regionais até a falta de investimento e de profissionais de saúde em determinadas áreas do país. O Brasil enfrenta desafios significativos no que diz respeito ao câncer, um dos principais problemas de saúde pública no país. Projeções do Instituto Nacional de Câncer (INCA) para os anos de 2023 a 2025 apontam que podem ocorrer 704 mil novos casos de câncer no período, com maior incidência nas regiões Sul e Sudeste, que concentram cerca de 70% dos casos. As estimativas do INCA reforçam a importância da prevenção e do diagnóstico precoce no combate ao câncer. Medidas como redução do tabagismo, adoção de hábitos saudáveis de alimentação e atividades físicas têm o potencial de evitar pelo menos um terço dos casos.
Exames em pessoas com os primeiros sinais ou sintomas da doença podem melhorar a eficácia dos tratamentos e reduzir as taxas de mortalidade. No entanto, devido as disparidades socioeconômicas nas diversas regiões brasileiras, percebe- se um impacto significativo no diagnóstico e tratamento do câncer. Um exemplo ilustrativo dessas discrepâncias é o câncer de colo de útero, que, embora ocupe o quinto lugar em incidência na região Sudeste, sobe para o segundo lugar nas regiões Norte e Nordeste. É importante observar que essas são justamente as regiões com os menores Índices de Desenvolvimento Humano (IDH) do Brasil.
Além disso, a falta de investimento é uma questão crônica no SUS. Os recursos destinados à saúde muitas vezes não acompanham o crescimento da demanda e as necessidades da população. Isso se traduz em hospitais e clínicas com infraestrutura inadequada, desde a falta de leitos até equipamentos obsoletos, o que afeta diretamente a qualidade do atendimento. Outra dificuldade crítica é a escassez de profissionais de saúde em determinadas áreas do país. A concentração de médicos, enfermeiros e outros profissionais em regiões urbanas e ricas deixa áreas rurais e remotas com falta de assistência. A complexidade da burocracia e a falta de prevenção de doenças são problemas adicionais que impactam a eficácia do sistema. Elas dificultam o acesso aos serviços de saúde, enquanto a falta de foco na prevenção faz com que o sistema reaja às doenças ao invés de evitá-las.
Diante disso, é imperativo que o Brasil encare esses desafios e promova reformas significativas no sistema de saúde. É fundamental que haja um investimento considerável em infraestrutura, na formação de profissionais de saúde e em campanhas de conscientização e prevenção. Também, a coordenação entre os diferentes níveis de atenção à saúde precisa ser aprimorada, garantindo que todos os cidadãos tenham acesso a cuidados de saúde de qualidade, independentemente de onde vivam ou de sua situação socioeconômica. A busca por soluções que promovam a igualdade de acesso e a qualidade dos serviços de saúde deve ser uma prioridade nacional. A luta contra o câncer requer uma abordagem multidisciplinar, que vai desde a prevenção e conscientização até o diagnóstico precoce e o tratamento eficaz.
Estudos e casos relevantes da Síndrome de Li-Fraumeni no Brasil
Em 1998, Maria Isabel Achatz, relacionou um caso à SLF após atender uma paciente de 65 anos, que relatava já ter tido seis tumores, classificados como independentes e sucessivos. Maria Isabel, juntamente a uma equipe de pesquisadores, concluíram que se tratava de uma doença de origem genética, a Síndrome de Li-Fraumeni.
Em seu primeiro ano trabalhando como pesquisadora no Hospital do Câncer A.C Camargo, Maria Isabel relata ter diagnosticado 35 pacientes com a síndrome.
No começo dos anos 2000, ela deu início à análise do gene TP53 nos pacientes dos quais ela suspeitava que tivessem SLF, com o propósito de encontrar a mutação que causava a doença, visto que diferentes tipos de mutações no gene TP53 podem levar a essa mesma síndrome. Ela descobriu que a mutação encontrada em seus pacientes não estava localizada na parte central do gene, como na maior parte do mundo, mas sim em sua extremidade, que hoje em dia é conhecida como a mutação p.R337H.
Após a análise, Maria Isabel contatou seus pacientes, pedindo para que eles questionassem seus familiares se teriam interesse em realizar os testes genéticos que pudessem diagnosticar a mutação. Dessa forma, Regina Romano, aos 33 anos de idade, descobriu que a família carregava a mutação que passava de uma geração a outra. Sua avó, apesar de nunca ter desenvolvido nenhum tipo de tumor, carregava o gene TP53 mutado, e passou a mesma mutação para quatro de seus filhos, que por sua vez também passaram a alguns netos.
Em uma das conversas a respeito da síndrome a matriarca da família relatou à pesquisadora que seu avô era um tropeiro durante o século 18, e que conduzia as tropas de cavalo nas regiões Sul e Sudeste do país por vários meses. Essa informação chamou a atenção da geneticista, que comparou os mapas das rotas que os tropeiros faziam naquela época com as cidades dos pacientes diagnosticados, tendo como resultados dois mapas iguais. Foi então realizado um estudo dos polimorfismos intragênicos encontrados no material genético dos pacientes, e todas as famílias testadas apresentavam o mesmo painel, situação essa considerada quase impossível de ocorrer caso os pacientes não tivessem uma origem em comum.
Atualmente, a Síndrome de Li- Fraumeni voltou a ter destaque com o caso da família de Régis Feitosa Mota, que a partir do ano de 2016, recebeu 11 diagnóstico de câncer, acarretando o falecimento de seus 3 filhos, Anna Carolina, Pedro e Beatriz, no período de quatro anos e meio. Régis compartilhava a experiência da família com a síndrome nas redes sociais, e conta que, com a frequência em que eram diagnosticados, foi impedido de processar o luto pelos seus filhos, visto que no mesmo momento do falecimento de um filho, era finalizado ou iniciado o tratamento de outro. Também conta que, apesar das dificuldades, a situação acabou por uni- los, por terem muita força e aceitação diante da gravidade da situação que encaravam, sempre buscando manter a alegria e harmonia.
O corretor de imóveis foi diagnosticado como portador da mutação aos 46 anos, sendo identificado três tipos de câncer diferentes de 2016 até 2023. [23] Régis, que já havia tratado de uma leucemia e um linfoma não Hodgkin, informou em suas redes sociais sobre o último diagnóstico, de mieloma múltiplo. Infelizmente, poucos meses após o diagnóstico, em agosto, o falecimento de Régis foi noticiado pelo irmão, Rogério Feitosa Mota.
Como o diagnóstico e acompanhamento é realizado na prática?
Apesar da síndrome ser diagnosticada através de critérios clínicos e confirmada por testes genéticos, o sequenciamento do gene TP53 não está presente na rotina da maior parte da população, sendo oferecido somente em grandes clínicas e centros de pesquisa. Mesmo que técnicas modernas de diagnóstico, como o sequenciamento de nova geração, estejam mais disponíveis atualmente, ainda não se encontram acessíveis àqueles que dependem do Sistema Único de Saúde. Embora testes de rastreamento têm se provado eficaz na redução da mortalidade associada ao câncer de mama e colorretal, não tem sido realizada em portadores da SLF em específico.
Em relação ao câncer de mama, exames clínicos e de imagem, como mamografia e RM (ressonância magnética), fazem parte das estratégias de monitoramento para portadores das mutações BRCA1 e BRCA2. Considerando a relação entre a radiação ionizante e a predisposição a tumores dos portadores com mutação no gene TP53, a ressonância magnética de mama representa uma boa estratégia de rastreamento, quando disponível. Porém, a mamografia se torna mais acessível à grande parte das mulheres que dependem do SUS.
O teste de sangue oculto nas fezes e a colonoscopia se mostram eficazes na redução da mortalidade quando associado ao câncer colorretal, tanto na população geral, quanto em parte da população que apresenta risco moderado de desenvolver esse tipo de câncer, se mostrando uma estratégia para vigilância em pacientes com SLF. Já para o câncer gástrico, é sugerida a realização de triagem endoscópica regularmente.
Com falta de um programa de rastreamento já estabelecido para grande parte dos tumores relacionados a síndrome, como sarcoma, carcinomas adrenocorticais e tumor cerebral, se tornam atraentes as estratégias de vigilância apresentadas pelo Protocolo de Toronto, como ressonância magnética de corpo inteiro. Um estudo brasileiro, ao analisar a possibilidade da triagem genética para mutação p.R337H em recém-nascidos, desenvolveu um kit de detecção rápida que seria incluído no teste de pezinho, porém, atualmente seu custo é um fator limitante.
O tratamento oncológico para pacientes diagnosticados com SLF é semelhante ao de pacientes que não possuem a síndrome. Porém, por apresentarem maior predisposição a desenvolver tumores devido à radiação, tanto a radioterapia, quanto a mamografia e tomografia computadorizada, devem ser limitados e seu uso investigado individualmente. Para detecção precoce é indicado o acompanhamento e triagem dos familiares dos pacientes diagnosticados, dando ênfase também ao aconselhamento genético.
Perspectivas futuras no tratamento da Síndrome de Li-Fraumeni
No Brasil, a busca por perspectivas futuras no tratamento da síndrome de Li Fraumeni tem sido pautada por dois pilares fundamentais: o rastreamento e diagnóstico precoce e a importância do Sistema Único de Saúde (SUS).
O rastreamento e diagnóstico precoce desempenham um papel crucial na gestão da Síndrome de Li- Fraumeni. A detecção precoce de tumores é essencial para melhorar as chances de tratamento bem-sucedido e aumentar a qualidade de vida dos afetados. [1] No entanto, a Síndrome de Li-Fraumeni é notória por sua variabilidade clínica, o que torna o diagnóstico desafiador.
A medicina de precisão, que envolve a análise genômica para identificar mutações específicas associadas à síndrome, oferece um caminho promissor. A identificação de mutações específicas permite o monitoramento mais eficaz e direcionado e com a crescente acessibilidade das tecnologias genômicas no Brasil, espera-se que o rastreamento baseado em genética desempenhe um papel central nas perspectivas futuras de tratamento.
O Sistema Único de Saúde (SUS) é um componente crucial no tratamento da Síndrome de Li- Fraumeni no Brasil. Sendo uma condição de base genética, a SLF requer acompanhamento médico regular e uma série de exames de rastreamento, que podem ser onerosos para os pacientes. O SUS desempenha um papel essencial na democratização do acesso a esses serviços de saúde, garantindo que os pacientes tenham igualdade de oportunidades para um diagnóstico precoce e tratamento adequado.
Além disso, o SUS é fundamental na promoção da educação em saúde e conscientização sobre a Síndrome de Li-Fraumeni. Campanhas de sensibilização, educação e reinamento de profissionais de saúde são necessárias para aumentar o conhecimento sobre a síndrome e promover o diagnóstico precoce.
CONSIDERAÇÕES FINAIS
Em um estudo realizado pelo INCA (Instituto Nacional do Câncer), entre 2023 e 2025, são esperados 704 mil novos casos de câncer no Brasil por ano, e entre eles 235 mil mortes, fazendo com que esta seja a terceira maior causa de óbito no país. [27][28] Em um levantamento feito pelo Observatório de Oncologia, R$ 3,8 bilhões foram direcionados ao tratamento do câncer no SUS, valor esse que equivale a 3% de todo o valor direcionado a área da saúde. Desses quase 4 bilhões de reais, 77% direcionado a tratamentos de quimioterapia e radioterapia.
Com o avanço da doença, o tratamento tende a encarecer devido a necessidade de cuidados mais avançados e um acompanhamento mais próximo. Segundo pesquisadores, grande parte dos custos poderiam ser evitados se houvesse o investimento adequado em estratégias de diagnóstico precoce.
Em uma análise realizada pela sociedade civil TJCC (Todos Juntos Contra o Câncer), uma sessão de quimioterapia contra o câncer de mama de estadiamento 1 custa cerca de R$ 134,17, enquanto o mesmo tratamento, em um câncer de mama na fase 4, custa aproximadamente R$ 809,56, um valor seis vezes mais alto.
Em conjunto com o CEE (Centro de Estudos Estratégicos da Fiocruz), o Observatório de Oncologia e o TJCC, realizaram um estudo que aponta um aumento de 400% no custo do tratamento da doença nos últimos quatro anos, incluindo quimioterapia, radioterapia e imunoterapia. Esse aumento deve-se não somente a incorporação de novos medicamentos e o impacto da pandemia no sistema de saúde, mas também ao diagnóstico tardio e subnotificação de casos da doença.
O estudo apresentado anteriormente (Frankenthal et al., 2022) demonstra que a aplicação do Protocolo de Toronto pelo Sistema Único de Saúde é custo-efetiva, tanto para pacientes do sexo masculino, quanto para pacientes do sexo feminino. Em ambos os casos, os valores apresentados mantêm-se dentro do limiar WTP, tornando viável a utilização das estratégias apresentadas pelo protocolo.
O diagnóstico precoce da síndrome de Li-Fraumeni é de extrema importância, pois possibilita que haja a identificação de portadores assintomáticos, ou seja, de indivíduos que não apresentam sinais clínicos de câncer. Sendo assim, ter um acompanhamento médico especializado é essencial para o paciente portador da síndrome. A realização de exames de imagem e testes genéticos, recomendados pelo Protocolo de Toronto, são essenciais para o monitoramento da saúde dos pacientes e permitem o descobrimento de tumores em estágios iniciais, possibilitando um melhor prognóstico, aumento de sobrevida do paciente e melhora da qualidade de vida, mesmo diante do alto risco de desenvolver tumores. Também, permite a personalização do tratamento de acordo com as particularidades e necessidades de cada paciente, visto que eles podem responder de forma diferente a terapias convencionais. Ademais, é importante que haja o aconselhamento genético familiar, para que informe aos outros membros da família a respeito do risco hereditário da síndrome, além de auxiliar nas estratégias de rastreio e no planejamento familiar.
REFERÊNCIAS BIBLIOGRÁFICAS
SCHNEIDER K, ZELLEY K, NICHOLS KE, GARBER J. Li-Fraumeni Syndrome. 1999 Jan 19 [updated 2019 Nov 21]. In: Adam MP, Feldman J, Mirzaa GM, Pagon RA, Wallace SE, Bean LJH, Gripp KW, Amemiya A, editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993–2023. PMID: 20301488.
ERIZA CRISTINA HAHN et al. TP53 p.Arg337His germline mutation prevalence in Southern Brazil: Further evidence for mutation testing in young breast cancer patients. v. 13, n. 12, p. e0209934–e0209934, 31 dez. 2018.
ROCCA, V. et al. Li–Fraumeni Syndrome: Mutation of TP53 Is a Biomarker of Hereditary Predisposition to Tumor: New Insights and Advances in the Treatment. Cancers, v. 14, n. 15, p. 3664, 27 jul. 2022.
LI, F. P. Soft-Tissue Sarcomas, Breast Cancer, and Other Neoplasms. Annals of Internal Medicine, v. 71, n. 4, p. 747, 1 out. 1969.
KAMIHARA, J.; RANA, H. Q.; GARBER, J. E. GermlineTP53Mutations and the Changing Landscape of Li-Fraumeni Syndrome. Human Mutation, v. 35, n. 6, p. 654–662, 20 maio 2014.
KUMAMOTO T, YAMAZAKI F, NAKANO Y, TAMURA C, TASHIRO S, HATTORI H, NAKAGAWARA A, TSUNEMATSU Y. Medical guidelines for Li- Fraumeni syndrome 2019, version 1.1. Int J Clin Oncol. 2021 Dec;26(12):2161- 2178. doi: 10.1007/s10147-021-02011-w. Epub 2021 Oct 11. Erratum in: Int J Clin Oncol. 2022 Jan;27(1):262-263. PMID: 34633580; PMCID: PMC8595164.
KRATZ, C. P. et al. Analysis of the Li-Fraumeni Spectrum Based on an International Germline TP53 Variant Data Set. JAMA Oncology, v. 7, n. 12, p. 1800, 1 dez. 2021.
¹Discente da Universidade Anhembi Morumbi, São Paulo/ SP, Brasil
²Docente da Universidade Anhembi Morumbi, São Paulo/ SP, Brasil
