Portosystemic shunt in a 5-mouth-old mixed-breed fameale dog – case report
REGISTRO DOI:10.69849/revistaft/th102411221424
Adriely Roberta Gonçalves,
Geovana de Fátima Santos Piola
Orientador: Maisa Martins Quirilos de Assis
RESUMO
O desvio portossistêmico ou shunt portossistêmico é uma afecção comumente vista em cães. Trata-se de uma anomalia vascular onde há comunicação entre a circulação sistêmica e a circulação portal. Foi diagnosticado em diversas espécies e pode ser classificado como: congênito, adquirido, solitário, múltiplo, intra ou extra-hepático. Em cães é mais comum ser encontrado em raças de porte pequeno, não tendo predileção de sexo. O paciente irá manifestar vários sinais clínicos com envolvimento neurológico ou apenas sistêmico em decorrência do acúmulo de toxinas no sangue. O tratamento de eleição para o shunt portossistemico é a ligadura do vaso anômalo, com auxílio do anel constritor ameróide.
Palavras-chave:Anomalia vascular; desvio portossistemico; constritor ameróide.
ABSTRACT
Portosystemic shunt or portosystemic shunt is a condition commonly seen dogs. It is a vascular anomaly where there is communication beyween the systemic circulation and the portal circulation. It has been diagnosed in several species and can be classified as: congenital, acquired, solitary, multiple, intra or extrahepatic. In dogs, it is more common to be found in small breeds, with no sex predilection. The patient will manifest several clinical signs with neurological or just systemic involvement due to the accumulation of toxins in the blood. The treatment of choice for portosystemic shunt is ligation of the anomalus vessel, with the aid of the ameroid constrictor ring.
Keywords: Vascular; portosystemic shunt; ameroid constrictor.
INTRODUÇÃO
O fígado é considerado a maior glândula do corpo, sendo localizado em região caudal ao diafragma do lado direito. Sua coloração de forma geral é vermelhoacastanhado, porém pode apresentar alteração devido ao acúmulo de gordura, passando a ter coloração mais amarelada (FRANDSON, 2011).
O fígado apresenta diversas funções, como: atua no metabolismo de carboidrato, gordura e proteína.Ainda produz a bile que é responsável pela emulsificação da gordura ingerida durante a alimentação (LEAL, 2021). Além disso, o fígado exerce função metabólica e imunológica sobre o sangue que está retornando do trato gastrointestinal, de forma que o sangue da veia porta constitui o suprimento sanguíneo funcional (FRANDSON, 2011).
O órgão recebe dois suprimentos sanguíneos: o sangue arterial oriundo da artéria hepática, um ramo da artéria celíaca, entra no lado do fígado adjacente às vísceras; com isso recebe o nome de Porta. A Porta recebe a veia porta, que carreia o sangue para o fígado a partir do estômago, baço, pâncreas e intestino (FRANDSON, 2011).
As Anomalias Vasculares Portossistêmicas ou SPS, são vasos anormais que permitem com que o sangue da porta que é drenado do estomago, pâncreas e baço entre diretamente na circulação sistêmica, sem passar pelo fígado primeiro (FOSSUM, 2021). O fígado dos animais que apresentam esta alteração tende a ser menor (JERICO, 2015). Os SPS são classificados como congênito, adquirido, intra-hepático e extrahepático. Congênito e extra-hepático normalmente são vasos anormais únicos, que permitem o fluxo sanguíneo anormal da veia porta diretamente para a circulação sistêmica. Os intra-hepáticos normalmente são congênitos, devido o não fechamento do ducto venoso após o nascimento ou até mesmo secundária a outras anastomoses da veia cava hepática ou da veia cava caudal (FOSSUM, 2021).
Adquirido e extra-hepático normalmente são múltiplos. Comumente, o intrahepático é encontrado em cães de raças grandes pela falha do fechamento do ducto venoso ao nascimento. As raças predispostas são: Pastor-alemão, Golden retriever, Dobermanpisncher, Labrador retriever, Setter irlandês, Samoieda, Wolfhound irlandês. Já o extra-hepático é encontrado em cães de raças pequenas devido a anastomose da veia porta. As raças mais predispostas são: Yorkshire terrier, Maltes, Silky terrier, Schnauzer terrier, Poodle, Lhasa-Apso, Bichonfrisé, Jack Russell terrier, Shihtzu e Pequines. O diagnóstico ocorre em animais com idade de 2 a 3 anos (JERICO, 2015. FOSSUM, 2021).
O tratamento inicial para o SPS é paliativo, buscando a melhora da condição clínica do paciente enquanto se aguarda o procedimento cirúrgico. Em casos que não pode ser realizado a cirurgia, o tratamento clínico deve ser realizado indefinidamente e o prognóstico do paciente pode ser desfavorável. O procedimento cirúrgico é o tratamento de escolha para animais com shunt (JERICO, 2015).
O objetivo do presente trabalho é relatar o caso de desvio portossistêmico em um cachorro fêmea sem raça definida, de 5 meses de idade diagnosticado por meio da tomografia na qual apresentou boa resposta ao tratamento cirúrgico.
RELATO DE CASO
Foi atendido, um canino fêmea, 5 meses de idade, SRD, no dia 10 de julho de 2023 na cidade de Maringá-PR com queixa principal a presença de ectoparasitas e sem protocolo vacinal estabelecido, além de dermatites na região do pescoço. Inicialmente, foi feito a administração do vermífugo e receitado rifamicina spray para passar nas lesões do pescoço à cada 12 horas.
No dia 29 de outubro de 2023 o animal veio a clínica para consulta onde apresentou quadro de apatia, episódios de êmese no qual tutora relatou que no dia anterior a consulta deu uma festa de aniversário e logo após isso, a paciente começou a apresentar os sinais clínicos. Relatou ainda a possibilidade de ingestão de algum alimento que não estaria dentro da sua alimentação padrão. No momento da consulta, foram coletados exames de sangue, onde se constatou níveis elevados das hemácias (7.270 milhões/mm3, valor ref.: 5,5-7,0 milhões/mm3), volume globular (46%,valor ref.: 34,40%) elevados níveis de alanina aminotransferase (ALT: 932,0 U/I, valor ref.: <10/88 U/I) e exame de ultrassonografia, no qual foram observados sedimentos urinários, esplenomegalia, sinal da medular renal e gastroenterite(Figura 1, 2 e 3).
Figura 1, 2 e 3 – Imagem ultrassonográfica, dia 29/10/2023.
Figura 1 e 2 – Bexiga urinária com moderada repleção líquida, com paredes normoespessas (0,08 cm), margens internas lisas e conteúdo luminal anecogenico associado a acentuada quantidade de partículas ecogênicas em suspensão. Figura 3- Fígado com margens regulares, arquitetura vascular portal e intra-hepática aparentemente preservadas quanto ao calibre e trajeto dos vasos. Figura 1:
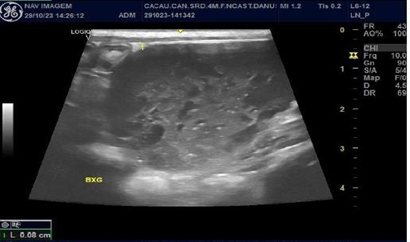
Figura 2:
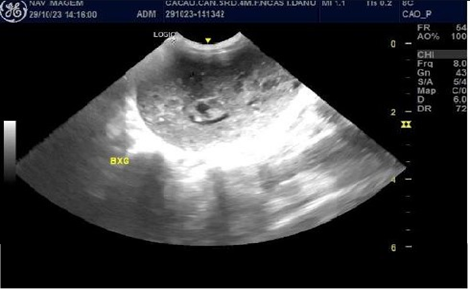
Figura 3:
Fonte: as autoras.
Logo após resultados dos exames, paciente ficou sob internação por 48 horas recebendo as seguintes medicações: Sulfadiazina (15 mg/kg,SC,duas vezes ao dia – BID), SAME (20 mg/kg,VO), silimarina (10 mg/kg, VO), dipirona (25 mg/kg, SC, duas vezes ao dia – BID) e citrato de maropitant (2 mg/kg, SC). Logo após isso, paciente foi liberado tendo a seguinte prescrição para casa:cloridrato de ondansetrona dihidratado– suspensão (4 gotas, duas vezes ao dia –BID) caso apresentar êmese ou náuseas; bifidobacteriumbifidum; enterococcusfaecium; lactobacillus acidophilus; lactobacillus plantarum, sacchamycescerevisiae – pasta (1 grama, 1 vez ao dia – SID) durante 7 dias.
No dia 14 de novembro e dia 17 de novembro de 2023 a paciente retornou para atendimento na clínica com os mesmos sinais clínicos e foi realizada nova coleta sanguínea para exames, onde constatou alterações no RDW (11,6%, valor ref.: 12,015,0%), níveis elevados de alanina aminotransferase (ALT: 3.267 U/I, valor ref.: 2173.0 U/I) e fosfatase alcalina (FA: 322 UI/L, valor ref.: 20-156 UI/L); no dia 18 foram constatados aumento da alanina aminotransferase (ALT: 3.036 U/I, valor ref.: 21-73 U/I), fosfatase alcalina (FA: 246 U/I, valor ref.: 20-156 UI/L), gama glutamil transpeptidase (GGT: 8.0 UI/L, valor ref.: 1.2-6.4 UI/L), redução dos níveis de colesterol total (102 mg/dl, valor ref.: 135-270 mg/dl) e bilirrubina total (0,08 mg/dl, valor ref.: 0,10-0,30 mg/dl) e ultrassonografia, no qual apresentou sedimentos/cristais urinários com diagnósticos diferenciais para microlitíases; sinal da medular que podendo estar relacionado a variação da normalidade ou nefropatia; achados esplênicos podendo estar relacionado a hiperplasia linfóide benigna, hematopoiese extramedular ou processo inflamatório/infeccioso e jejunite. (Figura 4, 5, 6 e 7).
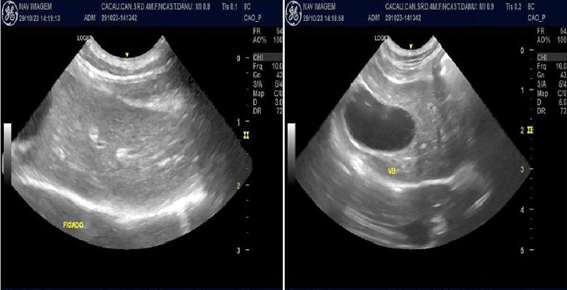
Figura 4, 5, 6, 7– Imagem ultrassonográfica, 14/11/2023.
Figura 4 e 5 – Bexiga urinária com presença de discreta quantidade de partículas ecogênicas em suspensão e depositadas em parede dorsal, parte delas realizando tênue artefato de reverberação (sedimentos/cristais urinários).Figura 6 – Vesícula biliar com ausência de imagem sonográficas compatíveis com cálculos,pólipos e/ou massas na vesícula. Figura 7- Fígado com arquitetura vascular portal e intra-hepática aparentemente preservadas quanto ao calibre e trajeto dos vasos.
Figura 4: Figura 5:
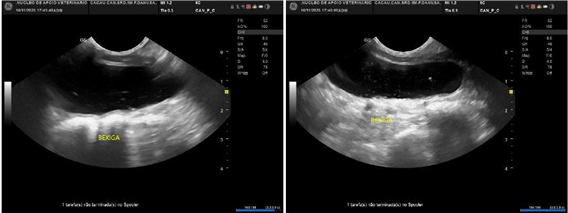
Figura 6: Figura 7:
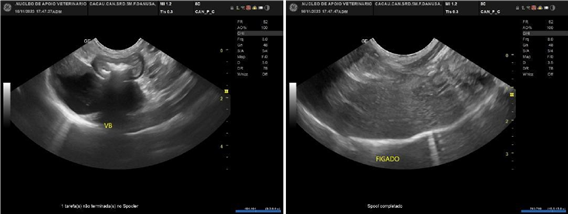
Fonte: as autoras.
Após isso, foi feito acompanhamento da paciente para monitoração dos níveis de alanina aminotransferase (ALT) e fosfatase alcalina (FA), além dos exames de ultrassonografia. Em ambos os retornos da paciente à clínica, foram observados e relatados os mesmos sinais clínicos: apatia, episódios de êmese.
No dia 23 de novembro de 2023, foi coletadas amostras de sangue para exames laboratoriais, tendo alteração no hematócrito (46%, valor ref.: 34-40%), leucograma sem alteração, na bioquímica sérica, onde foram constatada alteração em alanina aminotransferase (FA: 1.490 U/I, valor ref.: 21-73 U/I), gama glutamil transpeptidase (GGT: 11,0 UI/L, valor ref.: 1,2-6,4 UI/L), redução dos níveis de colesterol total (101, valor ref.: 135-270),aumento da bilirrubina total (0,44 mg/dl, valor ref.: 0,10-0,30 mg/dl) e bilirrubina direta (0,13 mg/dl, valor de ref.: 0,06-0,12 mg/dl) e ultrassonografia, tendo presença de sedimentos urinários; achados esplênicos dentro da normalidade para a idade do paciente, porém não descartando possibilidade de processo inflamatório/infeccioso, hiperplasia linfóide ou hematopoiese extramedular; possível microhepatia.
No dia 30 de novembro de 2023, paciente passou por exames hematológicos, no qual o hemograma apresentou alteração em hematócrito (46%, valor ref.: 34-40%), redução do RDW (11%, valor ref., 12-15%), no leucograma apresentou ausência de eosinófilos (valor ref.,: 80-800), na dosagem bioquímica, na qual apresentou um aumento significativo de 63 vezes da alanina aminotransferase (ALT: 4.662 U/I, valor ref.: 21-73 U/I), fosfatase alcalina (FA: 307 UI/L, valor ref.: 20-156 UI/L), redução dos níveis de colesterol total (113mg/dl, valor ref.: 135-270 mg/dl) e diminuição da uréia (11, valor ref.: 21,4-59,92). Além do mais, foi realizada a coleta da urina por meio da cistocentese para realização da urinálise (Quadro 1), onde foi apresentando alteração na coloração (amarelo escuro, ref.: amarelo), aspecto (turvo, ref.: límpido), presença de sangue oculto (+/+++,ref.: negativo), hemácias (30 a40, ref.: inferior a 5), bactéria (+/+++, ref.: ausentes), cristais (biurato de amônio +++/+++, ref.: ausentes).
Quadro 1 – Quadro de avaliação dos parâmetros de urinálise, dia 30/11/2023.
Resultado Referência: Exame físico Volume 10,0 ml Cor Amarelo escuro Amarelo Aspecto Turvo Límpido Densidade 1.030 1.015 a 1.045 Exame químico pH 6.5 5.5 a 7.5 Proteínas Traços Negativo a +/++++ Glicose Negativo Negativo Corpos cetónicos Negativo Negativo Cobilinogenio Normal 0,2 a 1.0 Bilirrubina Negativo Negativo a +/+++ Trito Negativo Negativo Sangue oculto +/+++ Negativo Cedimentoscopia Células renais ausentes Raras Células de pelve Ausentes Raras Células vesicais Raras Raras Células uretrais Ausentes Raras Leucócitos Ausentes Inferior a 5 Hemácias 30 a 40 Inferior a 5 Bactérias +/+++ Ausentes Cristais Biurato de (+++/+++) amonio Ausentes Cilindros Ausentes Ausentes Tipo de cistocentese coleta:
Fonte: as autoras.
No mesmo dia (dia 30 de novembro de 2023), paciente foi direcionada para a realização da Tomografia Computadorizada da região abdominal com administração de contraste iodado intravenoso no qual foi diagnosticado o Shunt Portossistêmico extrahepático do tipo portocaval (Figura 8 e 9).
Figura 8 e 9 – Imagem Tomografia Computadorizada, 30/11/2023.
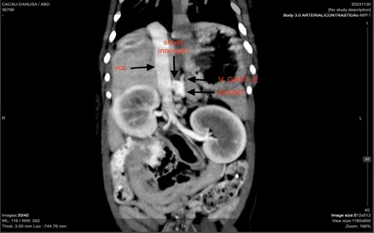
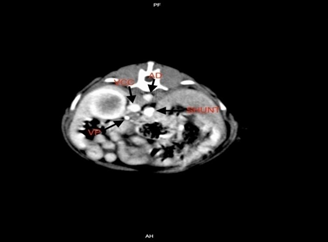
Fonte: as autoras.
Logo após resultados dos exames, paciente ficou sob internação por 72 horas recebendo as seguintes medicações: SAME (20 mg/kg, VO, duas vezes ao dia – BID), silimarina (10 mg/kg, VO, três vezes ao dia – TID), cerenia (2 mg/kg, SC, três vezes ao dia – SID), omeprazol (1 mg/kg, IV, três vezes ao dia – SID) até a realização da correção cirúrgica do shunt extra-hepático que a paciente apresentava, sendo feito a colocação do anel constritor ameróide no vaso anômalo.
No dia 03 de dezembro 2023, véspera do procedimento cirúrgico foi realizada novos exames, tendo aumento significativo da alanina aminotransferase (ALT: 2.973 U/I, valor ref.: 10-88 U/I) e da fosfatase alcalina (FA: 410 UI/L, valor ref.: 20-156 UI/L).
No dia 05 de dezembro de 2023, foi realizada a correção cirúrgica da paciente. A cirurgia teve como objetivo a identificação e oclusão do vaso anormal. Na paciente foi usado o constritor ameróide (Figura 11), no qual produto é importado.
Figura 11– Constritor ameróide.

Fonte: FOSSUM, 2021.
No pós operatório da paciente (dia 05 de dezembro de 2023), foram realizados novos exames hematológicos, os quais demonstraram diminuição de hemácias (4.680 milhões/mm3, valor ref.: 5,5-8,5 milhões/mm3), volume globular (28%, valor ref.: 3755%), hemoglobina (8,8 g/dL, valor ref.: 12-18 g/dL), plaquetas (83.000 mil/mm3, valor ref.: 166.000-575.000 mil/mm3). O leucograma apresentou diminuição dos monócitos (88.0 microlitros, valor ref.: 150-1.350 microlitros). A bioquímica sérica apresentou alteração da creatinina (0,4 mg/dL, valor ref.: 0,5-1,5mg/dL), e diminuição significativa da alanina aminotransferase (0,4 U/I, valor ref.: 10-88 U/I).
A paciente se manteve na Unidade de Tratamento Intensivo (UTI) e foi realizada a modificação de seu protocolo medicamentoso, sendo feito o uso dos medicamentos: ceftriaxona (30 mg/kg, IV, duas vezes ao dia – BID), meloxican (0,1 mg/kg, IV, uma vez ao dia – SID), dipirona (25 mg/kg, IV, duas vezes ao dia – BID), e caso necessário acepromazina e butorfanol para controle analgésico.
Depois de dois dias foram realizados novos exames, sendo observada redução significativa de hemácias (3,7 milhões/mm3, valor ref.: 5,5-7,0 milhões/mm3), hemoglobina (7,6 g/dL, valor ref.: 11-15,5 g/dL), hematócrito (26%, valor ref.: 3440%), CHCM (29,2 fL, valor ref.: 30-35 fL), RDW (11, valor ref.:12-15), plaquetas (104.000mil/mm3, valor ref.: 200.000-500.000 mil/mm3), PPT (4,3 g/dL, valor ref.:
5,0-6,5 g/dL), e na bioquímica sérica aumento significativo da alanina aminotransferase (ALT: 1.142 U/I, valor ref.: 21-79 U/I). Após internação, paciente foi liberada e recebeu a seguinte prescrição para casa: Cefalexina 90 mg – 1 cápsula duas vezes ao dia (BID) por 7 dias; meloxican 0,3 mg – 1 cápsula uma vez ao dia (SID) por 3 dias; dipirona – 3 gotas duas vezes ao dia (BID) por 3 dias. Para uso tópico, foi receitado rifocina spray para administrar sob a ferida 1 vez ao dia (SID).
DISCUSSÃO
Para diagnosticar o shunt teremos uma somatória de exames laboratoriais, sendo eles: hemograma, bioquímico, urinálise, exames de imagem como a ultrassonografia (US) e tomografia computadorizada (TM), além dos exames físicos e anamnese. (FOSSUM, 2021)
Na análise do hemograma, foi detectado um leve quadro de desidratação, quadro de anemia, classificada como anemia normocrômica hipocrômica arregenerativa. Normalmente o paciente com shunt apresenta macrocitose, não sendo a realidade neste caso (FOSSUM, 2021). Além disso, apresentou leucocitose de forma discreta, além de trombocitose.
Nos exames de bioquímica sérica, normalmente o paciente apresentará uma redução na concentração sérica da albumina, colesterol e uréia (FOSSUM, 2021). Logo após a cirurgia, a uréia e a albumina da paciente voltaram a normalidade, porém o colesterol se apresentou elevado podendo ser por inúmeros fatores o motivo de tal alteração.
Os exames laboratoriais da paciente apresentaram uma elevação significativa da ALT sendo 4 vezes acima do valor de referência indicado para sua idade e raça. A ALT é uma enzima presente no cortisol de várias células; é um indicador específico de lesão hepática em comparação com a AST. É liberada em casos de lesão celular e necrose e em casos de indução enzimática. A colestase e a obstrução biliar também podem causar aumento de ALT. De forma geral, a elevação da ALT não é algo totalmente considerável relevante quando alterada em níveis não tão significativos, mas quando ela se apresenta alterada de 2 a 3 vezes a mais que o valor normal é algo de extrema importância (SHELLY, 2013).
O exame ultrassonográfico permite a avaliação detalhada da arquitetura hepática interna, incluindo a vasculatura hepática e o sistema biliar (THALL, 2014). As veias hepáticas e portais são visualizados rotineiramente dentro do parênquima hepático. As veias portais são veias que se afinam suavemente caracterizadas por paredes ecogênicas brilhantes. O ramo esquerdo maior e o direito menor originam-se da veia porta principal próximo ao hilo hepático, embora se ramifiquem em planos e imagens diferentes (THRALL, 2014). As paredes das veias hepáticas não são ecogênicas, com exceção de sua confluência com a veia cava caudal, imediatamente adjacente ao diafragma. Porém, as artérias hepáticas não podem ser visualizadas com facilidade sem o Doppler colorido (THRALL, 2014).
A ultrassonografia é uma ferramenta que auxilia na diferenciação de doença hepática difusa da doença hepática focal. Além disso, ela pode ser utilizada para identificar a maioria dos desvios portossistêmicos de forma confiável, embora a detecção dessas anormalidades vasculares exija um alto nível de habilidade (THRALL, 2014). No desvio portossistêmico há a presença de um vaso anômalo, fígado pequeno, diminuição ou ausência da vasculatura portal intra-hepático do tamanho da via cava, rins aumentados e cálculos renais e/ou na bexiga. Os shunts são mais bem identificados quando se examina a veia cava e a veia porta pelo abdome direito craniolateralmente, com o animal em decúbito lateral esquerdo (SHELLY, 2013). O hilo hepático pode ser avaliado entre a décima primeira e a décima terceira costela direita. Além do mais, a veia cava é examinada do hilo hepático até sua bifurcação no abdome caudal (SHELLY, 2013). Além disso, para confirmação diagnóstica pode ser utilizado a ultrassonografia com auxílio do Doppler, o que não foi realizado no caso da paciente.
Os desvios extra-hepáticos afetam gatos e cães de raça pequena principalmente, sendo o achado mais comum um vaso anômalo único se conectando com a veia porta, ou com uma tributária maior da veia porta ao aspecto lateral esquerdo da veia cava caudal entre a veia renal direita e as veias hepáticas (THRALL, 2014). Esses tipos de desvios são os mais difíceis de serem visualizados devido à redução no tamanho hepático (micro-hepatia) devido a diminuição do fluxo sanguíneo e consequentemente falta de hepatotróficos para o seu correto funcionamento (Nelson & Couto, 2015).
Para realização da tomografia computadorizada (TM) da paciente foi realizado o uso de contraste intravenoso. Ela é de fácil e rápida execução, pouco invasiva e permite a visualização do desvio; exige anestesia geral e depende do estado clínico do paciente, não mede a velocidade do fluxo portal e possui alto custo. Na avaliação do fígado pode ser identificado uma estrutura vascular anômala de trajeto curvo (em ´C´´) em topografia epi-mesogástrica dorsal média, que se origina em face esquerda da veia porta, percorre craniodorsalmente acessando a veia cava caudal pré-hepática pela face esquerda (desvio portossistêmico extra-hepático portocaval). O vaso anômalo apresentou calibre de 0,77 cm junto com a veia cava caudal, 0,69 cm em seu terço médio e 0,57 cm junto com a veia porta. Veias esplênicas e gástricas esquerdas se inserem na estrutura vascular anômala ao invés de na veia porta.
Para correção do shunt foi utilizado o constritor ameróide que é constituído por um anel de caseína revestido por uma bainha de aço inoxidável. Inicialmente o desvio será afetado pelo volume higroscópio que é apresentado pelo dispositivo, ou seja, vai absorvendo água e se dilatando o que consequentemente levará a formação de um tecido fibroso devido sua presença, resultando dessa forma a oclusão do desvio. De forma geral, são usados ameróides de 3,5 a 5 mm na maior parte dos cães de pequeno porte; o uso de ameróides muito grandes deve ser evitado, pois o seu peso pode fazer com que o vaso se dobre e obstrua o fluxo de maneira prematura. O vaso é colocado na parte interna do dispositivo e o anel não deve comprometer o lúmen do vaso. É notório ressaltar que conforme for a proporção da velocidade da oclusão vascular, poderá influenciar a proporção individual do desenvolvimento do shunt adquirido. A concentração plasmática de proteínas pode afetar a velocidade de fechamento dos constritores ameróides, e alguns profissionais fazem uso do silicone que afeta diretamente no retardamento do dispositivo, porém no caso da paciente em questão não foi utilizado.
Logo após a realização do procedimento cirúrgico, foram realizados novamente exames bioquímicos no qual apresentou diminuição dos níveis de ALT voltando a sua normalidade sendo algo bastante significativo, pois desde o início do acompanhamento da paciente os níveis da ALT se apresentavam elevados, com aumento bastante significativo. Segundo GOMES et al., a ALT é uma enzima de extravasamento que se encontra livre no citoplasma dos hepatócitos, esta enzima é essencialmente hepatoespecífica. Deste modo, o aumento da ALT está relacionado com o desvio portossistemico.
Os valores da FA apresentaram-se bastante elevada pelo fato dela ser uma enzima de indução e, o aumento da produção e atividade sérica pode ser notado em casos de colestase. O aumento da sua atividade também se deve ao desvio portossistemico. No caso da paciente relatada, pode pressupor que houve danos nos hepatócitos, que liberaram a ALT acarretando lesão nos ductos hepáticos, causando o aumento da FA.
Nos exames bioquímicos a paciente apresentou elevação nos níveis de GGT na qual é considerada uma enzima marcadora de doenças hepáticas. Pode-se apresentar elevada em casos de colestase ou de necrose biliar (SHELLY, 2013).
A respeito das imagens ultrassonográficas da paciente, em ambos os exames foram visualizados: sedimentos/cristais urinários no qual paciente foi submetida a urinálise, achados esplênicos dentro da normalidade para a idade da paciente não descartando processo inflamatório/infeccioso, toxemia, esplenite ou hematopoiese extramedular, hiperplasia linfóide, microhepatia devido a diminuição do fluxo sanguíneo no órgão.
Com respeito a urinálise, a urina apresentou coloração amarelo escuro,com aspecto turvo, presença de sangue oculto, hemácias e bactérias, além disso foi encontrado cristais de biurato de amônio que, segundo Fossum seria um dos cristais normalmente encontrados nesses casos (FOSSUM, 2021).
Portanto, o tratamento cirúrgico foi bastante eficaz, a paciente não apresentou mais nenhum sinal clínico ou alterações em exames que estão relacionados com o shunt. Com as avaliações pós-cirurgicas, o prognóstico da paciente favorável, com recuperação clínica completa, sem necessidade de realização de tratamento medicamentoso contínuo, vindo à clínica somente para acompanhamento trimestral.
CONCLUSÃO
Com este relato, podemos concluir que a associação de técnicas diagnósticas pode ser de extrema importância para o diagnóstico e que dever ser realizado de forma que traga informações assertivas e rápidas, permitindo o tratamento adequado do paciente.
AGRADECIMENTO
Primeiramente a Deus que nos permitiu que tudo isso acontecesse, por ter nos amparado e sustentado durante os cinco anos de graduação, por ter iluminado nosso caminho e transformado cada obstáculo em degraus e dúvidas em fé; por nos ter dado força nos momentos de fraqueza e sabedoria nos momentos de incerteza.
A UNINGÁ que nos acolheu, desafiou e transformou em um profissional qualificado, mas também em uma pessoa melhor e completa; que abriu não somente suas portas, mas sim horizontes o que nos mostrou que o aprendizado vai além das salas de aula.
Agradecemos a todos os professores que puderam cooperar com a nossa formação, que passaram para nós seus conhecimentos e lições de vida, e em especial a nossa orientadora Maísa pelo suporte no pouco tempo que lhe coube e também pelo seu empenho dedicado à elaboração deste trabalho.
Aos nossos pais Ana Paula e Natalício, Luzia e Wilson, minha irmã Ana Júlia e meu sobrinho João Guilherme, que nos apoiaram em todas nossas dificuldades, que nos incentivaram nas horas difíceis, que nos momentos de nossa ausência dedicados aos estudos sempre nos mostraram e nos fizeram entender que o nosso futuro é feito a partir da nossa constante dedicação.
Para nossos companheiros, Bruno e Jefferson que compartilhou conosco sorrisos e lágrimas, que foram à calmaria em meio à tempestade. Obrigada por serem nossos portos seguros e nossas fontes inesgotáveis de apoio e carinho.
Agradecemos a clínica veterinária ProntoDog e Cat e todos os médicos veterinários que lá trabalham, pela oportunidade que nos deram em estar relatando o caso deste trabalho.
Por fim, nossa mensagem de agradecimento a todas as pessoas que cruzaram nosso caminho durante esta fase, cada um de vocês deixaram uma marca importante em nossa jornada, contribuindo para nosso crescimento e sucesso.
REFERÊNCIAS
Brito, M. R. (2019). Aspectos clínicos do shunt portossistemico em cães (Trabalho de Conclusão de Curso). UNICEPLAC, Gama, Distrito Federal.
Broome, C.J. et al. Congenital portosystemic shunts in dogs and cats. New Zealand Veterinary Journal, v. 52, n. 4, p. 154-162, 2004.
Fossum, Theresa Welch. Cirurgia de pequenos animais. 5. ed. Rio de Janeiro: Guanabara Koogan, 2021. p. 550-554.
Frandson, Rowen D. Anatomy and physiology of farm animals. 7 ed. Apêndice, 2011. p. 287-288.
Gomes, A., Parra, B. S., Franco, F. D. O., Basile, L., Jose, L. T., Romero, V. L., & Sacco, S. R. (2008). Exame da função hepática na Medicina Veterinária. Revista Científica Eletrônica de Medicina Veterinária, 11(2), 1-7.
Havig, K.A. Outcome of ameroid constrictor occlusion of single congenital extrahepatic portosystemic shunts in cats: 12 cases (1993–2000). Journal of the American Veterinary Medical Association, v. 220, p. 337–341, 2002.
Howes, F. Hepatopatias crônicas em cães. Monografia de especialização. Santa Maria – RS.p.13-72, 2011
Jerico, Márcia Marques. Tratado de medicina interna de cães e gatos. 1. ed. Rio de Janeiro, 2015. p. 550.
Junqueira, L.C.; Carneiro, J. Histologia básica. 11. ed. Rio de Janeiro: Guanabara Koogan, 2008. p. 268-284.
Leal, Leonardo Martins. Anatomia veterinária. 1. ed. São Paulo: Medvet, 2021. p. 116.
Mehl, ML, Kyles, AE, Hardie, EM, Kass, PH, Adin, CA, Flynn, AK, … & Gregory, CR (2005). Avaliação de constritores de anel ameroide para tratamento de shunts portossistêmicos extra-hepáticos únicos em cães: 168 casos (1995–2001). Journal of the American Veterinary Medical Association , 226 (12), 2020-2030.
Murphy, S.T. et al. A comparison of the ameroid constrictor versus ligation in the surgical management of single extrahepatic portosystemic shunts. Journal of the American Animal Hospital Association, v. 37, p. 390-396, 2001.
Pennik, D.; D’anjou, M.A. Atlas of Small Animal Ultrasonography. Blackwell, Iowa, 2008. p. 250-253.
Sereda, C. W., & Adin, C. A. (2005). Methods of gradual vascular occlusion and their applications in treatment of congenital portosystemic shunts in dogs: a review. Veterinary Surgery, 34(1), 83-91.
Thrall, Donald E. et al. Diagnóstico de radiologia veterinária. 6. ed. Tradução: Aldacilene Souza da Silva et al. Rio de Janeiro: Elsevier, 2014.
Maia, D. (2021/2). Desvio Portossistemico em um cão: Revisão bibliográfica e Relato de Caso (Trabalho de Conclusão de Curso). Universidade Federal do Rio Grande do Sul, Porto Alegre, Brasil.
NELSON, Richard; Couto, C. Guillermo. Medicina interna de pequenos animais. Elsevier Brasil, 2015.
Thrall, M.A.; Weiser, G.; Allison, R. et al. Hematologia e bioquímica clínica veterinária. 2. ed. Rio de Janeiro: Guanabara Koogan, 2015. p. 349-360.
Vaden, Shelly L. et al. Exames laboratoriais e procedimentos diagnósticos em cães e gatos. 1. ed. Tradução: Adriana Érica Wilkes Burton Meirelles et al. São Paulo: Roca, 2013.
Winkler, J.T. et al. Portosystemic shunts: diagnosis, prognosis, and treatment of 64 cases (1993-2001). Journal of the American Animal Hospital Association, v. 39, p. 169-185, 2003.
1 UNINGÁ – Centro Universitário Ingá, Departamento Medicina Veterinária
3 UNINGÁ – Centro Universitário Ingá, Departamento Medicina Veterinária
para correspondência, e-mail: adrielygon@gmail.com, geovanapiola5@gmail.com
