REGISTRO DOI: 10.69849/revistaft/cl10202509221648
Raphael Gomes dos Santos
Orientador: MV MSc Bruna Scalzilli Luzes
Resumo
O sarcoma de aplicação felino (SAF) é uma neoplasia cutânea maligna de origem mesenquimal, com comportamento localmente agressivo, elevada taxa de recorrência e exige abordagem cirúrgica agressiva para maior controle local. Relata-se o caso de um felino, macho, sem raça definida, com massa de 10 cm no flanco direito, compatível com SAF. Após exames de estadiamento, optou-se por excisão oncológica ampla, com margens de 3 cm e dois planos profundos, seguida de reconstrução por retalho de rotação do plexo subdérmico. A técnica permitiu cobertura adequada do defeito cirúrgico e restabelecimento da função local. O caso ressalta a importância do planejamento cirúrgico aliado a métodos reconstrutivos na abordagem do SAF, contribuindo para melhor controle da doença e qualidade de vida do paciente.
Palavras-chave: sarcoma de aplicação felino; oncologia veterinária; cirurgia reconstrutiva;
Abstract
Feline injection-site sarcoma (FISS) is a malignant cutaneous neoplasm of mesenchymal origin, characterized by locally aggressive behavior, high recurrence rate, and requires wide surgical excision for optimal local control. This case reports a mixed-breed male cat with a 10 cm right flank mass consistent with FISS. After staging, wide oncologic excision was performed with 3 cm margins and two deep planes, followed by reconstruction using a subdermal rotation flap. This technique ensured adequate wound coverage and restoration of local function. The case emphasizes the importance of meticulous surgical planning and reconstructive approaches in managing FISS, aiming to improve disease control and patient quality of life.
Keywords: feline injection-site sarcoma; veterinary oncology; reconstructive surgery;
Introdução
O sarcoma de aplicação felino (SAF) é uma neoplasia cutânea maligna, de origem mesenquimal, com comportamento localmente agressivo e alto índice de recorrência. Sua ocorrência é associada, principalmente, a reações inflamatórias crônicas após aplicações de vacinas, medicamentos ou outros agentes injetáveis. A prevalência estimada varia de 1 a 13 casos a cada 10.000 gatos vacinados, representando de 6 a 12% das neoplasias em felinos¹,⁶. O diagnóstico pode ser desafiador devido à presença de necrose e inflamação nas amostras citológicas, tornando a biópsia incisional a principal ferramenta diagnóstica. A avaliação de estadiamento inclui exames de imagem, como radiografias torácicas, ultrassonografia abdominal e tomografia computadorizada, essenciais para o planejamento cirúrgico¹²,¹¹,²¹. O tratamento de escolha envolve excisão cirúrgica ampla, com margens de 3 a 5 cm e dois planos profundos, sendo comum a necessidade de retalhos reconstrutivos e terapias adjuvantes, como eletroquimioterapia, para melhor controle local¹⁵,¹³.
Este trabalho tem como objetivo relatar o caso de um felino com fibrossarcoma grau III, destacando o planejamento da excisão oncológica ampla e a técnica reconstrutiva empregada por meio de retalho de rotação subdérmico.
Relato de caso
Um felino, macho, castrado, sem raça definida, foi atendido no Hospital Público Veterinário de Osasco, com histórico de hiporexia, prostração, emagrecimento progressivo e presença de massa firme, aderida, com aproximadamente 10 cm de diâmetro no flanco direito. De acordo com o histórico, cinco meses antes o paciente sofreu uma queda do terceiro andar e recebeu medicação injetável no flanco direito. Desde então, observou-se crescimento progressivo de uma massa no local, compatível com o quadro clínico de sarcoma de aplicação.
Inicialmente foram realizados dois exames citológicos, os quais apresentaram células inflamatórias e resultados inconclusivos. Foram solicitados exames de triagem oncológica e avaliação pré-anestésica, incluindo hemograma, bioquímicos hepáticos e renais, radiografias torácicas e abdominais, ecocardiograma, eletrocardiograma e ultrassonografia abdominal. Todos os exames apresentavam-se dentro da normalidade para a espécie, entretanto, a radiografia torácica evidenciou duas estruturas arredondadas, radiopacas, sugestivas de metástases pulmonares (Figura 1). A radiografia abdominal mostrou massa de densidade aumentada no abdome caudal esquerdo (Figura 2).
Figura 1: radiografia torácica, visualizadas duas estruturas de maior radiopacidade, arredondadas, sendo a maior medindo aproximadamente 1,0 cm de diâmetro em 9º espaço intercostal esquerdo pela projeção Ventrodorsal (A) e a menor medindo aproximadamente 0,5 cm de diâmetro em região de 3º espaço intercostal pela projeção laterolateral (B).
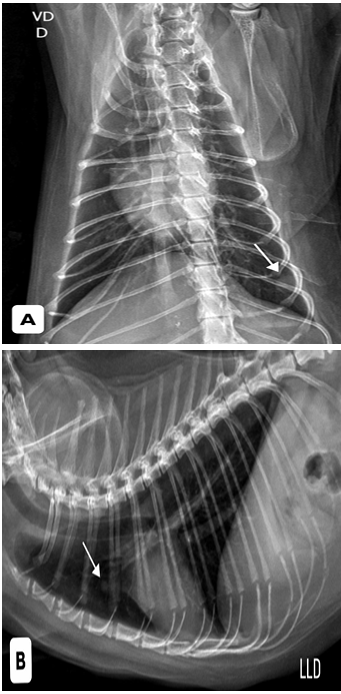
Fonte: Setor de imagem do Hospital Veterinário Público Anclivepa-SP, 2025.
Figura 2: radiografia abdominal mostrou acentuada estrutura de maior radiopacidade em região lateral direita do abdômen caudal pela projeção laterolateral (A) e pela projeção ventrodorsal (B).
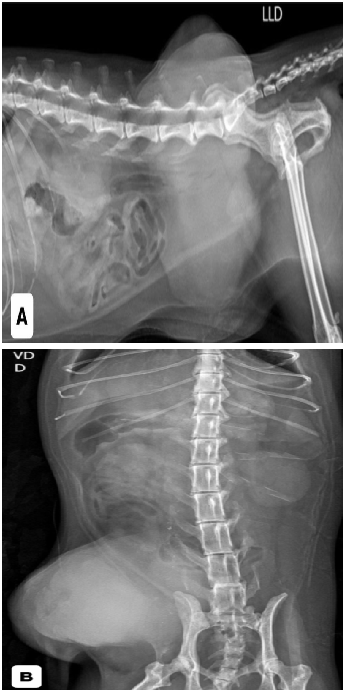
Fonte: Setor de imagem do Hospital Veterinário Público Anclivepa-SP, 2025.
Diante do quadro clínico e dos achados de imagem, optou-se por ressecção ampla da massa com margens de 3 cm e dois planos profundos, seguida de reconstrução com retalho de rotação do plexo subdérmico.
O paciente foi posicionado em decúbito lateral esquerdo, sendo realizada tricotomia ampla da região operatória, seguida de antissepsia cirúrgica com Clorexidina degermante a 2% e Clorexidina alcoólica a 0,5% (Figura 3). Procedeu-se à delimitação das margens cirúrgicas com 3 cm de distância da lesão, seguida de incisão cutânea e divulsão do tecido subcutâneo. Foi realizada ligadura dupla da artéria e veia ilíaca circunflexa profunda direita. Em seguida, efetuou-se a incisão das porções dos músculos glúteo médio, glúteo superficial e tensor da fáscia lata, a fim de alcançar as margens cirúrgicas profundas e permitir a excisão completa da neoformação (Figura 4).
Figura 3: Massa em flanco direito do paciente após antissepsia.
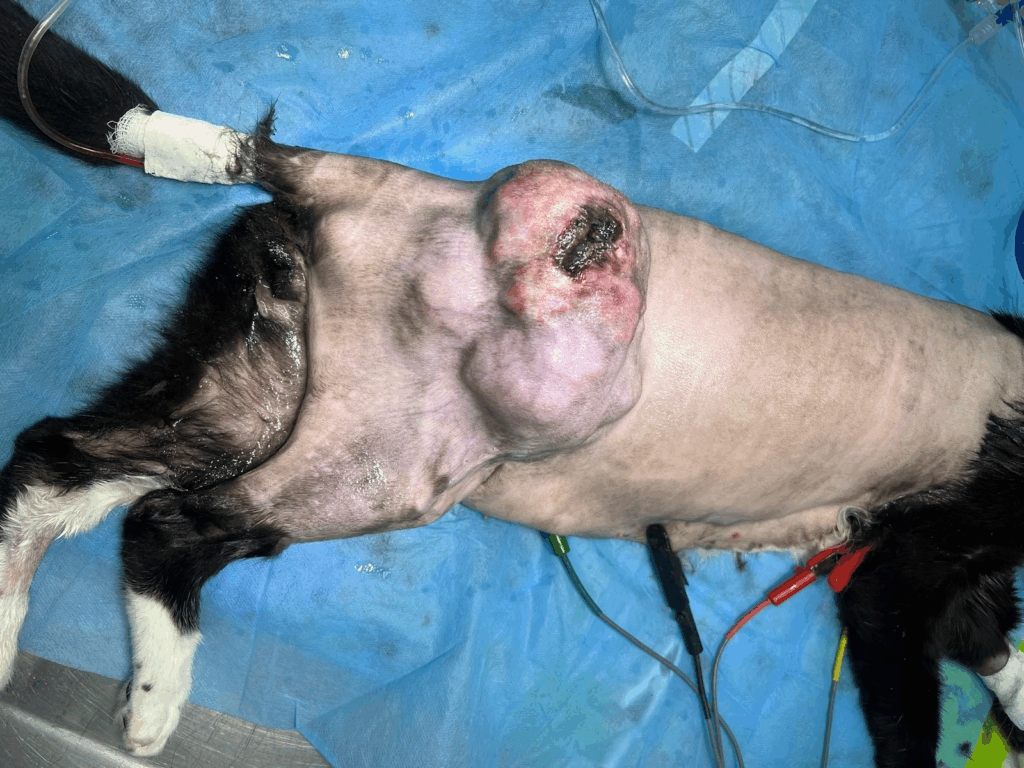
Fonte: Arquivo pessoal.
Figura 4: Excisão quase completa de neoformação.
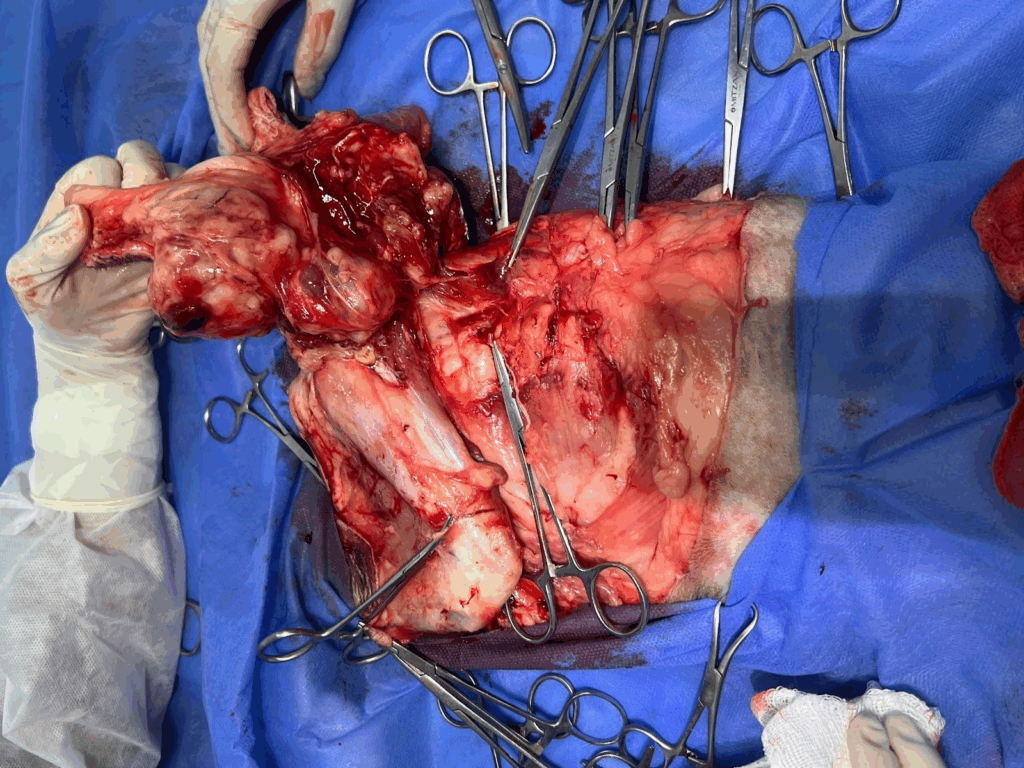
Fonte: Arquivo pessoal.
Realizou-se a troca de luvas e instrumentos cirúrgicos, iniciando-se então a síntese da ferida. A sutura teve início nos planos profundos, com aproximação da musculatura remanescente com fio nylon 3-0 em padrão simples separado. Em continuidade, foi empregada a técnica de retalho de rotação a partir da região toracodorsal direita. Para a confecção do retalho, foi necessária ampla divulsão do tecido subcutâneo, com atenção especial à preservação do músculo cutâneo do tronco e sua vascularização.
O retalho foi posicionado sobre o leito cirúrgico previamente preparado, e procedeu-se à redução do espaço morto utilizando-se a técnica de “walking suture”. A síntese do tecido subcutâneo foi realizada com padrão colchoeiro modificado, seguida de dermorrafia com pontos simples interrompidos. Foi possível observar, como aspecto cirúrgico final, uma extensa área de ferida operatória, abrangendo a região toracodorsal e a face lateral do membro pélvico direito (Figura 5). Não houve intercorrências.
Figura 5: Ferida cirúrgica, após finalização do procedimento cirúrgico.
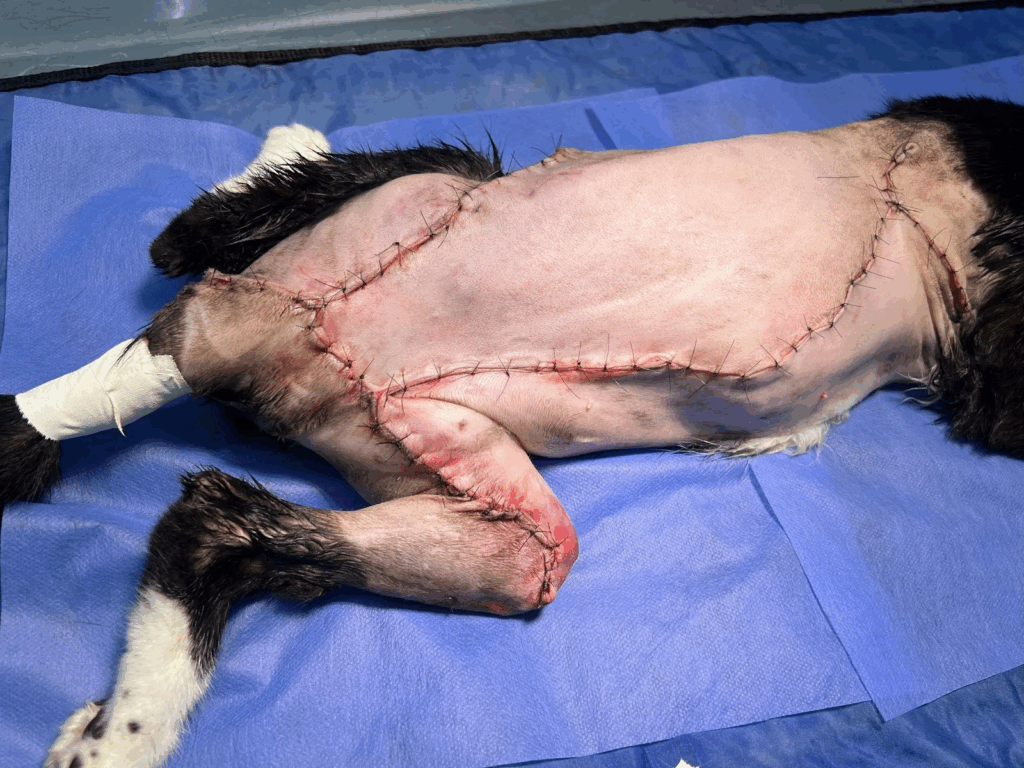
Fonte: Arquivo pessoal.
Ao término do procedimento, foi realizado curativo estéril e bandagem compressiva. No pós-operatório imediato, o animal recebeu medicação analgésica e anti-inflamatória (metadona 0,1mg/kg, dipirona 25mg/kg e meloxicam 0,1mg/kg). O paciente recebeu suporte intensivo nas primeiras 48 horas, com analgesia endovenosa e curativos diários. Nos dias que se seguiram ao pós-operatório, foi prescrito o uso de Amoxicilina com clavulanato de potássio 22 mg/kg por via oral a cada 12 horas, durante 7 dias, cloridrato de tramadol na dose de 2 mg/kg por via oral a cada 12 horas, durante 5 dias, dipirona na dose 25mg/kg por via oral a cada 24 horas, durante 5 dias e meloxicam na dose 0,05 mg/kg por via oral a cada 24 horas, durante quatro dias. A análise histopatológica confirmou o diagnóstico de fibrossarcoma grau III, com margens laterais livres e profundas estreitas. Diante disso, o paciente foi encaminhado para acompanhamento oncológico especializado, sendo o prognóstico reservado devido ao alto risco de recidiva local e possível progressão das metástases pulmonares.
Após sete dias do procedimento cirúrgico, a região de cicatrização apresentou hematomas, acompanhados por acúmulo de seroma na área correspondente ao retalho localizado em regiões lombar e torácica (Figura 6). Decorridas três semanas, observou-se deiscência da sutura, o que demandou a realização de desbridamento da área acometida e necessidade de cicatrização da ferida por segunda intenção (Figura 7).
Figura 6: Aspecto da ferida cirúrgica após 7 dias de procedimento
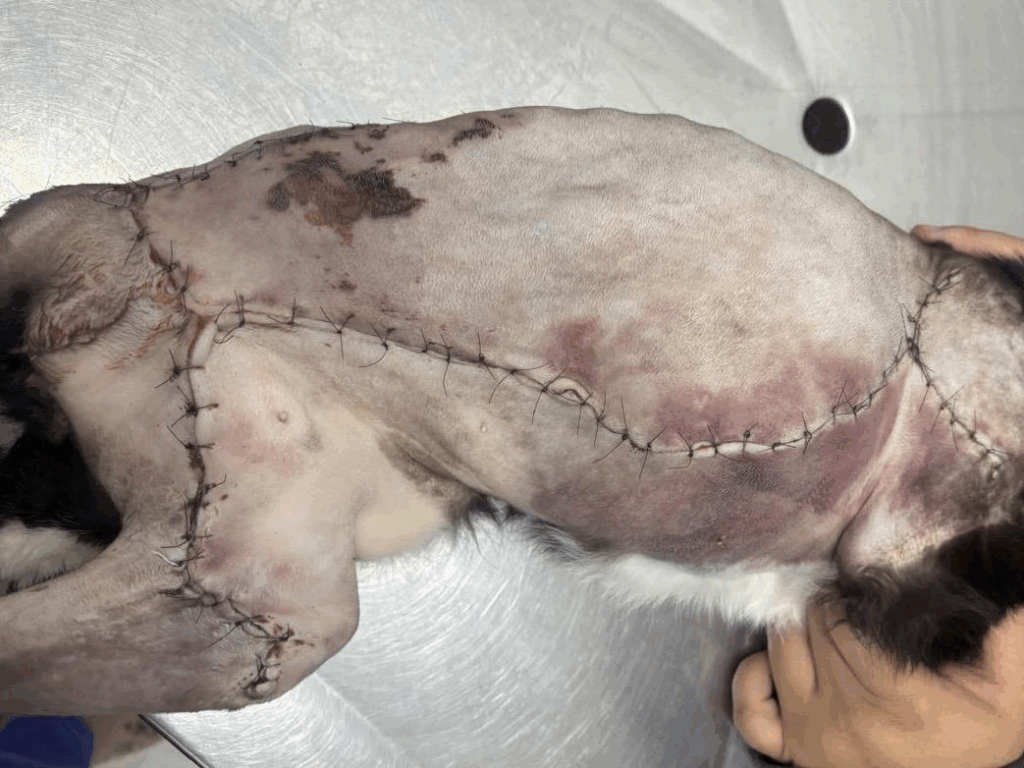
Fonte: Arquivo pessoal.
Figura 7: Aspecto da ferida após debridamento.
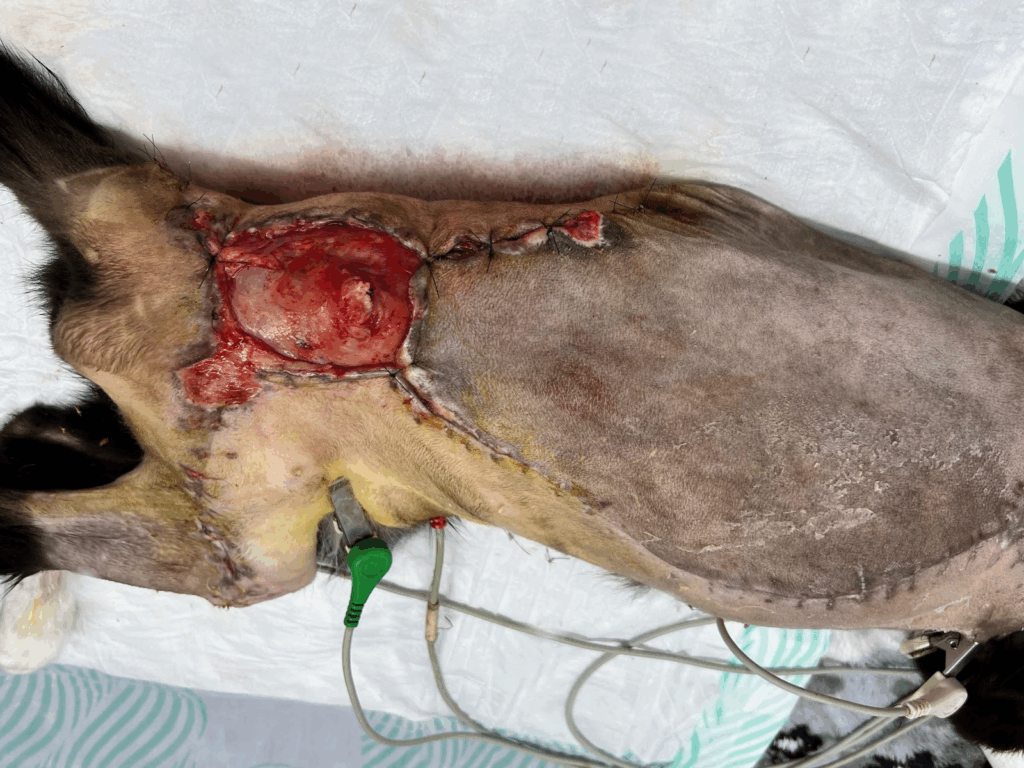
Fonte: Imagem cordialmente cedida pela equipe Cirúrgica Anclivepa, 2025.
Discussão
O sarcoma de aplicação felino (SAF) é uma neoplasia maligna de origem mesenquimal, que apresenta comportamento localmente invasivo e margens de crescimento pouco definidas⁹,¹⁴,²². No caso descrito, o paciente apresentava uma massa firme, aderida e progressiva na região do flanco direito, com histórico de aplicação de medicamento no mesmo local cerca de cinco meses antes. Esse histórico, aliado às características clínicas observadas, corrobora com a descrição clássica do SAF, que geralmente surge semanas ou meses após a aplicação de fármacos ou vacinas, destacando-se pela rápida progressão e aderência a planos profundos.
O exame citológico é frequentemente utilizado como triagem inicial por ser pouco invasivo, mas a intensa inflamação e necrose tumoral dificultam a visualização de células neoplásicas, resultando em diagnósticos inconclusivos em até 50% dos casos⁷,¹². No presente relato, a citologia foi inicialmente não diagnóstica, sendo necessário prosseguir com exames complementares e posterior confirmação histopatológica do fibrossarcoma grau III.
A avaliação oncológica do paciente com suspeita de SAF deve ser ampla, incluindo hemograma, bioquímica, exames de imagem e sorologias para os vírus da imunodeficiência felina (FIV) e da leucemia felina (FeLV), com o objetivo de estabelecer o estadiamento clínico e investigar a presença de metástases. No caso apresentado, as radiografias torácicas evidenciaram estruturas sugestivas de metástases pulmonares, achado compatível com a literatura, que aponta metástases em até 24% dos casos, principalmente para pulmões, linfonodos regionais, fígado e pelve¹⁸. Tal constatação agravou o prognóstico e reduziu a expectativa de vida do paciente.
A excisão cirúrgica ampla é a principal abordagem no tratamento do SAF, sendo essencial para reduzir a taxa de recidiva local. Margens laterais inferiores a três centímetros estão associadas a recorrência em até 70% dos casos, enquanto margens entre três e cinco centímetros e dois planos profundos garantem margens histologicamente limpas em 97% dos pacientes, com recidiva reduzida para 14%⁸,¹⁵. No caso relatado, foi realizada a exérese cirúrgica com margens laterais de 3 cm e dois planos profundos, seguida de reconstrução com retalho de rotação. Essa técnica é indicada para o fechamento de grandes defeitos, com preservação da vascularização subdérmica e boa adaptabilidade à anatomia do paciente¹³.
O controle da dor foi realizado com analgesia multimodal no pós-operatório, contribuindo para a recuperação clínica⁴,¹⁷. As complicações mais frequentemente associadas aos procedimentos cirúrgicos de ressecção tumoral em felinos, assim como cirurgias reconstrutivas, incluem seroma, deiscência, dor e infecção, sobretudo em intervenções de longa duração, nas quais o tempo cirúrgico está diretamente relacionado ao tamanho tumoral e à complexidade técnica envolvida ²,¹¹,²³. O manejo adequado da ferida operatória, por meio da manutenção de bandagens, inspeção frequente e higienização, é essencial para favorecer a evolução positiva do paciente. No caso relatado, observou-se a ocorrência de seroma, necrose e deiscência de sutura, achados que coincidem com as complicações mais descritas na literatura para este tipo de procedimento.
A radioterapia é uma modalidade complementar valiosa no tratamento do SAF, podendo ser aplicada tanto no pré quanto no pós-operatório. No pré-operatório, contribui para a redução do volume tumoral e facilita a excisão com menores chances de margens contaminadas, embora aumente o risco de complicações cicatriciais, como deiscências¹⁰. No pós-operatório, atua sobre a doença microscópica remanescente, sendo aplicada na região da cicatriz com margem de segurança de até 3 cm ao redor. Estudos demonstram intervalos livres da doença superiores a 1000 dias com essa abordagem, embora a taxa de recidiva local ainda possa chegar a 45%³,⁵. No caso descrito, a radioterapia não foi realizada devido a restrições financeiras, o que pode impactar negativamente o controle local da neoplasia.
A quimioterapia adjuvante também representa uma alternativa terapêutica importante, especialmente para sarcomas de alto grau e casos com metástases, como neste relato. A doxorrubicina é o agente citotóxico mais empregado, podendo aumentar o tempo livre de doença e reduzir a taxa de metástases¹⁶, embora seus efeitos adversos, como mielossupressão e nefrotoxicidade, exijam atenção.
A eletroquimioterapia com bleomicina ou cisplatina, associada à aplicação de pulsos elétricos locais, têm demonstrado eficácia em prolongar o tempo até a recidiva, mesmo em casos de margens comprometidas¹⁹,²⁰. No presente caso, essa modalidade não foi realizada devido a limitações financeiras, mas sua utilização poderia ter contribuído significativamente para o controle local da doença. Destaca-se ainda que o uso de exames de imagem avançados, como a tomografia computadorizada, teria proporcionado uma avaliação mais precisa da extensão tumoral e da infiltração em estruturas adjacentes, sendo de grande utilidade no planejamento cirúrgico²¹,²⁴.
Considerações finais
A excisão cirúrgica ampla permanece como o principal tratamento para o sarcoma de aplicação felino, especialmente em casos avançados. No caso descrito, a cirurgia com margens adequadas e reconstrução com retalho possibilitou uma boa recuperação pós-operatória, apesar da presença de metástases no momento do diagnóstico.
A indisponibilidade de exames avançados de imagem e de terapias adjuvantes, como radioterapia e eletroquimioterapia, pode comprometer o controle local e o prognóstico. Este relato reforça a importância do diagnóstico precoce, do planejamento cirúrgico adequado e da aplicação de terapias complementares, sempre que possível, para aumentar o intervalo livre de recidiva e melhorar a qualidade de vida dos pacientes felinos acometidos por essa neoplasia.
Referências
- BOWLT, K. Feline injection site-associated sarcomas. In Practice, v. 37, n. 1, p. 2-8, 2015. DOI: https://doi.org/10.1136/inp.h65.
- CANTATORE, M.; FERRARI, R.; BORACCHI, P.; GOBBETTI, M.; TRAVETTI, O.; RAVASIO, G.; GRANATO, A.; NODARI, S.; ROMUSSI, S. Factors influencing wound healing complications after wide excision of injection site sarcomas of the trunk of cats. Veterinary Surgery, v. 43, n. 7, p. 783-790, 2014. DOI: https://doi.org/10.1111/j.1532-950X.2014.12217.x.
- CRONIN, K.; PAGE, R. L.; SPODNICK, G.; DODGE, R.; HARDIE, E. N.; PRICE, G. S.; THRALL, D. E.; LARUE, S. M.; NOVOSEL, T. J.; THOMAS, R. Radiation therapy and surgery for fibrosarcoma in 33 cats. Veterinary Radiology & Ultrasound, v. 39, n. 1, p. 51-56, 1998. DOI: https://doi.org/10.1111/j.1740-8261.1998.tb00325.x.
- DAVIS, K. M.; HARDIE, E. M.; LASCELLES, B. D. X.; HANSEN, B. Feline fibrosarcoma: perioperative management. Compendium on Continuing Education for the Practicing Veterinarian, v. 29, n. 12, p. 712-732, 2007.
- ECKSTEIN, C.; GUSCETTI, F.; ROOS, M.; MARTÍN DE LAS MULAS, J.; KASER-HOTZ, B.; ROHRER BLEY, C. A retrospective analysis of radiation therapy for the treatment of feline vaccine-associated sarcoma. Veterinary and Comparative Oncology, v. 7, n. 1, p. 54-68, 2009. DOI: https://doi.org/10.1111/j.1476-5829.2008.00173.x.
- HARTMANN, K.; DAY, M. J.; THIRY, E.; LLORET, A.; FRYMUS, T.; ADDIE, D.; BELÁK, S.; BOUCRAUT-BARALON, C.; EGEBERG, C.; GRINDLAY, D.; HOSIE, M. J.; LLOBERA, A.; LUTZ, H.; MARSILIO, F.; PENNISI, M. G.; RADFORD, A. D.; TRUYEN, U.; HORZINEK, M. C. Feline injection-site sarcoma. Journal of Feline Medicine and Surgery, v. 17, n. 7, p. 606-613, 2015. DOI: https://doi.org/10.1177/1098612X15588451.
- HAUCK, M. Feline injection site sarcomas. Veterinary Clinics of North America: Small Animal Practice, v. 33, n. 3, p. 553-571, 2003.
- HENDRICK, M. J.; SHOFER, F. S.; GOLDSCHMIDT, M. H.; HAVILAND, J. C.; SCHELLING, S. H.; ENGLER, S. J.; NODINE, E. A. Comparison of fibrosarcomas that developed at vaccination sites and at nonvaccination sites in cats: 239 cases (1991-1992). Journal of the American Veterinary Medical Association, v. 205, n. 10, p. 1425-1429, 1994. Disponível em: http://www.ncbi.nlm.nih.gov/pubmed/7698923.
- HENRY, C. J. Update on vaccine-associated sarcomas. In: AUGUST, J. R. (ed.). Consultations in feline internal medicine. v. 4. Philadelphia: WB Saunders, 2001. p. 541-547.
- KOBAYASHI, T.; HAUCK, M. L.; DODGE, R.; PAGE, R. L.; PRICE, G. S.; WILLIAMS, L. E.; THRALL, D. E.; LARUE, S. M.; NOVOSEL, T. J.; THOMAS, R. Preoperative radiotherapy for vaccine associated sarcoma in 92 cats. Veterinary Radiology & Ultrasound, v. 43, n. 5, p. 473-479, 2002. DOI: https://doi.org/10.1111/j.1740-8261.2002.tb01036.x.
- LADLOW, J. Injection site-associated sarcoma in the cat. Journal of Feline Medicine and Surgery, v. 15, n. 5, p. 409-418, 2013. DOI: https://doi.org/10.1177/1098612X13483239.
- MARTANO, M.; MORELLO, E.; BURACCO, P. Feline injection-site sarcoma: past, present and future perspectives. The Veterinary Journal, v. 188, n. 2, p. 136-141, 2011. DOI: https://doi.org/10.1016/j.tvjl.2010.04.025.
- MÜLLER, N.; KESSLER, M. Curative-intent radical en bloc resection using a minimum of a 3 cm margin in feline injection-site sarcomas: a retrospective analysis of 131 cases. Journal of Feline Medicine and Surgery, v. 20, n. 6, p. 509-519, 2018. DOI: https://doi.org/10.1177/1098612X17717882.
- OGILVIE, G. K.; MOORE, A. S. Feline oncology: a comprehensive guide to compassionate care. Trenton: Veterinary Learning Systems, 2002.
- PHELPS, H. A.; KUNTZ, C. A.; MILNER, R. J.; POWERS, B. E.; BACON, N. J. Radical excision with five-centimeter margins for treatment of feline injection-site sarcomas: 91 cases (1998–2002). Journal of the American Veterinary Medical Association, v. 239, n. 1, p. 97-106, 2011. DOI: https://doi.org/10.2460/javma.239.1.97.
- POIRIER, V. J.; THAMM, D. H.; KURZMAN, I. D.; JEGLUM, K. A.; CHUN, R.; OBRADOVICH, J. E.; RICHARDSON, R. C. Liposome-encapsulated doxorubicin (Doxil) and doxorubicin in the treatment of vaccine-associated sarcoma in cats. Journal of Veterinary Internal Medicine, v. 16, n. 6, p. 726-731, 2002. DOI: https://doi.org/10.1111/j.1939-1676.2002.tb02415.x.
- ROBERTSON, S. A.; LASCELLES, B. D. X. Long-term pain in cats. Journal of Feline Medicine and Surgery, v. 12, n. 3, p. 188-199, 2010. DOI: https://doi.org/10.1016/j.jfms.2010.01.002.
- SÉGUIN, B. Feline injection site sarcomas. Veterinary Clinics of North America: Small Animal Practice, v. 32, n. 4, p. 983-995, 2002.
- SPUGNINI, E. P.; BALDI, A.; VINCENZI, B.; BONGIORNI, F.; BELLELLI, C.; CITRO, G.; PORCELLINI, A.; GIORDANO, A. Intraoperative versus postoperative electrochemotherapy in high grade soft tissue sarcomas: a preliminary study in a spontaneous feline model. Cancer Chemotherapy and Pharmacology, v. 59, n. 3, p. 375-381, 2006. DOI: https://doi.org/10.1007/s00280-006-0281-y.
- SPUGNINI, E. P.; RENAUD, S. M.; BUGLIONI, S.; CAROCCI, F.; DRAGONETTI, E.; MURACE, R.; DELL’ANNA, M. L.; BALDI, A. Electrochemotherapy with cisplatin enhances local control after surgical ablation of fibrosarcoma in cats. Journal of Translational Medicine, v. 9, p. 152, 2011. DOI: https://doi.org/10.1186/1479-5876-9-152.
- TRAVETTI, O.; DI GIANCAMILLO, M.; STEFANELLO, D.; FERRARI, R.; GIUDICE, C.; GRIECO, V.; CANTATORE, M. Computed tomography characteristics of fibrosarcoma — a histological subtype of feline injection-site sarcoma. Journal of Feline Medicine and Surgery, v. 15, n. 6, p. 488-493, 2013. DOI: https://doi.org/10.1177/1098612X12472174.
- WITHROW, S. J.; VAIL, D. M. Withrow and MacEwen’s small animal clinical oncology. 4. ed. Philadelphia: WB Saunders, 2007.
- ZABIELSKA-KOCZYWĄS, K.; WOJTALEWICZ, A.; LECHOWSKI, R. Current knowledge on feline injection-site sarcoma treatment. Acta Veterinaria Scandinavica, v. 59, n. 1, p. 47, 2017. DOI: https://doi.org/10.1186/s13028-017-0315-y.
- ZARDO, K. M.; DAMIANI, L. P.; MATERA, J. M.; FONSECA-PINTO, A. C. B. C. Feline injection site sarcoma: computed-tomographic density and assessment of tumor dimensions by different methods. Pesquisa Veterinária Brasileira, v. 37, n. 10, p. 1113-1118, 2017. DOI: https://doi.org/10.1590/s0100-736×2017001000012.
