REGISTRO DOI: 10.5281/zenodo.10918279
Romero A. Sobrinho¹;
Estela Batista Santos²;
Ana Camila Nobre de Lacerda Brito³;
Silvia Regina Arruda de Moraes4.
Resumo
Introduçãoː Estudos têm sido realizados para desenvolver biomateriais que acelerem a cicatrização nervosa. Diante disso, o presente estudo utilizou um biofilme de álcool polivinílico, com ácido ascórbico, para auxiliar o processo cicatricial após neurotmese. O estudo teve por objetivo analisar macroscopicamente e funcionalmente a compatibilidade do biofilme de álcool polivinílico com ácido ascórbico na cicatrização da neurotmese do nervo ciático em ratos Wistar.
Métodos: O biofilme foi produzido em laboratório e aplicado cirurgicamente após a lesão do nervo ciático. O estudo envolveu 72 ratos Wistar divididos em grupos de controle e lesão (neurotmese), com e sem biofilme. Seis nervos ciáticos por grupo foram coletados e avaliados na 1ª, 3ª ou 6ª semana pós-operatório, nos grupos formados para avaliação macroscópica onde, após o período experimental de cada grupo, os animais foram anestesiados, o nervo ciático foi visualizado e realizou-se a análise, observando alinhamento dos cotos nervosos, absorção do biofilme e a qualidade da sutura. Para a avaliação macroscópica foi utilizada uma análise qualitativa e os dados foram expressos em frequência. Na avaliação funcional, para a avaliação da recuperação da marcha do animal, foi aplicado o Índice Funcional do Ciático (IFC) no pré-operatório (um dia antes) e na 1ª e 3ª semana do pós-operatório, onde três parâmetros foram medidos a partir do software Image J e as comparações entre o lado lesado (experimental) e o intacto (normal) permitiram estabelecer o IFC.
Resultados: à partir das técnicas utilizadas com o biofilme de álcool polivinílico com ácido ascórbico, a análise macroscópica mostrou boa cicatrização da pele e do músculo, porém, o biofilme não foi absorvido completamente. Neuromas foram observados principalmente no grupo sem biofilme. O IFC mostrou redução na função nos grupos lesionados, mas aqueles com biofilme apresentaram melhor recuperação funcional.
Conclusões: devido à baixa taxa de neuromas e desalinhamento estrutural, pode-se afirmar que o biofilme utilizado foi compatível com o animal utilizado, apesar de não haver melhora significativa na avaliação funcional. No entanto, necessita de avaliações histológicas para verificar se houve regeneração nervosa, para então ser testado em modelo humano.
Palavras-chave: Ácido Ascórbico; Biofilme; Nervo Ciático; Procedimento Neurocirúrgico; Regeneração Nervosa; Ratos.
1. Introdução
A lesão nervosa periférica é um grande problema socioeconômico que incide sobre 500.000 indivíduos por ano em alguns países1, onde 2,8% dos pacientes se tornam permanentemente incapacitados devido ao prolongamento do tempo de regeneração do nervo. Essas lesões levam à deficiência da função motora e sensorial e podem levar à disfunção do membro acometido2, acarretando hipotrofias, limitações da amplitude de movimento articular, encurtamentos musculares, parestesias, áreas de hipoestesia ou anestesia, entre outros. Além disso, podem ocorrer alterações corticais e subcorticais, a partir das adaptações plásticas inadequadas no sistema nervoso central e periférico3, 4.
O nervo ciático é o nervo periférico mais acometido nessas lesões, principalmente de origem traumática, e o seu modelo de lesão tem sido utilizado na pesquisa pré-clínica e se demonstra eficaz na avaliação da reparação do sistema nervoso periférico, com este modelo são reproduzidos diferentes tipos de lesão5.
O sistema nervoso periférico tem capacidade de regeneração, porém esta ocorre de forma lenta e, às vezes, incompleta. Estas lesões podem ocorrer, segundo a classificação de Seddon (1942), por paralisia cursando com perda da sensibilidade (neuropraxia), descontinuidade dos axônios com interrupção da condução nervosa (axonotmese) ou transecção total ou parcial do nervo, causando perda da função motora e sensitiva (neurotmese)4. Nessa última, tanto o axônio quanto a bainha de mielina e envoltórios conjuntivos estão irreversivelmente danificados tornando-se necessário intervenção cirúrgica para realinhamento dos cotos para que a regeneração possa ocorrer de forma linear sem ocorrer a formação de neuromas6.
Estudos na área de engenharia tecidual têm sido realizados para desenvolver materiais biocompatíveis, biodegradáveis, de baixa citotoxicidade, maleabilidade e tempo adequado de decomposição, que possam ser utilizados como suporte para tratamento da lesão nervosa7, 8, 9. Um exemplo disso é o biofilme, que é um biomaterial que pode ser intumescido em água ou fluidos biológicos10, pode possuir a estrutura de uma matriz ou camada fina formada a partir de polímeros, de origem animal ou vegetal11 e para ser usado clinicamente, este deve apresentar propriedades que conferem uma interação benéfica com o organismo onde é implantado. Sua utilização vem sendo empregada em pesquisas para que seus benefícios clínicos sejam elucidados3, 11. Alguns estudos foram realizados com o objetivo de cicatrização do tecido nervoso periférico12.
À partir desses estudos uma técnica que vem ganhando destaque na área da saúde é a eletrofiação, a qual é capaz de produzir nanofibras semelhantes aos componentes da matriz extracelular, com diâmetro que pode variar de micrômeros a nanômetros, obtidas pela aplicação de campo elétrico forte em solução de polímero ou massa fundida. Através dela é possível incorporar fármacos a sua estrutura, os quais tem sua liberação, nos tecidos onde está inserido, em quantidades e período de tempo pré-definidos13.
Um dos benefícios estudados nesse âmbito é a liberação controlada de fármacos pelo biofilme, que é um processo que inclui a administração, liberação de um agente terapêutico e seu posterior transporte através das matrizes poliméricas ou biopolímeros para o local de ação14.
Já podem ser encontrados resultados dessa técnica na cicatrização de feridas em ratos diabéticos, onde é utilizada nanofibra de álcool polivinílico (PVA) com quitosana15. Além disso, essa técnica também conta com o benefício da tubulização ao envolver os cotos nervosos, estabelecendo uma melhor regeneração nervosa16. Assim, sendo o ácido ascórbico um importante cicatrizante tecidual17, a sua incorporação no biofilme pode facilitar a reparação de uma neurotmese, favorecendo a população afetada por esse tipo de lesão e devolvendo-os às suas atividades de vida diária.
Desse modo, o presente estudo teve por objetivo a avaliação da utilização do biofilme de álcool polivinílico com ácido ascórbico (vitamina C) na reparação do nervo ciático após neurotmese, por meio de uma análise macroscópica e da funcionalidade desses animais. Para isto, foram realizadas análises em diferentes períodos de tempo após a lesão.
2. Materiais e Métodos
2.1 Amostra e modelos experimentais
O estudo é do tipo experimental, sendo realizado no Laboratório de Plasticidade Neuromuscular do Departamento de Anatomia (UFPE) e no Laboratório de Biodispositivos Nanoestruturados (BIONANO) do Departamento de Bioquímica (UFPE). A amostra selecionada para a avaliação macroscópica foi composta por 54 ratos Wistar e a amostra selecionada para a avaliação funcional foi composta por 18 ratos Wistar. Todos foram mantidos em temperatura de 23 ± 1ºC, ciclo de luz invertido (12h) e com dieta (Purina®) e água ad libitum. Aos 40 dias de vida, os animais foram distribuídos aleatoriamente, através de números randômicos, em seis grupos: GCM – Grupo Controle para Avaliação Macroscópica (n = 18), GLM – Grupo Lesão para Avaliação Macroscópica (n = 18), GLBM – Grupo Lesão e Biofilme Cicatrizante para Avaliação Macroscópica (n = 18), GCF – Grupo Controle para Avaliação Funcional (n = 6), GL F – Grupo Lesão para Avaliação Funcional (n = 6), GLBF – Grupo Lesão e Biofilme Cicatrizante para Avaliação Funcional (n = 6). Seis nervos ciáticos por grupo foram coletados e avaliados na 1ª, 3ª ou 6ª semana pós-operatório, nos grupos formados para avaliação macroscópica (GCM, GLM e GLBM).
2.2 Obtenção do biofilme de álcool polivinílico com ácido ascórbico
O biofilme foi produzido pelo Laboratório de Biodispositivos Nanoestruturados do Departamento de Bioquímica da UFPE a partir da solução de Álcool Polivinílico a 8%, Gelatina a 2% e Ácido Ascórbico a 0,5% colocada em uma seringa.
A solução foi colocada em seringa e submetida à eletrofiação por 5 horas. Após a obtenção do biofilme, este foi submetido ao processo de cross-linking por 24 horas, no qual foi imerso em uma solução de 98,9% de Metanol, 1% de Glutaraldeído e Ácido Clorídrico. Em seguida, passou por cinco banhos de água deionizada, foi colocado para secar a 8ºC por três a sete dias e cortado em tamanhos de 10 mm x 10 mm x 5 mm e, em seguida, foram esterilizados na ultravioleta por 30 minutos.
2.3 Procedimento cirúrgico para lesão do nervo ciático
Na idade de 60 dias todos os animais foram anestesiados intraperitonealmente com uma solução de cloridrato de Xilazina (Anasedan®) (20mg/Kg) e Cloridrato de Ketamina (Dopalen®) (100mg/Kg), 0,05 mL e 0,1mL para cada 100g de peso animal, respectivamente. Os animais foram colocados na posição anatômica, tiveram a área limpa com o antisséptico Clorexidina e foi realizada uma incisão oblíqua na pele da região póstero-superior da pata direita, iniciando um centímetro abaixo do trocânter maior do fêmur, tendo direção diagonal e terminando próximo à fossa poplítea, ao nível da inserção dos músculos ísquiotibiais. A exposição do nervo ciático foi conseguida após a separação dos músculos glúteo superficial e bíceps femoral. Em seguida, com auxílio do Estereomicroscópio (LEICA zoom 2000/ 10,5- 45X), o nervo ciático foi visualizado e foi colocada uma tentacânula sob o nervo para seu isolamento com os tecidos adjacentes. Após esses procedimentos, foi realizada a neurotmese nos animais do GL e GLB com bisturi a 5 mm proximal da divisão dos três ramos principais do nervo ciático (tibial, fibular comum e sural), seguida da coaptação direta das extremidades nervosas, com alinhamento fascicular e sutura com monofilamento 7-0 CATGUT (ETHICON) em cerca de 3 pontos do epineuro18. No GLB, além da sutura, a mesma foi envolvida com o biofilme de álcool polivinílico com ácido ascórbico em sua estrutura. Os animais do GC apenas foram submetidos à incisão oblíqua da pele, disjunção dos músculos acima descritos e visualização do nervo ciático e em seguida, foi realizada sua sutura para promover o mesmo estresse cirúrgico que os demais grupos.
2.4 Cuidados cirúrgicos
Após a aplicação dos anestésicos, foi aplicado o analgésico Cloridrato de Tramadol (5% – 100mg/Kg de peso animal, diluído em soro fisiológico a 0,9% – 1:1), por via subcutânea, sendo reaplicado a cada 12 horas durante três dias. Ao final da cirurgia, foi realizada a antibioticoterapia tópica (Rifamicina SV sódica – 10mg/ml; Sulfato de Neomicina + Bacitrina – 5mg/g + 250UI/g) e foi aplicado o antibiótico Enrofloxacina (10% – 5mg/Kg de peso animal), por via subcutânea, por 4 dias a cada 24 horas e do anti-inflamatório Meloxican (0,2% – 0,1mL/Kg de peso animal), por 2 dias, a cada 24 horas.
2.5.Avaliação macroscópica do nervo ciático
Nos grupos equivalentes à avaliação macroscópica, após o período equivalente as semanas experimentais de cada grupo, os animais tiveram seus pesos corpóreos aferidos e em seguida foram anestesiados com solução de Xilazina (Anasedan®) (20mg/Kg) e Cloridrato de Ketamina (Dopalen®) (100mg/Kg), 0,05 mL e 0,1mL para cada 100g de peso animal, o nervo ciático direito foi visualizado e foi realizada a análise macroscópica.
Na avaliação macroscópica foram avaliados os seguintes aspectos: alinhamento dos cotos nervosos, absorção do biofilme e qualidade da sutura externa e interna. A avaliação foi constituída de respostas objetivas de “Sim” ou “Não” para as perguntas a seguir: “A sutura da pele foi bem reparada?” “Os pontos caíram ou os animais comeram os pontos da pele?” “A sutura muscular foi bem reparada?” “O fio de sutura do músculo foi absorvido?” “Os cotos estão alinhados estruturalmente?” “O biofilme foi bem absorvido pelo nervo ciático?” “Se não, o biofilme estava no lugar?” “Há presença de neuromas?”.
2.6. Índice Funcional do Ciático (IFC)
Nos grupos equivalentes à avaliação funcional, para a avaliação da recuperação da marcha do animal, foi aplicado o Índice Funcional do Ciático (IFC) nas seguintes etapas do estudo: pré-operatório (um dia antes) e na 1ª e 3ª semana do pós-operatório, segundo protocolo de Brain e colaboradores (1989). Os ratos tiveram suas patas pintadas com tinta azul e foram colocados em uma passarela de 10 cm de largura e 60 de comprimento para deambularem sobre um papel branco. Três parâmetros foram medidos nessas pegadas a partir do software Image J e as comparações entre o lado lesado (experimental) e o intacto (normal) permitiram estabelecer o índice funcional do ciático (IFC) através da Equação 1 (Brainet al., 1989), onde os resultados obtidos com esta expressão foram a expressão percentual negativa da função normal, em que 0 (zero) corresponde à função normal, ou ausência de deficiência, e -100 (menos cem) corresponde à disfunção total.
O resultado final será obtido do valor médio obtido de quatro mensurações das patas marcadas no papel (Equação 1).
IFC = -38,3 . [(EPL – NPL) . NPL-1] + 109,5 . [(ETS – NTS) . NTS-1] + 13,3 . [(EIT – NIT) . NIT-1] – 8,8
Equação 1
Onde:
E = experimental;
N = normal;
PL= “printlength”, ou comprimento da pata, é a distância entre os dois pontos mais extremos da pegada, no sentido longitudinal, que é sempre maior na pata lesada;
TS = “total spread”, ou espalhar total dos dedos, é distância entre os dois pontos mais extremos da pegada, no sentido transversal, devendo coincidir com a marca dos dois dedos mais extremos;
IT = “intermediate toes”, ou espalhar dos dedos intermediários, é a distância entre os dois dedos intermediários.
2.5 Análise estatística
Com os dados obtidos foi construído um banco de dados e posteriormente analisados através do software SPSS versão 20.0.
Para análise estatística do dos grupos avaliados funcionalmente foi realizado o Teste de Shapiro-Wilk para testar a normalidade. Em seguida, para o peso corporal foi empregado o ANOVA com post hoc o Teste de Bonferroni (dado não paramétrico).
Para o IFC foi utilizado o Teste de Kruskal-Wallis, seguido da comparação em pares. A análise estatística descritiva foi realizada por meio de medidas de média e desvio padrão. O nível de significância adotado foi de 5% (p < 0,05).
Para análise estatística do peso inicial nos grupos avaliados macroscopicamente foi utilizado o teste de normalidade de Kolmogorov-Smirnorv, em seguida o Teste de Kruskal-Wallis seguido da comparação em pares.
Para a avaliação macroscópica foi utilizada uma análise qualitativa e os dados foram expressos em frequência.
2.6 Aspectos éticos
Os procedimentos utilizados para manejo e cuidado dos animais estão de acordo com as normas internacionais estabelecidas pelo National Institute of Health Guide for Care and Use of Laboratory Animal e o projeto foi aprovado pela Comissão de Ética no Uso de Animais (CEUA) do Centro de Ciências Biológicas – UFPE sob o número de protocolo de 23076.052306/2017-10.
3. Resultados
PESO CORPORAL
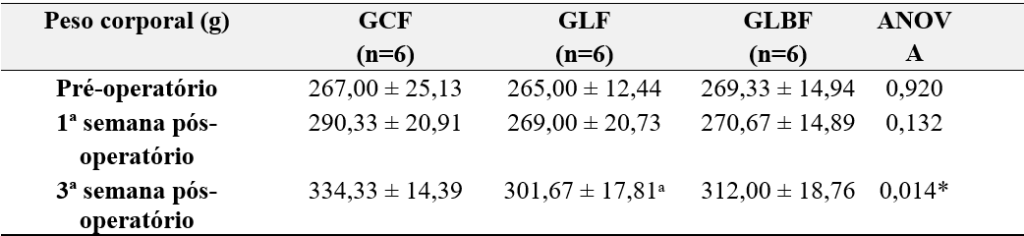
No início do estudo os grupos avaliados macroscopicamente tinham peso corporal semelhante (p = 0,082), assim como os grupos avaliados funcionalmente (p = 0,920; p = 0,132; respectivamente) (Tabelas 1 e 2).
Tabela 1 – Caracterização da amostra para avaliação macroscópica, antes da neurotmese.
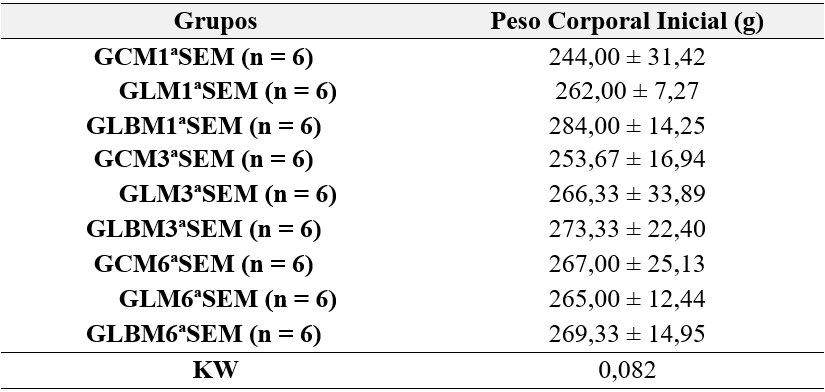
Tabela 2 – Caracterização da amostra para avaliação funcional, antes da neurotmese.
AVALIAÇÃO MACROSCÓPICA
À partir da avaliação macroscópica, realizada após o período experimental de cada grupo, foram obtidos resultados de forma qualitativa.
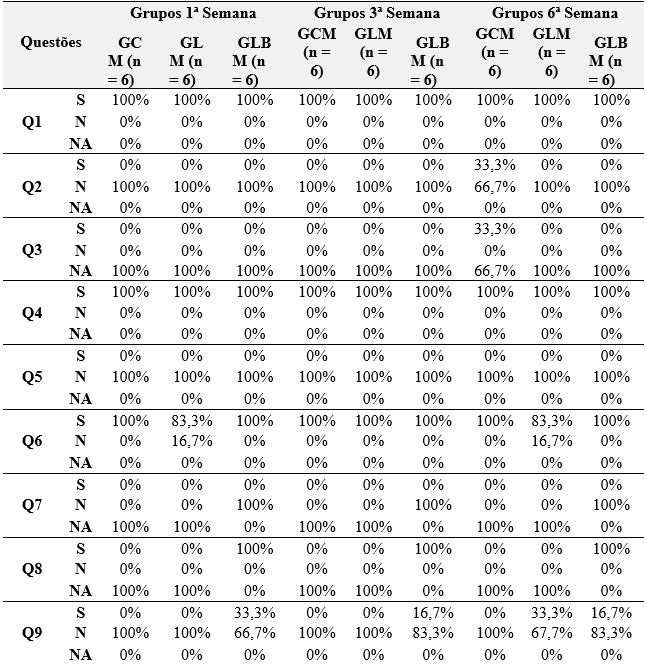
Os animais de todos os grupos tiveram as suturas da pele e do músculo bem reparadas, sendo observado rompimento de pontos na pele em 33,3% dos animais do GCM (Tabela 3). O fio de sutura do músculo não foi absorvido em nenhum dos grupos.
Os cotos nervosos estavam alinhados estruturalmente nos animais do GLM avaliados na primeira e sexta semana pós-operatória em 83,3%.
Embora tenha sido observado o aumento gradual na formação de neuromas no GLM no decorrer das seis semanas pós-cirúrgicas.
O biofilme não foi absorvido em 100% dos animais que utilizaram esse conduto.
Tabela 3 – Avaliação macroscópica da técnica cirúrgica de reparação de uma urotmese do nervo ciático utilizando um biofilme de álcool polivinílico com ácido ascórbico.
ÍNDICE FUNCIONAL DO CIÁTICO
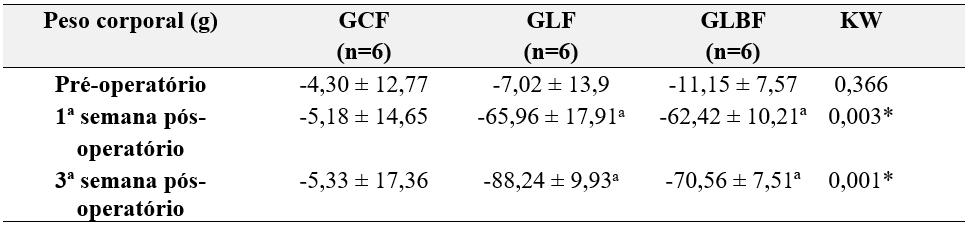
Quanto ao IFC, no período que antecede à cirurgia houve semelhança entre os grupos avaliados e os valores observados estavam dentro da normalidade (p = 0,366). Por outro lado, tanto na primeira semana quanto na terceira semana pós operatória, houve redução do IFC no grupo lesão quando comparado ao grupo controle (1ª semana: p = 0,003; 3ª semana: p < 0,001) e não houve diferença no GLBF quando comparado ao GLF (1ª semana – p = 0,914; 3ª semana – p = 0,084) como está exposto na Tabela 4.
Tabela 4 – Valores referentes ao IFC antes da cirurgia e na 1ª e 3ª semana após a realização da cirurgia.
4. Discussão
O desenvolvimento e utilização de novos produtos que visam auxiliar no processo de recuperação de lesões em nervos periféricos objetivando proporcionar melhores prognósticos vem sendo estudados nos últimos anos. O presente estudo avaliou de forma experimental a recuperação de ratos após a utilização de um biofilme enriquecido com ácido ascórbico envolvendo o local da lesão.
Como pode ser observado na Tabela 2, os animais de todos os grupos tiveram as suturas da pele e do músculo bem reparadas. No entanto, na sexta semana em 33,3% dos animais do GC, foi observado o rompimento de pontos na pele, provavelmente devido ao fato dos animais ficarem livres na gaiola, sendo realizada uma nova sutura após a cirurgia. Por outro lado, em todas as semanas avaliadas o fio de sutura do músculo não foi absorvido em nenhum dos grupos.
Tanto na primeira como na sexta semana pós-operatória 16,7% os cotos nervosos do GL não estavam alinhados estruturalmente. Segundo, De Medinaceli, o desalinhamento estrutural é um fator limitante na recuperação nervosa e para uma boa regeneração do nervo lesado alguns critérios são necessários, como: tensão mínima no local de reparo, coaptação adequada das extremidades (alinhamento estrutural dos cotos nervosos), preservação de fatores neurotróficos, fibrose mínima e reação mínima de corpo estranho no local da sutura. Por outro lado, nos animais que tiveram a sutura envolvida com o biofilme de álcool polivinílico não houve desalinhamento estrutural em nenhuma semana pós-operatória, assemelhando-se ao grupo controle e demonstrando, assim, a importância da técnica de tubulização, que é a utilização de condutos a fim de direcionar as fibras dos cotos nervosos, protegendo-as do tecido cicatricial e evitando também a formação de neuromas, favorecendo a regeneração16, 19.
Sabe-se que os neuromas são formações bulbosas que se formam em um nervo lesionado, como resultado de uma regeneração desorganizada de axônios após lesão parcial ou completa20, possivelmente decorrente do não-estabelecimento da cicatrização ou incorreto direcionamento dos axônios através de células de Schwann proliferantes21. Diante disso, no presente estudo foi observado que nos animais que tiveram a sutura envolvida pelo biofilme, a frequência de neuromas diminuiu ao longo de seis semanas, enquanto que no GL, houve o aumento gradual do aparecimento de neuromas.
Mesmo após seis semanas da reparação cirúrgica, o biofilme não foi absorvido em 100% dos animais que utilizaram esse conduto, corroborando com estudo anterior, o qual foi utilizado um conduto nervoso composto de PVA e células-tronco mesenquimais, o qual verificou que este não foi absorvido mesmo após 12 semanas da lesão22.
Quanto ao IFC, os animais do GL e GLB apresentaram redução da funcionalidade após a realização da neurotmese em relação ao GC. Resultados semelhantes foram observados por Moattari e colaboradoresonde observaram que os animais que apresentaram uma maior redução da funcionalidade foram os animais submetidos à neurotmese. Ao ser feita uma comparação entre os grupos, não foram observadas melhoras significativas nas primeiras semanas, como também ocorreu em nosso estudo23. A redução da funcionalidade encontrada nesses animais decorre do comprometido da interação do sistema nervo central e periférico devido à neurotmese. Quando ocorre esse tipo de lesão os estímulos elétricos direcionados as placas motoras são afetados levando a redução da funcionalidade dos músculos inervados pelo nervo comprometido24,25.
Na literatura frequentemente não são observados grandes ganhos na funcionalidade nas primeiras semanas após uma lesão nervosa26. Isso pode ser justificado pelo fato do processo de regeneração dos nervos periféricos ocorrer de forma lenta por se tratar de um processo complexo que envolve migração e interações de vários tipos de células para que ocorra o reparo27,28.
No presente estudo não foi possível observar melhora da funcionalidade na 3ª semana de pós-operatório, corroborando com uma metanálise, publicada recentemente por Deleonibus e colaboradores, que apontaram que os indícios iniciais da regeneração podem começar a serem observados a partir da 2ª semana de pós-operatório, mas sem achados significativos, apenas pequenos aumentos nos valores dos resultados dos testes avaliativos26.
Apesar de grandes avanços não estarem presentes na fase inicial da recuperação, é de grande importância o acompanhamento da evolução da regeneração a partir dos estágios iniciais após a reparação, para se ter uma visão mais detalhada desse processo.
5. Conclusões
Devido à baixa taxa de neuromas e desalinhamento estrutural, pode-se afirmar que o biofilme utilizado foi compatível no processo de reparação nervosa, estando o biofilme presente no local da lesão. No entanto, há necessidade de avaliações histológicas para verificar se houve regeneração nervosa. Em relação a funcionalidade, os animais não demonstraram melhora significativa após três semanas da intervenção, sugerindo que esse período ainda é insuficiente para a maturação do tecido neoformado e, consequente, retorno da funcionalidade do membro após a neurotmese.
Referências
- Bezerra, C. et al. Nerve injury sciatic and aspects regenerating oriented to fibroblast-2 growth factor. Revista Brasileira de Neurologia e Psiquiatria, 2016, v. 20, p. 83-95.
- Wang, M. Y. et al. Morinda citrifolia (Noni): a literature review and recent advances in Noni research. In: KWAN, C. Acta pharmacologica sinica: an international journal. 2002, v. 23, n. 12. Pequin: Science Press, p. 1127-1141.
- Da Silva, C.; Camargo, E. Mecanismos Envolvidos na Regeneração de Lesões Nervosas Periféricas. Saúde e Pesquisa, 2010, v. 3, n. 1.
- De carvalho, C. et al. Neuroestimulação e terapia espelho em pacientes com dor neuropática após traumatismo do plexo braquial. Revista Pesquisa em Fisioterapia. 2021,v. 10, n. 5, p. 35-44.
- Vargas, L. et al. O uso da terapia de laser e acupuntura na reabilitação de lesões nervosas periféricas. Anais do Salão Internacional de Ensino, Pesquisa e Extensão. 2019, v. 10, n. 2.
- Sullivan, R.; Dailey, T.; Duncan, K.; Abel, N.; Borlongsn, C. Peripheral Nerve Injury: Stem Cell Therapy and Peripheral Nerve Transfer. International Journal of Molecular Sciences. 2016, v. 17, n. 12, p.1-12.Capkin, S.; et al. A biological tube technique for the repair of peripheral nerve defects using ‘stuffed nerves’. UlusTravmaAcilCerrahiDerg. 2017, v. 23, n. 1.
- Roque, J. S.; Pomini, K.T.; Buchaim, R. L.; Buchaim, D. V.; Andreo, J. C.; Roque, D.D.; Rodrigues, A. C.; Júnior, G. M.; Moraes, L. H. R.; Viterbo, F. Inside-out and standard vein grafts associated with platelet-rich plasma (PRP) in sciatic nerve repair. A histomorphometric study. Acta Cir Bras. 2017, v. 32, n. 8, p. 617-625.
- Yurie, H.; Ikeguchi, R.; Aoyama, T.; Kaizawa, Y.; Tajino, J.; Ito, A.; et al. The efficacy of a scaffold-freeBio 3D conduit developedfrom human fibroblasts on peripheral nerve regeneration in a rat sciatic nerve model. PLoSONE. 2017, v. 12, n. 2.
- Peppas, N. A. et al. Hydrogels in pharmaceutical formulations. European Journal of Pharmaceutics and Biopharmaceutics. 2000, v. 50, issue 1, p. 27-46.
- Cao, Y.; Wang, B. Biodegradation of silk biomaterials. International Journal of Molecular Sciences. 2009, v. 10, n. 4, p. 1514-1524.
- Mohammadi, R.; Amini, K.; Charehsaz, S. Homeopathic treatment for peripheral nerve regeneration: an experimental study in a rat sciatic nerve transection model. Homeopathy, London. 2012 v. 101, n. 3, p. 141-146.
- Bhardwaj, N.; Kundu, S. C. Electrospinning: A fascinating fiber fabrication technique. Biotechnology Advances. 2010, v. 28, p. 325–347.
- Costa Neves, M. et al. Desenvolvimento de nano e micropartículas de acetato de celulose para sistemas de liberação controlada de anti-inflamatórios não esteroides. In: COLLOQUIUM EXACTARUM. 2017, v. 9, n. 4.
- Majd, A. et al. Application of Chitosan/PVA Nano fiber as a potential wound dressing for streptozotocin-induced diabetic rats. International Journal of Biological Macromolecules. 2016, v. 92, p. 1162–1168.
- Félix, S. P.; Pereira Lopes, F. P.; Marques, S. A.; Martinez, A. M. B. Comparison between suture and fibrin glue on repair by direct coaptation or tubulization of injured mouse sciatic nerve. Microsurgery. 2013.
- Moore, J. Vitamin C: a wound healing perspective. Br J Community Nurs. 2013, p. 8
- WU, R. et al. Evaluation of artificial nerve conduit and autografts in peripheral nerve repair in the rat model of sciatic nerve injury, Neurological Research. 2016, v. 38, n.5, p.461-466.
- Oliveira, A. L. R.; Pierucci, A.; Pereira, K. B. Peripheral nerve regeneration through the nerve tubulization technique. Braz. J. Morphol. Sci., 2004, v. 21, n. 4, p. 225-31.
- Martins, R. S.; et al. Neuroma sintomático do nervo sural uma complicação rara após a retirada do nervo: relato de caso. Arquivos de Neuro-Psiquiatria. 2002, v. 60, n. 3B, p. 866- 868.
- Anbinder, A. L. et al. Traumatic neuroma of the lower lip. West Indian Medical Journal. 2009, v. 58, n. 6, p. 604.
- Marinescu, S. A.; et al. An animal model of peripheral nerve regeneration after the application of a collagen–polyvinyl alcohol scaffold and mesenchymal stem cells. Rom J Morphol Embryol. 2014, v.55, n. 3, p. 891-903.
- Moattari, M.; Kouchesfehani, H. M.; Kaka, G.; Sadraie, S. H.; Naghdi, M. Study of Transected Sciatic Nerve Repair by Biodegradable Membrane and Betamethasone in Adult Albino Wistar Rats. Turkish Neurosurgery, v. 28, n. 4, p. 645-653, 2018.
- Vaughan, A.; Gardner, D.; Miles, A.; Copley, A.; Wenke, R.; Coulson, S. A Systematic Review of Physical Rehabilitation of Facial Palsy.Front. Neurol. v. 11, 2020.
- Lopes, B.; Sousa, P.; Alvites, R.; Branquinho, M.; Sousa, A. C. Mendonça, C.; Atayde, L. M.; Luis, A. L.; Varejão, A. S. P.; Maurício, A. C. Peripheral Nerve Injury Treatments and Advances: One Health Perspective. Int. J. Mol. Sci. v. 23, n. 2022.
- Deleonibus, A.; Rezaei, M.; Fahradyan, V.; Silver, J.; Rampazzo, A.; Gharb, B. B.; A meta-analysis of functional outcomes in rat sciatic nerve injury models. Microsurgery. v. 41, n, 3, p. 286-295, 2021.
- Silva, C. K.; Camargo, E. A. Mecanismos Envolvidos Na Regeneração De Lesões Nervosas Periféricas. Mecanismos Envolvidos na Regeneração de Lesões Nervosas Periféricas. Revista Saúde e Pesquisa. v. 3, n. 1, p. 93-98, 2010.
- Vargas, L. A.; Dias, D. V.; Andrade, J. C. T. A utilização do laser e da acupuntura na reabilitação de lesões nervosas periféricas –revisão integrativa. Brazilian Journal of Development. v. 7, n. 1, p. 1412-1417, 2021.
¹(https://orcid.org/0000-0001-6875-7710); Graduado em Fisioterapia, Universidade Federal de Pernambuco, Recife, Pernambuco, Brasil; Autor principal, Graduando, Departamento de Fisioterapia, Universidade Federal de Pernambuco, Avenida Professor Moraes Rego, 1235, Cidade Universitária, Recife, Pernambuco, CEP: 50670-901, Brasil. E-mail: romeroandion2@gmail.com.
²(https://orcid.org/0000-0002-5987-308X); Graduado em Fisioterapia, Universidade Federal de Pernambuco, Recife, Pernambuco, Brasil.
³(https://orcid.org/0000-0001-9354-3677); Doutora do Programa de Pós-graduação em Neuropsiquiatria e Ciências do Comportamento, Universidade Federal de Pernambuco, Recife, Pernambuco, Brasil. E-mail: britoanacamila@gmail.com.
4(https://orcid.org/0000-0002-3974-4483); Professora, Departmento de Anatomia, Universidade Federal de Pernambuco, Recife, Pernambuco, Brasil. Email: sramoraes@gmail.com.
