REGISTRO DOI: 10.5281/zenodo.7811697
Juliany Almeida Ramos¹
Loraine De Abreu Pereira¹
Dra. Deusilene Souza Vieira Dall’Acqua²
Dr Luis Alexandre Rassi Gabriel³
RESUMO
A acromatopsia é uma doença rara, também conhecida como monocromacia de bastonetes, geralmente diagnosticada precocemente nos primeiros meses de vida. Apresenta limitação visual importante como visão diurna severamente prejudicada, baixa acuidade visual, fotofobia, nistagmo, graus variados de degeneração dos cones, além de em alguns casos ter hipermetropia, miopia e estrabismo unilateral ou bilateral. Por ser uma doença rara, existem pzSoucas evidências quanto à eficiência de um tratamento que proporcione um impacto significativo na qualidade de vida dos portadores. fatores genéticos estão diretamente relacionados à doença, onde até 80% dos pacientes com a síndrome carregam mutações no gene CNGA3 ou CNGB3. Este relato de caso apresenta um paciente com acromatopsia incompleta sendo esta condição ainda mais rara, visto que grande parte dos pacientes possuem a ACM completa. Associada a mutação no gene CNGB3 cujo a síndrome genética foi identificada apenas no DNA paterno. Atualmente o caso continua em investigação em busca de uma anomalia por parte materna.
PALAVRAS CHAVE: Acromatopsia, baixa visão, gene CNGB3. terapia gênica, fotofobia, nistagmo.
ABSTRACT
Achromatopsia is a rare disease, also known as rod monochromacy, usually diagnosed early in the first months of life. It presents important visual limitations such as severely impaired daytime vision, low visual acuity, photophobia, nystagmus, varying degrees of cone degeneration, in addition to hyperopia, myopia and unilateral or bilateral strabismus in some cases. Because it is a rare disease, there is little evidence regarding the efficiency of a treatment that provides a significant impact on the quality of life of patients. genetic factors are directly related to the disease, where up to 80% of patients with the syndrome carry mutations in the CNGA3 or CNGB3 gene. This case report presents a patient with incomplete achromatopsia, which is an even rarer condition, since most patients have complete MCA. Associated with mutation in the CNGB3 gene whose genetic syndrome was identified only in the paternal DNA. The case is currently under investigation in search of an anomaly on the maternal side.
KEYWORDS: Achromatopsia, visual limitation, CNGB3 gene, gene therapy, photophobia, nystagmus.
1 INTRODUÇÃO
A visão é um dos sentidos mais desenvolvido e utilizado no dia a dia. Inicia com a codificação da imagem pelas células fotorreceptoras da retina que logo será enviada ao cérebro através do nervo óptico, com se inserindo primeiramente no núcleo geniculado do tálamo e logo após encaminhar a imagem para o córtex primário visual localizado ao redor da fissura calcarina do lobo occipital. Qualquer anomalia até este ponto pode modificar drasticamente o campo visual, na acuidade ou na coloração da imagem; ou seja, os distúrbios da visão primária. Após esse processo, a imagem formada no córtex visual primário deve ser reconhecida e interpretada. Para isso, deve ser criada uma representação mental da imagem que possa ser comparada com imagens previamente armazenadas na memória, adquirindo assim significado. (ÁLVAREZ; MASJUAN, 2016).
Ao examinar os pacientes é possivel encontrar, deturpações na discriminação de cores que podem ser observados no hemicampo contralateral à area acometida pela sindrome. Essas podem também ser devido a infartos cerebrais no território posterior, trauma, encefalite ou doenças neurodegenerativas. De tal forma que raramente encontramos pacientes com acromatopsia isolada, sendo mais frequente sua associação com alexia, defeitos campimétricos ou prosopagnosia, entre outros (MONTANES; CUECA; ÁLVAREZ, 2014).
A acromatopsia (ACHM) é também conhecida como monocromacia de bastonetes é uma doença com prevalência global de aproximadamente 1:30.000. Que geralmente é reconhecida nos primeiros meses de vida pelos sinais e sintomas, sofrem de visão diurna severamente prejudicada, baixa acuidade visual, fotofobia (sensibilidade com a claridade), nistagmo (movimentos oculares rápidos involuntários), graus variados de degeneração dos cones, além de em alguns casos ter hipermetropia, miopia e estrabismo que é o desvio de um ou dos dois olhos para fora do eixo, conforme figura 1 (MICHALAKIS et al., 2017).
Figura 1: Perfil da acromatopsia

A retina é formada por duas células que realizam distintas funções, são elas cones e os bastonetes, os cones são responsáveis pela visão policromática (cores), funcionam sob alta luminosidade e dão acuidade visual, e prioritariamente ocupam o centro da retina, já os bastonetes são mais numerosos ocupando a periferia da retina, desempenha o funcionamento da visão monocromática (noturna) e funcionam sob baixa luminosidade. Explicando assim porque pacientes acromáticos relatam melhora na visão em ambientes escuros e noturnos, afinal os bastonetes geralmente são as células não acometidas ou pouco acometidas geneticamente. O centro da retina que é prioritariamente prejudicado, cujo se encontra responsável pela visão quando existe alta luminosidade, já a periferia fica com o dever de zelar pelo bom funcionamento da visão na ausência parcial ou total de luz, o que explica então o porquê a degeneração de cones na acromatopsia implica na dificuldade da visão central iluminada, conforme figura 2 (HETCH 1937).
Figura 2: Funcionamento da visão
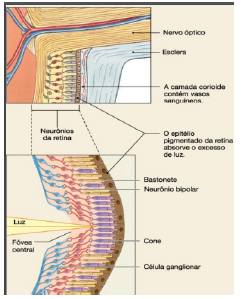
Fonte: Silverthorn (2010)
Exclusivamente sobre a falta de capacidade em graus variados de distinção das cores causada pelo acometimento genético, ocorre porque todos os três eixos de visão de cores correspondentes às três classes dos cones que se encontram pouco funcionantes: o eixo do cone sensível ao protan ou comprimento de onda longo (vermelho), o eixo do cone sensível ao comprimento de onda deutan ou médio (verde) e o eixo do cone sensível ao comprimento de onda curto ou tritan (azul) (HETCH 1937).
A grande parte dos indivíduos tem acromatopsia completa, com total falta de função dos três tipos de cones. Raramente, apresentam acromatopsia incompleta, na qual um ou mais tipos de cones podem estar funcionando parcialmente. As manifestações são semelhantes entre ambas sendo a incompleta geralmente menos graves o que permite uma melhor qualidade de vida (KOHL 2004).
Já o nistagmo se desenvolve durante as primeiras semanas após o nascimento, seguido de aumento da sensibilidade à luz brilhante. A melhor acuidade visual varia com a gravidade da doença; é 20/200 ou menos na acromatopsia completa e pode chegar a 20/80 na acromatopsia incompleta (KOHL 2004).
A doença é herdada geneticamente de forma autossômica recessiva e atinge seis genes, (ATF6, CNGA3, CNGB3, GNAT2, PDE6C e PDE6H) estão até o presente momento implicados na doença. Até 80% dos pacientes com a síndrome carregam mutações em CNGA3 ou CNGB3. Tais genes codificam as duas subunidades do canal de nucleotídeo cíclico (CNG) expresso em segmentos externos dos fotorreceptores de cone. O canal CNG do cone é um canal heterotetramérico que possui CNGA3 e CNGB3 funcionalmente, GNV se refere ao segmento genômico que influencia na expressão e estrutura dos genes, o acometimento do canal vai acarretar em prejuízo funcional visto que são um componente essencial da cascata de fototransdução que medeia a tradução de alterações desencadeadas pela luz na guanosina cíclica do segundo mensageiro monofosfato (cGMP) em uma voltagem e sinal de cálcio (MICHALAKIS et al., 2017).
No escuro, a ligação do cGMP para os canais de GNC leva à abertura dos canais e despolarização do cone célula fotorreceptora. Após a chegada de luz, o cGMP é hidrolisado por cone atividade da fosfodiesterase (PDE), os canais de CNG se fecham e o cone se torna hiperpolarizado. Essa hiperpolarização reduz a liberação do neurotransmissor glutamato no terminal sináptico e aciona a sinalização visual (MICHALAKIS et al., 2017).
Até o presente, mais de 100 mutações no CNGA3 e mais de 50 mutações no CNGB3. Referente aos possíveis locais de origem CNGB3 tem mais prevalência na Europa na e nos Estados Unidos, enquanto CNGA3 é mais encontrado no Oriente Médio e na China. A maioria das mutações CNGB3 são mutações nonsense, frameshift ou splice que causam proteínas de canal fortemente prejudicadas. Já a maioria dos genes CNGA3 passam por mutações missenses que afetam apenas resíduos de aminoácidos únicos da proteína G. Os outros genes conhecidos por pesquisadores, exceto ATF6, também codificam componentes essenciais do cascata de fototransdução de cone, e subunidades do cone PDE (PDE6C e PDE6H) ou a proteína de ligação ao nucleotídeo guanina (proteína G), (GNAT2) que sinaliza entre a rodopsina e o PDE. Recapitulando o que já foi dito anteriormente que explica o mau funcionamento de qualquer uma dessas fototransdução de genes que leva ao comprometimento funcional da cascata de sinalização. No entanto, o exato mecanismos que ligam mutações nestes genes de fototransdução à patologia ACHM ainda não foram estabelecidos. A mais recente adição aos genes ACHM é o ATF6, que codifica um fator de transcrição envolvido na resposta da proteína desdobrada. Foi sugerido que uma maior suscetibilidade a danos induzidos pelo estresse durante o desenvolvimento da retina está subjacente à patologia da ACHM em pacientes com mutações ATF6 (ANDERSEN, 2021; HIRJI et al., 2018).
Sabendo que a visão cromática é fortemente prejudicada os pacientes que convivem com tal mutação veem o mundo em tons de cinza, o que pode parecer um problema desagradavel visto que seu cotidiano fica profundamente afetado, sendo que pacientes para os que adquiriram a acromatopsia ao longa da vida geralmente por um trauma e percebem a falta de cor de forma extremamente mais aguda (HIRJI et al., 2018).
A deturpação na imagem pode parecer com a agnosia visual que é definida como um comprometimento do reconhecimento de objetos, na ausência de acuidade visual ou disfunção cognitiva. Existem 2 (duas) vias principais que processam a informação visual: a via ventral, responsável pelo reconhecimento de objetos, e a via dorsal, responsável pela sua localização no espaço. Nesse sentido, levando em conta a baixa acuidade visual do acromático, é possível que ele tenha as duas vias afetadas, muitos pacientes acromáticos relatam ter dificuldade em distinguir rostos especialmente quando estão expostos a luz, seja ela natural ou artificial que fica prejudicada pela fotofobia. Todos os pacientes são capazes de reconhecer as pessoas por voz. Esta é provavelmente a razão pelas quais muitos desses pacientes compensam pelo menos parcialmente o déficit por outros sentidos como audição (MARGATO; SEBASTIÃO, 2020).
O diagnóstico é feito principalmente por pesquisas genéticas através de uma amostra de sangue ou da mucosa retirado para análise com o sequenciamento do genoma no DNA do paciente e da família, assim como pela história clínica e anamnese feita pelo médico, juntamente com outros exames clínicos; videonistagmografia, teste de acuidade visual, avaliação da visão de cores pelo ishihara, exame fundoscópico, Teste de autofluorescência do fundo ocular (FAF) (MARGATO; SEBASTIÃO, 2020).
Sendo uma síndrome herdada de forma autossômica recessiva a história familiar geralmente se dá na concepção de cada irmão de um indivíduo afetado ter 25% de chance de ser afetado também, 50% de chance de ser um portador assintomático e 25% de chance de não ser afetado. Teste de portador para parentes em risco, teste pré-natal para gestações com risco aumentado e teste genético pré-implantação são possíveis se as variantes patogênicas tiverem sido identificadas na família (ÁLVAREZ, MASJUAN, 2016).
A acromatopsia ainda é uma doença em fase de pesquisa, não sendo desmistificado toda sua origem patológica e possíveis tratamentos, assim como muitos distúrbios herdados de retina não existe tratamento eficaz para mal funcionamento dos cones resultante de deficiência no canal CNG. Devido a esse fato, atualmente estão sendo desenvolvidos vários estudos clínicos, com diferentes tipos de tratamentos, com grande potencial para a cura da doença ou melhora significativa dos sintomas. Grande parte dos ensaios clínicos em busca de tratamento já passaram da fase 1(um) que são os testes feitos em camundongos entre outros animais, com o objetivo de encontrar a melhor dose terapêutica é atualmente a maioria dos estudos estão em fase 2 (dois) que busca participantes já diagnosticados com a síndrome e que preencham os critérios estabelecidos a depender da pesquisa que o paciente em conjunto com o médico que acompanha o caso queiram entrar para testar eficácia e possíveis efeitos colaterais senda uma dose já mais segura porém ainda não por completo (ANDERSEN, 2021).
Durante os últimos anos houve um grande progresso no sentido de trazer um tratamento curativo para ACHM em clínicas. Os primeiros ensaios clínicos estão em andamento ou serão lançados em breve e espera-se que contribuam com dados importantes sobre a segurança e eficácia do gene ACHM terapia de suplementação AAV (ÁLVAREZ; MASJUAN, 2016).
A técnica a ser usada pode variar sendo em sua maioria por advento dos vetores de vírus adeno-associados (AAV) como uma valiosa distribuição de genes ferramentas para fotorreceptores da retina, que consiste uma maneira de introduzir o material genético escolhido para dentro da célula do paciente através de vetores virais baseados em retrovírus, adenovírus, vírus adeno-associados, herpesvírus e poxvírus com intuito corretivo uma série de terapia de suplementação genética promissora tem sido iniciadas. Embora sejam excelentes no transporte do material genético, os vetores virais podem apresentar risco de infecção, hiperativação da resposta imune do hospedeiro, assim como um possível potencial oncogênico. Sabendo disso, para que a terapia gênica possa ser aplicada na rotina clínica, futuras pesquisas e testes ainda são necessários para a segurança e aperfeiçoamento da técnica (ÁLVAREZ; MASJUAN, 2016).
Novas estratégias terapêuticas estão sob investigação, sendo as estratégias de terapia gênica se mostrado promissora mediada por AAV (vírus adeno-associado) com resultados satisfatórios em modelos animais, como roedores e caninos com deficiência do gene CNGB3 (ÁLVAREZ; MASJUAN, 2016).
Atualmente, 11 ensaios clínicos utilizando estratégias baseadas em terapias gênicas estão em andamento, de acordo com o registro no banco ClinicalTrials.gov (acesso em https://clinicaltrials.gov/), sendo 1 (um) até o momento não recrutando, 3 (três) ativos não recrutando, 3 (três) recrutando, 2 (dois) concluídos e 2 (dois) concluídos com resultados.
As abordagens propostas para inclusão dos participantes nos referidos ensaios clínicos se baseiam na caracterização do perfil fenotípico para identificação dos pacientes elegíveis para cada intervenção terapêutica, de acordo com dados clínicos de indivíduos com acromatopsia.
2 JUSTIFICATIVA
O presente relato de caso expõe uma deficiência visual grave e ainda uma condição relativamente estacionária por ainda não ter um tratamento capaz de sanar as dificuldades enfrentadas na vida de quem a possui e o sofrimento psicológico que está relacionado ao sentimento de impotência.
Levando-se em conta a raridade da doença descrita, e a dificuldade de firmar o diagnóstico da acromatopsia visto que muitas vezes a equipe médica não tem ainda o conhecimento ao seu respeito, justifica-se a necessidade de apresentar o relato com informações valiosas capazes de contribuir com a literatura a respeito dessa distrofia de retina que ainda é tão pouco difundida, fornecendo assim um material original que poderá servir de base para prática clínica e pesquisas, levando em conta que relatos de pacientes sindrômicos têm muito a oferecer quanto a aprendizagem.
3 OBJETIVOS
3.1 Objetivo Geral
Apresentar relato de caso de acromatopsia associada a mutação sugestiva no gene CNGB3 no paciente, descrevendo o quadro clínico e o processo de investigação da doença.
3.2 Objetivos Específicos
- Descrever o quadro clínico e os resultados dos exames do paciente que convivem com a distrofia de retina;
- Discutir as estratégias em fase experimental de estudo usando terapia gênica para o caso relatado de distrofia de retina;
- Citar os ensaios clínicos disponíveis para tratamento do caso relatado de distrofia de retina usando estratégias de terapia gênica.
4 METODOLOGIA
O estudo trata de um relato de caso de paciente com acromatopsia com resultados preliminares de associação com mutações no gene CNGB3.
A caracterização dos ensaios clínicos disponíveis para encaminhamento do paciente será realizada a partir das abordagens registradas no banco de dados ClinicalTrials.gov do NIH. Tais dados subsidiarão informações importantes para tomada de decisão acerca das melhores opções de encaminhamento dos pacientes para novas estratégias terapêuticas ainda em desenvolvimento.
4.1 Metodologia de coleta de dados
Os dados clínicos serão obtidos por meio de revisão do prontuário, resultados de exames de imagem e anamnese ou entrevista coletados de forma qualitativa, se tratando de uma coleta de dados contínua sendo os dados registrados à medida que ocorre.
4.1.1 Critérios de inclusão
Indivíduo sindrômico que possuem anomalias na carga genética localizada no gene CNGB3 de origem hereditária, comprovado por avaliação genética e clínica.
4.1.2 Critérios de exclusão
Indivíduos sem comprovação ou manifestação genética e clínicas de mutação no gene CNGB3
4.1.3 Riscos da pesquisa
De acordo com a Resolução N° 466/12 CNS/CONEP Todas as pesquisas com seres humanos envolvem riscos. O relato de caso cujo o paciente está sendo apresentado, é levado em consideração a possibilidade de sofrer danos à dimensão física, psíquica, moral, intelectual, social, cultural ou espiritual ao ter constrangimento quando tem suas informações pessoais relacionadas à pesquisa expostas que se transformam em desconforto. Para evitar esses danos, será garantido sigilo e proteção das suas informações pessoais.
No entanto, ainda assim, o risco é justificável pelo benefício que a história pode levar ao campo de pesquisa contribuindo para o tratamento e informações para diagnóstico.
4.1.4 Benefícios
Por meio dos estudos demonstrados pode se observar os benefícios de forma direta para o paciente em questão, assim como outros indivíduos também serão beneficiados indiretamente com as informações. Pois esse estudo é o marco inicial que determina mudanças significativas na expansão para novas pesquisas.
4.2 Metodologia de análise de dados
O presente caso é descritivo com o intuito de divulgar características da deficiência enfrentada pelo entrevistado e experiências resultantes dos sinais e sintomas, utiliza também nesse estudo a análise diagnóstica que identifica padrões alterados no DNA responsável por demonstrar sua relação com o quadro clínico.
4.2.1 Desfecho primário
A terapia gênica é o tratamento definitivo, no momento se encontra na fase de recrutamento de possíveis grupos que preenchem os critérios estabelecidos de acordo com o ensaio clinico escolhido pelo candidato e seu médico, com objetivo de proporcionar segurança e eficácia aos acromáticos.
4.2.2 Desfecho secundário
O Tratamento conservador é pouco conhecido, não tem função de solucionar a deficiência e sim de diminuir o impacto dos sintomas através dos fármacos prescritos pelo médico geneticista. Sendo eles: Gabapentina com mecanismo de ação capaz de diminuir o nistagmo, a pilocarpina que reduz parte do desconforto pela claridade (astigmatismo), uso temporal da isotretinoína que proporcionou bons resultados na acuidade visual, o paciente também, já fez uso de acetilcisteína que demonstrou melhora em alguns grupos, porém não para o mesmo, e utiliza óculos especial, com lentes coloridas muito potentes que cumpre com o papel de bloquear a luminosidade estressante do ambiente aos olhos.
4.2.3 Tamanho da amostra
Uma amostra (relato de caso) de paciente portadora de acromatopsia relacionada ao gene CNGB3
5 DESENHO DE ESTUDO
JAR, feminino, 21 anos, apresentando sintomas desde a infância, onde aos 4 meses de idade foi diagnosticada com baixa visão, sem tratamento por desconhecimento da causa base pela equipe médica. Aos 15 anos recebeu diagnóstico definitivo de acromatopsia incompleta por mutação no Gene CNGB3, pelo médico geneticista Dr. Luis Alexandre Rassi Gabriel, desde então permanece em tratamento farmacológico que diminui parcialmente as limitações diárias e lentes para melhorar acuidade visual e controlar fotofobia. Permanece em busca do tratamento definitivo ainda em pesquisa.
6 CRONOGRAMA
Tabela 1 :
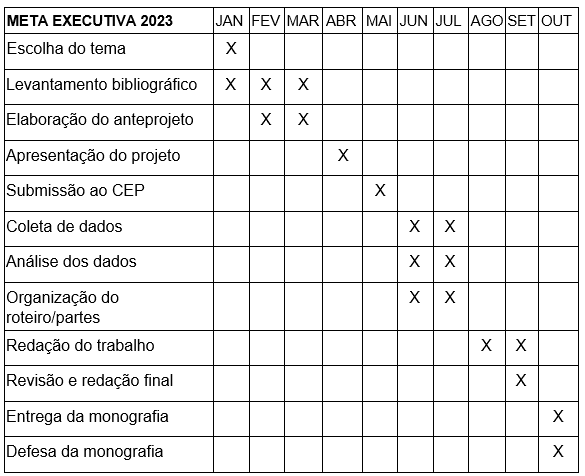
7 ORÇAMENTO DE GASTOS
Impressão do projeto 5 vezes; Valor R$: 6,00 (seis reais)
Encadernação das folhas 5 vezes de 14 folhas a4: R$: 22,50 (vinte e dois reais e cinquenta centavos)
Gastos em locomoção: R$: 50,00 (cinquenta reais)
REFERÊNCIAS
ANDERSEN, M. K. G.; KESSEL, L. Ametropia and Emmetropization in CNGB3 Achromatopsia. Investigative Ophthalmology & Visual Science. Colômbia, v. 62, n. 2, pag.
1-8,2021.Disponível em:<https://iovs.arvojournals.or/article.aspx?articleid=2772254#247159292>. Acesso em: 10 mar 2022;
ÁLVAREZ, R.; MASJUAN, J. Agnosias visuales. Revista Clínica Española, v. 216, n. 2, p. 85-91, 2016. Disponível em:<https://www.sciencedirect.com/science/article/abs/pii/S0014256515002003?via%3Dihub>. Acesso em: 11 fev 2022;
BURGUEÑO-MONTAÑÉS, C.; CUEVA, M. Colunga; ÁLVAREZ, C. Costales. A novel mutation in the CNGA3 gene responsible for incomplete achromatopsia. Archivos de la Sociedad Española de Oftalmología (English Edition), v. 89, n. 3, p. 107-109, 2014.
Disponível em: <https://pubmed.ncbi.nlm.nih.gov/24269407/>. Acesso em: 13 fev 2022; CASAS, Júlia; GUARDIOLA, Elena; BAÑOS, Josep-E. La acromatopsia en la obra de Oliver Sacks. Journal of Medicine and Movies, v. 14, n. 2, p. 124, 2018. Disponível em: <https://www.torrossa.com/en/resources/an/4382891#page=63>. Acesso em: 14 fev 2022;
CARVALHO, S. et al. Long-term and age-dependent restoration of visual function in a mouse model of CNGB3-associated achromatopsia following gene therapy. Human Molecular Genetics. Inglaterra, v. 20, n. 16, pag. 3161-3175, 2011. Disponível em:<https://academic.oup.com/hmg/article/20/16/3161/647879?login=false>. Acesso em: 24 fev. 2022;
FEKIH, O. et al. The interest of the OCT spectral Domain for the diagnosis of the acromatopsia. Lá Tunisie Médicale. Tunísia, v. 97, n.5, pag. 716-721, 2019. Disponível em:<https://www.latunisiemedicale.com/article-medicale-tunisie.php?article=3582>. Acesso em: 22 fev. 2022;
HIRJI, N. et al. Achromatopsia: clinical features, molecular genetics, animal models and therapeutic options. Ophthalmic Genet. Inglaterra, v. 39, n. 2, pag. 149-157, 2018.Disponível em:<https://www.tandfonline.com/doi/abs/10.1080/13816810.2017.1418389?journalCode=iopg2 0> . Acesso em: 10 fev 2022;
KOHL, S. et al. Mutations in the CNGB3 gene encoding the beta-subunit of the cone photoreceptor cGMP-gated channel are responsible for achromatopsia (ACHM3) linked to chromosome 8q21. Oxford Academic. Inglaterra, v. 9, n. 14, pag. 2107-2116, 2000. Disponível em: <https://academic.oup.com/hmg/article/9/14/2107/614716?login=false>. Acesso em: 30 jan. 2022;
MARGATO, Elmano; SEBASTIÃO, Rita. Nistagmo infantil: uma condição inócua ou algo mais? A propósito de um caso clínico. Revista Portuguesa de Medicina Geral e Familiar, v.36,n.4,p.360-8,2020.Disponível em:<https://www.rpmgf.pt/ojs/index.php/rpmgf/article/view/12617>. Acesso em: 25 sep. 2022;
MICHALAKIS, Stylianos et al. Gene therapy for achromatopsia. The journal of gene medicine, v. 19, n. 3, p. e2944, 2017. Disponível em:<https://onlinelibrary.wiley.com/doi/abs/10.1002/jgm.2944>. Acesso em: 15 fev 2022;
National Library of Medicine. Achromatopsia. Estados Unidos, 2015. Disponível em: <https://medlineplus.gov/genetics/condition/achromatopsia/#references>. Acesso em: 30 jan. 2022;
National Library of Medicine. Long-Term Follow-Up Gene Therapy Study for Achromatopsia CNGB3 and CNGA3. Estados Unidos, 2017. Disponível em:<https://clinicaltrials.gov/ct2/show/NCT03278873?cond=CNGB3&draw=2>. Acesso em: 20 fev. 2022;
National Library of Medicine. Safety and Efficacy Trial of AAV Gene Therapy in Patients With CNGB3 Achromatopsia. Estados Unidos, 2015. Disponível em:<https://clinicaltrials.gov/ct2/show/NCT02599922?cond=CNGB3&draw=2&rank=4>.Acesso em: 21 fev. 2022;
National Library of Medicine. CNTF Implants for CNGB3 Achromatopsia(CNTFCNGB3-1).Estados Unidos,2014.Disponível em:<https://clinicaltrials.gov/ct2/show/NCT01648452?cond=CNGB3&draw=2&rank=2>. Acesso em: 22 fev. 2022;
KOHL, S. et al. Achromatopsia. GeneReviews, 2004 [atualizado 2018]. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/20301591/> Acesso em 25 de set. de 2022;
HETCH, selig RODS, CONES, AND THE CHEMICAL BASIS OF VISION. american physiology society, 1937. Disponível em:<https://journals.physiology.org/doi/abs/10.1152/physrev.1937.17.2.239?journalCode=physre v> Acesso em: 25 set. 2022;
ROQUE, Joana. et al. Autofluorescência do fundo ocular: dos princípios básicos às aplicações clínicas. oftalmologia, 2021. Disponível em<https://revistas.rcaap.pt/oftalmologia/article/view/24546> Acesso em 25 de set. de 2022;
¹Autor-Discente do curso de Medicina da Faculdade Metropolitana/UNNESA.
²Docente Orientador.
³Coorientador.
