REPORT ON THE QUALITY OF LIFE IN PATIENTS WITH GUILLAIN BARRÉ SYNDROME WHEN UNDERGOING PHYSIOTHERAPY: A CASE SERIES
REGISTRO DOI: 10.69849/revistaft/ar10202506182055
Bruna Fátima Machado Rocha1
Rafaela Portella Postal2
Orientadora: Andyara Sepulveda3
Resumo
A Síndrome de Guillain-Barré, é uma polineuropatia inflamatória, que se manifesta de forma rápida, com fraqueza nos membros, hiporreflexia ou arreflexia, músculos rígidos e alterações sensoriais em diferentes estágios e, em casos mais graves, pode resultar em paralisia total ou parcial dos músculos. Neste contexto, a fisioterapia torna-se extremamente importante para reabilitação e para qualidade de vida desses indivíduos. O objetivo deste estudo foi investigar como esses indivíduos diagnosticados com a síndrome compreendem a sua qualidade de vida após o tratamento fisioterapêutico. O estudo representa uma série de casos descritivos, utilizando questionários como instrumento de avaliação, sendo um elaborado pelo próprio autor e outros dois já existentes: o SF-36 e a Escala de Barthel. Esses instrumentos foram aplicados a três participantes previamente diagnosticados com a Síndrome de Guillain-Barré e que realizaram fisioterapia. A coleta de dados foi através de questionário online, seguindo os critérios éticos. Os resultados se mostraram eficientes na reabilitação funcional, emocionais e sociais dos participantes. Ademais, observou-se que a resposta varia de paciente para paciente, o que reforça a personalização de protocolos de tratamento. A pesquisa colabora o papel da fisioterapia na recuperação dos indivíduos com a Síndrome de Guillain-Barré, salientando a necessidade de métodos integrados e contínuos na reabilitação.
Palavras-chave: Qualidade de vida. Fisioterapia neurológica. Reabilitação. Síndrome de Guillain-Barré.
1 INTRODUÇÃO
O primeiro relato de paralisia arreflexia progressiva na literatura médica foi descrito por Landry, no ano de 1916, a partir do caso de um paciente de 43 anos, que foi muito bem documentado por observações e exames longitudinais detalhados o que facilitou muito para que, qualquer médico da atualidade, não tenha dificuldade em reconhecer muitas das características do que hoje é conhecida como Síndrome de Guillain-Barré (SGB) (GUILLAIN et al., 1916).
Essa doença é caracterizada como uma polineuropatia inflamatória desmielinizante aguda, descrita manifestar-se com uma evolução rápida, antecipada de fraqueza dos membros, frequentemente simétrica e flácida tanto com diminuição de reflexo (hiporreflexia) ou sem reflexo (arreflexia), com separação celular proteica no líquido cefalorraquidiano (LCR) (RIGO et al., 2020).
A SGB apresenta uma incidência mundial de paralisia flácida aguda em torno de 1-2 casos por 100.000 indivíduos a cada ano, acometendo, anualmente, cerca de 100.000 pessoas mundialmente e afetando indivíduos de todas as idades, porém, entre os 50–70 anos, apresentam maiores chances de serem acometidos as doenças, resultando em uma maior incidência, já o gênero que tem mais tendência de ser afetado por essa síndrome são os homens, por volta de 1,5 vezes mais possibilidade do que as mulheres (VAN DOORN et al., 2023).
Devido ao comprometimento da bainha de mielina, o seu potencial de ação é implicado, ocasionando uma diminuição da condução da velocidade de condução dos nervos alcançados, resultando em fraqueza motora de forma retrógrada, gradual, simétrica e bilateral, em diferentes estágios, podendo atingir os membros inferiores (MMII) e membros superiores (MMSS), músculos rígidos, tronco e face, acompanhado de alterações sensoriais e perda de reflexos tendinosos profundos (UNCINI et al., 2020).
A SGB possui variantes, as quais são descritas como neuropatias pós-infecciosas e imuno mediadas, estudos indicam bases do mimetismo molecular, nas infecções por Campylobacter jejuni, é símile a gangliosídeos que estão presentes nos elementos dos nervos periféricos, a resposta imune desenvolvida para combater a infecção pode desencadear uma reação cruzada nos nervos do hospedeiro (YUKI et al., 1993).
Os tratamentos mais recomendados para a SGB incluem a imunoglobulina intravenosa (IVIg) e a troca de plasma, sendo que a administração da IVIg ocorre na dose de 0,4 g/kg por 5 dias, em pacientes dentro de 2 semanas (GPP também dentro de 2–4 semanas), após o início da fraqueza, caso não seja possível andar sem ajuda (VAN DOORN et al., 2023). A troca de plasma, com seu volume de 12–15 L sendo realizada em quatro a cinco trocas ao longo de 1–2 semanas, deve ser aplicada em pacientes dentro de 4 semanas após o início da fraqueza, caso não consigam andar sem ajuda (VAN DOORN et al., 2023).
Além do tratamento clínico, a intervenção fisioterapêutica cogita apressar a recuperação e conter a gravidade da SGB, abordando sintomas como fraqueza, dor e dificuldade respiratória, mediante exercícios respiratórios, mobilidades, fortalecimentos e controle postural (GAWANDE et al., 2024). Embora a fisioterapia tenha um papel essencial no processo de reabilitação, é necessário garantir a continuidade dos cuidados para maximizar os benefícios do tratamento e promover uma recuperação mais eficiente (SHAH et al., 2022).
Ainda que a fisioterapia seja largamente utilizada para a reabilitação de SGB, a sua relação com a qualidade de vida ainda não é completamente integrada, pois muitos pacientes sofrem de desafios físicos e emocionais perseverantes, afetando sua recuperação global, mesmo após o tratamento fisioterapêutico. Isso levanta a seguinte questão: “A fisioterapia impacta na qualidade de vida em pacientes portadores de SGB?”.
Este estudo é relevante para compreender como a fisioterapia impacta tanto a recuperação física quanto aspectos psicossociais, contribuindo para o avanço do conhecimento sobre a reabilitação de pacientes com SGB e para a criação de protocolos de tratamento personalizados e eficazes.
2 FUNDAMENTAÇÃO TEÓRICA OU REVISÃO DA LITERATURA
O primeiro relato de paralisia arreflexia progressiva na literatura médica é inicialmente descrita por Landry, no ano de 1916, ocorreu o caso de um paciente de 43 anos, que foi muito bem documentado por observações e exames longitudinais detalhados o que facilitou muito para qualquer médico que atue hoje não tenha dificuldade em reconhecer muitas das características do que hoje é conhecida como síndrome de Guillain-Barré (SGB) (GUILLAIN et al., 1916).
A provável causa subjacente parecia estar ligada à interrupção da porção central do arco reflexo. Em 1916, ainda não se conhecia o papel da mielina na fisiologia dos nervos, nem sua importância crucial para a condução saltatória dos impulsos nervosos (BOULLERNE, 2016).
Hoje, sabe-se que a mielina formada no SNC é produzida por células oligodendrócitos, e por células de Schwann no SNP, atua como uma barreira isolante ao redor dos axônios, no qual facilita a propagação rápida dos impulsos ao restringi-los aos nódulos de Ranvier, essa condução saltatória permite uma transmissão até 100 vezes mais rápida em comparação com axônios não mielinizados (NAVE, K.-A., & WERNER, H. B., 2014).
O Sistema Nervoso Periférico (SNP) é composto por axônios envolvidos pelas células de Schwann, endoneuro, epineuro e perineuro, sendo responsável pela transmissão de sinais do sistema nervoso central (SNC) ao restante do corpo, desempenhando seu papel tanto na função sensorial como na função motora (CHACHA et al., 2009).
A SGB afetará o SNP através da resposta autoimune, na qual os anticorpos atacarão os epitopos, e as células inflamatórias também prejudicarão, na destruição das células nervosas, todos esses acometimentos resultarão na destruição da mielina e irão causar danos aos axônios (SEJVAR et al., 2011).
A transmissão de sinais é a principal função que ocorre na fisiologia do SNP, composta pelos axônios que levam os impulsos nervosos, pelas células de Schwann que tem a função de formar a mielina que vai envolver esses axônios, e as camadas de tecido conjuntivo formadas pelo endoneuro, epineuro e perineuro (CHACHA et al., 2009).
A SGB altera a fisiologia do SNP através da desmielinização, quando no subtipo Polirradiculoneuropatia Desmielinizante Inflamatória Aguda (AIDP), o sistema imunológico ataca a mielina, no qual afeta a passagem dos impulsos nervosos, ocasionando na dormência, fraqueza e outros prejuízos neurológicos. No subtipo de Neuropatia Axonal Motora Aguda (AMAN), os axônios são os que vão ser prejudicados, na transmissão de impulsos. O que leva a ser considerado o dano mais grave, e até mesmo irreparável, gerando complicações permanentes (HUGHES, R. A., & CORNBLATH, D. R., 2005).
A SGB é uma doença que causa, no início, fraqueza em níveis agudos e subagudos nos membros e músculos inervados pelos nervos cranianos (SEJVAR et al., 2011). Esses nervos, que são extensões das estruturas cerebrais, percorrem a região da cabeça e do pescoço, incluindo o nervo facial (VII), o glossofaríngeo (IX) e o vago (X) (DALAQUA et al., 2022). O comprometimento desses nervos acaba resultando em uma diminuição ou perda dos reflexos tendinosos, outros indicativos incluem alterações no líquido cefalorraquidiano e resultados incomuns em exames de eletrodiagnóstico (SEJVAR et al. 2011).
Essa síndrome é um conjunto de polirradiculoneuropatias imunomediadas que geralmente sua dormência e fraqueza começam nos membros inferiores. Sua progressão é entre duas a quatro semanas atingindo 90% de fraqueza máxima (CHIKKANNA et al., 2022).
O diagnóstico para essa síndrome requer o histórico de infecção recente, análises do liquor, testes eletromagnéticos, testar os anticorpos Anti-GQ1b se houver suspeita da variante da SGB, a Síndrome de Miller Fisher. E também o teste de anticorpos nodais se estiver com a possibilidade de ter nodopatia autoimune (VAN DOORN et al., 2023).
A SGB é uma neuropatia periférica que se manifesta de forma súbita, sendo marcada por uma rápida progressão da fraqueza muscular, acredita-se que a SGB tenha uma natureza autoimune, surgindo como uma resposta do sistema imunológico do corpo após uma infecção prévia. Em aproximadamente dois terços dos casos, essa condição é desencadeada por infecções, como as vias respiratórias ou do trato gastrointestinal, sendo os focos mais comuns dessas infecções (MCGROGAN et al., 2019).
A fraqueza súbita dos membros, é frequentemente acompanhada por alterações sensoriais e envolvimento dos nervos cranianos, geralmente se desenvolve de uma há duas semanas após uma estimulação imunológica e atinge o auge clínico em duas a quatro semanas, sendo que quando os pacientes apresentam uma paralisia que progride rapidamente, é crucial que o diagnóstico da SGB seja realizado quanto antes (FOKKE et al., 2014).
A SGB tem como sintoma central a fraqueza gerada nos membros, no qual pode ocorrer nas extremidades e gradualmente provocar na pessoa dificuldades nos movimentos, fazer deglutição, e até mesmo problemas respiratórios em casos mais graves (WILLISON et al., 2016).
A SGB apresenta uma incidência mundial de paralisia flácida aguda em torno de 1-2 casos por 100.000 indivíduos a cada ano. A síndrome acomete, por ano, cerca de 100.000 pessoas mundialmente, afetando indivíduos de todas as idades, porém entre os 50-70 anos apresentam maiores chances de serem acometidos as doenças, resultando em uma maior incidência. Já o gênero que tem mais tendência de ser afetado por essa síndrome são os homens, por volta de 1,5 vezes mais possibilidade do que as mulheres (VAN DOORN et al., 2023).
Essas estimativas estão em concordância com os dados epidemiológicos de outros estudos que encontraram um índice de incidência entre 0,16 e 4,0 casos por 100.000 indivíduos, com sua prevalência em idades acima de 75 anos, e tendo sua predominância em homens, e na América do Norte e Europa apenas 5% dos casos são subtipos axonais da SGB, já na América Central, América do Sul, Japão e China têm sua incidência mais alta, em 30% e 47%, essas variações apontam que esses fatores regionais influenciam a aparição dessa síndrome (MCGROGAN et al., 2009).
A causa exata e os mecanismos fisiopatológicos da SGB ainda não são totalmente compreendidos, mas é amplamente aceito que a condição seja mediada pelo sistema imunológico (LEVIN et al., 1998). Esse processo envolve a produção de autoanticorpos e células inflamatórias que, ao reagirem de maneira cruzada com epítopos presentes nos nervos periféricos e raízes, provocam desmielinização, danos axonais ou ambos. Essa resposta imunológica é geralmente desencadeada por uma variedade de estímulos antigênicos, como infecções virais ou bacterianas (BOULLERNE et al., 2016).
No Polirradiculoneuropatia Desmielinizante Inflamatória Aguda (AIDP), ocorre a desmielinização em segmentos específicos do nervo, comprometendo a condução, deixando-a mais lenta. Já no Neuropatia Axonal Motora Aguda (AMAN) pode causar danos mais diretos, como a degeneração axonal extensa, prejudicando a função nervosa (VAN DOORN et al., 2023).
As infecções, como a de Campylobacter jejuni, são relacionadas a SGB, principalmente ao subtipo AMAN por conta da indução a produção de anticorpos que podem atacar os nervos ou a mielina, ocasionando na desmielinização e degeneração dos axônios (VAN DOORN et al., 2023).
Diversas infecções estão associadas a SGB, entre as mais frequentes estão as gastrointestinais e respiratórias, 70% dos pacientes apresentaram comorbidades antecedentes, sendo entre a primeira e sexta semanas anteriores (FOKKE et al., 2014). No período de 1947, onde ocorreu o primeiro surto do vírus Zika, diversas ocorrências de SGB foram relatadas (DIRLIKOV et al., 2018).
A SGB possui variantes, as quais são descritas como neuropatias pós-infecciosas e imuno mediadas, estudos indicam bases do mimetismo molecular. Nas infecções por Campylobacter jejuni, é símile a gangliosídeos que estão presentes nos elementos dos nervos periféricos, a resposta imune desenvolvida para combater a infecção que pode desencadear a uma reação cruzada nos nervos do hospedeiro (YUKI et al., 1993).
A qualidade de vida (QV) se concretizou como um conceito valioso tanto para a pesquisa quanto para a prática da área da saúde. A percepção da QV é essencial para o progresso de alívio dos sintomas, cuidados e reabilitação dos pacientes. Além de que a QV auxilia para a identificação de inúmeros problemas que podem envolver os pacientes (FAYERS et al., 2016).
Várias ferramentas são utilizadas para avaliar a QV, muitos desses instrumentos foram criados na base nas considerações percepcionadas e não em modelos baseados em definições ou modelos conceituais (HARALDSTAD et al., 2019). O termo qualidade de vida relacionada à saúde (QVRS) é constantemente retratado como “termo que se refere aos aspectos de saúde da QV, muitas vezes conceituado como reflexo do impacto da doença e tratamento”. A QVRS é uma quantidade de valores destacados a duração de vida, diante de modificações de deformações, funcionalidade, percepção, altamente influenciada pela doença em questão, nível de lesão, tratamento e política (TEIXEIRA, 2012).
O aumento da atividade física nos pacientes portadores de SGB quando supervisionado por profissional da saúde resultou na melhora da depressão, ansiedade, aptidão física, força muscular, diminuição da fadiga muscular e na melhoria da qualidade de vida. O aumento de contatos com outros pacientes, além de promover adesão ao exercício, promove melhores desempenhos psicológicos (GARSSEN et al., 2004).
A maioria dos estudos apresenta que a diminuição da qualidade de vida associada à saúde, para pessoas que possuem pontuação alta no SGB, ou seja, escala de incapacidade, propondo forte ligação entre funcionalidade percebida e perda objetiva. O agravamento da saúde física é o nível da dor que esses pacientes foram submetidos (DARWEESH et al., 2014). A fisioterapia se apresenta eficaz e fundamental no desenvolvimento da reabilitação a partir da descoberta da SGB, tendo em conta que quando iniciada de imediato após a descoberta, se precoce o mesmo tem possibilidade de um bom prognóstico (PEREIRA et al., 2017). O tratamento fisioterapêutico cogita apressar a recuperação e conter a gravidade da SGB, abordando sintomas como fraqueza, dor e dificuldade respiratória, mediante exercícios respiratórios, mobilidades, fortalecimentos e controle postural (GAWANDE et al., 2024).
A fisioterapia ocupa um cargo essencial no processo de reabilitação, porém é necessário manter a continuidade dos cuidados (SHAH et al., 2022).
Atualmente existem duas opções de tratamento mais aceitáveis, entre elas estão a imunoglobulina intravenosa (IVIG) e a troca de plasma. Considera-se que a IVIG atue na reação imunomoduladora, entretanto a ação exata ainda precisa ser esclarecida (ORTIZ-SALAS et al., 2016), a imunoglobulina intravenosa é administrada 0,4 g/kg por 5 dias, em pacientes dentro de 2 semanas (GPP também dentro de 2–4 semanas), após o início da fraqueza se não for possível andar sem ajuda (VAN DOORN et al., 2023).
A troca de plasma julga-se que atua eliminando anticorpos patogênicos, mediadores humorais e proteínas do complemento, entretanto semelhante com a IVIG sua ação ainda precisa ser comprovada (VAN DER MECHÉ et al., 1992). Com o seu cursor sendo 12–15 L em quatro a cinco trocas ao longo de 1–2 semanas, em pacientes dentro de 4 semanas após o início da fraqueza se não for possível andar sem ajuda (VAN DOORN et al., 2023).
A administração precoce de IVIg ou a realização de plasmaférese são intervenções comprovadamente eficazes e essenciais, especialmente para pacientes que apresentam uma progressão rápida da fraqueza muscular, aproximadamente um quarto dos pacientes necessita de suporte ventilatório, e muitos acabam desenvolvendo complicações autonômicas, durante essa fase de recuperação, a resposta imunológica diminui e o nervo periférico inicia um processo natural de reparo (HUGHES et al., 2014).
Muitas justificações possíveis para o efeito favorável da IVIg em doenças autoimunes, foram apontadas, possíveis procedimentos na SGB englobam: bloqueio de receptores FC nos macrófagos, bloqueando assim o ataque que está direcionado aos anticorpos, a membrana das células de Schwann e à mielina bem como regulação de autoanticorpo ou as citocinas, ou anti citocinas na imunoglobulina (TACKENBERG et al., 2009).
Várias pesquisas demonstraram uma significativa diminuição dos quadros infecciosos e mortalidade, bem como a melhora significativa do estado de saúde e a QV, pelo avanço da reposição de Ig intravenosa de pacientes com imunodeficiências primárias (IDP) (SIMÕES et al., 2017).
3 METODOLOGIA
Este estudo observacional retrospectivo do tipo série de casos visou investigar as características e os resultados da reabilitação fisioterapêutica em três pacientes diagnosticados com Síndrome de Guillain-Barré (SGB). A pesquisa apresentou um delineamento descritivo e utilizou dados retrospectivos coletados a partir de entrevistas estruturadas. A amostra foi intencional e não probabilística, composta por três pacientes que já realizaram tratamento fisioterapêutico para reabilitação neurológica. Esses participantes foram selecionados com base na disponibilidade de dados e no cumprimento dos critérios de inclusão do estudo.
A coleta de dados foi realizada por meio de um questionário online desenvolvido pelos pesquisadores, que foi aplicado via Google Forms e enviado aos participantes pelo aplicativo WhatsApp. O questionário foi composto por questões detalhadas sobre a qualidade de vida antes e após a fisioterapia, dificuldades funcionais enfrentadas, impactos no dia a dia, histórico do tratamento, sintomas persistentes e percepção do paciente sobre sua recuperação. Além disso, foram utilizados instrumentos validados para avaliação da qualidade de vida, como o SF-36 e a Escala Funcional de Barthel.
A pesquisa foi realizada de maneira remota, a coleta ocorreu em um período de um mês.
Os participantes foram previamente informados sobre os objetivos do estudo e leram e assinaram o Termo de Consentimento Livre e Esclarecido (TCLE) antes de responderem aos questionários. O estudo foi aprovado previamente pelo comitê de ética em pesquisa com seres humanos.
A população-alvo do estudo foi composta por pacientes diagnosticados com SGB que realizaram ou estejam realizando fisioterapia voltada para a reabilitação neurológica.
A amostra foi definida intencionalmente, considerando critérios de inclusão: ambos os sexos, idade entre 35 a 60 anos, capacidade de responder aos questionários, diagnóstico confirmado de SGB por critérios clínicos e eletrofisiológicos, realização de fisioterapia e aceite em participar do estudo por meio da assinatura do TCLE.
Os critérios de exclusão foram: interrupção do tratamento fisioterapêutico, presença de condições médicas ou neurológicas pré-existentes que interferissem na avaliação da qualidade de vida e a recusa ou impossibilidade de participar da pesquisa.
Após a aprovação pelo Comitê de Ética em Pesquisa, os participantes foram convidados a preencher o questionário eletrônico. A coleta de dados foi conduzida de forma padronizada para garantir consistência e confiabilidade nas respostas. Os dados foram analisados qualitativa e quantitativamente, com apresentação em tabelas e gráficos. Os resultados foram interpretados a partir de estatísticas descritivas, permitindo uma compreensão aprofundada do impacto da fisioterapia na qualidade de vida dos pacientes estudados.
Dentre os principais riscos da pesquisa estiveram possíveis viés nas respostas dos questionários, erros na coleta de dados e eventuais vazamentos de informações. No entanto, foram adotadas medidas para mitigar esses riscos, como o anonimato dos dados e a padronização na coleta e análise das informações. Entre os benefícios do estudo, destaca-se a ampliação do conhecimento sobre a reabilitação de pacientes com SGB, a contribuição para a melhoria das práticas fisioterapêuticas e a promoção de estratégias que possam beneficiar futuros pacientes acometidos pela doença.
A pesquisa foi conduzida de forma remota, utilizando materiais e equipamentos adequados à modalidade. O questionário foi disponibilizado por meio de plataformas digitais acessíveis, garantindo que os participantes pudessem respondê-lo de maneira conveniente e segura. Os dados coletados foram armazenados em ambiente virtual protegido, assegurando a confidencialidade das informações.
A análise estatística dos dados foi realizada por meio de métodos descritivos, incluindo frequências absolutas e relativas, médias, medianas e desvio-padrão, dependendo da natureza das variáveis. As informações foram apresentadas em tabelas, gráficos e descrições qualitativas, facilitando a interpretação dos resultados.
Assim, este estudo apresentou uma visão abrangente dos efeitos da fisioterapia na reabilitação de pacientes com SGB, garantindo rigor metodológico e transparência na condução da pesquisa, possibilitando a reprodução dos resultados por outros pesquisadores interessados na temática.
4 RESULTADOS E DISCUSSÕES OU ANÁLISE DOS DADOS
Com base nos dados extraídos dos formulários aplicados a pacientes com Síndrome de Guillain-Barré, observou-se a percepção de dificuldade em diversas atividades da vida diária. As tarefas que mais apresentaram dificuldade significativa foram “caminhar” e “subir escadas”, com dois de três pacientes, relatando que essas atividades “dificultam muito” sua funcionalidade. Atividades como “levantar da cama”, “vestir-se” e “ir ao banheiro” também apresentaram uma quantidade considerável de respostas nessa categoria. Por outro lado, tarefas como “escovar os dentes”, “alimentar-se sozinho” e “pentear o cabelo” foram os menos impactadas, com a maioria dos pacientes indicando que tais atividades “não dificultam” sua funcionalidade. Esses dados demonstram que, embora algumas atividades cotidianas sejam preservadas, funções motoras mais exigentes como: locomoção e mudança de postura, permanecendo significativamente comprometidas, reforçando a importância da reabilitação fisioterapêutica voltada à recuperação da mobilidade e independência funcional desses pacientes.
Tabela 1- Domínios de Qualidade de Vida do Questionário SF-36. (n=3).
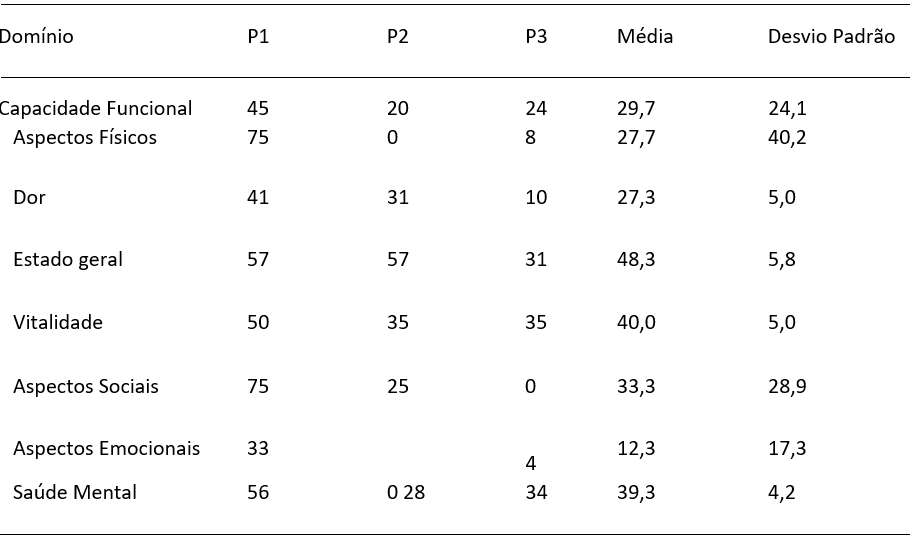
Em relação ao questionário SF-36, que inclui as condições de vida e saúde, 3 participantes responderam totalmente ao questionário. A Tabela 1 apresenta os escores obtidos em cada um dos oito domínios do questionário SF-36, aplicado a três participantes. Os escores foram convertidos para uma escala de 0 a 100, conforme orientações do manual de aplicação do instrumento, onde valores mais altos indicam melhor percepção de qualidade de vida relacionada àquele domínio específico.
A média global dos oito domínios, evidenciou valores que oscilaram de 12,3 e 48,3, expondo diferenças relevantes na avaliação da qualidade de vida. O domínio que obteve maior escore médio foi o Estado geral de saúde (48,3 ± 5,8), exibindo que dentre suas limitações, mantémse uma visão otimista sobre o assunto. De outro ângulo, os domínios com escores menores foram, aspectos emocionais (12,3 ± 17,3), Capacidade Funcional (29,7 ± 24,1) e Dor (27,3 ± 5,0).
Ademais, constatou-se um grande desvio padrão em domínios como Aspectos Físicos (DP = 40,2) e Aspectos Sociais (DP = 28,9), indicando uma variação significativa entre os participantes sobre como a saúde afeta a realização das atividades diárias e as interações sociais.
Gráfico 2. Eficiência da fisioterapia. 1-concordo, 2-discordo, 3-neutro
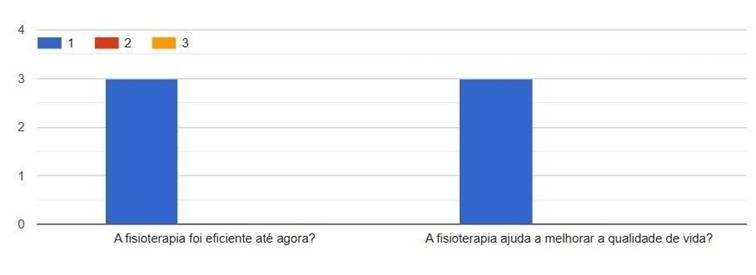
O questionário sobre Aspectos físicos e funcionais nos evidenciou que todos os participantes obtiveram uma melhora na qualidade de vida devido à fisioterapia, gráfico 2 e que de algum modo a fisioterapia influenciou em seu humor, sendo bem difuso seu resultado, gráfico 3.
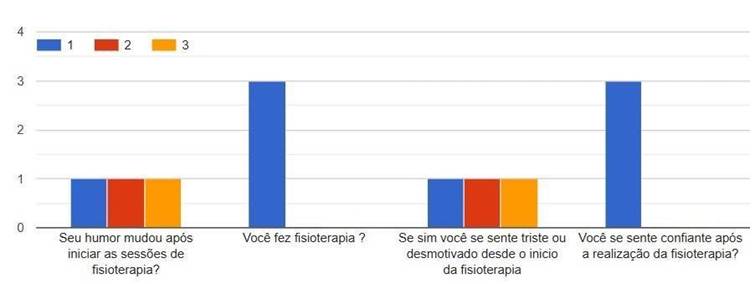
Gráfico 3. Humor 1-concordo, 2-discordo, 3-neutro
Por último, o questionário de Barthel, evidenciou que dentre as 10 categorias, somente em 2 os participantes relataram que requerem mínima ajuda, para deambular e subir escadas, reforçando assim o resultado da escala SF-36.
Os resultados obtidos por meio dos questionários aplicados aos pacientes com Síndrome de Guillain-Barré evidenciaram impactos significativos na qualidade de vida, principalmente na parte física e na vitalidade. No domínio da capacidade funcional, teve resultado baixo (29,7), o que mostra que os pacientes ainda enfrentam dificuldades em realizar atividades que exigem mais esforço físico, como caminhar e subir escadas.
Esses dados estão de acordo com Uncini et al. (2020) que apontam que a fraqueza muscular e a ausência de reflexos são características iniciais comuns da síndrome, resultantes da inflamação dos nervos periféricos. Complementando essa análise, Kiper et al. (2025) destacam que a SGB causa limitações físicas relevantes e que a resposta à reabilitação varia entre os pacientes. A pesquisa confirma que exercícios físicos estruturados, como os aplicados na fisioterapia, contribuem para o aumento da força, aprimoramento da resistência e recuperação funcional.
No domínio dos aspectos físicos, a média obtida foi de 27,7, porém, os pacientes também apresentaram dificuldades em lidar com limitações físicas impostas pela síndrome. Todavia, o desvio padrão elevado (40,2) indica que houve grande variação na resposta entre os pacientes: enquanto um deles apresentou boa recuperação, outros relataram limitações mais marcantes. Esses resultados reforçam que a resposta ao tratamento pode ser diferente para cada paciente e que a fisioterapia deve ser adaptada às necessidades individuais.
Segundo Berciano et al. (2022) explicam que a inflamação dos nervos periféricos pode causar falhas na condução nervosa e até lesões estruturais, o que contribui para essas variações na recuperação física. Complementando esse achado, Bhatia et al. (2022) identificaram que fatores como gravidade dos sintomas iniciais, tempo prolongado de internação e necessidade de suporte ventilatório estão diretamente relacionados a maior limitação funcional, mesmo após o tratamento, o que ajuda a entender os baixos escores nesse domínio.
No domínio da dor, o escore médio foi de 27,3, indicando que, embora a dor não tenha sido o sintoma mais intenso relatado, ela ainda exerce impacto importante sobre a qualidade de vida dos pacientes com SGB. Esse valor mostra que a dor pode ser persistente mesmo após a melhora dos sintomas motores, afetando o bem-estar físico e emocional. No estudo de Uz et al. (2023) acompanharam pacientes com SGB ao longo de três anos e relataram que a dor neuropática foi um dos sintomas mais duradouros, mesmo após a reabilitação inicial. Os autores destacam que o controle da dor deve ser parte fundamental da reabilitação, considerando que ela pode limitar a adesão do paciente com o tratamento e prejudicar sua funcionalidade.
De acordo com Papri et al. (2024), a dor continua a ser um desafio significativo para muitos pacientes após a alta hospitalar, com até 38% dos pacientes relatando dor persistente após 13 semanas, afetando diretamente a recuperação funcional. Ressalta-se ainda, a importância de estratégias eficazes para o manejo da dor durante todo o processo de reabilitação, a fim de promover uma recuperação mais completa e o avanço na melhoria da qualidade de vida de indivíduos acometidos com essa síndrome.
O domínio do estado geral de saúde apresentou uma média de 48,3, o que indica que, ainda que os pacientes não se percebam em estado grave, ainda não se sentem totalmente saudáveis ou recuperados. Essa percepção pode estar relacionada às sequelas físicas, à fadiga persistente e aos desafios emocionais que acompanham a recuperação da SGB. (Uz et al., 2023)
Estudos confirmam que essa sensação de saúde comprometida é comum entre pacientes que passaram pela síndrome. Uz et al. (2023) observaram que, mesmo após três anos de reabilitação, muitos pacientes continuavam relatando sintomas como dor neuropática e fadiga, afetando negativamente sua percepção de bem-estar geral. De forma semelhante, Bhatia et al. (2022) destacam que fatores como a gravidade dos sintomas iniciais e o tempo prolongado de internação podem influenciar de maneira significativa na forma como o paciente avalia sua própria saúde, mesmo após a melhora clínica.
O domínio dos aspectos sociais apresentou média de 33,3, indicando que a SGB impactou significativamente a vida social dos pacientes avaliados. Esse resultado pode estar relacionado ao isolamento durante o período de internação, a dificuldade de retornar às atividades sociais e à insegurança em conviver com outras pessoas após a doença. Um estudo realizado por Akanuwe et al. (2020) demonstrou que pacientes com a SGB enfrentam desafios sociais, como se sentir excluídos ou incompreendidos pelas pessoas ao redor, além das dificuldades para retomar suas atividades sociais e a rotina de trabalho.
Além disso, o estudo de Siriwardena et al. (2022) desenvolveu e validou um questionário para avaliar sintomas e as experiências dos pacientes após a SGB, reforçam essas dificuldades, ao destacar que muitos enfrentam grandes desafios na reintegração social e no retorno às atividades diárias. O estudo ressaltou a importância de suporte contínuo e intervenções direcionadas, com ênfase na promoção da participação social e no auxílio ao retorno das atividades cotidianas, aspectos importantes para melhorar a qualidade de vida desses pacientes.
Os resultados mostrados nos domínios emocionais (12,3) revelam que os pacientes enfrentam impactos significativos na sua estabilidade emocional por conta da SGB. Essa baixa pontuação evidencia que, além da recuperação física, é preciso considerar o lado emocional do paciente na reabilitação.
Um estudo recente de Harding et al. (2024) aponta que diversos pacientes com SGB enfrentam sentimentos de incerteza, medo e dificuldade de adaptação, afetando diretamente sua qualidade de vida. Portanto, uma abordagem que contemple tanto a recuperação física quanto o bem estar emocional, mostra-se essencial para otimizar os resultados do tratamento.
No domínio saúde mental, a média de 39,3 indica um comprometimento significativo entre os pacientes avaliados. Um estudo realizado por Piccione et al. (2021) demonstrou que pacientes com SGB apresentam um risco 7,6 vezes maior de desenvolver depressão nos dois primeiros anos após a hospitalização, em comparação com a população geral. Esse risco é especialmente elevado nos primeiros três meses após o diagnóstico, período em que os pacientes enfrentam maior vulnerabilidade emocional. Esses dados reforçam a importância de um acompanhamento psicológico contínuo e estruturado durante a reabilitação, visando melhorar a qualidade de vida e o bem-estar do paciente.
O domínio de vitalidade mostrou um escore reduzido (40,0), o que indica que, mesmo com o tratamento fisioterapêutico, o cansaço e a pouca disposição continuam presentes, afetando a qualidade de vida e bem estar do paciente. Segundo Baxter et al. (2020) pessoas com o diagnóstico da SGB, relatam sentir fadiga mesmo meses após terem a alta hospitalar, tornando assim a recuperação mais lenta e desgastante. Esses relatos mostram que, além da parte física, é importante também o cansaço emocional e a falta de energia do paciente, pois isso pode acabar atrapalhando o tratamento e deixando a pessoa sem ânimo para voltar a sua rotina.
Esse quadro é confirmado por Shah et al. (2022) que identificaram avanços relevantes na disposição e na diminuição da fadiga em pacientes com SGB submetidos a programas de exercícios supervisionados. Os autores reforçam que intervenções específicas voltadas à vitalidade são essenciais para uma reabilitação mais eficaz.
O gráfico 2, que avalia a percepção dos participantes quanto a eficiência da fisioterapia, mostra que todos os pacientes classificaram a intervenção como positiva. Este resultado reforça os dados obtidos nos domínios físicos na Escala de Barthel, indicando que, mesmo com algumas limitações ainda presentes, os pacientes reconhecem a melhora funcional promovida pelo tratamento fisioterapêutico.
Segundo Gawande et al. (2024) relataram que a aplicação estruturada da fisioterapia foi essencial para a recuperação funcional de um paciente com SGB, evidenciando a importância dessa intervenção no processo de reabilitação. Adicionalmente, Kiper et al. (2025) destacam que exercícios físicos supervisionados e adaptados à condição clínica promovem melhora na força muscular, resistência e na avaliação favorável da intervenção fisioterapêutica.
O gráfico 3, que aborda o humor dos pacientes, mostra uma leve melhora ao longo do tratamento. Essa evolução pode estar relacionada à melhora física e à sensação de acolhimento durante as sessões de fisioterapia. No entanto, considerando os baixos escores nos domínios emocionais e saúde mental, é possível afirmar que o humor ainda se apresenta como um fator delicado no processo de recuperação.
Nesse contexto, Harding et al. (2024) observaram que pacientes com SGB enfrentam desafios psicológicos importantes, incluindo sentimentos de perda, incerteza e dificuldades de adaptação, ressaltando a importância de uma abordagem multidisciplinar que inclua suporte psicológico e plano terapêutico.
No questionário de Barthel, observou-se que os pacientes mantêm um bom nível de independência nas atividades básicas, embora ainda necessitem de ajuda para deambular e subir escadas. Esses achados indicam que, apesar da recuperação funcional, certas limitações persistem no dia a dia. No estudo de Soman et al. (2022), o índice de Barthel evoluiu de 35 para 100 dias após 45 dias de reabilitação com suporte fisioterapêutico e terapias integrativas, evidenciando que a continuidade e a personalização do tratamento podem acelerar a conquista da autonomia funcional.
Entre as limitações deste estudo, destaca-se o número reduzido de participantes, o que dificulta a generalização dos resultados para uma população maior. Além disso, não foi realizado acompanhamento a longo prazo, o que impede verificar a manutenção dos ganhos obtidos após o tratamento fisioterapêutico. Para pesquisas futuras seria interessante ampliar o número de participantes e aplicar os instrumentos de avaliação em diferentes fases do tratamento. Além disso, estudos comparativos com diferentes protocolos fisioterapêuticos e a inclusão de avaliações emocionais mais específicas podem contribuir para um entendimento mais abrangente da qualidade de vida em pacientes com SGB. Essas futuras investigações poderão contribuir significativamente para a construção de protocolos mais eficazes e humanizados, promovendo melhorias reais na recuperação funcional e no bem-estar geral desses pacientes.
5 CONCLUSÃO/CONSIDERAÇÕES FINAIS
Os dados obtidos neste estudo independentemente da amostra ser reduzida puderam evidenciar que a fisioterapia desempenha um papel essencial na reabilitação de pacientes com Síndrome de Guillain-Barré, destacando ainda a importância de protocolos individualizados que considerem tanto os aspectos físicos quanto os emocionais, promovendo assim melhora funcional e favorecendo a melhoria da qualidade de vida, principalmente no que diz respeito à mobilidade e à independência nas atividades de vida diárias.
REFERÊNCIAS
ABDULLAHI, A. et al. Is Guillain–Barré Syndrome Associated With COVID-19 Infection? A Systemic Review of the Evidence. Frontiers in Neurology, v. 11, 2020. Disponível em: https://doi.org/10.3389/fneur.2020.566308. Acesso em: 19 set. 2024.
AKANUWE, J. N. A.; LAPARIDOU, D.; CURTIS, F.; JACKSON, J.; HODGSON, T. L.; SIRIWARDENA, A. N. Exploring the experiences of having Guillain-Barré Syndrome: a qualitative interview study. Health Expectations, v. 23, n. 5, p. 1338–1349, 2020. DOI: 10.1111/hex.13116. Acesso em: 10 abr. 2025.
BAXTER, R. et al. Fatigue in Guillain–Barré syndrome: prevalence, severity, and related factors. Neurology, v. 95, n. 11, p. e1524–e1532, 2020. DOI: 10.1212/WNL.0000000000010141. Acesso em: 03 abr. 2025.
BERCIANO, J. Axonal pathology in early stages of Guillain-Barré syndrome. Neurología (English Edition), v. 37, n. 6, p. 466–479, 2022. DOI: 10.1016/j.nrl.2018.06.002. Acesso em: 12 abr. 2025.
BHATIA, V. D. et al. Identification of factors affecting outcomes in patients with Guillain Barre syndrome. Medicine and Pharmacy Reports, v. 95, n. 4, p. 400–409, 2022. DOI: 10.15386/mpr-2184. Acesso em: 11 abr. 2025.
BOULLERNE, A. I. The history of myelin. Experimental Neurology, v. 283, p. B, p. 431-445, 2016. Disponível em: https://doi.org/10.1016/j.expneurol.2016.06.005. Acesso em: 28 ago. 2024.
CHACHA, J. et al. Peripheral nervous system and grounds for the neural insult in leprosy. Anais Brasileiros de Dermatologia, v. 84, n. 5, p. 495–500, 2009. Disponível em: https://doi.org/10.1590/s0365-05962009000500007. Acesso em: 1 set. 2024.
DALAQUA, M. et al. Magnetic resonance imaging of the cranial nerves in infectious, neoplastic, and demyelinating diseases, as well as other inflammatory diseases: a pictorial essay. Radiologia Brasileira, v. 55, n. 1, p. 38–46, 2022. Disponível em: https://doi.org/10.1590/0100-3984.2021.0042. Acesso em: 15 set. 2024.
DARWEESH, S. K. et al. Health-related quality of life In Guillain-Barré syndrome patients: a systematic review. Journal of the Peripheral Nervous System, v. 19, n. 1, p. 24–35, 2014. Disponível em: https://doi.org/10.1111/jns5.12051. Acesso em: 29 ago. 2024.
DIRLIKOV, E. et al. Clinical Features of Guillain-Barré Syndrome With vs Without Zika Virus Infection, Puerto Rico, 2016. JAMA Neurology, v. 75, n. 9, p. 1089–1097, 2018. Disponível em: https://doi.org/10.1001/jamaneurol.2018.1058. Acesso em: 22 ago. 2024.
FAYERS, P. M.; MACHIN, D. Qualidade de vida: avaliação, análise e relato de resultados relatados por pacientes. 3. ed. Hoboken, NJ: Wiley Blackwell, 2016.
FOKKE, C. et al. Diagnosis of Guillain-Barré syndrome and validation of Brighton criteria. Brain: a journal of neurology, v. 137, p. 1, p. 33–43, 2014. Disponível em: https://doi.org/10.1093/brain/awt285. Acesso em: 25 ago. 2024.
GARSSEN, M. P. et al. Physical training and fatigue, fitness, and quality of life in Guillain-Barré syndrome and CIDP. Neurology, v. 63, n. 12, p. 2393–2395, 2004. Disponível em: https://doi.org/10.1212/01.wnl.0000148589. Acesso em: 28 ago. 2024.
GAWANDE, I.; AKHUJ, A.; SAMAL, S. Effectiveness of Physiotherapy Intervention in Guillain Barre Syndrome: A Case Report. Cureus, v. 16, n. 1, p. e52062, 2024. Disponível em: https://doi.org/10.7759/cureus.52062. Acesso em: 31 ago. 2024.
GOUDOURIS, E. S. et al. II Brazilian Consensus on the use of human immunoglobulin in patients with primary immunodeficiencies. Einstein, São Paulo, v. 15, n. 1, p. 1–16, 2017. Disponível em: https://doi.org/10.1590/S167945082017AE3844. Acesso em: 15 set. 2024.
GUILLAIN, G.; BARRÉ, J. A.; STROHL, A. Sur un syndrome de radiculo-névrite avec hyperalbuminose du liquide céphalo-rachidien sans réaction cellulaire. Remarques sur les caractères cliniques et graphiques des réflexes tendineux. Bulletins et Mémoires de la Société des Médecins des Hôpitaux de Paris, v. 40, p. 1462-1470, 1916.
HALDEMAN, D.; ZULKOSKY, K. Treatment and nursing care for a patient with Guillain-Barré syndrome. Dimensions of Critical Care Nursing, v. 24, n. 6, p. 267–272, 2005. Disponível em: https://doi.org/10.1097/00003465-200511000-00004. Acesso em: 02 set. 2024.
HARALDSTAD, K. et al. A systematic review of quality of life research in medicine and health sciences. Quality of life research, v. 28, n. 10, p. 2641–2650, 2019. Disponível em: https://doi.org/10.1007/s11136-019-02214-9. Acesso em: 30 ago. 2024.
HARDING, R.; BROOKS, J.; PRINCE, K.; HOBART, J.; FULLER, S. The psychological effects of Guillain-Barré syndrome: A grounded theory study. Qualitative Health Research, v. 34, n. 3, p. 191–202, 2024. Disponível em: https://doi.org/10.1177/10497323241304641. Acesso em: 01 abr. 2025.
HUGHES, R. A.; CORNBLATH, D. R. Guillain-Barré syndrome. Lancet, London, v. 366, n. 9497, p. 1653–1666, 2005. Disponível em: https://doi.org/10.1016/S01406736(05)67665-9. Acesso em: 1 set. 2024.
HUGHES, R. A.; SWAN, A. V.; VAN DOORN, P. A. Intravenous immunoglobulin for Guillain-Barré syndrome. The Cochrane database of systematic reviews, v. 2014, n. 9, p. CD002063, 2014. Disponível em: https://doi.org/10.1002/14651858.CD002063.pub6. Acesso em: 26 ago. 2024.
KIPER, P.; CHEVROT, M.; GODART, J.; CIEŚLIK, B.; KIPER, A.; REGAZZETTI, M.; MERONI, R. Physical exercise in Guillain-Barré Syndrome: A scoping review. Journal of Clinical Medicine, v. 14, n. 8, p. 2655, 2025. DOI: 10.3390/jcm14082655. Acesso em: 05 abr. 2025.
LEVIN, M. C. et al. Neuronal molecular mimicry in immune-mediated neurologic disease. Annals of Neurology, v. 44, n. 1, p. 87–98, 1998. Disponível em: https://doi.org/10.1002/ana.410440115. Acesso em: 28 ago. 2024.
MCGROGAN, A.; MADLE, G. C.; SEAMAN, H. E.; DE VRIES, C. S. The epidemiology of Guillain-Barré syndrome worldwide. A systematic literature review. Neuroepidemiology, v. 32, n. 2, p. 150–163, 2009. Disponível em: https://doi.org/10.1159/000184748. Acesso em: 24 ago. 2024.
NAVE, K. A.; WERNER, H. B. Myelination of the nervous system: mechanisms and functions. Annual review of cell and developmental biology, v. 30, p. 503–533, 2014. Disponível em: https://doi.org/10.1146/annurev-cellbio-100913-013101. Acesso em: 30 set. 2024.
ORTIZ-SALAS, P. et al. Human Immunoglobulin Versus Plasmapheresis in Guillain-Barre Syndrome and Myasthenia Gravis: A Meta-Analysis. Journal of Clinical Neuromuscular Disease, v. 18, n. 1, p. 1–11, 2016. Disponível em: https://doi.org/10.1097/CND.0000000000000119. Acesso em: 22 set. 2024.
PAPRI, N. H. et al. Burden of pain and associated factors among patients with Guillain‐Barré syndrome: A prospective observational study. Journal of the Neurological Sciences, v. 459, p. 120216, 2024. Disponível em: https://doi.org/10.1016/j.jns.2024.120216. Acesso em: 01 abr. 2025.
PEREIRA, A. R.; BARBOZA, M. L.; SOUZA, D. Atuação da fisioterapia na reabilitação de paciente com Síndrome de Guillain-Barré. Fisioterapia Brasil, v. 18, n. 6, p. 778–787, 2017. Disponível em: https://docs.bvsalud.org/biblioref/2018/07/908755/atuacao-da-fisioterapianareabilitacao-de-paciente-com-sindrom_mAD2S06.pdf. Acesso em: 08 set. 2024.
PICCIONE, G. et al. Depression and anxiety in patients with Guillain–Barré syndrome: A longterm follow-up study. Neurological Sciences, v. 42, p. 1207–1213, 2021. DOI: 10.1007/s10072-020-04577-5. Acesso em: 02 abr. 2025.
REES, J. H.; SOUDAIN, S. E.; GREGSON, N. A.; HUGHES, R. A. Campylobacter jejuni infection and Guillain-Barré syndrome. The New England Journal of Medicine, v. 333, n. 21, p. 1374–1379, 1995. Disponível em: https://doi.org/10.1056/NEJM199511233332102. Acesso em: 24 set. 2024.
RIGO, D. F. H.; ROSS, C.; HOFSTÄTTER, L. M.; FERREIRA, M. F. A. P. L. Síndrome de Guillain Barré: perfil clínico epidemiológico e assistência de enfermagem. Enfermería Global, v. 19, n. 57, p. 346-389, 2020. Disponível em: https://dx.doi.org/eglobal.19.1.366661. Acesso em: 26 set. 2024.
SEJVAR, J. J.; BAUGHMAN, A. L.; WISE, M.; MORGAN, O. W. Population incidence of Guillain-Barré syndrome: a systematic review and meta-analysis. Neuroepidemiology, v. 36, n. 2, p. 123–133, 2011. Disponível em: https://doi.org/10.1159/000324710. Acesso em: 25 ago. 2024.
SHAH, N.; SHRIVASTAVA, M.; KUMAR, S.; NAGI, R. S. Supervised, individualised exercise reduces fatigue and improves strength and quality of life more than unsupervised home exercise in people with chronic Guillain Barré syndrome: a randomised trial. Journal of Physiotherapy, v. 68, n. 2, p. 119-126, 2022. Disponível em: https://doi.org/10.1016/j.jphys.2022.03.007. Acesso em: 02 abr. 2025.
SIRIWARDENA, A. N. et al. Patient-reported symptoms and experience following Guillain-Barré syndrome and related conditions: Questionnaire development and validation. Health Expectations, v. 25, n. 1, p. 223–231, 2022. DOI: 10.1111/hex.13367. Acesso em: 01 abr. 2025.
SOMAN, A. et al. Integrative Medicine Enhances Motor and Sensory Recovery in Guillain-Barre Syndrome – A Case Study. International Journal of Yoga, v. 15, n. 1, p. 80–84, 2022. Disponível em: https://doi.org/10.4103/ijoy.ijoy_186_21. Acesso em: 01 set. 2024.
TACKENBERG, B. et al. Impaired inhibitory Fcgamma receptor IIB expression on B cells in chronic inflammatory demyelinating polyneuropathy. PNAS, v. 106, n. 12, p. 4788-4792, 2009. Disponível em: https://doi.org/10.1073/pnas.0805906106. Acesso em: 18 set. 2024.
TEIXEIRA, C.; SANTOS, A.; PEREIRA, E. F. Qualidade de vida: abordagens, conceitos e avaliação. Revista Brasileira de Educação Física e Esporte, v. 26, n. 2, p. 277-286, 2012. Disponível em: https://www.scielo.br/j/rbefe/a/4jdhpVLrvjx7hwshPf8FWPC/?format=pdf&lang=pt. Acesso em: 29 ago. 2024.
UNCINI, A.; NOTTURNO, F.; KUWABARA, S. Hyper-reflexia in Guillain-Barré syndrome: systematic review. Journal of Neurology, Neurosurgery, and Psychiatry, v. 91, n. 3, p. 278–284, 2020. Disponível em: https://doi.org/10.1136/jnnp-2019-321890. Acesso em: 28 set. 2024.
VAN DEN BERG, B. et al. Guillain-Barré syndrome: pathogenesis, diagnosis, treatment and prognosis. Nature Reviews Neurology, v. 10, n. 8, p. 469–482, 2014. Disponível em: https://doi.org/10.1038/nrneurol.2014.121. Acesso em: 25 set. 2024.
UZ, F. B.; UZ, C.; KARAAHMET, O. Z. Three-year follow-up outcomes of adult patients with Guillain-Barré Syndrome after rehabilitation. Malawi Medical Journal, v. 35, n. 3, p. 156–162, 2023. DOI: 10.4314/mmj.v35i3.4. Acesso em: 01 abr. 2025.
VAN DER MECHÉ, F. G.; SCHMITZ, P. I. A randomized trial comparing intravenous immune globulin and plasma exchange in Guillain-Barré syndrome. The New England Journal of Medicine, v. 326, n. 17, p. 1123–1129, 1992. Disponível em: https://doi.org/10.1056/NEJM199204233261705. Acesso em: 13 set. 2024.
VAN DOORN, P. A. et al. European Academy of Neurology/Peripheral Nerve Society Guideline on diagnosis and treatment of Guillain-Barré syndrome. European journal of neurology, v. 30, n. 12, p. 3646–3674, 2023. Disponível em: https://doi.org/10.1111/ene.16073. Acesso em: 22 ago. 2024.
WILLISON, H. J.; JACOBS, B. C.; VAN DOORN, P. A. Guillain-Barré syndrome. Lancet, London, v. 388, n. 10045, p. 717–727, 2016. Disponível em: https://doi.org/10.1016/S0140-6736(16)00339-1. Acesso em: 22 ago. 2024.
YUKI, N. et al. A bacterium lipopolysaccharide that elicits Guillain-Barré syndrome has a GM1 ganglioside-like structure. The Journal of Experimental Medicine, v. 178, n. 5, p. 1771–1775, 1993. Disponível em: https://doi.org/10.1084/jem.178.5.1771. Acesso em: 23 ago. 2024. Fontes
¹Discente do Curso Superior de Bacharel de Fisioterapia do Instituto UNIVEL Campus UNIVEL e-mail: brunarocha1333@gmail.com
²Discente do Curso Superior de Bacharel de Fisioterapia do Instituto UNIVEL Campus UNIVEL e-mail: rafaelapostal27@gmail.com
³Docente do Curso Superior de Bacharel de Fisioterapia do Instituto UNIVEL Campus UNIVEL. Especialista em Terapia Intensiva adulto, pediátrico, neonatal e urgência e emergência (UNIOESTE). e-mail: andyara.silva@univel.br
