REGISTRO DOI: 10.69849/revistaft/pa10202501191630
Gilene de Jesus Pereira1
Cloud Kennedy Couto de Sá2
Jefferson Fagundes Loss1
RESUMO
O Diabetes Mellitus tipo 2 (DM2) é a forma mais comum da doença e se caracteriza pela resistência à insulina ou pela secreção comprometida de insulina pelas células beta pancreáticas. Uma das complicações comuns do DM2 é Neuropatia Diabética, que compromete progressivamente os nervos periféricos, resultando em disfunções dos membros inferiores. Objetivo: Sintetizar as descobertas sobre adaptação morfológica do Tendão de Aquiles em pessoas com DM2. Metodologia: Foi realizada uma busca de artigos científicos relacionados ao Tendão de Aquiles (TA) e DM2 nas bases de dados PubMed, Embase e Science Direct, utilizando palavras-chave no idioma inglês (“Diabetes OR diabetic” AND “Achilles Tendon”),. Resultados: Foram incluídos 08 estudos, envolvendo 490 indivíduos com DM2 e 232 controles (sem DM2). A maioria dos estudos mostrou um aumento da espessura do TA de indivíduos com DM2 quando comparado aos controles. Conclusão: Os resultados dessa revisão mostram que há uma tendência de aumento da espessura do TA de indivíduos com DM2 e que a espessura é ainda maior em indivíduos acometidos pela neuropatia diabética.
Palavras chave: Diabetes mellitus, Tendão de Aquiles, Espessura do tendão.
Abstract
Type 2 Diabetes Mellitus (T2DM) is the most common form of the disease and is characterized by insulin resistance or impaired insulin secretion by pancreatic beta cells. One of the common complications of T2DM is Diabetic Neuropathy, which progressively affects peripheral nerves, resulting in lower limb dysfunction.
Objective: To synthesize discoveries regarding the morphological adaptation of the Achilles Tendon in individuals with T2DM.
Methodology: A search was conducted for scientific articles related to the Achilles Tendon (AT) and T2DM in the PubMed, Embase, and Science Direct databases using keywords in English (“Diabetes OR diabetic” AND “Achilles Tendon”).
Results: Eight studies were included, involving 490 individuals with T2DM and 232 controls (without T2DM). Most studies reported an increase in AT thickness in individuals with T2DM compared to controls.
Conclusion: The results of this review indicate a trend of increased AT thickness in individuals with T2DM, with even greater thickness observed in those affected by diabetic neuropathy.
Keywords: Diabetes mellitus, Achilles Tendon, Tendon thickness.
INTRODUÇÃO
O Diabetes Mellitus é uma condição metabólica em que os níveis de glicose encontram-se elevados na corrente sanguínea, resultando em hiperglicemia. Esta elevação ocorre devido à insuficiência do hormônio insulina, podendo decorrer de uma secreção deficiente, parcial ou total, assim como por alterações em sua efetividade (Oliveira, Zugno, Silva, 2019).
O DM2, forma específica do Diabetes Mellius é caracterizado por uma falha na utilização da insulina ou por uma produção insuficiente desse hormônio, afetando o controle glicêmico do organismo (Sociedade Brasileira de Diabetes, 2023). Geralmente associado à obesidade e ao envelhecimento, o DM2 atinge 30,3% dos brasileiros com 65 anos de idade ou mais (SBD, 2023; VIGITEL, 2023).
Indivíduos diagnosticodos com Diabetes Mellitus estão expostos à disfunção em diversos sistemas do organismo, entre eles destaca-se o sistema nervoso, sendo comumente acometido pela Neuropatia Diabética (ND), que compromete progressivamente os nervos periféricos (Pedrosa et al., 2014; Hicks, Selvin, 2019).
A ND pode causar diversas alterações nos membros inferiores, como atraso na condução neural (Sacco et al., 2014; Suda et al., 2017), redução na amplitude de movimento do tornozelo (Sinacore et al., 2013), redução da força dos flexores e extensores do tornozelo (Andersen et al., 2004) e espessamento e desorganização das fibras do TA (Batista et al., 2008). Essas alterações podem aumentar o risco de surgimento de úlceras nos pés (Fernando et al., 2016; Giacomozzi et al., 2018).
Portanto, a análise de alterações relacionadas ao tendão de Aquiles em pessoas com DM2 é importante para a prevenção, diagnóstico e tratamento de complicações relacionadas ao diabetes, ajudando a melhorar a qualidade de vida e reduzindo o risco de complicações graves. Dessa forma, o objetivo dessa revisão é sintetizar as descobertas científicas relacionadas à adaptação morfológica do Tendão de Aquiles em indivíduos com DM2, com foco específico na variação da espessura do tendão.
METODOLOGIA
Foi realizada uma revisão bibliográfica de artigos científicos relacionados ao Tendão de Aquiles e DM2. Esta pesquisa bibliográfica foi realizada nas bases de dados PubMed, Embase e Science Direct, utilizando palavras-chave no idioma inglês (“Diabetes OR diabetic” AND “Achilles Tendon”), no título. A busca foi realizada no dia 22/10/23, sem limite de data ou idioma.
Foram incluíndos:
- Artigos que tratam da morfologia do TA em indivíduos com DM2
- Artigos disponíveis com texto completo
- Estudos realizados com seres humanos
A figura 01 apresenta a estratégia de busca específica realizada em cada base de dados e os critérios exclusão.
RESULTADOS
A busca sistemática da literatura identificou 124 registros potenciais, porém somente 08 artigos foram incluídos nesta revisão, conforme figura 01.
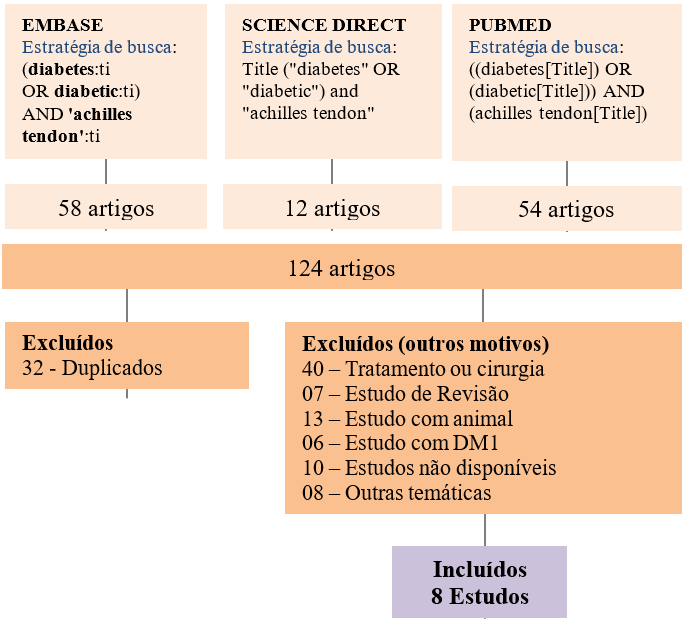
Fig. 01 – Diagrama com a estratégia de busca realizada e resultados obtidos.
CARACTERÍSTICA DOS ESTUDOS
Os estudos foram publicados entre os anos de 2005 e 2022. As características detalhadas dos estudos incluídos são apresentadas na Tabela 1. O tamanho da amostra variou de 45 (Iyidir et al., 2021) a 141 (Harish et al., 2020). Todos os estudos envolveram participantes de ambos os sexos, com idades entre 30 e 88 anos de idade e, apenas Zhang et al. (2022) não incluíram um grupo controle (sem DM2) em sua amostra.
O menor valor médio de hemoglobina (6.6±1.1%), entre os indivíduos com DM2, foi registrado no estudo de Abate et al. (2012) e o maior valor (10.4±2.1%), foi registrado no estudo de Evranos et al. (2015), já o tempo de diagóstico do DM2 variou de alguns meses (Abate et al., 2012) a 12.1±6.7 anos (Papanas et al., 2009).
A espessura do TA foi desfecho em todos os estudos incluídos. Apenas um dos estudos (Papanas et al., 2009) utilizou a ressonância magnética para avaliação das estruturas do TA, os demais estudos fizeram uso da ultrassonografia para esta finalidade.
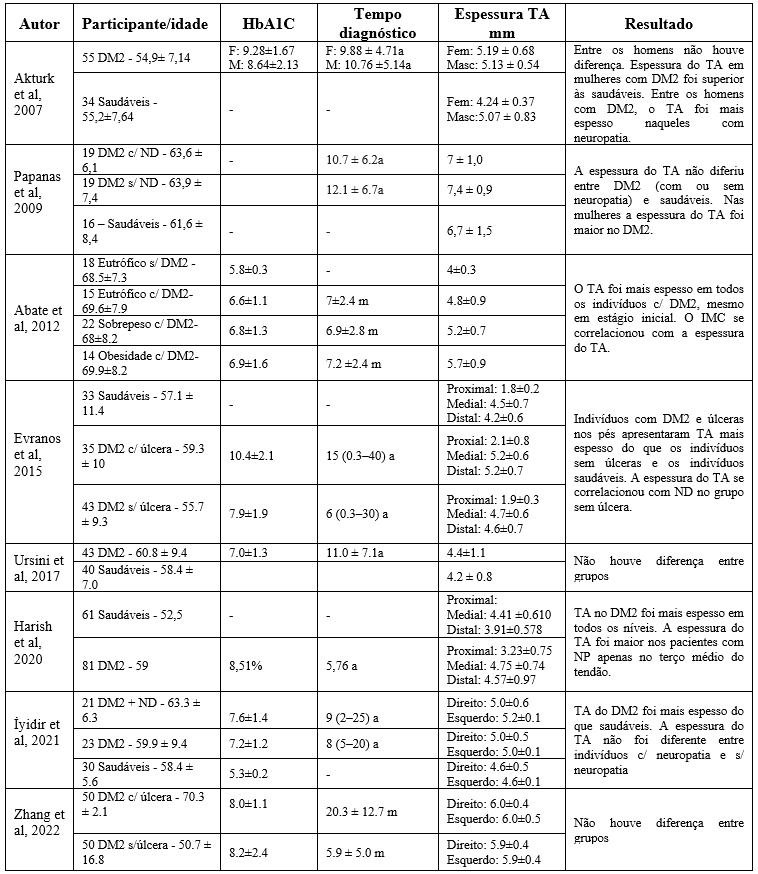
ND – Neuropatia diabética; TA – Tendão de Aquiles; F – feminino; M: masculino; a – anos; m – meses.
TENDÃO DE AQUILES E DIABETES MELLITUS TIPO 2
Mudanças morfológicas e funcionais do Tendão de Aquiles podem ter impactos significativos nas atividades cotidianas e potencialmente resultar em alterações na marcha e distribuição de peso, fatores que podem contribuir para o desenvolvimento de úlceras em pessoas com DM2.
De acordo com Schett, et al., (2013), existe uma relação entre as disfunções metabólicas do DM e alterações musculo-esqueléticas. Em seu estudo, verificaram que o DM2 está relacionado com a progressão e a gravidade da osteoartrite. Vance e Harness (2012) verificaram que a elevação dos níveis séricos da hemoglobina (>7%) estavam associados à tendinopatia.
Nesta revisão, dois estudos realizaram análise entre a espessura do TA e o nível de hemoglobina (Evranos et al., 2015; Harish et al., 2020) ou tempo de diagnóstico do DM2. Apenas no estudo de Evranos et al. (2015) foi encontrada associação entre o nível de hemoglobina e a espessura do TA.
Em geral, as pessoas com DM2 apresentam características anômalas no TA, incluindo desorganização nas fibras de colágeno (Batista, et al., 2008) ou espessamento (Abate et al., 2012; Evranos, et al., 2015; Harish et al., 2020; İyidir et al., 2021). Estas alterações tem um impacto social na vida das pessoas acometidas pela doença, visto que essas condições contribuem para a diminuição da mobilidade e da qualidade de vida (Ceravolo, Gaida, Keegan, 2018).
Dois estudos incluídos nesta revisão (Ursini et al., 2017; Zhang et al., 2022) não encontraram diferenças na espessura de TAs de indivíduos com DM2 e sem DM2. O estudo de Zhang et al. (2022) não incluiu um grupo de indivíduos saudáveis na amostra. A comparação foi realizada entre indivíduos com ou sem úlceras nos pés e não mostrou diferença entre os grupos.
Entre os estudos que apresentaram diferença significativa no TA entre indivíduos com e sem DM2, seis (Akturk et al., 2007; Abate et al., 2012; Papanas et al., 2012; Evranos et al., 2015; Harish et al., 2020; Iyidi et al., 2021) constataram que o TA é mais espesso nos indivíduos com DM2 em comparação a indivíduos sem a doença.
Tanto Akturk et al. (2007), quanto Papanas et al. (2009) analisaram separadamente TAs de homens e mulheres. Em ambos os estudos, apenas as mulheres com DM2 apresentaram TAs mais espessos quando comparadas à seus controles sem DM2 (5.19 ± 0.68mm vs. 4.24 ± 0.37mm; p<0,001); (7,2 ± 1,1 mm vs. 6,1 ± 0,9mm; p = 0,030) respectivamente.
Analisando juntamente homens e mulheres, Abate et al. (2012), Evranos et al. (2015), Harish et al. (2020) e Iyidi et al. (2021) confirmaram que a espessura do TA de indivíduos com DM2 são mais espessos do que o TA de indivíduos saudáveis (p=0.003; p<0,001; p=0,02; p<0,001) respectivamente.
ESPESSAMENTO DO TENDÃO DE AQUILES E NEUROPATIA DIABÉTICA
Uma das complicações associadas ao DM2 é a ND, causando perda da função sensorial que inicia nas extremidades inferiores e também pode causar dores nos membros inferiores e morbidade (Feldman et al., 2019).
Além disso, a ND causa outras complicações como redução na amplitude de movimento do tornozelo (Gomes et al., 2011; Sinacore et al., 2013), redução da força dos flexores e extensores do tornozelo (Andersen; et al., 2004) e espessamento e desorganização das fibras do TA (Batista et al., 2008).
Estas complicações levam a alterações na distribuição de forças no pé durante a marcha e, consequentemente aumenta o risco de surgimento de ulceras no pé (Fernando et al., 2016; Giacomozzi et al., 2018).
Alguns dos estudos incluídos nesta revisão verificaram que a ND é uma condição que favorece o aumento do espessamento do TA. Akturk et al. (2007) mostraram que indivíduos do sexo masculino com neuropatia apresentaram TA mais espessos do que os indivíduos sem neuropatia.
Evranos et al. (2015) verificaram que a prevalência de ND estava correlacionada com a espessura do TA nas regiões medial e distal. Enquanto, no estudo de Harish et al. (2020), a espessura do TA foi maior nos pacientes com ND apenas na região medial, comparado aos pacientes sem neuropatia.
Arktuk et al. (2007) verificaram que, entre os homens, o TA era mais espesso naqueles que apresentavam neuropatia ou retinopatia. Já no estudo de Papanas et al. (2009) e Iyidir et al. (2021) não foram encontradas diferenças entre os TAs de indivíduos com DM2 com ND e sem ND.
DISCUSSÃO
Em geral, houve tendência de aumento na espessura do TA entre os indivíduos com DM2 quando comparado aos controles (sem DM2). Porém dois dos estudos (Ursini et al., 2017; Zhang et al., 2022) não encontraram diferença significativa entre grupos em seus estudos.
As amostras de Ursini et al., 2017 e Zhang et al., 2022 possuíam tempo de diagnóstico médio de 11.0 ± 7.1 anos e 20.3 ± 12.7 meses respectivamente. Contudo estudos com amostra de indivíduos com menor tempo de diagnóstico apresentaram diferença na espessura do TA entre DM2 e controles (Abate et al., 2012; Harish et al., 2020).
Um fator que pode influenciar resultados contraditórios entre os estudos é o local da medição do TA. Alguns estudos (Evranos et al., 2015; Harish et al., 2020) apresentam três locais de medição (proximal, medial e distal). Os outros estudos realizaram a medição em um único ponto do TA.
Ursini et al. (2017) mediram a espessura do TA na tuberosidade do calcâneo; Abate et al. (2012) mediram 1cm à inserção do calcâneo; Akturk, et al. (2007) mediram próximo ao nível do maléolo medial; Iydir et al. (2021) e Zang et al. (2022) mediram na porção do terço médio (2 a 6 cm da inserção do calcâneo) e Papanas et al (2009), único estudo que utilizou a ressonância, determinou o corte de maior superfície no TA.
Outros fatores, além do DM2 e a presença da neuropatia podem estar associados à espessura do TA, como visto no estudo de Akturk et al. (2007), no qual houve correlação entre a espessura do TA e o IMC e o peso corporal em mulheres com DM2.
Abate et al. (2012) comparam os TAs de indivíduos eutróficos com e sem DM2 e indivíduos com obesidade e DM2 e verificaram que a diferença na espessura do TA era maior nos indivíduos com DM2 e obesidade. Contudo Iydir et al. (2021) não encontraram correlação entre IMC e espessura do TA.
Já Evranos et al. (2015) verificaram que o TA de indivíduos com DM2 era mais espesso do que o TA de indivíduos saudáveis, somente quando apresentavam também úlceras nos pés.
Além disso, Evranos et al. (2015) encontraram correlação entre idade e valores mais elevados de hemoglobina com a espessura do TA, enquanto Iyidir et al. (2021) encontraram correlação entre o nível de hemoglobina, mas não com a idade e a espessura do TA.
Contudo, no estudo de Harish et al. (2020) não foram encontradas correlações entre espessura do TA nem com a idade e nem com os níveis de hemoglobina.
Nenhum dos estudos que relacionaram a espessura do TA com a duração do DM2 encontraram correlação positiva (Papanas, et al., 2009; Evranos et al., 2015; Harish et al., 2020; İyidir et al., 2021). Contudo isto pode ser explicado pelo fato de que o DM2 geralmente é detectado tardiamente, logo o período do diagnóstico não representa o inicio da doença.
É importante destacar os efeitos do sobrepeso ou obesidade, pois, comumente, estão associados ao DM2. Alguns estudos incluídos na revisão não mencionaram o IMC dos participantes e poucos verificaram a relação entre IMC e TA.
Outro fator que pode estar relacionado ao espessamento do TA é o aumento da idade, como indicado no estudo de Hjerrild et al. (2019), o qual mostrou que a maior espessura do TA estava associada ao envelhecimento.
Além disso, tanto Stenroth et al. (2012), quanto Lindemann, et al. (2020) verificaram que a área de seção transversa (AST) dos TAs de idosos eram maiores do que AST dos TAs de indivíduos jovens (p<0,05 e p = 0,002 respectivamente).
LIMITAÇÕES
Esta revisão concentrou-se na relação entre a espessura do TA e o DM2. No entanto, é importante destacar que diversos fatores podem influenciar a espessura do tendão. Dessa forma, a falta de correlacionar a espessura do TA com variáveis como peso, idade e IMC, pode limitar a interpretação dos resultados. Além disso, houve grande variação do local da medição da espessura do TA e alguns estudos não diferenciaram a amostra por sexo.
É interessante que pesquisas futuras investiguem a correlação entre a morfologia do TA e o sobrepeso/obesidade e também verifiquem a relação entre a morfologia e parâmetros funcionais do pé e tornozelo.
CONCLUSÃO
Os achados deste estudo mostram que o Diabetes Mellitus tipo 2 exerce influência na estrutura do Tendão de Aquiles. Além disso, observa-se uma tendência de maior espessura em indivíduos com Neuorpatia Diabética.
REFERÊNCIAS
Abate M, Schiavone C, Di Carlo L. et al. Achilles tendon and plantar fascia in recently diagnosed type II diabetes: role of body mass index. Clin Rheumatol (2012) 31:1109–1113.
Andersen H, Nielsen S, Mogensen C, Jakobsen J. Muscle strength in type 2 diabetes. Diabetes. 2004;53(6):1543–8.
Akturk M, Ozdemir A, Maral I. et al. Evaluation of Achilles Tendon Thickening in Type 2 Diabetes Mellitus. Exp Clin Endocrinol Diabetes. 2007; 115: 92 – 96.
Batista F, Nery C, Pinzur M, et al. 2008. Achilles tendinopathy in diabetes mellitus. Foot Ankle Int 29:498–501
Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde e Ambiente. Departamento de Análise Epidemiológica e Vigilância de Doenças Não Transmissíveis. Vigitel Brasil 2023: vigilância de fatores de risco e proteção para doenças crônicas por inquérito telefônico: estimativas sobre frequência e distribuição sociodemográfica de fatores de risco e proteção para doenças crônicas nas capitais dos 26 estados brasileiros e no Distrito Federal em 2023 [recurso eletrônico]. Brasília: Ministério da Saúde, 2023.
Ceravolo ML, Gaida JE, Keegan RJ. Quality-of-Life in Achilles Tendinopathy: An Exploratory Study. Clin J Sport Med. 2018.
Diretriz da Sociedade Brasileira de Diabetes – Update 2/2023 DOI: 10.29327/5238993 / ISBN: 978-85-5722-906-8. Disponível: https://diretriz.diabetes.org.br/. acesso em novembro de 2023.
Evranos B, Idilman I, Ipek A et al. Real-time sonoelastography and ultrasound evaluation of the Achilles tendon in patients with diabetes with or without foot ulcers: a cross sectional study. Journal of Diabetes and Its Complications. 29 (2015) 1124–1129.
Feldman EL, Callaghan BC, Pop-Busui R, Zochodne DW, Wright DE, Bennett DL, et al. Diabetic neuropathy. Nat Rev Dis Primers. 2019;5(1):1-18.
Fernando ME, Crowther RG, Lazzarini PA, Sangla KS, Wearing S, Buttner P, et al. Plantar pressures are higher in cases with diabetic foot ulcers compared to controls despite a longer stance phase duration. BMC Endocr Disord. 2016;16(1):51.
Giacomozzi C, Sartor CD, Telles R, Uccioli L, Sacco ICN. Ulcer-risk classification and plantar pressure distribution in patients with diabetic polyneuropathy: exploring the factors that can lead to foot ulceration. Ann Ist Super Sanità. 2018;54(4):284–93.
Gomes AA, Onodera AN, Otuzi MEI, Pripas D, Mezzarane RA, Sacco ICN. Electromyography and kinematic changes of gait cycle at different cadences in diabetic neuropathic individuals. Muscle Nerve. 2011;44(2):258– 68.
Harish SC, Dixit R, Singh S. et al. Sonoelastographic Evaluation Of The Achilles Tendon In Patients With Type 2 Diabetes Mellitus. Ultrasound in Medicine & Biology.Volume 46, Number 11, 2020.
Hicks CW e Selvin E. Epidemiology of Periphereal Neuropathy and Lower Extremity Disease in diabetes. Cur iab Resp, 2019; 19(10): 86.
Hjerrild JN, Wobbe A , Stausholm MB et al. Effects of Long-Term Physical Activity and Diet on Skin Glycation and Achilles Tendon Structure. Nutrients 2019, 11, 1409.
Lindemann I, Coombes BK, Tucker K et al. Age-related differences in gastrocnemii muscles and Achilles tendon mechanical properties in vivo. Journal of Biomechanics 112 (2020) 110067.
Oliveira SG, Zugno R, Silva PC.The incidence of type 1 diabetes mellitus in southern Brazil.Revista Saúde e Desenvolvimento, v.13, n.15, 2019.
Papanas N, Courcoutsakis N, Papatheodorou K, et al.Achilles tendon volume in type 2 Diabetic Patients with or without Peripheral Neuropathy: MRI Study. Exp Clin Endocrinol Diabetes 2009; 117: 645 – 648.
Pedrosa HC, Vilar L, Boulton AJM. et al. Neuropatias e Pé Diabéticos. 1ª edição. São Paulo: AC Farmaceutica, 2014.
Sacco IC, Hamamoto AN, Onodera AN, Gomes AA, Weiderpass HA, Pachi CG, et al. Motor strategy patterns study of diabetic neuropathic individuals while walking. A wavelet approach. J Biomech. 2014;47(10):2475–82.
Schett G, Kleyer A, Perricone C, et al. 2013. Diabetes Is an Independent Predictor for Severe Osteoarthritis. Results from a longitudinal cohort study. Diabetes Care 36:403–409. Sinacore DR, Gutekunst DJ, Hastings MK, Strube MJ, Bohnert KL, Prior FW, et al.
Neuropathic midfoot deformity: associations with ankle and subtalar joint motion. J Foot Ankle Res. 2013;6(1):1.
Stenroth L, Peltonen J, Cronin NJ. Age-related differences in Achilles tendon properties and triceps surae muscle architecture in vivo. Appl Physiol113: 1537–1544, 2012
Suda EY, Madeleine P, Hirata RP, Samani A, Kawamura TT, Sacco ICN. Reduced complexity of force and muscle activity during low level isometric contractions of the ankle in diabetic individuals. Clin Biomech. 2017;42:38– 46.
Ursini F, Arturi F, Nicolosi K et al. 2017. Plantar fascia enthesopathy is highly prevalent in diabetic patients without peripheral neuropathy and correlates with retinopathy and impaired kidney function. PLoS One 12:e0174529.
Vance MC, Tucker JJ, Harness NG. 2012. The association of hemoglobin A1c with the prevalence of stenosing flexor tenosynovitis. J Hand Surg Am 37:1765–1769
İyidir ÖT, Rahatlı FK, Bozkuş Y. Acoustic Radiation Force Impulse Elastography and Ultrasonographic Findings of Achilles Tendon in Patients With and Without Diabetic Peripheral Neuropathy: A Cross-Sectional Study. Exp Clin Endocrinol Diabetes. 2021 Feb;129(2):99-10.
Zhang F, Wang J, Ma Y et al. Evaluation of Achilles Tendon in Patients with Diabetic Foot Ulcer by High-Frequency Ultrasound Combined with Real-Time Shear-Wave Elastography. J Healthc Eng. v.2022; Jan 2022.
1 Gilene de Jesus Pereira – Graduada em Educação Física – Universidade Estadual de Feira de Santana, BA; Mestra em Educação Física – Universidade Federal de Sergipe – Aracaju, SE; Doutoranda em Ciências do Movimento Humano – Universidade Federal do Rio Grande do Sul – Porto Alegre, RS. e-mail: gilenejp@gmail.com
2Universidade Estadual de Feira de Santana, BA, Brasil
