ANOMALOUS NEURONAL NETWORKS IN AUTISM SPECTRUM DISORDER AND THE USE OF CANNABIS AND ITS COMPOUNDS
REGISTRO DOI: 10.5281/zenodo.10888761
Ágata Caroline Barradas de Lira Campano;
Gabriela Yurie Arakaki;
Emilene Dias Fiuza Ferreira
RESUMO
O Transtorno do Espectro Autista (TEA) é um transtorno neuropsiquiátrico que afeta vários domínios do desenvolvimento, principalmente a comunicação e o comportamento. Sua etiologia ainda é desconhecida, porém estudos indicam que existe uma contribuição da genética, fatores imunológicos, fatores ambientais, e fatores peri e pré-natais. Segundo a OMS (2023) existem em média 70 milhões de pessoas no mundo com TEA e no Brasil 2 milhões de pessoas com algum grau desse transtorno, o equivalente a 1% da população. O nível de funcionamento intelectual entre pessoas autistas é variável desde comprometimento profundo a níveis superiores. O tratamento do TEA é multiprofissional, pois envolve terapia psicológica, fonoaudiologia, psicomotricidade, entre outras. Além disso, existem alguns fármacos para tratamento sintomático do transtorno, como antipsicóticos, ISRS, entre outros. No entanto, nota-se ainda muitos efeitos adversos causados por esses medicamentos. Perante o exposto, essa pesquisa tem como objetivo realizar uma revisão integrativa sobre o tratamento do TEA com a cannabis e seus derivados. A pesquisa será feita buscando ensaios clínicos publicados em inglês, português e espanhol, nas bases de dados PubMed, LILACS, Scielo e Periódicos da Capes com descritores. Além disso, serão utilizados trabalhos encontrados em uma busca geral nas mesmas bases com as mesmas palavras-chave, porém abordando seu uso nos títulos e resumos. Espera-se compreender os benefícios e/ou malefícios da terapia com cannabis, o seu mecanismo de ação e suas possíveis consequências futuras. Além disso, espera-se achar lacunas de conhecimento a serem preenchidas para que o tratamento com a planta e derivados possa ou não ser utilizado e para que novos trabalhos possam ser desenvolvidos.
Palavras-chave: autismo; canabidiol; cannabis, crianças
ABSTRACT
Autism Spectrum Disorder (ASD) is a neuropsychiatric disorder that affects several developmental domains, mainly communication and behavior. Its etiology is still unknown, but studies indicate that there is a contribution from genetics, immunological factors, environmental factors, and peri- and prenatal factors. According to the WHO (2023), there are on average 70 million people in the world with ASD and in Brazil there are 2 million people with some degree of this disorder, equivalent to 1% of the population. The level of intellectual functioning among autistic people varies from profound impairment to higher levels. The treatment of ASD is multi-professional, as it involves psychological therapy, speech therapy, psychomotor therapy, among others. In addition, there are some drugs for symptomatic treatment of the disorder, such as antipsychotics, SSRIs, among others. However, there are still many adverse effects caused by these drugs. In view of the above, this research aims to carry out an integrative review on the treatment of ASD with cannabis and its derivatives. The research will search for clinical trials published in English, Portuguese and Spanish, in the PubMed, LILACS, Scielo and Capes Periodicals databases with descriptors. In addition, papers found in a general search in the same databases with the same keywords will be used, but addressing their use in titles and abstracts. It is expected to understand the benefits and/or harms of cannabis therapy, its mechanism of action and its possible future consequences. In addition, it is expected to find gaps in knowledge that need to be filled so that treatment with the plant and its derivatives can be used or not, and so that new work can be developed.
Keywords: autism; cannabidiol; cannabis, children
1. INTRODUÇÃO
O transtorno do espectro autista (TEA) é um transtorno neuropsiquiátrico que tem como característica afetar principalmente dois domínios: dificuldades, persistentes e em múltiplos contextos, na interação social e comunicação; padrões de comportamento restritivos e repetitivos, podendo estar presente atualmente ou em história prévia. Os sintomas além de poderem variar com a gravidade, podem mudar com o desenvolvimento sendo mascarados por mecanismos compensatórios do organismo (AMERICAN PSYCHIATRIC ASSOCIATION, 2014).
O DSM-5 também adota níveis de gravidade do TEA, os quais variam de acordo com a necessidade de apoio: leve (precisa de apoio), moderado (precisando de apoio substancial) e grave (necessidade de apoio muito substancial).
Além disso, o transtorno pode estar associado a deficiência intelectual, irritabilidade, agressividade, déficit de reciprocidade, interesse fixo ou altamente restritos, comportamentos repetitivos, déficit de atenção e hiperatividade (TDAH), hipo ou hiper reatividade a estímulos sensoriais, problemas de sono e outras comorbidades como depressão, ansiedade, epilepsia e convulsões (POLI, et al., 2020).
Segundo a OMS (2023), 1% da população é acometida pelo transtorno. Os sintomas aparecem na infância e não há nenhum tratamento específico disponível até o momento, os medicamentos aprovados ainda apresentam diversas limitações gerando, assim, a procura por outras opções ou complementos à terapia convencional (CARREIRA; MATIAS; CAMPOS, 2022; SILVA JUNIOR et al., 2021).
A etiologia do transtorno não é completamente esclarecida, possivelmente tenha envolvimento de fatores genéticos, perinatais e ambientais . Acredita-se que a fisiopatologia do TEA esteja relacionada ao desequilíbrio de neurotransmissão do sistema endocanabinóide, do sistema serotoninérgico e do o ácido gama- aminobutírico (GABA) que regulam funções como respostas emocionais e interações sociais tipicamente prejudicadas no TEA (FUSAR-POLI et al., 2020; ZOU et al., 2021).
Além disso, no sistema endocanabinoide há dois receptores principais – receptor cannabinoide tipo 1 (CB1), codificado pelo gene CNR1 que é composto por 472 aminoácidos sua expressão é majoritária em neurônios do SNC, principalmente nos gânglios da base, córtex cerebral, hipocampo e cerebelo. Já o receptor canabinóide tipo 2 (CB2), codificado pelo gene CNR2 e composto por 360 aminoácidos, presente principalmente no baço, timo e amígdala (COHEN; WEIZMAN; WEINSTEIN, 2019; ZOU; KUMAR, 2018).
Esses receptores são ativados por endocanabinoides endógenos, como o N-araquidoniletanolamina ou anandamida (AEA) e o 2- araquinodil glicerol (2-AG), ambos produzidos conforme a demanda e envolvidos com a modulação da excitabilidade dos neurônios (NEZGOVOROVA et al., 2021). O AEA é um endocanabinoide agonista parcial com grande afinidade para o receptor CB1 e baixa afinidade para o receptor CB2 (ZOU, et al., 2021). O AEA e seus derivados, palmitoiletanolamida e oleiletanolamida estão em níveis mais baixos em pacientes com TEA (KARHSON, 2018).
O sistema endocanabinóide é um sistema retrógrado que regula a plasticidade sináptica (SCHONHOFEN et al., 2018). Portanto, a sinalização é iniciada em neurônios pós-sinápticos e atua nos terminais pré-sinápticos. Portanto, é ao contrário da neurotransmissão clássica (ARAN et al., 2019).
Estudos recentes vêm sendo realizados para esse transtorno no intuito de descobrir novas formas terapêuticas, suprir a insuficiência de tratamento e impedir o desenvolvimento de complicações graves como a síndrome metabólica (POLEG et al., 2019). O sistema endocanabinóide, tem tido relevância pois estudos experimentais em ratos, mostraram que o componente químico não intoxicante, canabidiol (CBD), auxilia nesse sistema, amenizando os sintomas relacionados com a interação social, uma das principais características do transtorno. Também, quanto ao sistema serotoninérgico, o CBD, tem ação agonistas nos receptores 5-HT1a, ajudando nos sintomas de ansiedade e depressão, que são uma comorbidade que afeta cerca de 20% das pessoas com TEA (FUSAR-POLI et al., 2020).
Em relação a utilização de partes da Cannabis sativa, de seus extratos, de seus fitocanabinóides isolados ou em misturas com diferentes proporções, apoiando a terapia já protocolada ou como estratégia única, tem sido usada para amenizar sintomas comórbidos do TEA- hiperatividade, automutilação, problemas de sono, ansiedade, inquietação, irritabilidade e depressão. Além de evidências de melhora na cognição, sensibilidade sensorial, atenção, interação social e linguagem (CARREIRA; MATIAS; CAMPOS, 2022; SILVA JUNIOR et al., 2021). Conforme Junior et al. (2022), a cannabis e os canabinóides têm efeito promissor nos sintomas do TEA, pois podem alterar níveis de neurotransmissores excitatórios e inibitórios com TEA, ajudando nos sintomas do transtorno.
Os principais compostos da cannabis são o delta-9-tetrahidrocanabinol (THC) e o CBD, estes parecem serem capazes de modular o sistema endocanabinóide (CARREIRA; MATIAS; CAMPOS, 2022). O CBD é considerado o canabinóide terapêutico mais promissor para crianças e adolescentes devido ao seu bom perfil de segurança e ação de amplo espectro com propriedades ansiolíticas, antipsicóticas e neuroprotetoras (DE FREITAS et al., 2022). Outrossim, é notório que o CBD pode alterar os níveis de glutamato, glutamina e GABA, substâncias relacionadas com neurotransmissão excitatória e inibitória tanto de indivíduos neurotípicos ou com TEA (SILVA JUNIOR et al., 2021).
2. METODOLOGIA
Foi realizada uma revisão integrativa relacionada ao uso de cannabis e seus compostos no tratamento do transtorno do espectro autista. A pesquisa foi realizada buscando ensaios clínicos publicados em inglês, espanhol e português, nas bases de dados PubMed, Scielo, LILACS e Periódicos da Capes. Além disso, foram utilizados trabalhos encontrados em uma busca geral nas mesmas bases com as mesmas palavras-chave, porém abordando seu uso nos títulos e resumos. Foram excluídos do trabalho ensaios em animais.
As palavras-chave utilizadas foram “autismo”, “cannabis”, “canabidiol” e “crianças”. Foram utilizados como filtros: texto completo, estudos em humanos e publicados entre 2018 e 2023.
3. RESULTADOS e DISCUSSÃO
A busca dos artigos utilizando as palavras-chave “autismo”, “cannabis”, “canabidiol” e “crianças” com seus filtros nos últimos 5 anos resultou em 41 artigos na plataforma PubMed, 1 artigo na plataforma CAPES, 1 artigo na plataforma LILACS e 5 artigos na plataforma Scielo. Dentre os 48 artigos, 8 foram retirados por duplicidade nas plataformas, 1 artigos foram retirados após a leitura do resumo por não abordar sobre o tema proposto do estudo, sendo incluídos neste estudo 13 artigos para leitura na íntegra, para citação na introdução nesta revisão e 7 artigos relacionados a ensaios clínicos, portanto sendo usado apenas 25 trabalhos para a confecção do artigo em sua totalidade (figura 1).
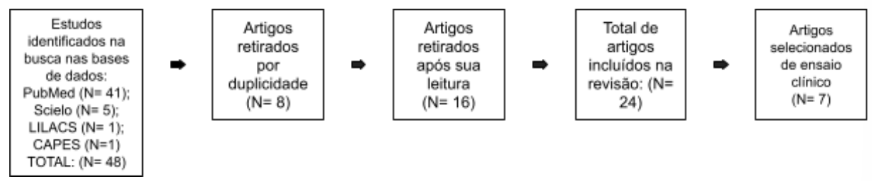
Figura 1. Fluxograma
Existe um interesse crescente sobre o uso da cannabis e de um dos seus principais componentes , o CBD, para o tratamento do TEA. Assim sendo, a análise de 2 ensaios clínicos para, primeiramente, explicar como o CBD pode interferir no SNC faz-se necessário. Os estudos avaliaram, através de ressonância magnética, as diferenças entre o SNC de indivíduos TEA e de neurotípicos após o uso de CBD. Um deles testou 34 homens saudáveis (17 neurotípicos, 17 TEA) e demonstrou que o CBD pode alterar os níveis de glutamato, glutamina e GABA, reguladores da neurotransmissão excitatória e inibitória. O mesmo estudo inferiu que o CBD teve efeitos opostos no GABA em cada grupo. Aumentou o GABA nos controles, mas diminuiu o GABA no TEA, principalmente no córtex pré-frontal dorsomedial (PRETZSCH, et al. 2019a). Isso demonstra que o cérebro de indivíduos TEA reagem distintamente ao GABA.
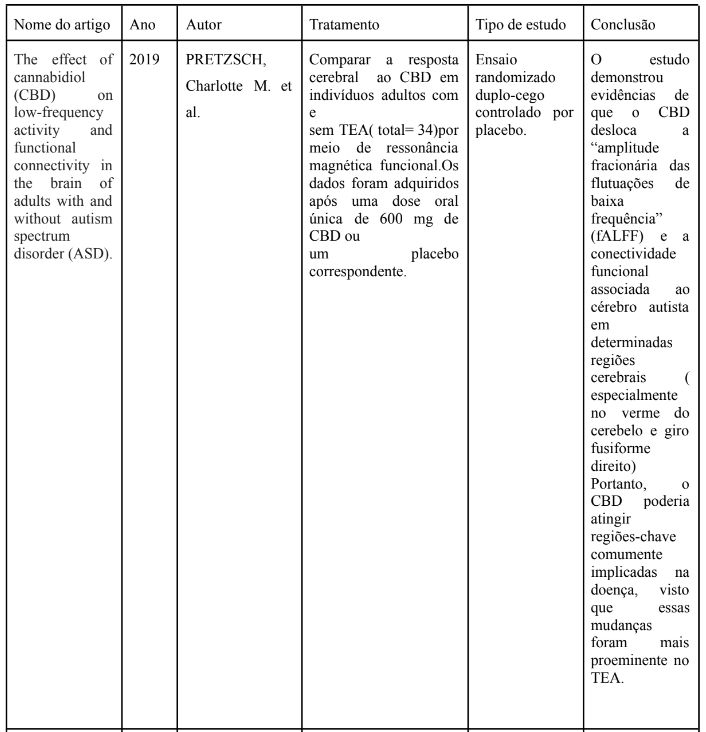
Outro estudo de Pretzsch et al. (2019b) demonstrou que o CBD desloca a “amplitude fracionária das flutuações de baixa frequência” (fALFF) e a conectividade funcional associada ao cérebro autista em determinadas regiões cerebrais (especialmente no verme do cerebelo e giro fusiforme direito). Portanto, o CBD poderia atingir regiões-chave comumente implicadas na doença, visto que essas mudanças foram mais proeminentes no TEA. Isso foi um achado importante para a possibilidade de neuromodulação através do CBD. No entanto, esses ensaios clínicos não avaliaram os efeitos do composto a longo prazo e a observação foi feita após uma única administração. Esses estudos vão ao encontro da revisão sistemática de Batalla et al. (2021) que chegou a conclusão de que o CBD, agudamente administrado, em voluntários saudáveis e com transtorno psiquiátricos, modulou redes relevantes como circuitos fronto-estriatais, fronto-límbicos. Sugerindo que pode ser útil como tratamento, restaurando redes neuronais desequilibradas.
Conforme Aran et al. (2019), o sistema endocanabinóide está desregulado no TEA, isso é demonstrado através da análise sanguínea dos endocanabinóides séricos diminuídos quando comparado ao grupo controle de crianças sem o transtorno, o que corrobora com os outros dois ensaios clínicos de ressonância magnética supracitados, evidenciando a necessidade dos estudos de função cerebral associado a administração do CBD. Nesse aspecto, o estudo observacional que comparou metabólitos salivares de crianças neurotípicas (n=9) com o de crianças com TEA (n = 15) que passaram por pelo menos um ano de tratamento com cannabis medicinal mostraram resultados que assinalam que os biomarcadores responsivos à cannabis aproximam-se em direção à média das crianças neurotípicas após o tratamento com cannabis medicinal e poderiam quantificar os benefícios a nível metabólico (SILVA JUNIOR et al., 2021).
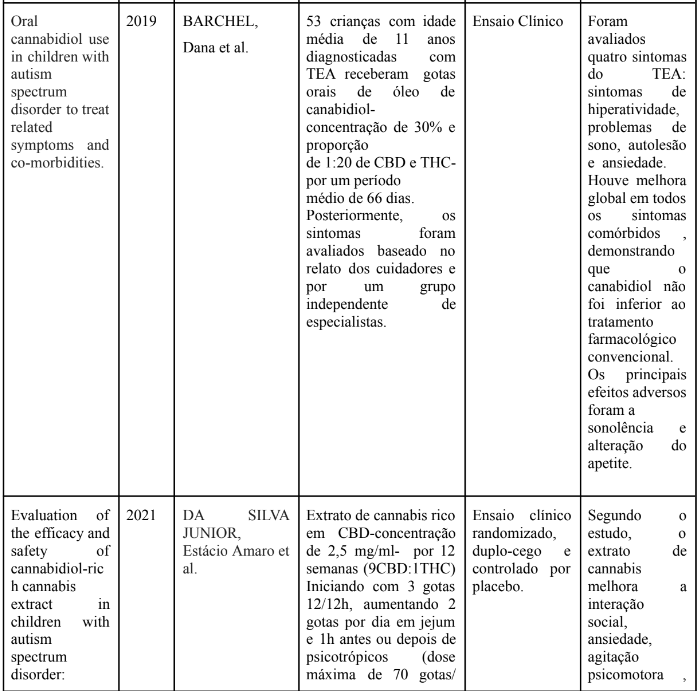
Após a leitura de 5 ensaios clínicos que administram via oral cannabis e seus extratos, foi possível observar resultados semelhantes. O tratamento com extrato de cannabis rico em CBD-concentração de 2,5 mg/ml- por 12 semanas, em 64 crianças de 5 e 11 anos, teve impacto positivo na interação social, ansiedade, agitação psicomotora e número de refeições diárias.Nos casos leves, também houve melhora na concentração. Quanto aos efeitos adversos, 9,7% apresentaram sintomas de tonturas, insônia, cólicas e aumento de peso,mas estes foram leves e transitórios. A limitação do estudo é por ter ocorrido durante o período da pandemia do coronavírus , o que pode ter interferido na rotina das crianças e, portanto, na qualidade dos dados (DA SILVA JUNIOR et al., 2021).
Em outro estudo, com resultados positivos, foi usado o THC ou também conhecido como o extratos de cannabis de espectro total (FCE), em 20 participantes com diagnóstico de TEA, por pelo menos 3 meses. O tratamento foi feio via oral, em gotas, em regime posológico baseado na resposta e adaptado para cada participante. Sendo a média da concentração usada no início do tratamento 45mg/dia: 1,94 mg/dia (CBD: THC) e no final 2,32 mg/dia, administradas duas ou três vezes por dia. Os pacientes foram avaliados mensalmente por 3 meses até a estabilização dos sintomas e posteriormente avaliados semestralmente. E como resultado, todos os pais dos participantes relataram melhora significativa no comportamento, interação social e qualidade de vida da família. Além disso, o FCE foi bem tolerado pelos participantes em relação ao uso concomitante com outros medicamentos psiquiátricos, podendo ser usado como adjuvante para o tratamento do TEA (MONTAGNER, Patrícia et al. 2023).
Ainda sobre os benefícios do canabidiol para o TEA, Barchel et al. (2019) administraram em 53 crianças, com idade média de 11 anos, diagnosticadas com TEA gotas orais de óleo de canabidiol- concentração de 30% e proporção de 1:20 de CBD e THC por aproximadamente de 66 dias. As doses recomendadas foram CBD 16 mg/Kg (dose diária máxima 600mg) THC 0,8 mg/Kg (dose diária máxima 40mg). Posteriormente, quatro sintomas- hiperatividade, problemas de sono, autolesão e ansiedade- foram avaliados com base no relato de cuidadores e por um grupo de especialistas. Das crianças que tinham hiperatividade 68,4% tiveram melhora dos sintomas, a melhora foi estatisticamente similar ao tratamento convencional (p = 0,063); quanto ao comportamento autolesivo em 67,6% houve melhora, com leve melhora ao se comparar com tratamento convencional (p = 0,063); melhora do sono em 71,4%, sem diferença para o tratamento convencional (p = 0,4); ansiedade melhorando em 47,1%, também comparável a farmacologia convencional (p = 0,232). Os efeitos adversos mais relatados foram sonolência e diminuição do apetite. Como limitação o estudo não teve grupo controle e os relatos de melhora são baseados em informações subjetivas dos pais.
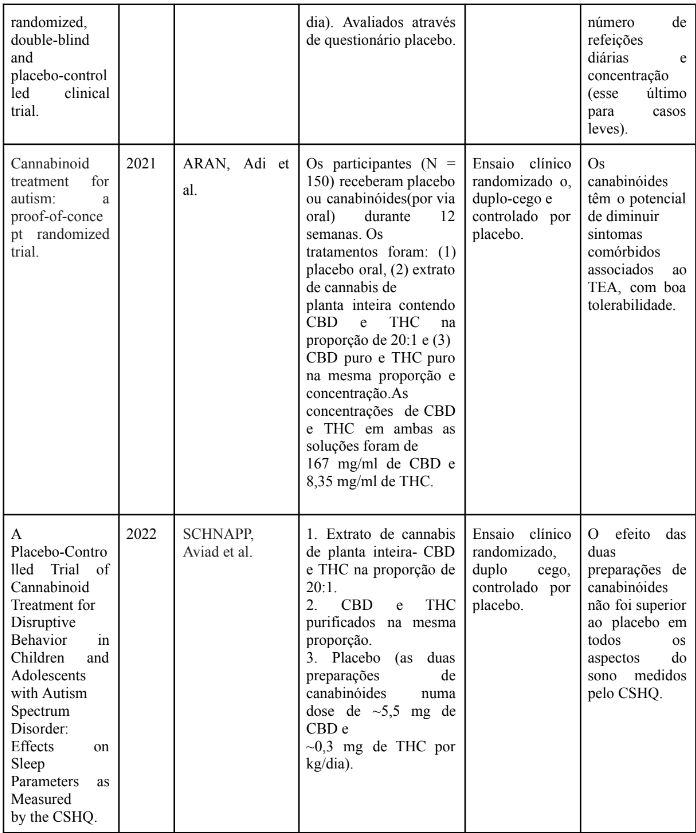
Em contrapartida, ao contrário do estudo acima, quanto à avaliação do sono SCHNAPP et al. (2022) dividiram os 150 participantes, entre 5 e 21 anos, em três gruposextrato de cannabis de planta inteira- CBD e THC na proporção de 20:1; CBD e THC purificados na mesma proporção e placebo. O efeito das duas preparações de canabinóides não foi superior ao placebo em todos os aspectos do sono medidos pelo Questionário de Hábitos de Sono Infantil (CSHQ), independentemente do tratamento (canabinóides ou placebo), No entanto, melhorias na pontuação total do CSHQ correlacionam-se com a melhora nos sintomas centrais do autismo, conforme indicado pelas pontuações totais da SRS-2.
Conforme o estudo de ARAN et al. (2021), 150 participantes entre 5 e 21 anos, receberam placebo ou canabinóides (por via oral) durante 12 semanas, seguido por um washout de 4 semanas e cruzamento por mais 12 semanas. Os tratamentos foram: (1) placebo oral, (2) extrato de cannabis de planta inteira contendo CBD e THC na proporção de 20:1 e (3) CBD puro e THC puro na mesma proporção e concentração. Os participantes foram avaliados através dos questionários- Home Situation Questionnaire-ASD (HSQ-ASD) e na escala Clinical Global Impression-Improvement com pontos de ancoragem de comportamento disruptivo (CGI-I). As medidas secundárias foram a Escala de Responsividade Social (SRS-2) e o Índice de Estresse Parental do Autismo (APSI).
Dois resultados co-primários avaliaram a melhoria nos comportamentos comórbidos após o tratamento com canabinóides: um questionário aos pais (HSQ-ASD) e uma avaliação clínica baseada em entrevistas (CGI-I). As pontuações do HSQ-ASD não diferiram significativamente entre os participantes que receberam canabinóides e os participantes que receberam o placebo. O comportamento disruptivo no CGI-I (resultado co-primário) melhorou em 49% no extrato de planta inteira (n=45) versus 21% no placebo (n=47; p=0,005). No entanto, como resultado secundário, a SRS-2 apresentou melhora dos sintomas, melhorou em 14,9 no extrato de planta inteira (n = 34) versus 3,6 pontos após o placebo (n = 36; p= 0,009), isso é algo positivo, visto que é um dos sintomas centrais do TEA. Como efeito adverso a sonolência e redução do apetite foram os mais prevalentes. As limitações foram os questionários que continham itens inaplicáveis para alguns participantes com baixo desempenho, resultando em inúmeras pontuações inválidas e na diminuição do poder estatístico dessas medidas. Também, não havia dados sobre farmacocinética das intervenções e medicações administradas. Portanto, chegou-se a conclusão que tanto o extrato de planta inteira de cannabis contendo canabidiol como o canabidiol purificado foram bem tolerados (ARAN et al. 2021).
Em todos os estudos analisados a utilização da cannabis em suas mais diversas preparações melhoraram os sintomas comórbidos associados ao TEA com exceção ao sono em que um estudo não demonstrou melhora nem piora. Também, é digno de nota que em um dos estudos a Cannabis e seus compostos tiveram resultados estatísticos semelhantes aos fármacos utilizados para o controle dos sintomas comórbidos, o que é algo positivo visto que muitos dos fármacos apresentam efeitos colaterais superiores. No geral, os estudos demonstraram benefícios quanto ao uso na cannabis e/ou extratos, isso vai de encontro a algumas revisões sistemáticas que relatam que a cannabis medicinal tem poder significativo nos sintomas centrais do TEA e melhora a qualidade de vida desses pacientes e familiares. (AGARWA; KURKE; MADDUX, 2019; BABAYEVA et al., 2022; MINELLA; LINARTEVICHI, 2021; NEZGOVOROVA et al., 2021; SILVA JUNIOR et al., 2021;). Porém ainda é necessário mais estudos para compreender melhor essa linha de tratamento.
A maioria dos efeitos colaterais, nos artigos analisados, foram leves, os mais prevalentes foram sonolência e diminuição do apetite. As preparações variaram quanto a dose diária e proporção de compostos CBD: THC. Vale ressaltar que o uso recreativo de cannabis por jovens está associado a vários problemas, incluindo falta de motivação, dependência da droga, declínio cognitivo leve e esquizofrenia, mas estas complicações foram atribuídas ao THC (BILGE ; EKICI, 2021).
A tabela 1 apresenta os artigos analisados, em ordem cronológica, na íntegra e incluídos na discussão desta revisão. Foram utilizados para confecção da tabela ensaio clínico randomizado. Na tabela há nome do artigo, ano, autor, tipo de estudo e conclusão.
TABELA 1 – Artigos analisados – Ensaio clínico




4. CONCLUSÃO
Dos 7 artigos analisados, 2 apresentaram resultados expressivos em relação a alterações na ressonância magnética funcional e possíveis modulações sinápticas com o uso agudo do canabidiol. Principalmente em regiões como verme do cerebelo, giro fusiforme direito, ao deslocar fALFF. Essas estruturas estão relacionadas ao reconhecimento de face e propriocepção o que implicaria numa possível modulação para os indivíduos TEA.
Quanto aos ensaios clínicos que analisaram a administração oral, os resultados dos estudos incluídos na presente revisão integrativa concluíram que a cannabidiol e seus compostos são promissores nos indivíduos com TEA pois trouxe benefícios para muitos sintomas típicos, como comunicação social, irritabilidade, contato visual, distúrbios do sono, hiperatividade, atenção, convulsões, anormalidades comportamentais, e que ajudaram tanto na melhoria da qualidade de vida dos pacientes quanto dos familiares. E em relação aos efeitos colaterais e interação medicamentosa, comparando aos medicamentos convencionais, que muitos causam ganho de peso, dislipidemia, diabetes e síndrome metabólica, foram muito promissores, uma vez que, em sua maioria os sintomas foram inespecíficos, leves e melhoraram com o ajuste de doses. Mostrando a necessidade de administração da dose terapêutica de forma individualizada.
Diante do exposto, a principal limitação deste artigo é a ausência de uma análise estatística dos resultados, isso se deve pela heterogeneidade do desenho do estudo, da diversidade das preparações dos canabinóides e diferentes populações. Além da existência de uma lacuna de conhecimento em relação aos efeitos colaterais a longo prazo, tempo de eficácia, perfil de segurança nos diferentes fenótipos do TEA, sendo necessário novos estudos nesse contexto.
Como sugestão para próximos estudos do tema acreditamos que existe uma necessidade de ensaios clínicos que integrem exames de imagem juntamente com a análise da melhora dos sintomas do TEA após a administração da Cannabis e seus compostos. Isso porque ao analisarmos esses dois tipos de ensaios clínicos acreditamos na necessidade de comparar a concomitância dos dois achados e assim esclarecer as redes neuronais anômalas nos indivíduos TEA e, portanto, possíveis tratamentos.
REFERÊNCIAS BIBLIOGRÁFICAS
AMERICAN PSYCHIATRIC ASSOCIATION et al. DSM-5: Manual diagnóstico e estatístico de transtornos mentais. Artmed Editora, 2014.
AGARWAL, Rumi; BURKE, Shanna L.; MADDUX, Marlaina. Current state of evidence of cannabis utilization for treatment of autism spectrum disorders. BMC psychiatry, v. 19, n. 1, p. 1-10, 2019.
ARAN, Adi et al. Cannabinoid treatment for autism: a proof-of-concept randomized trial. Molecular autism, v. 12, n. 1, p. 1-11, 2021.
ARAN, Adi et al. Lower circulating endocannabinoid levels in children with autism spectrum disorder. Molecular autism, v. 10, n. 1, p. 1-11, 2019.
BATALLA, Albert et al. The impact of cannabidiol on human brain function: A systematic review. Frontiers in pharmacology, v. 11, p. 618184, 2021.
BARCHEL, Dana et al. Oral cannabidiol use in children with autism spectrum disorder to treat related symptoms and co-morbidities. Frontiers in pharmacology, v. 9, p. 1521, 2019.
BILGE, Serap; EKICI, Barış. CBD-enriched cannabis for autism spectrum disorder: an experience of a single center in Turkey and reviews of the literature. Journal of cannabis research, v. 3, p. 1-11, 2021.
CARREIRA, Laura D.; MATIAS, Francisca C.; CAMPOS, Maria G. Clinical data on canabinoids: translational research in the treatment of autism spectrum disorders. Biomedicines, v. 10, n. 4, p. 796, 2022.
COHEN, Koby; WEIZMAN, Abraham; WEINSTEIN, Aviv. Positive and negative effects of cannabis and cannabinoids on health. Clinical Pharmacology & Therapeutics, v. 105, n. 5, p. 1139-1147, 2019.
DE FREITAS, Francisca Dias et al. El papel de los cannabinoides en los trastornos del neurodesarrollo de niños y adolescentes. Revista de Neurología, v. 75, n. 7, p. 189, 2022.
DA SILVA JUNIOR, Estácio Amaro et al. Evaluation of the efficacy and safety of cannabidiol-rich cannabis extract in children with autism spectrum disorder: randomized, double-blind and placebo-controlled clinical trial. Trends in Psychiatry, n. AheadOfPrint, p. 0-0, 2021.
FUSAR-POLI, Laura et al. Cannabinoids for people with ASD: a systematic review of published and ongoing studies. Brain sciences, v. 10, n. 9, p. 572, 2020.
KARHSON, Debra S. et al. Plasma anandamide concentrations are lower in children with autism spectrum disorder. Molecular autism, v. 9, n. 1, p. 1-6, 2018.
MINELLA, Flávia Cristina Osaku; LINARTEVICHI, Vagner Fagnani. Efeitos do canabidiol nos sinais e comorbidades do transtorno do espectro autista. Research, Society and Development, v. 10, n. 10, p. e64101018607-e64101018607, 2021.
MONTAGNER, Patrícia Soares Silva et al. Individually tailored dosage regimen of full-spectrum Cannabis extracts for autistic core and comorbid symptoms: a real-life report of multi-symptomatic benefits. Frontiers in Psychiatry, v. 14, p. 1210155, 2023.
NEZGOVOROVA, V. et al. Potential of cannabinoids as treatments for autism spectrum disorders. Journal of Psychiatric Research, v. 137, p. 194-201, 2021.
PRETZSCH, Charlotte Marie et al. Effects of cannabidiol on brain excitation and inhibition systems; a randomised placebo-controlled single dose trial during magnetic resonance spectroscopy in adults with and without autism spectrum disorder. Neuropsychopharmacology, v. 44, n. 8, p. 1398-1405, 2019a.
PRETZSCH, Charlotte M. et al. The effect of cannabidiol (CBD) on low-frequency activity and functional connectivity in the brain of adults with and without autism spectrum disorder (ASD). Journal of Psychopharmacology, v. 33, n. 9, p. 1141-1148, 2019b.
POLEG, Shani et al. Cannabidiol as a suggested candidate for treatment of autism spectrum disorder. Progress in Neuro-Psychopharmacology and Biological Psychiatry, v. 89, p. 90-96, 2019.
SCHNAPP, Aviad et al. A placebo-controlled trial of cannabinoid treatment for disruptive behavior in children and adolescents with autism spectrum disorder: effects on sleep parameters as measured by the CSHQ. Biomedicines, v. 10, n. 7, p. 1685, 2022.
SCHONHOFEN, Patrícia et al. Cannabinoid-based therapies and brain development: potential harmful effect of early modulation of the endocannabinoid system. CNS drugs, v. 32, n. 8, p. 697-712, 2018.
SILVA JUNIOR, Estácio Amaro da et al. Cannabis and cannabinoid use in autism spectrum disorder: a systematic review. Trends in psychiatry and psychotherapy, v. 44, p. e20200149, 2021.
ZOU, Shenglong; KUMAR, Ujendra. Cannabinoid receptors and the endocannabinoid system: signaling and function in the central nervous system. International journal of molecular sciences, v. 19, n. 3, p. 833, 2018.
ZOU, Mingyang et al. Alterations of the endocannabinoid system and its therapeutic potential in autism spectrum disorder. Open Biology, v. 11, n. 2, p. 200306, 2021.
