ATUAL COLORECTAL CANCER SCREENING: A SYSTEMATIC REVIEW OF THE CURRENT SCENARIO
REGISTRO DOI: 10.5281/zenodo.7983107
Cinthya Tamie Passos Miura1
Rayane Santos de Seles2
Julia Pontes Silva3
Rodrigo de Miranda Aires4
Areta Agostinho Rodrigues de Souza5
RESUMO
O Câncer Colorretal é uma das neoplasias mais frequentes na população adulta mundial, apresentando incidência e mortalidade crescentes em várias partes do mundo.
Objetivo: Realizar a integração dos principais métodos de delineamento para o rastreio do Câncer Colorretal no cenário global, evidenciando os principais resultados positivos e negativos na adoção dos mesmos.
Métodos: O presente estudo adotou como protocolo de revisão o método PRISMA, sendo o levantamento bibliográfico sistemático da literatura realizado nas seguintes bases de dados eletrônicas: PubMed (National Library of Medicine and National Institutes of Health), Scielo (Scientific Eletronic Library Online), Lilacs (Literatura Latino-Americana e do Caribe em Ciências da Saúde) e Cochrane Library. A revisão das publicações científicas foi realizada por meio da combinação de descritores específicos, determinados pelo Decs, no período de setembro a outubro do ano de 2020, sendo a última busca, realizada no último dia do mês de outubro. Foram adotados critérios de elegibilidade que determinaram a entrada ou não do artigo para a análise final, respeitando toda a metodologia do método PRISMA.
Resultados: O levantamento bibliográfico inicial totalizou um registro de 3528 artigos selecionados, que teve seu número reduzido a 563 e posteriormente a 38 estudos, por não atenderem os critérios de elegibilidade, durante a leitura dos abstracts (501 artigos), seguido da exclusão das duplicidades (24 artigos), respectivamente. A fase seguinte contou com a leitura dos artigos na íntegra, fundando uma seleção de 19 artigos que compuseram este estudo.
Conclusões: A presente revisão sistemática observou evidências de que a colonoscopia associada ou não com a pesquisa de sangue oculto nas fezes têm sido as principais ferramentas descritas para o rastreio do câncer colorretal na população assintomática, livre de fatores de risco e síndromes hereditárias. Mesmo a pesquisa de sangue oculto nas fezes, apresentar baixa sensibilidade e especificidade, o seu baixo custo e o caráter não invasivo, a torna um bom método para rastreamento de populações consideradas de baixo risco, mesmo não compreendendo a integralidade dos estudos pesquisados no intervalo de tempo pré determinado. Mais estudos devem ser acompanhados, considerando os graus de evidências que os guidelines já tem compilado, sendo a unificação dos métodos de rastreio o primeiro passo para a inserção desta prática na rotina de rastreamento no sistema único de saúde. Dessa forma, assim como as outras formas de rastreio já implementadas, a metodologia contribuirá positivamente para a diminuição da morbimortalidade mundial.
Palavras-chave (DeCS): Neoplasias Colorretais, Rastreamento, Diagnóstico Precoce.
ABSTRACT
Colorectal cancer is one of the most frequent neoplasms in the adult population worldwide, with increasing incidence and mortality in various parts of the world.
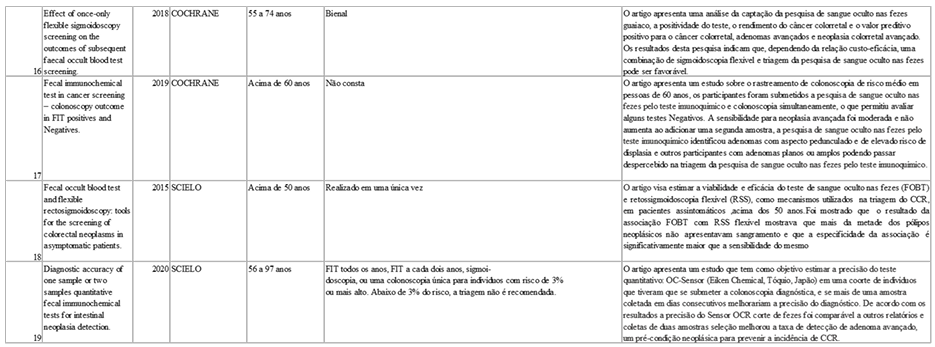
Objective: To carry out the integration of the main methods of design for the screening of Colorectal Cancer in the global scenario, showing the main positive and negative results in their adoption.
Methods: The present study adopted the PRISMA method as a review protocol, with a systematic bibliographic survey of the literature carried out in the following electronic databases: PubMed (National Library of Medicine and National Institutes of Health), Scielo (Scientific Electronic Library Online), Lilacs (Latin American and Caribbean Literature in Health Sciences) and Cochrane Library. The review of scientific publications was carried out through the combination of specific descriptors, determined by the Decs, from September to October of the year 2020, the last search being carried out on the last day of the month of October. Eligibility criteria were adopted that determined the entry or not of the article for the final analysis, respecting the entire methodology of the PRISMA method.
Results: The initial bibliographic survey totaled a record of 3528 selected articles, which had its number reduced to 563 and later to 38 studies, for not meeting the eligibility criteria, when reading the abstracts (501 articles), followed by the exclusion of duplicates (24 articles), respectively. The next phase included reading the articles in full, ending a selection of 19 articles that make up this study.
Conclusions: The present systematic review observed evidence that colonoscopy, associated or not with the analysis of occult blood in feces, has been the main tool described for the screening of colorectal cancer in the asymptomatic population, free of risk factors and hereditary syndromes. Even the search for occult blood in the feces, presenting low sensitivity and specificity, its low cost and the non-invasive character, makes it a good method for screening populations considered to be of low risk, even if it does not understand the completeness of the studies researched in the interval of predetermined time. Further studies should be followed, considering the degrees of evidence that the guidelines have already compiled, with the unification of screening methods being the first step towards the insertion of this practice in the screening routine in the single health system. In this way, as well as the other forms of screening already implemented, the methodology will contribute positively to the reduction of global morbidity and mortality.
Keywords (DeCS): Colorectal Neoplasms, Screening, Early Diagnosis.
1. INTRODUÇÃO
As neoplasias malignas têm assumido uma importância, ainda maior, no perfil da morbimortalidade dos países, tornando-se importante problema de saúde pública. O câncer colorretal (CCR), consiste no crescimento celular anormal, na região do cólon e/ou reto, sendo a combinação de ambas as estruturas a origem do intestino grosso, parte final do trato gastrointestinal (TGI) onde ocorre o processamento alimentar1.
O CCR é uma das neoplasias mais frequentes na população adulta mundial, apresentando incidência e mortalidade crescentes em várias partes do mundo2. Segundo a International Association of Cancer Registries (IACR) 3 a estimativa foi de 18,1 milhões de novos casos de câncer (17 milhões excluindo câncer de pele não melanoma) e 9,6 milhões de mortes por câncer (9,5 milhões excluindo câncer de pele não melanoma), sendo que o câncer colorretal correspondeu a 6,1% das mortes mundiais. Em 2020 a estimativa foi de 19,5 milhões de casos novos de CCR, com uma taxa de mortalidade mundial de 6,2%4.
No Brasil, o Instituto Nacional de Câncer- INCA5 estima que em cada ano do triênio 2020/2022, sejam diagnosticados, 40.990 novos casos de câncer colorretal, entre eles 20.540 em homens e 20.470 em mulheres, valores esses que correspondem a um risco estimado de 19,63 casos novos a cada 100 mil homens e 19,63 para cada 100 mil mulheres, ou seja, o segundo tipo de câncer mais frequente em homens e mulheres.
O CCR se apresenta como o terceiro tipo mais incidente na população brasileira, ocupando o 2º lugar tanto para as mulheres quanto para os homens, com diferenças entre as regiões brasileiras, o que pode ser atribuído a diferentes estados de exposição aos fatores de risco, principalmente àqueles associados aos hábitos de vida6.
A etiologia na maioria dos casos de CCR parece estar relacionada a fatores ambientais. Pesquisadores encontraram vários fatores que podem aumentar o risco do câncer colorretal, porém esse processo ainda não está bem elucidado7. Segundo Pinho et al.8 em populações com melhor nível socioeconômico, a ocorrência do CCR é maior em consequência aos padrões dietéticos adotados.
Com relação ao risco para o desenvolvimento do CCR, o INCA6 enumera os principais fatores de acordo com: idade igual ou acima de 50 anos, excesso de peso corporal e alimentação não saudável (ou seja, pobre em frutas, vegetais e outros alimentos que contenham fibras), além do consumo de carnes processadas (salsicha, mortadela, linguiça, presunto, bacon, blanquet de peru, peito de peru e salame) e a ingestão excessiva de carne vermelha (acima de 500 gramas de carne cozida por semana). A exposição ocupacional à radiação ionizante, como aos Raios X e gama, podem aumentar o risco para câncer de cólon, considerado como fator de risco ambiental.
É sabido que o câncer colorretal geralmente inicia com um crescimento lento, não canceroso, com lesões precursoras denominada pólipo, que se desenvolvem no revestimento interno do cólon ou reto, sendo mais comum, o pólipo adenomatoso, ou adenoma, que surgem a partir de células glandulares, produtoras de muco, responsável pela lubrificação do cólon e do reto6,9. A transformação dos pólipos adenomatosos de origem esporádica corresponde a 75% dos casos em pessoas com idade ≥ 50 anos, 20% de origem familiar e o restante secundário à doença inflamatória intestinal, síndromes de CCR hereditárias10. Portanto, praticamente todos os casos de câncer colorretal esporádicos têm como lesões precursoras os adenomas, que muitas vezes são assintomáticos, podendo ser diagnosticados por meio de exames de rastreamento11.
Aproximadamente 25% dos homens e 15% das mulheres submetidos ao rastreamento com 50 anos ou mais, possuem pelo menos um ou mais pólipos adenomatosos, sendo a taxa descrita de transformação desses pólipos adenomatosos em carcinoma cerca de 0,25% ao ano, variando conforme o tamanho e às características histológicas dos pólipo. Portanto, para que este risco seja eliminado a literatura descreve como principal medida a retirada completa dos pólipos, previamente detectados por exames de rastreio, já que, comumente, passam despercebidos por se apresentarem assintomáticos11,12.
A OMS preconiza o rastreamento sistemático de pessoas acima de 50 anos naqueles países com condições de garantir todas as etapas de cuidado ao paciente com a doença. Recomenda-se, entretanto, que a estratégia de diagnóstico precoce seja implementada com todos seus componentes: divulgação ampla dos sinais de alerta para a população e profissionais de saúde, acesso imediato aos procedimentos de diagnóstico dos casos suspeitos, o que implica ampliação da oferta de serviços de endoscopia digestiva e demais suportes diagnósticos, além do acesso ao tratamento adequado e oportuno11.
No Brasil, apesar da alta incidência de câncer colorretal, não existe um programa para rastreamento dos pacientes assintomáticos no Sistema Único de Saúde (SUS). Atualmente, este tipo de política pública se restringe ao câncer de mama e ao de colo do útero., recomendando a abordagem individual para as situações de alto risco. Acredita-se que esse fato tenha influência da insuficiência de investimentos nos serviços de saúde, bem como a ausência de um programa de rastreamento populacional organizado para o CCR13. Segundo o Ministério da Saúde, não é considerado viável e custo-efetivo, atualmente, a implantação de programas populacionais de rastreamento para câncer colorretal11.
Portanto, a implementação de programas de rastreio adequados à população assintomática, livre de fatores de risco e síndromes hereditárias, na fase subclínica da doença, é capaz de promover acentuada redução nas taxas de mortalidade promovendo a prevenção do câncer colorretal por meio da identificação de pólipos, lesões pré-malignas que podem ser removidas antes de progredirem à neoplasia. Desse modo, além de evitar o desenvolvimento de uma patologia maligna, o custo benefício de remover as lesões pré-malignas é maior quando comparado com o tratamento de um câncer colorretal avançado.
2. OBJETIVO
Realizar a integração dos principais métodos de delineamento para o rastreio do Câncer Colorretal no cenário global, evidenciando os principais resultados positivos e negativos na adoção dos mesmos.
3. MÉTODOS
O presente estudo adotou como protocolo de revisão, o método PRISMA, que consiste em um checklist de 27 itens e um fluxograma de quatro etapas. O objetivo do método é promover uma avaliação crítica de revisões sistemáticas, entre outros tipos de estudo publicados14.
Para a construção da pergunta norteadora que regeu os objetivos deste presente estudo, utilizou-se da estratégia PICO, maximizando portanto, a recuperação das evidências nas bases de dados, focando no escopo da pesquisa15. A revisão foi registrada na plataforma PROSPERO, sob o número de registro 243063.
4. CRITÉRIOS DE ELEGIBILIDADE
Critérios de inclusão:
1. Conter os descritores em Ciências da Saúde (Decs) previamente determinados na língua portuguesa e inglesa:
– Neoplasias Colorretais (Colorectal Neoplasms)
– Rastreamento (Screening)
– Diagnóstico precoce (Early Diagnosis)
2. Publicações entre os anos de 2015 a 2020
3. Obras descritas na Língua Portuguesa e Inglesa
4. Artigos publicados na íntegra, com relevância científica e acesso gratuito.
Critérios de exclusão:
1. Pesquisas que envolvam estudos populacionais de câncer colorretal, como história pessoal de CRC / pólipos ou o diagnóstico de síndrome de câncer colorretal hereditário.
2. Publicações que não englobam a finalidade deste estudo
4.1 FONTES DE INFORMAÇÃO E BUSCA
O levantamento bibliográfico sistemático da literatura foi realizado nas seguintes bases de dados eletrônicas: PubMed (National Library of Medicine an National Institutes of Health), Scielo (Scientific Eletronic Library Online), Lilacs (Literatura Latino-Americana e do Caribe em Ciências da Saúde) e Cochrane Library.
A revisão das publicações científicas foi realizada por meio da combinação de descritores específicos, determinados pelo Decs, no período de setembro e outubro do ano de 2020, sendo a última busca, realizada no último dia do mês de outubro.
4.2 SELEÇÃO DE ESTUDO
Com a identificação dos estudos nas bases de dados, posteriormente foram empregados os critérios de elegibilidade resultando em um número menor de publicações decorrente do processo de filtragem.
A seleção foi composta por etapas, sendo:
– Primeira etapa: Leitura apenas dos abstracts promovendo a seleção dos artigos que contemplavam todos os critérios de inclusão e nenhum critério de exclusão, sendo a leitura realizada pelos autores e a inserção feita por meio de quorum qualificado. Na presença de empate, um autor extraordinário determinava a inclusão ou não, justificando-a.
– Segunda etapa: Os trabalhos eleitos na primeira etapa foram avaliados com relação à duplicidade, sendo excluídos.
– Terceira etapa: Os artigos selecionados na fase anterior foram analisados na sua íntegra para a extração das informações, sendo que, caso algum artigo apresentasse algum critério de exclusão, mesmo nesta etapa, automaticamente foram retirados da análise.
4.3 PROCESSO DE COLETA DE DADOS
O processo de extração dos dados dos artigos foi realizado por quatro pesquisadores, para evitar opiniões tendenciosas.
4.4 LISTA DOS DADOS
Para a extração das informações dos artigos selecionados foi construído um instrumento em planilha Excel que permitiu a sumarização das informações chaves, dentre elas: título, ano de publicação, base de dado de extração e opinião do leitor, a fim de estabelecer os pontos positivos e negativos de cada método de diagnóstico precoce adotado neste cenário.
5. RESULTADOS
De acordo com as recomendações propostas pelo modelo PRISMA, o levantamento bibliográfico inicial totalizou um registro de 3528 artigos selecionados, que teve seu número reduzido a 563 e posteriormente a 38 estudos, por não atenderem os critérios de elegibilidade, durante a leitura dos abstracts (501 artigos), seguido da exclusão das duplicidades (24 artigos), respectivamente. A fase seguinte contou com a leitura dos artigos na íntegra findando uma seleção de 19 artigos que compuseram este estudo (Figura 01).
A seleção final cumpriu, com rigor, todos os critérios de inclusão e exclusão. A leitura foi realizada por todos os autores, sendo que a decisão de inclusão foi de forma unânime, não sendo necessário o julgamento de um autor excepcional.
Figura 1. Fluxograma da seleção de artigos segundo modelo PRISMA
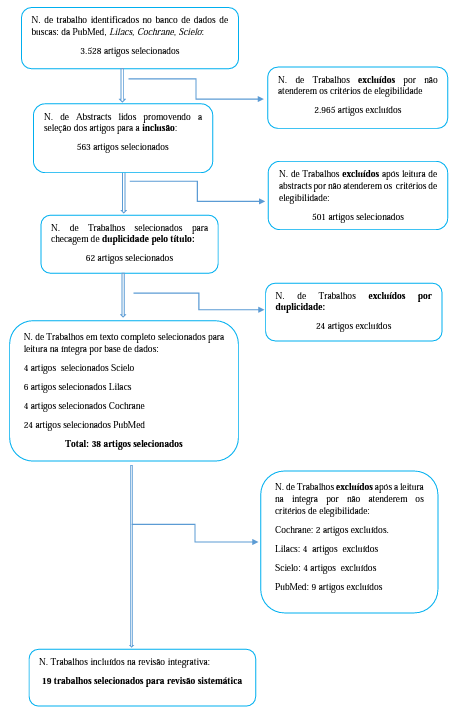
Fonte: O autor (2020).
Os anos de 2019 e 2018 foram os que mais publicaram com relação ao rastreamento populacional do câncer colorretal, compreendendo, respectivamente, 26,3 e 21% dos artigos selecionados. Com relação à metodologia dos artigos científicos incluídos, 26,3% eram revisões sistemáticas que retratam os principais métodos de escolha, descrevendo em torno da sensibilidade e especificidade para a detecção precoce do CCR. Os demais artigos compreenderam estudos randomizados, transversais, com base populacional e ensaio clínico. Dentre os artigos selecionados a média de idade foi de 62,5 anos, variando de 50 a 75 anos.
Com relação à prevenção secundária do CCR, as estratégias de rastreamento populacional (screening) para indivíduos assintomáticos, com ausência de fatores de riscos e síndromes hereditárias, obteve destaque na adoção dos exames de imagem – Colonoscopia ou Retossigmoidoscopia associado à Pesquisa de sangue oculto nas fezes – PSOF (Método Guaiaco), compreendendo 21% das evidências selecionadas, seguida da associação da Colonoscopia com à Pesquisa de sangue oculto nas fezes por meio do Teste Imunoquímico, 15,8%. Apenas 1 estudo, dentre os selecionados, foi descontinuado precocemente devido à falta de apoio financeiro.
Quando comparado a Pesquisa de Sangue Oculto nas Fezes por meio do Teste Imunoquímico ou pelo Método Tradicional – Guaiaco, dois estudos, dentro do prazo estipulado para esta pesquisa, observaram que a taxa de adesão foi maior para o teste Imunoquímico (64%), e que quando afrontados a proporção de positividade é de 9,6% para este mesmo teste.
Por fim, 36,9% dos estudos demonstraram que indivíduos, entre 50 a 79 anos, quando realizam o rastreio por meio da associação da colonoscopia e da PSOF, diminuem a incidência do CCR . Além disso ambos permitiram a avaliação dos falsos negativos da PSOF, evidenciando alto valor preditivo negativo da PSOF, sendo nesta situação, assegurado por 15,8% dos artigos selecionados, que a colonoscopia pode ser evitada, sendo que a especificidade da associação é maior que a sensibilidade do mesmo.
A síntese dos artigos incluídos para o presente trabalho estão descritos na tabela 01.
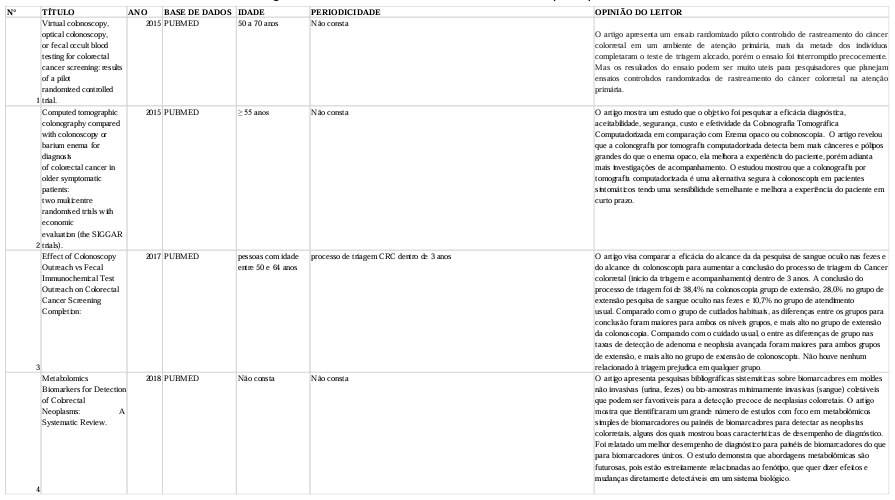
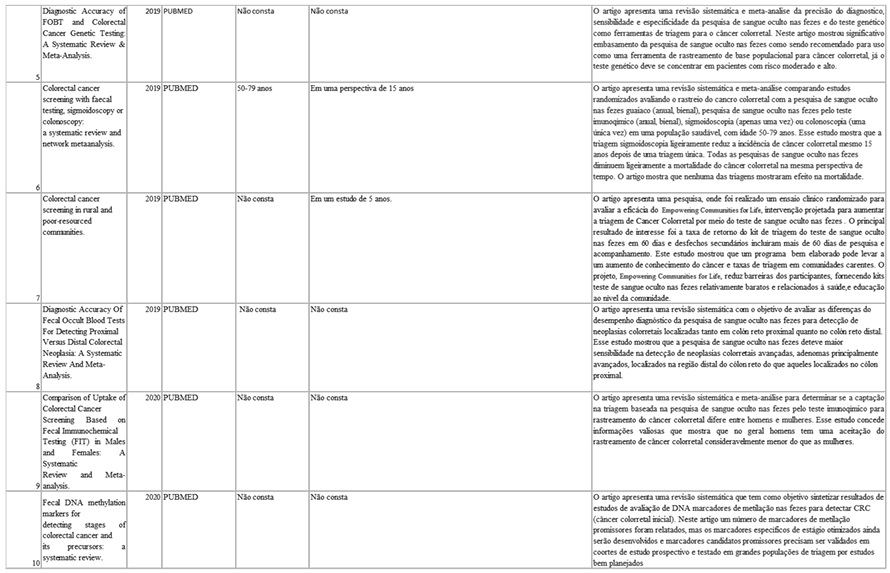
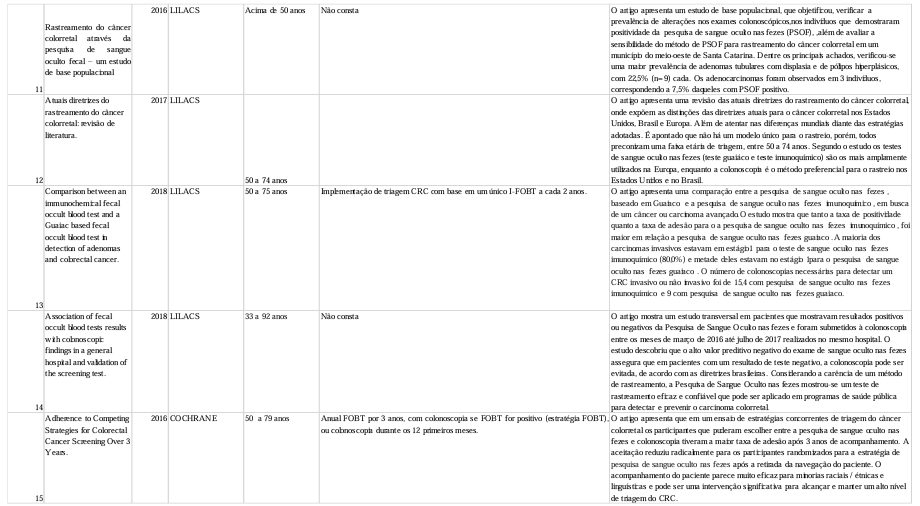
6. DISCUSSÃO
A metodologia de rastreamento populacional é a principal ferramenta para a redução da morbimortalidade por câncer colorretal, em populações assintomáticas, na fase subclínica da doença, livres de fatores de riscos e síndromes hereditárias.
No levantamento bibliográfico realizado a média da idade populacional incluída neste estudo foi de 62,5 anos, se adequando às orientações da ACS16 que demonstrou que a abordagem diagnóstica mais eficaz é desenvolvida a partir de medidas de rastreamento com base na estratificação de risco de cada paciente (risco médio, aumentado ou alto), porém um pouco mais alto do que é preconizado pelas diretrizes. Segundo a National Comprehensive Cancer Network (NCCN) 17, a idade ideal para iniciar o rastreamento para o CCR em pessoas assintomáticas, sem história familiar de câncer colorretal, é de 40 anos, no entanto, no Brasil a recomendação de idade é de 45 anos de acordo com a estratificação de risco18.
Com relação aos métodos de rastreio, a colonoscopia tem sido, junto com a pesquisa de sangue oculto nas fezes, as principais ferramentas descritas nos últimos 5 anos, sendo a PSOF indicado para detectar fundamentalmente o câncer, enquanto os exames estruturais são capazes de detectar lesões pré-malignas e o câncer propriamente dito19.
Estudos tem demonstrado evidências de que ambas as ferramentas são capazes de diminuir a mortalidade do câncer colorretal na mesma perspectiva de tempo20,21. Porém, ainda não há um consenso acerca de um método de rastreio altamente qualificado e utilizado mundialmente de maneira unânime. Em um estudo realizado por Santa Helena et al. 19 observou-se que na Europa, são preconizados os métodos organizacionais, de maior adesão, incluindo o teste de sangue oculto nas fezes (guaiáco ou imunoquímico) e seguimento com sigmoidoscopia flexível ou colonoscopia periódicas, se necessário. Na América, o rastreamento oportunista priorizou a colonoscopia, considerando então que foi o método mais utilizado, embora a diretriz indique, primeiramente, a realização do teste de fezes anual e após testes endoscópicos.
Saraceni et al.22 demonstra evidências de que o alto valor preditivo negativo do PSOF garante que, em pacientes com resultado negativo do teste, a colonoscopia pode ser evitada, em consonância com as diretrizes brasileiras. O baixo custo da PSOF e o perfil seguro, por ser um método não invasivo, chama a atenção para seu uso em população maior como um teste de rastreamento confiável para câncer colorretal, principalmente em países com recursos financeiros médios e baixos. Porém, Singal et al.23 não corroboram com os dados anteriores, na comparação entre o rastreio por meio do PSOF e a colonoscopia, evidenciando com a participação de 5.999 pessoas em sua pesquisa, que a taxa de conclusão do processo de triagem foi maior com a colonoscopia do que com PSOF (27.7% [95% CI], 25.1% para 30.4%).
Enfim, na ausência de um consenso quanto ao processo de rastreamento, o presente estudo demonstrou, por meio do rigoroso levantamento bibliográfico, que ambas as ferramentas são viáveis e eficientes quando associadas ou não, na detecção de pólipos em geral e de importante significado clínico na detecção de lesões pré-malignas e neoplásicas do câncer colorretal em indivíduos assintomáticos e de baixo risco24, 25.
Além da eficácia dos métodos para rastreio, o custo benefício entre eles e taxa de adesão, são quesitos relevantes a serem considerados na adoção de um programa sistematizado de rastreamento. Poucos foram os artigos encontrados, neste levantamento bibliográfico, que considerasse ambas as situações.
Em um acompanhamento de 3 anos de um estudo randomizado comparando estratégias de triagem de CRC concorrentes, a adesão como rastreio por meio da colonoscopia foi relativamente alta (38%, P <0,001), enquanto a adesão no grupo PSOF caiu significativamente (14%) em virtude da necessidade de testes anuais desta metodologia26. No entanto, estudos demonstram que a pesquisa de sangue oculto nas fezes, pelo seu baixo custo e caráter não invasivo, apesar da baixa sensibilidade e especificidade, é um bom método para rastreamento de populações consideradas de baixo risco19.
Além disso, a PSOF, em suas duas modalidades – prova de sangue oculto nas fezes por meio do método Guaico (PSOF – G) ou Imunoquímico (PSOF-I), mostrou maior positividade, taxa de adesão e capacidade de detectar lesões significativas maiores no PSOF-I em populações assintomáticas. Portanto, pela sua alta eficácia, custo-benefício e adesão, um programa nacional organizado usando este tipo de teste levaria à redução na mortalidade do CCR e um possível efeito na incidência do CCR27,28.
Mais estudos sobre o rastreamento do câncer colorretal, devem ser conduzidos com o objetivo de investigar estratégias de convite, para melhorar a participação em exames de rastreio, tanto por parte da população quanto do profissional da saúde. Além disso, a unificação por meio de um consenso, a respeito da padronização dos métodos a ser empregado, se faz necessário, tendo em vista a diferença da incidência mundial, e a relação do custo-benefício, temas esses essenciais a serem considerados que contribuirão para o controle da morbimortalidade em populações assintomáticas acometidas pelo CCR.
7. CONCLUSÃO
A presente revisão sistemática observou evidências de que a colonoscopia associada ou não com a pesquisa de sangue oculto nas fezes têm sido as principais ferramentas descritas para o rastreio do câncer colorretal na população assintomática, livre de fatores de risco e síndromes hereditárias. Mesmo a pesquisa de sangue oculto nas fezes, apresentar baixa sensibilidade e especificidade, o seu baixo custo e o caráter não invasivo, a torna um bom método para rastreamento de populações consideradas de baixo risco, mesmo não compreendendo a integralidade dos estudos pesquisados no intervalo de tempo pré determinado.
Mais estudos devem ser acompanhados, considerando os graus de evidências que os guidelines já tem compilado, sendo a unificação dos métodos de rastreio o primeiro passo para a inserção desta prática na rotina de rastreamento no sistema único de saúde. Dessa forma, assim como as outras formas de rastreio já implementadas, a metodologia contribuirá positivamente para a diminuição da morbimortalidade mundial.
REFERÊNCIAS
1. American Cancer Society. Colorectal Cancer Facts & Figures. American Cancer Society. Colorectal Cancer Facts & Figures Atlanta: American Cancer Society. [online] 2017.
2. Campos FGCM, Figueiredo MN, Monteiro M, Nahas SC, Cecconello I. Incidência de câncer colorretal em pacientes jovens. Rev. Col. Bras. Cir. [online]. 2017; 44 (2): 208-215.
3. International Agency for Research on Cancer – IARC. World Cancer Report. [internet]. 2018 . Available at: http://www.iarc.fr.
4. World Health Organization. Colorectal Cancer. Source: Globocan. [internet].2020. Available at: www. gco.iarc.fr.
5. Instituto Nacional de Cancer – INCA. Estimativa 2020: incidência de cancro no Brasil. [internet]. 2020. Disponível em: www.inca.gov.br.
6. Instituto Nacional de Câncer – INCA. Câncer de Intestino. [internet]. 2020. Disponível em: https://www.inca.gov.br/tipos-de-cancer/cancer- de-intestino.
7. American Cancer Society. What Causes Colorectal Cancer? Atlanta. [online] 2018.
8. Pinho MSL, Ferreira LC, Brigo MJK, Pereira Filho A, Wengerkievicz A, Ponath A, Salmoria l. Incidência do câncer colorretal na regional de saúde de Joinville (SC). Rev bras Coloproct. [online]. 2003;23(2):73-76
9. Secretaria Municipal da Saúde. Coordenação de Epidemiologia e Informação CEInfo. Boletim CEInfo Análise nº 06. [internet]. 2012. 35p. Available at: http: https://www.prefeitura.sp.gov.br/cidade/secretarias/upload/saude/arquivos/publica coes/Boletim_CEInfo_Analise_06.pdf.
10. Assis RVBF. Rastreamento e Vigilância do Câncer Colorretal: Guidelines Mundiais. GED gastroenterol. endosc.dig. 2011; 30(2):62-74.
11. BRASIL Ministério da Saúde. Caderno de Atenção primária / Rastreamento. Secretaria de Atenção à Saúde, Departamento de Atenção Básica. Série A. Normas e Manuais Técnicos. 2010.
12. Conteduca V, Sansonno D, Russi S, Dammacco F. Precancerous colorectal lesions (Review). Int J Oncol. 2013;43(4):973-84.
13. Scandiuzzi MCP, Camargo EBC, Elias FTS. câncer colorretal no brasil: perspectivas para detecção precoce. Brasília Med.[online]. 2019: 8-13.
14. Moher D, Shamseer L, Clarke M, Ghersi D, Liberati A, Petticrew M, Shekelle P, Stewart AS. Preferred reporting items for systematic review and meta-analysis protocols (PRISMA-P). Ver. Syst. [online]. 2015; 4 (1): 10.1186 / 2046-4053-4-1.
15. Santos CMS; PimentaI CAM; Nobre MRC. A estratégia PICO para a construção da pergunta de pesquisa e busca de evidências. Rev. Latino-Am. Enfermagem vol.15 no.3 Ribeirão Preto June 2007.
16. American Cancer Society.What Causes Colorectal Cancer? Atlanta; 2018. 17. NCCN Guidelines for Detection, Prevention, & Risk Reduction. 2020. 18.American Cancer Society. Cancer Statistics Center. Atlanta; 2020.
19. Helena FGS ,Carvalho LPD, Guimarães MRF,Miranda B. Atuais diretrizes do rastreamento do câncer colorretal: revisão de literatura. Porto Alegre. Revista da AMRIGS, 2017. 61 (1): 76-83.
20. Jodal HC, Helsingen LM, Anderson JC, Lytvyn L, Vandvik PO, Emilsson L. Colorectal cancer screening with faecal testing, sigmoidoscopy or colonoscopy: a systematic review and network meta-analysis. BMJ Open. 2019; 9(10): e032773.
21. Wilén HR,Blom J, Höijer J,Andersson G,Löwbeer C,Hultcrantz R. Fecal immunochemical test in cancer screening – colonoscopy outcome in FIT positives and negatives.Estocolmo. Scandinavian Journal of Gastroenterology.2019.
22. Saraceni AF ,Azevedo R ,Almeida CMG,Baraviera AC,Kiss DR , Almeida MG. Association of fecal occult blood tests results with colonoscopic findings in a general hospital and validation of the screening test. São Paulo. Sociedade Brasileira de Coloproctologia.2018.
23. Singal AG, Gupta S, Skinner CS, Ahn C, Santini NO, Agrawal D, Mayorga CA, Murphy C, Tiro JA, McCallister K, Sanders JM, Bishop WP, Loewen AC, Halm EA. Effect of Colonoscopy Outreach vs Fecal Immunochemical Test Outreach on Colorectal Cancer Screening Completion (A Randomized Clinical Trial). JAMA. 2017;318(9): 806–815.
24. Braga, Conci D, Bortolini, Mônica S, Quadros, Juliano N, Panazolo, Abel C, Debarba, Bortoli LV, Corrêa-Junior, Batista J, Neto A, Orlando. Rastreamento do câncer colorretal através da pesquisa de sangue oculto fecal – um estudo de base populacional. GED gastroenterol. endosc. dig . 2017; 36(2): 60-64.
25. Jucá MJ, Assuncão PRT ,Júnior HNHR. Fecal occult blood test and flexible rectosigmoidoscopy: tools for the screening of colorectal neoplasms in asymptomatic patients. Maceió.Sociedade Brasileira de Coloproctologia.2015.
26. Liang PS ,Wheat CL, Abhat A,Brenner AT,Fagerlin A, Hayward RA,Thomas JP, Vijan S, Inadomi JM. Adherence to Competing Strategies for Colorectal Cancer Screening Over 3 Years. Seattle. Am J Gastroenterol.2016.111(1): 105–114.
27. Kupper BEC, Junior AS, Nakagawa WT ,Takahashi RM , Batista RMSS , Bezerra TS , Filho PRS,Chulam TC , Lopes A. Comparison between an immunochemical fecal occult blood test and a Guaiac based fecal occult blood test in detection of adenomas and colorectal câncer.São Paulo. Colorectal Cancer Department, A.C.Camargo Cancer Center.2018.
28. Lu M, Luo X, Li N, Chen H, Dai M. Diagnostic Accuracy Of Fecal Occult Blood Tests For Detecting Proximal Versus Distal Colorectal Neoplasia: A Systematic Review And Meta-Analysis. Clin Epidemiol. 2019; 11: 943–954.
1Graduanda em Medicina Instituto Tocantinense Presidente Antonio Carlos – ITPAC Palmas, Palmas, TO, Brasil., E-mail: cinthyamiura@gmail.com. Orcid iD: https://orcid.org/0000-0001-8663-3949
2Graduanda em Medicina Instituto Tocantinense Presidente Antonio Carlos – ITPAC Palmas, Palmas, TO, Brasil., E-mail: rayaneseles@hotmail.com. Orcid iD: https://orcid.org/0000-0001-7199-2658
3Graduanda em Medicina Instituto Tocantinense Presidente Antonio Carlos – ITPAC Palmas, Palmas, TO, Brasil., E-mail: juliia.pontes19@hotmail.com. Orcid iD: https://orcid.org/0000-0002-1931-3977
4Graduando em Medicina Instituto Tocantinense Presidente Antonio Carlos – ITPAC Palmas, Palmas, TO, Brasil., E-mail: rodrigomasanches@gmail.com. Orcid iD: https://orcid.org/0000-0001-8532-7499
5Doutora em Ciências de Patologia pela Faculdade de Medicina da USP, Médica Oncologista Clínica Instituto Tocantinense Presidente Antonio Carlos – ITPAC Palmas, Palmas, TO, Brasil., E-mail: areta.agostinho@gmail.com. Orcid iD: https://orcid.org/0000-0002-5587-9310
