REGISTRO DOI: 10.5281/zenodo.10558587
Luan Rios Paz;
Luis Alberto Loureiro dos Santos
RESUMO
A quitina é o carboidrato mais abundante na natureza, depois da celulose, e pode ser extraída por métodos químicos ou biológicos, envolvendo etapas de desmineralização, desproteinização e despigmentação. A quitina e quitosana podem ser obtidos a partir de métodos químicos ou biológicos e cada vez mais estão sendo desenvolvidas metodologias mais eficazes, incluindo as tecnologias verdes e sustentáveis para minimizar o impacto ambiental na obtenção desses materiais. As propriedades físico-químicas da quitina e quitosana estão sendo cada vez mais exploradas, em virtude de apresentarem propriedades como biodegradabilidade, biocompatibilidade, atividade antimicrobiana, capacidade de coagulação sanguínea e de formação de filmes, o que permite o desenvolvimento de diferentes aplicações, sobretudo em áreas como biomedicina, engenharia de materiais, agricultura, entre outras.
Palavras-chave: quitina; quitosana; métodos de obtenção; propriedades; aplicações.
ABSTRACT
Chitin is the second most abundant carbohydrate in nature, after cellulose, and can be extracted by chemical or biological methods, involving steps of demineralization, deproteinization and depigmentation. Chitin and chitosan can be obtained from chemical or biological methods and increasingly more effective methodologies are being developed, including green and sustainable technologies to minimize the environmental impact in obtaining these materials. The physicochemical properties of chitin and chitosan are being increasingly explored, due to their properties such as biodegradability, biocompatibility, antimicrobial activity, blood coagulation ability and film formation ability, which allows the development of different applications, especially in areas such as biomedicine, materials engineering, agriculture, among others.
Keywords: chitin; chitosan; extraction methods; properties; applications.
1. INTRODUÇÃO
O polissacarídeo acetilado, quitina, é composto por unidades de N-acetil-d-glucosamina ligadas por ligações β(1 → 4) e é o carboidrato presente em maior quantidade no mundo depois da celulose. Este composto é extraído principalmente de crustáceos, como siris, caranguejos e camarões, os quais apresentam este material em suas carapaças. Em insetos, a quitina está presente em seus exoesqueletos e é encontrada em fungos, os quais apresentam quitina em suas paredes celulares. A quitosana, a principal derivação da quitina, se destaca pela sua solubilidade superior, ampliando seu uso em áreas como bioestimulantes para plantas, setor químico e alimentício, bem como na área da saúde, através da obtenção de biomateriais (PELLIS; GUEBITZ; NYANHONGO, 2022; SANTOS, et al., 2019).
Caracterizada por sua biodegradabilidade, compatibilidade com organismos vivos, baixa toxicidade e eficácia na coagulação sanguínea, além de atividade antimicrobiana, a quitosana tem aplicações promissoras em diversos setores (ESSAWY; HEFNI; EL-NGGAR, 2019). Sua utilidade estende-se à indústria têxtil e de papel, no tratamento de águas residuais e na agricultura, onde atua como biopesticida, possibilitando o controle sobre fungos e bactérias. Também é utilizada como elicitador e bioestimulante de plantas, contribuindo para um desenvolvimento agrícola mais produtivo e sustentável. Os usos da quitosana como biomaterial apresentam valor, pois é um material biocompatível, com baixa toxicidade e capacidade de biodegradação (MALIKI, et al., 2022; LI, K., et al., 2020).
Na extração da quitina e posterior obtenção da quitosana, a economia circular é enaltecida, com a reutilização de resíduos de carapaças de crustáceos os quais impactam negativamente o meio ambiente quando descartados de maneira inapropriada. Embora alguns produtos no mercado sejam rotulados como quitina e quitosana, mas contenham principalmente carbonato de cálcio e outras impurezas, técnicas de processamento químico adequadas garantem a obtenção de materiais de alta qualidade (JUNCEDA-MENA; GARCÍA-JUNCEDA; REVUELTA, 2023; TRIUNFO, et al., 2022).
A fim de obter uma melhor compreensão acerca dos processos para obtenção desses materiais, bem como as suas potenciais aplicações, essa revisão da literatura tem por objetivo trazer maiores detalhes sobre as técnicas de extração e obtenção desses materiais, que não são apresentadas de forma clara em artigos da literatura. São discutidas as metodologias mais recentes e eficazes, incluindo as tecnologias verdes e sustentáveis que estão sendo adotadas para minimizar o impacto ambiental. Além disso, esta revisão também aborda as propriedades físico-químicas da quitina e quitosana, com foco em como estas características influenciam suas aplicações em diversos campos, como biomedicina, engenharia de materiais, agricultura, entre outras.
2. QUITINA
2.1 FONTES DE OBTENÇÃO E MÉTODOS DE EXTRAÇÃO
A quitina foi identificada pela primeira vez no ano de 1811 por Henri Braconnot. É um carboidrato complexo formado por cadeias de N-acetilglucosamina e normalmente está presente nas carapaças de lagostas, caranguejos, camarões e nos exoesqueletos de insetos, como mostrado na Figura 1. Este biopolímero está presente na natureza em grande quantidade e apenas a celulose o supera em termos de disponibilidade. É comumente encontrado como microfibrilas cristalinas ordenadas no componente estrutural de artrópodes e insetos, além de ser encontrado em fungos, especificamente em suas paredes celulares. Geralmente, este biopolímero acetilado é formado por cadeias de N-acetil-D-glucosamina ligadas por uma ligação β(1 → 4) (VERMA; FORTUNATI, 2019). Comercialmente, a quitina pode ser obtida a partir das carapaças de caranguejos, camarões e krill, por meio de uma série de processos de desproteinização e desmineralização para remover proteínas e minerais que, junto com a quitina, formam a estrutura das carapaças desses animais. A massa seca desses resíduos de carapaças contém tipicamente cerca de 15-25% de quitina (QIN, 2016).
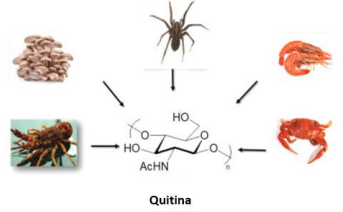
Figura 1- Fontes biológicas de quitina.
Adaptado de DABAS; JAISWAR, 2021.
A fonte mais abundante de quitina são as carapaças de crustáceos, que também contêm uma grande quantidade de cálcio. A quitina pode ser obtida por um processo que inclui etapas de remoção de minerais, remoção de pigmentos e remoção de proteínas. A remoção de minerais é realizada comumente com ácido clorídrico diluído, onde o cálcio é convertido em sais facilmente removíveis por filtração. A desproteinização, ou seja, a remoção de proteínas, é feita utilizando bases como hidróxido de sódio. A despigmentação pode ser realizada com solução diluída de hipoclorito de sódio. Além disso, a extração da quitina pode ser feita por meio de um processo biológico, que consiste em etapas de desmineralização e desproteinização, realizadas por bactérias produtoras de ácidos orgânicos e protease, respectivamente em cada uma dessas etapas. Este método resulta em uma produção mais rápida, segura e controlada (GIRI et al., 2021). Os processos químico e biológico típicos de obtenção da quitina oriunda das carapaças de crustáceos estão ilustrados na Figura 2.
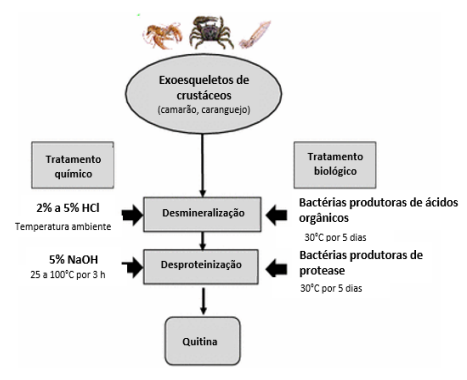
Figura 2- Etapas de obtenção de quitina a partir de extração pelo método químico e biológico oriunda de carpaças de crustáceos.
Adaptado de KIM; PARK, 2015.
2.2 ISOLAMENTO DA QUITINA
Para isolar a quitina a partir das carapaças de camarões, caranguejos ou siris, é necessário efetuar duas etapas fundamentais: (1) a desproteinização e (2) a remoção dos minerais (carbonatos e fosfatos) por meio da desmineralização. Estas etapas também podem ser realizadas em ordem inversa, ou seja, primeiro a desmineralização e, em seguida, a desproteinização. No entanto, se a recuperação de proteínas for um objetivo, recomenda-se extrair as proteínas antes da desmineralização para maximizar o rendimento proteico e a qualidade (JOHNSON; PENISTON, 1982). O fluxograma para o isolamento da quitina, incluindo as etapas de tratamento químico, está a apresentado a seguir (Figura 3).
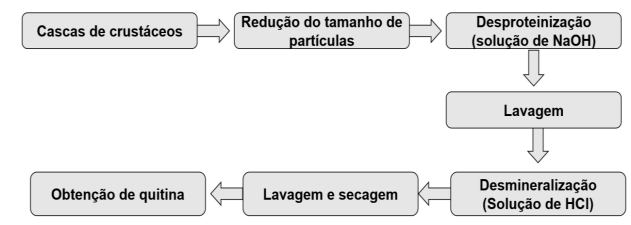
Figura 3- Etapas do processo de extração da quitina a partir carapaças de crustáceos.
Adaptado de NO; MEYERS,1995.
Fontes primordiais para obtenção de quitina incluem as estruturas de proteção externa de crustáceos, notadamente caranguejos e camarões. Em tais organismos, a quitina faz parte de uma complexa malha proteica, na qual se acumula carbonato de cálcio para constituir o exoesqueleto resistente. A conexão entre a quitina e as proteínas é intensa, havendo ainda uma fração minoritária de proteínas que participa de uma matriz complexa com o polissacarídeo (HORST; WALKER; KLAR, 1993). Para a extração da quitina em moluscos, é imprescindível a eliminação de dois elementos fundamentais da concha: proteínas e carbonato de cálcio, bem como quantidades menores de pigmentos e lipídios. Em certos contextos, um procedimento adicional para retirar colorações é empregado para dissipar pigmentos que persistem. Múltiplos procedimentos foram propostos e adotados ao decorrer dos anos para purificar quitina; porém, nenhum procedimento se consolidou como padrão. As etapas de desproteinização e descalcificação podem ser executadas por meio de técnicas químicas ou enzimáticas. A ordem destes processos pode ser invertida, resultando em vantagens em determinados casos, em particular quando o tratamento enzimático é aplicado. A fermentação bacteriana também é utilizada; neste caso, os processos de remoção de proteínas e minerais acontecem conjuntamente (NO; MEYERS, 1995; YOUNES; RINAUDO, 2015).
A etapa inicial da extração da quitina é a escolha adequada da matéria-prima, que é crucial para o resultado do processo. Em casos como o de lagostas e caranguejos, essa seleção tem um papel fundamental na qualidade do material isolado obtido. O procedimento ideal envolve a escolha de conchas de tamanho uniforme e da mesma espécie. Para camarões, que possuem carapaças mais finas, o processo de isolamento da quitina tende a ser mais fácil do que com outros crustáceos. As carapaças escolhidas precisam ser limpas, secas e trituradas em fragmentos menores (reduzindo a granulometria do material) (HORST; WALKER; KLAR, 1993; YOUNES; RINAUDO, 2015).
2.3 DESPROTEINIZAÇÃO QUÍMICA
O procedimento de retirar proteínas envolve desfazer as ligações químicas entre a quitina e as proteínas. Esta etapa é realizada de forma desigual, empregando-se compostos químicos que também podem fragmentar o biopolímero. A eliminação integral da proteína é essencial para aplicações na área de saúde, visto que um segmento dos indivíduos é sensível a crustáceos, com a parte proteica sendo o agente alergênico principal (AYE; STEVENS, 2004; LOPES et al., 2018).
As estratégias químicas foram os primeiros métodos empregados na desproteinização. Uma extensa variedade de agentes químicos foi testada para essa fase, englobando hidróxido de sódio, carbonato de sódio, bicarbonato de sódio, hidróxido de potássio, carbonato de potássio, hidróxido de cálcio, sulfito de sódio, bissulfito de sódio, bissulfito de cálcio, fosfato de sódio tribásico e sulfeto de sódio. As condições de cada reação diferem marcadamente em cada pesquisa. O hidróxido de sódio é comumente o reagente preferido, sendo aplicado em concentrações que oscilam entre 0,125 a 5,0 molar, em temperaturas que podem alcançar até 160 graus Celsius e durante tempos que variam de alguns minutos até diversos dias. A utilização do hidróxido de sódio pode provocar a desacetilação parcial da quitina e a sua subsequente hidrólise, acarretando na redução do peso molecular do polímero (YOUNES; RINAUDO, 2015; TOKATLI; DEMİRDÖVEN, 2018).
2.4 DESMINERALIZAÇÃO QUÍMICA
O processo de desmineralização consiste na eliminação de minerais, principalmente carbonato de cálcio. Usualmente, é feito através de tratamento ácido empregando reagentes tais como ácido clorídrico, ácido nítrico, ácido sulfúrico, ácido acético e ácido fórmico (NO; HUR, 1998; PERCOT; VITON; DOMARD, 2003). Dentre estes ácidos, o ácido clorídrico diluído é frequentemente escolhido. A desmineralização é realizada com facilidade, envolvendo a quebra do carbonato de cálcio em sais de cálcio que são solúveis em água com a liberação de dióxido de carbono, conforme ilustrado na Equação 1.
2HCl + CaCO3 → CaCl2 + H2O + CO2 Eq. 1
Os demais minerais presentes reagem de maneira similar, originando sais que são solúveis na presença de ácido, que podem ser separados por meio de filtração da fase sólida da quitina, seguida de lavagem com água desionizada. Os procedimentos de desmineralização são frequentemente baseados na experiência e variam de acordo com o nível de minerais na matériaprima, o período de extração, a temperatura, o tamanho das partículas, a concentração do ácido e a proporção soluto/solvente. A remoção completa depende da quantidade de ácido, dado que duas moléculas de ácido clorídrico são necessárias para transformar uma molécula de carbonato de cálcio em cloreto de cálcio. Para que a reação seja completa, a quantidade de ácido deve ser igual ou maior que a quantidade estequiométrica dos minerais (JOHNSON; PENISTON, 1982; SHAHIDI; SYNOWIECKI, 1991). Devido à dificuldade de remover todos os minerais pela heterogeneidade do sólido, utiliza-se um volume maior ou uma solução de ácido mais concentrada. O processo de desmineralização pode ser acompanhado por titulação ácida, com a mudança do pH para neutralidade indicando a conclusão do uso de ácido, enquanto a persistência de acidez sinaliza a continuidade da reação (TOLAIMATE et al., 2003).
A desmineralização com HCl pode ser geralmente alcançada em 2 a 3 horas sob agitação (JOHNSON; PENISTON, 1982). No entanto, o tempo de reação pode variar de 15 minutos a 48 horas dependendo do método de preparação (PERCOT; VITON; DOMARD, 2003). Um tempo de desmineralização mais longo, de até vários dias, resulta numa ligeira redução do teor de cinzas, mas também pode causar a degradação do polímero (OKAFOR, 1965; SHIMAHARA; OHKOUCHI; IKEDA, 1992).
Elevadas temperaturas potencializam o processo de remoção de minerais, pois facilitam a infiltração do solvente na estrutura da quitina. Portanto, algumas reações para extrair os minerais são efetuadas em ambientes de maior temperatura (TRUONG et al., 2007). Ademais, a incursão do solvente na estrutura da quitina é grandemente influenciada pela dimensão das partículas. O sucesso na extração dos minerais está vinculado à superfície de contato entre a estrutura de quitina e o solvente. No entanto, sob temperaturas altas, períodos de processamento extensos e concentrações elevadas de ácido afetam as características físico-químicas finais da quitina obtida (MARQUIS-DUVAL, 2008).
2.5 DESPIGMENTAÇÃO
Procedimentos ácidos e alcalinos, isoladamente, tendem a produzir quitina pigmentada. Para obter quitina incolor, os pigmentos podem ser retirados empregando diversos agentes.
Estes incluem etanol e éter (HACKMAN, 1954), preparado aquoso de hipoclorito de sódio com 0,5% de cloro ativo (BLUMBERG et al., 1951), acetona pura (KAMASASTRI; PRABHU, 1961; MIMA et al., 1983), triclorometano (ANDERSON et al., 1978), peróxido de hidrogênio (BRINE; AUSTIN, 1981; MOORJANI et al., 1975), acetato de etila (BREZSKI, 1982), ou uma sequência de tratamento com acetona seguida de um composto aquoso de hipoclorito de sódio (NO et al., 1989). Como ilustração, HACKMAN (1954) obteve uma quitina de tom creme de lagosta através da lavagem com etanol e éter. NO et al. (1989) conseguiram uma quitina branca de lagosta, inicialmente extraída com acetona e depois branqueada com um preparado aquoso de hipoclorito de sódio a 0,315%. A cor da quitina resultante pode variar de branco a rosa.
2.6 PARÂMETROS DE EXTRAÇÃO
No estudo realizado por TOLAIMATE et al., (2003), foi sugerida uma abordagem inovadora que utiliza banhos sequenciais com baixas concentrações de ácido clorídrico (0,55 M) e hidróxido de sódio (0,3 M). A quantidade total de banhos varia dependendo da espécie animal de onde a matéria-prima é derivada. Este método provou ser eficiente na diminuição de proteínas e minerais, bem como na manutenção da forma original da quitina em 12 espécies distintas de crustáceos e celacantos, como ilustrado na Tabela 1. Os graus de acetilação das quitinas produzidas foram determinados utilizando a técnica de ressonância magnética nuclear de carbono-13 (13C-RMN), variando entre 96% e 100% para todas as espécies. Por exemplo, para as carapaças do camarão, a quitina extraída apresentou 100% de acetilação. Até o presente momento, esse alto grau de acetilação não havia sido relatado na literatura (YOUNES; RINAUDO, 2015).
Tabela 1- Comparação da produção de quitina de diferentes fontes.
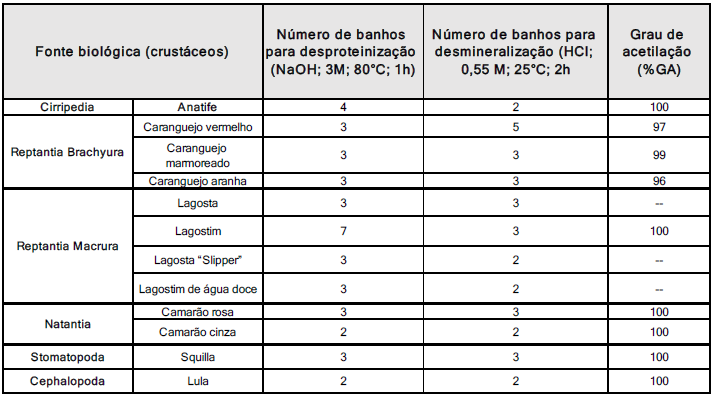
Adaptado de TOLAIMATE et al., 2003.
2.7 ESTRUTURAS POLIMÓRFICAS
A quitina, um polissacarídeo (aminoglicano) composto por unidades de N-acetil-Dglicosamina unidas em β(1-4) (Figura 4), é encontrada nos revestimentos externos, nas membranas de proteção de muitos invertebrados e nas estruturas celulares de algas verdes, além de alguns fungos e leveduras (FRANCESKO et al., 2010).
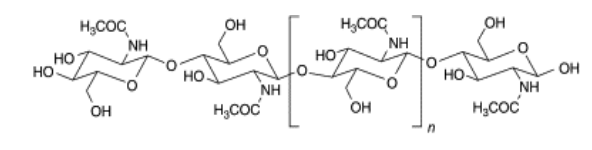
Figura 4- Cadeia molecular da quitina.
Adaptado de FRANCESKO et al., 2010.
A quitina, um polissacarídeo (aminoglicano) estruturalmente e funcionalmente semelhante à celulose, ocorre naturalmente em três formas distintas: alfa (α), beta (β) e gama (γ), cada uma com diferentes orientações de microfibrilas de quitina (RUDALL, 1963). A forma alfa, composta por cadeias antiparalelas, é a mais comum na natureza e pode ser encontrada em exoesqueletos de crustáceos, conchas de moluscos e cutículas de insetos. Também está presente nas paredes celulares dos fungos (GARDNER; BLACKWELL, 1975; KAMEDA et al., 2005). A forma beta é formada por cadeias paralelas e é menos comum. Pode ser encontrada nos gládios (conchas) das lulas e nas espinhas extracelulares das diatomáceas (microorganismos unicelulares que habitam ambientes úmidos e aquáticos) (HERTH; BARTHLOTT, 1979), assim como nos tubos dos pogonóforos (animais marinhos vermiformes e tubícolas) (BLACKWELL, 1969). A forma gama é composta tanto por cadeias paralelas quanto antiparalelas e está presente nos casulos dos insetos (RUDALL; KENCHINGTON, 1973). Na natureza, a quitina raramente é encontrada em sua forma pura; geralmente está associada às proteínas nas matrizes (KNORR, 1982). As três estruturas polimórficas da quitina são mostradas na Figura 5.
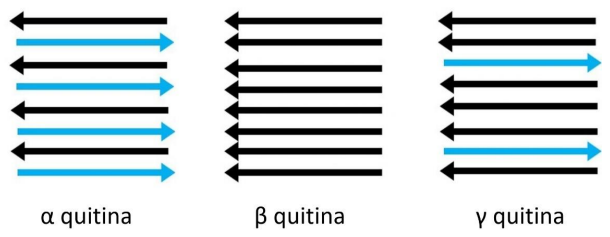
Figura 5- Estrutura de diferentes conformações de quitina (alfa, beta e gama).
Adaptado de PAKIZEH; MORADI; GHASSEMI, 2021.
As três formas cristalinas alomórficas, denominadas alfa, beta e gama, identificadas através de estudos de difração de raios X (ROBERTS, 1992; SUKSANGPANYA et al., 2017), exibem características e propriedades variadas que influenciam a função da quitina em tecidos e funções fisiológicas dos seres vivos que contêm esse material em sua estrutura. Por exemplo, a estrutura rígida dos camarões mantis (Stomatopoda) é definida pela presença de fibras de quitina organizadas em uma estrutura espiral torcida da quitina, seguida por mineralização e ligação com proteínas (SUKSANGPANYA et al., 2017). Esta configuração específica proporciona ao camarão mantis propriedades mecânicas notáveis, permitindo flexibilidade, tenacidade e resistência ao impacto, além de exibir uma adaptação evolutiva significativa para defesa e predação (ZHANG et al., 2016).
A α-quitina, principalmente localizada nas carapaças de crustáceos, como camarões, caranguejos e lagostas, além de besouros e nas paredes celulares de fungos (BECKHAM; CROWLEY, 2011), é uma das três formas cristalinas alomórficas identificadas através de estudos de difração de raios X (ROBERTS, 1992; SUKSANGPANYA et al., 2017). Esta variante da quitina é a mais estável, com cadeias de polímeros organizadas de forma antiparalela, resultando em fortes ligações de hidrogênio, conforme ilustrado na Figura 6 (SIKORSKI; HORI; WADA, 2009). A estrutura da α-quitina tem um grupo espacial ortorrômbico P212121 com uma célula unitária de dimensões a = 4,74 Å, b = 18,86 Å e c (eixo da fibra) = 10,32 Å (MINKE; BLACKWELL, 1978).
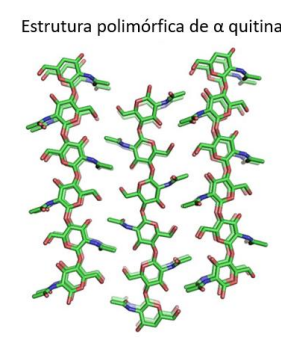
Figura 6- Estrutura polimórfica da α-quitina.
Adaptado de HOU; AYDEMIR; DUMANLI, 2021.
A β-quitina é predominantemente obtida de diatomáceas marinhas (CHIRIBOGA; LEDUFF; RORRER, 2020), moluscos (HAJJI et al., 2014) e da matriz peritrófica de insetos (LIU et al., 2019). As cadeias de polímeros desta forma estão dispostas de maneira paralela, como mostrado na Figura 7. As ligações de hidrogênio (uma por célula unitária) entre as cadeias cristalizam-se no grupo espacial monoclínico P21. A célula unitária monoclínica dessa cadeia tem dimensões a = 4,85 Å, b = 9,26 Å e c (eixo da fibra) = 10,38 Å, com um ângulo γ de 97,5° (NISHIYAMA; NOISHIKI; WADA, M., 2011).
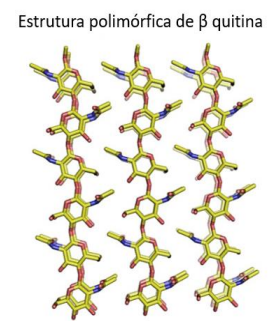
Figura 7- Estrutura polimórfica da β-quitina.
Adaptado de HOU; AYDEMIR; DUMANLI, 2021.
A configuração das cadeias de β-quitina é semelhante à polaridade da cadeia paralela encontrada nas estruturas polimórficas de celulose. Um aspecto notável é que, enquanto a maioria dos cristais de polissacarídeo naturais exibe uma estrutura paralela, o polimorfo estável e comum da quitina, a α-quitina, apresenta uma configuração de cadeia antiparalela e polaridade, sendo que o entendimento dos processos de polimerização ainda é limitado (HOU; AYDEMIR; DUMANLI, 2021). O alinhamento da cadeia polimérica da α-quitina é resultado da presença de uma estrutura agregada formada por ligações de hidrogênio. Por outro lado, a β-quitina possui uma estrutura mais flexível e quimicamente “aberta”, onde os grupos funcionais da quitina estão orientados de maneira a permitir uma maior atividade química.
Em relação à terceira forma polimórfica da quitina, a γ-quitina, a disposição das cadeias poliméricas e da estrutura cristalina é um pouco mais complexa, consistindo em três cadeias de quitina com cadeias de polímeros paralelas e antiparalelas alternadas (DAS; ROY; SEN, 2016). Comparada às estruturas α e β, a ocorrência da estrutura γ não é tão comum, sendo relatada em alguns estudos apenas na presença de fibras de casulo de escaravelho (MOUSSIAN, 2019). Esta estrutura também pertence ao grupo espacial monoclínico P21, com dimensões de célula unitária a = 4,7 Å, b = 10,3 Å e c (eixo das fibras) = 28,4 Å e β = 90° (ROBERTS, 1992).
Estudos indicam que, embora a γ-quitina seja distinta das demais, ela possui uma estrutura similar à α-quitina. A difração de raios X (DRX) é frequentemente utilizada para distinguir essas estruturas, e pode ser complementada por outras técnicas como microscopia eletrônica de varredura (MEV), calorimetria diferencial de varredura (DSC), espectroscopia de infravermelho (FTIR), análise termogravimétrica (TGA), espectroscopia Raman. As análises de espectroscopia de infravermelho e espectroscopia Raman auxiliam na confirmação da semelhança estrutural entre γ-quitina e α-quitina. Além disso, a microscopia eletrônica de varredura revela a existência de nanofibras nas estruturas de alfa-quitina e beta-quitina, enquanto a gama-quitina é distinguida por ter microfibras em sua superfície (KAYA et al., 2017).
CAMPANA-FILHO et al., (2007) destacaram que a α-quitina possui uma cristalinidade superior à β-quitina, conforme evidenciado pela análise de difração de raios X e espectroscopia de infravermelho. Essas técnicas também confirmam a variação estrutural entre elas, apesar das semelhanças existentes. A maioria dos solventes não consegue dissolver as estruturas da αquitina e β-quitina, exibindo uma solubilidade restrita e lenta em substâncias limitadas, como ácido fórmico anidro e ácidos fortes concentrados. Adicionalmente, a dissolução em ambientes de alta acidez pode resultar na despolimerização da estrutura. Mesmo após um período extenso de tentativas de solubilização, a β-quitina se dissolve em um intervalo mais curto do que a αquitina e mostra uma habilidade aumentada para absorver umidade – uma propriedade ligada à sua menor cristalinidade quando comparada à α-quitina.
3. QUITOSANA
Nos últimos anos, a quitosana tem sido altamente notada por suas características e propriedades, que englobam biocompatibilidade, biodegradabilidade, atividade antimicrobiana e a habilidade de auxiliar em processos de cicatrização na engenharia de tecidos. O interesse na quitosana é ampliado pela sua capacidade de criar filmes e pela possibilidade de ser alterada tanto física quanto quimicamente (HUA et al., 2021; KUMARIHAMI et al., 2021; ZHANG et al., 2021).
A quitosana é produzida através do processo de desacetilação da quitina, o segundo polímero natural mais prevalente na natureza, superado apenas pela celulose. A quitosana comercial tem geralmente uma massa molar em torno de 100g/mol (AGUILA-ALMANZA et al., 2021; MOURA et al., 2011). As estruturas da quitina e da quitosana são formadas por unidades de 2-acetamido-2-desoxi-D-glicopiranose (GlcNAc) e 2-amino-2-desoxi-D-glicopiranose (GlcN) ligadas por ligações glicosídicas β(1→4). Contudo, os polímeros exibem variações na proporção relativa dessas unidades, afetando assim a solubilidade dos materiais. Por exemplo, a quitina é insolúvel na maioria dos solventes devido à predominância das unidades de GlcNAc, enquanto a quitosana, que possui uma maior proporção de unidades GlcN, é solúvel em meio ácido (GUINESI; CAVALHEIRO, 2006; PAVONI; LUCHESE; TESSARO, 2019). Durante o processo de desacetilação ocorre a transformação dos grupos acetamida em grupos amino como mostrado na Figura 8 (YOUNES; RINAUDO, 2015).
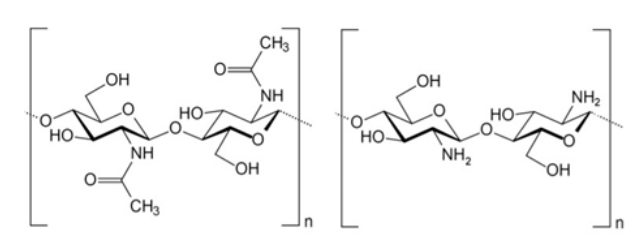
Figura 8- Representação das moléculas da quitina e quitosana.
Adaptado de YOUNES; RINAUDO, 2015.
A presença do grupo livre NH2 na porção GlcN da quitosana aumenta sua reatividade química e bioquímica em comparação à quitina. O incremento na reatividade da quitosana devese ao caráter catiônico do grupo amina livre. Esse aspecto contribui para propriedades como biocompatibilidade, baixa toxicidade, biodegradabilidade e atividade antimicrobiana, despertando interesse crescente na utilização da quitosana em diversas aplicações nas áreas de agricultura, alimentos, biomedicina, cosmética, entre outras (MORIN-CRINI et al., 2019). Para avaliar a capacidade da quitosana em uma aplicação específica, é crucial a identificação de suas características físicas (solubilidade, densidade, dimensão das partículas e viscosidade), químicas (pH, nível de desacetilação, habilidade de retenção de água, peso molecular) e biológicas (biocompatibilidade, citotoxicidade, pirogenicidade) (RIANDE, 2000).
Para a obtenção de quitosana do exoesqueleto de crustáceos, a etapa inicial consiste na extração da quitina, envolvendo processos químicos de desmineralização (extração de minerais), desproteinização (eliminação de proteínas) e despigmentação (retirada de pigmentos e atenuação do cheiro), conforme mencionado anteriormente. A transformação da quitina em quitosana ocorre através de um procedimento adicional de desacetilação, utilizando soluções alcalinas para transformar, em diferentes níveis, os grupos acetamido (NHCOCH3) em grupos amino (NH2). À medida que o grau de desacetilação (GD) da quitina aproxima-se de 50%, dependendo da origem biológica do polímero, ela torna-se solúvel em soluções aquosas acidificadas e passa a ser denominada quitosana (QAVAMI et al., 2017; BRASSELET et al., 2019). As condições de processo, como tempo, temperatura e concentração de reagentes, assim como as variações nas estruturas polimórficas da quitina (α, β e γ), podem resultar em quitosanas com propriedades distintas, como cristalinidade, pureza, massa molar e grau de desacetilação. Tais variações justificam a complexidade do processamento e as diferenças nas propriedades químicas da quitosana, mesmo quando produzida a partir da mesma fonte biológica (KOU; PETERS; MUCALO, 2021).
Em comparação com outros biopolímeros, a quitosana é notável por seu caráter catiônico, em contraste com a maioria que apresenta caráter neutro (como amido, dextrana e celulosee) ou aniônico (carragenina, xantana e alginato). Tal particularidade é responsável pelas propriedades exclusivas da quitosana, incluindo métodos específicos para entrelaçar suas cadeias (SANTOS et al., 2003). A solubilização da quitosana normalmente se dá com ácidos orgânicos, como fórmico e acético, embora também possa ser efetuada em ácidos inorgânicos diluídos, tais como nítrico, clorídrico, perclórico e fosfórico. A hidratação da quitosana em meio aquoso é otimizada após sua solução em ambiente ácido, uma vez que os grupos amino livres se protonam, agregando versatilidade química ao composto e possibilitando alterações, como a geração de sais de quitosana, N-alquilação, N-carboxilação, N-sulfonação e bases de Schiff com cetonas e aldeídos, conforme demonstrado na Figura 9 (FILHO; SIGNINI; CARDOSO, 2007).
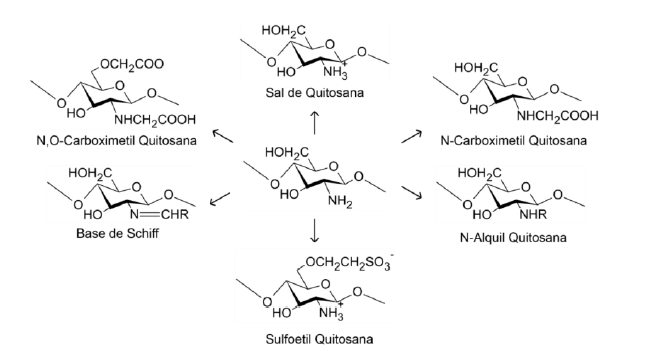
Figura 9- Possíveis modificações da quitosana.
Adaptado de FILHO; SIGNINI; CARDOSO, 2007.
As modificações químicas em quitosana conduzem à obtenção de características e propriedades específicas. Os derivados carboximetilquitosana (N-, O- e O,Ncarboximetilquitosana), por exemplo, são solúveis em amplo espectro de pH, tornando-os adequados para aplicações médicas e farmacêuticas (ABREU; CAMPANA-FILHO, 2005). Em contrapartida, os sais quaternários de amônio em quitosana adicionam cargas positivas permanentes nas cadeias poliméricas devido à quaternização dos átomos de nitrogênio dos grupos amino. A TMQ (N,N,N-trimetilquitosana) é solúvel numa extensa faixa de pH, exibindo potencial para facilitar a absorção intestinal de fármacos (CURTI; DE BRITTO; CAMPANAFILHO, 2003; SENRA, 2015). Embora as modificações químicas em quitosana ocorram majoritariamente nos grupos amino, as hidroxilas presentes também são suscetíveis a alterações estruturais (GONÇALVES; ARAÚJO, 2011). Tais mudanças estruturais influenciam aspectos como solubilidade, cristalinidade, grau de desacetilação e massa molar, fatores que afetam a capacidade do polímero de formar filmes (PAVONI; LUCHESE; TESSARO, 2019).
3.1 OBTENÇÃO DA QUITOSANA A PARTIR DE DESACETILAÇÃO QUÍMICA E BIOLÓGICA
A quitina pode ser processada de forma homogênea ou heterogênea. No método homogêneo, a quitina é dissolvida em álcali concentrado a 25 °C durante 3 horas e, após isso, dispersa em gelo a cerca de 0 °C (ZAMANI; TAHERZADEH, 2010). No processo heterogêneo, a quitina é tratada com uma solução alcalina quente de alta concentração e, em seguida, lavada com água destilada até que o pH seja neutralizado. Existe dificuldade para obter quitosana com um alto grau de desacetilação. A adição de tiofenol como catalisador durante este processo ajuda a minimizar a degradação do polímero, pois retém o oxigênio e melhora o processo efetivo de desacetilação. Um processo eficaz de desacetilação da quitina permite a preparação de quitosana se a concentração alcalina for quatro vezes maior que o total de grupos amino no polissacarídeo, a uma temperatura de cerca de 100 °C por 1 hora. Contudo, para evitar a degradação do polímero, é preferível usar soluções alcalinas de baixa concentração e um curto tempo de contato com o material (THOMAS; THOMAS, 2013).
A desacetilação química apresenta desvantagens relacionadas ao consumo de energia e à poluição ambiental, caso não sejam tomados os devidos cuidados e otimizados os processos (RAVAL; RAVAL; MOERSCHBACHER, 2013). Como alternativa ao método químico, desenvolveu-se o método enzimático para minimizar esses inconvenientes. A enzima para desacetilação da quitina atua como catalisador, hidrolisando as ligações de N-acetamida (PAGNONCELLI et al., 2010). Esta enzima pode ser extraída de fungos como Mucor rouxii, Absidia coerulea, Aspergillus nidulans e duas cepas de Colletotrichum lindemuthianum. É termicamente estável e tem afinidade com as ligações poliméricas β(1-4) ligadas a N-acetil-Dglucosamina (SINHA; CHAND; TRIPATHI, 2014).
3.2 PROPRIEDADES FÍSICO-QUÍMICAS
A quitina é um composto incolor, que pode apresentar formas cristalinas ou amorfas, e não se dissolve em água, nem em solventes orgânicos, ácidos diluídos ou soluções alcalinas. Ela só se solubiliza em ácidos minerais concentrados, mas isso provoca a degradação do polímero (MATHUR; NARANG, 1990). A quitosana tem a mesma insolubilidade em água que a quitina, mas pode ser solubilizada por vários ácidos, tanto orgânicos quanto inorgânicos (ácido acético, fórmico, clorídrico, nítrico etc.). A forma e a composição da quitina e quitosana dependem da origem biológica e do método usado na sua obtenção (BRINE; AUSTIN, 1981). Estudos indicam que os métodos e as características desses produtos são variados. As propriedades físico-químicas da quitina e quitosana são influenciadas pelo peso molecular (Mw) e pelo grau de desacetilação (%GD), que por sua vez são definidos pelas condições do processo ou método de extração empregado (BRINE; AUSTIN, 1981; BOUGH et al., 1978). Portanto, as características físico-químicas destes materiais estão relacionadas às suas funcionalidades. O peso molecular e o grau de desacetilação são determinados pelas condições processuais ou pelos métodos de extração utilizados (CHO; NO; MEYERS, 1998).
3.3 GRAU DE DESACETILAÇÃO
O grau de desacetilação (GD) é a razão molar de glucosamina (GlcN) nos copolímeros de quitosana em comparação com N-acetilglicosamina (GlcNAc) (SHIGEMASA et al., 1996), como mostra a Figura 10.
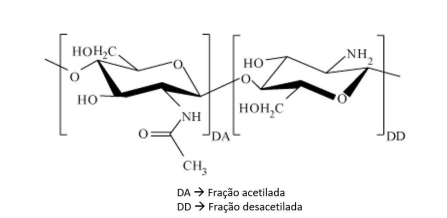
Figura 10- Representação das frações acetiladas e desacetiladas da molécula da quitosana.
Adaptado de ZHANG et al., 2016.
O grau de desacetilação (%GD) é essencial para avaliar as aplicações da quitosana em áreas como medicina, nutrição, purificação de água e biotecnologia (KUMIRSKA et al., 2010). Esse parâmetro está relacionado às características, atividades biológicas e estruturais específicas da quitosana. É importante saber que a quitosana é a forma desacetilada da quitina, cujo precursor é predominantemente acetilado. A análise do %GD é fundamental para determinar as composições químicas, propriedades físicas e interações químicas da quitosana. Isso é essencial para estabelecer uma base para prever suas funções e aplicações potenciais (MUANPRASAT; CHATSUDTHIPONG, 2017). Assim, um processo confiável para medir os valores de GD é indispensável para avançar nas aplicações práticas deste material (ZHANG et al., 2014).
Várias metodologias foram desenvolvidas e empregadas para identificar o GD da quitosana, de acordo com os estudos de SHIGEMASA et al., (1996), que investigou o efeito de diversos níveis de desacetilação nas taxas de absorção usando o método de espectroscopia infravermelha (FTIR) para analisar esse parâmetro em amostras de quitina; KUMIRSKA et al., (2010) examinou a eficiência dos métodos espectroscópicos (DRX, FTIR, UV-VIS, espectroscopia de massas, RMN) para a avaliação estrutural e determinação do %GD da quitina e quitosana; ZAJAC et al., (2015) quantificou a fração dos grupos N-acetilados empregando a espectroscopia Raman. Cada técnica apresenta diferentes graus de precisão e confiabilidade.
3.4 MASSA MOLECULAR
A quitosana e seus derivados têm diversas aplicações, porém, a eficácia e as propriedades requeridas desses materiais são determinadas pelo seu processo de preparação. O grau de desacetilação, a cristalinidade e o peso molecular (HWANG et al., 2002) são fatores diretamente afetados pelas condições do processo de desacetilação, que envolvem aspectos como temperatura, concentrações dos reagentes, ordem das etapas e condições atmosféricas (TOLAIMATE et al., 2003). A quitosana pode ser obtida por processos químicos ou enzimáticos (KURITA, 2006), mas o método químico apresenta problemas como baixa eficiência na produção e dificuldades no controle dos parâmetros Mw e %GD (CHO; NO; MEYERS, 1998).
O processo enzimático é uma alternativa para sintetizar a quitosana, oferecendo maior facilidade na obtenção dos parâmetros desejados (ILYINA et al., 2000). Neste processo, são utilizadas bactérias produtoras de ácido lático para a desmineralização de cascas de crustáceos. O ácido lático reage com o carbonato de cálcio, facilitando a remoção ao precipitá-lo. A desproteinização ocorre com o uso de enzimas proteases de bactérias como Serratia marcescens FS-3, Bacillus subtilis., Serratia sp., Bacillus sp e Pseudomonas aeruginosa K-187 , pois são bactérias que produzem enzimas deacetilases, promovendo a desacetilação da quitina para obtenção de quitosana (HAMED; ÖZOGUL; REGENSTEIN, 2016). Uma desacetilação eficaz pode ser alcançada através da lavagem intermitente do produto intermediário com água durante o tratamento alcalino (MIMA et al., 1983). O peso molecular médio da quitosana obtida por este método é de aproximadamente 500 kDa, com um grau de desacetilação elevado, próximo de 100%. O GD aumenta rapidamente durante a primeira hora de tratamento alcalino, alcançando cerca de 68% (com 50% m/V de NaOH, a 100°C), e após esse período, o aumento do GD se torna mais lento (BOUGH, et al., 1978).
Existem diversos métodos para estimar o peso molecular, abrangendo técnicas de espalhamento de luz, cromatografia de permeação em gel (GPC) e viscosimetria capilar. A viscosimetria capilar é o método mais simples e eficiente para avaliar o Mw da quitosana. Durante o ensaio, um viscosímetro capilar do tipo Ubbelohde é utilizado para medir o tempo de fluxo das soluções que passam pelo capilar a 25°C. São usadas várias formulações da quitosana com diferentes viscosidades, contendo concentrações do polímero variando entre 0,00125% e 0,15%, em diferentes composições solventes; por exemplo, foi relatado o uso de uma mistura de NaCl 0,1 M e ácido acético 0,2M. O viscosímetro é preenchido com a amostra e mantido em um banho termostático a 25°C. Os tempos de fluxo da amostra e do solvente são registrados para calcular a viscosidade relativa. A equação proposta por Mark-Houwink-Sakurada (Equação 2), mostrada abaixo, estabelece a relação entre a viscosidade intrínseca (η) e o Mw (HWANG et al., 2002).
[ η ] = K ∗ [Mw]a = 3.04 x 10−5 ∗ [Mw]1.26 Eq. 2
Onde K e α são constantes definidas pelo sistema soluto-solvente (α = 0,83 e K = 1,4 x 10-4 em sistema de solvente composto por 0,25 M de ácido acético e 0,25 M de acetato de sódio) (HWANG et al., 2002).
Com base no Mw, a quitosana é classificada em três tipos diferentes: quitosana de baixo peso molecular (Mw < 50 kDa), quitosana de médio peso molecular (Mw = 50 a 250 kDa) e quitosana de alto peso molecular (Mw > 250 kDa). Vários autores afirmam que a quitosana de baixo peso molecular apresenta características excepcionais, como propriedades antibacterianas e antifúngicas, efeito no metabolismo lipídico e dissacaridase intestinal (SONG et al., 2011), além de propriedades mucoadesivas (LUO et al., 2008). Além disso, o Mw também influencia significativamente as características reológicas do biopolímero, contribuindo diretamente para a produção de biomateriais à base de quitosana (SOUZA; DOTTO, 2017). A quitosana de baixo peso molecular é usada para criar um acabamento resistente, sendo posteriormente aplicada no tratamento antigordurante de tecidos de algodão. Por outro lado, a quitosana de alto peso molecular é empregada na fabricação de filmes com sais quaternários, exibindo características como solubilidade em água e neutralização dos radicais livres. Esta variação da quitosana também é utilizada na mistura dos polímeros e na separação das fases (SOUZA; DOTTO, 2017).
3.5 VISCOSIDADE
A quitosana apresenta propriedades únicas, com sua natureza policatiônica evidente quando dissolvida em solução ácida (em valores de pKa = 6,0). A quitosana pode ser dissolvida em solução ácida, gerando um líquido viscoso. Essa viscosidade da solução está relacionada com o Mw, com o %GD, a concentração de polímero, o pH e a temperatura. A viscosidade da solução de quitosana, a nível molecular, é uma medida do volume das moléculas do polímero, que, por sua vez, é governada pelo tamanho molecular ou comprimento da cadeia. A viscosidade e as propriedades de fluxo das soluções concentradas de quitosana com diferentes graus de desacetilação são distintas. As viscosidades e as propriedades de fluxo não newtonianas das soluções aumentam com o grau de desacetilação (GD) crescente da quitosana (KUMARI; KISHOR, 2020).
A quitosana apresenta caracteríticas que dependem da sua polidispersão e massa molar. Se a massa molar for conhecida e houver uma boa compreensão da conformação do polímero no meio solvente, as propriedades reológicas e mecânicas podem ser estimadas (KASAAI, 2007). Em soluções diluídas, as interações entre o polímero e o solvente podem fornecer informações sobre o volume hidrodinâmico da cadeia no solvente e as dimensões da macromolécula. A viscosimetria capilar é um método experimental que fornece essas informações. Há um grande interesse em desenvolver métodos experimentais e matemáticos que possam simultaneamente reduzir o tempo de determinação experimental desses parâmetros e fornecer resultados com pequena margem de erro (DELPECH et al., 2007; DELPECH; OLIVEIRA, 2005; DELPECH; COUTINHO; HABIBE, 2002; COUTINHO; DELPECH; GARCIA, 2002; MELLO et al., 2006).
3.6 SOLUBILIDADE
A quitosana é facilmente solúvel em meio ácido diluído abaixo de seu pKa (pH = 6,5). Já a quitina não apresenta solubilidade na maior parte dos ácidos diluídos e solventes orgânicos. Os grupos amino da quitosana aumentam a ionização em pH ácido, protonando o grupo amino (formando o grupamento NH3+), o que aumenta a solubilidade do polissacarídeo, enquanto que em pH mais elevado (superior a 6,0), o polímero precipita. A capacidade dos meios ácidos de protonar a quitosana influencia a ionização e a solubilidade dos polieletrólitos. A quitosana apresenta solubilidade em meios ácidos diluídos, como ácido acético, ácido fórmico (HUNT; HUCKERBY, 1987), ácido L-glutâmico, ácido láctico, ácido succínico, entre outros (ROMANAZZI et al., 2009).
A quitosana pode ser solubilizada em soluções ácidas diluídas desde que apresente um grau de desacetilação em torno de 50% ou mais, devido à presença de unidades de N-amino-Dglucosamina (CHO et al., 2000). Outros parâmetros, como a temperatura, o tempo de desacetilação e os tratamentos prévios aplicados durante o isolamento da quitina, também afetam diretamente a solubilidade da quitosana. Por conseguinte, a fração de unidades de Namino-D-glucosamina tem uma grande influência sobre a solubilidade e as propriedades da solução (SANNAN et al., 1976).
4. APLICAÇÕES DA QUITINA E QUITOSANA
A quitosana possui grupos funcionais, como hidroxilas e grupos amino, que podem ser modificados por reações químicas controladas para alterar suas propriedades físicas e de solubilidade. Devido às suas propriedades únicas, abre-se um amplo horizonte de possibilidades de aplicações, como em biomedicina, agricultura (bioestimulantes, recobrimentos para ampliação do shelf-life de frutas, legumes e verduras, entre outros), embalagem de alimentos, têxteis, bioplásticos, nanocompósitos, entre outras (SANFORD, 1989).
4.1 APLICAÇÕES BIOMÉDICAS
A maior parte dos tecidos vivos é carregada negativamente, enquanto a quitosana é carregada positivamente, por conta da predominância de grupos catiônicos (NH2). Isso faz com que este biopolímero seja atraído por tecidos, pele, osso e cabelo. A superfície externa da maioria dos micróbios é também carregada negativamente (ANTONINO et al., 2017). Portanto, a capacidade da quitosana de interagir eletrostaticamente é uma propriedade fundamental no desenvolvimento de aplicações biomédicas. Seu uso também depende das propriedades biológicas que se deseja explorar, sendo relevante a avaliação quanto à porosidade e ao tamanho. Esse polímero também apresenta potencial para o transporte de medicamentos, bem como para a imobilização enzimática e celular (RINAUDO; DOMARD, 1989). A Figura 11 apresenta as principais propriedades biológicas da quitina, quitosana e seus derivados.
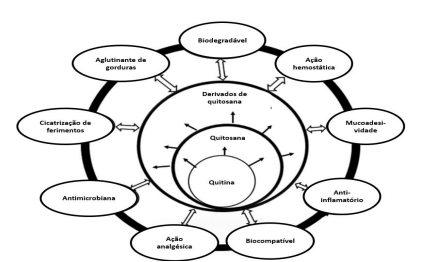
Figura 11- Propriedades biológicas da quitina, quitosana e derivados.
Adaptado de THOMAS; PIUS; GOPI, 2020.
A quitosana apresenta excepcional biocompatibilidade, capacidade de promover a regeneração de tecidos, possui ação antibacteriana, propriedades anti-inflamatórias e hemostáticas. Suas aplicações biomédicas estão relacionadas principalmente com a sua biocompatibilidade e biodegradabilidade. A biocompatibilidade está diretamente relacionada com a citotoxicidade do material. O método de cultura celular é a forma mais acessível e muito empregada para estudar tanto a toxicidade quanto as interações da quitosana com as células (ALI; AHMED, 2018; ZHAO et al., 2018).
Dentre as principais características da quitosana, o fato dela não induzir inflamação e não provocar reação do sistema imunológico do organismo possui grande relvância. As avaliações deste material têm demonstrado que a variação do seu peso molecular e grau de desacetilação possibilitam otimizar as propriedades biológicas da quitosana (HUANG; KHOR; LIM, 2004; CHIEN; YEN; MAU, 2016; AIPING et al., 2006; YAN et al., 2015).
Normalmente, devido à natureza catiônica do polímero, as soluções de quitosana têm propriedades bactericidas e bacteriológicas. A carga positiva na cadeia do polímero adere às superfícies bacterianas, induzindo alterações na permeabilidade da parede da membrana que impedem o crescimento microbiano (GOY; DE BRITTO; ASSIS, 2009).
Um baixo grau de desacetilação e baixo pH da quitosana promovem melhor atividade antibacteriana. A redução do peso molecular pode aumentar as atividades antibacterianas contra bactérias gram-negativas e diminuir as atividades contra bactérias gram-positivas. Além disso, a quitosana apresenta uma ampla gama de atividades antimicrobianas contra bactérias grampositivas e gram-negativas, com uma elevada taxa de mortalidade por meio da interação entre a quitosana e seus derivados e a parede celular bacteriana (YOUNES et al., 2014). Esta interação entre a quitosana e a célula bacteriana depende da hidrofilicidade da parede celular, o que pode explicar a menor toxicidade da quitosana para as células de mamíferos (KONG et al., 2010).
A capacidade da quitosana de aderir às superfícies é uma de suas principais características. Isso não só gera novas abordagens para fornecer moléculas benéficas através de vias mucosas, mas também ajuda a adsorver moléculas que não têm afinidade com o muco (BUGNICOURT; LADAVIÈRE, 2016). Através da permeação, a quitosana aumenta a aderência dos polímeros, o que é útil para acessar junções epiteliais que geralmente são de difícil acesso (YAMAMOTO et al., 2005).
Ainda, a quitosana está sendo amplamente usada em estudos relacionados com a sua capacidade de coagulação sanguínea. De fato, a quitosana pode acelerar a taxa de cicatrização de feridas através de interações entre plaquetas e grupos aminoácidos (OKAMOTO et al., 2003). As propriedades hemostáticas da quitosana têm sido largamente utilizadas na cicatrização de feridas. Como material para cicatrização de feridas, a quitosana apresenta várias características, tais como quimiotração, ativação de macrófagos e neutrófilos, aceleração de processos de reepitelização, propriedades analgésicas, resposta fisiológica do corpo para a prevenção e interrupção de sangramentos e hemorragias e propriedades antibacterianas intrínsecas (BUSILACCHI et al., 2013).
Recentemente trabalhos demonstram que a quitosana e materiais que podem ser obtidos a partir da mesma têm atividades antitumorais em modelos in vitro e in vivo. O efeito antitumoral dos derivados da quitosana é causado pelo aumento da secreção de interleucina (IL)-1 e 2, que resulta na maturação e infiltração de linfócitos T citolíticos (TOKORO et al., 1988).
É conhecido que os antioxidantes têm efeitos benéficos na saúde, pois evitam a destruição de lípidos de membranas, proteínas e DNA pelas moléculas reativas dos radicais de oxigênio do organismo (NGO; KIM, 2014). Estudos demonstraram que a quitosana e seus derivados conseguem realizar a neutralização dos radicais livres de oxigênio ativos in vitro. As moléculas de quitosana de baixo peso molecular apresentam várias vantagens sobre as de alto peso no processo de eliminação dos radicais livres (PARK; JE; KIM, 2003). Um estudo sugeriu que o mecanismo da atividade antioxidante da quitosana pode ser através da estabilização dos radicais livres por grupos amino e carboxilo na quitosana (YOUNES; RINAUDO, 2015).
A degradação da quitosana em organismos biológicos pode ser catalisada por bioenzimas para despolimerizar a molécula. Os produtos de degradação desta molécula são Nacetil glicose e glucosamina, que são não tóxicos para o corpo humano. Os produtos intermediários de degradação não se acumulam no corpo e não possuem imunogenicidade (WANG et al., 2011).
4.2 APLICAÇÕES NA AGRICULTURA
O controle e a gestão de doenças em plantas cultivadas sempre foram considerados temas de grande interesse devido aos enormes prejuízos financeiros que provocam. Durante muitos anos, o controle de agentes patogênicos foi realizado principalmente através da aplicação de pesticidas químicos, devido ao seu fácil uso, ao custo relativamente baixo e ao amplo espectro de ação. A aplicação de pesticidas na defesa das culturas tem sido amplamente utilizada desde os anos do pós-guerra e contribuiu para um grande crescimento do rendimento na agricultura, fomentando o desenvolvimento econômico, reduzindo a incidência de doenças endêmicas, protegendo e restaurando plantações, florestas e diversos produtos agrícolas (ECOBICHON, 2000). Na realidade, as doenças das plantas representam um problema crítico para o sucesso da produção. A produtividade agrícola tem se beneficiado da utilização de pesticidas tanto quantitativa quanto qualitativamente; por exemplo, quando os pesticidas são devidamente utilizados, contribuem para uma maior produção e melhores características de qualidade das culturas. No entanto, a sua utilização também provoca problemas e inconvenientes relacionados com dois aspectos principais: a saúde humana e o impacto ambiental. De fato, os produtos químicos fitofarmacêuticos, incluindo o cobre permitido na agricultura orgânica, são na sua maioria tóxicos, persistentes, bioacumulativos e extremamente prejudiciais não só para a saúde humana, mas também para muitos organismos vivos (AKTAR; SENGUPTA; CHOWDHURY, 2009). Os pesticidas podem contaminar as matrizes ambientais sobre aquíferos (HARIA; HODNETT; JOHNSON, 2003), causando danos diretos e permanentes ao ecossistema. Além disso, há a possibilidade real de seus resíduos entrarem na cadeia alimentar dos consumidores (BOOBIS et al., 2008). A utilização maciça dessas substâncias químicas favorece também o aparecimento de fenômenos de resistência nas principais pragas dessas culturas (HOLLINGWORTH; DONG, 2008) e o desaparecimento contemporâneo de muitos inimigos naturais das pragas, tais como abelhas, borboletas e demais insetos (VAN LENTEREN, 2003).
A aplicação de pesticidas e seus efeitos constituem um tema de grande preocupação. De acordo com as novas diretivas europeias a favor de uma agricultura sustentável, muitos produtos fitofarmacêuticos atualmente em uso serão substituídos por substâncias de menor impacto ambiental. Por essa razão, muitos estudos científicos e investigações têm se centrado no desenvolvimento de abordagens alternativas à utilização de pesticidas para a gestão de doenças das culturas. Essas experiências têm seguido diferentes caminhos, incluindo métodos físicos (SCHMITT et al., 2009) de gestão integrada de pragas e controle biológico (TINIVELLA et
al., 2009). Uma abordagem promissora consiste na utilização de compostos naturais, como extratos de plantas e seus princípios ativos (alcaloides, fenóis, monoterpenos, sesquiterpenos, isoprenoides), que têm sido estudados por suas várias propriedades antifúngicas, antibacterianas e antioxidantes (ISMAN, 2000; MARINELLI et al., 2012; RICCIONI; ORZALI, 2011), além de compostos derivados de animais, como a quitosana. Esta tem se mostrado muito interessante para o controle de doenças das plantas (EL HADRAMI et al., 2010), demonstrando possuir atividade antimicrobiana de amplo espectro contra vários organismos fitopatogênicos e induzir numerosas respostas biológicas nas plantas (MALERBA; CERANA, 2016).
Uma das propriedades mais estudadas da quitosana é sua elevada atividade antimicrobiana contra uma série de microrganismos, como bactérias, fungos e vírus. Uma substância antimicrobiana é definida como uma substância que elimina ou efetua a inibição do crescimento de microrganismos (ANDREWS, 2001).
Foi descrita uma atividade fungicida de largo espectro da quitosana, que inibe o crescimento fúngico in vitro de muitos fungos patogênicos, por exemplo, Botrytis cinerea, Alternaria alternata, Colletotrichum gloeosporoides e Rhizopus stolonifer. A inibição foi observada em diferentes fases do desenvolvimento patogênico, como crescimento micelial, esporulação, viabilidade dos esporos, germinação e na produção de fatores de virulência fúngica (BADAWY; RABEA, 2011). Além disso, a atividade antifúngica foi também demonstrada in vivo em muitos sistemas diferentes de plantas-patógenos, como na pera contra A. kikuchiana e Physalospora piricola (MENG et al., 2010), na videira e no morango contra B. cinerea (FELIZIANI; LANDI; ROMANAZZI, 2015; REGLINSKI et al., 2010) e na pitaia contra C. gloeosporoides (ZAHID et al., 2015). No arroz, a atividade antifúngica contra R. solani foi ainda demonstrada por observações ao microscópio eletrônico de transmissão e testes de patogenicidade (LIU et al., 2012).
A forma exata da atividade antimicrobiana direta da quitosana ainda é ambígua, e diferentes mecanismos foram propostos e descritos (BADAWY; RABEA, 2011; XING et al., 2015), mas nenhum deles é mutuamente exclusivo. O principal modo de ação proposto está relacionado com suas propriedades catiônicas (SHARP, 2013), hipótese apoiada pela falta de atividade antifúngica dos oligômeros de quitina não carregados (PARRA; RAMÍREZ, 2002). Ao contrário da quitosana, a forma polimérica da quitina é naturalmente não carregada e não apresenta atividade antimicrobiana substancial. Com base neste modelo, as cargas positivas nas moléculas de quitosana interagem com as superfícies patogênicas carregadas negativamente (interações eletrostáticas), levando à destruição da estrutura celular, causando uma extensa alteração da superfície celular e aumentando a permeabilidade da membrana (CHUNG et al., 2004; RABEA et al., 2003; LIU et al., 2004). Outro mecanismo proposto envolve a alteração da permeabilidade celular pela quitosana, que inclui sua deposição na superfície da célula patogênica, criando uma camada polimérica impermeável que impede a absorção de nutrientes na célula e, enquanto isso, altera a excreção de metabolitos na matriz extracelular (XING et al., 2015).
A produção vegetal é um dos elementos mais importantes da agricultura e da economia, que requer progresso contínuo. A introdução de várias tecnologias inovadoras contribuiu para o rápido aumento do desempenho agrícola, mas a busca por soluções ecológicas que aumentem a eficiência da produção vegetal tornou-se essencial atualmente (KATIYAR; HEMANTARANJAN; SINGH, 2015). As atividades pró-ecológicas nesta área são também reforçadas pelas últimas mudanças nas políticas agrícolas, como o Acordo Verde Europeu, que visa reduzir a utilização de produtos fitofarmacêuticos e promover a agricultura biológica (A EUROPEAN GREEN DEAL., 2021). Assim, o interesse na utilização de substâncias de origem natural como estimulantes do crescimento e desenvolvimento das plantas, os chamados bioestimulantes, tem aumentado nos últimos anos. O conceito de bioestimulantes foi proposto no final do século XX, mas ainda não foi claramente definido até à data. Além disso, não existem regulamentos legais adequados para a sistematização das preparações disponíveis ou registro de novos agentes. No entanto, o termo “bioestimulante vegetal” é usado para designar qualquer substância ou formulação que não seja um constituinte vegetal, fertilizante ou pesticida, mas que contenha compostos naturais (simples ou misturas) ou microrganismos. Destina-se a ser aplicado na planta inteira, numa parte da planta, ou na rizosfera (região onde o solo e as raízes das plantas entram em contato) para intensificar os processos fisiológicos naturais, aumentar a resistência das plantas ao estresse, melhorar a utilização de minerais, e melhorar o tamanho e qualidade dos rendimentos das culturas (DMYTRYK et al., 2014; MATYJASZCZYK, 2015; POSMYK; SZAFRAŃSKA, 2016).
A literatura destaca o potencial da quitosana na indústria de fertilizantes como ingrediente que atua na liberação controlada de nutrientes. O interesse neste polímero tem sido despertado principalmente pelo seu efeito benéfico no solo e nas plantas e por algumas características físico-químicas. Dadas à
as suas propriedades de formação de película, bem como sua elevada biocompatibilidade e biodegradabilidade, a quitosana pode ser empregada como material de revestimento regulador da taxa de liberação de minerais na solução do solo; além disso, pode ser utilizada para resolver o problema com a eliminação de resíduos de revestimentos produzidos a partir de polímeros não biodegradáveis. Na indústria agroquímica, as nanopartículas de quitosana são utilizadas tanto para otimizar a atividade e eficiência de vários tipos de formulações como para reduzir a sua toxicidade para o ambiente (LUBKOWSKI; GRZMIL, 2007; MALERBA; CERANA, 2016; GUMELAR et al., 2020). Um exemplo de tal aplicação foi mostrado em uma experiência realizada por ABDEL-AZIZ et al., 2016, na qual a aplicação foliar de um fertilizante à base de nanoquitosana-NPK contribuiu para um aumento do crescimento e rendimento do trigo em comparação com plantas tratadas com formas tradicionais de nitrogênio, fósforo e potássio.
Frutas e vegetais frescos contêm alta porcentagem de água e continuam a atividade metabólica após a colheita, resultando em maturação, aumento da sensibilidade a fungos causadores de decomposição e, consequentemente, perda e desperdício. Os revestimentos comestíveis, preparados a partir de fontes renováveis naturais, podem contribuir para a redução de resíduos, respeitando o ambiente e a saúde dos consumidores. A quitosana e outros materiais utilizados na obtenção de revestimentos comestíveis formam uma camada fina ao redor do produto fresco, atuando como agente protetor, prolongando a vida útil e tendo o potencial de controlar o processo de maturação e manter as propriedades nutricionais do produto revestido (ROMANAZZI; MOUMNI, 2022).
A quitosana é um material com grande potencial para desenvolvimento e obtenção de revestimentos comestíveis devido à sua biocompatibilidade, biodegradabilidade e bioatividade, sendo um material poderoso aplicável em medicina regenerativa, cosmética e agricultura. Quando aplicada em frutas e vegetais, a quitosana promove estímulos que favorecem o sistema de defesa do hospedeiro, proporcionando atividade antimicrobiana contra fungos causadores de decomposição e produzindo uma película semipermeável na superfície tratada. Contudo, é importante destacar que nesse tipo de aplicação é necessário combinar a quitosana com outros componentes a fim de obter um revestimento com melhor eficiência (ROMANAZZI; FELIZIANI; SIVAKUMAR, 2019). Os revestimentos comestíveis têm sido amplamente aplicados na conservação pós-colheita de frutas e legumes frescos. A literatura científica sobre revestimentos comestíveis utilizando quitosana tem aumentado nos últimos anos, explicado pela importância da quitosana na proteção das plantas como agente fungicida natural e estimulador da defesa das plantas, e pela sua utilização para prolongar o armazenamento de uma variedade de frutas e vegetais mundialmente. Este biopolímero pode formar uma película semipermeável em superfícies de frutas e vegetais, reduzindo a taxa respiratória ao ajustar a permeabilidade de O2 e a produção de CO2, e ao aumentar a atividade antioxidante (SHAH; HASHMI, 2020). A quitosana tem atividade antimicrobiana de amplo espectro e efeitos inibidores comprovados em diversos agentes patogênicos fúngicos pós-colheita (LANDI et al., 2021; RAJESTARY; LANDI; ROMANAZZI, 2021), demonstrando que pode atuar como um elicitor exógeno induzindo atividades de várias enzimas relacionadas à defesa na fruta da papaia. Nos últimos anos, numerosos estudos revelaram a eficácia da quitosana aplicada sozinha ou combinada com outros compostos naturais para manter as propriedades físicas de várias frutas e vegetais. A incorporação de diversos óleos essenciais em matrizes poliméricas atraiu grande atenção, pois este biopolímero reduz a volatilidade dos óleos essenciais e mascara o mau sabor que podem promover (DANILA et al., 2021; SÁNCHEZ ALDANA et al., 2021; ZHANG et al., 2022).
Os revestimentos podem alterar a composição da atmosfera ao redor do fruto, resultando na criação de uma barreira à troca de gases, como oxigênio, dióxido de carbono e etileno, envolvidos no processo respiratório, conforme demonstrado na Figura 12. Foram relatados diferentes revestimentos comestíveis para preservar o valor nutricional dos frutos de forma semelhante ou até melhor que a embalagem convencional (KARAGÖZ; DEMIRDÖVEN, 2019).
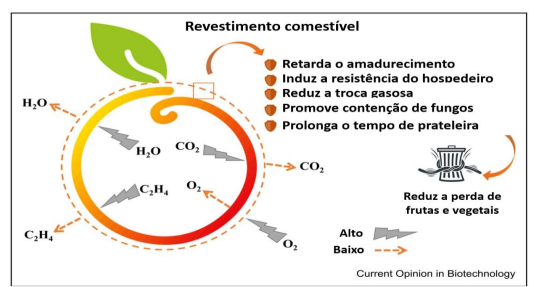
Figura 12- Principais propriedades dos revestimentos comestíveis aplicados em frutas e vegetais, afetando a permeabilidade ao etileno (C2H4), água (H2O), oxigénio (O2), e dióxido de carbono (CO2).
Adaptado de ROMANAZZI; MOUMNI, 2022.
5. CONCLUSÃO
A versatilidade da quitina e quitosana faz com que esses polímeros apresente uma ampla gama de aplicações práticas e potenciais em diversos campos. As técnicas avançadas e sustentáveis para a extração e obtenção desses materiais não apenas apresentam uma solução eficiente para o aproveitamento de resíduos da indústria de crustáceos, mas também abrem caminho para o desenvolvimento de produtos inovadores e ambientalmente responsáveis. A quitina e quitosana, com suas propriedades únicas como biodegradabilidade, biocompatibilidade e atividade antimicrobiana, destacam-se como materiais promissores, especialmente na área de biomateriais e na agricultura sustentável.
Embora existam desafios na purificação e padronização na obtenção desses materiais, as pesquisas atuais estão focadas em superar essas barreiras, garantindo a qualidade e eficácia desses polímeros para uso industrial e médico. Esta revisão destaca a necessidade contínua de pesquisa e desenvolvimento para otimizar ainda mais os processos de produção e expandir as aplicações da quitina e quitosana. Por fim, o potencial desses polímeros naturais na promoção de uma economia mais circular e sustentável é inegável, e sua exploração contínua trará benefícios significativos não apenas para a indústria e saúde, mas também para o meio ambiente.
6. REFERÊNCIAS
ABDEL-AZIZ, H. M. M.; HASANEEN, M. N. A.; OMER, A. M. Nano chitosan-NPK fertilizer enhances the growth and productivity of wheat plants grown in sandy soil. Spanish Journal of Agricultural Research 14, (2016).
ABREU, F.R., CAMPANA-FILHO, S. P. Preparation and characterization of carboxymethylchitosan. Polímeros, 15(2), 79–83, (2005).
A EUROPEAN GREEN DEAL. Available online: https://ec.europa.eu/info/strategy/priorities-2019-2024/european-green-deal (accessed on 7 December 2021).
ÁGUILA-ALMANZA, E.; LOW, S. S.; HERNÁNDEZ-COCOLETZI, H.; ATONALSANDOVAL, A.; RUBIO-ROSAS, E.; VIOLANTE-GONZÁLEZ, J.; SHOW, P. L. Facile and green approach in managing sand crab carapace biowaste for obtention of high deacetylation percentage chitosan. Journal of Environmental Chemical Engineering 9, (2021).
AIPING, Z.; TIAN, C.; LANHUA, Y.; HAO, W.; PING, L. Synthesis and characterization of N-succinyl-chitosan and its self-assembly of nanospheres. Carbohydrate Polymers 66, 274–279 (2006).
AKTAR, W.; SENGUPTA, D.; CHOWDHURY, A. Impact of pesticides use in agriculture: Their benefits and hazards. Interdisciplinary Toxicology, 2(1), 1–12, (2009).
ALI, A.; AHMED, S. A review on chitosan and its nanocomposites in drug delivery. International Journal of Biological Macromolecules. Elsevier B.V, (2018).
ANDERSON, C. G. et al. Antarctic Krill (Bcplrartsia srrperba) as a source of chitin and chitosan. (Ed.), p. 54. MIT Sea Grant Program, Cambridge, MA, (1978).
ANDREWS, J. M. Determination of minimum inhibitory concentrations. Journal of Antimicrobial Chemotherapy, 48(SUPPL. 1), 5–16, 2001.
ANTONINO, R. S. C. M. D. Q.; FOOK, B. R. P. L.; LIMA, V. A. D. O.; RACHED, R. Í. D. F.; LIMA, E. P. N.; LIMA, R. J. D. S.; FOOK, M. V. L. Preparation and characterization of chitosan obtained from shells of shrimp (Litopenaeus vannamei Boone). Marine Drugs 15, (2017).
AYE, K. N.; STEVENS, W. F. Improved chitin production by pretreatment of shrimp shells. Journal of Chemical Technology and Biotechnology, 79(4), 421–425, (2004).
BADAWY, M. E. I.; RABEA, E. I. A Biopolymer Chitosan and Its Derivatives as Promising Antimicrobial Agents against Plant Pathogens and Their Applications in Crop Protection. International Journal of Carbohydrate Chemistry, 2011, 1–29, (2011).
BECKHAM G. T.; CROWLEY M. F. Examination of the α-chitin structure and decrystallization thermodynamics at the nanoscale. Journal of Physical Chemistry B, 115(15), 4516–4522, (2011).
BLACKWELL, J. Structure of beta-chitin or parallel chain systems of poly-beta-(1-4)N-acetyl-D-glucosamine. Biopolymers. Vol 7, 281–298, (1969).
BLUMBERG, R.; SOUTHALL, C. L.; VAN RENSBURG, N. J. & VOLCKMAN, O. B. South african fish products. XXXII.—The rock lobster: A study of chitin production from processing wastes. Journal of the Science of Food and Agriculture 2, 571–576 (1951).
BOOBIS, A. R.; OSSENDORP, B. C.; BANASIAK, U.; HAMEY, P. Y.; SEBESTYEN, I.; MORETTO, A. Cumulative risk assessment of pesticide residues in food. Toxicology Letters 180, 137–150 (2008).
BOUGH, W. A.; SALTER, W. L.; WU, A. C. M.; PERKINS, B. E. Influence of manufacturing variables on the characteristics and effectiveness of chitosan products. I. Chemical composition, viscosity, and molecular‐weight distribution of chitosan products. Biotechnology and Bioengineering 20, 1931–1943 (1978).
BRASSELET, C., PIERRE, G., DUBESSAY, P., DOLS-LAFARGUE, M., COULON, J., MAUPEU, J., DELATTRE, C. Modification of chitosan for the generation of functional derivatives. Applied Sciences (Switzerland) 9, (2019).
BRINE, C.I.; AUSTIN, P.R. Chitin variability with species and method of preparation. Comp. Biochem. Physiol. 698: 283, (1981).
BRZESKI, M.M. Concept of chitinlchitosan isolation from Antartic Krill (Euphausia superba) shells on a technical scale. In Proceedings of the Second Inlernaliot~al Cotlference on Chitin and Chitosan, S. Hirano and S. Tokura (Ed.), p. 15. The Japan Society of Chitin and Chitosan, Sapporo, Japan, (1982).
BUGNICOURT, L.; LADAVIÈRE, C. Interests of chitosan nanoparticles ionically crosslinked with tripolyphosphate for biomedical applications. Progress in Polymer Science. Elsevier Ltd, (2016).
BUSILACCHI, A.; GIGANTE, A.; MATTIOLI-BELMONTE, M.; MANZOTTI, S.; MUZZARELLI, R. A. A. Chitosan stabilizes platelet growth factors and modulates stem cell differentiation toward tissue regeneration. Carbohydrate Polymers 98, 665–676 (2013).
CAMPANA-FILHO, S. P.; DE BRITTO, D.; CURTI, E.; ABREU, F. R.; CARDOSO, M. B.; BATTISTI, M. V.; LAVALL, R. L. Extração, Estruturas e Propriedades de α- e βQuitina. Quim. Nova, Vol. 30, No. 3, 644-650, (2007).
CHIEN, R. C.; YEN, M. T.; MAU, J. L. Antimicrobial and antitumor activities of chitosan from shiitake stipes, compared to commercial chitosan from crab shells. Carbohydrate Polymers, 138, 259–264, (2016).
CHIRIBOGA O. G.; LEDUFF P.; RORRER G. L. Extracellular Chitin Nanofibers from Marine Diatoms. In Encyclopedia of Marine Biotechnology (pp. 1083–1092). Wiley, (2020).
CHIU, C. Y.; FENG, S. A.; LIU, S. H.; CHIANG, M. T. Functional comparison for lipid metabolism and intestinal and fecal microflora enzyme activities between low molecular weight chitosan and chitosan oligosaccharide in high-fat-diet-fed rats. Marine Drugs 15, (2017).
CHO, Y. I.; NO, H. K.; MEYERS, S. P. Physicochemical Characteristics and Functional Properties of Various Commercial Chitin and Chitosan Products. Journal of Agricultural and Food Chemistry, 46(9), 3839–3843, (1998).
CHO, Y. W.; JANG, J.; PARK, C. R.; KO, S. W. Preparation and solubility in acid and water of partially deacetylated chitins. Biomacromolecules 1, 609–614 (2000).
CHUNG, Y. C.; SU, Y. P.; CHEN, C. C.; JIA, G.; WANG, H. L.; WU, J. C. G.; LIN, J. G. Relationship between antibacterial activity of chitosan and surface characteristics of cell wall. Acta Pharmacologica Sinica 25, 932–936 (2004).
COUTINHO, F. M. B.; DELPECH, M. C.; GARCIA, M. E. F. Evaluation of gas permeability of membranes obtained from poly(urethane-urea)s aqueous dispersions based on hydroxyl-terminated polybutadiene. Polymer Testing, 21(6), 719–723, (2002).
CURTI, E.; DE BRITTO, D.; & CAMPANA-FILHO, S. P. Methylation of Chitosan with Iodomethane: Effect of Reaction Conditions on Chemoselectivity and Degree of Substitution. in Macromolecular Bioscience 3, 571–576 (2003).
DABAS, N.; JAISWAR, G. Fundamentals of processing and characterization of polysaccharide nanocrystal-based materials. In Innovation in Nano-polysaccharides for Eco-sustainability: From Science to Industrial Applications (pp. 61–81). Elsevier. https://doi.org/10.1016/B978-0-12-823439-6.00014-3, (2021).
DANILA, A.; MURESAN, E. I.; IBANESCU, S. A.; POPESCU, A.; DANU, M.; ZAHARIA, C.; STARAS, A. I. Preparation, characterization, and application of polysaccharidebased emulsions incorporated with lavender essential oil for skin-friendly cellulosic support. International Journal of Biological Macromolecules 191, 405–413 (2021).
DAS, S.; ROY, D.; SEN, R. Utilization of Chitinaceous Wastes for the Production of Chitinase. In Advances in Food and Nutrition Research (Vol. 78, pp. 27–46). Academic Press Inc, (2016).
DELPECH, M. C.; COUTINHO, F. M. B.; HABIBE, M. E. S. Viscometry study of ethylene-cyclic olefin copolymers. Polymer Testing, 21(4), 411–415, (2002).
DELPECH, M. C.; COUTINHO, F. M. B.; SOUSA, K. G. M.; CRUZ, R. C. Estudo viscosimétrico de prepolímeros uretânicos. Polímeros 17, 294–298 (2007).
DELPECH, M. C.; OLIVEIRA, C. M. F. Viscometric study of poly(methyl methacrylateg-propylene oxide) and respective homopolymers. Polymer Testing, 24(3), 381–386, (2005).
DMYTRYK, A., et al. Effect of new biostimulators on the initial phase of plant growth. Przem. Chem, 93, 1020–1025. (In Polish), (2014).
ECOBICHON, D. J. Our changing perspectives on benefits and risks of pesticides: A historical overview. NeuroToxicology, 2000.
EL HADRAMI, A.; ADAM, L. R.; EL HADRAMI, I.; DAAYF, F. Chitosan in plant protection. Marine Drugs 8, 968–987 (2010).
ESSAWY, A. A.; HEFNI, H.; EL-NGGAR, A. M. in Sustainable Polymer Composites and Nanocomposites 143–183 (Springer International Publishing, 2019). doi:10.1007/978-3-030-05399-4_5.
FELIZIANI, E.; LANDI, L.; ROMANAZZI, G. Preharvest treatments with chitosan and other alternatives to conventional fungicides to control postharvest decay of strawberry. Carbohydrate Polymers, 132, 111–117, (2015).
FILHO, S. P. C.; SIGNINI, R.; CARDOSO, M. B. Propriedades e Aplicações da Quitosana. Processos Químicos, v. 1, p. 9–20, 2007.
FRANCESKO, A.; DÍAZ GONZÁLEZ, M.; LOZANO, G. R.; TZANOV, T. in Advances in Textile Biotechnology 288–311 (Elsevier Inc.). doi:10.1533/9780857090232.2.288, (2010).
GARDNER, K. H.; BLACKWELL, J. Refinement of the structure of βchitin. Biopolymers, 14(8), 1581–1595, 1975.
GIRI, S.; DUTTA, P.; KUMARASAMY, D.; GIRI, T. K. Natural polysaccharides: Types, basic structure and suitability for forming hydrogels. In Plant and Algal Hydrogels for Drug Delivery and Regenerative Medicine (pp. 1–35), (2021).
GONSALVES, A. de A.; ARAÚJO, C. R. M. Diferentes estratégias para reticulação de quitosana. Revista Química Nova, v. 34, n. 7, p. 1215–1223, (abr. 2011).
GOY, R. C.; DE BRITTO, D.; ASSIS, O. B. G. A review of the antimicrobial activity of chitosan. Polimeros. Associacao Brasileira de Polimeros, 2009.
GUINESI, L. S.; CAVALHEIRO, É. T. G. The use of DSC curves to determine the acetylation degree of chitin/chitosan samples. Thermochimica Acta, 444(2), 128–133, (2006).
GUMELAR, M. D.; HAMZAH, M.; HIDAYAT, A. S.;SAPUTRA, D. A.; IDVAN. Utilization of Chitosan as Coating Material in Making NPK Slow Release Fertilizer. Macromolecular Symposia 391, (2020).
HACKMAN, R. H. Studies on chitin. I. Enzymatic degradation of chitin and chitin esters. Aust. J. Biol. Sci. 7: 168, (1954).
HAJJI, S.; YOUNES, I.; GHORBEL-BELLAAJ, O.; HAJJI, R.; RINAUDO, M.; NASRI, M.; JELLOULI, K. Structural differences between chitin and chitosan extracted from three different marine sources. International Journal of Biological Macromolecules, 65, 298–306, (2014).
HAMED, I.; ÖZOGUL, F.; REGENSTEIN, J. M. Industrial applications of crustacean by-products (chitin, chitosan, and chitooligosaccharides): A review. Trends in Food Science and Technology. Elsevier Ltd, (2016).
HARIA, A. H.; HODNETT, M. G.; JOHNSON, A. C. Mechanisms of groundwater recharge and pesticide penetration to a chalk aquifer in southern England. Journal of Hydrology, 275(1–2), 122–137, (2003).
HERTH, W.; BARTHLOTT, W. The site of beta-chitin fibril formation in centric diatoms. I. Pores and fibril formation. Journal of Ultrastructure Research 68, 6-15, (1979).
HOLLINGWORTH, R. M.; DONG, K. The biochemical and molecular genetic basis of resistance to pesticides in arthropods. In Global Pesticide Resistance in Arthropods (pp. 40–89). CABI Publishing, (2008).
HORST M.N.; WALKER A.N.; KLAR E. The pathway of crustacean chitin synthesis. In: Horst M.N., Freeman J.A., editors. The Crustacean Integument: Morphology and Biochemistry. CRC; Boca Raton, FL, USA: pp. 113–149, (1993).
HOU, J.; AYDEMIR, B. E.; DUMANLI, A. G. Understanding the structural diversity of chitins as a versatile biomaterial. Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences. Royal Society Publishing, 2021.
HUA, L.; DENG, J.; WANG, Z.; WANG, Y.; CHEN, B.; MA, Y.; XU, B. Improving the functionality of chitosan-based packaging films by crosslinking with nanoencapsulated clove essential oil. International Journal of Biological Macromolecules, 192, 627–634, (2021).
HUANG, M.; KHOR, E.; LIM, L. Y. Uptake and Cytotoxicity of Chitosan Molecules and Nanoparticles: Effects of Molecular Weight and Degree of Deacetylation. Pharmaceutical Research, 21(2), 344–353, (2004).
HUNT, S.; HUCKERBY, T. N. A comparative study of molluscan and crustacean chitin proteoglycans by carbon-13 NMR spectroscopy. Identification of carbohydrate and amino acid contributions and the determination of amino acid chemical shifts in anhydrous formic acid. Comparative Biochemistry and Physiology — Part B: Biochemistry And, 88(4), 1107–1116, (1987).
HWANG, K. T; JUNG, S. T.; LEE, G. D.; CHINNAN, M. S.; PARK, Y. S.; PARK, H. J. Controlling molecular weight and degree of deacetylation of chitosan by response surface methodology. Journal of Agricultural and Food Chemistry 50, 1876–1882 (2002).
ILYINA, A. V.; TIKHONOV, V. E.; ALBULOV, A. I.; VARLAMOV, V. P. Enzymic preparation of acid-free-water-soluble chitosan. Process Biochemistry 35, 563–568 (2000).
ISMAN, M. B. Plant essential oils for pest and disease management. In Crop Protection (Vol. 19, pp. 603–608), (2000).
JOHNSON, E.L.; PENISTON, Q.P.. Utilization of shellfish waste for chitin and chitosan production. Ch. 19. In Chemistry & Biochemistry of Marine Food Products, RE Martin, G.J. Flick, C.E. Hebard, and D.R. Ward (Ed.), p. 415. AVI Publishing Co., Westport, CT, (1982).
JUNCEDA-MENA, I.; GARCÍA-JUNCEDA; REVUELTA, J. From the problem to the solution: Chitosan valorization cycle. Carbohydrate Polymers 309, (2023).
KAMASASTRI, P.V; PRABHU, P.V. Preparation of chitin & glucosarnine horn prawn shell waste. J. Sci. Ind. Res. 20D: 466, (1961).
KAMEDA, T.; MIYAZAWA, M.; ONO, H.; YOSHIDA, M. Hydrogen bonding structure and stability of α-chitin studied by 13C solid-state NMR. Macromolecular Bioscience 5, 103–106 (2005).
KARAGÖZ, S.; DEMIRDÖVEN, A. Effect of chitosan coatings with and without Stevia rebaudiana and modified atmosphere packaging on quality of cold stored fresh-cut apples. LWT, 108, 332–337, (2019).
KASAAI, M. R. Calculation of Mark-Houwink-Sakurada (MHS) equation viscometric constants for chitosan in any solvent-temperature system using experimental reported viscometric constants data. Carbohydrate Polymers, 68(3), 477–488, (2007).
KATIYAR, D.; HEMANTARANJAN, A.; SINGH, B. Chitosan as a promising natural compound to enhance potential physiological responses in plant: a review. Indian Journal of Plant Physiology. Springer Verlag, (2015).
KAYA, M.; MUJTABA, M.; EHRLICH, H.; SALABERRIA, A. M.; BARAN, T.; AMEMIYA, C. T.; LABIDI, J. On chemistry of γ-chitin. Carbohydrate Polymers, 176, 177–186, (2017).
KIM, Y.; PARK, R. D. Progress in bioextraction processes of chitin from crustacean biowastes. Journal of the Korean Society for Applied Biological Chemistry 58, 545–554, (2015).
KNORR, D. Functional Properties of Chitin and Chitosan. Journal of Food Science, 47(2), 593–595, (1982).
KONG, M.; CHEN, X. G.; XING, K.; PARK, H. J. Antimicrobial properties of chitosan and mode of action: A state of the art review. International Journal of Food Microbiology 144, 51–63 (2010).
KOU, S., G.; PETERS, L. M.; MUCALO, M. R. Chitosan: A review of sources and preparation methods. International Journal of Biological Macromolecules. Elsevier B.V., (2021).
KUMARI, S.; KISHOR, R. Chitin and chitosan: origin, properties, and applications. In Handbook of Chitin and Chitosan: Volume 1: Preparation and Properties (pp. 1–33). Elsevier, (2020).
KUMARIHAMI, H. M. P. C.; KIM, Y. H.; KWACK, Y. B.; KIM, J.; KIM, J. G. Application of chitosan as edible coating to enhance storability and fruit quality of Kiwifruit: A Review. Scientia Horticulturae 292, (2022).
KUMIRSKA, J.; CZERWICKA, M.; KACZYŃSKI, Z.; BYCHOWSKA, A.; BRZOZOWSKI, K.; THÖMING, J.; STEPNOWSKI, P. Application of spectroscopic methods for structural analysis of chitin and chitosan. Marine Drugs. MDPI AG, 2010.
KURITA, K. Chitin and chitosan: Functional biopolymers from marine crustaceans. Marine Biotechnology, 2006.
LANDI, L.; PERALTA-RUIZ, Y.; CHAVES-LÓPEZ, C.; ROMANAZZI, G. Chitosan Coating Enriched With Ruta graveolens L. Essential Oil Reduces Postharvest Anthracnose of Papaya (Carica papaya L.) and Modulates Defense-Related Gene Expression. Frontiers in Plant Science 12, (2021).
LI, K.; XING, R.; LIU, S.; LI, P. Chitin and Chitosan Fragments Responsible for Plant Elicitor and Growth Stimulator. Journal of Agricultural and Food Chemistry 68, 12203– 12211 (2020).
LIU, H.; DU, Y.; WANG, X.; SUN, L. Chitosan kills bacteria through cell membrane damage. International Journal of Food Microbiology 95, 147–155 (2004).
LIU, H.; TIAN, W.; LI, B.; WU, G.; IBRAHIM, M.; TAO, Z.; SUN, G. Antifungal effect and mechanism of chitosan against the rice sheath blight pathogen, Rhizoctonia solani. Biotechnology Letters 34, 2291–2298 (2012).
LIU, X.; COOPER, A. M. W.; ZHANG, J.; ZHU, K. Y. Biosynthesis, modifications and degradation of chitin in the formation and turnover of peritrophic matrix in insects. Journal of Insect Physiology 114, 109–115 (2019).
LOPES, C.; ANTELO, L. T.; FRANCO-URÍA, A.; ALONSO, A. A.; PÉREZ-MARTÍN, R. Chitin production from crustacean biomass: Sustainability assessment of chemical and enzymatic processes. Journal of Cleaner Production, 172, 4140–415, (2018).
LUBKOWSKI, K.; GRZMIL, B. Controlled release fertilizers. Polish Journal of Chemical Technology, 9(4), 83–84, (2007).
LUO, K., YIN, J., KHUTORYANSKAYA, O. V. & KHUTORYANSKIY, V. V. Mucoadhesive and elastic films based on blends of chitosan and hydroxyethylcellulose. Macromolecular Bioscience 8, 184–192 (2008).
MALERBA, M.; CERANA, R. Chitosan effects on plant systems. International Journal of Molecular Sciences. MDPI AG, (2016).
MALIKI, S.; SHARMA, G.; KUMAR, A.; MORAL-ZAMORANO, M.; MORADI, O.; BASELGA, J.; GARCÍA-PEÑAS, A. Chitosan as a Tool for Sustainable Development: A Mini Review. Polymers 14, (2022).
MARINELLI, E.; ORZALI, L.; LOTTI, E.; RICCIONI, L. Activity of some essential oils against pathogenic seed borne fungi on legumes. Asian Journal of Plant Pathology 6, 66–74 (2012).
MARQUIS-DUVAL, F.O. Ph.D. Dissertation. Laval University; Quebec, Canada: 2008.
Isolation et valorisation des constituants de la carapace de la crevette nordique. MATHUR, N. K.; NARANG, C. K. Chitin and chitosan, versatile polysaccharides from marine animals. Journal Of Chemical Education, 67(11), 938–942, (1990).
MELLO, I. L.; DELPECH, M. C.; COUTINHO, F. M. B.; ALBINO, F. F. M. Viscometric Study of high-cis polybutadiene in toluene solution. Journal of the Brazilian Chemical Society 17, 194–199 (2006).
MENG, X.; YANG, L.; KENNEDY, J. F.; TIAN, S. Effects of chitosan and oligochitosan on growth of two fungal pathogens and physiological properties in pear fruit. Carbohydrate Polymers 81, 70–75 (2010).
MIMA, S.; MIYA, M.; IWAMOTO, R.; YOSHIKAWA, S. Highly deacetylated chitosan and its properties. Journal of Applied Polymer Science 28, 1909–1917 (1983).
MINKE, R.; BLACKWELL, J. The structure of α-chitin. Journal of Molecular Biology, 120(2), 167–181, (1978).
MOORJANI, M.N., et al. Parameters affecring the viscosily of chitosan from prawn waste. J. Food Sci. Technol. 12: 187, (1975).
MORIN-CRINI, N.; LICHTFOUSE, E.; TORRI, G.; CRINI,. G. Applications of chitosan in food, pharmaceuticals, medicine, cosmetics, agriculture, textiles, pulp and paper, biotechnology, and environmental chemistry. Environmental Chemistry Letters, Springer Verlag, 17 (4), pp.1667 – 1692, (2019).
MOURA, C. M. DE; MOURA, J. M. DE; SOARES, N. M.; PINTO, L. A. DE A. Evaluation of molar weight and deacetylation degree of chitosan during chitin deacetylation reaction: Used to produce biofilm. Chemical Engineering and Processing: Process Intensification 50, 351–355 (2011).
MOUSSIAN B. Chitin: Structure, chemistry and biology. In Advances in Experimental Medicine and Biology (Vol. 1142, pp. 5–18). Springer New York LLC, (2019).
MUANPRASAT, C.; CHATSUDTHIPONG, V. Chitosan oligosaccharide: Biological activities and potential therapeutic applications. Pharmacology and Therapeutics. Elsevier Inc, (2017).
NGO D.H.; KIM S.K. Chapter Two-Antioxidant effects of chitin, chitosan, and their derivatives. Adv. Food Nutr. Res.;73:15–31, (2014).
NISHIYAMA, Y.; NOISHIKI, Y.; WADA, M. X-ray structure of anhydrous β-chitin at 1 Å resolution. Macromolecules, 44(4), 950–957, (2011).
NO H.K.; HUR E.Y. Control of foam formation by antifoam during demineralization of crustacean shell in preparation of chitin. J. Agric. Food. Chem. (1998).
NO, H. K.; MEYERS, S. P. Preparation and Characterization of Chitin and Chitosan—A Review. Journal of Aquatic Food Product Technology, 4(2), 27–52, (1995).
NO, H. K.; MEYERS, S. P.; LEE, K. S. Isolation and Characterization of Chitin from Crawfish Shell Waste. Journal of Agricultural and Food Chemistry 37, 575–579 (1989).
OKAFOR N. Isolation of chitin from the shell of the cuttlefish, Sepia oficirralis L. Biochim. Biophys. Acta;101:193–200, (1965).
OKAMOTO, Y.; YANO, R.; MIYATAKE, K.; TOMOHIRO, I.; SHIGEMASA, Y.; MINAMI, S. Effects of chitin and chitosan on blood coagulation. Carbohydrate Polymers 53, 337– 342 (2003).
PAGNONCELLI, M. G. B.; DE ARAÚJO, N. K.; DA SILVA, N. M. P.; DE ASSIS, C. F.; RODRIGUES, S.; DE MACEDO, G. R. Chitosanase production by Paenibacillus ehimensis and its application for chitosan hydrolysis. Brazilian Archives of Biology and Technology 53, 1461–1468 (2010).
PAKIZEH, M.; MORADI, A.; GHASSEMI, T. Chemical extraction and modification of chitin and chitosan from shrimp shells. European Polymer Journal. Elsevier Ltd, (2021).
PARK, P. J.; JE, J. Y.; KIM, S. K. Free radical scavenging activity of chitooligosaccharides by electron spin resonance spectrometry. Journal of Agricultural and Food Chemistry, 51(16), 4624–4627, (2003).
PARRA, Y.; RAMÍREZ, M. A. EFECTO DE DIFERENTES DERIVADOS DE LA QUITINA SOBRE EL CRECIMIENTO In Vitro DEL HONGO Rhizoctonia solani Kuhn. Instituto Nacional de Ciencias Agrícolas, 23(2), 73–75, (2002).
PAVONI, J. M. F., LUCHESE, C. L., & TESSARO, I. C. Impact of acid type for chitosan dissolution on the characteristics and biodegradability of cornstarch/chitosan based films. International Journal of Biological Macromolecules, (2019).
PELLIS, A.; GUEBITZ, G. M.; NYANHONGO, G. S. Chitosan: Sources, Processing and Modification Techniques. Gels 8, (2022).
PERCOT A.; VITON C.; DOMARD A. Percot A., Viton C., Domard A. Characterization of shrimp shell deproteinization. Biomacromolecules; 4:1380–1385, (2003).
QAVAMI, N., NAGHDI BADI, H., LABBAFI, M., MEHREGAN, M., TAVAKOLI, M., & MEHRAFARIN, A. Overview on Chitosan as a valuable ingredient and biostimulant in pharmaceutical industries and agricultural products. Trakia Journal of Science 15, 83– 91 (2017).
QIN, Y. A brief description of textile fibers. In Medical Textile Materials (pp. 23–42).
Elsevier. https://doi.org/10.1016/b978-0-08-100618-4.00003-0, (2016).
RABEA, E. I.; BADAWY, M. E. T.; STEVENS, C. V.; SMAGGHE, G.; STEURBAUT, W. Chitosan as antimicrobial agent: Applications and mode of action. Biomacromolecules 4, 1457–1465 (2003).
RAJESTARY, R.; LANDI, L.; ROMANAZZI, G. Chitosan and postharvest decay of fresh fruit: Meta-analysis of disease control and antimicrobial and eliciting activities. Comprehensive Reviews in Food Science and Food Safety 20, 563–582 (2021).
RAVAL, R.; RAVAL, K.; MOERSCHBACHER, B. M. Enzymatic Modification of Chitosan Using Chitin Deacetylase Isolated from Bacillus cereus. Open Access Scientific Reports, 2(1), 2–5, (2013).
REGLINSKI, T.; ELMER, P. A. G.; TAYLOR, J. T.; WOOD, P. N.; HOYTE, S. M. Inhibition of Botrytis cinerea growth and suppression of botrytis bunch rot in grapes using chitosan. Plant Pathology 59, 882–890 (2010).
RIANDE, R. Polymer viscoelasticity stress and strain in practice. New York : Marcel Dekker, 879p, (2000).
RICCIONI, L.; ORZALI, L. Activity of tea tree (Melaleuca alternifolia, Cheel) and thyme (Thymus vulgaris, Linnaeus.) essential oils against some pathogenic seed borne fungi. Journal of Essential Oil Research, 23(6), 43–47, (2011).
RINAUDO, M.; DOMARD, A. Solution properties of chitosan. Chitin and Chitosan. ResearchGate, 71–79, (1989).
ROBERTS G. A. F. Chitin chemistry. London, UK: Macmillan International Higher Education. 26. Kaya M, et al. 2017 On chemistry of γ-chitin. Carbohydr. Polym. 176, 177–186, (1992).
ROMANAZZI, G.; FELIZIANI, E.; SIVAKUMAR, D. Chitosan, a biopolymer with triple action on postharvest decay of fruit and vegetables: Eliciting, antimicrobial and filmforming properties. Frontiers in Microbiology, 9, (2019).
ROMANAZZI, G.; GABLER, F. M.; MARGOSAN, D.; MACKEY, B. E.; SMILANICK, J. L. Effect of chitosan dissolved in different acids on its ability to control postharvest gray mold of table grape. Phytopathology 99, 1028–1036 (2009).
ROMANAZZI, G.; MOUMNI, M. Chitosan and other edible coatings to extend shelf life, manage postharvest decay, and reduce loss and waste of fresh fruits and vegetables Current Opinion in Biotechnology, Volume 78, 102834, ISSN 0958-1669, (2022).
RUDALL, K. M.. The Chitin/Protein Complexes of Insect Cuticles. Advances in Insect Physiology, 1(C), 257–313, (1963).
RUDALL, K., M.; KENCHINGTON. The chitin system. Biological Reviews of the Cambridge Philosophical Society, 48(4), 597–633, (1973).
SÁNCHEZ ALDANA, D., et al. Preparation, characterization, and application of polysaccharide-based emulsions incorporated with lavender essential oil for skinfriendly cellulosic support. International Journal of Biological Macromolecules, 191, 405–413, (2021).
SANFORD, P. A. Biomedical applications of high purity chitosan: physical, chemical and bioactive properties. In American Chemical Society, Polymer Preprints, Division of Polymer Chemistry (Vol. 30, p. 365). Publ by ACS, (1989).
SANNAN, T.; KURITA, K.; IWAKURA, Y. Studies on Chitin, 1 – Effect of Deacetylation on Solubility. Die Makromolekulare Chemie, 177(12), 3589–3600, (1976).
SANTOS, J. E. DOS, SOARES, J. DA P., DOCKAL, E. R., CAMPANA FILHO, S. P., & CAVALHEIRO, É. T. G. Caracterização de quitosanas comerciais de diferentes origens. Polímeros 13, 242–249 (2003).
SANTOS, V. P.; MAIA, P.; ALENCAR, N. DE S.; FARIAS, L.; ANDRADE, R. F. S.; SOUZA, D.; CAMPOS-TAKAKI, G. M.. Recovery of chitin and chitosan from shrimp waste with microwave technique and versatile application. Arquivos do Instituto Biológico 86, (2019).
SCHMITT, A.; KOCH, E.; STEPHAN, D.; KROMPHARDT, C.; JAHN, M.; KRAUTHAUSEN, H.-J.; P, S. Evaluation of non-chemical seed treatment methods for the control of Phoma valerianellae on lamb’s lettuce seeds. Journal of Plant Diseases and Protection 116, 200–207 (2009).
SHAH, S.; HASHMI, M. S. Chitosan–aloe vera gel coating delays postharvest decay of mango fruit. Horticulture Environment and Biotechnology, 61(2), 279–289, (2020).
SHAHIDI F.; SYNOWIECKI J. Isolation and characterization of nutrients and valueadded products from snow crab (Chifroeceles opilio) and shrimp (Panda- 111sb orealis) processing discards. J. Agric. Food Chem. ;39:1527–1532, (1991).
SHARP, R. G.. A review of the applications of chitin and its derivatives in agriculture to modify plant-microbial interactions and improve crop yields. Agronomy. MDPI AG, (2013).
SHIGEMASA, Y., MATSUURA, H., SASHIWA, H., & SAIMOTO, H. Evaluation of different absorbance ratios from infrared spectroscopy for analyzing the degree of deacetylation in chitin. International Journal of Biological Macromolecules 18, 237–242 (1996).
SHIMAHARA K.; OHKOUCHI K.; IKEDA M. In: Chitin Chemistry. Roberts G.A.F., editor. Macmillan Press; London, UK: p. 56, (1992).
SIKORSKI P.; HORI R.; WADA M. evisit of α-chitin crystal structure using high resolution X-ray diffraction data. Biomacromolecules, 10(5), 1100–1105, (2009).
SINHA, S.; CHAND, S.; TRIPATHI, P. Production, purification and characterization of a new chitosanase enzyme and improvement of chitosan pentamer and hexamer yield in an enzyme membrane reactor. Biocatalysis and Biotransformation, 32(4), 208–213, (2014).
SONG, M. J.; PARK, C. H.; KIM, J. D.; KIM, H. Y.; BAE, S. H.; CHOI, J. Y.; LEE, H. G. Drug-eluting bead loaded with doxorubicin versus conventional Lipiodol-based transarterial chemoembolization in the treatment of hepatocellular carcinoma: A casecontrol study of Asian patients. European Journal of Gastroenterology and Hepatology 23, 521–527 (2011).
SOUZA, V.C.; DOTTO, G.L. Application of chitosan based materials as edible films and coatings, Frontiers in Biomaterials: Chitosan Based Materials and Its Applications, vol. 3, pp. 249-271, (2017).
SUKSANGPANYA, N.; YARAGHI, N. A.; KISAILUS, D.; ZAVATTIERI, P. Twisting cracks in Bouligand structures. Journal of the Mechanical Behavior of Biomedical Materials 76, 38–57 (2017).
THOMAS, D.; THOMAS, S. Chemical Modification of Chitosan and Its Biomedical Application. In Biopolymer Nanocomposites (pp. 33–51). John Wiley & Sons, Inc., (2013).
THOMAS, S.; PIUS, A.; GOPI, S. Handbook of Chitin and Chitosan: Volume 1: Preparation and Properties. Handbook of Chitin and Chitosan: Volume 1: Preparation and Properties (pp. 1–492). Elsevier, (2020).
TINIVELLA, F.; HIRATA, L. M.; CELAN, M. A.; WRIGHT, S. A. I.; AMEIN, T.; SCHMITT, A.; GULLINO, M. L. Control of seed-borne pathogens on legumes by microbial and other alternative seed treatments. European Journal of Plant Pathology 123, 139–151 (2009).
TOKATLI, K.; DEMIRDÖVEN, A. Optimization of chitin and chitosan production from shrimp wastes and characterization. Journal of Food Processing and Preservation, 42(2), (2018).
TOKORO, A.; TATEWAKI, N.; SUZUKI, K.; MIKAMI, T.; SUZUKI, S.; SUZUKI, M. Growth-Inhibitory Effect of Hexa-N-acetyklhitohexaose and Chitohexaose against Meth-A Solid Tumor. Chemical and Pharmaceutical Bulletin 36, 784–790 (1988).
TOLAIMATE, A.; DESBRIERES, J.; RHAZI, M.; ALAGUI, A. Contribution to the preparation of chitins and chitosans with controlled physico-chemical properties. Polymer, 44(26),7939–7952. https://doi.org/10.1016/j.polymer.2003.10.025 (2003).
TRIUNFO, M.; TAFI, E.; GUARNIERI, A.; SALVIA, R.; SCIEUZO, C.; HAHN, T.; FALABELLA, P.. Characterization of chitin and chitosan derived from Hermetia illucens, a further step in a circular economy process. Scientific Reports 12, (2022).
TRUONG, T. O.; HAUSLER, R.; MONETTE, F.; NIQUETTE, P. The valorization of industrial fishery waste through the hydrothermal-chemical transformation of chitosan [Valorisation des résidus industriels de pêches pour la transformation de chitosane par technique hydrothermo-chimique]. Revue des Sciences de l’Eau 20, 253–262 (2007).
VAN LENTEREN, J. C. Need for quality control of mass-produced biological control agents. In Quality Control and Production of Biological Control Agents: Theory and Testing Procedures (pp. 1–18), (2003).
VERMA, D.; FORTUNATI, E. Biopolymer processing and its composites: An introduction. In Biomass, Biopolymer-Based Materials, and Bioenergy: Construction, Biomedical, and other Industrial Applications (pp. 3–23). Elsevier. https://doi.org/10.1016/B978-0-08-102426-3.00001-1.
WANG, J. J.; ZENG, Z. W.; XIAO, R. Z.; XIE, T.; ZHOU, G. L.; ZHAN, X. R.; WANG, S. L. Recent advances of chitosan nanoparticles as drug carriers. International journal of nanomedicine 6, 765–774 (2011).
XING, K.; ZHU, X.; PENG, X; QIN, S. Chitosan antimicrobial and eliciting properties for pest control in agriculture: a review. Agronomy for Sustainable Development 35, 569– 588 (2015).
YAMAMOTO, H.; KUNO, Y.; SUGIMOTO, S.; TAKEUCHI, H.; KAWASHIMA, Y. Surface-modified PLGA nanosphere with chitosan improved pulmonary delivery of calcitonin by mucoadhesion and opening of the intercellular tight junctions. Journal of Controlled Release 102, 373–381 (2005).
YAN, C. YUN; GU, J. WEI; HOU, D. PING; JING, H. YING; WANG, J.; GUO, Y. ZHI; YAMAMOTO, A. Synthesis of Tat tagged and folate modified N-succinyl-chitosan selfassembly nanoparticles as a novel gene vector. International Journal of Biological Macromolecules 72, 751–756 (2015).
YOUNES, I.; RINAUDO, M. Chitin and chitosan preparation from marine sources. Structure, properties and applications. Marine Drugs. MDPI AG, (2015).
YOUNES, I.; SELLIMI, S.; RINAUDO, M.; JELLOULI, K; NASRI, M. Influence of acetylation degree and molecular weight of homogeneous chitosans on antibacterial and antifungal activities. International Journal of Food Microbiology 185, 57–63 (2014).
ZAJA̧ C, A.; HANUZA, J.; WANDAS, M.; DYMIŃSKA, L. Determination of N-acetylation degree in chitosan using Raman spectroscopy. Spectrochimica Acta – Part A: Molecular and Biomolecular Spectroscopy 134, 114–120 (2015).
ZAMANI, A.; TAHERZADEH, M. J. Production of low molecular weight chitosan by hot dilute sulfuric acid. BioResources, 5(3), 1554–1564, (2010).
ZHANG, C. M.; YU, S. H.; ZHANG, L. S.; ZHAO, Z. Y.; DONG, L. L. Effects of several acetylated chitooligosaccharides on antioxidation, antiglycation and NO generation in erythrocyte. Bioorganic and Medicinal Chemistry Letters 24, 4053–4057 (2014).
ZHANG, W.; JIANG, H.; RHIM, J. W.; CAO, J.; JIANG, W. Effective strategies of sustained release and retention enhancement of essential oils in active food packaging films/coatings. Food Chemistry 367, (2022).
ZHANG, X.; ISMAIL, B. B.; CHENG, H.; JIN, T. Z.; QIAN, M.; ARABI, S. A.; GUO, M. Emerging chitosan-essential oil films and coatings for food preservation – A review of advances and applications. Carbohydrate Polymers 273, (2021).
ZHANG, Y.; PARIS, O.; TERRILL, N. J.; GUPTA, H. S. Uncovering three-dimensional gradients in fibrillar orientation in an impact-resistant biological armour. Scientific Reports, 6. https://doi.org/10.1038/srep26249 (2016).
ZHAO, D.; YU, S.; SUN, B.; GAO, S.; GUO, S.; ZHAO, K. Biomedical applications of chitosan and its derivative nanoparticles. Polymers 10, (2018).
Laboratório de Biomateriais e Cerâmicas Avançadas (Labiomat), Programa de Pós-Graduação em Engenharia de Minas, Metalúrgica e de Materiais (PPGE3M), Departamento de Materiais (DEMAT), Universidade Federal do Rio Grande do Sul (UFRGS)
