L-PRF BIOLOGICAL PROPERTIRES AND ITS APLICATIONS IN DENSTISTRY: INTEGRATIVE LITERATURE REVIEW
REGISTRO DOI: 10.5281/zenodo.8235712
¹Amanda Fernandes Pereira
²Juan Vitor Costa Leite
²Marcos André Batista da Silva
³Hellen Bandeira de Pontes Santos
³Priscilla Kelly Batista da Silva Leite
³Amanda Lira Rufino de Lucena
³Marcos André Azevedo da Silva
³Amaro Lafayette Nobre Formiga Filho
³Pedro Everton Marques Goes
4Mayra Sousa Gomes
Resumo
A odontologia traz inovações para otimizar as técnicas de reabilitação oral e proporcionar eficácia no tratamento. Assim, a tecnologia procurou desenvolver biomateriais que regulam a inflamação e aceleram a cicatrização para evitar a ocorrência de danos no tecido mole. O L-PRF foi desenvolvido como uma membrana de fibrina de plaquetas e leucócitos, que libera fatores de crescimento, promove a angiogênese, a migração e proliferação celular, visa o aumento tecidual em reconstruções alveolares e levantamento do seio maxilar. Portanto, o objetivo deste estudo é analisar os benefícios da utilização do L-PRF e suas aplicações nas diversas áreas da Odontologia, como a periodontia, implantodontia e a cirurgia. Este estudo trata-se de uma revisão de literatura integrativa, que foi realizada usando as bases de dados do PubMed e Medline para o levantamento bibliográfico de artigos nacionais e estrangeiros, preexistentes, sobre o L-PRF e suas aplicações na odontologia, no período de 2020 até 2022. Após avaliação dos artigos encontrados, foi possível notar que os estudos relataram que o L-PRF auxilia na regeneração tecidual, na diminuição da dor e edema, acelera o processo de cicatrização, além de ser eficiente na técnica de levantamento do seio maxilar e regeneração alveolar pós-extração dentária. Além disso, o L-PRF é capaz de ativar os fatores de crescimento, proporcionar hemostasia e a estabilidade ao implante. Ademais, sugere-se mais estudos histológicos e clínicos sobre o assunto, a fim de que novos procedimentos tragam maior precisão na atuação clínica e benefícios para o paciente, agregando qualidade de vida e confiabilidade no Cirurgião-Dentista.
Palavras-chave: L-PRF. Fibrina rica em plaquetas e leucócitos. Cicatrização.
Abstract
Dentistry has been bringing innovations to optimize oral rehabilitation techniques and provide effective treatment. With this, technology sought to develop biomaterials that regulate inflammation and accelerate healing to prevent the occurrence and damage to soft tissue. In 2001 Choukroun developed L-PRF, which is a fibrin and leukocyte membrane that releases growth factors, and also promotes angiogenesis, cell migration and proliferation, aiming at tissue augmentation, alveolar reconstructions and maxillary sinus lifting. The aim of this study is to analyze the benefits of using L-PRF and its applications in areas of dentistry such as periodontics and surgery. This is an integrative literature review that was carried out using PubMed, Web of Science and Medline databases to carry out a bibliographic survey of pre-existing national and foreign articles from the period 2021 to 2022. publication of 2005. The vast majority of studies report that L-PRF assists in tissue regeneration, in the reduction of pain and edema, and accelerates the healing process, in addition to being efficient in the technique of lifting the maxillary sinus and post alveolar regeneration -dental extraction. In addition, they all suggest further histological and clinical studies on the subject. The present scientific studies demonstrate evidence that L-PRF accelerates tissue healing, helps in a more satisfactory postoperative period, being a product rich in leukocytes and platelets, activating growth factors, providing hemostasis and stability to the implant. However, more studies are needed so that these new procedures bring more precision in clinical performance and benefits for the patient, adding quality of life and reliability to the Dental Surgeon.
Keywords: L-PRF. Platelet-rich and leukocyte fibrin. Healing.
1. INTRODUÇÃO
As inovações na Odontologia, ao longo do tempo, desenvolveram técnicas de reabilitação que proporcionam otimização do tempo e melhor previsibilidade de procedimento. Atualmente, os implantes tornaram-se uma abordagem de tratamento confiável na resolução de vários problemas clínicos. Assim, a fibrina rica em plaquetas e leucócitos (L-PRF) é reconhecida como um procedimento moderno, em que o seu objetivo é o auxiliar no desenvolvimento cirúrgico, com a finalidade de obter a osseointegração do implante no tecido ósseo receptor para que a função e a estética sejam restabelecidas.
A fibrina rica em plaquetas e leucócitos foi elaborada por Choukroun em 2001, e implantada na Odontologia para o uso, principalmente, na implantodontia. Esse método foi desenvolvido na França e hoje vem ganhando espaço como peça fundamental na instalação de implantes. A membrana do L-PRF é retirada a partir da centrifugação do sangue do próprio paciente, por uma técnica que não exige o processamento químico do sangue.
Por ser um biomaterial de origem autóloga, as propriedades do L-PRF são fundamentais nas cirurgias em que se faz presente, uma delas é seu potencial na cicatrização. Isso se dá devido à matriz de fibrina presente na membrana (CARRANZA & NEWMAN, 2020). Essa matriz tem uma formação molecular que favorece sua característica de agregação das moléculas e da cicatrização.
A capacidade de regular a inflamação e de estimular o processo imunológico da quimiotaxia tem o benefício de eliminar riscos de transmissão de doenças. Esses fatores são devidos à proliferação dos osteoblastos, reduzindo o tempo de cicatrização dos tecidos moles (AGARWAL et al., 2014).
O L-PRF ainda ganha espaço ao trazer seus benefícios nas diversas áreas, como na periodontia e na cirurgia orofacial, principalmente, com a presença dos fatores de crescimento. Na periodontia é usada, geralmente, para tratamentos de defeitos ósseos periodontais. Por muito tempo procurou-se um tratamento eficaz para a resolução de recessões gengivais. Uma das formas mais eficazes e baratas foi o uso do L-PRF, assim como o seu uso em extrações dentárias para evitar alveolites, principalmente, na remoção de terceiros molares.
À vista disso, o presente estudo tem como objetivo averiguar, dentro da literatura, as evidências científicas acerca dos benefícios do uso do L-PRF na Odontologia, bem como suas propriedades biológicas e suas aplicações em diversas áreas.
2. REVISÃO DA LITERATURA
2.1. FIBRINA RICA EM PLAQUETAS
A fibrina rica em plaquetas pertence a uma segunda geração de concentrados de plaquetas voltados para o processamento simplificado, sem manipulação bioquímica do sangue. A primeira geração foi o plasma rico em plaquetas (PRP), sendo utilizado pela primeira vez, na cirurgia maxilofacial, em 1997, por Whitman, Berry e Green, além do Marx et al., em 1998. Os fins para suas utilizações não tiveram resultados conclusivos para que fossem utilizados em grande demanda (CARRANZA & NEWMAN, 2020).
Nessa segunda geração, encontramos o L-PRF e o I-PRF (Plasma rico em fibrina injetável) que juntos desenvolvem uma grande ação dentro da implantodontia. Isso graças às células de defesas presentes, como os leucócitos, além das plaquetas. Estes auxiliam preventivamente nas infecções e também modulam os processos inflamatórios. Enquanto as plaquetas promovem hemostasia e liberam fatores de crescimento (DRAGONAS et al., 2018).
A utilização dos agregados plaquetários autólogos é uma realidade inovadora nos procedimentos odontológicos, com o objetivo de promover uma melhor cicatrização dos tecidos moles e duros, como observados dentro da implantodontia. Isso porque suas propriedades bioquímicas trazem benefícios em suas atuações no meio das aplicações clínicas, como: a cicatrização, a angiogênese, controle imunológico, fatores de crescimento, além de uma ótima biocompatibilidade (PONTE, 2020). Atualmente, o L-PRF tem sido frequentemente empregado em procedimentos regenerativos, pois os grânulos de plaquetas, presente em alta concentração, apresentam grande quantidade de citocinas e fatores de crescimento (XU et al., 2020).
Ademais, essas plaquetas têm um forte potencial regenerativo e, isoladas do sangue periférico, são uma fonte de fatores de crescimento com capacidade de estimular a proliferação celular, a remodelação da matriz, a angiogênese e a regeneração tecidual. Ressalta-se que, esses eventos desempenham uma cicatrização de tecidos acelerada, devido ao desenvolvimento eficaz da neovascularização, intensificando o fechamento da ferida com rápida remodelação do tecido cicatricial e com grande redução de eventos infecciosos. (CHOUKROUN et al., 2006).
O resultado que o L-PRF proporciona é a produção de membranas com propriedades mecânicas que a rede de fibrina tem, ou seja, a membrana de fibrina obtida após a centrifugação do sangue coletado está repleta de fatores de crescimento, como o fator de crescimento transformante b (TGF-b), fator de crescimento semelhante à insulina 1 (IGF-1), fator de crescimento derivados de plaquetas (PDGF), fator de crescimento vascular endotelial (VEGF), fator de crescimento fibroblástico (FGF), fator de crescimento epidermal (EGF) e fator de crescimento epidermal derivado de plaquetas (PDGF). (KON et al, 2008).
Esses fatores de crescimento junto com o suporte da matriz de fibrina constitui o elemento determinante responsável para o potencial terapêutico da PRF. Houve um interesse em estudar o I-PRF junto do L-PRF, pelo grande potencial de reparo tecidual ósseo, a proliferação de fibroblastos, o benefício da vascularização tecidual, a formação de colágeno, a mitose de células estaminais mesenquimais e células endoteliais, assim como de osteoblastos, desempenhando papéis fundamentais na taxa e extensão de neoformação óssea (ANILKUMAR et al., 2009).
Outro ponto relevante do L-PRF é o favorecimento da angiogênese, ao melhorar a microvascularização, pois fornece uma matriz, como um suporte para que as células endoteliais sofram mudança de fenótipo. Esse processo é explicado pela estrutura tridimensional do gel de fibrina e as citocinas presas em sua malha, que induzem ao processo de angiogênese, sobretudo porque os fatores de crescimento possuem grande afinidade pela rede de fibrina. Este biomaterial é capaz de guiar a migração de células epiteliais na sua superfície, protegendo feridas abertas ao acelerar o processo de cicatrização, segundo estudo de Choukroun e colaboradores em 2006.
Além disso, os principais fatores de crescimento da angiogênese são incluídos no gel de fibrina (CHOUKROUN et al., 2006), o que segundo GUPTA et al., (2011) investigaram que uando liberados após a ativação das plaquetas aprisionadas dentro da matriz de fibrina, estimulam uma resposta mitogênica em periósteo de osso para sua reparação durante a cicatrização de feridas.
2.2. CICATRIZAÇÃO TECIDUAL
O início da cicatrização consiste em uma cascata de eventos bioquímicos, onde células trabalham de forma ordenada e traz ótimos resultados para a utilização do L-PRF. (SUZUKI, MORIMOTO & IKADA, 2013). Dentro desses eventos, pode-se citar a formação de tecido de granulação, formação da repitelização, remodelação da matriz, etc. Podemos dividir esse processo em três fases: inflamatória, proliferativa e remodeladora (CAMPOS, BORGES & GROTH, 2007).
O processo de regeneração, a famosa cascata, é iniciada a partir da liberação dos grânulos pelas plaquetas, tendo a fase inflamatória estabelecida com o aumento da vasodilatação e permeabilidade vascular. Com isso, acontece a migração dos neutrófilos, promovendo a quimiotaxia. Os neutrófilos são as primeiras células de defesa que são liberadas pelas plaquetas. Estas plaquetas também produzem radicais livres, que auxiliam na destruição bacteriana e são gradativamente substituídos por macrófagos. Estes, sendo liberados para secretar citocinas e fatores de crescimento, contribuem na angiogênese, fibroplasia e síntese de matriz extracelular (MENDONÇA & COUTINHO-NETTO, 2009)
Para o fechamento da lesão, a fase proliferativa entra em execução com quatros etapas: angiogênese, epitelização, depósito de colágeno e tecido de granulação. Na fase de remodelamento, ocorre a melhora da estrutura tecidual, reorganizando a matriz extracelular. A característica mais importante desta fase é a deposição de colágeno de maneira organizada. (AGRAWAL et al., 2014)
2.3. PROTOCOLO DE CHOUKROUN
O protocolo de Choukroun, considerado simples e acessível, pode trazer resultados diferentes pelos tipos de centrífuga, além do tempo investido nela. (CUNHA, 2018). O seu primeiro passo é a coleta sanguínea do paciente, em tubos de plástico ou de vidros secos de 10 mL, sem adição de qualquer material bioquímico, como anticoagulante. Em seguida, centrifugados a 3000 rpm (aproximadamente 400g), por 10 minutos. Em alguns minutos, ocorre a liberação da cascata de coagulação, devido ao contato do sangue com as paredes do tubo de coleta (Figura 1) .
Devido a essa liberação, o fibrinogênio concentra-se inicialmente na parte superior do tubo, até que o efeito da trombina circulante o transforme em uma rede de fibrina (DOHAN e et al., 2006). Depois disso, o coágulo é removido do tubo e os glóbulos vermelhos anexados são raspados e descartados (Figura 2). Com isso, o coágulo de L-PRF é colocado na grade da caixa de PRF para comprimi-los. Assim, a membrana de fibrina autóloga é produzida em, aproximadamente, um minuto. O I-PRF, que é coletado no fundo da caixa, pode ser usado para hidratar os materiais do enxerto (TOFLLER et al., 2009).
O sucesso dessa técnica depende da velocidade da coleta e transferência do sangue para a centrífuga, pois, se a centrifugação for muito longa, pode ocorrer uma falha, como a polimerização da fibra de maneira difusa, com um pequeno coágulo sanguíneo sem consistência. Além disso, o PRF tem característica de polimerizar naturalmente e lentamente durante a centrifugação. Dessa forma, ele possui concentrações de trombina que atua no fibrinogênio autólogo, determinando a organização tridimensional da rede de fibras, proporcionando uma membrana flexível, elástica e resistente (DOHAN et al., 2006) (Figura 3).
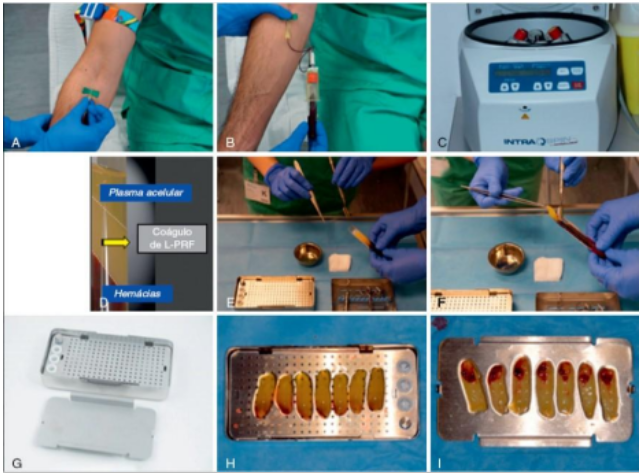
Figura 1: Preparo de coágulos e membranas de L-PRF. (A e B) Coleta do sangue. (C) Centrífuga. (D) Coágulo de L-PRF no tubo, mostrando a clara separação: hemácias no fundo, PPP (plasma pobre em plaquetas) no topo e coágulo de fibrina (L-PRF) no meio. (E e F) Separação do coágulo das hemácias e sua remoção do tubo. G) Kit especial usado para compreensão para os coágulos do L-PRF. (H) Coágulos antes de serem comprimidos. (I) Membranas de L-PRF após a compressão delicada. (Fonte: CARRANZA & NEWMAN 2020 pg. 711).
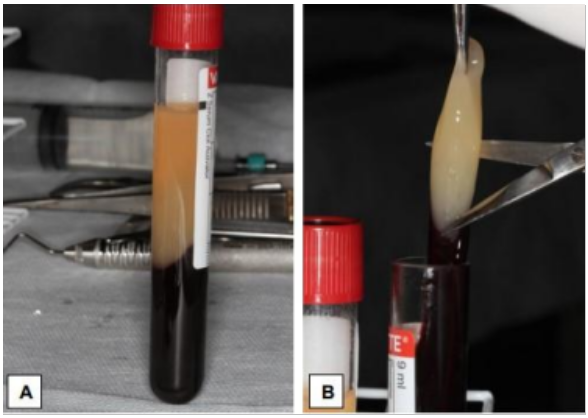
Figura 2: Membrana do L-PRF após a centrifugação. A) Observa-se as três camadas: PPP na parte de cima, de forma líquida, no centro a membrana L-PRF e no fundo as células vermelhas. (Fonte: LIMA, 2021).
Figura 3: Membrana de PRF (Fonte: ANDRÉ WEBBER, 2021).
2.4. L-PRF ASSOCIADO AO ENXERTO NA IMPLANTODONTIA
O principal objetivo da utilização do L-PRF dentro da implantodontia é na sua otimização, potencializando o aumento do tecido ósseo para a instalação de implantes (TUNALI et al., 2013). Posto que, alguns casos necessitam de procedimentos cirúrgicos prévios, para obter a espessura óssea adequada, como em casos de levantamento de seio maxilar e regeneração óssea guiada, que desenvolve um suporte adequado e de qualidade para uma maior longevidade dos implantes (SIMONPIERI et al., 2009).
Para haver uma altura satisfatória óssea na região maxilar para instalação de implantes, muitas vezes é necessário a realização de procedimento cirúrgico de levantamento do seio maxilar (CHOUKROUN et al., 2006). A membrana autóloga associada ao enxerto ósseo forma uma espécie de atadura de fibrina, oferecendo uma proteção pós-operatória considerável, além de acelerar a integração e remodelação do biomaterial enxertado (TOFFLER et al., 2009) (Figura 4).
Dentre as vantagens dessa utilização, pode-se citar: a resistência das membranas, ao permitir que o material formado seja mantido na posição e protegido, pois quando misturado ao enxerto, os seus fragmentos servem como conectores biológicos entre as partículas ósseas, exercendo força biomecânica durante o início da cicatrização. A integração dessa rede de fibrina com fragmentos ósseos facilita a migração celular, principalmente, das células endoteliais, para a angiogênese, vascularização e sobrevivência do enxerto. Dessa forma, à medida que a matriz de fibrina é absorvida, as citocinas plaquetárias encontradas são liberadas e a existência dos leucócitos e citocinas no arcabouço de fibrina desempenham um papel significativo na auto-regulação de fenômenos inflamatórios e infecciosos no material enxertado (SIMONPIERI et al., 2009).
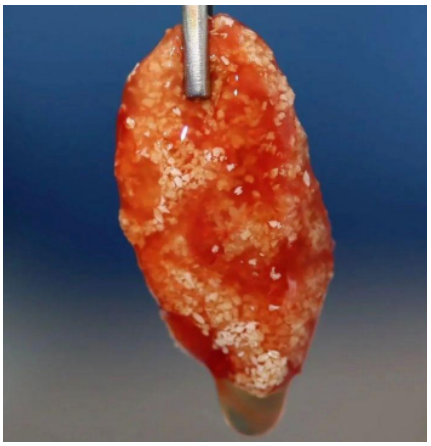
Figura 4: Enxerto ósseo associado ao material I-PRF (FONTE: ANDRÉ WEBBER, 2021)
2.5. O USO DO L-PRF NA PERIODONTIA
O tratamento da recessão gengival e do recobrimento radicular em raiz exposta por anos foi encarado como um desafio para a periodontia. A doença periodontal é uma doença infecto-inflamatória que leva à destruição dos tecidos de suporte e sustentação dos dentes, podendo, quando não tratada, levar a uma perda progressiva da aderência, do tecido ósseo e pode, possivelmente, conduzir à perda precoce dos dentes (PRADEEP et al., 2012).
A membrana de PRF, na periodontia tem sido usada para tratar recessões gengivais, defeitos intra-ósseos e lesões periapicais. Além disso, a fibrina rica em plaquetas foi utilizada como uma nova abordagem da cobertura da raiz em potencial, avaliado pela cobertura localizada da recessão gengival em dentes anteriores inferiores, usando a combinação de técnica de retalho posicionado lateralmente e membrana PRF (AGRAWAL et al., 2014).
O estudo de Anilkumar et al., (2009), relata que o tratamento da recessão gengival objetiva atingir a completa cicatrização e a regeneração da unidade periodontal. A manutenção dos tecidos moles forma a principal barreira de defesa do tecido contra uma infecção bacteriana, a fim de proteger e manter a dentição natural do paciente que apresenta uma crescente demanda estética, favorecendo também o conforto e manutenção da função. Dentre os procedimentos para tratamento da recessão gengival, o uso da técnica bilaminar, que utiliza enxerto de tecido conjuntivo subepitelial, ainda é responsável pelos resultados mais favoráveis em termos de recobrimento da raiz.
O uso da PRF objetivando a cobertura da raiz, pode diminuir a necessidade de adquirir tecido conjuntivo local, que deixa o sítio de doação com morbidade. O enxerto gengival livre é uma das técnicas mais utilizadas quando pretende-se aumentar as dimensões dos tecidos queratinizados, entretanto deixam locais doadores cicatrizarem por segunda intenção, o que requer um tempo de recuperação maior sendo mais desconfortável para o paciente (ARAVINDAKSHA et al., 2013).
2.6. EXTRAÇÃO DENTÁRIA E ASSOCIAÇÃO DO L-PRF
Para um volume ósseo adequado, é recomendado adicionar biomaterial no local da extração realizada. Quando utilizada, nessas situações, o L-PRF potencializa a formação do coágulo sanguíneo, de modo que o processo fisiológico de cicatrização é favorecido. É, particularmente, determinante a utilização em sítios com infeção e em pacientes com condições médicas sistêmicas, que possam comprometer o processo de cicatrização: diabéticos, pacientes medicados com imunossupressores ou anticoagulantes (DEL CORSO, TOFFLER & DOHAN, 2010).
Agrawal et al., (2014), apresenta a membrana PRF como material de preenchimento das cavidades de extração, que vai atuar como um coágulo de sangue estável para neovascularização e regeneração tecidual acelerada. Choukroun et al., (2006) relata um caso onde foi utilizado o L-PRF para preenchimento do alvéolo após extração. Observou-se a rápida formação de coágulo e cobertura epitelial, além da cura da ferida sem dor ou complicações purulentas. Graças a neovascularização inicial, novas células são levadas até o local da ferida e ficam presas pela malha de fibrina, transformando-se em um fenótipo secretor que induz a restauração vascular e de tecidos, importante para a neoformação óssea.
Manter o volume ósseo em sítios pós-avulsão ou extração é um dilema, pois a perda volumétrica que ocorre atrapalha a estética e a implantação. Os materiais de preenchimento, normalmente, não oferecem as condições necessárias para reabsorção e remodelação óssea, dificultando a sua regeneração e a neovascularização. Há também a dificuldade em manusear o tecido mole sobre o enxerto, uma vez que, habitualmente é necessário realizar incisões de relaxamento, com o intuito de recobrir e proteger o material enxertado, objetivando uma menor perda do material.
O L-PRF pode ser usado também como uma membrana para regeneração óssea guiada, onde a arquitetura tridimensional forte e elástica atua como uma tela suturável que cobrirá e estabilizará o material enxertado, protegendo o material e a própria ferida em si, permitindo a aproximação dos bordos gengivais e, consequentemente, favorecendo a sua reepitelização. Sendo assim, a aceleração do processo de cura torna o local cirúrgico menos sensível às agressões, reduzindo a sensibilidade pós-operatória e atuando a favor da estética (DEL CORSO, TOFFLER & DOHAN, 2010).
11. METODOLOGIA
Foi realizada uma revisão de literatura integrativa utilizando como base bibliografias e artigos científicos, do tipo estudos clínicos, publicados de 2020 até 2022, sendo estes em língua inglesa e portuguesa.
As buscas foram feitas nas bases de dados Pubmed e Medline. Com a utilização de palavras chaves: “fibrin rich plasm”; “L-PRF”; “bone graft and L-PRF”; “L-PRF” e “Platelet-rich and leukocyte fibrin” para sua obtenção.
Como critérios de inclusão, foram considerados os ensaios clínicos controlados, randomizados ou não, sobre o uso do L-PRF nas diversas áreas da Odontologia, entre os anos de 2020 a 2022. O estudo base sobre o PRF para nortear a realização deste trabalho, foi o de Choukroun, tendo data de publicação de 2006. Os critérios de exclusão foram os estudos de revisões sistemática com ou sem meta-análise, in vitro e aqueles que aplicaram o L-PRF em outras áreas fora da Odontologia. A finalidade dessas buscas foi reunir um número possível de dados para a melhor exposição da eficácia do uso das propriedades do L-PRF e sua aplicabilidade na Odontologia.
12. RESULTADOS
Foram selecionados 11 estudos, submetidos a intervenções com uso de L-PRF, encontrados no PubMed, sendo este a principal base de dados utilizada (Tabela 1). . Dos estudos encontrados, observou-se que o L-PRF auxilia e acelera a cicatrização, diminuindo a dor e, também, o edema, proporcionando maior regeneração óssea e redução do defeito ósseo do rebordo alveolar (ARAVENA et al., 2020; GASPARRO et al., 2020). Além disso, dois não apresentaram melhoras, no qual não foi observado mudanças significativas entre a utilização e não utilização do L-PRF no alvéolo após extração dentária e no recobrimento de retalho, quanto a sondagem da inserção clínica exemplificado com a furca grau II (BOZKURT & USLU, 2022; SERRONI et al., 2022).
O estudo Reyes et al., (2020) aponta a diminuição da distalização na mudança da inclinação dos caninos superiores no grupo que foi usado o L-PRF. Enquanto os estudos de Paolantonio et al., (2020); Aldana et al., (2021) e Tadepalli et al., (2022), apontam que o uso do L-PRF sozinho para tratamento de recessões gengivais não traz resultados estatisticamente relevantes quanto a sua utilização, os resultados mostram que ele associado a técnica de enxerto autógeno traz bons efeitos.
Na mesma proporção, Rexhepi et al., (2021) e Harlos et al., (2022) comparam o L-PRF associado ao enxerto ósseo xenógeno com o uso de membrana de colágeno com o enxerto ósseo bovino, para a melhora da formação óssea em regiões com perdas de extrações de longa data. Com isso, observou-se que os outros enxertos demonstram maiores melhorias que o L-PRF.
E dentre os selecionados um estudo fez a escolha do L-PRF na endodontia para uso em dentes necróticos, com objetivo da reparação óssea periapical e auxílio de desenvolvimento posterior. É uma opção de tratamento viável, porém sem diferença significativa. No entanto, todos sugerem estudos clínicos e duradouros sobre o assunto para obter mais eficácia e confiabilidade para o uso do L-PRF.
Tabela 1. Estudos encontrados sobre o potencial do L-PRF na área da odontologia a partir da busca bibliográfica.
Autor/ano Objetivo Resultados Conclusão Gasparro R. et al, 2020. Avaliar a redução da perda de inserção clínica na face distal do segundo molar após a extração do terceiro molar e aplicação de fibrina rica em leucócitos e plaquetas (L-PRF). Após 6 meses, a alteração média do nível de inserção clínica (CAL) foi de 1,99 ± 1,18 mm no grupo teste e 1,15 ± 1,01 mm no grupo controle; a alteração da profundidade de sondagem foi de 1,33 ± 0,87 mm no grupo teste e 0,50 ± 0,63 mm no grupo controle. Os locais tratados por meio da aplicação de L-PRF após a extração de terceiros molares impactados apresentaram melhores resultados em termos de ganho de níveis de inserção clínica e redução da profundidade de sondagem quando comparados aos locais de controle. Avarena et al., 2020 Determinar a eficácia do uso de preenchimento L-PRF versus cicatrização natural de coágulo sanguíneo na preservação do rebordo alveolar, de acordo com as medidas clínicas, radiográficas e volumétricas dos alvéolos dentários pós-extração. As medidas de cicatrização de feridas e comprimento, profundidade e diferença de formação óssea foram semelhantes para ambos os grupos de estudo nos tempos inicial e final. O preenchimento com L-PRF mostrou o mesmo comportamento dimensional e volumétrico que a cicatrização normal de coágulos sanguíneos na preservação do rebordo alveolar de alvéolos dentários após a extração. Paolantonio M. et al.,2020 Verificar se uma combinação de leucócitos e fibrina rica em plaquetas (L-PRF) + enxerto ósseo autógeno (ABG) pode ser uma modalidade de tratamento clinicamente “não inferior” em comparação com a associação de esmalte derivado de matriz (EMD) com ABG no gerenciamento de defeitos intraósseos (IBDs). Depois de 12 meses de estudos , as cirurgias em ambos os locais de teste e controle, sem diferenças intergrupos para cada medição. Os resultados sugerem que o tratamento combinado L-PRF+ABG de IBDs não contidos produz resultados não inferiores em termos de ganho de CAL, redução de PPD, aumento de recessão gengival e ganho de nível ósseo em comparação com a combinação EMD+ABG. Reyes Pacheco A.A et al., 2020 Avaliar a taxa de distalização e as mudanças na inclinação dos caninos superiores em alvéolos preservados com membranas de fibrina rica em plaquetas (L-PRF)em pacientes adultos. Quatro dos sujeitos desistiram do estudo, deixando um total de 17 pacientes (n = 17). A taxa de distalização e inclinação dos caninos foram maiores no lado controle do que no lado tratado com L-PRF (P<0,05). Uma correlação fraca foi encontrada entre a taxa de distalização e a inclinação dos caninos para ambos os lados (lado controle, ρ = 0,17; experimental, ρ =0,11). O uso de L-PRF em pacientes adultos jovens diminuiu a taxa de distalização e mudanças na inclinação dos caninos superiores em comparação com o grupo controle. Meschi et al., 2021 Avaliar o impacto da fibrina rica em leucócitos e plaquetas(L-PRF) em procedimentos endodônticos regenerativos(REPs) de dentes permanentes imaturos em termos de reparação óssea periapical (PHB) e posterior desenvolvimento(RD). PBH completo foi obtido em 91,3% e 87% dos casos com base na avaliação qualitativa e quantitativa da RP, respectivamente, sem diferença significativa entre os grupos em relação à linha de base. A mudança quantitativa PR em RD na última sessão de recordação em relação à linha de base não foi significativa (todos os valores de P 0,05) em ambos os grupos. A avaliação qualitativa do tipo de cicatrização REP não foi uniforme. O REP e L-PRF (unidos) parece ser uma opção de tratamento viável para obter PBH e auxiliar na RD de dentes permanentes imaturos necróticos. Aldana et al., 2021 Comparar as membranas de fibrina rica em leucócitos e plaquetas (L-PRF) com um enxerto de tecido conjuntivo(CTG) em combinação com um retalho avançado coronalmente(CAF) no tratamento recessões gengivais localizadas Classe I ou II de Miller. Ambos os tratamentos apresentaram melhorias significativas na recessão gengival (RD), largura da recessão gengival (RW) e nível de inserção clínica (CAL) em 1, 3 e 6 meses. CTG alcançou um recobrimento radicular (RC) significativamente maior em 1, 3 e 6 meses e uma pontuação no escore estético de recobrimento radicular(RES) significativamente maior em 6 meses. L-PRF apresentou um escore de dor significativamente menor e menos complicações pós-operatórias. Ambas as estratégias foram eficazes para o tratamento de recessões gengivais localizadas. O CTG obteve maior RC e resultados estéticos, e o L-PRF teve menos dor e complicações pós-cirúrgicas. Rexhepi et al., 2021 Demonstrar que um enxerto ósseo bovino inorgânico (IBB) em combinação com uma fibrina rica em leucócitos e plaquetas (L-PRF) não é inferior a uma combinação com uma membrana de colágeno (CM) ao gerenciar defeitos infra ósseos desfavoráveis. Doze meses após a cirurgia, uma melhora significativa dos parâmetros clínicos e radiográficos foi observada em ambos os locais experimentais. O tratamento L-PRF+IBB de IBDs desfavoráveis oferece eficácia não inferior para ganho de inserção clínica, mostrando menos recessão gengival e mais ganho de nível ósseo também, enquanto para redução de profundidade da sondagem é inferior ao tratamento CM+IBB. Harlos et al., 2022 A avaliação histológica do comportamento de diferentes materiais de enxerto em seios maxilares largos, a uma altura de 8 a 10 mm do rebordo alveolar, combinados com remanescentes ósseos menores que 3 mm. O L-PRF produz poucas vantagens em relação à formação de osso novo nos seios maxilares largos. Em seios maxilares com grandes cavidades antrais, osso autógeno combinado com osso xenógeno parece demonstrar melhor remodelação do enxerto e melhorar a formação óssea, em comparação com a adição de L-PRF. Bozkurt et al., 2022 Avaliar o efeito da aplicação de fibrina rica em plaquetas (PRF), fatores de crescimento concentrados (CGF) e cola de fibrina autóloga (AFG) na cicatrização precoce de feridas após operações de gengivectomia e gengivoplastia. Observou-se que o uso do concentrado de plaquetas no dia 7 reduziu a dor precoce pós-operatória. Os pacientes ficaram muito satisfeitos com a estética pós-operatória. Após as operações de gengivectomia e gengivoplastia, a aplicação de PRF, CGF e AFG apresentou efeitos positivos na cicatrização de feridas. No entanto, as aplicações de PRF, CGF e AFG não foram superiores entre si em termos de cicatrização secundária de feridas. Tadepalli et al.,2022 Comparar a eficácia clínica da fibrina rica em plaquetas leucocitária (L-PRF) e da fibrina rica em plaquetas avançada (A-PRF) em combinação com retalho avançado coronalmente(CAF) no tratamento de defeitos de recessão gengival. Ganho estatisticamente significativo em CAL, WAG e KTH*. Foi observado em ambos os grupos terapêuticos (p < 0,05). A análise intergrupo não revelou diferenças estatisticamente significativas entre os parâmetros do estudo entre os grupos em nenhum momento (p > 0,05). Com base nos achados deste estudo, tanto o L-PRF quanto o A-PRF podem ser sugeridos como opções de tratamento viáveis para o manejo da recessão gengival na maxila. Serroni M. et al., 2022 Avaliar o benefício adicional da fibrina rica em leucócitos e plaquetas (L-PRF) aos enxertos ósseos autógenos (ABGs) no tratamento do envolvimento de furca, grau II, em molar mandibular, comparando os resultados clínicos com os tratamentos de desbridamento de retalho aberto. Todas as terapias demonstraram uma significância e melhora tanto clínica quanto radiológica. A adição de L-PRF ao ABG produz um ganho de HCAL (Inserção horizontal) significativamente maior e redução de PD (profundidade da sondagem).
* Legenda: CAL: nível clínico de inserção; WAG: Largura de gengiva inserida; KTH: Altura do tecido queratinizado
13. DISCUSSÃO
O L-PRF melhora a cicatrização devido a sua capacidade de regular a inflamação e estimular o processo imunológico da quimiotaxia. A fibrina de L-PRF é constituída por junções ligadas que induz uma rede de fibrina flexível a promover a liberação gradual de fatores de crescimento e migração de leucócitos, além de induzir o processo de formação de capilares (MARENZI et al., 2015).
Junto a isso, também secreta citocinas pró-inflamatórias, dos tipos interleucinas 1 beta (IL-1b), interleucinas 6 (IL-6) e fatores de necrose tumoral alfa (TNF- α), que estimulam várias funções biológicas, como quimiotaxia, angiogênese, proliferação, diferenciação e modulação. Esse processo foi corroborado nos estudos de Ratajczak et al., (2018).
Choukroun et al., (2006) retrata o L-PRF como um concentrado autólogo de plaquetas, com uma malha de fibrina polimerizada que contém leucócitos e citocinas. Estas, ativam o sistema vascular e a angiogênese, contendo também moléculas bioativas concentradas que liberam fatores de crescimento como PDGF, TGF, IGF e VEGF que estão envolvidos na cicatrização.
As plaquetas também fornecem peptídeos de sinalização que atraem células de macrófagos. Para o aumento do assoalho do seio maxilar, a utilização do PRF combinada com aloenxerto ósseo liofilizado pareceu acelerar a cicatrização óssea, reduzindo o tempo de cicatrização para 4 meses antes da colocação do implante (CHOUKROUN et al., 2006). Assim como na série de casos, o L-PRF utilizado como preenchimento único no levantamento de seio maxilar e na reabilitação oral com implantes, parece ser eficaz, promovendo cicatrização óssea natural e estabilidade aos implantes (SIMPONIERI et al., 2009).
Os ensaios clínicos randomizados de Gasparro et al., (2020) e Avarena et al., (2020), mostraram que a utilização do L-PRF é capaz de reduzir os defeitos do rebordo alveolar, proporcionando uma maior preservação. O estudo de Tadepalli (2022) o uso do L-PRF nas recessões gengivais não traz um resultado ao ponto de substituir o enxerto gengival, e com isso, esta técnica ainda é considerada padrão-ouro para aumento e largura de mucosa queratinizada.
14. CONSIDERAÇÕES FINAIS
A revisão em questão demonstrou que existe uma ampla possibilidade de aplicações do L-PRF na Odontologia, com excelentes resultados a curto prazo, apoiados por diversos estudos já publicados, relatando a segurança no seu uso para aplicação oral e maxilofacial.
Dentre suas características, a hemostasia e o suporte do sistema imune contribuem para seu sucesso e real efetividade na diminuição da morbidade em procedimentos cirúrgicos. Ademais, possui um padrão cicatricial muito significativo, com bom funcionamento na fase inicial da cicatrização, estabelecendo uma recuperação mais rápida, melhorando o pós-operatório.
A literatura científica evidencia a eficácia do L-PRF, no entanto, são necessários mais estudos que demonstrem o papel do PRF durante a regeneração do tecido duro, para que estas novas abordagens possam assegurar a viabilidade clínica e a efetividade na cicatrização óssea. Por sua vez, parece esclarecido que a matriz de fibrina, devido à própria estrutura tridimensional, facilita a migração celular, estando relacionada com um maior aprisionamento e melhor distribuição das células, o que leva a um bom potencial na liberação de fatores de crescimento. Entretanto, é preciso mais estudos para que novos procedimentos tragam precisão na atuação clínica e benefícios para o paciente, agregando qualidade de vida e confiabilidade ao Cirurgião-Dentista.
REFERÊNCIAS
AGARWAL, Ashis et al. Platelet Rich Fibrin in Combination with Decalcified Freeze Dried Bone Allograft for the Management of Mandibular Degree II Furcation Defect: A randomized Controlled Clinical Trial. Singapore Dent J, v. 39, n. 1, p. 1–8, 2020.
ALDANA, Catherine Andrade et al. Leukocyte- and Platelet-Rich Fibrin Versus Connective Tissue Graft for a Coronally Advanced Flap in the Treatment of Miller Class I and II Localized Gingival Recessions: A Randomized Controlled Clinical Trial. Int J Periodontics Restorative Dent, v. 41, n. 6, p. 287–296, 2021.
ARAVENA, Pedro Christian et al. Leukocyte and Platelet-Rich Fibrin Have Same Effect as Blood Clot in the 3-Dimensional Alveolar Ridge Preservation. A Split-Mouth Randomized Clinical Trial. J Oral Maxillofac Surg, v. 79, n. 3, p. 575–584, 2021.
ARAVINDAKSHA, Shyam Prasad et al. Use of platelet rich fibrin (PRF) membrane as palatal bandage. Clin Adv Periodontics, v. 4, n. 4, p. 246–250, 2014.
ANILKUMAR, Kanakamedala. et al. A novel root coverage approach. J Indian Soc Periodontol, v. 13, n. 1, p. 50-54, 2009.
BOZKURT Esra; USLU Mustafa. Evaluation of the effects of platelet-rich fibrin, concentrated growth factors, and autologous fibrin glue application on wound healing following gingivectomy and gingivoplasty operations: a randomized controlled clinical trial. Quintessence Int, v.53, n. 4, p. 328-341, 2022.
CAMPOS, Antonio Carlos Ligoki; BORGES-BRANCO, Alessandra; GROTH, Anne Karoline. Cicatrização de feridas. ABCD Arq Bras Cir Dig, v. 20, n. 1, 2007. p. 51-58, 2007.
CARRANZA, G.; NEWMAN, M. Newman e Carranza – Periodontia Clínica. Ed 13º. Rio de Janeiro: Guanabara Koogan, 2020.
CHOUKROUN, Joseph et al. Une opportunité en paro‐implantologie: Le PRF. Implantodontie, v.42, p. 55-62,2001.
CUNHA, V. P. M. Uma nova tendência de regeneração tecidular. Tese. Instituto Universitário de Ciência da Saúde, Gandra, PRD, p. 2018.
DEL CORSO, Marco; TOFFLER, Michael; DOHAN EHRENFEST, David. Use of an Autologous Leukocyte and Platelet-Rich Fibrin (L-PRF) Membrane in Post-Avulsion Sites: An Overview of Choukroun’s PRF. The Journal of Implant & Advanced Clinical Dentistry, v. 1, n. 9, p. 27-35, 2010.
DOHAN, David et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part II: platelet-related biologic features. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v. 101, n. 3, p. 45-50, 2006.
DRAGONAS, Panagiotis et al. Effects of leukocyte-platelet-rich fibrin (L-PRF) in different intraoral bone grafting procedures: a systematic review. Int J Oral Maxillofac Surg, v. 48, n. 2, p. 250–262, 2019.
GASPARRO, Roberta et al. Treatment of periodontal pockets at the distal aspect of mandibular second molar after surgical removal of impacted third molar and application of L-PRF: a split-mouth randomized clinical trial. Quintessence Int, v. 51, n. 3, p. 204–211, 2020.
GUPTA, Vivek et al. Regenerative Potential of Platelet Rich Fibrin in Dentistry: Literature Review. Asian Journal of Oral Health & Allied Sciences, v.1, n. 1, p. 22–28, 2011
HARLOS, Mauricio Marcelo et al. Histomorphometric evaluation of different graft associations for maxillary sinus elevation in wide antral cavities: a randomized controlled clinical trial. Clinical oral investigations, v. 26, n. 8, p. 1–9, 2022.
KON, Elizaveta. et al. Platelet-rich plasma: new clinical application: a pilot study for treatment of jumper’s knee. Injury, v. 40, n. 6, p. 598–603, 2008.
LIMA, V.C.S. A utilização de membranas de l-prf junto à instalação de implantes unitários em área anterior de maxila: estudo clínico randomizado. Dissertação -UNESP. São José dos Campos, p. 45, 2020.
MARENZI, Gaetano et al. Influence of Leukocyte- and Platelet-Rich Fibrin (L-PRF) in the Healing of Simple Postextraction Sockets: A Split-Mouth Study. Biomed Res Int, p. 369273, 2015.
MENDONÇA, Ricardo José de; COUTINHO-NETTO, Joaquim. Aspectos celulares da cicatrização. An Bras Dermatol, v. 84, n. 3, p. 257–262, 2009.
MESCHI, Nastaran et al. Regenerative Endodontic Procedure of Immature Permanent Teeth with Leukocyte and Platelet-rich Fibrin: A Multicenter Controlled Clinical Trial. J Endod, v. 47, n. 11, p. 1729–1750, 2021.
PRADEEP, Avani R et al.. Comparative evaluation of autologous platelet-rich fibrin and platelet-rich plasma in the treatment of 3-wall intrabony defects in chronic periodontitis: a randomized controlled clinical trial. J Periodontol, v. 83, n. 12, p. 499-507, 2012.
PONTE, J. S. Avaliação histomorfométrica de alvéolos dentários humanos pós-extração tratados com fibrina autóloga, fosfato de cálcio bifásico ou sua associação. Dissertação – Universidade Federal do Ceará, Sobral, CE, 86p, 2020.
PAOLANTONIO, Michele et al. Periodontal regeneration by leukocyte and platelet-rich fibrin with autogenous bone graft versus enamel matrix derivative with autogenous bone graft in the treatment of periodontal intrabony defects: A randomized non-inferiority trial. J Periodontol, v. 91, n. 12, p. 1595-1608, 2020.
RATAJCZAK, Jessica et al. Angiogenic Properties of ‘Leukocyte- and Platelet-Rich Fibrin’. Sci Rep, v.8, n. 1, p. 14632, 2018.
REXHEPI, Imena et al. Efficacy of inorganic bovine bone combined with leukocyte and platelet-rich fibrin or collagen membranes for treating unfavorable periodontal infrabony defects: Randomized non-inferiority trial. J Periodontol,v. 92, n. 11, p. 1576–1587, 2021.
REYES PACHECO, Ariel Adriano et al. Distalization rate of maxillary canines in an alveolus filled with leukocyte-platelet-rich fibrin in adults: A randomized controlled clinical split-mouth trial. Am JOrthod Dentofacial Orthop, v.158, n. 2, p. 182-191, 2020.
SERRONI, Matteo et al. Added benefit of L-PRF to autogenous bone grafts in the treatment of degree II furcation involvement in mandibular molars. Journal of periodontology v. 93, n. 10, p.1486–1499, 2022.
SIMONPIERI, Alain et al. The relevance of Choukroun’s platelet-rich fibrin and metronidazole during complex maxillary rehabilitations using bone allograft. Part I: a new grafting protocol. Implant Dent, v. 18, n. 2, p. 102-111, 2009.
SUZUKI, Shuko; MORIMOTO, Natsumi; IKADA, Yoshito. Gelatin gel as a carrier of platelet-derived growth factors. Journal of Biomaterials Applications, v.28, n.4, p. 1-12 2013.
TADEPALLI, Anupama et al. Comparative Evaluation of Clinical Efficacy of Leukocyte-Rich Platelet-Rich Fibrin with Advanced Platelet-Rich Fibrin in Management of Gingival Recession Defects: A Randomized Controlled Trial. Med Princ Pract, v. 31, n. 4, p. 376-383, 2022.
TOFFLER, Michael. et al. Introducing Choukroun’s platelet rich fibrin (PRF) to the reconstructive surgery. Milieu, The Journal of Implant & Advanced Clinical Dentistry, v. 1, n. 6, p. 21-31, 2009.
TUNALI, Mustafa et al. Clinical Evaluation of Autologous Platelet-Rich Fibrin in the Treatment of Multiple Adjacent Gingival Recession Defects: A 12-Month Study. Int. J. Periodontics Restor. Dent, v. 35, p. 105–114, 2015.
XU, Jian.et al. .Platelet-Rich Plasma and Regenerative Dentistry. Aust Dent J, v. 65, n. 2, p. 131-142, 2020.
¹Cirurgiã-dentista pela Faculdade de Enfermagem Nova Esperança (FACENE)
e-mail: amandafpa.18@gmail.com.
²Cirurgião-dentista pela Faculdade de Enfermagem Nova Esperança (FACENE).
³Docente do curso de Odontologia da Faculdade de Enfermagem Nova Esperança (FACENE).
4Docente do curso de Odontologia da Faculdade de Enfermagem Nova Esperança (FACENE). Doutora em Ciências Odontológicas (UFRN).
e-mail: mayragomes89@gmail.com.
