in silico TOXICITY PREDICTING OF POTENTIAL ENZYME INHIBITANT CUMARIN ANALOGS FOR ALZHEIMER’S DISEASE TREATMENT
REGISTRO DOI: 10.5281/zenodo.7793446
João Victor de Sousa Coutinho1
Juliana de Sousa Coutinho2
RESUMO
A doença de Alzheimer (DA) consiste na principal causa de demência, acometendo a população geriátrica. Grandes avanços foram estabelecidos quando se diz respeito a formas de tratamento dessa patologia, todavia, na ausência de uma cura se faz necessário a permanência de estudos visando desenvolver novos medicamentos com potencial de bloquear enzimas associadas a DA. Os compostos derivados de cumarinas demonstraram
significativo poder terapêutico em estudos in silico, in vivo e in vivo em fases pré cínicas. O objetivo desse estudo consistiu em avaliar o perfil toxicológico desses análogos em potencial. Para isso, foram utilizadas ferramentas de modelagem molecular e triagem farmacológica e toxicológica, por meio das bases Marvin e ADMETlab, respectivamente, utilizando compostos descritos na literatura. Com isso, foi possível notar que todos os protótipos apresentaram um valor significativo de dano cardíaco, o que pode representar riscos por conta dos comprometimentos geriátricos em níveis fisiológicos e bioquímicos. A mesma aplicação quanto aos aspectos hepáticos é dimensionada, aplicada aos protótipos B, C, D, E, e G, e apenas o A apresentou perfil de danos carcinogênicos. Portanto é possível concluir a primordialidade de testes mais avançados focados nos riscos de hepatotoxicidade e de danos cardíacos.
Palavras-Chaves: Doença de Alzheimer, cumarinas, toxicologia e triagem in silico.
ABSTRACT
Alzheimer’s disease (AD) is the leading cause of dementia, affecting the geriatric population. Great advances have been established when it comes to treatment of this pathology, however, in the absence of a cure it is necessary to continue studies to develop new drugs with the potential to block enzymes associated with
AD. Coumarin-derived compounds have shown significant therapeutic power in in silico, in vivo and in vivo pre-clinical studies. The aim of this study was to evaluate the toxicological profile of these potential analogues. To this end, molecular modeling tools and pharmacological and toxicological screening were used, through the bases Marvin and ADMETlab, respectively, using compounds described in the literature. With this, it was possible to note that all prototypes presented a significant value of cardiac damage, which may represent risks because of geriatric impairments at physiological and biochemical levels. The same application regarding liver aspects is scaled, applied to prototypes B, C, D, E, and G, and only A presented a carcinogenic damage profile. Therefore, it is possible to conclude the primordiality of more advanced tests focused on the risks of hepatotoxicity and cardiac damage.
Keywords: Alzheimer’s disease, coumarins, toxicology and in silico screening.
1. INTRODUÇÃO
A doença de Alzheimer (DA) consiste na principal causa de demência presente na contemporaneidade. Diversos são os fatores associados a gênese dessa patologia, indo desde questões genômicas a influências multifatoriais, e tais multifatoriedades propiciam a oxidação e a inflamação dos sistemas neuronais, a deposição proteica de β-amilóide, e a redução da atividade colinérgica (SERRANO-POZO; GROWDON, 2019).
Esses processos tendem a ser cumulativos, até em determinado momento gerar o acometimento das estruturas presentes no sistema nervoso central superior, iniciando o processo de degeneração. Tendo em vista a postergação da expectativa de vida do ser humano, é possível realizar uma projeção de um drástico aumento nos casos da DA, bem como de outras doenças neurodegenerativas (ESQUERDA-CANALS et al., 2017).
Na eminencia desse cenário, torna-se necessário o desenvolvimento de medidas terapêuticas que contribuam no controle da DA, visando evitar o agravo drástico, e um prognóstico desfavorável. A inexistência de uma cura para essa neuropatologia intensifica a primordialidade de estudos no campo químico medicinal, que auxiliem no desenvolvimento de potenciais fármacos que atuem sobre os mecanismos fisiopatológicos dessa enfermidade (CAÑIZARES CARMENATE et al., 2022).
Nesse contexto, ao longo dos anos, diversos pesquisadores desenvolveram análogos estruturais a partir da cadeia heterocíclica de cumarinas, denominada de 1,2 Benzopirona, que pode ser visualizada na figura 01. Esse composto é biossintetizado em diversas rotas metabólicas secundárias no reino vegetal, todavia alguns fungos e bactérias também possuem a habilidade de sintetiza-las, ao passo que na atualidade existam cerca de 1300 tipos de cumarinas oriundas de fontes naturais (FRANCO et al., 2021).
FIGURA 01: Estrutura base de cumarinas
Os metabólitos secundários vegetais são gerados por meio de um desenvolvimento adaptativo, que caracteriza uma vantagem evolutiva da espécie, permitindo que essa reaja a meios de estresse e defenda-se de potenciais predadores e danificadores. No caso das cumarinas, há uma atribuição dupla na bioquímica e fisiologia das plantas, onde essas moléculas atuam como antioxidantes e/ou como inibidores enzimáticos, evitando o desencadeamento de acometimentos nas estruturas vegetais.
Essas atribuições vem sendo estudadas e adaptadas para a aplicação sobre patologias humanas, e para tal, uma série de análogos estruturais foram desenvolvidos, e dentre as enfermidades com viabilidade de aplicação dessas moléculas está a DA. Essas têm demonstrado, in silico e in vitro, efeito inibidor sobre a acetilcolinesterase (AChE) e a butirilcolinestere (BuChE), que são as enzimas responsáveis pela a degradação do neurotransmissor acetilcolina (ACh). Com a inibição há um aumento na oferta de ACh na região da fenda sináptica, reduzindo desregulações químicas que induzem e potencializam a DA (CARNEIRO et al., 2021).
O objetivo da presente pesquisa consiste em avaliar a predição in silico de toxicidade de análogos cumarínicos descritos na literatura, e analisar a viabilidade de aplicação desses na terapêutica clínica, passando anteriormente por testes in vitro e in vivo pré clínicos.
2. METODOLOGIA
A presente obra caracteriza-se como um estudo experimental e descritivo, de caráter quali-quantitativo. Para o seu desenvolvimento utilizou-se programas computacionais, sendo o MARVIN®, da Chemaxon, para o desenho das estruturas estudadas e a obtenção do sorriso canônico dessas, e a plataforma ADMETlab® para predizer o perfil toxicológico e físico-químico desses compostos. Dos muitos perfis de toxicidade possíveis de serem analisados, selecionou-se três de maior relevância, tendo em vista a realidade fisiológica da maioria dos pacientes que possuem a DA.
O primeiro parâmetro a ser analisado consiste na capacidade de atuação dessas moléculas como bloqueadores hERG, podendo desencadear arritmias cardíacas, e em casos graves a síndrome do QT longo, que pode gerar uma irregularidade a nível fatal. O segundo é o DILI que permite avaliar o potencial de gênese e agravo de danos hepáticos por conta do uso dessas substâncias. Por fim, o terceiro é a toxicidade AMES, que indica a viabilidade de ocorrerem mutações no material genético do tipo frameshift ou o desdobramento de substituição dos pares de base, e com isso o desenvolvimento de carcinomas.
Foram selecionadas moléculas que demostraram atividade in silico e in vivo, em fase pré clínica contra as enzimas a AChE e a BuChE, nos ensaios computacionais relatados na literatura. Para a revisão literária foram utilizadas trabalhos indexadas em bases de dados consolidadas, como PUBMED, PUBCHEM, DROGBANK, SciELO e demais bases informacionais. Para isso, foram utilizados os seguintes descritores “Coumarins”; “Alzheimer Disease” “Geriatrics”, todos devidamente padronizados como descritores em saúde (DeCS). Ao todo foram encontrados 43 artigos, desses 7 possuíam maior relevância pra a aplicação de revisão.
Como critério de inclusão foram admitidos artigos que possuíssem datas de publicação igual ou posterior ao ano de 2010, contendo os descritores ou termos similares em seus títulos e/ou resumos. Foram descartadas revisões narrativas, isentas de metodologia, e com problemas estruturais em seus métodos de obtenção de dados e experimentos.
3. RESULTADOS E DISCUSSÃO
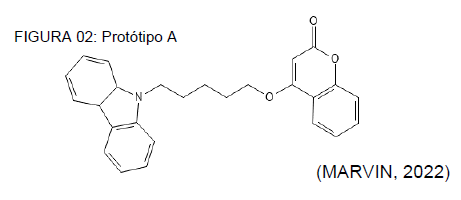
A primeira molécula analisada, o protótipo A, pode ser visualizada na figura 02, que segundo Franco e seus colaboradores (2021) possui um maior poder de interação com a AChE, atuando nos receptores CAS e o PAS. Esse processo gera uma maior potência inibitória. Ao avaliar os perfis de toxicidade foi notório uma probabilidade entre 70% e 90% dessa molécula desencadear irregularidades cardio-arrítmicas, e tendo em vista muitos dos pacientes com a DA possuem problemas e fragilidades cardiovasculares é de suma importância a avaliação de dosagem em estudos subsequentes, para a aplicação pré e clínica.
Quanto ao perfil de toxicidade hepática há um probabilidade entre 30% e 50%, o que é considerado relativamente moderado, e com o provável ajuste de dosagem por conta dos danos cardíacos esse perfil hepático pode mitiga-se e oferecer poucos riscos, todavia é essencial que o índice terapêutico em humanos seja efetivo sem gerar possíveis danos toxicológicos.
Um fator preocupante nessa análise está justamente ligado ao potencial carcinogênico desse protótipo, possuindo esse uma porcentagem provável entre 90% e 100%, e novamente o fator de risco decorrente da idade torna-se algo preocupante, havendo a necessidade de avaliar a dosagem efetiva para testes clínicos, como demonstra Bednarczuk et al (2010). Os dados referentes as análises toxicológicas podem ser visualizadas no quadro 01.
QUADRO 01: Avaliação toxicológica do protótipo A
PERFIL ANALÍTICO AVALIAÇÃO DE TOXICIDADE Bloqueadores hERG + + (70% – 90%) DILI – (30% – 50%) Toxicidade AMES + + + (90% – 100%)
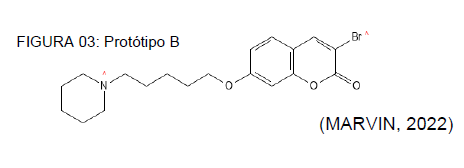
O protótipo B, C e D e E foram desenvolvido e testado in silico por Franco et al (2021), e demonstrou ação sobre a AChE e a BuChE, em testes in vitro. O protótipo B pode ser vislumbrado na figura 03, onde evidenciou-se um alto índice de probabilidade de agir bloqueando os receptores hERG, entre 90% e 100%, oferecendo riscos significativos para a saúde, e que dependendo do índice terapêutico apresentarão uma inviabilidade clínica.
Os danos hepáticos apresentaram a mesma faixa de probabilidade, o que comprometeria muitos processos metabólicos, já defasados no estado geriátrico como Mello et al (2022) demostram em sua obra. Um ponto positivo diz respeito a probabilidade de ocorrência de tumores, que se estendeu na faixa mais baixa de análise do programa, entre 0% e 10%, e isso pode ser visualizado no quadro 02.
QUADRO 02: Avaliação toxicológica do protótipo B
PERFIL ANALÍTICO AVALIAÇÃO DE TOXICIDADE Bloqueadores hERG + + + (90% – 100%) DILI + + + (90% – 100%) Toxicidade AMES – – – (0% – 10%)
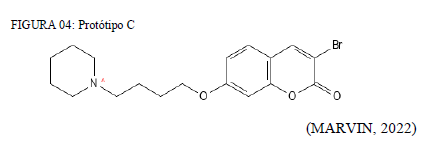
Os protótipos C e D, expressos nas figuras 04 e 05, apresentaram exatamente o mesmo índice toxicológicos, dentro dos padrões analisados, que constam nos quadros 03 e 04. Logo os pontos positivos e negativos também são similares. Obviamente há interferências da relação estrutura e atividade, sobretudo quanto ao perfil físico-químico, onde a molécula D apresenta um menor LogP, sendo esse igual a 3.99, enquanto o protótipo B possui um LogP de 4.77, e o C igual a 4.26.
QUADRO 03: Avaliação toxicológica do protótipo C
PERFIL ANALÍTICO AVALIAÇÃO DE TOXICIDADE Bloqueadores hERG + + + (90% – 100%) DILI + + + (90% – 100%) Toxicidade AMES – – – (0% – 10%) 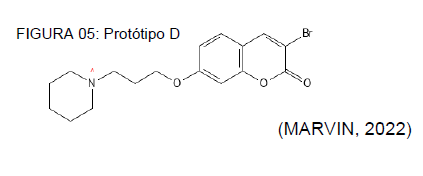
QUADRO 04: Avaliação toxicológica do protótipo D
PERFIL ANALÍTICO AVALIAÇÃO DE TOXICIDADE Bloqueadores hERG + + + (90% – 100%) DILI + + + (90% – 100%) Toxicidade AMES – – – (0% – 10%)
O protótipo E possui um carbono a menos do que o D, como é possível notar na figura 06. Essa alteração reduz a probabilidade dessa molécula interagir com os receptores hERG, bloqueando-os, sendo essas de 70% a 90%. Beneficiando esse perfil analítico em comparação aos demais protótipos com estrutura similar.
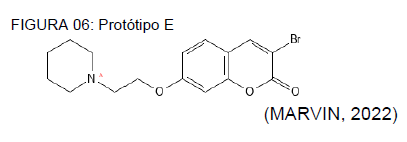
QUADRO 05: Avaliação toxicológica do protótipo E
PERFIL ANALÍTICO AVALIAÇÃO DE TOXICIDADE Bloqueadores hERG + + (70% – 90%) DILI + + + (90% – 100%) Toxicidade AMES – – – (0% – 10%)
Na tabela 06, referente ao protótipo F, demostrado na figura 06, é notório uma taxa considerável entre 70 a 90% de predição referente ao potencial de interação com os receptores hERG, sendo similar ao protótipo demonstrado na figura e tabela 07. Com isso torna-se essencial estudos mais específicos, focados em avaliar segurança desses compostos com relação ao sistema cardiovascular, por conta dos motivos supracitados, defendidos por Zaslavsky e Gus (2022).
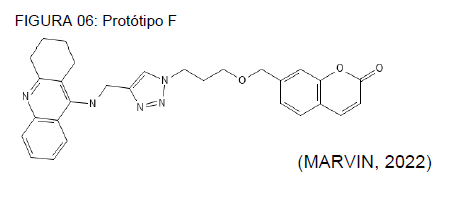
QUADRO 06: Avaliação toxicológica do protótipo F
PERFIL ANALÍTICO AVALIAÇÃO DE TOXICIDADE Bloqueadores hERG + + (70% – 90%) DILI – (30% – 50%) Toxicidade AMES – (30% – 50%)
Quanto à possibilidade de danos hepáticos o protótipo F manifesta riscos moderados, porém, o G apresentou um risco potencial alarmante, entre 90 e 100%. Já o potencial de carcinogênico do protótipo G é inferior ao F, todavia ambos apresentam-se abaixo de 50%.
FIGURA 07: Protótipo G
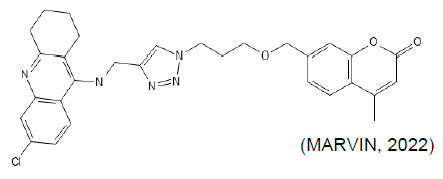
QUADRO 07: Avaliação toxicológica do protótipo G
PERFIL ANALÍTICO AVALIAÇÃO DE TOXICIDADE Bloqueadores hERG + + (70% – 90%) DILI + + + (90% – 100%) Toxicidade AMES – – (10% – 30%)
4. CONCLUSÃO
A partir dos resultados obtidos foi possível concluir que todos os protótipos apresentaram níveis significativos de interação com bloqueadores hERG, sendo necessário mais estudos de viabilidade de aplicação. Já os protótipos B, C, D, E e G apresentaram a capacidade de gerar danos hepáticos, e o protótipo A apresentou alta habilidade de desenvolvimento carcinogênico, sendo também necessário estudos mais avançados nos campos fisiológicos e bioquímicos.
REFERÊNCIAS
BEDNARCZUK, V. O. et al. TESTES IN VITRO E IN VIVO UTILIZADOS NA TRIAGEM TOXICOLÓGICA DE PRODUTOS NATURAIS. Visão Acadêmica, [s. l.], v. 11, n. 02, p. 1518-5192, 2010.
CAÑIZARES-CARMENATE, Y et al. Ligand-based discovery of new potential acetylcholinesterase inhibitors for Alzheimer‘s disease treatment. SAR and QSAR in Environmental Research, [s. l.], v. 33, n. 01, p. 49-61, 2022.
CARNEIRO, Aitor; MATOS, Maria João; URIARTE, Eugenio; SANTANA, Lourdes. Trending Topics on Coumarin and Its Derivatives in 2020. Trending Topics on Coumarin and Its Derivatives in 2020, [s. l.], v. 26, n. 02, 2021.
ESQUERDA-CANALS, Gisela et al. Mouse Models of Alzheimer‘s Disease. Journal of alzheimer‘s disease, [s. l.], v. 57, n. 04, p. 1171-1183, 2017.
MELLO, Palloma Aline et al. Hepatotoxicidade e Alterações de Exames Laboratoriais de Avaliação da Função Hepática por Fármacos. Revista Saúde em Foco, [s. l.], v. 09, n. 02, 2022.
SERRANO-POZO, Alberto; GROWDON, John. Is Alzheimer‘s Disease Risk Modifiable?. Journal of alzheimer’s disease, [s. l.], v. 67, n. 03, p. 795-819, 2019.
ZASLAVSKY, Cláudio; GUS, Iseu. Idoso: Doença Cardíaca e Comorbidades. Arquivos Brasileiros de Cardiologia, [s. l.], v. 79, n. 06, 2022
1Graduando de Farmácia do centro universitário São Camilo e de processos químicos do centro universitário internacional
2Pós graduanda em estética avançada na universidade vila velha
