REGISTRO DOI:10.5281/zenodo.10285794
Edson Lima e Lima¹
Prof. Esp. Carlos Augusto Barboza Toledo²
RESUMO
A fitoterapia tem sido subutilizada nos serviços públicos, e a falta de informações técnicas-científicas por parte dos profissionais, especialmente a respeito dos fitoterápicos listados na RENAME, acaba dificultando a correta prescrição, pois existem medicamentos alopáticos que podem interagir com alguns fitoterápicos. Com base no exposto, o objetivo aqui foi realizar uma busca de informações farmacológicas relevantes sobre os fitoterápicos e suas principais interações com medicamentos alopáticos, contribuindo assim, para o uso seguro e racional desses recursos terapêuticos. Desse modo, o estudo proposto caracteriza-se como uma revisão integrativa, cujo levantamento bibliográfico foi realizado, por meio de consulta eletrônica nas bases de dados BVS, Scielo e PUBMED. Assim, a classe de medicamentos alopáticos que mais interagiram com fitoterápicos foram os antifúngicos (N = 03/ 37,5%), o cetocanazol principalmente; anti-hipertensivos (N = 02/ 25,0%), como anlodipino, indapamida e furosemida; antiinflamatórios (N = 01/ 12,5%) a colchicina; antidiabéticos (N = 01/ 12,5%) a glibenclamida e redutores de colesterol (N = 01/ 12,5%) como a sinvastantina. E no caso dos fitoterápicos responsáveis pelas interações, a Alcachofra (N = 02/ 25,0%) e a Babosa (N = 02/ 25,0%), foram os mais mencionados. Neste sentido, é fundamental que os pacientes sejam adequadamente instruídos a respeito dos riscos associados ao uso concomitante de fitoterápicos e medicamentos convencionais. Para isso, é necessário que o profissional de saúde tenha o pleno conhecimento sobre este assunto, de um modo a prestar as devidas orientações a respeito dos riscos desta associação e sobre como utilizar as plantas medicinais de forma segura.
Palavras-chave: Plantas medicinais. Fitoterapia. Medicamentos alopáticos. RENAME.
ABSTRACT
Phytotherapy has been underused in public services, and the lack of technical-scientific information on the part of professionals, especially regarding herbal medicines listed in RENAME, ends up making correct prescription difficult, as there are allopathic medicines that can interact with some herbal medicines. Based on the above, the objective here was to search for relevant pharmacological information about herbal medicines and their main interactions with allopathic medicines, thus contributing to the safe and rational use of these therapeutic resources. Thus, the proposed study is characterized as an integrative review, whose bibliographic survey was carried out through electronic consultation in the VHL, Scielo and PUBMED databases. Thus, the class of allopathic medicines that most interacted with herbal medicines were antifungals (N = 03/37.5%), mainly ketocanazole; antihypertensives (N = 02/ 25.0%), such as amlodipine, indapamide and furosemide; anti-inflammatory drugs (N = 01/ 12.5%) colchicine; antidiabetics (N = 01/ 12.5%) such as glibenclamide and cholesterol reducers (N = 01/ 12.5%) such as simvastantin. And in the case of herbal medicines responsible for the interactions, Artichoke (N = 02/ 25.0%) and Aloe Vera (N = 02/ 25.0%) were the most recommended. In this sense, it is essential that patients are specifically instructed about the risks associated with the concomitant use of herbal medicines and occasional medications. To achieve this, it is necessary that the health professional has full knowledge of this subject, in order to provide the necessary guidance regarding the risks of this association and how to use medicinal plants safely.
Keywords: Medicinal plants. Phytotherapy. Allopathic medicines. RENAME.
1 INTRODUÇÃO
A medicina tradicional, também denominada medicina não convencional ou complementar, foi declarada pela Organização Mundial da Saúde (OMS) como sendo uma significante alternativa para garantir o acesso aos cuidados em saúde. As plantas medicinais e os seus derivados (drogas vegetais e produtos industrializados – fitoterápicos por exemplo), fazem parte dessa medicina, representando um dos seus principais recursos terapêuticos.1, 2, 3
Segundo a Agência Nacional de Vigilância Sanitária (ANVISA), as plantas medicinais são aquelas utilizadas pela população com finalidade terapêutica, enquanto os fitoterápicos são produtos naturais, produzidos diretamente a partir dessas plantas ou de seus derivados, para tratar uma variedade de condições de saúde. Ambos possuem eficácia comprovada, seja por meio de estudos químicos e farmacológicos (plantas vegetais) ou baseado em evidências clínicas (fitoterápicos).4
Na atualidade, a fitoterapia passou a ganhar notória confiabilidade, tornando-se aceita culturalmente e atraente em quase todos os países.2 Por esse motivo, a OMS expressou na Declaração de Alma-Ata (1978), a importância da valorização das plantas medicinais, uma vez que elas ou suas preparações são utilizadas por cerca de 80% da população mundial.5 A legitimação e a institucionalização dessas abordagens de atenção à saúde, só foram iniciadas no Brasil na década de 80, após a criação do Sistema Único de Saúde (SUS). 3
Em 2016 foi publicada a 1ª edição do Memento de Fitoterápicos da Farmacopeia Brasileira, com o propósito de auxiliar profissionais da saúde na prescrição desses produtos naturais, que inclusive, estão inseridos até mesmo no próprio instrumento utilizado pelo SUS para o fornecimento gratuito de medicamentos nas unidades básicas (a Relação Nacional de Medicamentos Essenciais – RENAME), são eles: Alcachofra, Aroeira, Babosa, Cáscara-sagrada, Espinheira-santa, Guaco, Garra-do-diabo, Hortelã, Isoflavona de soja, Plantago, Salgueiro e Unha-de-gato.6, 7
Ainda sobre os fitoterápicos, nas últimas décadas, o Ministério da Saúde (MS) tem incentivado a elaboração de pesquisas, como a Política Nacional de Práticas Integrativas e Complementares (PNPIC) e a Política Nacional de Plantas Medicinais e Fitoterápicos (PNPMF), visando à sua distribuição e o uso racional, na tentativa desses produtos não representarem um risco a saúde, por meio do uso indiscriminado.3, 8
Na prática é plangente observar como a fitoterapia tem sido subutilizada nos serviços públicos, não recebendo por muitas vezes a atenção necessária, chegando a tornar-se um assunto inexplorado por alguns profissionais. 9, 10,11, 12 Em torno deste assunto, existem relatos de profissionais da Atenção Primária em Saúde, que por total desconhecimento dos 12 fitoterápicos presentes no RENAME, acabaram em algum momento, indicando ao menos uma planta medicinal que não consta nessa listagem, dificultando não somente a correta prescrição, mais ainda pondo em risco o próprio paciente, pois existem certos medicamentos alopáticos que podem interagir com fitoterápicos. 6
Normalmente no âmbito do SUS, as informações técnicas e científicas a respeito dos fitoterápicos não estão disponíveis em unidades básicas de saúde, dificultando assim, a adesão por parte dos profissionais em prescrever os fitoterápicos que estão disponíveis nos municípios. 6 Em decorrência da atual e crescente preocupação sobre este tema, o seguinte problema foi desenvolvido: dentre os fitoterápicos utilizados pela atenção primária em saúde, quais deles são mais propensos a ocorrência de interações?
Assim, este artigo foi elaborado devido a necessidade de se trazer informações sobre a segurança e eficácia desses produtos naturais, elucidando as informações relevantes encontrados na literatura nacional e internacional, de um modo a contribuir com a prática segura dos profissionais habilitados para a prescrição na atenção primária, auxiliando-os a respeito dos riscos e benefícios do uso de fitoterápicos. Desse modo, espera-se que esta pesquisa possa ajudar esses profissionais da saúde para a indicação segura, evitando o surgimento de reações indesejadas.
Com base no exposto, o objetivo dessa revisão foi realizar uma busca de informações farmacológicas relevantes sobre os fitoterápicos e suas principais interações com medicamentos alopáticos, na tentativa de contribuir para o uso seguro e racional desses recursos terapêuticos.
2. METODOLOGIA
O estudo proposto caracteriza-se como uma revisão integrativa, cujo levantamento bibliográfico foi realizado, por meio de consulta eletrônica nas bases de dados da Biblioteca Virtual em Saúde (BVS), Scientific Eletronic Library Online (Scielo) e PUBMED no período de setembro a novembro de 2023.
Na tentativa de abranger uma quantidade mais relevante de publicações sobre o tema, essa pesquisa utilizou a associação entre os descritores (DeCS) “interações + medicamentosas” e “Drug + interactions”, para cada uma das 12 plantas medicinais do RENAME e o seu nome científico, conforme pode ser observado no Quadro 01.
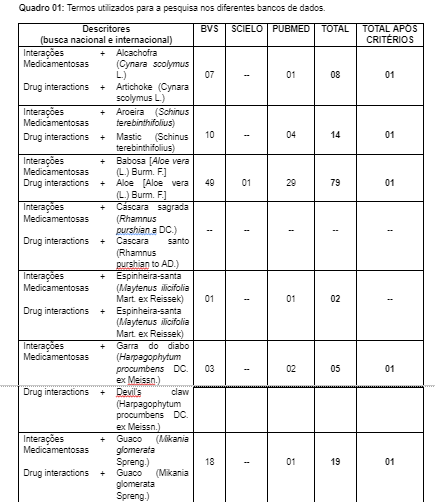
Foram incluídos artigos originais com idioma em português e inglês, dos últimos dez anos (2013 – 2023) que tratassem o tema. Já os critérios de exclusão foram artigos duplicados, de revisão ou incompletos, teses, dissertações, monografias, resumos expandidos, com mais de dez anos, que não abordavam as ideias principais a serem exposta no artigo.
Foram seguidas as seguintes etapas: (1) identificação do problema, onde o tema foi definindo em forma de pergunta norteadora; (2) seleção da amostra, por meio da definição das características da pesquisa; (3) análise dos estudos incluídos na revisão, onde foram identificados similaridades e conflitos; (4) discussão e interpretação dos resultados; e (5) apresentação da revisão/síntese do conhecimento, através de textos, tabelas, quadros e fluxogramas.
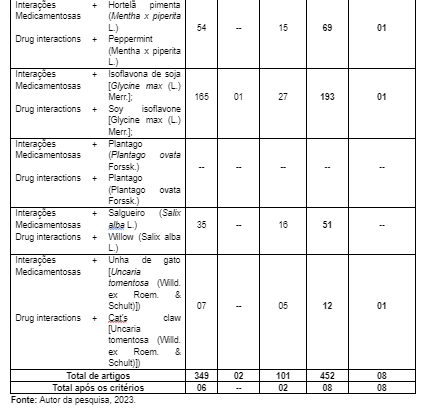
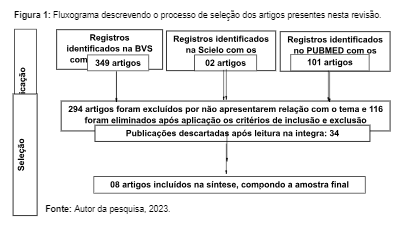
Com isso, aplicando-se os filtros de idioma e data, a amostragem constituiu-se de 452 artigos, sendo 349 encontrados na BVS, 02 na SCIELO e 101 artigos na PUBMED. A princípio foram excluídos 410 pelas seguintes causas: duplicidade, títulos ou resumos não se adequarem à pergunta tema ou por se tratar de revisões, monografias ou teses de dissertação, restando somente 42 artigos, todos disponíveis para leitura.
Todos esses foram lidos na íntegra e 34 foram excluídos por abordarem de forma pouco exploratória a temática, não respondendo à pergunta norteadora. Desse modo, 08 artigos foram estabelecidos como corpus de análise (BVS = 07 e PUBMED = 3) (Figura 1).
04 RESULTADOS E DISCUSSÃO
Após a busca, foi realizada a leitura do resumo de cada publicação, originando um total de 08 (100%) artigos selecionados para composição da amostra, como forma de responder à questão norteadora do estudo.
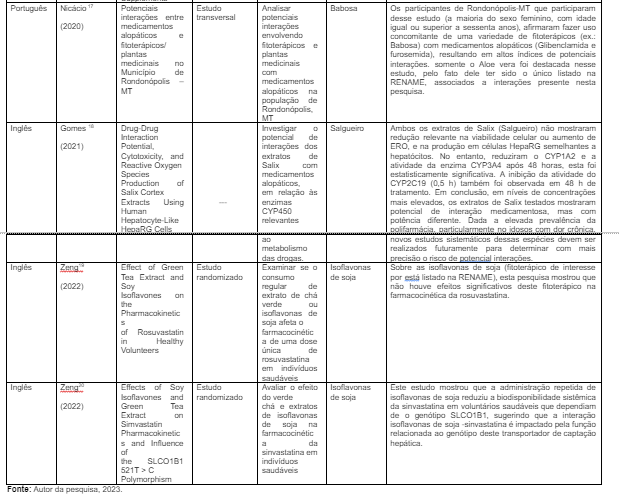
Analisando detalhadamente os materiais selecionados, foram encontradas 06 (75,0%) publicações na base de dados BVS e 02 (25,0%) no PUBMED, 01 (12,5%) no idioma português e 07 (87,5%) na língua inglesa, onde 02 (25,0%) possuem abordagem transversal, 02 (25,0%) randomizados, 01 (12,5%) estudo de caso e 01 (12,5%) cromatográfico (%). Em relação ao ano de publicação, 01 (12,5%) foi publicado em 2015, 01 (12,5%) em 2018, 02 (25,0%) em 2020, 01 (12,5%) em 2021, 02 (25,0%) em 2022 e 01 (12,5%) em 2023.
O Quadro 2 foi elaborado para a apresentação dos resultados, expondo cada publicação de acordo com seus idiomas (local da pesquisa), respectivos autores, ano de publicação, títulos, tipo de estudo, objetivos alcançados, fitoterápicos listados na RENAME que foram mencionados na pesquisa e os principais resultados alcançados em torno desses produtos naturais.
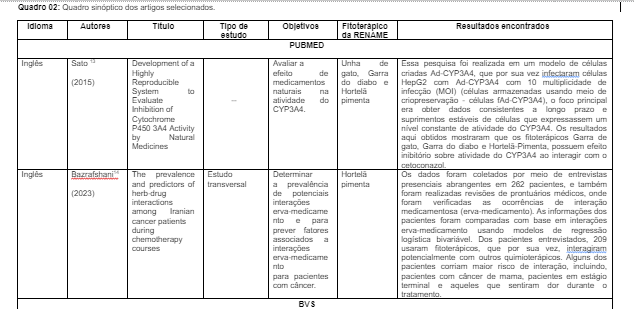
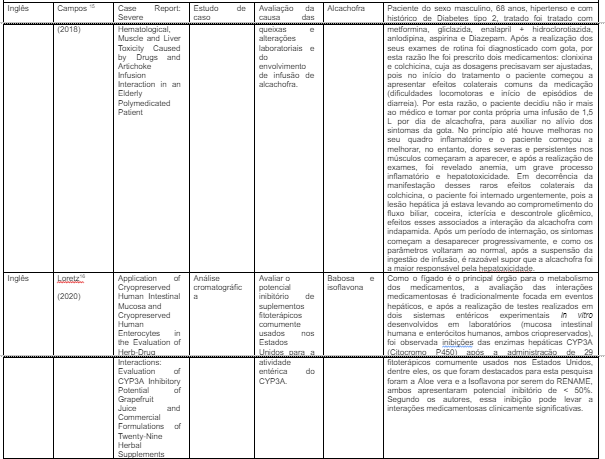
Os principais fitoterápicos da RENAME identificadas nesta revisão estão expostos na Tabela 01 a seguir, foram eles: Isoflavona de soja (N = 01/ %), Babosa (N = 01/ %), Hortelã pimenta (N = 02/ 25,0%), unha de gato (N = 01/ %), Garra do diabo (N = 01/ %) e Alcachofra (N = 01/ %).
Na tabela 01 também é possível observar o nome científico de cada um desses fitoterápicos, suas composições fitoquímicas (cujo o principal composto encontrado na maioria deles foram os flavonoides (N = 04/ 50,0%), e ainda suas respectivas indicações de uso.
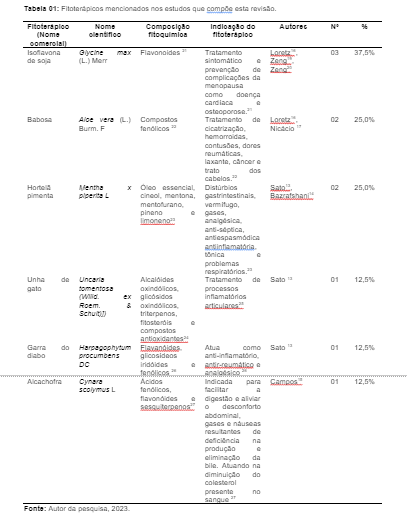
As isoflavonas ou isoflavonóides, são compostos químicos fenólicos, pertencentes à classe dos fitoestrógenos. Elas estão amplamente distribuídas no reino vegetal e suas concentrações são relativamente maiores nas leguminosas, especialmente na soja (Glycine max). As principais encontradas com os seus derivados são: genisteína (que representa dois terços do total de isoflavonas), daidzeína, e pequenas quantidades de gliciteína. Vale ressaltar, que dependendo da fermentação ou extensão do seu processamento, elas podem apresentar-se como várias formas de conjugados glicosídicos. 28,29
Existe uma variedade de indicações para a Isoflavona, entre elas: reposição hormonal, Mal de Alzheimer, endometriose, câncer de mama/ próstata/ colo do útero e ainda, tratamento sintomático e prevenção de complicações da menopausa (osteoporose e doença cardíaca). Sua estrutura química assemelha-se ao estrógeno, e por essa razão ela também é uma substância capaz de aliviar os efeitos da tensão pré-menstrual, contribuindo para a redução de problemas causados pela deficiência hormonal.30
A Babosa, cujo nome é Aloe vera (significa verdadeira substância amarga e brilhante), foi outro fitoterápico bastante mencionado nesta pesquisa. O seu uso é milenar por diversas culturas, sendo ela uma planta originária da África do Sul, no Brasil, por outro lado, o seu cultivo é para fins cosméticos e medicinais. Existem várias atividades biológicas atribuídas a Aloe vera ao longo dos anos, atribuídas diretamente aos diversos ativos existentes em sua composição, como por exemplo: cicatrização de feridas, contusões, queimaduras, laxante, câncer, hemorroidas, dores reumáticas e tratos dos cabelos. 31, 32
Sobre a Mentha x piperita L. (Lamiaceae), conhecida popularmente como hortelã-pimenta, menciona-se que ela é produto do cruzamento de Mentha spicata (Mentha longifolia x Mentha rotundifolia) e Mentha aquática, não possuindo assim, origem geográfica específica, por se tratar de um híbrido triplo. A sua variabilidade de uso (antisséptica, expectorante, antitussígena e descongestionante das vias respiratória, calmante suave, vermífuga etc.), é decorrente das suas propriedades medicinais e aromáticas, tanto etnofarmacologicamente quanto industrialmente.33
Dentre os compostos fitoquímicos presentes nos fitoterápicos encontrados nessa revisão, os principais foram os flavonóides, compostos fenólicos presentes em diversos alimentos do reino vegetal (maçã, uva, repolho, soja, brócolis, cacau etc.), que possuem ação antioxidante, protegendo as células contra os efeitos danosos dos radicais livres. Portanto, a literatura pontua o qual beneficioso é para a saúde o uso constante de flavonoides, afinal de contas, eles são capazes de neutralizar os radicais livres, prevenindo uma variedade de patologias, como doenças virais, bacterianas, crônicas, como o câncer e as doenças cardiovasculares, entre outras. 34
Segundo Djuv35, existem pacientes que habitualmente utilizam fitoterápicos junto com medicamentos convencionais, ação essa que potencialmente representa um risco a saúde, devido a possibilidade de interação erva-medicamento, por meio da alteração da farmacocinética ou farmacodinâmica do fármaco.
Campos15 alega, que geralmente essa ação tende a acontecer pela total ignorância do paciente, em pensar que o uso concomitante do fitoterápico com o medicamento alopático não irá comprometer o seu tratamento ou até por em risco a sua vida, causando toxicidade, por isso a importância de pesquisas sobre esse assunto, pois atualmente, tem se observado frequentemente, casos de interações entre medicamentos alopáticos e extratos de ervas.
Desse modo, foi identificado nessa pesquisa de revisão, oito interações fitoterápico-medicamento, que foram devidamente distribuídas na Tabela 02. Assim, a classe de medicamentos alopáticos que mais interagiram com fitoterápicos foram os antifúngicos (N = 03/ 37,5%), o cetocanazol principalmente; anti-hipertensivos (N = 02/ 25,0%), como anlodipino, indapamida e furosemida; antiinflamatórios (N = 01/ 12,5%) a colchicina; antidiabéticos (N = 01/ 12,5%) a glibenclamida e redutores de colesterol (N = 01/ 12,5%) como a sinvastantina.
E no caso dos fitoterápicos responsáveis pelas interações, a Alcachofra (N = 02/ 25,0%) e a Babosa (N = 02/ 25,0%), foram as mais mencionadas. Portanto, no quadro a seguir é possível observar a descrição dessas interações com suas potenciais consequências.
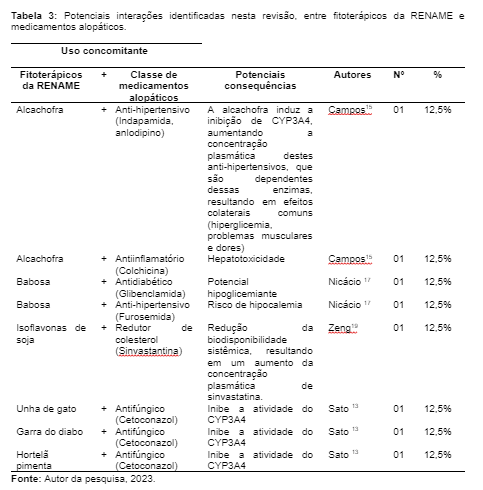
Umas das interações de maior prevalência encontradas nesta pesquisa, que deve ser evitada é a da Babosa com os medicamentos antidiabéticos, devido ao aumento dos efeitos hipoglicêmicos, promovidos comumente pela estimulação de células β. 9,38 De acordo com Djuv35 o Aloe vera é um fitoterápico comumente utilizado pelos pacientes, seja por indicação (amigo ou parente) ou por prescrição, por esta razão, recomendações sobre interações farmacológicas precisam ser repassadas.
O consumo de fitoterápicos na maioria das vezes, acontece por prescrição médica ou por automedicação, nesse caso, geralmente o paciente desconhece o perfil tóxico da maioria destes compostos, acarretando o surgimento de efeitos indesejáveis. Por esta razão, considera-se extremamente relevante conhecer as possíveis interações medicamentosas com erva-medicamento, de um modo que possa contribuir para a redução dos riscos à saúde das populações.17
As interações fitoterápicas mais medicamentos convencionais, tendem acontecer do mesmo modo que as interações medicamentosas, ou seja, interações farmacocinéticas e farmacodinâmicas. Normalmente a primeira tende a ser mais comum de acontecer, alterando principalmente a concentração plasmática de diferentes fármacos metabolizados pelo citocromo P450 (o mais importante sistema enzimático para a metabolização de drogas, sendo responsável pelo metabolismo de aproximadamente 80% de todos os medicamentos prescritos) ou transportados pela glicoproteína-P. 6, 36
OS genes CYP (superfamília citocromo P450), além de apresentarem uma variedade de funções (ativação e desativação oxidativa; excreção de uma grande parte dos xenobióticos e fármacos; controle do grau de toxicidade entre outras), ainda são considerados um elétron chave cadeia de transporte na membrana do endoplasmático retículo da célula.39
Segundo Sen39 a oxidação lipofílica é catalisada pelo citocromo P450, que além de introduzir um átomo de oxigênio molecular no substrato, ainda transforma este último em metabólitos hidrofílicos inofensivos ou menos tóxicos, que podem ser excretados do corpo. É acrescentado por Nelson40, que o citocromo P450 age como um facilitador de uma gama de eventos de oxidação endobiótica e xenobiótica, que são responsáveis por muitas reações.
Um total de 57 proteínas CYP são expressas pelos humanos. Destas, sete são encontrados nas mitocôndrias, catalisando específicos eventos de oxidação associados ao metabolismo esteróide; seis (CYP1A2, CYP2C9, CYP2B6, CYP2C19, CYP2D6 e CYP3A4) contribui substancialmente para a eliminação de fármacos – cerca de 60% de todo o material relacionado a medicamentos fornecido aos pacientes; os demais genes ainda são estudados. A subfamília CYP3A é responsável para metabolizar aproximadamente metade dos medicamentos que foram eliminados pelos CYPS.39 E nesta revisão, 03 (37,5%) estudos abordando diretamente a ação dessas enzimas hepáticas CYP3A, na interação fitoterápicos e medicamentos convencionais.13, 16, 18
Após a co-administração de medicamentos e fitoterápicos, em termos de indução ou inibição, é extremamente importante que as enzimas hepáticas CYP450 sejam avaliadas, na busca por possíveis interações, afinal de contas, a indução enzimática geralmente leva à biotransformação acelerada de uma droga, e esse metabolismo acelerado para a maioria dos medicamentos, resulta em redução da sua eficácia, no entanto, se um pró-fármaco for ativado pelas enzimas CYP450, a sua eficácia e/ou toxicidade podem aumentar.18
Sobre essa afirmativa, Lee41 afirma que quando dois fármacos competem no mesmo local receptor da enzima, ocorre uma inibição enzimática, onde o inibidor mais forte tende a predominar, resultando em diminuição metabolismo da droga concorrente. Essa competição enzimática pode aumentar os níveis séricos da droga não metabolizada, gerando assim, um maior potencial para toxicidade. No caso dos fármacos cuja atividade farmacológica exija biotransformação de uma forma pró-droga, essa inibição pode resultar em eficácia diminuída. Além da competição pelo substrato, um medicamento também pode reduzir a atividade enzimática devido à interação direta ou mRNA inibição.
Campos15 alega que a hepatotoxicidade ocasionada por fármacos, suplementos dietéticos ou fitoterápicos permanece em grande parte um diagnóstico clínico, baseando-se especialmente em minuciosos históricos do paciente. No geral, esses quadros estão associados ao fato do paciente tomar muitos medicamentos, aumentando consequentemente as concentrações plasmáticas, devido à quantidade de inibidores 3A4 de citocromo P450, que estão sendo consumidos. No caso da Alcachofra, ela tende a contribuir ainda mais para esse processo, por conta dos ácidos fenólicos (derivados de ácido caféico e flavonóides como glicosídeos de luteolina), presentes em sua composição.15
Os estudos de Felten9 e Nicoletti37 mostraram que a alcachofra e os diuréticos de alça/ tiazídicos são sinérgicos, portanto, não podem ser utilizados concomitantemente, caso contrário resultaria em queda de pressão arterial por hipovolemia e aumento da excreção de potássio com risco de hipocalemia. Essas interações foram identificadas pelos autores como as mais graves.
Para Bazrafshani14 a redução dos riscos de interações erva-medicamento só será possível, quando os pacientes forem educados adequadamente e suas famílias treinadas sobre os perigos da automedicação, especialmente com fitoterápicos. Veiga42 ressalta que a utilização segura de fitoterápicos e plantas medicinais está diretamente vinculada a prática de orientação adequada, pois a falta de informação em conjunto com a automedicação, a polifarmácia e a não comunicação ao profissional de saúde sobre utilização destes produtos nas consultas, são fatores de risco para interações farmacológicas.
Muitos acreditam que os fitoterápicos são seguros, por se tratarem de produtos naturais, porém a literatura nacional e internacional nos mostra resultados diferentes. Portanto, é necessário que os profissionais de saúde sejam adequadamente informados sobre as características dessas plantas medicinais, afinal de contas, são enormes as possibilidades de interação, gerando riscos a população.6
Conforme é pontuado por Nicácio17, existe uma escassez de pesquisas abordando a avaliação do consumo e a prevalência de medicamentos fitoterápicos e alopáticos. Temas como esses precisam ser ampliados, especialmente nas atenções básicas de saúde, a fim de se fortalecer a Política Nacional de Plantas Medicinais e Fitoterápicos, evitando prescrições perigosas.
4 CONSIDERAÇÕES FINAIS
Os dados apresentados neste estudo mostraram potenciais interações de fitoterápicos com medicamentos alopáticos, algumas com repercussões graves, evidenciando assim, o vasto uso de plantas medicinais pela população e os riscos de toxicidade e interações medicamentosas, provenientes da polifarmácia e/ou automedicação.
Neste sentido, é fundamental que os pacientes sejam adequadamente instruídos a respeito dos riscos associados ao uso concomitante de fitoterápicos (por exemplo: Babosa, Alcachofra, Hortelã pimenta etc.) e medicamentos convencionais (Furosemida, Glibenclamida, Cetoconazol entre outros). Para isso, é necessário que o profissional de saúde tenha o pleno conhecimento sobre os fitoterápicos presentes na RENAME, somente desse modo ele poderá estabelecer um protocolo de atendimento, que permitirá a devida orientação a respeito dos riscos desta associação e sobre como utilizar as plantas medicinais de forma segura.
REFERÊNCIAS
1. Macedo JAB, Monteiro MHDA. Plantas medicinais e fitoterápicos na atenção primária à saúde: contribuição para profissionais prescritores. Rio de Janeiro: Monografia; p. 58; 2016.
2. Silva AA, Padilha WAR. Fitoterapia e desmedicalização na Atenção Primária à Saúde: um caminho possível? Rev Bras Med Fam Comunidade: Rio de Janeiro; Jan-Dez; 17(44); 2022
3. Gonçalves RN, Gonçalves JRSN, Buffon MCM, Negrelle RRB, Rattmann YD. Plantas medicinais na Atenção Primária à Saúde: riscos, toxicidade e potencial para interação medicamentosa. Rev. APS.: jan.-mar.; 25(1); p. 120 – 53; 2022
4. Esteves CO, Rodrigues RM, Martins ALD, Vieira RA, Barbosa JL, Vilela JBF. Medicamentos fitoterápicos: prevalência, vantagens e desvantagens de uso na prática clínica e perfil e avaliação dos usuários. São Paulo: Rev Med; set.-out.; 99(5); p. 463-72; 2020.
5. Sousa IMC, Tesser CD. Medicina Tradicional e Complementar no Brasil: inserção no Sistema Único de Saúde e integração com a atenção primária. Cad Saúde Pública; 2017.
6. Kirchner GA, Pelaquin MM, Magalhães M, Gouveia NM. Possíveis interações medicamentosas de fitoterápicos e plantas medicinais incluídas na relação nacional de medicamentos essenciais do SUS: revisão sistemática. Revista Fitos. Rio de Janeiro. 2022; 16(1): 93-119 | e-ISSN: 2446-4775
7. Pereira JBA, Rodrigues MM, Morais IR, Vieira CRS, Sampaio JPM, Moura MG, et al. O papel terapêutico do Programa Farmácia Viva e das plantas medicinais. Botucatu: Rev Bras Plantas Med; 2015.
8. Ministério da Saúde. Plantas medicinais e fitoterápicos no SUS. 2022.
9. Felten RD, Magnus K, Santos L, Souza AH. Interações medicamentosas associadas a fitoterápicos fornecidos pelo sistema único de saúde. Revista Inova Saúde, Criciúma: vol. 4; nº 1; jul.; 2015.
10. Dias ECM, Trevisan DD, Nagai SC, Ramos NA, Silva EM. Uso de fitoterápicos e potenciais riscos de interações medicamentosas: reflexões para prática segura. Revista Baiana de Saúde Pública: vol. 41; nº 2; p. 297-307; abr./jun.; 2017
11. Silva PES, Furtado CO, Damasceno CA. Utilização de Plantas Medicinais e Medicamentos Fitoterápicos no Sistema Público de Saúde Brasileiro nos últimos 15 anos: Uma Revisão Integrativa. Brazilian Journal of Development, Curitiba, v.7, n.12, p. 116235-116255 dec. 2021
12. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada – RDC n.º 26, de 13 maio de 2014. Dispõe sobre o registro de medicamentos fitoterápicos e o registro e a notificação de produtos tradicionais fitoterápicos. Brasília, 2014.
13. Sato Y, Sasaki T, Takahashi S, Kumagai T, Nagata K. Development of a Highly Reproducible System to Evaluate Inhibition of Cytochrome P450 3A4 Activity by Natural Medicines. J Pharm Pharm Sci.: p. 316 – 327; 2015
14. Bazrafshani MS, Pardakhty A, Khandani BK, Tajadini H, Pour SG, Hashemi S, Amiri S, Mehmandoost S, et al. The prevalence and predictors of herb‑drug interactions among Iranian cancer patients during chemotherapy courses. BMC Complementary Medicine and Therapies: 2023
15. Campos MG, Machado J, M.L. Costa, Lino S., Correia F, Maltez F. Case Report: Severe Hematological, Muscle and Liver Toxicity Caused by Drugs and Artichoke Infusion Interaction in an Elderly Polymedicated Patient. Current Drug Safety. p. 44-50; 2018,
16. Loretz C, Ho MCD, Alam N, Mitchell W, Albert PL. Application of Cryopreserved Human Intestinal Mucosa and Cryopreserved Human Enterocytes in the Evaluation of Herb-Drug Interactions: Evaluation of CYP3A Inhibitory Potential of Grapefruit Juice and Commercial Formulations of Twenty-Nine Herbal Supplements. Drug Metab Dispos p. 1084–1091, October; 2020
17. Nicácio RAR, Pinto GF, Oliveira FRA, Santos DAS, Mattos M, Goulart LS. Potenciais interações entre medicamentos alopáticos e fitoterápicos/ plantas medicinais no Município de Rondonópolis – MT. Rev. Ciênc. Méd. Biol.: Salvador; vol. 19; nº 3; p. 417-422; set./dez., 2020
18. Gomes JVD, Herz C, Helmig S, örster N, Mewis I, Lamy E. Drug-Drug Interaction Potential, Cytotoxicity, and Reactive Oxygen Species Production of Salix Cortex Extracts Using Human Hepatocyte-Like HepaRG Cells
Frontiers in Pharmacology: Nov.; 2021
19. Zeng W, Hu M, Lee HK, Wat E, Lau CBS, Ho CS, Wong CK, Tomlinson B. Effect of Green Tea Extract and Soy Isoflavones on the Pharmacokinetics of Rosuvastatin in Healthy Volunteers. Frontiers in Nutrition. 24 March 2022
20. Zeng W, Hu M, Lee HK, Wat E, Lau CBS, Ho CS, Wong CK, Tomlinson B. Effects of Soy Isoflavones and Green Tea Extract on Simvastatin Pharmacokinetics and Influence of the SLCO1B1 521T > C Polymorphism. Front Nutr.: May.; 2022.
21. Ferreira A. Guia Prático de Farmácia Magistral. Pharmabooks, 4ªed., vol. 01, São Paulo, 2010.
22. Sousa EAO, Neves EA, Alves CR. Potencial Terapêutico de Aloe Vera (Aloe Barbadensis): Uma Breve Revisão. Rev. Virtual Quim.: p. 378-388; 2020,
23. Pinto JEBP, Santiago EJA. de. Compêndio de plantas medicinais. Lavras: UFLA/FAEPE; p. 205; 2000
24. Indice Terapêutico Fitoterápico. Ervas Medicinais. 2ªed. Petrópolis, Rio de Janeiro: EPUB, p.422. 2013.
25. Sitiniki RS. Bula do Unha de Gato Herbarium, 2020
26. Sitiniki RS Bula do Garra do Diabo Herbarium. 2022
27. Sitiniki RS. Bula do Alcachofra Herbarium. 2023
28. Esteves EA, Monteiro JBR. Efeitos benéficos das isoflavonas de soja em doenças crônicas beneficial. Rev. Nutr., Campinas: p. 43-52; jan./abr.; 2001
29. Setchell KD. Phytoestrogens: the biochemistry, physiology, and implications for human health of soy isoflavones. American Journal Clinical of Nutrition, Bethesda, vol. 134; nº 6; p.1333S-1343S, 1998.
30. Florien. Isoflavona de Soja (100mg – 90 Cápsulas). 2023
31. Sistema Único de Saúde. Babosa Aloe vera (L.) Burm. F. Farmácia viva do cerpis; out.; 2019
32. Freitas VS, Rodrigues RAF, Gaspi FOG. Propriedades farmacológicas da Aloe vera (L.) Burm. f.. Rev. Bras. Pl. Med.: Campinas, vol.16; nº 02; p. 299-307; 2014.
33. Fernandes LCP, Khalil OAK. Aspectos químicos, farmacológicos e biotecnológicos da Mentha x piperita L. Londrina: Nov.; 2018
34. Oliveira VP, Espeschit ACR, Peluzio MCG. Flavonóides e doenças cardiovasculares: ação antioxidante. Rev Med Minas Gerais: p. 234-8; 2006
35. Djuv A, Nilsen OG, Steinsbekk A.The co-use of conventional drugs and herbs among patients in Norwegian general practice: a cross-sectional study. BMC Complementary and Alternative Medicine: 2013.
36. Izzo AA. Interactions between herbs and conventional drugs: overview of the clinical data. Med Princ Pract. 2012; 21(5): 404-28.
37. Nicoletti MA, Oliveira-Junior MA, Bertasso CC, Caporossi PY, Tavares APL. Principais interações no uso de medicamentos fitoterápicos. 2007 jun.; 19(1/2): 32-40. Acesso 17 jan 2022.
38. Ulbricht C, Armstrong J, Basch E, Basch S, Bent S, Dacey C et al. An evidence-based systematic review of Aloe vera by the natural standard research collaboration. J Herb Pharmacother; p. 279-323; 2007
39. Alaattin ŞEN. Complementary medicines used in ulcerative colitis and unintended interactions with cytochrome P450-dependent drug-metabolizing enzymes. Turk J Med Sci.; p. 1425-1447; 2022
40. Nelson DR. The cytochrome p450 homepage. Human Genomics: p. 59-65; 2009
41. Lee MD, Ayanoglu E, Gong, L. Drug-induced Changes in P450 Enzyme Expression at the Gene Expression Level: a New Dimension to the Analysis of Drug-Drug Interactions. Xenobiotica; p. 1013–1080; 2009
42. Veiga Júnior VF. Estudo do consumo de plantas medicinais na Região Centro-Norte do Estado do Rio de Janeiro: aceitação pelos profissionais de saúde e modo de uso pela população. Rev. Bras. Farmacogn.: São Paulo; vol. 18; nº 02; p. 308-313; 2008.
