MEDICINAL PLANT FROM THE AMAZON USED IN STANDARD STRAIN OF CANDIDA ALBICANS
REGISTRO DOI: 10.5281/zenodo.10080863
Ibrain Narlei Oliveira de Souza1
Lígia de Nazaré Mota Araujo Brito2
Amajucy Tavares Vilhena3
Tabata Resque Beckemann Carvalho3
Silvio Algusto Fernandes de Menezes3
Ricardo Roberto de Souza Fonseca4
RESUMO
Objetivo: Avaliar a sensibilidade e a concentração inibitória mínima (CIM) frente à cepa padrão de Candida albicans por meio de microdiluições seriadas do extrato Lippia thymoide testando sua ação fungicida. Métodos: Foi realizado estudo experimental, o óleo essencial foi obtido por hidrodestilação e analisado por Cromatografia de Fase Gasosa/Espectrometria de Massas (CG/EM), a cepa padrão testada foi Candida albicans por meio da técnica de microdiluição em caldo. Resultados: O óleo essencial apresentou como constituintes principais timol (70,69%), p-cimeno (7,27%), acetato de timol (5,82%), γ-terpineno (5,41%) e β- cariofileno (4,23%). A CIM do óleo de L. thymoides foi de 0,19 µL para as amostras testadas apresentando resultados promissores. Na determinação da Concentração Inibitória Mínima (CIM), o óleo foi ativo até a diluição de 0.19 µL frente ao fungo testado e revela que todas as amostras até a 9ª diluição apresentou atividade antimicrobiana, inibindo o crescimento da cepa padrão avaliada. Foi determinada como MIC a 9ª diluição. Conclusão:conclui-se que o óleo essencial da espécie Lippia thymoides (Verbenacea) inibe o crescimento microbiano, predominantemente, devido à sua ação fungicida frente à cepa padrão Candida Albicans, portanto, potencialmente pode ser usado como produto alternativo aos antifungicidas convencionais.
Palavras-chave: Candida albicans, Lippia thymoide, óleo essencial, fungicida.
ABSTRACT
Objective: To evaluate sensitivity and minimum inhibitory concentration (MIC) against the standard strain of Candida albicans through serial microdilutions of the Lippia thymoid extract, testing its fungicidal action. Methods: An experimental study was carried, out the essential oil was obtained by hydrodistillation and analyzed by Gas Chromatography/Mass Spectrometry (GC/MS), the standard strain tested was Candida albicans using the broth microdilution technique. Results: The essential oil had thymol as its main constituents (70.69%), p-cymene (7.27%), thymol acetate (5.82%), γ-terpinene (5.41%) and β-caryophyllene (4.23%). The MIC of L. thymoides oil was 0.19 µL for the samples tested, showing promising results. In determining the Minimum Inhibitory Concentration (MIC), the oil was active up to a dilution of 0.19 µL against the tested fungus and reveals that all samples up to the 9a dilution showed antimicrobial activity, inhibiting the growth of the standard strain evaluated. The 9a dilution was determined as MIC. Conclusion: it is concluded that the essential oil of the species Lippia thymoides (Verbenacea) inhibits microbial growth, predominantly, due to its fungicidal action against the standard Candida Albicans strain, therefore, it can potentially be used as an alternative product to conventional antifungicides.
Key words: Candida albicans, Lippia thymoid, essential oil, fungicide
1. INTRODUÇÃO
Cândida é um microrganismo saprófito, que vive comumente na cavidade bucal, mas em algumas situações pode tornar-se patogênico causando infecção conhecida como candidíase bucal. Espécies como Candida albicans, Candida tropicalis, Candida glabrata, Candida krusei, Candida parapsilosis e Candida guillermondii, têm sido detectadas em casos de candidíases bucais, dentre as quais a Candida albicans é o comensal evidenciado com maior frequência (LIMA, 1994; LYNCH, et al., 1994)
Pesquisas recentes têm demonstrado a possível relação entre Candida albicans com doença periodontal, cáries de dentina e/ou raiz. Além disso, Candida albicans é um fungo frequentemente encontrado no biofilme dental e esse microrganismo possui uma grande habilidade de secretar ácidos orgânicos e enzimas colagenolíticas que são responsáveis por envolvimento em processos de cáries (KLINKE et aI., 2002).
L. thymoides é uma das plantas medicinais mais conhecidas desde a antiguidade, graças as suas propriedades medicinais, comestíveis e aromatizantes, é bastante utilizada para fins culinários e médicos, apresentando propriedades antioxidantes e antimicrobianas ( ALMEIDA, 2011).
O gênero Lippia (Verbenaceae), possui cerca de 200 espécies de ervas, arbustos e pequenas árvores, cujos maiores centros de dispersão se encontram em países das Américas do Sul e Central, como também em territórios da África tropical. O território brasileiro é um dos grandes centros de diversidade do gênero Lippia com aproximadamente 120 espécies conhecidas (PASCUAL, 2001; JUDD, 2002; TERBLANCHÉ & KOENELIUS, 1996; PIMENTA, 2007; GOMES, 2011; SOARES & TAVARES-DIAS, et al., 2013).
A utilização dessa espécie em vários tratamentos na medicina tradicional desencadeou uma série de estudos realizados, em várias áreas, com óleos e extratos comprovando que o gênero Lippia tem ação sedativa, antiespamódica, estomáquica, anti-inflamatória e antipirética, efeito antisséptico e cicatrizante, ação contra a malária, no tratamento de hipertensão, combate à sarna e larvas de Aedes aegypti (PASCUAL, 2001; CARVALHO, 2003; GOMES, 2011; LIMA, 2013; SOARES & TAVARES-DIAS, et al., 2013).
Lippia thymoides MART. & SCHAUER é um arbusto aromático de aproximadamente 1,0 m de altura conhecida popularmente como alecrim de cheiro miúdo (CRAVEIRO et al., 1981), alecrim do mato ou alecrim do campo (PINTO et al., 2013; FUNCH et al., 2004) e na região Amazônica, em especial em Abaetetuba-Pará, é conhecida como manjerona. É uma espécie nativa e endêmica brasileira com distribuição nos estados da Bahia e Minas Gerais nas áreas de vegetação da caatinga e cerrado (SALIMENA & MULGURA, 2014). Os óleos essenciais do gênero Lippia, relatados anteriormente, têm um perfil químico característico, apresentando com maior frequência os constituintes químicos limoneno, β-cariofileno, p-cimeno, cânfora, linalol, α-pineno, timol, 1,8-cineol, mircenona, carvona, α-tujona, tagetenona, piperitenona, perilaldeído, neral, geranial, carvacrol, acetato de timila, β- e γ-elemeno, β-cubebeno e lippifoli-1(6)-ene-5-one (TERBLANCHÉ & KOENELIUS, 1996; ZOGHBI, 1998; PASCUAL, 2001; ZOGHBI, 2002; MAIA, 2003; MAIA, 2005; MAIA & ANDRADE, et. al., 2009).
Este trabalho tem como objetivo avaliar a sensibilidade e a concentração inibitória mínima (CIM) frente à cepa padrão de Candida albicans por meio de microdiluições seriadas do extrato testando sua ação fungicida.
2. FUNDAMENTAÇÃO TEÓRICA OU REVISÃO DA LITERATURA
A associação entre a função que os princípios ativos e seus metabólitos desempenham, com a necessidade da identificação de novas moléculas com potencial antimicrobiano, indica que as plantas podem se tornar fontes de substâncias de interesse para a medicina natural. A confirmação dessa observação reside no fato de que vários constituintes provenientes de plantas utilizadas na medicina popular são empregados no tratamento de infecções (DOMINGO; LÓPEZBREA, 2003; SAMY; GOPALAKRISHNAKONE, 2008).
Vários metabólitos têm sido indicados como fontes de agentes antifúngicos e antimicrobianos, como alcaloides, compostos fenólicos, terpenos e óleos essenciais (COWAN, 1999; BURT, 2004). A utilização de informações obtidas na medicina popular tem sido utilizada como uma forma de rastrear possíveis plantas de interesse farmacológico na terapêutica antimicrobiana, especialmente quando se refere aos dados obtidos de pesquisas brasileiras (SOUZA et al., 2004). Nesse sentido, como a espécie L. thymoides é utilizada popularmente no tratamento de feridas, foi realizado uma investigação da atividade antimicrobiana dos óleos essenciais, extratos e frações das folhas e caules frente a bactérias e fungos.
O mecanismo pelo qual os óleos essenciais podem inibir o crescimento ou eliminar os microrganismos envolvem diferentes formas de ação, sendo em parte devido às suas características hidrofóbicas. Como resultado disso, os constituintes dos óleos podem atravessar a membrana plasmática e se ligar a componentes celulares essenciais para a vida dos microrganismos (EDRIS, 2007).
Os óleos essenciais de várias espécies de Lippia têm sido relatados como potenciais fontes de compostos antimicrobianos, apresentando tanto efeitos bacteriostáticos quanto bactericidas em micro-organismos Gram-positivos e negativos (ALBUQUERQUE et al., 2006; BASSOLE et al., 2003; MEVY et al., 2007; OHNO et al., 2003; OLIVEIRA et al., 2006). Outro aspecto relevante de óleos voláteis de Lippia ricos em monoterpenos corresponde à potencialização de fármacos antimicrobianos, provavelmente devido à desorganização da membrana plasmática das bactérias, permitindo que aqueles a atravessem com maior facilidade (VERAS et al., 2011; VERAS et al., 2012).
As frações que apresentaram significativa atividade antimicrobiana foram as que demonstraram maior teor de fenóis totais, indicando uma correlação entre a presença dessas classes de metabólitos secundários com o efeito sobre micro-organismos. Os compostos fenólicos possuem um amplo espectro de ação sobre bactérias e fungos, apresentando como alvos de ação desde a membrana plasmática dos microrganismos a inativação de enzimas essenciais em processos metabólicos essenciais (COWAN, 1999).
3. METODOLOGIA
OBTENÇÃO DO ÓLEO ESSENCIAL POR HIDRODESTILAÇÃO
O material botânico (parte área) foi colhido manualmente às 6 horas da manhã, transportado de imediato para o laboratório, em seguida colocado sobre bandejas, em estufa (340C), com ventilação, para secagem durante três dias, após isso foi triturado em processador. A extração do óleo essencial das folhas secas de L. thymoides foi realizada por hidrodestilação (HD), utilizando sistema de vidro do tipo Clevenger modificado e acoplado a um sistema de refrigeração para manutenção da água de condensação entre 10º-15º C, durante 3 h. Os óleos, após extração foram centrifugados durante 5 min a 3000 rpm, desidratados com Na2SO4 anidro e novamente centrifugados nas mesmas condições. Os óleos foram armazenados em ampolas de vidro âmbar, vedadas com chama e, acondicionados em ambiente refrigerado a 5ºC.
CÁLCULO DO RENDIMENTO DO ÓLEO ESSENCIAL EXTRAÍDO POR HIDRODESTILAÇÃO
O rendimento mássico (%) do óleo essencial foi realizado em base seca de acordo com a equação:
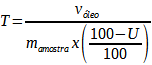
Onde:
- T é o teor do óleo essencial, em %;
- V óleo é o volume de óleo extraído, em mL;
- M amostra é a massa vegetal bruta, em g;
- U é o teor de umidade presente na massa vegetal bruta, em %.
IDENTIFICAÇÃO DOS CONSTITUINTES QUÍMICOS
A composição química dos óleos essenciais foi analisada por Cromatografia de Fase Gasosa/Espectrometria de Massas no equipamento Shimadzu QP 2010 plus, auto-injetor: AOC-20i equipado com coluna capilar de sílica Rtx-5MS (30m x 0,25 mm; 0,25 mμ de espessura do filme) nas seguintes condições operacionais: programa de temperatura: 60°-240°C, com gradiente de 3°C/min); temperatura do injetor: 250°C; gás de arraste: hélio (velocidade linear de 32 cm/s, medida a 100°C); injeção sem divisão de fluxo (0,1 μL de uma sol. 2:1000 de n-hexano); temperatura da fonte de íons e outras partes 200°C. O filtro de quadrupolo foi utilizado para varredura na faixa de 39 a 500 daltons a cada segundo. A ionização será obtida pela técnica de impacto eletrônico a 70 eV.
A identificação dos componentes voláteis foi baseada no índice de retenção linear (IR) calculado em relação aos tempos de retenção de uma série homóloga de n-alcanos e no padrão de fragmentação observados nos espectros de massas, por comparação destes com amostras autênticas existentes nas bibliotecas do sistema de dados e da literatura (ADAMS, 2007).
ANÁLISE MICROBIOLÓGICA
As análises microbiológicas foram realizadas na Faculdade de Farmácia do Centro Universitário do Estado do Pará – Cesupa, no laboratório de Microbiologia e Análises Químicas.
ANÁLISE DA ATIVIDADE ANTIMICROBIANA IN VITRO
Nos ensaios microbiológicos foi utilizada uma cepa de microrganismos padrão de (Candida albicans ATCC 90028) adquirido da Fundação Oswaldo Cruz (FIOCRUZ) e pertencente ao banco de padrões do Laboratório de Controle de qualidade microbiológico de medicamentos do Centro Universitário do Pará-CESUPA.
O inóculo foi obtido a partir de uma suspensão bacteriana de uma cultura recente (máximo 24 h) em solução salina 0,85% (m/V). A concentração do microrganismo foi padronizada pela comparação turbidez do inóculo com a escala MacFarland equivalente a concentração de 1,5×108 UFC/mL (NCCLI M7-A7, 2006) em turbidímetro de marca Grant-Bio-Den-1, modelo V.1GW.
CONTROLE POSITIVO E NEGATIVO
O antifúngico nistatina (Nystatin®) N6261- SIGMA-ALDRICHT foi usado como controle positivo na concentração de (1mg/mL) ; como controles negativos foram adotadas a cultura do microrganismo avaliado e o meio estéril. Os meios de cultura utilizados para análise foram o ágar cérebro e coração (BHI) contendo polissorbato 80 à 0.5% (m/V).
AVALIAÇÃO DA SENSIBILIDADE DA AMOSTRA PELO MÉTODO DE DIFUSÃO EM ÁGAR
Para preparar as placas foram vertidos 11 mL do Ágar BHI em placas de 15×100 mm. Sobre essa camada de meio solidificada foram adicionados 10 mL do Agar BHI-inóculo contendo106 UFC/mL (F. Bras, 2010, NCCLI M7-A7, 2006).
Com as duas camadas de meio uniformemente sobrepostas e já solidificadas, foram adicionados papel de filtro com diâmetros de aproximadamente 6 e 8 mm (F. Bras, 2010) impregnados com 10 µL de óleo de Lippia thymoide. As amostras foram colocadas sobre a cultura e incubadas à 25°C/24h em ambiente de aerobiose (F. Bras, 2010, NCCLI M7-A7, 2006). A análise foi realiza em triplicata.
Após o período de incubação as placas foram reveladas com cloreto de trifeniltetrazólico à 7 mg/mL em ágar bacteriológico à 1% (m/V).
Os resultados dos halos (mm) foram mensurados com auxílio de um paquímetro e avaliados por meio de análise descritiva, frente aos valores de média, desvio padrão e coeficiente de variação.
DETERMINAÇÃO DA CONCENTRAÇÃO INIBITÓRIA MÍNIMA (CIM), PELO MÉTODO DE DILUIÇÃO EM CALDO
A CIM do óleo essencial foi realizada segundo a metodologia adaptada da microdiluição proposta por NCCLI M7-A7(2006). O teste foi realizado em tubos eppendorfs®, onde uma alíquota de 50 µL do óleo foi diluída na proporção 1:2 em caldo BHI contendo 105 UFC/mL até 15 diluições. Em seguida, as culturas foram incubado à 25°C/24h em estufa. O teste foi realizado em triplicata.
Após o período de incubação as placas foram reveladas pelo semeio de 40 µL da cultura de cada diluição em placas de petri (5×50 mm) contendo ágar SABORAUD e incubados por mais 24h/25°C. As placas foram avaliadas pela presença ou ausência de crescimento, quando comparadas aos grupos controle negativo e positivo. A CIM foi revelada na última diluição onde não houve crescimento microbiano.
Segundo tipo de revelação: Após a incubação, as placas foram reveladas com caldo bacteriológico à 1% (m/V) contendo solução de cloreto de trifeniltetrazólico 7 mg/mL. A manutenção da cor vermelha no meio é interpretada como presença de crescimento microbiano.
4. RESULTADOS
Na determinação da Concentração Inibitória Mínima (CIM), o óleo foi ativo até a diluição de 0.19 µL frente ao fungo testado. O resultado apresentado na tabela 1 revela que todas as amostras até a 9ª diluição apresentou atividade antimicrobiana, inibindo o crescimento da cepa padrão avaliada. Foi determinada como MIC a 9ª diluição. Com relação a avaliação da sensibilidade da amostra pelo método de difusão em ágar com os discos embebidos em extrato da Lippia thymoide, os halos em diâmetro formados na triplicata obtiveram os seguintes resultados para as amostras de acordo com a tabela 2.
Os testes aplicados, obedeceram aos padrões de controle microbiológicos normativos. Esse resultado se revela promissor, tendo em vista que essa espécie de Lippia thymoide é encontrada em muitas regiões brasileiras e principalmente no bioma amazônico podendo ser usado como recurso alternativo para a medicina e odontologia preventiva em casos de Candidíase oral.
Tabela 1 – Amostra dos resultados da atividade microbiana em 9 diluições
AMOSTRA/ DILUIÇÃO (µL) LÍPIA I II III 1º 50 – – – 2º 25 – – – 3º 12,5 – – – 4º 6,25 – – – 5º 3,0625 – – – 6º 1,53 – – – 7º 0,76 – – – 8º 0,38 – – – 9º 0,19 – – – 10º 0,095 MIC + MIC Crescimento + (+) Crescimento – (MIC)
Fonte: Autor, 2023
Imagem 01- Referente a tabela 1 (CIM microdiluição)
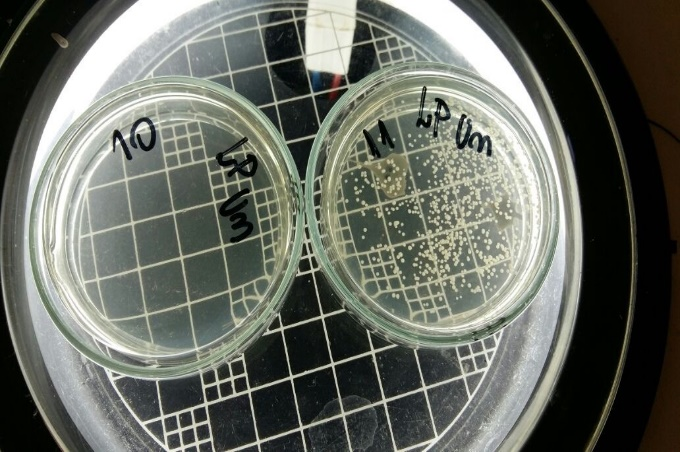
Fonte: Autor, 2023
Imagem 02 – Referente a tabela 1 (CIM 9ª microdiluição)
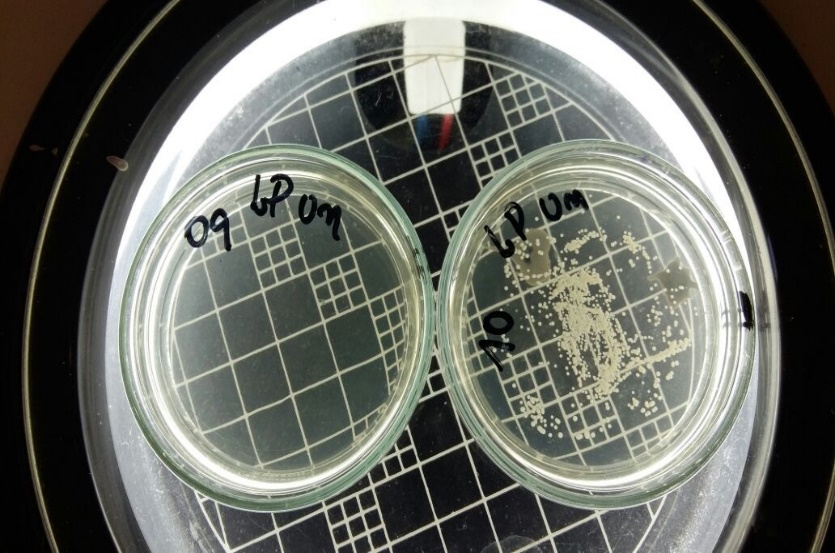
Fonte: Autor, 2023
Tabela 2-
Placa 1 Placa 2 Placa 3 41,5 mm 42,65 mm 38,8 mm
Fonte: Autor, 2023
Imagem 03 – Referente a tabela 2 (teste de sensibilidade)
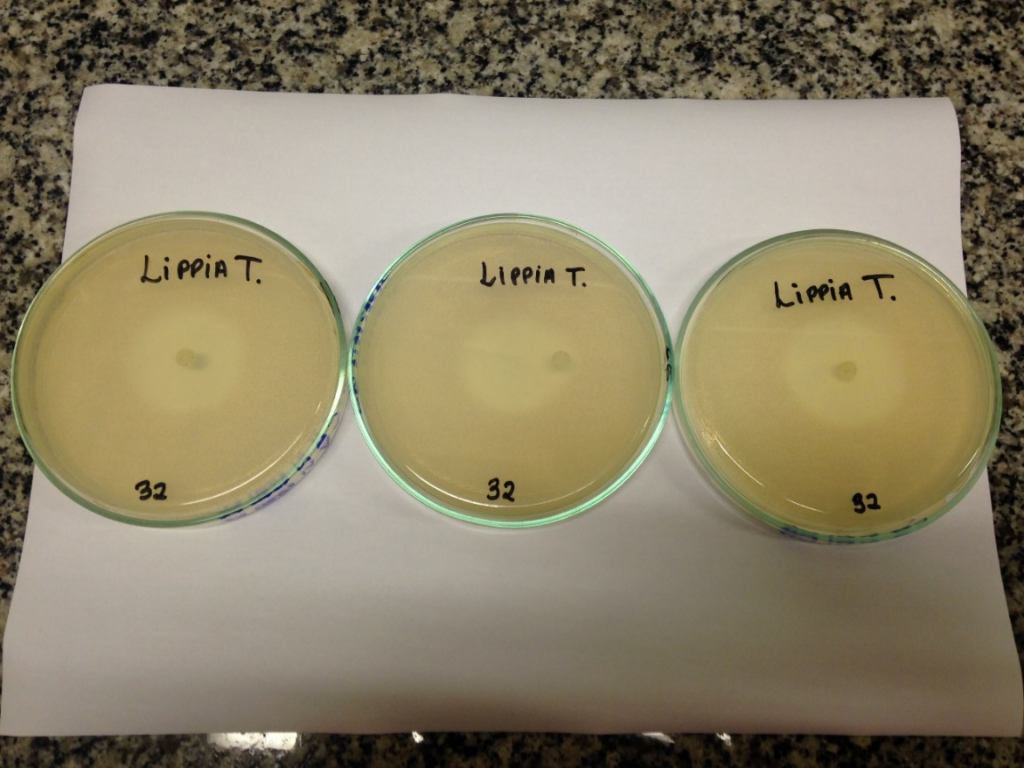
Fonte: Autor, 2023
5. DISCUSSÕES
Os dados apresentados nesse trabalho revelam o grande potencial farmacológico da espécie Lippia thymoides, planta encontrada no bioma amazônico. Tanto a técnica do extrato supercríticos como o da hidrodestilação em obtenção de óleos essenciais e extratos das folhas e caules de espécimes como a Lippia thymoides estudada, podem ser uma fonte imensurável de substâncias de interesse farmacêutico aplicados em abordagens terapêuticas odontológicas atuais.
Vários estudos tem apontados excelentes propriedades terapêuticas dos óleos essências. Entretanto, nos ensaios sobre atividade antifúngica, in vitro, dos óleos, é possível verificar uma variedade de metodologias propostas, o que torna a comparação com esses estudos problemáticas (MENEZES et al., 2008).
Pinto et al., em estudo de 2013 ao analisarem Lippia thymoides (caule, folhas e flores) sob cepa de C. albicans obteve como resultado resistência frente a amostra testada.
Oliveira et al., em 2007 ao testarem o óleo essencial de Lippia grandis observou que a mesma não inibiu o crescimento de C. Albicans, apesar do fato de que os óleos essenciais de outras espécies de Lippia demonstraram ter um efeito inibitório sobre C. Albicans.
Silva et al, em 2015, ao realizaram a análise química dos óleos essências de L. thymoides, durante as estações do ano na região do nordeste brasileiro, obteve como produto majoritário o β-cariofileno das amostras analisadas. A atividade antimicrobiana de óleos essenciais de L. thymoides foi testada contra bactérias Gram-negativos e Gram-positivos e fungos. Os microrganismos E. coli, P. aeruginosa, B. cereus e S. choleraesuis foram resistentes a todos os óleos essenciais já o Staphylococcus aureus e Candida albicans foram os microrganismos mais sensíveis com (MIC <0,004 mg / mL).
Silva et al, em 2014 ao testarem óleo essencial obtido das folhas/ramos in natura de L. thymoides na região da Amazônia apresentando o timol como constituinte majoritário, o qual é reportado na literatura como um potente antimicrobiano obteve como resultado atividade bactericida contra os microrganismos Bacillus subtilis e Escherichia coli.
Menezes et al., em 2008 avaliando óleos de várias plantas amazônicas como a Psidium guajava (goiabeira) e Eleutherine plicata (marupazinho) apresentaram moderada atividade antifúngica.
Desta forma, os resultados encontrados em nesta pesquisa demonstram que o óleo da Lippia thymoides (caule e folha) são promissores, pois observa-se um grande potencial antifúngico e bacteriano desta planta em nosso bioma amazônico
6. CONCLUSÃO/CONSIDERAÇÕES FINAIS
Dessa forma, conclui-se que o óleo essencial da espécie Lippia thymoides (Verbenacea) inibe o crescimento microbiano, predominantemente, devido à sua ação fungicida frente à cepa padrão Candida Albicans. Tais resultados indicam o potencial de uso dos óleos essenciais dessas plantas como produto alternativo aos antifungicidas convencionais
REFERÊNCIAS
NCCLS. NCCLS document M7-A7 – Methods for dilution antimicrobial susceptibility tests for bacteria that grow Aerobically; 7ª ed. Wayne (Pennsylvania): NCCLS; 2006.
NCCLS. NCCLS document M38-A2 – Reference Method of broth diluition Antifungal Susceptibility tests of filamrntous Fungi; 2ª ed. Wayne (Pennsylvania): NCCLS; 2008.
DOMINGO, D.; LÓPEZ-BREA, M. Plantas con acción antimicrobiana. Revista Española de Quimiterapia, v. 16, p. 385-393, 2003
ALMEIDA, M. Z. DE. Plantas medicinais. 3. ed. – Salvador : EDUFBA, p. 221, 2011.
DUPUY A, David M, Li L, Heider T, Peterson J, Montano E, et al. Redefining the human oral mycobiome with improved practices in amplicon-based taxonomy: discovery of Malassezia as a prominent commensal. PLoS One. 2014 Mar 10;9(3):e90899. doi: 10.1371/journal.pone.0090899.
MILLSOP J, Fazel N. Oral candidiasis. Clin Dermatol. 2016 Jul-Aug;34(4):487-94. doi: 10.1016/j.clindermatol.2016.02.022.
PRETZL B, Sälzer S, Ehmke B, Schlagenhauf U, Dannewitz B, Dommisch H, et al. Administration of systemic antibiotics during non-surgical periodontal therapy-a consensus report. Clin Oral Investig. 2019 Jul;23(7):3073-85. doi: 10.1007/s00784-018-2727-0.
HAAS A, Pannuti C, Andrade A, Escobar E, Almeida E, Costa F, et al. Mouthwashes for the control of supragingival biofilm and gingivitis in orthodontic patients: evidence-based recommendations for clinicians. Braz Oral Res. 2014 Jul;28(spe):1-8. doi: 10.1590/1807-3107bor-2014.vol28.0021.
OLIVEIRA J, Pinto M, Santana L, Pinto A, di Lenardo D, Vasconcelos D. Biological effects of medicinal plants on induced periodontitis: a systematic review. Int J Dent.2016;2016:3719879. doi: 10.1155/2016/3719879. Corrigendum to: 2018 Feb 27;2018:5656189. doi: 10.1155/2018/5656189.
LI X, Yang X, Deng H, Guo Y, Xue J. Gelatin films incorporated with thymol nanoemulsions: Physical properties and antimicrobial activities. Int J Biol Macromol. 2020 May;150:161-8. doi: 10.1016/j.ijbiomac.2020.02.066.
ANTUNES D, Salvia A, de Araújo R, Di Nicoló R, Koga Ito C, de Araujo M. Effect of green tea extract and mouthwash without alcohol on Candida albicans biofilm on acrylic resin. Gerodontology. 2015 Dec;32(4):291-5. doi: 10.1111/ger.12132
REGINATO C, Bandeira L, Zanette R, Santurio J, Alves S, Danesi C. Antifungal activity of synthetic antiseptics and natural compounds against Candida dubliniensis before and after in vitro fluconazole exposure. Rev Soc Bras Med Trop. 2017;50(1):75-9. doi: 10.1590/0037-8682-0461-2016
ARBIA L, Chikhi-Chorfi N, Betatache I, Pham-Huy C, Zenia S, Mameri N, et al. Antimicrobial activity of aqueous extracts from four plants on bacterial isolates from periodontitis patients. Environ Sci Pollut Res Int. 2017 May;24(15):13394-404. doi: 10.1007/s11356-017-8942-4.
JUIZ P, Lucchese A, Gambari R, Piva R, Penolazzi L, Di Ciano M, et al. Essential oils and isolated compounds from Lippia alba leaves and flowers: antimicrobial activityand osteoclast apoptosis. Int J Mol Med. 2015 Jan;35(1):211-7. doi: 10.3892/ijmm.2014.1995.
MOISE P, Sakoulas G, Forrest A, Schentag J. Vancomycin in vitro bactericidal activity and its relationship to efficacy in clearance of methicillin-resistant Staphylococcus aureus bacteremia. Antimicrob Agents Chemother. 2007 Jul;51(7):2582-6. doi: 10.1128/AAC.00939-06.
PAGE R, Offenbacher S, Schroeder H, Seymour G, Kornman K. Advances in the pathogenesis of periodontitis: summary of developments, clinical implications and future directions. Periodontol 2000. 1997 Jun;14:216-48. doi: 10.1111/j.1600-0757.1997.tb00199.x
LALLA R, Patton L, Dongari-Bagtzoglou A. Oral candidiasis: pathogenesis, clinical presentation, diagnosis and treatment strategies. J Calif Dent Assoc. 2013 Apr;41(4):263-8.
MILLSOP J, Fazel N. Oral candidiasis. Clin Dermatol. 2016 Jul-Aug;34(4):487-94. doi: 10.1016/j.clindermatol.2016.02.022.
FERNANDES T, Bhavsar C, Sawarkar S, D’souza A. Current and novel approaches for control of dental biofilm. Int J Pharm. 2018 Jan;536(1):199-210. doi: 10.1016/j.ijpharm.2017.11.019
KUANG X, Chen V, Xu X. Novel approaches to the control of oral microbial biofilms. Biomed Res Int. 2018 Dec;2018:6498932. doi: 10.1155/2018/6498932.
YOST S, Duran-Pinedo A, Teles R, Krishnan K, Frias-Lopez J. Functional signatures of oral dysbiosis during periodontitis progression revealed by microbial metatranscriptome analysis. Genome Med. 2015 Apr;7(1):27. doi: 10.1186/s13073-015-0153-3. Erratum to: 2015 Oct;7(1):111. doi: 10.1186/s13073-015-0231-6.
SOCRANSKY S. Microbiology of periodontal disease – present status and future considerations. J Periodontol. 1977 Sep;48(9):497-504. doi: 10.1902/jop.1977.48.9.497.
1 Discente do Curso Superior de Odontologia da Faculdade de Teologia, FIlosofia e Ciências humanas Gamaliel FATEFIG Campus Tucuruí-Pa. e-mail: ibra777pfe@gmail.com
2 Discente do Curso Superior de Odontologia da Faculdade de Teologia, Filosofia e Ciências Humanas gamaliel FATEFIG Campus Tucuruí-Pa. e-mail: ligiamota248@gmail.com
3 Department of periodontology, School of Dentistry, University Center of State of Pará, Belém, Pará, Brazil.
4 Laboratory of Virology, Institute of Biological Sciences, FederalUniversity of Pará, Belém, Pará, Brazil.
