REGISTRO DOI: 10.69849/revistaft/th10248261627
Daiani Munoz Moura1
Tawany Rannemam Pelentir Silva1
Kelly Lima Gomes1
RESUMO
A Leishmaniose Visceral (LV) é uma doença tropical negligenciada com significativa relevância para a saúde pública na região Norte do Brasil. Este estudo teve como objetivo analisar o perfil epidemiológico da LV humana nessa região no período de 2020 a 2022, utilizando dados de notificações oficiais do Sistema de Informação de Agravos de Notificação (SINAN). Foram avaliados aspectos como a distribuição geográfica, demográfica e temporal dos casos, além de fatores relacionados à mortalidade e ao acesso aos serviços de saúde. Os resultados mostraram que a LV permanece endêmica em vários estados da região Norte, com destaque para o Pará, seguido por Tocantins e Roraima. Durante o período estudado, foram notificados aproximadamente 972 casos, com uma taxa de mortalidade por LV igual a 6,28%. A maioria dos casos ocorreu em áreas rurais e periurbanas, destacando o papel do ambiente silvestre e do cão doméstico como reservatórios primários. A análise demográfica revelou que a doença afeta principalmente jovens entre 20 a 39 anos, com predominância de casos em indivíduos do sexo masculino (n=608 casos).. A mortalidade associada à LV na região Norte continuou elevada, especialmente em áreas com menor acesso a cuidados médicos e onde os tratamentos disponíveis são limitados. Fatores socioeconômicos, como baixa renda e condições de habitação precárias, foram identificados como determinantes importantes para a vulnerabilidade à LV. Além disso, a dificuldade de acesso a serviços de saúde adequados contribuiu para a alta taxa de mortalidade observada. Este estudo destaca a necessidade urgente de estratégias de controle mais eficazes na região Norte, incluindo campanhas de prevenção, melhorias no diagnóstico precoce e no tratamento adequado, além de maior investimento em pesquisa e desenvolvimento de novas terapias. A compreensão do perfil epidemiológico da LV é essencial para o desenvolvimento de políticas públicas que possam reduzir a incidência e a mortalidade da doença na região.
Palavras-chave: Leishmaniose Visceral, Epidemiologia, Doenças Tropicais Negligenciadas.
ABSTRACT
Visceral Leishmaniasis (VL) is a neglected tropical disease with significant public health relevance in the Northern region of Brazil. This study aimed to analyze the epidemiological profile of human VL in this region from 2020 to 2022, using official notification data from the Information System for Notifiable Diseases (SINAN). Aspects such as geographic, demographic, and temporal distribution of cases were evaluated, as well as factors related to mortality and access to healthcare services. The results showed that VL remains endemic in several states in the Northern region, with Pará, followed by Tocantins and Roraima, being the most affected. During the study period, approximately 972 cases were reported, with a mortality rate for VL of 6.28%. Most cases occurred in rural and peri-urban areas, highlighting the role of the wild environment and domestic dogs as primary reservoirs. Demographic analysis revealed that the disease mainly affects young adults between 20 to 39 years old, with a predominance of cases in males (n=608 cases). The mortality associated with VL in the Northern region remained high, especially in areas with limited access to medical care and where available treatments are scarce. Socioeconomic factors such as low income and poor housing conditions were identified as important determinants for VL vulnerability. Additionally, the difficulty in accessing adequate healthcare services contributed to the high mortality rate observed. This study highlights the urgent need for more effective control strategies in the Northern region, including prevention campaigns, improvements in early diagnosis and adequate treatment, as well as increased investment in research and development of new therapies.
Understanding the epidemiological profile of VL is essential for the development of public policies that can reduce the incidence and mortality of the disease in the region.
Keywords: Visceral Leishmaniasis, Epidemiology, Neglected Tropical Diseases.
INTRODUÇÃO
A Leishmaniose Visceral (LV) é uma doença crônica e sistêmica causada pelo protozoário Leishmania infantum, pertencente à família Trypanosomatidae. Este protozoário, também conhecido como L. chagasi, é transmitido por vetores e resulta em uma condição que pode ser fatal (Abbiati et al., 2019; Lima et al., 2009; Silva & Braga, 2010). A LV é a segunda maior causa de mortalidade entre as doenças tropicais e ocupa o sétimo lugar em termos de anos de vida ajustados por incapacidade (Wang et al., 2016; GBD, 2017). Devido à sua alta letalidade e ao significativo impacto na qualidade de vida dos pacientes, a Leishmaniose Visceral constitui um sério problema de saúde pública, necessitando de esforços contínuos em prevenção, controle e tratamento.
No entanto, a LV é vista principalmente como uma doença de países em desenvolvimento, o que resulta em pouco interesse da indústria farmacêutica em investir em sua pesquisa. Por essa razão, a LV é classificada entre as “doenças negligenciadas” (Pacheco-Fernandez et al., 2021; Yamey, 2002) Além disso, nas regiões mais impactadas, o acesso aos serviços de saúde é muitas vezes limitado e os medicamentos necessários são frequentemente inacessíveis, o que contribui para uma taxa de mortalidade ainda mais elevada (Murray, 2002).
Sem tratamento, a LV pode levar ao óbito em mais de 90% dos casos. A transmissão do agente etiológico para o ser humano envolve um vetor e um reservatório. O vetor é um díptero da família Psychodidae, subfamília Phlebotominae. A principal espécie transmissora é a Lutzomyia longipalpis, popularmente conhecida como mosquito-palha (Cunha et al., 2014). Outras espécies, como Lutzomyia cruzi e Lutzomyia migonei, também são mencionadas, embora com importância secundária em áreas geográficas específicas (Santos et al., 1998). Nas áreas urbanas, o cão (Canis familiaris) é o principal reservatório, enquanto em ambientes silvestres, as espécies de raposas Dusicyon vetulus, Cerdocyon thous e o marsupial Didelphis albiventris desempenham esse papel (Hoffmann et al., 2012; Mendes et al., 2011). A transmissão ocorre pela picada de um vetor infectado, que transmite o protozoário durante o repasto sanguíneo, seja para um reservatório, seja para o homem. A participação do vetor é essencial, não havendo contágio direto entre humanos ou entre humanos e cães (Nery et al., 2017; Ribeiro, 2007).
De acordo com a Organização Mundial da Saúde (OMS), quase 13.000 casos de LV foram registrados em 2020 (Ruiz-Postigo et al., 2021). A LV é endêmica em mais de 70 países espalhados por todos os continentes, exceto na Antártica e na Austrália, com uma população estimada de 200 milhões de pessoas em risco (Burza, S.; Croft, S.L.; Boelaert, M, 2018). No entanto, a maioria dos casos de LV está concentrada em sete países: Brasil, Etiópia, Índia, Quênia, Somália, Sudão do Sul e Sudão, que reportam mais de 90% dos casos mundiais de LV (Burza, S.; Croft, S.L.; Boelaert, M, 2018). Estima-se que ocorram 500.000 novos casos de LV e 50.000 mortes anualmente, números que provavelmente estão subestimados (Van Griensven, J.; Diro, E, 2012).
Leishmaniose refere-se a uma variedade de manifestações clínicas causadas por infecções de protozoários do gênero Leishmania, que inclui os subgêneros Leishmania e Vianna (ARONSON et al., 2016). As principais espécies responsáveis pela leishmaniose visceral (LV) são Leishmania donovani e Leishmania infantum, esta última também conhecida como Leishmania chagasi na América do Sul. A LV por L. donovani é prevalente no Sudeste Asiático, notadamente na Índia, Bangladesh e Nepal, assim como no Leste da África, em países como Sudão, Etiópia, Quênia e Somália (ARONSON et al., 2016). A doença pode afetar indivíduos de todas as idades, mas em regiões endêmicas, é mais comum entre crianças devido à imunidade adquirida pelos adultos. Em ambas as áreas, a incidência de LV segue um padrão cíclico: ela aumenta por um período de 2 a 5 anos, alcança um pico e depois diminui (WHO, 2016). Em 2014, foram registrados mais de 14.000 casos no Sudão, Sudão do Sul e Etiópia, enquanto Índia e Bangladesh relataram aproximadamente 10.000 casos (WHO, 2016).
O transmissor da Leishmania é a fêmea do flebótomo, um pequeno artrópode hematófago que mede entre 2 a 3 mm de comprimento e varia em cor do preto ao branco (PACE, 2014). Geralmente, esses insetos são ativos ao ar livre entre o anoitecer e o amanhecer, embora alguns possam picar dentro de casa e até mesmo durante o dia (PACE, 2014). Para a sobrevivência do parasito Leishmania, é necessário um reservatório mamífero. No caso da Leishmania donovani, o reservatório são humanos infectados, resultando em uma transmissão predominantemente humana (ciclos antrópicos) nas regiões asiáticas e africanas. Em contraste, a Leishmania infantum utiliza cães como seu principal reservatório, com lebres, coelhos selvagens e outros mamíferos selvagens servindo como reservatórios secundários, levando à transmissão zoonótica (ciclos zoonóticos) no Mediterrâneo e na América Latina (BERN; MAGUIRE; ALVAR, 2008).
O protozoário Leishmania apresenta duas formas principais: a promastigota, que é extracelular e se desenvolve dentro do flebótomo, e a amastigota, que é intracelular e reside nas células monócito-macrófagos do hospedeiro mamífero (PACE, 2014). As amastigotas se multiplicam dentro dessas células até que sejam liberadas por lise celular, permitindo a infecção de novos macrófagos. Essas diferentes formas do parasita são cruciais para o diagnóstico, especialmente por meio da visualização direta em amostras de tecido. As amastigotas intracelulares, observadas em colorações de amostras clínicas, são conhecidas como corpos de Leishman-Donovan (ARONSON et al., 2016; RATHER et al., 2022).
A LV pode apresentar uma ampla gama de sintomas, variando entre formas agudas e crônicas. O início dos sintomas é geralmente subagudo, insidioso e lentamente progressivo, raramente agudo. Nos casos agudos, a febre persistente é frequentemente um dos primeiros sinais, geralmente manifestandose de forma intermitente ou irregular. Os pacientes também costumam sofrer de perda significativa de apetite e peso, acompanhada por uma sensação de fadiga extrema e fraqueza generalizada. O aumento significativo do fígado (hepatomegalia) e do baço (esplenomegalia) é uma característica marcante da doença. Pancitopenia, mais frequentemente anemia e trombocitopenia, é comum, juntamente com a elevação das enzimas hepáticas e hipoalbuminemia com hipergamaglobulinemia. A pancitopenia varia em frequência e gravidade, mas geralmente está associada a doença prolongada (BERN et al., 2005; ARONSON et al., 2016; KIMBERLIN; BARNET, 2003).
A anemia normocítica normocrômica é frequentemente encontrada em adultos e crianças, mas parece ser mais grave em crianças. Estudos como o de Al-Jurrayan et al. relataram que todas as crianças em um grupo de 94 casos de LV estavam anêmicas (VARMA, 2010; AL-JURAYYAN et al., 1995). Dado que os parasitas se reproduzem não apenas no baço e no fígado, mas também na medula óssea, a pancitopenia grave pode ocorrer devido à combinação de vários fatores: supressão da hematopoiese, sequestro esplênico e hemólise. A febre geralmente é remitente com picos duas vezes ao dia, mas pode ser intermitente ou, menos frequentemente, contínua. Pacientes com LV podem se queixar de plenitude abdominal e desconforto devido à esplenomegalia, que pode causar dor quando aumenta rapidamente. A hepatomegalia é geralmente menos acentuada que a esplenomegalia, mas também pode estar presente (VARMA, 2010; AL-JURAYYAN et al., 1995).
Uma análise retrospectiva recente revelou que quase metade (45%) das crianças com menos de 15 anos afetadas por leishmaniose visceral apresentavam nódulos no baço, sendo que a idade média dessas crianças era significativamente menor do que a do grupo sem nódulos (8 meses em comparação a 21 meses). A presença de linfadenopatia é mais comum em casos de LV na África Oriental, como no Sudão do Sul, mas é rara em outras regiões onde a doença é endêmica. Com a progressão da LV, pode ocorrer comprometimento hepático, levando a sintomas como icterícia e ascite. A insuficiência do fígado e a trombocitopenia podem causar complicações hemorrágicas, incluindo sangramentos espontâneos nas mucosas nasal e oral. Se os protozoários invadirem o trato intestinal, pode-se observar sintomas como diarreia, má absorção de nutrientes e níveis baixos de albumina no sangue. A hipergamaglobulinemia, resultado da ativação das células B, é frequentemente observada (MELCHIONDA et al., 2014; LEVI; SILVAPALARATNAM, 2018).
O diagnóstico clínico da LV é complexo devido à sua semelhança com outras infecções, como febre tifóide, tuberculose, brucelose, malária, ou algumas doenças malignas hematológicas (SAFAVI et al., 2021). Em crianças com suspeita de LV (febre com esplenomegalia, hepatomegalia, perda de peso e sinais laboratoriais como pancitopenia e hipergamaglobulinemia ou síndrome hemofagocítica), o diagnóstico tradicionalmente é confirmado pela detecção direta de Leishmania em amostras de tecido ou culturas, ou por testes sorológicos. No entanto, esses métodos têm limitações: a detecção direta pode ter baixa sensibilidade e os testes sorológicos podem apresentar baixo desempenho em pacientes imunocomprometidos. Novas opções de diagnóstico, como kits de teste rápido e testes de reação em cadeia da polimerase (PCR), têm sido desenvolvidas. Para aumentar a precisão do diagnóstico, é recomendável o uso de múltiplas técnicas diagnósticas simultaneamente (ARONSON et al., 2016; VARANI et al., 2017).
O tratamento da LV continua a ser um desafio significativo devido à falta de opções terapêuticas satisfatórias e à crescente resistência aos medicamentos disponíveis. Atualmente, a quimioterapia é a única opção viável, centrada principalmente em compostos antimoniais pentavalentes como o estibogluconato de sódio (SSG) e o antimoniato de meglumina (MA), além de outras drogas como paromomicina, miltefosina e anfotericina B. No entanto, esses tratamentos enfrentam limitações sérias, incluindo resistência aos medicamentos e efeitos adversos significativos, como cardiotoxicidade, pancreatite, pancitopenia e nefrotoxicidade (Alves et al., 2018; Sundar; Agarwal, 2018; Sundar; Pakula, 2019). A abordagem terapêutica para a LV na faixa etária pediátrica é particularmente carente de estudos específicos, com crianças frequentemente sendo tratadas com protocolos adaptados de adultos. Esta lacuna na investigação científica motiva a necessidade urgente de estudos epidemiológicos e clínicos que abordem os desafios específicos do tratamento pediátrico da LV (SUNDAR; Chakravarty, 2010).
Na região Norte do Brasil, a leishmaniose visceral apresenta particularidades epidemiológicas que necessitam de uma abordagem diferenciada. Entre 2020 e 2022, a incidência da LV na região Norte manteve-se elevada, com uma distribuição heterogênea entre os estados, sendo o Pará, Tocantins e Roraima os mais afetados. A elevada incidência pode ser atribuída a fatores como condições climáticas favoráveis à proliferação do vetor, presença de reservatórios naturais e fatores socioeconômicos que dificultam o controle da doença (REIS., et al 2019). Além disso, a região enfrenta desafios adicionais no tratamento da LV devido ao acesso limitado a serviços de saúde especializados, à escassez de medicamentos e à resistência aos tratamentos convencionais. Programas de vigilância epidemiológica e controle vetorial, junto com campanhas educativas voltadas para a população e capacitação dos profissionais de saúde, são essenciais para a redução da incidência e mortalidade da doença na região. A implementação de estratégias de saúde pública, como o fortalecimento da infraestrutura de saúde e a promoção de pesquisas voltadas para a realidade local, é crucial para enfrentar a leishmaniose visceral na região Norte (BRASIL, 2021).
Considerando esses desafios terapêuticos e a lacuna de evidências na faixa etária pediátrica, o presente estudo tem como objetivo realizar uma análise epidemiológica detalhada dos casos de Leishmaniose Visceral registrados pelo Sistema de Informação de Agravos de Notificação (SINAN-DATASUS) na região Norte do Brasil, durante os anos de 2020 a 2022, com o intuit de fornecer informações cruciais sobre a distribuição geográfica da doença, características demográficas dos pacientes afetados e possíveis padrões de resistência aos tratamentos disponíveis. Esses dados são essenciais para orientar políticas públicas de saúde e estratégias de controle da LV, especialmente na população pediátrica, contribuindo assim para melhorar as práticas clínicas e reduzir o impacto da doença na região.
MATERIAL E MÉTODOS
Este trabalho representa um estudo epidemiológico descritivo e retrospectivo que se baseou na coleta de dados realizada através de consultas ao Sistema de Informação de Agravos de Notificação (SINAN) durante o período compreendido entre os anos de 2020 e 2022.
Durante esse processo, foram obtidos todos os dados sociodemográficos e epidemiológicos disponíveis no sistema de notificação, abrangendo informações como idade, sexo, raça/etnia, escolaridade, evolução dos casos, municípios de infecção, municípios de notificação e a possível coinfecção por HIV.
Esses dados coletados foram posteriormente organizados em forma de tabelas, as quais foram elaboradas utilizando a ferramenta Word. Importante ressaltar que os casos registrados no sistema foram tratados de forma que não permitisse a identificação individual dos pacientes, uma vez que apenas o número total de casos foi disponibilizado. Portanto, nenhuma pessoa foi ou será identificada, garantindo assim a privacidade e o anonimato dos envolvidos. Essa abordagem não apenas protege a confidencialidade dos indivíduos, mas também nos possibilita realizar uma análise segura e eficaz dos dados, visando compreender melhor a epidemiologia da Leishmaniose Visceral em nossa região.
RESULTADOS E DISCUSSÃO
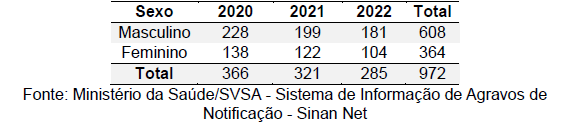
De forma retrospectiva, foram analisados 972 casos de Leishmaniose Visceral registrados em todo o território da região norte durante o período de 2020 a 2022. Observou-se uma distribuição variável dos casos ao longo dos anos, com um período de estabilidade entre 2012 e 2021, seguido por uma redução mais acentuada em 2022. A incidência média anual foi de 324 casos, sendo o ano de 2022 o de maior incidência, com 366 casos notificados, e o ano de 2022 o de menor incidência, com 285 casos (Tabela 1).
Tabela 1: Casos confirmado na região norte nos anos de 2020-2022

Com base na análise dos dados deste estudo, durante o período de 2020 a 2022, a região norte do Brasil apresentou um total de 972 casos confirmados de Leishmaniose Visceral (LV). Destes, a maior incidência foi registrada no estado do Pará, com 549 casos, seguido pelo estado do Tocantins, com 368 casos (conforme mostrado na Tabela 2). Essa distribuição sugere que fatores socioeconômicos e ambientais específicos podem estar contribuindo para a prevalência da LV no Pará.
A região amazônica, onde o Pará está localizado, é conhecida por suas vastas áreas de floresta tropical, onde a transmissão da leishmaniose muitas vezes ocorre em áreas rurais e periurbanas. Além disso, a pobreza, a falta de saneamento básico e o desmatamento são fatores que contribuem para o aumento do risco de infecção. O aumento da incidência de LV no Pará destaca a importância de investigações mais aprofundadas sobre os determinantes locais da doença, incluindo estudos epidemiológicos e análises ambientais. Além disso, ressalta a necessidade de implementar estratégias específicas de prevenção e controle, como programas de co
mento para a população afetada. Essas medidas são essenciais para reduzir a carga da doença e melhorar a qualidade de vida das comunidades afetadas pela LV na região norte do Brasil.
Tabela 2: Casos confirmados por estado da região norte nos anos de 2020 – 2022.
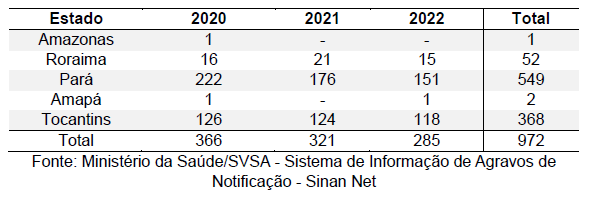
Os dados relacionados à evolução da leishmaniose visceral revelam informações importantes sobre os resultados clínicos da doença. A maioria dos casos, representando 71,3%, evoluíram para cura. Esse dado destaca a eficácia dos tratamentos disponíveis e sugere que a maioria dos pacientes responde de forma positiva aos protocolos terapêuticos estabelecidos. Essa constatação é crucial, pois indica que muitos indivíduos afetados podem recuperar sua saúde e qualidade de vida após o tratamento da leishmaniose visceral. Além disso, a alta taxa de cura pode ser atribuída a fatores como diagnósticos precoces, tratamentos adequados, e o acesso a serviços de saúde de qualidade.
Por outro lado, 6,28% dos casos resultaram em óbito. Embora essa porcentagem seja relativamente baixa comparada à taxa de cura, ainda representa uma preocupação significativa, especialmente considerando que a leishmaniose visceral é uma doença tratável. A mortalidade pode ser influenciada por vários fatores, incluindo a gravidade da doença no momento do diagnóstico, comorbidades dos pacientes, e dificuldades no acesso a cuidados de saúde em tempo hábil (Tabela 3).
Tabela 3: Evolução da Leishmaniose visceral nos anos de 2020 – 2022.
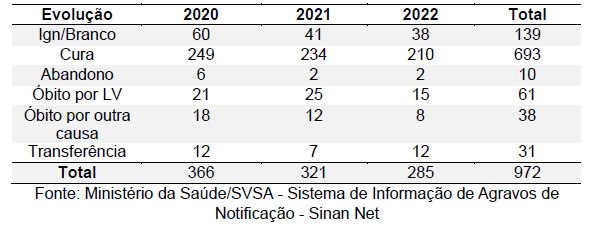
Levando em consideração as características epidemiológicas dos casos de Leishmaniose Visceral (LV) em residentes da região norte no período de 2020 a 2022, de um total de 972 casos, a faixa etária mais acometida corresponde aos jovens adultos de 20 a 39 anos, com 258 casos, representando aproximadamente 26,54% do total de casos. Em seguida, os indivíduos de 40 a 50 anos foram afetados, com 199 casos, correspondendo a aproximadamente 20,47% do total de casos. As crianças de 1 a 4 anos também apresentaram um número significativo de casos, com 177 casos, representando cerca de 18,20% do total de casos. Esses dados destacam a distribuição desigual dos casos de LV em diferentes faixas etárias na região norte durante o período mencionado. A alta incidência entre os jovens adultos pode estar relacionada a fatores como maior exposição a áreas endêmicas, comportamentos de risco e imunidade reduzida. A ocorrência substancial de casos em crianças sugere a necessidade de medidas preventivas adicionais direcionadas a essa faixa etária, bem como programas de vigilância e controle específicos para abordar as condições de transmissão em comunidades afetadas (Tabela 4).
Tabela 4: Casos confirmados segundo Faixa Etária 2020 – 2022.
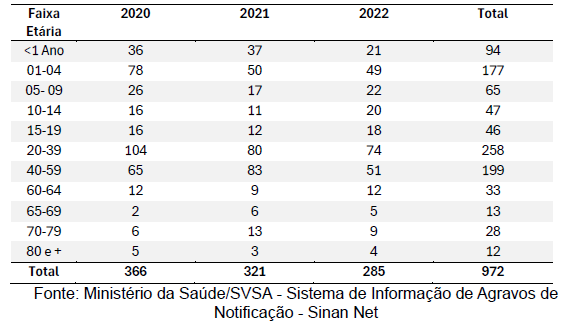
Com relação à variável sexo, o masculino representou 608 (62,55%) e o sexo feminino 364 (37,45%) do total de casos entre 2020 e 2022 evidenciado na Tabela 5.
Tabela 5: Casos confirmados por Sexo 2020 – 2022.
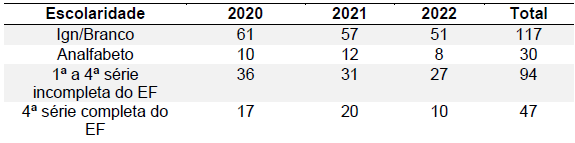
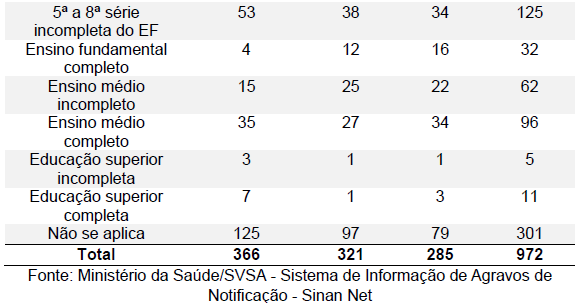
A análise dos casos de leishmaniose visceral revela uma relação significativa entre o nível de escolaridade dos indivíduos e a incidência da doença. Os dados mostram que o maior número de casos ocorreu entre pessoas com grau de escolaridade da 5ª a 8ª série incompleta do ensino fundamental, totalizando 125 casos. Este dado sugere que a falta de conclusão do ensino fundamental, especialmente nos anos intermediários, pode estar associada a um aumento na vulnerabilidade à leishmaniose visceral. Em seguida, observa-se que pessoas com ensino médio completo apresentaram 96 casos, sendo o segundo grupo mais afetado. Este fato indica que, embora tenham completado o ensino médio, esses indivíduos ainda estão significativamente expostos à doença, o que pode refletir que fatores além da escolaridade formal influenciam a vulnerabilidade. Além disso, o grupo com 1ª a 4ª série incompleta do ensino fundamental registrou 94 casos. Isso sugere que a baixa escolaridade, representada por poucos anos de estudo, pode estar correlacionada com menor acesso à informação sobre prevenção e tratamento da doença, bem como com condições socioeconômicas desfavoráveis que aumentam o risco de exposição ao vetor da leishmaniose visceral.
Os dados indicam que a maior incidência entre aqueles que têm escolaridade de 5ª a 8ª série incompleta pode estar relacionada a diversos fatores. Esses indivíduos podem ter acesso limitado a informações sobre prevenção e tratamento, vivem frequentemente em condições socioeconômicas mais precárias, e têm comportamentos e estilos de vida que aumentam o risco de exposição ao vetor da doença. Por outro lado, o fato de que mesmo aqueles com ensino médio completo apresentam um número significativo de casos (96) sugere que a educação formal, por si só, não é suficiente para prevenir a doença. Isso pode ser atribuído à persistência de condições ambientais desfavoráveis e à falta de intervenções específicas de saúde pública nesse grupo. A proximidade dos números de casos entre aqueles com ensino médio completo e aqueles com 1ª a 4ª série incompleta (96 e 94 casos, respectivamente) sugere que o simples aumento nos anos de escolaridade não resolve o problema por completo (Tabela 6). É necessário um enfoque mais integrado que inclua campanhas educativas específicas sobre a prevenção da leishmaniose, melhorias nas condições de habitação e saneamento básico, e a facilitação do acesso aos serviços de saúde para diagnóstico e tratamento precoces.
Tabela 6: Casos confirmados segundo Escolaridade
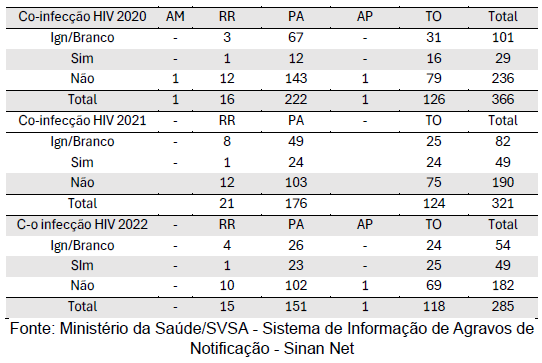
Ao analisar de maneira qualitativa, foi calculado o percentual de coinfecção em cada estado da região norte e, foi observado que o Tocantins (n=65) com 51,18%, apresentou o maior percentual dentre os estados estudados ,seguido pelo estado do Pará (n=59), com 46,46%.
Concomitantemente, o estado de Roraima manifestou a menor porcentagem, com 2,36% dos casos de Leishmaniose Visceral apresentando coinfecção por HIV (Tabela 7).
Tabela 7: Casos confirmados por UF de notificação segundo Co-infecção HIV
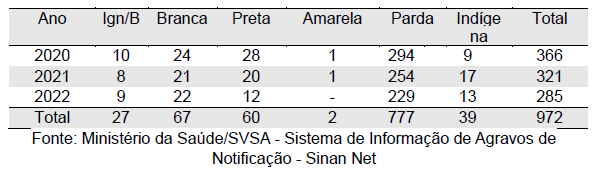
Em relação à etnia, a cor parda foi a mais comumente declarada, representando 79,94% dos casos. Esses dados indicam uma predominância significativa da cor parda entre os casos de Leishmaniose Visceral (Tabela 8). Esse achado pode refletir as características demográficas da população afetada na região estudada. A cor parda pode ser mais prevalente em determinadas áreas geográficas, influenciada por fatores como composição étnica e distribuição populacional. Além disso, questões socioeconômicas e de acesso à saúde podem desempenhar um papel importante na incidência da doença em determinados grupos étnicos. Portanto, é crucial considerar esses aspectos ao desenvolver estratégias de prevenção e controle da Leishmaniose Visceral, garantindo abordagens inclusivas e eficazes que atendam às necessidades específicas das comunidades afetadas.
Tabela 8: Casos confirmados por Raça
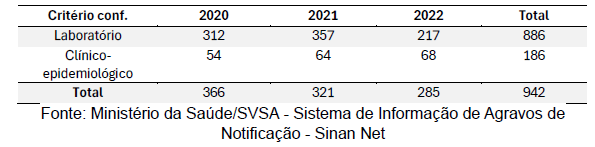
Entre 2020 e 2022, foram registrados 942 casos de leishmaniose visceral na região norte do Brasil. Desses, 886 casos (94%) foram confirmados por critérios laboratoriais, enquanto 186 casos (20%) foram confirmados por critérios clínico-epidemiológicos (Tabela 9)
Tabela 9: Critérios de conferência
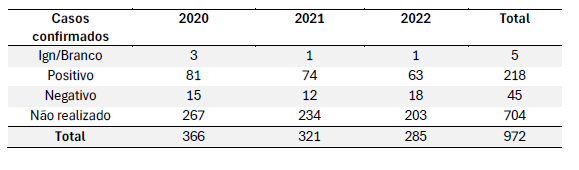
Entre 2020 e 2022, foram registrados 218 casos positivos de leishmaniose visceral na região norte do Brasil, 45 casos negativos, 704 testes não realizados e 5 registros com dados ignorados ou em branco. Os 218 casos positivos refletem tanto a incidência da doença quanto a eficácia dos métodos diagnósticos utilizados, sendo essenciais para o tratamento adequado. No entanto, os 704 testes não realizados são preocupantes, indicando uma grave falta de confirmação diagnóstica, possivelmente causada por limitações no acesso a serviços de saúde, recursos laboratoriais escassos ou problemas logísticos e administrativos. Essa ausência de diagnóstico confirmado impede o tratamento eficaz e aumenta o risco de complicações e disseminação da doença. Além disso, os 5 casos com dados ignorados ou em branco apontam para falhas na coleta e registro de informações, dificultando a avaliação precisa da situação epidemiológica e a tomada de decisões informadas para o controle da doença.
Tabela 10: Casos confirmados na região norte
CONSIDERAÇÕES FINAIS
A análise do perfil epidemiológico da leishmaniose visceral humana na região norte do Brasil entre 2020 e 2022 revelou importantes dados sobre a distribuição e características dessa doença. Observou-se que a leishmaniose visceral ainda representa um significativo desafio de saúde pública, com uma alta incidência em diversas faixas etárias, especialmente entre crianças e jovens adultos. A predominância de casos em indivíduos de baixa escolaridade aponta para a necessidade de estratégias educativas e preventivas direcionadas a essas populações mais vulneráveis.
Os dados indicam uma elevada taxa de cura, mas a mortalidade ainda é preocupante, especialmente em função das complicações associadas à doença e às comorbidades presentes em muitos pacientes. A distribuição geográfica dos casos sugere a necessidade de intervenções mais focalizadas em áreas específicas da região norte, onde a incidência é maior.
Além disso, a identificação de desafios no diagnóstico e no tratamento da leishmaniose visceral, como a resistência aos medicamentos e a falta de abordagens terapêuticas específicas para populações pediátricas, reforça a urgência de investimentos em pesquisa e desenvolvimento de novas opções terapêuticas. As evidências apontam para a importância de políticas públicas eficazes que integrem ações de vigilância epidemiológica, controle vetorial, educação em saúde e melhorias no acesso ao diagnóstico e tratamento. Somente através de uma abordagem multidisciplinar e integrada será possível reduzir a carga da leishmaniose visceral na região norte do Brasil e melhorar os desfechos clínicos para os pacientes afetados.
REFERÊNCIAS BIBLIOGRÁFICAS
ABBATI, T. C., FREITAS, D. M., ALVES, L. C., FREITAS, B. G., REZENDE, R. S., BARBOSA, S. G., JORGE, A. L. T. A., SANTOS, S. M., & LOPES, M. C. Leishmaniose visceral canina: Relato de caso. PUBVET, 13, 1–8, 2019.
AL-JURAYYAN, N.A.M.; AL-NASSER, M.N.; AL-FAWAZ, I.M.; AL AYED, I.H.; AL HERBISH, A.S.; MAZROU, A.M.M.; AL SOHAIBANI, M.O. The Haematological Manifestations of Visceral Leishmaniasis in Infancy and Childhood. J. Trop. Pediatr. 1995, 41, 143–148.
ALVES, F.; BILBE, G.; BLESSON, S.; GOYAL, V.; MONNERAT, S.; MOWBRAY, C.; OUATTARA, G.M.; PÉCOUL, B.; RIJAL, S.; RODE, J.; et al. Recent Development of Visceral Leishmaniasis Treatments: Successes, Pitfalls, and Perspectives. Clin. Microbiol. Rev. 2018, 31, 1–30.
ARONSON, N.; HERWALDT, B.L.; LIBMAN, M.; PEARSON, R.; LOPEZ-VELEZ, R.; WEINA, P.; CARVALHO, E.M.; EPHROS, M.; JERONIMO, S.; MAGILL, A. Diagnosis and Treatment of Leishmaniasis: Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin. Infect. Dis, 63, 1539–1557, 2016.
ATTARD, L.; VANINO, E.; GAIBANI, P.; VOCALE, C.; ROSSINI, G.; CAGARELLI, R.; PIERRO, A.; BILLI, P.; VARANI, S.; ORTALLI, M. Serological and Molecular Tools to Diagnose Visceral Leishmaniasis: 2-Years’ Experience of a Single Center in Northern Italy. PLoS ONE, 12, e0183699, 2017.
BRASIL, Saúde lança nova estratégia para controle da leishmaniose visceral.2021. Disponivel em< https://www.gov.br/saude/pt-br/assuntos/noticias/2021/agosto/saude-lanca-nova-estrategia-para-controleda-leishmaniose-visceral> Acessado em> 22 de Junho de 2024.
BERN, C.; HIGHTOWER, A.W.; CHOWDHURY, R.; ALI, M.; AMANN, J.; WAGATSUMA, Y.; HAQUE, R.; KURKJIAN, K.; VAZ, L.E.; BEGUM, M.; et al. Risk Factors for Kala-Azar in Bangladesh. Emerg. Infect. Dis. 2005, 11, 655–662.
BURZA, S.; CROFT, S.L.; BOELAERT, M. Leishmaniasis. Lancet 2018, 392, 951–970.
CUNHA, R. C., ANDREOTTI, R., COMINETTI, M. C., & SILVA, E. A. (2014). Detection of Leishmania infantum in Lutzomyia longipalpis captured in Campo Grande, MS. Revista Brasileira de Parasitologia Veterinária, 23, 269–273.
EPHROS, M.; YERNO, L. Revival of Leishmanization and Leishmanin. Front.Cell. Infect. Microbiol. 2021, 11, 639801.
HOFFMANN, A. R., NAVARRO, I. T., CAMARGO JUNIOR, V. E., CALDART, E. T., BREGANÓ, R. M., & PEREIRA, P. M. (2012). Leishmania amazonensis em cão com quadro clínico de leishmaniose visceral no Estado do Paraná, Brasil– relato de caso. Semina: Ciências Agrárias, 33(2), 3265–3270.
JERONIMO, S.; MAGILL, A. Diagnosis and Treatment of Leishmaniasis: Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin. Infect. Dis. 2016, 63, 1539–1557.
LIMA, M. B., & BATISTA, E. A. R. (2009). Epidemiologia da leishmaniose visceral humana em FortalezaCE. Revista Brasileira Em Promoção Da Saúde, 22(1), 16–23.
MAGILL, A.; ARONSON, N.; PEARSON, R. Diagnosis and Treatment of Leishmaniasis: Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA) and the American Society of Tropical Medicine and Hygiene (ASTMH). Clin. Infect. Dis. 2016, 63, 1539–1557.
MELCHIONDA, F.; VARANI, S.; CARFAGNINI, F.; BELOTTI, T.; DI MUCCIO, T.; TIGANI, R.; BERGAMASCHI, R.; Pession, A. Spleen Nodules: A Potential Hallmark of Visceral Leishmaniasis in Young Children. BMC Infect. Dis. 2014, 14, 620.
MURRAY, H. Kala-Azar—Progress against a Neglected Disease. N. Engl. J. Med. 2002, 145, 127–145.
NERY, G., BECERRA, D. R. D., BORJA, L. S., SOUZA, B. M. P. S., FRANKE, C. R., VERAS, P. S. T., LARANGEIRA, D. F., & BARROUIN-MELO, S. M. (2017). Avaliação da infectividade parasitária a Lutzomyia longipalpis por xenodiagnóstico em cães tratados para leishmaniose visceral naturalmente adquirida. Pesquisa Veterinária Brasileira, 37, 701–707.
PACE, D. Leishmaniasis. J. Infect. 2014, 69, S10–S18.
REIS, L. L. DOS.; BALIEIRO, A. A. DA S.; FONSECA, F. R.; GONÇALVES, M. J. F. Leishmaniose visceral e sua relação com fatores climáticos e ambientais no Estado do Tocantins, Brasil, 2007 a 2014. Cadernos de Saúde Pública, v. 35, n. 1, p. e00047018, 2019.
SAFAVI, M.; ESHAGHI, H.; HAJIHASSANI, Z. Visceral Leishmaniasis: Kala-Azar.Diagn. Cytopathol. 2021, 49, 446–448.
SANTOS, S. O., ARIAS, J., RRIBEIRO, A. A., HOFFMANN, M. P., FREITAS, R. A., & MALACCO, M. A. F. (1998). Incrimination of Lutzomyia cruzi as a vector of American visceral leishmaniasis. Medical and Veterinary Entomology, 12(3), 315–317.
SILVA, O. A., & BRAGA, G. M. S. (2016). Leishmaniose visceral canina no município de São Vicente Férrer, Estado de Pernambuco, Brasil. PUBVET, 4, 879–885.
SUNDAR, S.; AGARWAL, D. Visceral Leishmaniasis—Optimum Treatment Options in Children. Pediatr. Infect. Dis. J. 2018, 37, 492–494.
SUNDAR, S.; CHAKRAVARTY, J. Antimony Toxicity. Int. J. Environ. Res. Public Health 2010, 7, 4267–4277.
SUNDAR, S.; PAKULA, A. Chemotherapeutics of Visceral Leishmaniasis: Present and Future Developments. Methods Mol. Biol. 2019, 176, 139–148.
VARMA, N.; NASEEM, S. Hematologic Changes in Visceral Leishmaniasis/Kala Azar. Indian J. Hematol. Blood Transfus. 2010, 26, 78–82.
WANG, H.; NAGHAVI, M.; ALLEN, C.; BARBER, R.M.; CARTER, A.; CASEY, D.C.; CHARLSON, F.J.; CHEN, A.Z.; COATES, M.M.; COGGESHALL, M.; et al.
Global, Regional, and National Life Expectancy, All-Cause Mortality, and CauseSpecific Mortality for 249 Causes of Death, 1980–2015: A Systematic Analysis for the Global Burden of Disease Study 2015.
Faculdade da Amazônia – UNAMA Porto Velho1
