CULTURE POSITIVITY PROFILE IN A NEONATAL INTENSIVE CARE UNIT IN A PRIVATE HOSPITAL IN SERGIPE
PERFIL DE CULTURA POSITIVIDAD EN UNA UNIDAD DE CUIDADOS INTENSIVOS NEONATALES DE UN HOSPITAL PRIVADO DE SERGIPE
REGISTRO DOI: 10.69849/revistaft/cl10202411082004
Guilherme Oliveira Rosada1
Deivison Souto Dinizio2
Marcos Alves Pavione3
RESUMO
OBJETIVOS: Este estudo apresenta, como objetivo primário, a necessidade de identificar a prevalência de hemoculturas positivas e qual o perfil de patógenos mais comuns na principal maternidade privada do estado, em Aracaju (SE) e, como objetivo secundário, avaliar o padrão de resistência aos antibióticos dos patógenos mais comuns. METODOLOGIA: Trata-se de um estudo observacional, descritivo e transversal. Será utilizada uma amostra de conveniência de forma a incluir todos os recém nascidos (até 28 dias) que tiveram hemoculturas realizadas no período de estudo dentro da unidade de terapia intensiva neonatal (UTIN). O período de inclusão do estudo foi de janeiro a dezembro de 2023. Não há critérios de exclusão para a população estudada. RESULTADOS/DISCUSSÃO: Das 677 hemoculturas realizadas durante o período de estudo, 23 apresentaram resultados positivos, com a identificação de 13 bactérias gram-positivas, 7 patógenos gram-negativos e 5 fungos. Os estafilococos exibiram altas taxas de resistência à ampicilina e gentamicina. Entre as culturas positivas para Staphylococcus aureus, 66% mostraram resistência à oxacilina. Os patógenos gram-negativos apresentaram sensibilidade à gentamicina e resistência à ampicilina, com resposta favorável ao uso de cefotaxima, enquanto as bactérias gram-negativas multirresistentes demonstraram sensibilidade ao uso de meropenem. CONCLUSÃO: Os microrganismos mais prevalentes no hospital de estudo foram os estafilococos dentre os gram-positivos (Staphylococcus coagulase-negativo, S. aureus), que apresentaram alto nível de resistência a terapias usuais como oxacilina/ampicilina associada a gentamicina, sugerindo a necessidade de reavaliar o uso desses antibióticos. Já entre os gram-negativos, estes que ainda demonstram sensibilidade aos aminoglicosídeos e carbapenêmicos, destacou-se a Klebsiella pneumoniae.
Palavras chaves: Hemocultura; Neonatologia; Sepse neonatal.
ABSTRACT
OBJECTIVES: This study presents, as a primary objective, the need to identify the prevalence of positive blood cultures and the profile of the most common pathogens in the main private maternity hospital in the state, in Aracaju (SE) and, as a secondary objective, to evaluate the antibiotic resistance pattern of the most common pathogens. METHODOLOGY: This is an observational, descriptive, and cross-sectional study. A convenience sample will be used to include all newborns (up to 28 days) who had blood cultures performed during the study period within the neonatal intensive care unit (NICU). The study inclusion period was from January to December 2023. There are no exclusion criteria for the study population. RESULTS/DISCUSSION: Of the 677 blood cultures performed during the study period, 23 presented positive results, with the identification of 13 grampositive bacteria, 7 gram-negative pathogens, and 5 fungi. Staphylococci exhibited high rates of resistance to ampicillin and gentamicin. Among the cultures positive for Staphylococcus aureus, 66% showed resistance to oxacillin. Gram-negative pathogens showed sensitivity to gentamicin and resistance to ampicillin, with a favorable response to the use of cefotaxime, while multidrug-resistant Gram-negative bacteria demonstrated sensitivity to the use of meropenem. CONCLUSION: The most prevalent microorganisms in the study hospital were staphylococci among the Gram-positives (coagulase-negative Staphylococcus, S. aureus), which showed a high level of resistance to usual therapies such as oxacillin/ampicillin associated with gentamicin, suggesting the need to reevaluate the use of these antibiotics. Among the Gram-negatives, which still demonstrate sensitivity to aminoglycosides and carbapenems, Klebsiella pneumoniae stood out.
Keywords: Blood culture; Neonatology; Neonatal sepsis.
RESUMEN
OBJETIVOS: Este estudio presenta, como objetivo principal, la necesidad de identificar la prevalencia de hemocultivos positivos y el perfil patógeno más común en la principal maternidad privada del estado, en Aracaju (SE) y, como objetivo secundario, evaluar el patrón de resistencia a los antibióticos para los patógenos más comunes. METODOLOGÍA: Se trata de un estudio observacional, descriptivo y transversal. Se utilizará una muestra de conveniencia para incluir a todos los recién nacidos (hasta 28 días) a quienes se les realizaron hemocultivos durante el período de estudio dentro de la unidad de cuidados intensivos neonatales (UCIN). El período de inclusión del estudio fue de enero a diciembre de 2023. No existen criterios de exclusión para la población estudiada. RESULTADOS/DISCUSIÓN: De los 677 hemocultivos realizados durante el período de estudio, 23 arrojaron resultados positivos, identificándose 13 bacterias grampositivas, 7 patógenos gramnegativos y 5 hongos. Los estafilococos mostraron altas tasas de resistencia a la ampicilina y la gentamicina. Entre los cultivos positivos para Staphylococcus aureus, el 66% mostró resistencia a la oxacilina. Los patógenos gramnegativos mostraron sensibilidad a la gentamicina y resistencia a la ampicilina, con una respuesta favorable al uso de cefotaxima, mientras que las bacterias gramnegativas multirresistentes demostraron sensibilidad al uso de meropenem. CONCLUSIÓN: Los microorganismos más prevalentes en el hospital del estudio fueron los estafilococos grampositivos (Staphylococcus coagulasa negativo, S. aureus), los cuales mostraron un alto nivel de resistencia a terapias habituales como oxacilina/ampicilina asociada a gentamicina, lo que sugiere la necesidad de reevaluar el uso de estos antibióticos. Entre los gramnegativos, aquellos que aún muestran sensibilidad a los aminoglucósidos y carbapenémicos, destacó Klebsiella pneumoniae.
Palabras clave: Hemocultivo; Neonatología; sepsis neonatal.
INTRODUÇÃO
A Unidade de Terapia Intensiva Neonatal (UTIN) é um ambiente especializado no atendimento de neonatos – idade de 0 a 28 dias – a termo ou pré-termo em condições de risco de vida e que necessitam de monitorização contínua e/ou terapias específicas (Almeida et al., 2016)
De acordo com a Organização Mundial da Saúde, a prematuridade é caracterizada pelo nascimento de um recém-nascido (RN) com menos de 37 semanas completas. Os bebês prematuros podem ser classificados em prematuros moderados, aqueles que nascem entre 32 e 36 semanas de gestação; muito prematuros, os recém nascidos de 28 a 31 semanas; e prematuros extremos os que nascem antes de 28 semanas. A prematuridade se apresenta como um importante fator de morbimortalidade neonatal, devido à imaturidade fisiológica apresentada pelo RN as más respostas adaptativas ao ambiente extrauterino, contribuindo significativamente para maiores complicações médicas após o nascimento e aumento do risco infeccioso desses pacientes.
O sistema imunológico do RN apresenta habilidade limitada em montar uma resposta efetiva contra patógenos invasivos, implicando maior suscetibilidade a infecções. Portanto, quanto menor o período gestacional, menos desenvolvido será o sistema imunológico ao nascimento e, dessa maneira, prematuros extremos apresentam risco de 5-10 vezes mais alto de infecções que recém-nascidos a termo (Diniz & Figueiredo, [s.d.])
Dentre os mecanismos que envolvem a imunidade inata no RN, a pele é uma das primeiras barreiras, no entanto, por ser imatura, tem maior permeabilidade. No período em que esses pacientes estão hospitalizados, a quebra desse tecido barreira pode agir como facilitador para a entrada de agentes patogênicos. Além disso, a produção de IgA está ausente nos primeiros dias de vida, levando a maior vulnerabilidade das mucosas do trato respiratório e gastrointestinal à invasão por microrganismos patogênicos (Diniz & Figueiredo, [s.d.]). Diniz (2014) afirma, ainda, que as células natural killer, mastócitos e macrófagos se apresentam qualitativamente reduzidas no recém-nascido, neutrófilos estão reduzidos em número e apresentam baixa efetividade, com menor capacidade de recrutamento destes em resposta a um estímulo, e as proteínas do sistema complemento mostram-se quantitativamente reduzidas, 60-90% em RN nascidos a termo e 47-70% em prematuros.
Acerca da imunidade adaptativa, o RN apresenta uma baixa produção de citocinas e a diminuta quantidade presente está voltada para manutenção de um perfil Th2, estimulador da resposta humoral, conferindo deficiência a toda imunidade do neonato e prejuízo a função de citotoxicidade promovida pelos linfócitos CD4+ Th1. Ao nascimento, o RN apresenta baixos níveis de imunoglobulinas, e reduzida eficácia destas, sendo a grande maioria formada por IgG provenientes da mãe, vindo a iniciar sua produção própria pelas células B apenas entre o terceiro e o quinto mês de vida em resposta a antígenos alimentares e ambientais.
Dentre os principais fatores de risco para uma infecção em UTIN estão: deficiência imune apresentada pelo RN, baixo peso ao nascer, colonização materna por estreptococo, rotura das membranas amnióticas > 18 horas, corioamnionite, lesões e quebra da barreira cutânea e as infecções primárias de corrente sanguínea. Além destes, a permanência dos RNs em UTINs predispõe processos infecciosos devido a necessidade de realização de procedimentos invasivos, como o uso prolongado de ventilação mecânica invasiva, uso de cateter venoso central (CVC) por tempo prolongado, nutrição parenteral, atraso ao início da nutrição enteral, sondagem gástrica ou gastroduodenal e derivações ventriculares, uso prolongado de antibioticoterapia empírica, bem como a alteração da flora bacteriana normal por aquisição da flora hospitalar (Cruz et al., 2020).
Sobre a sepse neonatal e sua forma de classificação em sepse neonatal precoce e sepse neonatal tardia, podemos afirmar que:
A sepse neonatal precoce é considerada quando o quadro clínico surge nas primeiras 72 horas de vida. A exceção a essa definição é a sepse neonatal causada por Streptococcus agalactiae, que, embora tenha etiologia perinatal, pode ocorrer nos primeiros 7 dias de vida. A sepse neonatal tardia é aquela que se inicia após 72 horas de vida. (Procianoy & Silveira, 2020).
São distintos os agentes etiológicos encontrados na sepse neonatal precoce e na sepse neonatal tardia. Segundo Procianoy (2020), a sepse neonatal precoce é adquirida antes ou durante o momento periparto, assim como durante o parto, sendo ocasionada por microrganismos advindos do trato geniturinário materno onde, em 62% dos casos, são patógenos gram-positivos, destes 43% correspondem ao Streptococcus agalactiae. Já em 37% dos casos, os microrganismos causadores de sepse neonatal precoce são gram-negativos, sendo 29% Escherichia coli. Procianoy (2020) também traz que a sepse neonatal tardia ocorre mais comumente em neonatos que se mantêm hospitalizados por longos períodos de tempo com necessidade de procedimentos invasivos. Em cerca de 79% dos casos, identifica-se a presença de patógenos gram-positivos, onde 57% são infecções por Staphylococcus coagulase-negativo e 12% por Staphylococcus aureus. As infecções por gram-negativos constituem 19% do total e as infecções fúngicas 6%.
Sepse neonatal precoce Sepse neonatal tardia Germes gram-positivos Streptococcus agalactiae (43%) Staphylococcus coagulase-negativo – SCN (57%) Staphylococcus aureus (12%) Germes gram-negativos Escherichia coli (29%) Klebsiella pneumoniae, Escherichia coli e/ou outros germes gram-negativos como Enterobacter spp., Acinectobacter baumanii (19%) Fungos Cândida albicans e/ou outras espécies de fungos (6%)
O processo infeccioso-inflamatório da sepse acomete diferentes sistemas cardíaco, respiratório, hematológico, gastrointestinal/hepático, neurológico e renal – sendo que os principais sinais clínicos visualizados são:
a) apneia, dificuldade respiratória, cianose; b) taquicardia ou bradicardia, má perfusão ou choque; c) irritabilidade, letargia, hipotonia, convulsões; d) distensão abdominal, vômitos, intolerância alimentar, resíduo gástrico, hepatomegalia; e) icterícia inexplicável; f) instabilidade da temperatura corporal; g) petéquias ou púrpura. (Procianoy & Silveira, 2020)
O diagnóstico da sepse neonatal se baseia na avaliação de sinais clínicos acrescido por exames laboratoriais complementares. Recomenda-se a realização de hemoculturas – 2 amostras coletadas em sítios de punções diferentes -, assim como culturas de líquor e da urina. Outros testes complementares como hemograma e proteína C-reativa podem ser feitos e apresentam bom valor preditivo negativo para exclusão do diagnóstico de sepse neonatal (Procianoy & Silveira, 2020).
A antibioticoterapia empírica inicial de escolha deve ser avaliada quanto a suspeita de infecção de início precoce e/ou tardia. Para sepse neonatal precoce, recomenda-se que o esquema inicial seja uma benzilpenicilina associada a gentamicina, a menos que os padrões locais de resistência demonstrem a necessidade da escolha de outro antibiótico (HU et al., 2022) (NICE, 2021). Referente a sepse neonatal tardia, a recomendação de antibioticoterapia deve cobrir bactérias gram-positivas e gram negativas, a exemplo do uso da oxacilina/ampicilina associada a gentamicina como tratamento de primeira escolha (NICE, 2021). Muitos patógenos da sepse neonatal tardia são suscetíveis a uma penicilina antiestafilocócica (i.e., nafcilina, oxacilina, flucloxacilina) combinada com um aminoglicosídeo (i.e., gentamicina, amicacina) (Flannery et al., 2022).
O tratamento com antibioticoterapia deve ser reavaliado em 36 horas após a administração inicial, acompanhando a evolução clínica e laboratorial – principalmente com avaliação de proteína C-reativa – e a positividade ou não da hemocultura, mantendo-se um tratamento mínimo por 5 a 7 dias em caso de positividade da hemocultura ou forte suspeita clínica de sepse se hemocultura negativa (NICE, 2021). Após a identificação do agente na cultura, deve-se guiar a antibioticoterapia pelo resultado do antibiograma
METODOLOGIA
Faz-se, deste, um estudo observacional, descritivo e transversal, baseado na avaliação do perfil de positividade de culturas na principal maternidade privada do estado e na quantificação destes, juntamente com a sua tradução em números e dados que possam ser interpretados e analisados. A busca de produção científica para realização do artigo foi feita nas bases de dados SciELO e PUBMED.
Fora utilizada uma amostra de conveniência, onde não é necessário um cálculo amostral, de forma a incluir todos os recém-nascidos (até 28 dias) que tiveram hemoculturas realizadas no período de estudo dentro da unidade de terapia intensiva neonatal (UTIN). O período de inclusão para o estudo foi de janeiro de 2023 a dezembro de 2023. Não há critérios de exclusão para a população estudada.
O estudo tem como evidência uma ficha para coleta dos dados. Os dados revisados em prontuário foram: peso ao nascer; idade gestacional ao nascimento; diagnóstico de sepse neonatal precoce e/ou tardia; número de amostras coletadas para hemocultura; se paciente invadido por dispositivo no momento da coleta; antibioticoterapia iniciada após diagnóstico; modificação da antibioticoterapia durante o tratamento; realização ou não de profilaxia contra infecções fúngicas associadas; patógeno identificado na hemocultura, assim como a sensibilidade e resistência dos mesmos aos antibióticos e a evolução do paciente.
Os dados categóricos foram analisados e apresentados em gráficos e tabelas, números relativos e também expressos em percentuais e os dados numéricos em média, mediana e desvio-padrão. A análise foi realizada pelo programa SPSS.
O estudo tem, como objetivo primário, identificar a prevalência das hemoculturas positivas e qual o perfil de patógenos mais comuns no hospital de estudo. E, como objetivo secundário, avaliar o padrão de resistência aos antibióticos dos patógenos mais comuns.
RESULTADOS
A análise amostral na instituição demonstrou que, no período de inclusão do estudo, janeiro de 2023 a dezembro de 2023, foram realizadas 677 hemoculturas em neonatos, das quais 23 (3,4%) foram positivas.
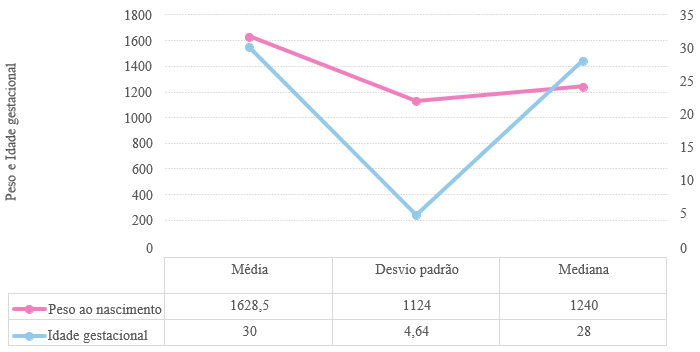
Na avaliação dos fatores de risco para o desenvolvimento da sepse neonatal, observou-se que a média do peso ao nascimento dos RNs avaliados foi de 1628 gramas – baixo peso ao nascer – com um desvio padrão amostral de 1124, enquanto que, a mediana dos pesos dos RNs avaliados foi de 1240 gramas – muito baixo peso ao nascer. Quanto à idade gestacional avaliada, classificou-se os prematuros de acordo com seu grau de prematuridade, onde 40% dos RNs avaliados foram classificados como prematuros extremos, 40% como muito prematuros e 20% como prematuros moderados. Além disso, verificou-se uma média de 30 semanas de idade gestacional, com desvio padrão amostral de 4,64, enquanto que a mediana encontrada foi de 28 semanas de idade gestacional.
Os valores percentuais de diagnóstico de sepse neonatal precoce e sepse neonatal tardia foram quase equivalentes, onde 52,17% dos recém nascidos apresentaram sepse neonatal precoce enquanto que 47,28% dos RNs apresentaram sepse neonatal tardia.
Para a realização das hemoculturas, 65,21% dos pacientes tiveram a coleta de apenas uma amostra sanguínea para avaliação, 30,43% tiveram coleta de duas amostras e apenas 4,34% dos pacientes tiveram três amostras coletadas. No momento da coleta, 73,91% dos pacientes estavam invadidos por algum dispositivo – CVC ou PIC – enquanto que 26,08% dos pacientes não faziam uso de nenhum dispositivo.
De acordo com a avaliação clínica e laboratorial, 86,95% dos pacientes apresentaram critérios para início da antibioticoterapia empírica, enquanto que em 13,04% não foi iniciado. Nesse sentido, 43,37% dos pacientes iniciaram, concomitantemente, a profilaxia com antifúngico, fluconazol, enquanto que 56,52% dos pacientes não apresentaram critérios para início da profilaxia, uma vez que o peso ao nascer não era menor que 1000 gramas.
Para a escolha da terapia antimicrobiana, consoante ao protocolo de antibioticoterapia empírica do hospital de estudo, 60% dos pacientes fizeram o uso de ampicilina associada a gentamicina ou amicacina como terapia inicial; 10% tiveram início da terapia antimicrobiana com oxacilina associada a amicacina ou gentamicina; 10% com tazocin puro ou associado a outro antibiótico; 10% com vancomicina puro ou associação; 10% com uso de antifúngico em dose terapêutica; enquanto que nenhum paciente iniciou terapia antimicrobiana com cefalosporinas de 3ª ou 4ª geração.
Com relação ao número total de pacientes que iniciaram a terapia antimicrobiana, 43,37% apresentaram indicações clínicas, laboratoriais ou guiadas pelo resultado da hemocultura para modificação da terapia de escolha durante o tratamento, enquanto que 56,52% não a modificaram.
O perfil de patógenos encontrados na UTIN da instituição, no período do estudo, será representado abaixo:
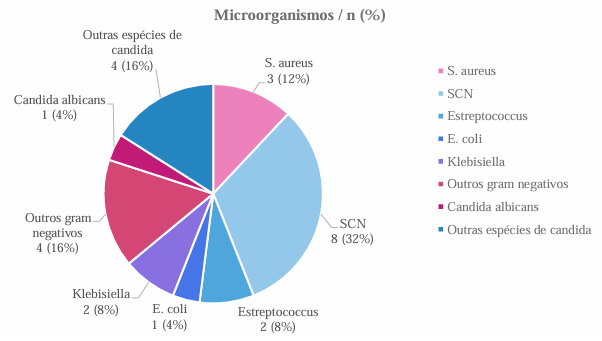
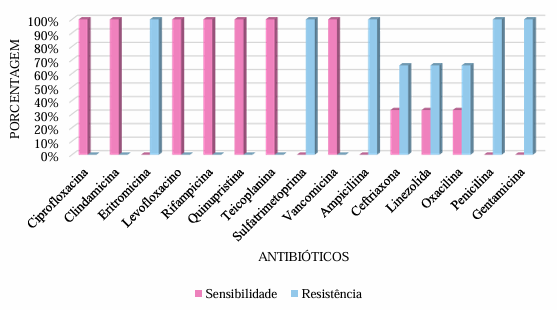
Na avaliação da positividade de hemoculturas, foram identificadas 13 hemoculturas com germes gram positivos (56,52%), onde três (12% das hemoculturas positivas) dos patógenos encontrados foram Staphylococcus aureus. O perfil de sensibilidade e resistência destes patógenos será representado abaixo:
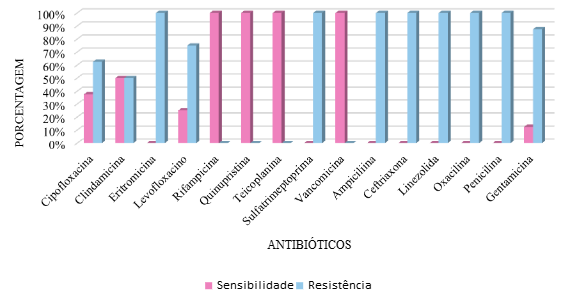
Dos patógenos identificados, oito (32% das hemoculturas positivas) foram do grupo dos Staphylococcus coagulase-negativo (sete S. epidermidis e um S. hominis). Apresentando o seguinte perfil de sensibilidade e resistência:
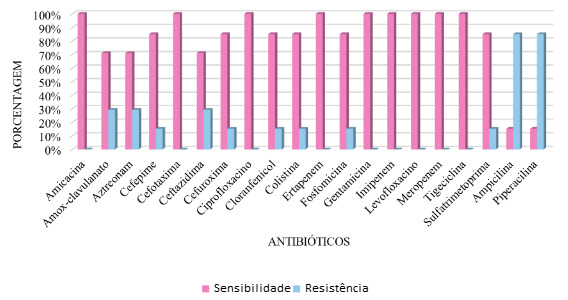
Duas das hemoculturas avaliadas com germes gram-positivos tiveram como patógenos identificados Estreptococcus, dos quais apresentaram sensibilidade a todos os antibióticos avaliados – amoxicilina associada a clavulanato, ampicilina associada a sulbactam, ciprofloxacino, clindamicina, daptomicina, linezolida, oxacilina, penicilina, teicoplanina, vancomicina, ceftriaxona, levofloxacino, rifampicina, quinupristina – com exceção a eritromicina. Foram identificadas sete hemoculturas com bactérias gram-negativas, onde uma foi Escherichia coli, duas foram Klebsiella e quatro foram classificadas como outros patógenos gram-negativos. Desse modo, foram avaliados todos os germes gram negativos de maneira conjunta, apresentando o seguinte perfil de sensibilidade e de resistência:
Dentre as cinco hemoculturas positivas para fungos, obteve-se uma com positividade confirmada para Candida albicans e quatro identificando outras espécies de cândida. O antifungigrama para Cândida albicans apresentou sensibilidade a todos os antifúngicos avaliados – anfotericina, fluconazol, caspofungina, flucitosina, micafungina, voriconazol. Para as outras espécies de cândida demonstradas, não havia padronização de antifungigrama para avaliação desses microrganismos.
Na evolução, referente a alta hospitalar ou óbito do paciente, 65,21% dos pacientes apresentaram alta hospitalar enquanto que 35,78% dos pacientes evoluíram para óbito durante o período que permaneceram internados.
DISCUSSÃO
Neste estudo, constatou-se que os agentes etiológicos mais prevalentes foram as bactérias gram-positivas, seguidas por germes gram-negativos e fungos. Esses resultados estão em consonância com a literatura, que indica uma frequência maior de agentes gram-positivos, variando de 67% a 73%, em comparação com infecções por gram-negativos, que ocorrem entre 21% e 28%. (Sousa et al., 2019).
A avaliação de hemoculturas positivas para germes gram-positivos demonstrou grande correlação com as literaturas estudadas onde, epidemiologicamente, observou-se maior incidência de culturas positivas para SCN do que para Staphylococcus aureus em pacientes com diagnóstico de sepse neonatal tardia.
O protocolo hospitalar traz como indicações de terapia antimicrobiana empírica inicial, o uso de ampicilina associada a gentamicina tanto em pacientes com diagnóstico de sepse tardia como para aqueles com diagnóstico de sepse neonatal precoce, entretanto, observa-se que os patógenos gram-positivos avaliados – Estafilococos –, excetuando-se os Streptococcus, apresentaram altas taxas de resistência à ampicilina e à gentamicina. Logo, avaliando o perfil de sensibilidade do antibiograma, pode-se cogitar o uso de clindamicina e teicoplanina, já que estes apresentaram 100% de sensibilidade contra os patógenos gram positivos avaliados.
Dentro da avaliação de hemoculturas positivas para Staphyloccocus aureus, verificou-se que 66% destes eram methicilin-resistant Staphylococcus aureus (MRSA), enquanto que 33% das infecções foram por methicilin-sensitive Staphylococcus aureus (MSSA). Os achados amostrais, dentro do período de estudo avaliado, diferem de relatórios recentes os quais demonstram que as infecções por MSSA ocorrem 2,5 vezes mais frequentemente que infecções invasivas por MRSA em neonatos, havendo, entre estas, um comparável padrão de morbidade e mortalidade nessa população (Popoola et al., 2016).
O protocolo do hospital de estudo apresenta, como terapêutica direcionada a MRSA, o uso de vancomicina ou teicoplanina. A vancomicina atua por meio de diferentes controles, como inibição da síntese de peptidoglicano, alteração da permeabilidade da membrana citoplasmática e interferência na síntese de RNA citoplasmático (Porchera et al., 2024). Entretanto, apesar da sua eficaz resposta contra patógenos MRSA, esta apresenta alguns efeitos adversos importantes como nefrotoxicidade e ototoxicidade, assim como dor local, flebite e a “síndrome do homem vermelho”.
A linezolida, por sua vez, é um medicamento do grupo das oxazolidinonas e seu mecanismo de ação consiste na inibição de proteínas ribossômicas, por meio da ligação ao complexo do sítio de iniciação (Porchera et al., 2024). Esta apresenta melhor perfil de tolerabilidade tanto na sua forma intravenosa quanto oral, com menos efeitos adversos, podendo ser utilizada contra MRSA assim como patógenos gram-positivos resistentes à vancomicina.
O uso de outros antibióticos protocolados, como teicoplanina, e não protocolados como linezolida se faz útil para aqueles pacientes que não apresentam boa tolerabilidade à vancomicina, principalmente àqueles que já apresentam alteração da função renal. A eficácia clínica geral entre os dois antimicrobianos apresenta resultados semelhantes, variando de 84,4% a 94% para linezolida e de 76,9% a 90% para vancomicina (Porchera et al., 2024).
A restrição recomendada pelo CDC (Centers for Disease Control and Prevention) ao uso de vancomicina visa prevenir o desenvolvimento de Enterococcus resistente à vancomicina (VRE), que é considerado um problema global devido à alta mortalidade associada a esse agente de difícil tratamento (Porchera et al., 2024).
A avaliação de hemoculturas positivas para germes gram-negativos evidenciou que Klebsiella pneumoniae foi o principal patógeno encontrado nesse grupo, corroborando com os estudos que demonstram que os patógenos gram-negativos mais frequentes encontrados em UTIN são Klebsiella spp., com uma frequência de 21% a 52% e E. coli de 3% a 32%. (Berezin & Solórzano, 2014)
Como definição, patógenos multidroga-resistente (MDR) são aqueles que apresentam não apresentam sensibilidade a pelo menos um agente em três ou mais categorias de antimicrobianos ou a algum antibiótico específico (Flannery et al., 2022). Desse modo, a partir da observação do perfil de sensibilidade e resistência dos patógenos gram-negativos, verificou-se que três destas – K. pneumoniae, Morganella morganii e Serratia marcens – se apresentaram como patógenos multidroga-resistente, onde Klebsiella pneumoniae apresentava perfil de resistência contra ampicilina, cloranfenicol, fosfomicina, piperacilina e bactrim; Morganella morganii contra clavulin, ampicilina, aztreonam, cefepime, colistina e piperacilina; e Serratia marcens contra amoxicilina com clavulanato, ampicilina, aztreonam, ceftazidima e piperacilina com tazobactam.
Dessa maneira, a avaliação do perfil de resistência e sensibilidade do principal patógeno gram-negativo encontrado – K. pneumoniae – apresentou dados coerentes com base no China Antimicrobial Surveillance Network (CHINET), o qual demonstrou que 50% ou mais dos isolados de K. pneumoniae apresentam resistência a penicilinas de amplo espectro comumente usadas, assim como cefalosporinas e fluoroquinolonas.
De acordo com a avaliação de resistência aos patógenos gram-negativos, verifica-se que estes apresentaram altas taxas de sensibilidade à gentamicina enquanto que, em contrapartida, demonstraram altas taxas de resistência à ampicilina. Logo, pode-se cogitar o uso de cefotaxima como alternativa à terapêutica inicial. Com relação aos bacilos gram-negativos multidroga resistentes, incluindo bactérias gram-negativas produtoras de β-lactamases de espectro estendido (Extended spectrum βlactamases – ESBL), pode-se direcionar a terapêutica com o uso de meropenem que também apresentou perfil de sensibilidade de 100% contra os patógenos gram-negativos avaliados.
Destarte, verificou-se que 0% dos pacientes iniciaram tratamento com cefalosporina de 3ª e/ou 4ª geração. Além do protocolo hospitalar não considerar o uso dessas classes de antibióticos como primeira escolha, estudos demonstram que o uso prévio de cefalosporinas de 3ª e 4ª geração é um fator de risco para infecções por bactérias gram-negativas produtoras de βlactamases de espectro estendido (ESBL). (Silva et al., 2018) (Tsai et al., 2014).
CONCLUSÃO
A positividade das culturas foi maior para sepse precoce do que para sepse tardia. A idade gestacional mediana para positividade foi de 28 semanas (80% da amostra muito prematuros e prematuros extremos). Os patógenos mais prevalentes no hospital de estudo foram os estafilococos dentre os gram-positivos (Staphylococcus coagulase-negativo, S. aureus) e dentre os gram-negativos a Klebsiella pneumoniae.
Observa-se ainda uma alta resistência dos estafilococos à oxacilina, com taxas superiores a 70%. Considerando que essa é a primeira escolha o protocolo institucional para tratar sepse tardia, a continuidade dessa prática precisa ser reavaliada. Por outro lado, os estreptococos estudados não mostraram resistência à ampicilina, e as bactérias gram-negativas analisadas ainda permanecem sensíveis aos aminoglicosídeos e carbapenêmicos.
REFERÊNCIAS
Almeida, F. de A., Moraes, M. S. de, & Cunha, M. L. da R. (2016). Taking care of the newborn dying and their families: Nurses’ experiences of neonatal intensive care. Revista Da Escola de Enfermagem Da USP, 50, 122–129. https://doi.org/10.1590/S0080-623420160000300018
Bentlin, M. R., Rugolo, L. M. S. S., & Ferrari, L. S. L. (2015). Practices related to late-onset sepsis in very low-birth weight preterm infants. Jornal de Pediatria, 91(2), 168–174. https://doi.org/10.1016/j.jped.2014.07.004
Berezin, E. N., & Solórzano, F. (2014). Gram-negative infections in pediatric and neonatal intensive care units of Latin America. The Journal of Infection in Developing Countries, 8(08), 942–953. https://doi.org/10.3855/jidc.4590
Cruz, M. R. da, Albernaz, V. S. M. L., Silva, L. C. S., Costa, T. A. M. da, & Cavalcanti, D. da S. P. (2020). FATORES DE RISCO RELACIONADO À INFECÇÃO EM UTI NEONATAL. SAÚDE & CIÊNCIA EM AÇÃO, 6(2), Artigo 2.
Diniz, L. M. O., & Figueiredo, B. de C. G. e. ([s.d.]). O sistema imunológico do recém-nascido. 24(2), 233–240. https://doi.org/10.5935/2238-3182.20140056
Fang, P., Gao, K., Yang, J., Li, T., Gong, W., Sun, Q., & Wang, Y. (2023). Prevalence of Multidrug-Resistant Pathogens Causing Neonatal Early and Late Onset Sepsis, a Retrospective Study from the Tertiary Referral Children’s Hospital. Infection and Drug Resistance, 16, 4213–4225. https://doi.org/10.2147/IDR.S416020
Flannery, D. D., Chiotos, K., Gerber, J. S., & Puopolo, K. M. (2022). Neonatal multidrug resistant gram-negative infection: Epidemiology, mechanisms of resistance, and management. Pediatric research, 91(2), 380–391. https://doi.org/10.1038/s41390-021-01745-7
Fujimura, S., Kato, S., Hashimoto, M., Takeda, H., Maki, F., Watanabe, A., & Fujimura, S. (2004). Survey of methicillinresistant Staphylococcus aureus from neonates and the environment in the NICU. Journal of Infection and Chemotherapy, 10(2), 131–132. https://doi.org/10.1007/s10156-004-0306-6
Hu, F., Yuan, L., Yang, Y., Xu, Y., Huang, Y., Hu, Y., Ai, X., Zhuo, C., Su, D., Shan, B., Du, Y., Yu, Y., Lin, J., Sun, Z., Chen, Z., Xu, Y., Zhang, X., Wang, C., He, L., … Zhang, Y. (2022). A multicenter investigation of 2,773 cases of bloodstream infections based on China antimicrobial surveillance network (CHINET). Frontiers in Cellular and Infection Microbiology, 12, 1075185. https://doi.org/10.3389/fcimb.2022.1075185
Korang, S. K., Safi, S., Nava, C., Gordon, A., Gupta, M., Greisen, G., Lausten-Thomsen, U., & Jakobsen, J. C. ([s.d.]). Antibiotic regimens for early‐onset neonatal sepsis—Korang, SK – 2021 | Cochrane Library. Recuperado 18 de setembro de 2024, de https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013837.pub2/full
Lima, C. S. S. da C., Lima, H. A. R., & Silva, C. S. de A. G. e. ([s.d.]). Late-onset neonatal infections and bacterial multidrug resistance. Revista Paulista de Pediatria, 41, e2022068. https://doi.org/10.1590/1984-0462/2023/41/2022068
Overview | Neonatal infection: Antibiotics for prevention and treatment | Guidance | NICE. (2021, abril 20). NICE. https://www.nice.org.uk/guidance/ng195
Popoola, V. O., Colantuoni, E., Suwantarat, N., Pierce, R., Carroll, K. C., Aucott, S. W., & Milstone, A. M. (2016). Active Surveillance Cultures and Decolonization to Reduce Staphylococcus aureus Infections in the Neonatal Intensive Care Unit. Infection Control & Hospital Epidemiology, 37(4), 381–387. https://doi.org/10.1017/ice.2015.316
Porchera, B. R., Silva, C. M. da, Miranda, R. P., Gomes, A. R. Q., Fernandes, P. H. dos S., Menezes, C. G. O. de, Laurindo, P. do S. de O. da C., Dolabela, M. F., & Brígido, H. P. C. (2024). Linezolid and vancomycin for nosocomial infections in pediatric patients: A systematic review. Jornal de Pediatria, 100, 242–249. https://doi.org/10.1016/j.jped.2023.08.011
Procianoy, R. S., & Silveira, R. C. (2020). The challenges of neonatal sepsis management. Jornal de Pediatria, 96, 80–86. https://doi.org/10.1016/j.jped.2019.10.004
Rampelotto, R. F., Coelho, S. S., Franco, L. N., Mota, A. D. da, Calegari, L. F., Jacobi, L. F., & Hörner, R. (2022). Coagulasenegative staphylococci isolates from blood cultures of newborns in a tertiary hospital in southern Brazil. Brazilian Journal of Pharmaceutical Sciences, 58, e19664. https://doi.org/10.1590/s2175-97902022e19664
Romanelli, R. M. D. C., Anchieta, L. M., Bueno E Silva, A. C., De Jesus, L. A., Rosado, V., & Clemente, W. T. (2016). Empirical antimicrobial therapy for late-onset sepsis in a neonatal unit with high prevalence of coagulase-negative Staphylococcus. Jornal de Pediatria, 92(5), 472–478. https://doi.org/10.1016/j.jped.2016.01.008
Sepse neonatal—Perfil microbiológico e sensibilidade antimicrobiana em um hospital no Nordeste do Brasil. ([s.d.]). Revista RBAC. Recuperado 19 de outubro de 2024, de https://www.rbac.org.br/artigos/sepse-neonatal-perfil-microbiologicoe-sensibilidade-antimicrobiana-em-um-hospital-no-nordeste-do-brasil/
Silva, A. C. B., Anchieta, L. M., Lopes, M. F. de P., & Romanelli, R. M. de C. (2018). Inadequate use of antibiotics and increase in neonatal sepsis caused by resistant bacteria related to health care assistance: A systematic review. Brazilian Journal of Infectious Diseases, 22, 328–337. https://doi.org/10.1016/j.bjid.2018.07.009
Singu, B. S., Pieper, C. H., Verbeeck, R. K., & Ette, E. I. (2024). Predictors of gentamicin therapy failure in neonates with sepsis. Pharmacology Research & Perspectives, 12(4), e1250. https://doi.org/10.1002/prp2.1250
Tsai, M.-H., Chu, S.-M., Hsu, J.-F., Lien, R., Huang, H.-R., Chiang, M.-C., Fu, R.-H., Lee, C.-W., & Huang, Y.-C. (2014). Risk Factors and Outcomes for Multidrug-Resistant Gram-Negative Bacteremia in the NICU. Pediatrics, 133(2), e322–e329. https://doi.org/10.1542/peds.2013-1248
1ORCID: https://orcid.org/0009-0007-9656-4271 Universidade Tiradentes, Brasil Email: guilherme.rosada@souunit.com.br
2ORCID: https://orcid.org/0009-0009-8084-9728 Universidade Federal de Sergipe, Brasil Email: deivison_dinizio@hotmail.com
3ORCID: https://orcid.org/0000-0002-3968-5882 Universidade Tiradentes, Brasil Email: marcos.alves@souunit.com.br
