REGISTRO DOI: 10.69849/revistaft/ar10202408231451
Estefany Santos Pereira¹; Anderson Carlos Marçal²; Clésio Andrade Lima³; Alisson dos Santos⁴; Lúcio Marques Vieira-Souza⁵; José Uilien de Oliveira⁶; Charles dos Santos Estevam⁷; Felipe J. Aidar⁸; Jymmys Lopes dos Santos⁹.
RESUMO
Introdução: É bem conhecido que o estresse oxidativo desempenha um papel crucial no envelhecimento, sendo um dos mecanismos subjacentes às doenças relacionadas à idade. Além disso, o exercício agudo também pode causar estresse oxidativo e danos musculares. Dessa forma, a suplementação PEAK O² é estudada como estratégia antioxidante. Objetivo Analisar os efeitos da ingestão prévia de PEAK O2 frente ao estresse oxidativo e dano muscular induzido por teste aeróbico de esforço máximo em ratos wistar idosos. Métodos: 24 ratos machos com 18 meses de vida, divididos em 4 grupos: controle (GS); grupo teste (TR); grupo controle+PEAK O² (GS+ PK); grupo teste+ PEAK O² (TR+ PK).Os ratos fizeram a ingestão de 200mg1hora antes do teste. Resultados: os animais do grupo TR+ PK teve uma redução do MDA de 33.02% (p= 0,0121) em relação ao grupo TR. Os marcadores SH e TAC aumentou em 17.47% (p=0.0258), e 2.33% (p=0.0067) respectivamente, no grupo TR+ PK, em comparação aos animais dos grupos GS, TR e GS+PK. Conclusão: Através da redução de MDA no músculo gastrocnêmio (31.48%, p=0.0017) e no músculo sóleo (22.38%; p=0.0040) e diminuição dos valores de CK e LDH (34,14% e 26,07%) respectivamente, a ingestão prévia de PEAK O² atenuou o estresse oxidativo e o dano muscular após teste aeróbico de esforço máximo em ratos wistar idosos.
Palavra chaves: cogumelos, estresse oxidativo, exercício, dano muscular
ABSTRACT
Introduction: It is well known that oxidative stress plays a crucial role in aging, being one of the underlying mechanisms of age-related diseases. In addition, acute exercise can also cause oxidative stress and muscle damage. In this way, PEAK O2 supplementation is studied as an antioxidant strategy. Objective Analysing the effects of prior ingestion of PEAK O2 against oxidative stress and muscle damage induced by maximum stress aerobic test in elderly wistar mice. Methods: 24 male mice with 18 months of age, divided into 4 groups: control (GS); test group (TR); control group+PEAK O2 (GS+PK); test group+ PEAK O2 (TR+ PK). The mice took 200mg per hour before the test. Results: animals in the TR+ PK group had a reduction of MDA of 33.02% (p= 0.0121) compared to the TR group. The SH and TAC markers increased by 17.47% (p=0.0258), and 2.33% (P=0.0067) respectively, in the TR+ PK group, compared to the animals in the GS, TR and GS+PK groups. Conclusion: Through the reduction of MDA in the gastrocnemial muscle (31.48%, p=0.0017) and the soleous muscle (22.38%; p =0.0040) and decreased values of CK and LDH (34.14% and 26.07%) respectively, previous intake of PEAK O2 mitigated oxidative stress and muscle damage after maximum-stress aerobic test in elderly wistar rats.
Key words: mushrooms, oxidative stress, exercise, muscle damage
Introdução
O envelhecimento populacional está aumentando em todo o mundo, com cerca de 11% da população mundial tendo mais de 60 anos, e isso pode aumentar até 22% até 2050 (JUAN et al.,2019). No Brasil, a população de idosos será a sexta maior no mundo, em 2050, com mais de 32 milhões de pessoas, representando 16% da população (DOS SANTOS et al., 2021). O envelhecimento é multifatorial, caracterizado por um declínio progressivo dos processos bioquímicos e fisiológicos, e por uma crescente suscetibilidade a doenças (NOBLANC et al., 2020).
É bem conhecido que o estresse oxidativo desempenha um papel crucial no envelhecimento, sendo um dos mecanismos subjacentes às doenças relacionadas à idade (JAKOVOU; KOURTI, 2022). Além disso, o estresse oxidativo também acontece após a prática aguda de exercício físico, que, por sua vez, aumenta a produção de EROS no músculo esquelético (POWERS; SCHRAGER,2022) embora o organismo tenha um complexo sistema de defesa endógeno antioxidante, que neutraliza os RL, as células podem apresentar distúrbios fisiológicos, como a apoptose, devido aos danos irreparáveis que causam ao DNA(LUO et al., 2019).
Por este motivo, a suplementação à base de cogumelos tem sido testada, tanto em ratos como humanos, demonstrando estar associada ao aumento das atividades antioxidantes, podendo assim, atenuar o estresse oxidativo e o dano muscular induzido pelo exercício (HABTEMARIAM et al 2020). Neste sentido esse estudo teve como objetivo desvendar os efeitos da ingestão prévia de PEAK O2, uma combinação de seis espécies de cogumelos (Cordyceps militaris, Ganoderma lucidum, Pleurous eryngii, Lentinula edodes, Hericium erinaceus e Trametes versicolor), frente ao estresse oxidativo e ao dano muscular promovido por um teste aeróbico de esforço máximo em ratos wistar idosos.
MÉTODOS
Animais
Foram utilizados 24 ratos wistar machos, com 24 meses de vida, pesando entre 400g – 600g, mantidos em gaiolas coletivas (2 animais por gaiola) provenientes do Biotério de Pesquisa em Sinalização Intracelular (NUPESIN – UFS, Brasil), e mantidos sob condições ambientais de temperatura e ciclo claro-escuro de 12 horas, tendo livre acesso à água e ração padrão (Nuvilab®). Todos os procedimentos foram aprovados em 2022, protocolado sob o CEUA nº 9989220322.
Delineamento experimental
Os animais foram divididos em quatro grupos: a) Grupo Sedentário (GS): animais sedentários; b) Grupo Teste (GT): animais que realizaram o teste; c) Grupo sedentário + PEAK O2 (GS+PK): animais sedentários que fizeram a ingestão do PEAK O2; d) Grupo Teste + PEAK O2(GT+PK): animais que realizaram o teste e fizeram a ingestão do PEAK O2.
PROCEDIMENTOS
Adaptação ao exercício
O teste aeróbico de esforço máximo foi realizado em esteira ergométrica, marca AVS, com capacidade para oito animais, cuja velocidade varia de 0 a 30 metros por minutos, e a inclinação de 0 a 10%, com uma fonte de estimulação elétrica variando de 0,2 a 1,2 volts de intensidade de corrente, com 4 saídas independentes e comando no próprio controle da esteira. Para tanto, grupos GS, GS+PK, TR e TR+PK foram familiarizados à esteira mediante protocolo de Rossoni et al. (2011) com sessão de exercício de 10 minutos e velocidade entre 5 a 8 m/ minutos durante 5 dias. Após o período de familiarização os animais foram submetidos ao protocolo de teste aeróbico máximo adaptado de Pagan et al. (2015).
Ingestão de PEAK O2
A PEAK O2 foi adquirida da Galena Química e Farmacêutica LTDA (Campinas, Saão Paulo- Brazil) com lote interno nº 475452-0 e o lote do fabricante nº NPT. 0917/890. A administração de PEAK O2 uma hora antes do protocolo de teste. A dose utilizada foi de 200mg/kg de peso corporal, obtida através de um cálculo de média na bula do fabricante, via intragástrica (gavagem) utilizando uma cânula de inox específica para roedores e com a extremidade arredondada para que não causasse lesão.
Protocolo adaptado de teste aeróbico de esforço máximo
O teste consistiu em 6 estágios de andar/correr, começando com a velocidade de 6m/min aumentando progressivamente 3m/min a cada minuto. Foi considerado exaustão dos ratos quando eles não conseguiam mais andar ou correr de forma coordenada mesmo sob estímulos elétricos.
PROTOCOLO ADAPTADO DE TESTE AERÓBICO DE ESFORÇO MÁXIMO ESTÁGIO TEMPO (min) VELOCIDADE (m/min) INCLINAÇÃO (%) CHOQUE (mA) 1 1 6 0 2,5 2 1 9 0 2,5 3 1 12 0 2,5 4 1 15 0 2,5 5 1 18 0 2,5 6 1 21 0 2,5
Eutanásia e preparação dos tecidos
Após 24 horas do fim da última sessão do período experimental, os animais foram anestesiados com cetamina/xilazina (75mg/kg + 10mg/kg i.p) e o sangue (± 5mL) foi coletado através de punção cardíaca e então foram eutanasiados (Flecknell, 2009). Depois de recolhido, o sangue foi imediatamente centrifugado a 800 x g durante 15 minutos a +4 °C e o sobrenadante armazenado a ± -80°C. Paralelamente, os órgãos (músculos, fígado e coração)foram removidos e lavados 3 vezes com solução de cloreto de potássio (KCL) secos e pesados. Em seguida, foram homogeneizados onde cada grama de tecido foi misturada com 5 mL de KCl + 10 µLde fluoreto de fenilmetilsulfonil (PMSF – 100 mmol. L-1) + 15 µL de solução de 10% de Triton e centrifugados a 3000 x g durante 10 min a ± -70°C para análise posterior de marcadores de estresse oxidativos.
No soro sanguíneo foram determinadas as concentrações de CK, LDH de acordo com os procedimentos do fabricante (Labtest ®, Lagoa Santa, Minas Gerais, Brazil). Também foram avaliados os marcadores de estresse oxidativo. A lipoperoxidação foi determinada pela medida das substâncias reativas ao ácido tiobarbitúrico (TBARS) de acordo com método descrito por Lapenna et al. (2001). A determinação dos grupos sulfidrilas (SH) foi realizada conforme metodologia descrita por Faure and Lafond (1995). A capacidade antioxidante total TAC, conforme os procedimentos do fabricante Labtest ®.
Determinação do estresse oxidativo in vivo
A lipoperoxidação foi determinada pela medida das substâncias reativas ao ácido tiobarbitúrico (TBARS) de acordo com método descrito por Lapenna et al. (2001). Para isto, 200 µL de alíquotas (sangue e órgãos) foram adicionados a uma mistura de 400 µL formada por partesiguais de ácido tricloroacético (TCA) a 15%,0,25 N HCl e 0,375% TBA, mais 2,5 mM de hidroxitolueno butilado (BHT) e 40 µL de sulfato de sódio (SDS) a 8,1%, sendo aquecido por 30 mina 95°C em um forno. O pH da mistura foi ajustado para 0,9 com HCl. O BHT foi utilizado para evitar a peroxidação lipídica durante o aquecimento. Após resfriamento à temperatura ambiente e adição de 4 mL de butanol, o material foi centrifugado a 800 xg durante 15 min a ± 4 °C e a absorvância sobrenadante foi medida a 532 nm.O coeficiente de extinção molar utilizado foi de 1,54 x 10 5 M -1 cm -1 e o resultado TBARS expresso em nmol Eq MDA/mL de plasma para amostras de sangue ou nmol Eq MDA/mL de soro para órgãos.
Determinação das sulfidrinas totais (SH)
A determinação dos grupos foi realizada de acordo com a metodologia descrita por Faure e Lafond (1995) na qual 50 μL alíquotas (de fígado, coração e gastrocnêmio) foram misturadas em 1 mL de tampão tris-EDTA, pH 8,2. Em seguida, a primeira leitura (A) foi realizada em espectrofotômetro a 412 nm. Após a leitura, as amostras foram transferidas para tubos de ensaio e misturadas com 20 μL de 10 mM DTNB diluídos em metanol (4 mg/mL), deixados no escuro. Ao final de 15 min, foi realizada a segunda leitura de absorbância (A2). A concentração de SH foi calculada de acordo com a seguinte equação: (A2-A1) – B x 1,57 mM x 1000, e o resultado foi expresso em nmol.mg de tecido.
Determinação da capacidade antioxidante total
A mensuração da TAC foi realizada utilizando o kit (Labtest ®, MG, Brasil), conforme recomendações do fabricante. Uma curva de calibração foi obtida com uso de solução aquosa padrão de Trolox (2,0 mmol/L) em diferentes concentrações (0,1; 0,25; 0,5; 1,0 e 1,5 mmol/L). Alíquotas de 20 µL de cada solução padrão Trolox foram acrescidas a 800 µL do R1. Após 3 minutos de estabilização em temperatura ambiente (TA), foram adicionados 80 µL do R2. Após 5 minutos de incubação em TA, foi realizada a leitura da absorbância utilizando-se 620 nm de comprimento de onda. A partir dos valores obtidos das absorbâncias das diferentes concentrações de padrão Trolox foi criada uma curva de reação para TAC e o valores expressos em mmol Trolox equivalente/L.
Determinação enzimática de lesão tecidual
A determinação enzimática de lesão tecidual ocorreu através da mensuração dos marcadores enzimáticos: Creatina Quinase (CK), Lactato Desidrogenase (LDH),utilizando o kit laboratorial específico (Labtest ®, Minas Gerais, Brasil) de acordo com as normas do fabricante do mesmo.
Quantificação de creatina quinase (CK) e lactato desidrogenase (LDH) total plasmática
A partir das recomendações do fabricante (Labtest ®, Minas Gerais, Brasil), 20 µL do plasma de cada animal foram homogeneizados em mistura reacional a 37 ± 0,2ºC e realizada a leitura em espectrofotômetro UV/VIS a um comprimento de onda de 340 nm. Como a LDH catalisa a transferência de elétrons da NADH para o piruvato, convertendo-o em lactato, há uma queda da absorbância em um minuto, a qual é proporcional à atividade da LDH, além da CK, que catalisa a fosforilação.
8. Análise estatística
Os resultados são apresentados como média ± desvio padrão (DP). As diferenças entre as amostras foram consideradas estatisticamente significativas quando p < 0,05. Todas as análises foram feitas em triplicata. Após avaliação da normalidade dos dados por meio do teste de Shapiro Wilk, os dados foram analisados estatisticamente por meio da análise de variância (ANOVA) de uma via, seguida dos testes de comparações múltiplas de Tukey, caso fosse apropriado. Neste estudo, foi utilizado o software estatístico GraphPad Prism versão 8.0 (GraphPad Software, San Diego, CA, E.U.A.).
RESULTADOS
Após realizar análise para as variáveis de estresse oxidativo malondialdeído (MDA), sulfidrilas totais (SH) e capacidade antioxidante total (TAC) plasmático (Tabela 1), verificamos que os animais que fizeram a ingestão de PEAK O² e não realizaram o teste, não tiveram alterações estatísticas nos parâmetros de MDA, SH e TAC em relação ao grupo GS (p= 0,9626, p= 0,0637 e p= 0,9998, respectivamente). Por outro lado, os animais submetidos ao teste tiveram um aumento significativo nos valores de MDA na ordem de 40.43% (p= 0,0258) em relação aos animais do grupo GS. Ao passo que, os animais do grupo TR+PK teve uma redução na ordem de 33.02% (p= 0,0121) em relação ao grupo TR.
Quando analisamos SH, observamos aumento significativo na ordem de 17.47% (p=0.0258), 39.29% (p <0.0001) e 18.87% (p=0.0167) nos animais do grupo TR+PK em relação aos grupos GS, GS+PK e TR respectivamente. Quanto a variável de análise TAC, observamos aumento significativo destes valores na ordem 2.33% (p=0.0067), 2.39% (p= 0,0056) e 3.02% (p= 0,0007) entre os animais do grupo TR+PK em relação aos animais dos grupos GS, GS+PK e TR, respectivamente.
Tabela 1. Parâmetros de estresse oxidativo no sangue dos animais que fizeram a ingestão do PEAK O² em condição sedentária e submetidos ao teste aeróbico de esforço máximo.
VARIÁVEISSANGUE(N=6) GS GS+PK TR TR+PK MDA(X±SD) 73.76 ± 15.01A 68.89 ± 17.66 A 103.6 ±20.26 B 69.13 ± 11.03 A,C SH(X±SD) 187.1 ± 5.92 A 157.9 ± 22.25 A 148.9 ± 21.57 A 219.8 ± 13.61 B TAC (X±SD) 80.36 ± 0.37 A 80.32 ± 1.03 A 79.89 ± 0.30A 82.24 ± 1.1B
Figura 1: Parâmetros de estresse oxidativo no marcador MDA dos músculos gastrocnêmio e sóleo dos animais que fizeram a ingestão do PEAK O² em condição sedentária e submetidos ao teste aeróbico de esforço máximo.
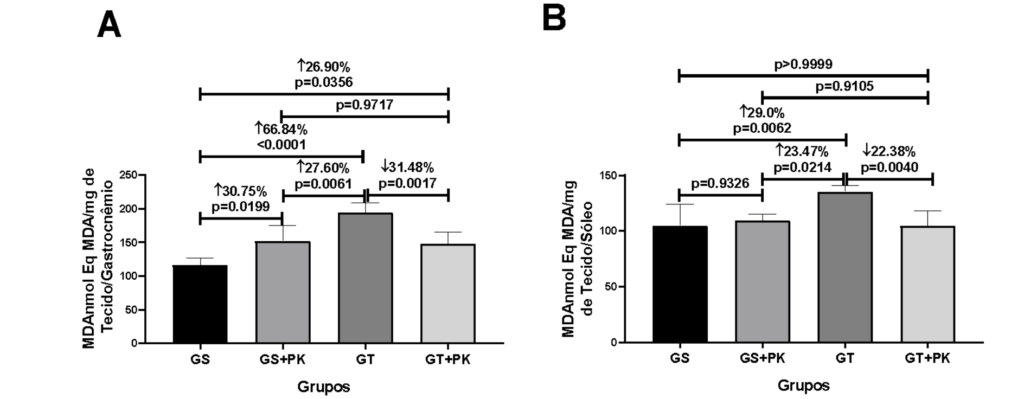
No presente estudo, houve aumento significativo de MDA (30.75%; p=0.00199) no músculo gastrocnêmio de GS+PK em relação à GS, no entanto, o mesmo não foi observado para o músculo sóleo. Da mesma forma, no grupo TR houve aumento significativo de MDA no músculo gastrocnêmio (66.84%, p<0.0001; 27.60%, p=0.0061) e músculo sóleo (29.0%, p=0.0062; 23.47%, p=0.0214)quando comparado com GS e GS+PK, respectivamente. Por outro lado, houve redução de MDA no músculo gastrocnêmio (31.48%, p=0.0017) e no músculo sóleo (22.38%; p=0.0040) do grupo TR+PK em relação a TR.
Figura 2: Parâmetros de estresse oxidativo nos marcadores de SH dos músculos gastrocnêmio e sóleo dos animais que fizeram a ingestão do PEAK O² em condição sedentária e submetidos ao teste aeróbico de esforço máximo.
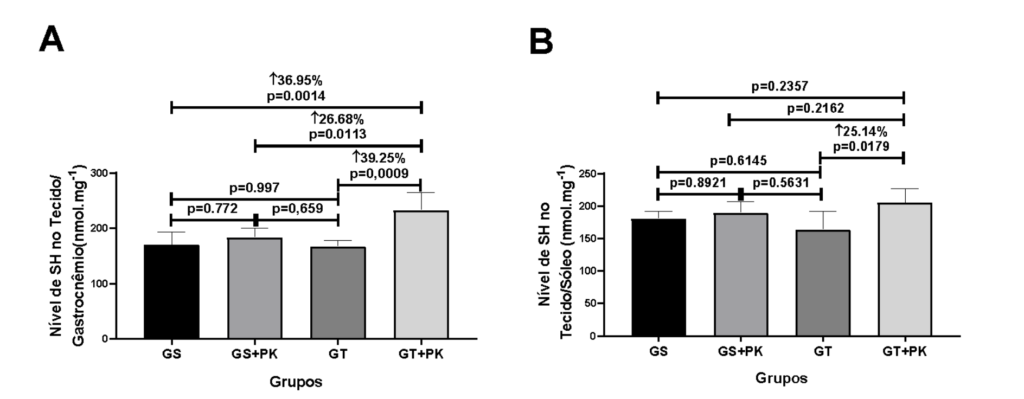
Constatamos que os fatores de intervenção geraram respostas duais nos músculos gastrocnêmio e sóleo. O grupo TR+PK teve um aumento significativo na SH no músculo gastrocnêmio de (36.95%, p=0.0014; 26.68%, p=0.0113; 39.25%, p=0.0009) quando comparado aos grupos GS, GS+PK ou TR, respectivamente. No músculo sóleo somente houve aumento significativo de SH (25.14%; p=0.0170) no grupo TR+PK em relação ao grupo TR.
Figura 3: Parâmetros de estresse oxidativo no marcador TAC dos músculos gastrocnêmio e sóleo dos animais que fizeram a ingestão do PEAK O² em condição sedentária e submetidos ao teste aeróbico de esforço máximo.
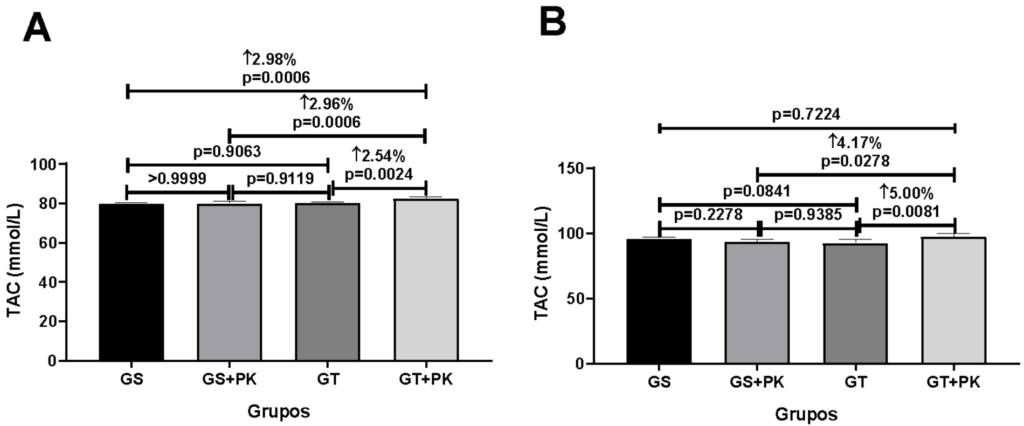
Ao analisarmos os resultados podemos perceber que houve aumento significativo no TAC (2.98%, p=0.0006); 2.96%, p=0.0006); 2.54%, p=0.0024) do grupo TR+PK no músculo gastrocnêmio quando comparado com os grupos GS, GS+PK e TR, respectivamente. Já no músculo sóleo o aumento significativo de TAC (4.17%, p=0.0278; 5.00%, p=0.0081) do grupo TR+PK só existiu em relação aos grupos GS+PK e TR, respectivamente.
Figura 4: Parâmetros de dano muscular para os marcadores de CK e LDH no sangue dos animais que fizeram a ingestão do PEAK O² em condição sedentária e submetidos ao teste aeróbico de esforço máximo.
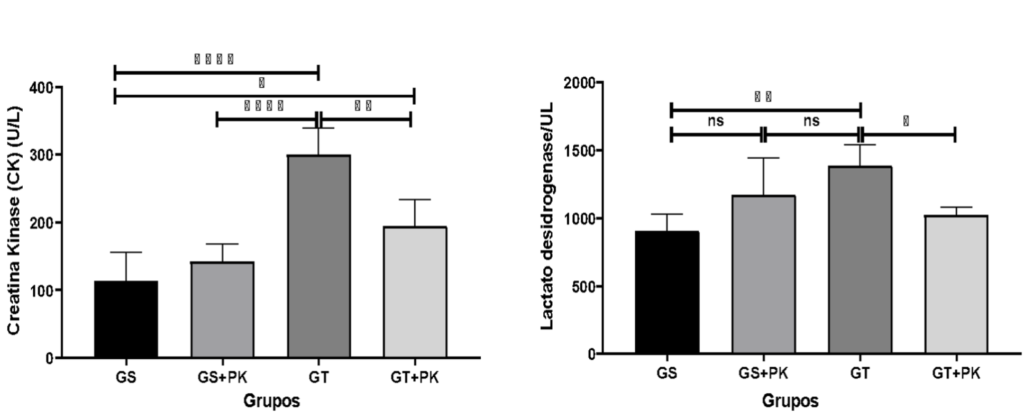
Ao analisar essas variáveis, constatamos que o protocolo de teste utilizado no presente estudo gerou aumento do dano tecidual (164,52% e 52,45%, respectivamente) quando comparamos os valores de CK e LDH dos grupos controle e sem PEAK O², em relação ao grupo teste (p=0.0001; p=0.0015, respectivamente). Em contrapartida, a suplementação de PEAK O² foi capaz de atenuar em 34,14% e 26,07% os valores de CK e LDH dos animais do grupo TR+PK em relação ao grupo TR (p=0. 0017; p=0.0110, respectivamente).
DISCUSSÃO
No presente estudo verificamos que uma sessão de teste aeróbico de esforço máximo pode elevar os marcadores de estresse oxidativo e dano muscular no sangue e nos músculos gastrocnêmio e sóleo de ratos wistar idosos. Os resultados desta pesquisa estão condizentes com o previamente encontrado com animais de laboratório, onde o exercício agudo aumentou os níveis de estresse oxidativo no sangue, órgãos e tecidos. No presente estudo, de acordo com tabela 1, os valores do malonaldeído (MDA), um indicador de estresse oxidativo foi significativamente maior no grupo TR em comparação ao grupo GS no sangue dos animais. Logo, níveis elevados de MDA indicaram que mais oxigênio foi absorvido durante o exercício, levando ao aumento da produção de radicais livres e colocando as células em um estado de estresse oxidativo (WHANG et al., 2022). Ou seja, exercícios intensos podem afetar a permeabilidade da membrana celular, permitindo que algumas macromoléculas no citoplasma vazem através da membrana celular e entrem no sangue (ZHOU et al., 2019).
Além disso, nota-se que os valores de SH (sulfidrilas) e TAC (capacidade antioxidante total) no sangue do grupo TR é significativamente menor que os valores do grupo GS. Logo, após o teste aeróbico de esforço máximo, a superprodução de EROS leva a um desequilíbrio entre oxidantes e antioxidantes em favor dos oxidantes, resultando no estresse oxidativo induzido pelo exercício, que provoca o aumento da peroxidação lipídica, produzem aldeídos reativos e atacam biomoléculas, reduzindo a capacidade antioxidante do próprio organismo de se defender (IQBAL et. al, 2024). Portanto, verificamos que o protocolo de teste utilizado foi eficiente em gerar estresse oxidativo. Estes resultados também foram encontrados no estudo de Kabakci et al. (2022) , após o exercício exaustivo agudo aumentar significativamente os níveis plasmáticos de MDA dos ratos.
De acordo com a figura 1, pode-se observar que esse aumento no MDA também aconteceu nos músculos gastrocnêmio e sóleo. Esse aumento da peroxidação lipídica, após o protocolo de teste, é um dos principais resultados da lesão mediada por radicais livres (CHEESEMAN et al., 1993). Por outro lado, animais que realizaram o teste e fizeram a ingestão de PEAK O² sofreram redução desse biomarcador. Da mesma forma, Chen et al. (2017), ao pesquisarem os efeitos de um extrato de cogumelos, descobriram que dentre as substancias antioxidantes presentes, os polissacarídeos, em especial, são responsáveis pela diminuição dos níveis de MDA em ratos.
Os antioxidantes são classificados como preventivos, ao impedir a formação do radical alquil inicial, o que daria origem ao ciclo de propagação, e quebradores de cadeia, se eles bloqueiam ou retardam a propagação da peroxidação lipídica (VALGIMIGLI et al., 2023). Nessa linha, as superóxidos dismutases (SODs), a glutationa redutase (GR), a catalase (CAT), e as peroxidases de tiol como GPX, podem ser classificadas como antioxidantes preventivos, uma vez que “alimentam” o processo de iniciação (VALGIMIGLI et al., 2012). Neste sentido, os polissacarídeos presentes no PEAK O², por ação doadora de elétrons, podem impedir que espécies radicais reativas atinjam biomoléculas, inibindo a peroxidação lipídica de se propagar e aumentando as atividades da (SOD, GPx e CAT), enzimas envolvidas na eliminação de espécies reativas de oxigênio prejudicial (AHMAD et al., 2023).
Dado que quantidades excessivamente altas de EROS intracelulares têm repercussões terríveis, não é surpreendente que cada etapa da geração de EROS seja fortemente desintoxicada por uma linha de enzimas antioxidantes. Por exemplo, o O 2 − é convertido em peróxido de hidrogênio (H2O2) pela enzima superóxido dismutase (SOD), o H2O2 é então reduzido a água pela glutationa peroxidase ou catalase, e a glutationa peroxidase reduz H2O2, em água pela oxidação da glutationa reduzida (GSH) para a forma oxidada (GSSG) (CHOI et al., 2016).
De acordo com os dados da figura 2, os animais do grupo TR+PK tiveram níveis elevados de SH, porque os antioxidantes presentes no PEAK O² parecem ser doadores de tiol, atuando como um potente antioxidante, sequestrando elétrons vazados (SALLES et al., 2022). A principal via antioxidante não enzimática no músculo é o sistema de glutationa (GSH), que utiliza ciclos de tiol, compostos por moléculas dos grupos sulfidrilas (SH), como antioxidantes não enzimáticos no plasma, estabilizando radicais livres ao aceitar seu elétron desemparelhado e regulando os potenciais de oxidação-redução (redox), ou seja, uma proporção maior de glutationa reduzida para oxidada (GSH/GSSG), sugere um ambiente redutor onde os níveis de EROS são mantidos em níveis homeostáticos (ULRICH; JAKOB, 2019). Muito embora, em resposta a períodos de exercício intensos, os níveis circulantes de glutationa reduzida diminuem enquanto os níveis de glutationa oxidada aumentam, sendo então, uma indicativa de estresse oxidativo (MCLEAY et al., 2017).
O estresse oxidativo causado pelo exercício exaustivo, provoca uma diminuição significativa nas atividades de SOD, GPX e CAT nos músculos esqueléticos, que então, sobrecarrega a capacidade dos sistemas de defesa antioxidante (GEORGE et al., 2016). Consequentemente, a atividade antioxidante é a capacidade de um composto ou enzima de diminuir a produção de oxidantes ou espécies reativas (SILVESTRINI et al., 2023) Neste sentido, o TAC (capacidade antioxidante total) foi utilizado no presente estudo para quantificar a possível capacidade de tamponamento oxidante do PEAK O². Dessa forma, de acordo com os resultados da figura 3, o grupo TR+PK apresentou níveis de TAC significativamente maiores em comparação aos demais grupos no músculo gastrocnêmio. Logo, a atividade antioxidante dos cogumelos é atribuída aos β-glucanos, que possuem a capacidade de eliminação de radicais livres ela presença de hidrogênio de unidades monossacarídicas específicas e certas, e pelo tipo de sua ligação em ramos laterais da cadeia principal (KOZARSKI et al., 2015). Além disso, os polissacarídeos possuem capacidade de reduzir e quelar Fe2+ e regular positivamente as atividades de enzimas antioxidantes endógenas nos músculos (YAN et al., 2014).
A alta atividade da LDH e CK no presente estudo, conforme os achados da figura 4, pode significar ruptura do disco Z sarcométrico, resultando no vazamento dessas enzimas das células musculares, que foram danificadas por lesão peroxidativa durante o exercício ( CALLEGARI et al., 2017). Em exercícios de sessão única, os animais não tem tempo suficiente para adaptação a uma variedade de fatores, como estresses mecânicos, que podem aumentar a atividade mitocondrial, resultando na produção EROS, e vazamento de CK e LDH na circulação sanguínea, que levam a ativação de uma resposta inflamatória para recuperação do tecido muscular lesionado (LEITE et al., 2023).
Conforme observado, o protocolo de teste utilizado gerou dano muscular em todos os animais que treinaram. Por outro lado, os animais do grupo TR+ PK sofreram redução nesses biomarcadores de CK e LDH. Da mesma forma, Zhang et al. (2023) observaram, que os polissacarídeos do cogumelo Cordyceps militaris através dos β-glucanos sequestram todos os tipos de radicais livres, confirmando seu potencial antioxidante. Além disso, os beta-glucanos são fibras solúveis que apresentam propriedades anti-inflamatórias, que ajudam a modular a resposta imune e podem reduzir a inflamação associada ao dano muscular após exercícios intensos (ROJANO et al., 2023)
Além disso, Hirsch et al. (2017) encontraram melhorias no consumo de oxigênio e no desempenho físico de atletas através da ingestão prévia de PEAK O², após exercício aeróbico de alta intensidade. Isso demonstra além dos benefícios antioxidantes e anti-inflamatórios, o PEAK O² pode continuar sendo avaliado na perspectiva de outros biomarcadores.
CONCLUSÃO
No presente estudo, o consumo prévio do PEAK O2 atuou como agente antioxidante, diminuindo os marcadores de estresse oxidativo e dano muscular em ratos Wistar idosos em resposta ao teste aeróbico de esforço máximo. Entretanto, são necessários mais estudos afins de explorar novas estratégias de utilização da suplementação antioxidante em protocolos diferentes de exercício. Dessa forma, a ingestão prévia de PEAK O² atenuou o estresse oxidativo e o dano muscular após teste aeróbico de esforço máximo em ratos wistar idosos.
REFERÊNCIAS
Ahmad MF, Ganoderma lucidum: Novel Insight into Hepatoprotective Potential with Mechanisms of Action. Nutrients. 2023;15(8):1874. doi: 10.3390/nu15081874.
Callegari GA, Novaes JS, Neto GR, Dias I, Garrido ND, Dani C. Creatine Kinase and Lactate Dehydrogenase Responses after Different Resistance and Aerobic Exercise Protocols. J Hum Kinet. 2017 Aug 1;58:65-72. doi: 10.1515/hukin-2017-0071. PMID: 28828078; PMCID: PMC5548155.
Cheeseman KH. Mechanisms and effects of lipid peroxidation. Mol Aspects Med. 1993;14(3):191-7. doi: 10.1016/0098-2997(93)90005-x. PMID: 8264333.
Choi MH, Ow JR, Yang ND, Taneja R. Oxidative Stress-Mediated Skeletal Muscle Degeneration: Molecules, Mechanisms, and Therapies. Oxid Med Cell Longev. 2016;2016:6842568. doi: 10.1155/2016/6842568.
Dos Santos Silva A, Porath Azevedo Fassarella B, de Sá Faria B, Moreira El Nabbout TG, Moreira El Nabbout HG, da Costa d’Avila J. Envelhecimento populacional: realidade atual e desafios. Glob Acad Nurs J. 2021;2(Sup.3). doi: 10.5935/2675-5602.20200188.
Faure P, Lafond JL. Measurement of plasma sulphydryl and carbonyl groups as a possible indicator of protein oxidation. Birkhäuser Verlag. 1995;237-48.
Habtemariam S. Trametes versicolor (Synn. Coriolus versicolor) Polysaccharides in Cancer Therapy: Targets and Efficacy. Biomedicines. 2020;8(5):135. doi: 10.3390/biomedicines8050135.
Hirsch KR, Smith-Ryan AE, Roelofs EJ, Trexler ET, Mock MG. Cordyceps militaris Improves Tolerance to High-Intensity Exercise After Acute and Chronic Supplementation. J Diet Suppl. 2017;14(1):42-53. doi: 10.1080/19390211.2016.1203386.
Iakovou E, Kourti M. A Comprehensive Overview of the Complex Role of Oxidative Stress in Aging, The Contributing Environmental Stressors and Emerging Antioxidant Therapeutic Interventions. Front Aging Neurosci. 2022;14:827900. doi: 10.3389/fnagi.2022.827900.
Iqbal T, Sohaib M, Iqbal S, Rehman H. Explorando o potencial terapêutico dos cogumelos Pleurotus ostreatus e Agaricus bisporus contra hiperlipidemia e estresse oxidativo usando modelo animal. Foods. 2024;13:709. doi: 10.3390/foods13050709.
Juan SMA, Adlard PA. Ageing and Cognition. Subcell Biochem. 2019;91:107-22. doi: 10.1007/978-981-13-3681-2_5.
Kabakçı R, Çınar Y, Çınar M. What is the Combined Effects of Ginkgo Biloba Extract (EGb761) and Acute Exhaustive Exercise on the Thiol-Disulfide Homeostasis in Rats?. Vet Sci Pract. 2022;17(2):35-40.
Kozarski M, Klaus A, Jakovljevic D, Todorovic N, Vunduk J, Petrovic P, et al. Antioxidants of Edible Mushrooms. Molecules. 2015;20(10):19489-95. doi: 10.3390/molecules201019489.
Leite CDFC, Zovico PVC, Rica RL, Barros BM, Machado AF, Evangelista AL, et al. Exercise-Induced Muscle Damage after a High-Intensity Interval Exercise Session: Systematic Review. Int J Environ Res Public Health. 2023;20(22):7082. doi: 10.3390/ijerph20227082.
Luo Z, Xu X, Sho T, Zhang J, Xu W, Yao J, et al. ROS-induced autophagy regulates porcine trophectoderm cell apoptosis, proliferation, and differentiation. Am J Physiol Cell Physiol. 2019;316(2). doi: 10.1152/ajpcell.00256.2018.
McLeay Y, Stannard S, Houltham S, Starck C. Dietary thiols in exercise: oxidative stress defence, exercise performance, and adaptation. J Int Soc Sports Nutr. 2017;14:12. doi: 10.1186/s12970-017-0168-9.
Noblanc A, Klaassen A, Robaire B. The Exacerbation of Aging and Oxidative Stress in the Epididymis of Sod1 Null Mice. Antioxidants. 2020;9(2):151. doi: 10.3390/antiox9020151.
Powers SK, Schrager M. Redox signaling regulates skeletal muscle remodeling in response to exercise and prolonged inactivity. Redox Biol. 2022;54:102374. doi: 10.1016/j.redox.2022.102374.
Rodney GG, Pal R, Abo-Zahrah R. Redox regulation of autophagy in skeletal muscle. Free Radic Biol Med. 2016;98:103-12. doi: 10.1016/j.freeradbiomed.2016.05.010.
Rojano-Ortega D, Peña-Amaro J, Berral-Aguilar AJ, Berral-de la Rosa FJ. Quercetin supplementation promotes recovery after exercise-induced muscle damage: a systematic review and meta-analysis of randomized controlled trials. Biol Sport. 2023;40(3):813-25. doi: 10.5114/biolsport.2023.121320.
Rossoni LV, Oliveira RA, Caffaro RR, Miana M, Sanz-Rosa D, Koike MK, et al. Cardiac benefits of exercise training in aging spontaneously hypertensive rats. J Hypertens. 2011;29(12):2349-58. doi: 10.1097/HJH.0b013e32834d2532.
Salles J, Chanet A, Guillet C, Vaes AM, Brouwer-Brolsma EM, Rocher C, et al. Vitamin D status modulates mitochondrial oxidative capacities in skeletal muscle: role in sarcopenia. Commun Biol. 2022;5(1):1288. doi: 10.1038/s42003-022-04246-3.
Silvestrini A, Meucci E, Ricerca BM, Mancini A. Total Antioxidant Capacity: Biochemical Aspects and Clinical Significance. Int J Mol Sci. 2023;24(13):10978. doi: 10.3390/ijms241310978.
Ulrich K, Jakob U. O papel dos tióis nos sistemas antioxidantes. Free Radic Biol Med. 2019;140:14-27. doi: 10.1016/j.freeradbiomed.2019.05.035.
Valgimigli L. Lipid Peroxidation and Antioxidant Protection. Biomolecules. 2023;13(9):1291. doi: 10.3390/biom13091291.
Valgimigli L, Pratt DA. Antioxidantes em Química e Biologia. In: Chatgilialoglu C, Studer A, editors. Encyclopedia of Radicals in Chemistry, Biology and Materials. 2012. doi: 10.1002/9781119953678.rad055.
Wang Y, Chen M, Gao Y, He K, Yang Z, Li Y, et al. Effect of one-time high load exercise on skeletal muscle injury in rats of different genders: oxidative stress and mitochondrial responses. Acta Cir Bras. 2022;37(8) doi: 10.1590/acb370805.
Yan F, Wang B, Zhang Y. Polysaccharides from Cordyceps sinensis mycelium ameliorate exhaustive swimming exercise-induced oxidative stress. Pharm Biol. 2014;52(2):157-61. doi: 10.3109/13880209.2013.820197.
Zhang D, Tang Q, He X, Wang Y, Zhu G, Yu L. Antimicrobial, antioxidant, anti-inflammatory, and cytotoxic activities of Cordyceps militaris spent substrate.
Zhou W, Zeng G, Lyu C, Kou F, Zhang S, Wei H. The Effect of Exhaustive Exercise on Plasma Metabolic Profiles of Male and Female Rats. J Sports Sci Med. 2019 Jun 1;18(2):253-63. PMID: 31191095; PMCID: PMC6543993.
1Programa de Pós-Graduação em Educação Física da Universidade Federal de Sergipe (PPGEF/UFS), Sergipe, Brasil.
https://orcid.org/0009-0008-3143-2793
2Programa de Pós-Graduação em Educação Física da Universidade Federal de Sergipe (PPGEF/UFS), Sergipe, Brasil.
Núcleo de Pesquisa em Sinalização Intracelular – (NUPESIN/CNPq), Universidade Federal de Sergipe, São Cristóvão, Sergipe, Brasil.
https://orcid.org/0000-0001-7869-2922
3Programa de Pós-Graduação em Educação Física da Universidade Federal de Sergipe (PPGEF/UFS), Sergipe, Brasil.
https://orcid.org/0000-0002-5721-0725
4Programa de Pós-Graduação em Educação Física da Universidade Federal de Sergipe (PPGEF/UFS), Sergipe, Brasil.
https://orcid.org/0000-0003-2030-0003
5Programa de Pós-Graduação em Educação Física da Universidade Federal de Sergipe (PPGEF/UFS), Sergipe, Brasil.
Departamento de Movimento Corporal Humano, Universidade do Estado de Minas Gerais (DCMH/UEMG), Minas Gerais, Brasil.
Centro de Estudos e Pesquisas em Atividade Física, Saúde e Esporte (NEPAFISE/CNPq), Brasil.
https://orcid.org/0000-0002-3387-9715
6Programa de Pós-Graduação em Educação Física da Universidade Federal de Sergipe (PPGEF/UFS), Sergipe, Brasil.
Programa de Pós-Graduação em Ciências Fisiológicas da Universidade Federal de Sergipe (PROCFIS/UFS), Sergipe, Brasil.
https://orcid.org/0000-0003-1945-0645
7Programa de Pós-Graduação em Ciências Fisiológicas da Universidade Federal de Sergipe (PROCFIS/UFS), Sergipe, Brasil.
https://orcid.org/0000-0001-6940-6891
8Programa de Pós-Graduação em Educação Física da Universidade Federal de Sergipe (PPGEF/UFS), Sergipe, Brasil.
Programa de Pós-Graduação em Ciências Fisiológicas da Universidade Federal de Sergipe (PROCFIS/UFS), Sergipe, Brasil.
https://orcid.org/0000-0001-7378-4529
9Programa de Pós-Graduação em Educação Física da Universidade Federal de Sergipe (PPGEF/UFS), Sergipe, Brasil.
Centro de Estudos e Pesquisas em Atividade Física, Saúde e Esporte (NEPAFISE/CNPq), Brasil.
Núcleo de Pesquisa em Sinalização Intracelular – (NUPESIN/CNPq), Universidade Federal de Sergipe, São Cristóvão, Sergipe, Brasil.
https://orcid.org/0000-0003-1433-2041
