EMERGING PARASITOSES IN PATIENTS WITH HIV/AIDS: LITERATURE REVIEW
REGISTRO DOI: 10.69849/revistaft/ar10202408212144
Caio Soares Neves Miranda¹; Geraldo Angelo Abelha Neto¹; Gustavo Andrade Neves¹; Walton Fernandes da Silva Filho¹.
Resumo
Introdução: as parasitoses intestinais representam um importante problema de saúde pública, principalmente em países subdesenvolvidos, sendo responsáveis por alta morbimortalidade em pacientes portadores do Vírus da Imunodeficiência Humana (HIV), tendo em vista que não afetam pacientes imunocompetentes da mesma maneira. Nesse sentido, o diagnóstico e o tratamento das parasitoses intestinais em pacientes portadores do Vírus da Imunodeficiência Humana (HIV) sofrem influência dessa coinfecção e a Terapia Antirretroviral (TARV) se apresenta como um dos métodos fundamentais de profilaxia para elevar a contagem de células TCD4+ acima de 200 células/mm³, diminuindo significativamente o risco da ocorrência das infecções oportunistas. A detecção precoce através do controle dos níveis da contagem de células TCD4+ são essenciais para reduzir o impacto dessas infecções secundárias. Objetivo: o objetivo geral desta revisão foi obter uma avaliação das parasitoses intestinais em pacientes com HIV/AIDS, abordando sua prevalência, prevenção, diagnóstico e tratamento dessas infecções oportunistas causadas pelos principais parasitas intestinais. Método: trata-se de uma revisão de literatura narrativa, por meio de pesquisas bibliográficas em artigos originais, relatos de casos, diretrizes e ensaios clínicos. Os artigos foram selecionados nas bases de dados da Scielo e Pubmed, entre o período de 2018-2024. Desenvolvimento: as infecções parasitárias em pacientes com HIV/AIDS, são mais comuns em países subdesenvolvidos ou em desenvolvimento. Ademais, os parasitos mais prevalentes nesses casos são Cryptosporidium sp e o helminto Strongyloides stercoralis. Em relação ao diagnóstico, ele é baseado em técnicas parasitológicas, sorológicas e moleculares, sendo importante utilizar diferentes métodos para identificar e caracterizar infecções parasitárias com maior sensibilidade nesta população vulnerável. Cabe lembrar que a monitorização da contagem de células TCD4+ é de suma importância para a instituição de terapia específica em paciente com parasitose intestinal previamente diagnósticado com HIV/AIDS. Nesse sentido, a prevenção dos indivíduos infectados ou expostos se baseia no acesso à água tratada, saneamento ambiental e às medidas de higiene pessoal. Além disso, a terapia antirretroviral e o tratamento específico para parasitas são de suma importância para um prognóstico adequado do paciente afetado com a coinfecção entre HIV e Cryptosporidium parvum ou Strongyloides stercoralis. Conclusão: Parasitas como Cryptosporidium parvum e Strongyloides stercoralis apresentaram-se de maneira prevalente em pacientes imunocomprometidos. Ademais, nessa revisão foi observado que o ideal para o diagnóstico preciso seria utilizar técnicas moleculares e sorológicas, que são mais avançadas, juntamente com o EPF, entretanto aquelas têm alto custo e não estão disponíveis em locais precários. Além disso, este trabalho demonstrou que a TARV, juntamente com a terapia específica para a Strongyloides stercoralis e Cryptosporidum parvum, se mostraram de suma importância para o controle da coinfecção entre o HIV e os parasitas emergentes.
Palavras-chave: Parasitoses Intestinais. HIV. AIDS. Terapia Antiretroviral.
Abstract
Introduction: intestinal parasites represent an important public health problem, especially in underdeveloped countries, being responsible for high morbidity and mortality in patients with the Human Immunodeficiency Virus (HIV), considering that they do not affect immunocompetent patients in the same way. In this sense, the diagnosis and treatment of intestinal parasites in patients with the Human Immunodeficiency Virus (HIV) are influenced by this co-infection and Antiretroviral Therapy (ART) presents itself as one of the fundamental prophylaxis methods to raise the CD4+ T cell count above of 200 cells/mm³, significantly reducing the risk of opportunistic infections. Early detection through control of CD4+ T cell count levels is essential to reduce the impact of these secondary infections. Objective: the general objective of this review was to obtain information about intestinal parasites in patients with HIV/AIDS, addressing their prevalence, prevention, diagnosis and treatment of these opportunistic infections caused by the main intestinal parasites. Method: this is a narrative literature review, through bibliographical research in original articles, case reports, guidelines and clinical trials. The articles were selected from the Scielo and Pubmed databases, between the period 2018-2024. Development: parasitic infections in patients with HIV/AIDS are more common in underdeveloped or developing countries. Furthermore, the most prevalent parasites in these cases are Cryptosporidium sp and the helminth Strongyloides stercoralis. Regarding diagnosis, it is based on parasitological, serological and molecular techniques, and it is important to use different methods to identify and characterize parasitic infections with greater sensitivity in this vulnerable population. It is worth remembering that monitoring the CD4+ T cell count is extremely important for the institution of specific therapy in patients with intestinal parasitosis previously diagnosed with HIV/AIDS. In this sense, prevention of infected or exposed individuals is based on access to treated water, environmental sanitation and personal hygiene measures. Furthermore, antiretroviral therapy and specific treatment for parasites are of utmost importance for an adequate prognosis of patients affected by co-infection between HIV and Cryptosporidium parvum or Strongyloides stercoralis. Conclusion: Parasites such as Cryptosporidium parvum and Strongyloides stercoralis were prevalent in immunocompromised patients. Furthermore, in this review it was observed that the ideal for accurate diagnosis would be to use molecular and serological techniques, which are more advanced, together with the EPF, however these are high cost and are not available in precarious locations. Furthermore, this work demonstrated that Antiretroviral Therapy, together with specific therapy for Strongyloides stercoralis and Cryptosporidum parvum, proved to be extremely important for controlling co-infection between HIV and emerging parasites.
Keywords: Intestinal Parasitosis. HIV. AIDS. Antiretroviral Therapy.
Introdução
As parasitoses intestinais são responsáveis por infectar cerca de 3,5 bilhões de indivíduos no mundo atualmente, representando um relevante problema de saúde pública. Dentre esses, cerca de 450 milhões são diagnosticadas diretamente com algumas enteroparitoses. Tais parasitoses são comuns em países que carecem de condições sanitárias adequadas, falta de informações e infraestrutura, ou seja, em regiões subdesenvolvidas, como aqueles da América Latina, Ásia e África. Além disso, cabe salientar que elas são diretamente responsáveis por elevar o índice de morbimortalidade naqueles indivíduos portadores de HIV/AIDS (Aliyo; Gemechu, 2022) (Udeh et al., 2019).
Nesse âmbito, é importante destacar que o corpo possui células de defesa, sendo uma delas as células TCD4+, que são importantes para a proteção do organismo contra infecções devido à liberação de citocinas com consequente ativação de células apresentadoras de antígenos, fagocíticas, células T citotóxicas e natural killer (Sadiq; Zomer; Guzman, 2020). Sendo assim, indivíduos portadores de HIV/AIDS possuem risco aumentado para infecções oportunistas, principalmente na ausência de TARV, tendo em vista que depleção do sistema imune do indivíduo aumenta o risco para coinfecção com parasitos intestinais e, consequentemente, a evolução do HIV para AIDS (Mohebali; Yimam; Woreta, 2020).
Dentre as manifestações clínicas em pacientes que possuem coinfecção entre parasitose intestinal e HIV/AIDS, a diarreia se destaca por afetar cerca de 90% dos pacientes e influenciar negativamente na qualidade de vida e sobrevivência desses indivíduos. Dentre os parasitas mais comumente associados a esse quadro clínico, destaca-se Cryptosporidium parvum e Strongyloides stercoralis (Amoo et al., 2018).
Dessa forma, existem diferentes métodos diagnóstico de parasitoses intestinais, entre os quais podem-se destacar a microscopia direta, os métodos sorológicos e moleculares (Barcelos et al., 2018). Além disso, a dosagem de linfócitos TCD4+ e da carga viral (CV) de maneira periódica em pacientes com HIV são de suma importância para o manejo adequado das infecções causadas pelo Cryptosporidium parvum e Strongyloides stercoralis (Pereira, 2022) (Ribeiro; Vaz; Zanelatto; Domingos, 2019). Nesse sentido, a prevenção de infecções oportunistas naqueles
pacientes com diagnóstico concomitante de parasitose intestinal e HIV/AIDS precisam de cuidado envolvendo equipes multidisciplinares e educação do paciente. Dentre as estratégias adotadas no controle da coinfecção, a TARV e a terapia específica para parasitoses emergentes são de suma importância, tanto para prevenção como para o tratamento, influenciando positivamente no prognóstico dos pacientes (Sadiq; Zomer; Guzman, 2020).
O objetivo geral desta revisão foi obter uma avaliação das parasitoses emergentes em pacientes com HIV/AIDS, abordando sua prevalência, prevenção, diagnóstico e tratamento dessas infecções oportunistas causadas pelos principais parasitas intestinais.
Método
Este estudo consistiu em uma revisão de literatura do tipo narrativa, buscando consolidar informações sobre parasitoses intestinais em pacientes com HIV/AIDS. Na pesquisa foram utilizadas as palavras-chaves “Intestinal Parasitoses”, “HIV/AIDS”, “Terapia Antirretroviral”, “Infecções oportunistas”, extraídas dos Descritores em Ciências da Saúde (DeCS) e do Medical Subject Heandigs (MESH), com a combinações boolenas “AND” para refinar as buscas, tais como “Intestinal Parasitoses” AND “HIV/AIDS”, “HIV/AIDS” AND “Terapia Antirretroviral”, “HIV/AIDS” AND “Infecções oportunistas” e “Terapia Antirretroviral” AND “Infecções oportunistas”.
As consultas foram conduzidas nas bases de dados Scielo e PubMed, escolhidas devido a sua relevância na área da saúde. Foram considerados diversos tipos de estudos, tais como estudos originais, relatos de casos, diretrizes, ensaios clínicos, visando abranger diversas perspectivas sobre o tema.
O recorte temporal entre 2018 e 2024 foi estabelecido devido ao aumento significativo de pesquisas sobre o tema nesse intervalo. Os critérios de inclusão incluem artigos que se alinham à temática da pesquisa, publicados integralmente em português ou inglês e de acesso livre. Por outro lado, foram excluídos artigos que não estavam diretamente relacionados ao tema proposto. Este processo de inclusão e exclusão visou garantir a qualidade e relevância dos estudos considerados na revisão de literatura.
VÍRUS DA IMUNODEFICIENCIA HUMANA
O HIV é uma infecção provocada por um retrovírus, podendo evoluir, em alguns casos, para a Síndrome da Imunodeficiência Humana Adquirida (AIDS). Cabe salientar que a doença pode apresentar diferentes evoluções clínicas por haver variações entre hospedeiros (Heuvel; Schatz; Rosengarten; Stitz, 2022).
A disseminação, inicialmente, ocorre dos linfonodos locais e logo após para os tecidos linfoides, que são reservatórios virais latentes. O vírus do HIV afeta em sua grande maioria os linfócitos TCD4+ de memória, sofrendo replicação intracelular. Por volta de 3 a 4 semanas após a exposição, há um pico de viremia e uma diminuição no número linfócitos TCD4+. Através da disseminação sistêmica, a resposta imune celular e humoral é ativada, entretanto, os anticorpos anti-HIV têm sua produção mais tardia e insuficiente, com isso se torna incapaz de erradicar a infecção. Ademais, a ativação imune gera um aumento no número de linfócitos TCD8+, que controlam parcialmente a infecção, porém não são capazes de impedir a queda nos linfócitos TCD4+, que ocorre de forma lenta e progressiva, e a progressão para a AIDS (Ribeiro; Vaz; Zanelatto; Domingos, 2019).
PARASITOSES INTESTINAIS E O VÍRUS DA IMUNODEFICIENCIA HUMANA
PREVENÇÃO
As infecções pelos principais parasitas intestinais afetam predominantemente indivíduos e comunidades que carecem de acesso ao saneamento básico e água potável, tendo em comum a necessidade de que o hospedeiro seja exposto a algum material ou local infectado por fezes humanas como água, solo ou alimentos contaminados. Dessa forma, cabe salientar que o ciclo de vida de enteroparasitas como Cryptosporidium parvum e Strongyloides stercoralis estão diretamente relacionados ao saneamento básico (Jeske et al., 2020).
A elevada incidência de parasitoses intestinais em regiões sem condições adequadas de saneamento básico destaca a importância de adotar estratégias para a eliminação de enteroparasitas. Entre os objetivos, a identificação de elementos de risco e a realização de atividades educacionais contínuas são fundamentais para promover o planejamento urbano e habitacional, além de práticas educacionais para a prevenção de parasitoses intestinais (Braganollo et al., 2019).
Nesse sentido, as medidas relacionadas à prevenção de enteroparasitas se baseiam no tratamento dos indivíduos infectados, na melhoria do acesso à água tratada, ao saneamento básico e às medidas de higiene pessoal. Dessa forma, é importante diferentes componentes para que ocorra eficácia na prevenção, tendo em vista a inexistência de uma única medida individual efetiva (Ross et al., 2020).
Ciclo de vida do Cryptosporidium parvum
Cryptosporidium é um protozoário que pertence ao filo Apicomplexa. Apresenta um ciclo de vida complexo, incluindo fases de reprodução sexuada e assexuada, que termina com a excreção de oocistos nas fezes do hospedeiro (WANG et al., 2022). O seu ciclo de vida possui um único hospedeiro, sendo que a transmissão acontece devido ao contato com água ou alimentos contaminados por oocistos, os quais são liberados por animais infectados ou até mesmo por autoinfecção. Quando os oocistos são ingeridos ocorre desencistamento e liberação de esporozoítos nas células do epitélio gastrointestinal e, a partir disso, os parasitas irão se multiplicar assexuadamente ou sexuadamente, desenvolvendo oocistos que esporulam no hospedeiro infectado. Dessa maneira, ocorre a produção de oocistos de parede grossa e parede fina que serão liberados no ambiente e envolvidos na autoinfecção, respectivamente (Helmy; Hafez, 2022).
Cabe lembrar que os tratamentos básicos de água são eficazes contra a maioria dos patógenos transmitidos por ela, entretanto isso não ocorre em protozoários formadores de cistos, como o Cryptosporidium parvum. A capacidade desse parasita de formar cistos concede um aumento da resistência aos tratamentos de água à base de cloro. Sendo assim, a maioria das pessoas podem entrar em contato com esse parasita e não desenvolver sintomas, tendo em vista que em indivíduos imunocompetentes as doenças causadas por esses organismos são autolimitadas. O mesmo não ocorre em populações imunocomprometidas devido à gravidade da doença ser influenciada pelo sistema imunológico do hospedeiro, podendo inclusive se cronificar. (Fradette; Culley; Charette, 2022)
Ciclo de vida do Strongyloides stercoralis
A estrongiloidíase é uma verminose causada pelo nematoide (helminto) Strongyloides stercoralis que costuma habitar o intestino delgado dos indivíduos infectados e, na maioria dos pacientes com sistema imunológico sadio, não provoca sintomas relevantes (SHARMA et al., 2022). O ciclo biológico do S. stercoralis é mais complexo quando comparado ao do Cryptosporidium, podendo se apresentar de três maneiras alternadas, sendo elas ciclo de vida livre e parasitários, além da autoinfecção. Em geral, seu ciclo de vida livre se inicia com as larvas rabditiformes sendo excretadas em fezes de
humanos infectados e, a partir disso, esses parasitas sofrem transformações, podendo se tornar adultos de vida livre ou larvas filarioides infectantes (L3), os quais têm a capacidade de penetrar o tegumento humano, para continuar o ciclo de vida. Os adultos de vida livre copulam e as fêmeas eclodem os ovos e, novamente, podem formar vermes de livre ou larvas filarioides infectantes. Cabe lembrar que essa segunda geração de larvas filariformes não se tornarão adultos de vida livre e deverão procurar algum hospedeiro para a continuação do ciclo de vida (CDC, 2019).
Aquelas larvas infectantes que conseguiram penetrar à pele humana, através do solo contaminado, irão atingir a circulação sistêmica e os capilares alveolares, adentrando os alvéolos e fazendo um trajeto até a glote, passando por bronquíolo, brônquios e traqueia. Posteriormente, será deglutida atingindo o trato gastrointestinal, especificamente o duodeno e jejuno proximal. Nessa porção do intestino delgado as larvas sofrem duas transformações e tornam-se fêmeas adultas que irão produzir ovos por partenogênese, formando através disso as larvas rabditiformes, as quais serão eliminadas pelas fezes, reiniciando o ciclo (Page; Judd; Bradbury, 2018).
Ademais, as larvas rabditiformes, no intestino grosso, podem se transformar em larvas filariformes infecciosas, podendo penetrar na mucosa intestinal (autoinfecção interna) ou na pele na região anal (autoinfecção externa). Uma vez que elas reinfectam os hospedeiros, o ciclo será reiniciado com o parasita se disseminando por todo o corpo (Vasquez-Rios et al., 2019).
PREVALÊNCIA
As enteroparasitoses desempenham um verdadeiro desafio para a saúde pública, especialmente em países onde persistem más condições de vida, infraestruturas inadequadas e falta de educação em saúde (Cociincic et al., 2020; Paes et al., 2020). Neste cenário, estima-se que no mundo, cerca de metade da população esteja infectada com alguma parasitose intestinal, sendo mais prevalentes em locais como Ásia, África e América Latina (Bragagnollo et al., 2019). Em relação ao HIV, estima-se que existam cerca de 35 milhões de pessoas vivendo com o vírus em todo o mundo, especialmente em países em desenvolvimento, o que representa um sério problema de saúde pública. Cabe salientar que a evolução para a AIDS possui um prognóstico desfavorável, quando a mesma acontece, tendo uma mortalidade significativamente aumentada quando comparada às outras infecções sexualmente transmissíveis (Qiao et al., 2019).
Naqueles pacientes com diagnóstico de HIV, os quais já são vulneráveis em razão do imunocomprometimento, o nível socioeconômico torna-se um fator relevante, quando considerado baixo, para coinfecção entre parasitoses intestinais e HIV (Amoo et al., 2018).
Dentre os sintomas, a diarreia é uma das manifestações clínicas mais significativas e ocorrem principalmente quando a infecção não é controlada (García; Alger; Soto, 2021). Essa manifestação decorre de desequilíbrios na microbiota intestinal, sendo que quase metade dos casos de diarreia nesta população são causadas por parasitas intestinais como Cryptosporidium sp. e Strongyloides stercoralis (Lopes, 2023).
Prevalência de Strongyloides stercoralis
Dentre as espécies mais prevalentes, o Strongyloides stercoralis é um dos parasitas mais citados. Em indivíduos com estrongiloidíase associado a AIDS pode ocorrer a hiperinfecção, que consiste em múltiplos focos de infecção associado à disseminação generalizada do parasita, podendo afetar diferentes órgãos do corpo humano (Bagwell; Vasudevan; Mondy, 2021).
Dessa forma, a prevalência estimada, segundo estudo realizado por Akanksha, da infecção por Strongyloides stercoralis em pacientes HIV positivos foi de 5%, principalmente em países subdesenvolvidos como aqueles da África Subsaariana, América Latina e Ásia (Akanksha et al., 2023). Em um outro estudo realizado na Etiópia, a prevalência média de Strongyloides stercoralis foi de 11,5% naqueles pacientes portadores do HIV (Aliyo; Gemechu, 2022).
Prevalência de Cryptosporidium parvum
Cryptosporidium é um parasita apicomplexo entérico, ou seja, tem ciclo de vida complexo e em cada estágio do seu desenvolvimento pode apresentar característica celular, morfológica e bioquímica distinta. Ele pode infectar vários mamíferos, causando diarreia crônica em pacientes com HIV/AIDS, tendo como consequência, em alguns casos, o óbito desses indivíduos. Em um estudo foram analisadas amostras fecais de 350 pacientes HIV positivo, sendo 33 positivas com presença de oocistos. Dentre os pacientes infectados, 31 tinham quadro de diarreia crônica associado e os valores médios da contagem de células TCD4+ foram de aproximadamente 81 células/mm³. Isso demonstra que os níveis de células TCD4+ apresentam correlação com o prognóstico do paciente, principalmente se abaixo de 50 células/mm³ (Semmani et al., 2023)
Em um outro estudo, a prevalência mundial de infecções por Cryptosporidium sp. no contexto da coinfecção por HIV foi de aproximadamente 14%. No Brasil, esse mesmo estudo constatou que a prevalência de infecções por Cryptosporidium sp. é de 5,1% (Wang et al., 2018).
DIAGNÓSTICO
Para diagnosticar parasitas intestinais em pacientes portadores de HIV/AIDS, é fundamental a utilização de diferentes testes a fim de detectar as infecções com mais sensibilidade principalmente nos indivíduos portadores da AIDS (García; Alger; Soto, 2021). A técnica mais usada para diagnóstico desses parasitos são os testes parasitológicos, porém os métodos sorológicos e moleculares também são usados para investigação. O diagnóstico das parasitoses intestinais muitas vezes se torna difícil, isso se deve ao fato dos oocistos serem pequenos e leves, além da necessidade de técnicas especializadas (Santos; Faria, 2020).
O EPF é realizado como rotina em casos de suspeita de infecção por parasitas que podem ser diagnosticadas através de cistos, ovos e larvas presentes nas fezes. Atualmente, não há um método que possa identificar todas as formas dos parasitas, alguns testes detectam muitos patógenos, já outros são mais específicos de cada um. Dentre os parasitas identificados nas fezes do trato gastrointestinal humano, podemos elencar protozoários como o Cryptosporidium parvum e helmintos como o Strongyloides stercoralis (WHO, 2023).
Strongyloides stercoralis
Em relação a estrongiloidíase, frequentemente os pacientes são assintomáticos, sendo assim para manejo é recomendado observar se ocorre aumento na contagem de eosinófilos, sendo assim, com a presença de eosinofilia inexplicada, é necessário suspeitar de infecção por Strongyloides Stercoralis. Cabe lembrar que a infecção por Strongyloides stercoralis pode persistir por muito anos em pacientes imunocomprometidos, tornando seu diagnóstico essencial(Siqueira- Batista, 2020).
No diagnóstico é considerado padrão-ouro a visualização direta das larvas. A microscopia, quando é feita com amostra única, tem sensibilidade em torno de 21% e isso é explicado pela eliminação intermitente e baixa carga infecciosa do parasita. Sendo assim, quando se faz a utilização de múltiplas amostras em dias diferentes ocorre um aumento da sensibilidade para próximo de 100%. Outrossim, esse método é demorado e operador dependente, podendo influenciar no resultado do exame. Embora haja o emprego de diferentes técnicas além dos métodos parasitológicos, como imunológicas e moleculares, os primeiros são preferidos devido à sua melhor especificidade, baixo custo e nenhuma necessidade de equipamentos especiais (Hui; Urusa Thaenkham, 2023).
Outro método utilizado para diagnóstico é a reação em cadeia de polimerase (PCR), que tem uma sensibilidade aumentada em comparação com os métodos parasitológicos, entretanto, em pacientes assintomáticos com baixos níveis de produção larval é difícil que haja sensibilidade adequada, sendo também um método de difícil acesso em locais precários. Devido à sua alta sensibilidade, mesmo após a administração de medicamentos, ele permite o acompanhamento do paciente infectado, a fim de saber sobre a efetividade do mesmo (Romain Blaizot et al., 2019).
Os testes sorológicos, como ELISA, também podem ser utilizados para diagnosticar a presença de Strongyloides stercoralis. Esse método apresenta maior sensibilidade, sendo mais simples, rápido e excede as limitações presentes nos métodos parasitológicos, entretanto são métodos caros que não estão amplamente disponíveis em locais de baixo nível socioeconômico. Entretanto, em infecções recentemente adquiridas esse teste apresenta limitações de sensibilidade, sendo necessário o uso de outros testes, como os moleculares (Czeresnia; Weiss, 2022).
Cryptosporidium parvum
Devido a diversidade de vulnerabilidade e altas incidências de morbimortalidade causadas pelo Cryptosporidium sp. em pessoas imunossuprimidas, a criação de critérios de triagem eficazes e algoritmos de testes vigorosos em laboratórios clínicos é fundamental. Apesar disso, não existe padronização internacional para realização de testes diagnósticos para criptosporidiose. Os métodos diagnósticos de Cryptosporidium sp. são realizados apenas em pessoas portadoras de HIV/AIDS em alguns países, porém quando há suspeita do parasito, como na presença de diarreia aquosa ou persistente, geralmente é ofertado testes de amostra aos indivíduos imunocompetentes (O’leary; Sleator; Lucey, 2021).
Para a detecção de Cryptosporidium sp. geralmente, são utilizados testes de menor sensibilidade, frequentemente baseados na identificação de oocistos nas fezes coradas pelo Ziehl-Nielsen modificado (mZN). Todavia, o EPF possui limitações como baixa sensibilidade na presença de poucos oocistos em uma amostra de fezes, requer muito tempo e necessita de uma microscopia qualificada para detectar os oocistos (Pacheco et al., 2022).
A sensibilidade do PCR se tornou maior em relação aos métodos de microscopia e imunológicos convencionais no diagnóstico de criptosporidiose, além de possibilitar a identificação de espécies de Cryptosporidium sp., testes em lote e subespécies de organismos (Gerace; Presti; Biondo, 2019). Com isso, esses testes são mais relevantes em relação à microscopia para identificação de Cryptosporidium parvum, apesar de não serem amplamente disponíveis (O’leary; Sleator; Lucey, 2021).
Por fim, o teste de ELISA possui uma alta especificidade e sensibilidade na detecção de coproantígeno, porém ele não deve ser o único teste utilizado no diagnóstico de Cryptosporidium sp., sendo o mZN uma alternativa favorável, principalmente em regiões com poucos recursos devido ao seu baixo custo. Já nos países em desenvolvimento ou em laboratórios referenciais, o PCR foi útil na diferenciação da espécie de Cryptosporidium sp. e na avaliação uma discordância entre os testes de ELISA e microscopia (Pacheco et al., 2022).
Monitoramento do Vírus da Imunodeficiência Humana Adquirida
O monitoramento da infecção pelo HIV é realizado laboratorialmente através da contagem de células TCD4+ e da carga viral (CV), sendo estes fundamentais para acompanhar a resposta à terapia, bem como possíveis falhas, indicações de imunizações e necessidade de prevenção para infecções oportunistas (Brasil, 2018).
Nas pessoas vivendo com HIV em tratamento com a TARV, assintomáticos, com carga viral indetectável e contagem de células TCD4 maior 350 células/mm3³ em duas amostras consecutivas, é recomendado apenas a carga viral de 6 em 6 meses. Naqueles pacientes que possuem diagnóstico de HIV que estão em uso de TARV, sem sintomas e com carga viral indetectável, se a contagem de células TCD4+ for menor 350 células/mm³ devem ser solicitados os exames de linfócito TCD4+ e carga viral (CV) de 6 em 6 meses (Quadro 1). E, por último, aqueles que não fazem uso da TARV, com falha virológica ou sintomáticos, independentemente dos níveis de células TCD4+, é recomendado a contagem de TCD4+ e CV de 6 em 6 meses (Ribeiro; Vaz; Zanelatto; Domingos, 2019).
Quadro 1 – Frequência de solicitações de exame de linfócito TCD4+ para monitoramento laboratorial de PVHIB de acordo com situação clínica.
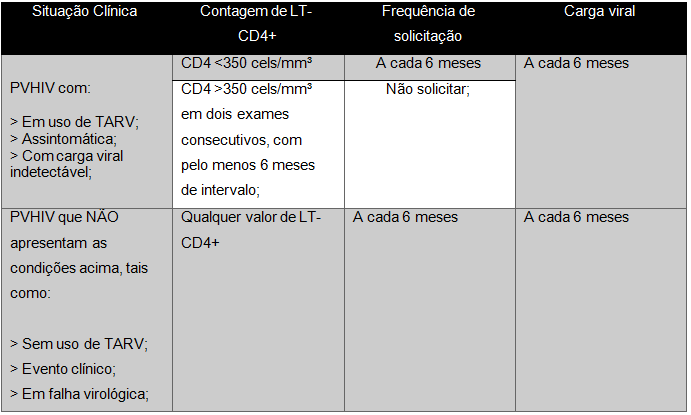
Nesse sentido, é relevante salientar que o mais importante para controle da afecção por Cryptosporidium sp. são as células TCD4+, principalmente por estarem localizadas também na lâmina própria do intestino, local em que ocorre a infecção pelo parasito. Por isso, a diminuição na contagem de células TCD4+ tem correlação com o pior prognóstico do paciente na criptosporidiose, especialmente em contagens abaixo de 180 células/mm³. Ademais, na estrongiloidíase as respostas Th1 e Th2 irão atuar imunologicamente contra a infecção. Cabe lembrar que as células Th1 e Th2 são subgrupos do linfócito TCD4+, sendo assim, em indivíduos imunocompetentes ocorre uma ação adequada da resposta Th2, combatendo a infecção. Isso não ocorre em indivíduos imunocomprometidos, pois há inativação da resposta Th2, exacerbando os sintomas (Siqueira-Batista, 2020)
TRATAMENTO
Terapia de HIV
A introdução da TARV marcou um ponto de virada no tratamento do HIV, visando diminuir os impactos da imunossupressão e proporcionar uma melhora na qualidade e expectativa de vida dos indivíduos afetados. Desde a implementação dos primeiros esquemas farmacológicos, buscou-se introduzir critérios para iniciar o tratamento com base no risco de infecções oportunistas ou evolução para AIDS, entretanto, atualmente sabe-se que a iniciação da TARV em pacientes com HIV é benéfica mesmo em situações em que as contagens de TCD4+ estejam acima de 500 células/mm³ e carga viral indetectável (Brasil, 2018).
A TARV é composta por 3 fármacos combinados antirretrovirais com distintos mecanismos de ação, escolhidos conforme critérios como: eficácia, segurança, perfil de toxicidade e a facilidade de uso. Entretanto, apesar dos benefícios, essa terapia pode levar a distúrbios metabólicos e a um elevado risco cardiovascular, fatores estes que podem comprometer a adesão ao tratamento por parte dos pacientes (Souza et al., 2019).
Dentre esses medicamentos, estão dois análogos de nucleosídeos inibidores de transcriptase reversa, já o terceiro pertence à outra classe, como inibidor da integrase, inibidor não-nucleosídeo da transcriptase reversa ou inibidor de protease. Os tratamentos disponíveis atualmente são notavelmente eficazes, possuem uma boa tolerância e apresentam longa duração, possibilitando a muitos pacientes uma vida com expectativa de vida praticamente normal (Phanuphak; Gulick, 2019)
Dentro deste cenário, a adesão rigorosa à TARV é crucial para a eficácia do regime terapêutico. Para alcançar uma anulação viral duradoura, é necessário que o paciente tome mais de 95% das doses prescritas. A dificuldade de aderir ao tratamento é um fator diretamente associado à falha terapêutica, podendo ocasionar em uma maior transmissibilidade de variantes de HIV resistentes aos medicamentos, impossibilitando o controle da patologia e tornando suscetível às infecções oportunistas (Trindade et al., 2023).
Tratamento de Strongyloides stercoralis
O medicamento atualmente mais indicado para o tratamento de estrongiloidíase é a ivermectina, devendo ser administrada em via oral com duração de 1-2 dias e dose única de 200 mcg/kg. Como alternativa, pode-se administrar tiabendazol em doses de 25 mg/kg, duas vezes diárias, por 5 dias. É importante salientar que nos casos em que o paciente apresentar o teste de fezes positivo para vermes e persistir com os sintomas, devem ser reavaliados e acompanhados durante 2-4 semanas após o tratamento para assegurar a completa erradicação da infecção. Caso ocorra o reaparecimento das larvas, um tratamento subsequente se faz necessário (Xavier; Ferreira, 2021).
Para casos severos ou de hiperinfecção, particularmente na coinfecção do Strongyloides stercoralis com o HIV, o regime de tratamento recomendado é a administração diária de ivermectina durante 7 dias, ou até a ausência do parasita ser confirmada por testes diagnósticos. Contudo, é crucial enfatizar que o manejo da estrongiloidíase em estágios avançados permanece sendo um desafio na prática clínica, e um diagnóstico feito tardiamente pode agravar consideravelmente o prognóstico dos pacientes afetados, conforme observado nos casos relatados (Siqueira-Batista, 2020).
Tratamento de Crystosporidium parvum
Para pacientes imunocompetentes infectados pelo Cryptosporidium parvum, normalmente não é indicado nenhum tratamento especial. O único medicamento aprovado pela Food Drug Association (FDA) para tratamento de diarreia ocasionada pela criptosporidiose é o Nitazoxanida 500mg durante 3-14 dias, tempo que vai variar de acordo com nível de imunocompetência do indivíduo (Quadro 2). Ademais, em pacientes HIV+ que fazem uso da terapia antirretroviral ocorre aumento na contagem de linfócitos TCD4+ e, com isso, obtém-se melhora dos sintomas e a interrupção da eliminação de oocistos. Cabe lembrar que a terapia varia de acordo com a contagem de linfócitos TCD4+ e o tratamento mais indicado é o uso dos medicamentos antirretrovirais (Pereira, 2022).
Quadro 2 – Tratamento de Crystosporidium parvum
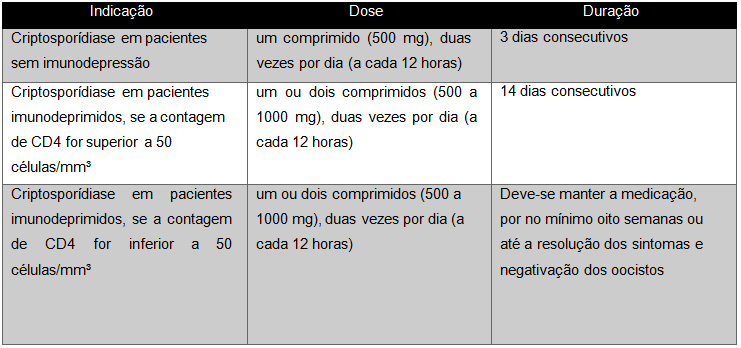
Portanto, por não existir um tratamento específico, em relação à criptosporidiose intestinal o método terapêutico fundamenta-se na reposição hidroeletrolítica e na redução dos sintomas (Pinto; Vinayak, 2021). De acordo com estudos presentes na literatura, é fundamental que ocorra a restauração do sistema imune para um melhor controle da patologia em pacientes com HIV/AIDS com o parasita Cryptosporidium sp. Sendo assim, a utilização da Terapia Antirretroviral nesses pacientes acarretou a restauração dos linfócitos CD4+, auxiliando na reparação de danos na mucosa intestinal e no controle da infecção (Nayan et al, 2023) (Pinto; Vinayak, 2021).
Conclusão
Parasitas como Cryptosporidium parvum e Strongyloides stercoralis apresentaram-se de maneira prevalente em pacientes imunocomprometidos. Ademais, nessa revisão foi observado que o diagnóstico das infecções parasitárias emergentes em pacientes com HIV se baseou em diferentes técnicas como exame parasitológico, técnicas moleculares e sorológicas. Dentre esses, o exame parasitológico de fezes foi associado à baixa acurácia na detecção dos parasitas, o que dificulta o diagnóstico mesmo naqueles pacientes que não possuem prejuízo imunológico. O ideal para o diagnóstico preciso seria utilizar técnicas moleculares e sorológicas, que são mais avançadas, juntamente com o EPF, entretanto aquelas têm alto custo e não estão disponíveis em locais precários. É importante salientar que a monitorização dos níveis de linfócitos TCD4+ se mostrou relevante para escolha do manejo adequado dos pacientes.
Além disso, este trabalho demonstrou que a Terapia Antirretroviral, juntamente com a terapia específica para a Strongyloides stercoralis e Cryptosporidum parvum, se mostrou de suma importância para o controle da coinfecção entre o HIV e os parasitas emergentes. Foi ratificado o fato supracitado devido à depleção dos níveis de células TCD4+ se mostrarem diretamente relacionadas à evolução clínica do paciente. Outrossim, cabe salientar que o tratamento do protozoário, Cryptosporidium parvum e do helminto, Strongyloides stercoralis depende diretamente da imunocompetência do paciente.
Referências
AKANKSHA, K.; KUMARI, A.; DUTTA, O.; PRASANTH, A.; DEEBA, F.; SALAM, N. Prevalence of soil-transmitted helminth infections in HIV patients: a systematic review and meta-analysis. Scientific Reports, v. 13, n. 1, p. 11055, 8 jul. 2023.
ALIYO, A.; GEMECHU, T. Assessment of intestinal parasites and associated factors among HIV/AIDS patients on antiretroviral therapy at Bule Hora General Hospital, West Guji, Ethiopia. Sage Open Medicine, v. 10, p. 205031212211246-205031212211246, 1 jan. 2022.
AMOO, J. K.; AKINDELE, A. A.; AMOO, A. O. J.; EFUNSHILE, A.; OJURONGBE, T. A.; FAEYEMIWO, S. A. et al. Prevalence of enteric parasitic infections among people living with HIV in Abeokuta, Nigeria. Pan African Medical Journal, v. 30, 2018.
BAGWELL, K.; VASUDEVAN, J.; MONDY, K. Recurrent Strongyloides stercoralis infection in an HIV+ patient. IDCases, v. 26, p. e01325, 2021.
BARCELOS, N. B.; SILVA, L. F; DIAS, R. F. G.; FILHO. H. R. M.; RODRIGUES. R. M. Opportunistic and non-opportunistic intestinal parasites in HIV/AIDS patients in relation to their clinical and epidemiological status in a specialized medical service in Goiás, Brazil. Revista do Instituto de Medicina Tropical de São Paulo, v. 60, n. 0, 8 mar. 2018. Acesso em: 11 mar. 2024.
BATISTA, F. S.; MIRANDA, L. S.; SILVA, M. B. O.; TABORDA, R. L. M.; SOARES, M. C. F.; MATOS, N. B. Chronic Cystoisospora belli infection in an HIV/AIDS patient treated at the specialized assistance service in Porto Velho County – Rondônia. Revista da Sociedade Brasileira de Medicina Tropical, v. 52, 2019.
BATISTA-SIQUEIRA, R.; GOMES, A. P.; SANTOS, S. S.; SANTANA, L. A. Parasitologia: fundamentos e prática clínica. Disponível em: <https://pesquisa.bvsalud.org/portal/resource/pt/biblio-1121779>. Acesso em: 19 mar. 2024.
BLAIZOT, R.; SIMON, S.; BROTTIER, J.; BLANCHET, D.; BROUSSE, P.; BOUKHARI, R. et al. Utility of PCR in Patients with Strongyloides stercoralis and HTLV-1 Coinfection in French Guiana. The American journal of tropical medicine and hygiene, v. 101, n. 4, p. 848–850, 2 out. 2019.
BRAGAGNOLLO, G. R.; SANTOS, T. S.; FONSECA, R. E.; ACRANI, M.; BRANCO, M. Z. P. C.; FERREIRA, B. R. Playful educational intervention with schoolchildren on intestinal parasitosis. Revista Brasileira de Enfermagem, v. 72, n. 5, p. 1203–1210, out. 2019.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de DST, Aids e Hepatites Virais. Protocolo clínico e diretrizes terapêuticas para manejo da infecção pelo HIV em adultos. Brasília – DF, 2018.
CENTERS FOR DISEASE CONTROL AND PREVENTION. CDC – DPDx – Strongyloidiasis. 2019.Disponível em: <https://www.cdc.gov/dpdx/strongyloidiasis/index.html>.
COCIANCIC, P.; TORRUSIO, S. E.; ZONTA M.L.; NAVONE, G.T. Risk factors for intestinal parasitoses among children and youth of Buenos Aires, Argentina. One Health, v. 9, p. 100116, 1 jun. 2020.
CZERESNIA, J. M.; WEISS, L. M. Strongyloides stercoralis. Lung, v. 200, n 2, 9 abr. 2022.
DUBEY, J. P.; ALMERIA, S. Cystoisospora belli infections in humans: the past 100 years. Parasitology, v. 146, n. 12, p. 1490–1527, 9 ago. 2019.
GALVÁN-DÍAZ, A. L.; AZALTE, J. C.; VILLEGAS, E.; GIRALDO, S.; BOTERO, J.; GARCIA-MONTOYA, G. Chronic Cystoisospora belli infection in a Colombian patient living with HIV and poor adherence to highly active antiretroviral therapy. Biomédica, v. 41, n. Suppl 1, p. 17–22, 31 maio 2021.
GARCÍA, J.; ALGER, J.; SOTO, R. J. Intestinal apicomplexan parasitoses among a hospital- based population in Honduras, 2013-2019. Biomédica, v. 41, n. 4, p. 734–744, 1 dez. 2021.
GERACE, E.; PRESTI, V. D. M. L.; BIONDO, C. Cryptosporidium infection: epidemiology, pathogenesis, and differential diagnosis. European Journal of Microbiology and Immunology, v. 9, n. 4, p. 119–123, dez. 2019.
HELMY, Y. A.; HAFEZ, H. M. Cryptosporidiosis: From Prevention to Treatment, a Narrative Review. Microorganisms, v. 10, n. 12, p. 2456, 1 dez. 2022.
IORDANOV, R. B.; LEINING, L. M.; WU, M.; CHAN, G.; DINARDO, A. R.; MEJIA, R. Case Report: Molecular Diagnosis of Cystoisospora belli in a Severely Immunocompromised Patient with HIV and Kaposi Sarcoma. American Journal of Tropical Medicine and Hygiene, v. 106, n. 2, p. 678–680, 2 fev. 2022.
HEUVEL, Y. V.; SCHATZ, S.; ROSENGARTEN, J. F.; STITZ, J. Infectious RNA: Human Immunodeficiency Virus (HIV) Biology, Therapeutic Intervention, and the Quest for a Vaccine. Toxins, v. 14, n. 2, p. 138, 14 fev. 2022.
HUI, A.; URUSA THAENKHAM. From past to present: opportunities and trends in the molecular detection and diagnosis of Strongyloides stercoralis. Parasites & Vectors, v. 16, n. 1, 11 abr. 2023.
JEREZ PUEBLA, L. E.; FERNÁNDEZ F. A. N.; MILLÁN I. A.; AVILA J. P.; NODARSE J. F.; RODRÍGUEZ I. C. et al. Identification of two potential aetiological agents of chronic diarrhoea in an immunocompromised patient in Cuba using conventional and molecular diagnostic techniques. Journal of Microbiological Methods, v. 192, p. 106376, jan. 2022.
JESKE, S.; BIACHINI, T.; LEON, Í. F.; VILLELA, M. Neoplastic patients’ knowledge about intestinal parasitoses in southern Brazil. Brazilian Journal of Biology, v. 80, n. 2, p. 386– 392, jun. 2020.
KROLEWIECKI, A.; NUTMAN, T. B. Strongyloidiasis. Infectious Disease Clinics of North America, v. 33, n. 1, p. 135–151, mar. 2019.
LI, J.; WANG, R.; CHEN, Y.; XIAO, L.; ZHANG, L. Cyclospora cayetanensis infection in humans: biological characteristics, clinical features, epidemiology, detection method and treatment. Parasitology, v. 147, n. 2, p. 160–170, 8 nov. 2019.
LOPES, A. B. O. INFECÇÃO POR ENTEROPARASITOS EM PACIENTES HIV/AIDS DE UM HOSPITAL DE REFERÊNCIA EM MACEIÓ, ALAGOAS: Um estudo de caso-controle. Trabalho de conclusão de curso (Curso de Graduação de Bacharelado em Ciências Biológicas) – Instituto de Ciências Biológicas e da Saúde, da Universidade Federal de Alagoas, [S. l.], 2023.
MATHISON, B. A.; PRITT, B. S. Cyclosporiasis—Updates on Clinical Presentation, Pathology, Clinical Diagnosis, and Treatment. Microorganisms, v. 9, n. 9, p. 1863, 2 set. 2021.
MOHEBALI, M.; YIMAM, Y.; WORETA, A. Cryptosporidium infection among people living with HIV/AIDS in Ethiopia: a systematic review and meta-analysis. Pathogens and Global Health, p. 1–11, 3 abr. 2020.
NAYAN, M. U.; SILLMAN, B.; HASAN, M.; DEODHAR, S.; DAS, S.; SULTANA, A. et al. Advances in long-acting slow effective release antiretroviral therapies for treatment and prevention of HIV infection. Advanced Drug Delivery Reviews, v. 200, p. 115009–115009, 1 set. 2023.
O’LEARY, J. K.; SLEATOR, R. D.; LUCEY, B. Cryptosporidium spp. Diagnosis and Research in the 21st Century. Food and Waterborne Parasitology, v. 24, p. e00131, set. 2021.
PAES, A. L. V.; GOMES, H. G.; COUTINHO, M. V. C.; TEIXEIRA, Y. R. Enteroparasitoses em pacientes com HIV/AIDS: Prevalência, contagem de células CD4 e perfil socioeconômico. Brazilian Journal of Health Review, v. 3, n. 4, p. 7532–7549, 2020.
PACHECO, F. T. F.; FREITAS, H. F.; SILVA, R. K. N. R.; CARVALHO, S. S.; MARTINS, A. S.; MENEZES, J. F. et al. Cryptosporidium diagnosis in different groups of children and characterization of parasite species. Revista da Sociedade Brasileira de Medicina Tropical, v. 55, p. e0041, 25 jul. 2022.
PAGE, W.; JUDD, J.; BRADBURY, R. The Unique Life Cycle of Strongyloides stercoralis and Implications for Public Health Action. Tropical Medicine and Infectious Disease, v. 3, n. 2, p. 53, 25 maio 2018.
PEREIRA, P. AVALIAÇÃO DAS ABORDAGENS TERAPÊUTICAS PARA A CRIPTOSPORIDIOSE INTESTINAL EM MODELOS IMUNOCOMPROMETIDOS: Uma revisão integrativa. [s.l: s.n.]. Disponível em: <https://repositorio.ufpe.br/bitstream/123456789/48225/1/TCC%20Pamella%20Almeida%20 Pereira.pdf>. Acesso em: 15 mar. 2024.
PINTO, D. J.; VINAYAK, S. Cryptosporidium: Host-Parasite Interactions and Pathogenesis. Current Clinical Microbiology Reports, v. 8, n. 2, p. 62–67, 2021.
PHANUPHAK, N.; GULICK, R. M. HIV treatment and prevention 2019. Current Opinion in HIV and AIDS, v. 15, n. 1, p. 1, out. 2019.
QIAO, Y-C.; XU, Y.; JIANG, D-X.; WANG, F.; YANG, J.; WEI, Y-S. et al. Epidemiological analyses of regional and age differences of HIV/AIDS prevalence in China, 2004– 2016. International Journal of Infectious Diseases, v. 81, p. 215–220, abr. 2019.
QIN, S.-Y.; SUN, H-T.; LYU, C.; ZHU, J-H.; WANG, Z-H.; MA, T. et al. Prevalence and Characterization of Cryptosporidium Species in Tibetan Antelope (Pantholops hodgsonii). Frontiers in Cellular and Infection Microbiology, v. 11, 6 set. 2021.
RIBEIRO, H. F.; VAZ, L. S.; ZANELATTO, C.; DOMINGOS, P. P. Imunologia clínica. Grupo A, 2019. E-book. ISBN 9788533500716. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788533500716/. Acesso em: 23 mai. 2024.
ROSS, A. G.; RAHMAN, M.; ALAM, M.; ZAMAN, K.; QADRI, F. Can we “WaSH” infectious diseases out of slums? International Journal of Infectious Diseases, v. 92, p. 130–132, mar. 2020.
SADIQ, U.; ZOMER, H.; GUZMAN, N. HIV Prevention Of Opportunistic Infections. Disponível em: <https://www.ncbi.nlm.nih.gov/books/NBK513345/>. Acesso em 11 mar. 2024.
SANTOS, R. P.; FARIA, A. R. Atualização em coccidioses intestinais: uma abordagem crítica. Revista Brasileira de Análises Clínicas, v. 51, n. 4, 2020.
SEMMANI, M.; COSTA, D.; ACHOUR, N.; CHERCHAR, M.; ZIANE, H.; MOUHAJIR, A. et al. Occurrence and Molecular Characterization of Cryptosporidium Infection in HIV/Aids Patients in Algeria. Viruses, v. 15, n. 2, p. 362, 27 jan. 2023.
SIQUEIRA-BATISTA, Rodrigo. Parasitologia – Fundamentos e Prática Clínica. Grupo GEN, 2020. E-book. ISBN 9788527736473. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788527736473/. Acesso em: 14 mai. 2024.
SOUZA, H. C.; MOTA, M. R.; ALVES, A. R.; LIMA, F. D.; CHAVES, S. N.; DANTAS, R. A. E. et al. Analysis of compliance to antiretroviral treatment among patients with HIV/AIDS. Revista Brasileira de Enfermagem, v. 72, n. 5, p. 1295–1303, out. 2019.
TRINDADE, K. I.; BATISTA, K. B.; SANTOS, T. C. DOS; NUNES, P. L. ASPECTOS DA TERAPIA ANTIRRETROVIRAL: UMA REVISÃO NARRATIVA – ISSN 1678-0817 Qualis B2. Disponível em: <https://revistaft.com.br/aspectos-da-terapia-antirretroviral-uma-revisao- narrativa/>. Acesso em: 19 mar. 2024.
UDEH, E. O.; OBIEZIE, R. N. N.; OKAFOR, F. C.; IKELE, C. B.; OKOYE, I. C.; OTUU. C. A. Gastrointestinal Parasitic Infections and Immunological Status of HIV/AIDS Coinfected Individuals in Nigeria. Annals of Global Health, v. 85, n. 1, 2019.
VASQUEZ-RIOS, G.; PINEDA-REYES, R.; PINEDA-REYES, J.; MARIN, R.; RUIZ, E.; TERASHIMA, A. Strongyloides stercoralis hyperinfection syndrome: a deeper understanding of a neglected disease. Journal of Parasitic Diseases, v. 43, n. 2, p. 167–175, 6 fev. 2019.
WANG, Z. D.; LIU, Q.; LIU, H. H.; LI, S.; ZHANG, L.; ZHAO, Y. K. et al. Prevalence of Cryptosporidium, microsporidia and Isospora infection in HIV-infected people: a global systematic review and meta-analysis. Parasites & Vectors, v. 11, n. 1, 9 jan. 2018.
WASIHUN, A. G.; TEFERI, M.; NEGASH, L.; MARUGÁN, J.; YEMANE, D.; McGUIGAN, K. G. et al. Intestinal parasitosis, anaemia and risk factors among pre-school children in Tigray region, northern Ethiopia. BMC Infectious Diseases, v. 20, n. 1, 27 maio 2020.
WHO. Soil-transmitted helminth infections. Disponível em: <https://www.who.int/news-room/fact-sheets/detail/soil-transmitted-helminth-infections>.
XAVIER, L. B.; FERREIRA, T. V. ENTRONGILOIDÍASE DISSEMINADA EM PACIENTES IMUNOSSUPRIMIDOS COM DOENÇAS AUTOIMUNE: REVISÃO DA LITERATURA ENTRONGYLOIDIASIS DISSEMINATED IN IMMUNOSUPPRESSED PATIENTS WITH AUTOIMMUNE DISEASES: LITERATURE REVIEW. [s.l: s.n.]. Disponível em: <https://www.revistas.unipacto.com.br/storage/publicacoes/2021/763_entrongiloidiase_disse minada_em_pacientes_imunossuprimidos_com_doencas.pdf>.
WANG, L. et al. Enrichment and proteomic identification of Cryptosporidium parvum oocyst wall. Parasites & Vectors, v. 15, n. 1, p. 335, 23 set. 2022.
SHARMA, N. et al. Strongyloides stercoralis Infection in Immunocompromised Host. Cureus, 13 jan. 2022.
¹Acadêmicos do curso de Medicina da Faculdade de Ciências Médicas de Ipatinga, Minas Gerais, Brasil.
