REGISTRO DOI: 10.5281/zenodo.10050649
Azamor Viana França[1]
Ivis Dawson Mello de Oliveira[2]
Bruna da Silva Souza Avelino[3]
RESUMO
Objetivo: Identificar os procedimentos do controle de qualidade no laboratório clínico. Metodologia: Revisão da literatura, exploratória e qualitativa, envolvendo uma revisão integrativa de publicações existentes, conforme as diretrizes disponíveis. Com levantamento dos dados baseados nas referências de sites, revistas, plataformas de universidades e livros acadêmicos, das bases de dados SCIELO (Biblioteca Eletrônica Scientific Eletronic Library Online), BVS (Biblioteca Virtual em Saúde) e Google Acadêmico, partindo do uso dos termos: “métodos de avaliação”, “legislações” e “atuação do biomédico”; na faixa temporal dos anos de 2013 e 2023. Resultados: Após coleta dos dados e adoção dos critérios de exclusão foram selecionadas 25 publicações elegíveis para análise. Os estudos demonstraram a importância dos procedimentos de controle da qualidade em laboratórios clínicos, pois são necessários parâmetros específicos que correspondam as obrigatoriedades das legislações vigentes, como a verificação de reagentes, kits, meios de cultura, equipamentos, pessoal técnico, resultados e a documentação laboratorial. No entanto, a execução destes procedimentos deve ser realizada por um responsável técnico com amplo conhecimento em análise clinica, como o biomédico, garantindo a fidedignidade dos resultados de exames. Considerações Finais: É notório que os profissionais da biomedicina podem atuar neste segmento do diagnóstico laboratorial, visto que aliam a análise de materiais biológicos com tecnologias de ponta em diagnósticos preventivos e no tratamento de afecções patológicos, considerando um conhecimento humanizado em relação a vida dos pacientes enfermos.
Palavras-chave: Controle de Qualidade; Laboratório Clínico; Análises Clínicas; Profissional biomédico.
_________________________________________
1 INTRODUÇÃO
O laboratório de análises clínicas é o local onde coexistem equipamentos, objetos, amostras e pessoal, expostos a um grande número de substâncias que podem ou não ser potencialmente nocivas à saúde dos trabalhadores, como bactérias, fungos, parasitas e vírus. As preocupações sobre os riscos e erros associados aos serviços laboratoriais de análises clínicas remontam desde as décadas de 1980 e 1990 (CAMPOS, 2019).
No Brasil, as atividades de laboratório em análises clínicas estão interligadas ao Conselho Federal de Farmácia, Conselho Federal de Biologia, Conselho Federal de Química e ao Conselho Federal de Biomedicina, sendo biólogos, farmacêuticos, bioquímicos, médicos patologistas e biomédicos, parte do corpo de profissionais de um laboratório clínico (CONSELHO REGIONAL DE BIOMEDICINA, 2021).
Diante a necessidade de controlar e reduzir contaminações e falhas nas análises laboratoriais foram criadas leis e regulamentos definidos na Constituição Federal Brasileira, impostas pela Agência Nacional de Vigilância Sanitária (ANVISA), definidas por Resoluções da Diretoria Colegiada (RDC) que incluem a RDC nº 50/2002, a RDC nº 306/2004 e a RDC nº 302/2005 estabelecidos aos laboratórios para padronizar e garantir a segurança e o controle de qualidade dos resultados prestados (CHAVES, 2016).
Atualmente os laboratórios clínicos desempenham um papel importante, pois através dos exames laboratoriais são obtidos evidências para tomada de decisão clínica, no diagnóstico e prevenção de doenças. Para isso, é imprescindível que os resultados sejam confiáveis, precisos e controlados por um órgão de inspeção que garanta a qualidade do serviço prestado aos clientes, sejam médicos ou pacientes, a fim de garantir a sua satisfação (SILVA et al., 2020).
Desta forma, o controle de qualidade em laboratório clínico consiste na prática de auditoria interna e externa, para garantir resultados qualitativos e quantitativos completos e suntuosos, de forma fidedigna e consistente, assegurando um resultado sem nenhuma interferência de processo. A informação produzida deve possibilitar a determinação e a realização correta de diagnóstico, tratamento e prognóstico de patologias (PASQUINI, 2018).
Neste processo, a padronização e a realização do controle de qualidade nos laboratórios clínicos representam elementos imprescindíveis para a rotina laboratorial.
Como a avaliação da qualidade para demonstrar exatidão e validade por meio de ensaios de proficiência, um dos métodos mais conhecidos. Pois, a análise laboratorial bem executada agrega valor a assistência médica (DOS SANTOS et al., 2015).
Nesse contexto, o profissional biomédico pode atuar como responsável técnico no laboratório clínico, realizando os procedimentos de supervisão, controle de qualidade, liberação de laudos, ser responsável pela equipe técnica, garantir a confidencialidade das informações dos pacientes e ser encarregado pelos equipamentos, reagentes e insumos (UNILAB, 2017).
Portanto, a atuação do biomédico no controle de qualidade visa saber aplicar e validar controles, ferramentas e programas da qualidade, através de um gerenciamento estratégico, sendo uma competência essencial do biomédico para garantir a qualidade da realização dos exames, em todos os processos, fortalecendo as atribuições da profissão (CÂMARA, 2015).
Mediante este cenário de análise do controle de qualidade no laboratório clínico e sua aplicação, o estudo tem por justificativa promover a eficácia dos métodos de avaliação, tornar eminente a compreensão das regulamentações técnicas, e a necessidade da participação do biomédico como um agente importante na garantia de qualidade e segurança dos resultados das análises clínicas realizadas no ambiente laboratorial.
Sendo assim, o estudo se objetiva identificar os procedimentos do controle de qualidade no laboratório clínico.
2 METODOLOGIA
Trata-se de uma revisão da literatura, referente ao controle de qualidade no laboratório clínico. Para De Sousa et al. (2021) trata-se de um estudo exploratório, de natureza bibliográfica e pesquisa qualitativa, envolvendo uma revisão integrativa de publicações existentes, conforme as diretrizes disponíveis.
O levantamento dos dados fora baseado nas referências de sites, revistas, plataformas de universidades e livros acadêmicos, das bases de dados SCIELO (Biblioteca Eletrônica Scientific Eletronic Library Online), BVS (Biblioteca Virtual em
Saúde) e Google Acadêmico, partindo do uso dos termos: “métodos de avaliação”, “legislações” e “atuação do biomédico”; isolados e associados, em manuscritos que contemplam a faixa temporal dos anos de 2013 e 2023.
No critério de inclusão foram selecionados artigos, monografias, teses, livros e pesquisas catalogadas na integra de acesso livre, nas línguas portuguesa e inglesa, na faixa temporal delimitada, e que se relacionem ao tema da pesquisa. No critérios de exclusão, todos os estudos técnico-científicos com os objetivos não relacionados a temática, duplicados, em línguas estrangeiras diferentes das elencadas e em outras bases de busca, fora da faixa temporal do estudo foram desconsideradas.
A análise dos manuscritos terá como foco os objetivos, resumos e considerações finais relacionados ao tema in loco, para uma análise mais elaborada do estudo. Os artigos pesquisados foram classificados pelos assuntos para a leitura analítica dos respectivos objetivos para posterior desenvolvimento da pesquisa.
Após a análise de todas as publicações fora estabelecido por meio do fluxograma PRISMA (Figura 1), o processo de busca e seleção dos artigos desde o princípio, que resultou ao final em 20 publicações e 5 livros que compõem a parte textual deste estudo.
Figura 1. Fluxograma PRISMA para esta revisão da literatura.
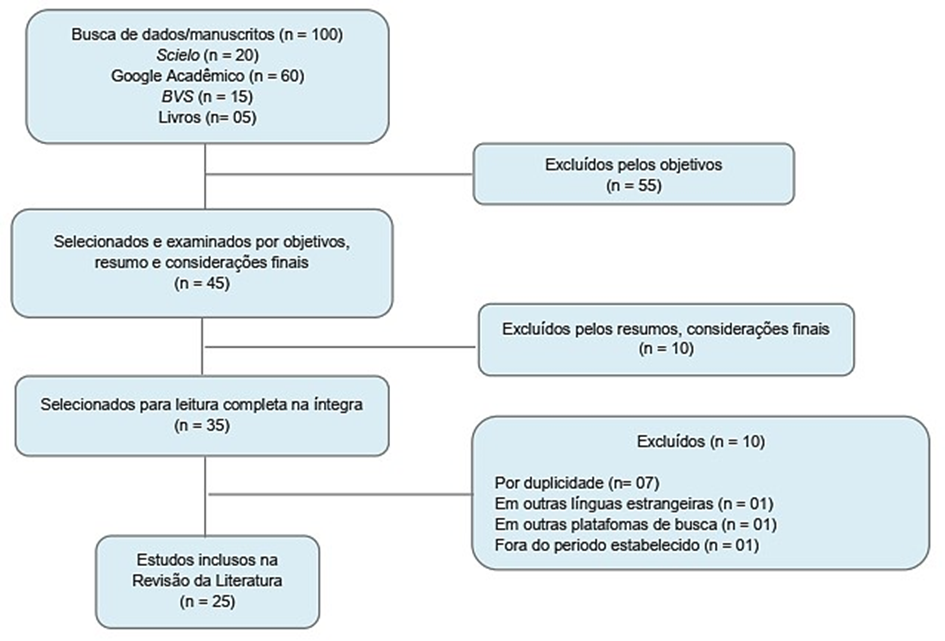
Fonte: Elaborado pelos Autores (2023).
3 RESULTADOS
Após a filtragem dos dados coletados e selecionadas as publicações, obtevese como resultados encontrados um quantitativo de 25 pesquisas, onde desenvolveuse um quadro com as singularidades dos principais achados que enfatizaram com maior exatidão sua correlação com o tema (Quadro 1).
Quadro 1 – Singularidades dos principais achados analisados.
AUTOR, ANO TÍTULO OBJETIVOS PRINCIPAIS RESULTADOS Dos Santos Nascimento et al., 2023. Controle de qualidade em laboratório de análises clínicas. Compreender a importância do controle de qualidade em laboratórios de análises clínicas, além de descrever as etapas do processo de controle de qualidade em laboratórios clínicos. Para instalação e organização eficiente de um programa de controle de qualidade, os procedimentos devem ser implementados e aprimorados, incluindo o treinamento técnico profissional contínuo, conscientização e comprometimento de cada profissional e equipe gerencial. Santos et al., 2020. Controle de qualidade no Laboratório de Análises Clínicas na Fase Analítica: A Segurança dos Resultados. Realizar um levantamento bibliográfico sobre a importância da implantação do controle de qualidade no laboratório clínico com ênfase na fase analítica, explicitando a finalidade de garantir a segurança dos resultados. A necessidade e importância da implementação de um sistema de controle de qualidade, visa melhorar os processos na fase analítica, por ser um processo delicado deve ser executado com os parâmetros, para implantá-lo com sucesso. Kaim et al., 2019. Ações de melhoria do sistema de gestão da qualidade do laboratório clínico escola de biomedicina. Identificar as práticas necessárias para melhoria do sistema de gestão da qualidade de acordo com as determinações da portaria nº 234/2009 do CEVS/RS e estabelecidas pelo Sistema Nacional de Acreditação (DICQ). A rotina laboratorial necessita de uma atualização de formulários de registros da qualidade, revisão dos procedimentos operacionais, elaboração do manual da qualidade, adequações quanto ao ambiente, distribuição de equipamentos, instrumentos e insumos no Laboratório Escola de Biomedicina Trevisan, 2017. Relato de experiência sobre as ações de regulação sanitária nos laboratórios clínicos em Palmas – TO. Dar importância das análises clínicas em Palmas, a Vigilância Sanitária Municipal iniciou em 2010 uma proposta de aprimoramento da atividade regulatória nestes estabelecimentos A cultura da capacitação e divulgação da necessidade de aprimoramentos e correções dos pontos de maior probabilidade de problemas sanitários e analíticos, tendo a Vigilância Sanitária é bem aceita como um setor de apoio e parceria. Da Graça Becker et al., 2016. A importância do controle de qualidade em laboratórios clínicos. Descrever a importância do controle de qualidade em laboratórios de análises clínicas. O biomédico pode contribuir no cumprimento das especificações contidas nos procedimentos de controle de qualidade pode minimizar, gradativamente, o aparecimento de erros, oriundos da atividade humana, por isso, a importância de se implantar um controle de qualidade nos laboratórios de análises clínicas.
Fonte: Elaborado pelos Autores (2023).
Nesta revisão da literatura foi verificado por meio dos principais achados analisados de Santos et al. (2020) e Kaim et al. (2019) que os métodos de controle da qualidade se constituem de um sistema dedicado, que tem o intuito de controlar e gerenciar processos executando parâmetros, atualizando formulários de registros, procedimentos operacionais, adequações de ambiente, instrumentos e insumos no contexto funcional do laboratório clínico.
De acordo com Trevisan (2017) e Dos Santos Nascimento et al. (2023) para a garantia do controle de qualidade em laboratórios de análises clínicas é imprescindível a aplicação e execução de regulamentos técnicos que visem os aprimoramentos e correções de problemas sanitários e analíticos, para que atuem em conformidade com a Vigilância Sanitária, por isso a precisão de treinamento técnico profissional contínuo, conscientização e comprometimento profissional e dos gestores laboratoriais.
Da Graça Becker et al. (2016) expõe que nesse contexto em executar e gerenciar procedimentos do controle de qualidade laboratorial, o biomédico pode atuar no cumprimento das especificações de qualidade, analisando requisitos de conformidade e não-conformidade minimizando o aparecimento de erros, muitas vezes causados pela atividade humana, e tem a capacidade de implantar programas de controle de qualidade nestes ambientes de análises clínicas.
Concomitante a tais dados, observa-se que o os procedimentos de controle de qualidade laboratorial podem ser concretizados pelo profissional biomédico, que em virtude de suas qualificações, pode exercer atribuições que resultarão em efeitos positivos como um todo sob as atividades laborais nestes ambientes.
4 DISCUSSÃO
4.1 Principais métodos de controle de qualidade laboratorial
Segundo Da Silva et al. (2015) os métodos de controle de qualidade consistem em ações tomadas para garantir que determinado serviço ou produto tenha o mínimo possível de defeitos, através da medição da qualidade, para diagnosticar se os requisitos são respeitados e se os objetivos da empresa são atingidos. No laboratório clinico, os métodos em visam a fidedignidade e acreditação de todos os processos laborais, divididos em controle interno e externo, desde a classificação dos materiais até ao processamento de laudos entregues aos pacientes.
Dias et al. (2017) explica que controle interno da qualidade laboratorial é um controle intralaboratorial que analisa de forma diária as amostra-controle com o objetivo de avaliar a precisão de ensaios realizados no laboratório clínico. Já controle externo da qualidade, visa demonstrar exatidão e verificar a validade de todo o sistema da qualidade, através dos ensaios por meios externos, através de uma avaliação dos dados obtidos a partir de análises de comparações de resultados entre um laboratório com outros.
Para Marques-Garcia et al. (2015) o controle de qualidade em análises clinicas é executado por meio de programas com sistema interno de planejamento de gestão, que fornece condições para que tal ação seja implementada e mantida para alcançar resultados satisfatórios, dentro das conformidades. Os procedimentos de controle de qualidade empregados nestes ambientes são: o desempenho dos procedimentos técnicos, verificação de reagentes, kits, meios de cultura, equipamentos e pessoal técnico; revisão de resultados e a documentação quanto à validade dos métodos adotados na rotina laboratorial, que deve ser feita periodicamente para procurações corretivas.
De acordo com Todd et al. (2014) o controle de qualidade laboratorial deve abranger também a veracidade da infraestrutura, da equipe técnica atuante e treinada, da qualidade dos reagentes, a segurança dos processos de limpeza dos instrumentos utilizados, se os processos de coleta e armazenamento de amostras estão em conformidades com as legislações técnicas vigentes, e se acontecem de forma periódica as manutenções de equipamentos. Estimulando essa conscientização além dos gestores para os funcionários.
4.2 Legislações de regulamento técnico para qualidade laboratorial
Segundo DICQ (2018) para assegurar à melhoria contínua em interpretações e evidências dos requisitos exigidos no funcionamento de laboratórios de análises clínicas, se faz necessário o cumprimento de normas, resoluções e requisitos de acreditação embasados em diretrizes Nacionais e Internacionais – ISO em conformidade com normas sanitárias, trabalhistas, ambientais e profissionais aplicáveis aos serviços de Laboratório Clínico.
Nesse contexto, Souza e Mendes (2019) apontam que no Brasil, existem normas específicas para acreditação laboratorial. No âmbito da ISO, a norma 15189:2012 que apresenta requisitos para qualidade e competência em laboratórios clínicos que têm sido incorporados a normas de acreditação. A norma 15189:2012 vem sendo utilizada de forma crescente em alguns países da Europa e outros continentes.
De acordo com Anvisa (2023) as resoluções nacionais sob as atividades nos laboratórios clinicos passam por constantes atualizações, que primam a melhoria destes serviços em virtude de atuarem na investigação e diagnóstico de patologias. Nisto, a recente RDC Nº 786/2023 determina o controle de qualidade como uma forma de monitoramento pela análise de amostras controle, de modo a acompanhar os resultados para definição da precisão e exatidão do processo analítico através do uso de controle interno da qualidade (CIQ) e controle externo da qualidade (CEQ).
Nesta perspectiva, Fleury (2019) esclarece que a importância do cumprimento dos requisitos estipulados em normas e resoluções vigentes no país, projetam reduzir a possibilidade de contaminação da amostra por fatores ambientais, evitar a contaminação das embalagens ou do seu transporte pela exposição a microrganismos infecciosos, o vazamento de emabalagens devido a danos ou embalagem inadequada, além de garantir integridade e estabilidade do material biológico transportado.
Desta forma, torna-se necessária a contribuição de um profissional responsável capacitado com conhecimento nos procedimentos de análises clínicas, como o biomédico para a execução destes processos.
4.3 Atuação do biomédico no controle de qualidade do laboratório clínico
É de conhecimento geral que o biomédico é o profissional capacitado e habilitado em diversas especialidades, com atuação em segmentos diversificados como a patologia clínica – análises clínicas, mas, devido à polivalência da profissão, pode atuar em diversos setores no serviço público do País (CRBM1).
Nesta esfera, o papel do biomédico na área de análises clinicas é de grande relevância por colaborar no controle de qualidade em todos os processos laboratoriais, assim como pode auditar desde que obtenha doutorado e especialização em auditoria, em conformidade com a gestão organizacional, como estabelece a resolução n. 184 do CFBM (TAKIZAWA e SLOB, 2020).
Dito isto, os profissionais biomédicos são profissionais-chave na área de análises clínicas devido à sua formação especializada, principalmente porque aliam a análise a procedimentos e tecnologias de ponta que estão frequentemente no mercado pararealizar diagnósticos preventivos, infecções e doenças, considerando a vida dos pacientes (IBECO, 2023).
Sendo assim, Da Costa et al. (2022) cita que o trabalhador da biomedicina atuante nesta área, influencia na promoção a saúde do paciente através de análises clínicas, pelo contato direto com materiais biológicos, para análise de dados clínicos e troca de informações com os pacientes e equipe multiprofissional. Em contrapartida, como esta especialidade profissional é recente no mercado de trabalho, entende-se que a inserção progressiva da biomedicina é o motivo pela falta de publicações a respeito, o que poderá mudar futuramente.
CONSIDERAÇÕES FINAIS
Considerando os estudos analisados na literatura, foi possível identificar que o controle de qualidade em laboratórios clínicos segue parâmetros e métodos com fins de melhoria em seus procedimentos, desde a anamnese, coleta, testes até a entrega de laudos aos pacientes. Para isso são empregados sistemas de controle de qualidade que passam por verificações de forma periódica.
Do ponto de vista técnico, observa-se que a verificação desde o ambiente laboratorial, a equipe técnica, ao uso dos reagentes, limpeza dos instrumentos, processos de coleta e armazenamento de amostras devem atender as legislações vigentes como a ANVISA, resoluções e normas, para garantir a veracidade dos resultados dispostos a população.
Pode ser constatado, que as legislações são fundamentais no regimento das atividades realizadas em análises clinicas, tanto no âmbito nacional como internacional, demonstrando assim que é obrigatório a sua implementação, assim como a integração de profissionais qualificados para tal exercício nestes departamentos.
Em síntese, os profissionais da biomedicina podem atuar neste segmento do diagnóstico laboratorial, visto que aliam a análise de materiais biológicos com tecnologias de ponta em diagnósticos preventivos e no tratamento de afecções patológicos, considerando um conhecimento humanizado em relação a vida dos pacientes enfermos.
É importante salientar, que se espera que este estudo seja fonte norteadora de pesquisas futuras, com compreendam percursos metodológicos, recortes temporais e evidências cientificas diversificadas, enfatizando a contribuição, participação e importância do biomédico nos procedimentos do controle de qualidade no laboratório clínico.
REFERÊNCIAS
ANVISA – AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Resolução da Diretoria Colegiada (RDC) nº 786 de 05 de maio de 2023. Dispõe sobre os requisitos técnico-sanitários para o funcionamento de Laboratórios Clínicos, de Laboratórios de Anatomia Patológica e de outros Serviços que executam as atividades relacionadas aos Exames de Análises Clínicas (EAC) e dá outras providências. Brasília, DF, 2023. Disponível em: < https://crbm1.gov.br/site2019/wpcontent/uploads/2023/05/RDC-No-786_2023.pdf >. Acesso em: 17 out. 2023.
CÂMARA, Bruno. Entrevista sobre Gestão da Qualidade com a biomédica Fabrícia Arruda, 2015. Disponível em: <https://www.biomedicinapadrao.
com.br/2015/08/entrevista-sobre-gestao-da-qualidade.html>. Acesso em: 08 set 2023.
CAMPOS, Maria Clara Garcia. Biossegurança e Risco Ocupacional: Uma análise da legislação e sua aplicação na atividade do biomédico em laboratório de análises clínicas. 45f. Trabalho de Conclusão, Curso de Biomedicina, Faculdade de Iguatama, Iguatama – MG, 2019.
CRBM1 (Conselho Regional de Biomedicina – 1ª Região). Manual do biomédico. 2021. Disponível em: <https://crbm1.gov.br/site2019/wp-content/uploads/2021/06/ Manual_do_Biomedico_2021_V4.pdf>. Acesso em: 16 out. 2023.
CHAVES, Márcio José Figueira. Manual de Biossegurança e Boas Práticas Laboratoriais v.2.0. 2016. Disponível em: < https://genetica.incor.usp.br/wpcontent/uploads/2014/12/Manual-de-biosseguran%C3%A7a-e-BoasPr%C3%A1ticas-Laboratoriais1.pdf>. Acesso em: 09 set 2023.
CONSELHO REGIONAL DE BIOMEDICINA. Manual do biomédico. 1ª Edição
Digital, 2021. Disponível em: < https://crbm1.gov.br/site2019/wp-content/ uploads/2021/06/Manual_do_Biomedico_2021_V4.pdf>. Acesso em: 09 set 2023.
DA COSTA, Vanessa Gomes; BELO, Mariana Soares da Silva Peixoto; DAS NEVES GAMARRA, Tatiana Pereira. Produção científica sobre profissional biomédico e promoção da saúde: uma revisão de escopo. Research, Society and Development, v. 11, n. 3, p. e44811326598-e44811326598, 2022.
DA GRAÇA BECKER, Maria; SELOW, Marcela Lima Cardoso; TONIOLO, Rucieli Maria Moreira. A importância do controle de qualidade em laboratórios clínicos. Revista Dom Acadêmico, v. 1, n. 1, 2016.
DA SILVA, Paulo Henrique et al. Hematologia laboratorial: teoria e procedimentos. Artmed Editora, 2015.
DE SOUSA, Angélica Silva; DE OLIVEIRA, Guilherme Saramago; ALVES, Laís Hilário. A pesquisa bibliográfica: princípios e fundamentos. Cadernos da FUCAMP, v. 20, n. 43, 2021.
DIAS, Valter Soares; BARQUETTE, F. R. D. S.; BELLO, Alexandre Ribeiro. Padronização da qualidade: alinhando melhorias contínuas nos laboratórios de análises clínicas. RBAC, v. 49, n. 2, p. 164-9, 2017.
DICQ. Manual para Acreditação do Sistema de Gestão da Qualidade de Laboratórios Clínicos: Sistema nacional de Acreditação DICQ. 7° ed, 2018. Disponível em: < https://acreditacao.org.br/wp-content/uploads/2021/04/manual-dicq7aedicao2.pdf >. Acesso em: 17 out. 2023.
DOS SANTOS, Adriano Palhari; JUNIOR, Gerson Zanusso. Controle de qualidade em laboratórios clínicos. Revista Uningá, v. 45, n. 1, 2015.
DOS SANTOS NASCIMENTO, Fernanda; DE SANTANA CERQUEIRA, Layanna Rebouças; DOS SANTOS SILVA, Manassés. Controle de qualidade em laboratório de análises clínicas. Revista Perspectiva, v. 47, n. 177, p. 119-129, 2023.
FLEURY, Marcos Kneip. Manual de Coleta em Laboratório Clínico. 3ª Edição, PNCQ – Programa Nacional de Controle de Qualidade, 2019.
IBECO. Qual a importância de um biomédico em análises clínicas e toxicológicas?. 2023. Disponível em: <https://ibeco.com.br/qual-importancia-deum-biomedico-em-analises-clinicas-e-toxicologicas/>. Acesso em: 17 out. 2023.
KAIM, Maiara; FISCHER, Vanusa Braz; COMPARSI, Bruna. Ações de melhoria do
sistema de gestão da qualidade do laboratório clínico escola de biomedicina. Revista saúde integrada, v. 12, n. 24, p. 108-125, 2019.
PASQUINI, Nilton César. Implantação de sistema de qualidade (PALC) em laboratório clínico: um estudo de caso. Revista Tecnológica da Fatec Americana, vol. 06 n. 1, 2018.
MARQUES-GARCIA, F. et al. Importance of implementing an analytical quality control system in a core laboratory. Revista de Calidad Asistencial, v. 30, n. 6, p. 302-309, 2015.
SANTOS, Christiane Samara Souza et al. Controle de qualidade no Laboratório de Análises Clínicas na Fase Analítica: A Segurança dos Resultados. Brazilian Journal of health Review, v. 3, n. 4, p. 8512-8523, 2020.
SILVA, João Paulo Bastos. Avaliação do impacto de laboratórios de análises clínicas de hospitais de urgência e emergência do município de Belém-PA na saúde. Revista de Ciências Farmacêuticas Básica e Aplicada, vol 35, n. 1.2020.
SOUSA, Paulo; MENDES, Walter (Ed.). Segurança do paciente: conhecendo os riscos nas organizações de saúde. SciELO-Editora FIOCRUZ, 2019.
TAKIZAWA, Jully Oyama; SLOB, Edna Márcia Grahl Brandalize. Importância da atuação do Biomédico na equipe multiprofissional de auditoria em saúde. Saúde e Desenvolvimento, v. 9, n. 17, 2020.
TODD, Christopher A. et al. Implementation of Good Clinical Laboratory Practice (GCLP) guidelines within the external quality assurance program oversight laboratory (EQAPOL). Journal of immunological methods, v. 409, p. 91-98, 2014.
TREVISAN, Márcio. Relato de experiência sobre as ações de regulação sanitária nos laboratórios clínicos em Palmas-TO. Vigilância Sanitária em Debate: Sociedade, Ciência & Tecnologia, v. 5, n. 3, p. 123-129, 2017.
UNILAB. Acreditação Laboratorial: o que é e como se preparar. 2017. Disponível em: <https:www.unilab.com.br/materiais educativos/artigos/ acreditação-laboratorialo-que-e-e-como-se-preparar/. Acesso em: 08 set 2023.
[1] Graduando do curso de Biomedicina. E-mail: azamor.vianaa@gmail.com
[2] Graduando do curso de Biomedicina. E-mail: ivis.dawson.oliveira@gmail.com
[3] Profa. Esp. Orientadora do curso de Biomedicina. E-mail: bruna.avelino@uniniltonlins.edu.br
