EXTRACTION OF EUPHORBIA TIRUCALLI LINNAU AND EVALUATION OF ITS ANTIFUNGAL AND ANTIBACTERIAL ACTIVITY
REGISTRO DOI: 10.5281/zenodo.10203583
Wallace Ferreira de Lima¹
Juliano Henrique Gati²
Araceli Scalcon³
Juliana Pagnonceli4
RESUMO
Este estudo aborda a planta Euphorbia tirucalli L pertencente à família Euphorbiaceae, é amplamente distribuída no mundo, com diversas espécies encontradas no Brasil. O gênero Euphorbia possui cerca de 2.000 espécies e apresenta diferentes formas e características morfológicas. Euphorbia tirucalli L. possui um látex branco leitoso em seu interior, que pode ser irritante e tóxico se ingerido. A composição química do látex inclui ésteres, taninos hidrolisáveis, polifenóis, flavonoides e outros compostos. Diversas propriedades terapêuticas são atribuídas à Euphorbia tirucalli L, incluindo analgesia, ação anti-inflamatória, estimulação do sistema imunológico, tratamento de câncer, entre outros. Estudos científicos demonstraram que o extrato da planta possui atividade antimicrobiana contra uma variedade de bactérias gram-negativas e gram-positivas, assim como contra o fungo Candida albicans. Alguns dos principais microrganismos identificados e abordados são Staphylococcus aureus, Klebsiella pneumoniae (KPC), Escherichia coli e Pseudomonas aeruginosa. A atividade antimicrobiana da Avelós contra esses microrganismos pode sugerir seu potencial como agente terapêutico. O objetivo deste estudo foi determinar a atividade antimicrobiana in vitro dos extratos vegetais dos ramos e látex da planta Avelós (Euphorbia tirucalli L) em cepas de microrganismos. Pode-se observa no estudo que o extrato seco concentrado a 10% e o extrato fresco tiveram boa inibição frente as bactérias Staphylococcus aureus, Pseudomonas aeruginosa e Escherichia coli. Podendo assim concluirmos que os ensaios antibacterianos indicaram potencial de ação do extrato etanólico de avelós
Palavras-Chave: Medicinal, Antibiograma, Extração
ABSTRACT
This study deals with the plant Euphorbia tirucalli L, which belongs to the Euphorbiaceae family and is widely distributed throughout the world, with several species found in Brazil. The genus Euphorbia has around 2,000 species and different morphological forms and characteristics. Euphorbia tirucalli L. has a milky white latex inside, which can be irritating and toxic if ingested. The chemical composition of the latex includes esters, hydrolysable tannins, polyphenols, flavonoids and other compounds. Various therapeutic properties are attributed to Euphorbia tirucalli L, including analgesia, anti-inflammatory action, stimulation of the immune system, cancer treatment, among others. Scientific studies have shown that the plant’s extract has antimicrobial activity against a variety of gram-negative and gram-positive bacteria, as well as the fungus Candida albicans. Some of the main microorganisms identified and discussed are Staphylococcus aureus, Klebsiella pneumoniae (KPC), Escherichia coli and Pseudomonas aeruginosa. The antimicrobial activity of hazelnut against these microorganisms may suggest its potential as a therapeutic agent. The aim of this study was to determine the in vitro antimicrobial activity of plant extracts from the branches and latex of the hazelnut plant (Euphorbia tirucalli L) on strains of microorganisms. The study showed that the 10% concentrated dry extract and the fresh extract had good inhibition against the bacteria Staphylococcus aureus, Pseudomonas aeruginosa and Escherichia coli. We can therefore conclude that the antibacterial tests indicated the potential action of the ethanolic extract of hazelnuts.
Keywords: Medicinal, Antibiogram, Extraction
1. INTRODUÇÃO
A busca por substâncias ativas provenientes de plantas desperta grande interesse devido à diversidade de compostos que podem ter propriedades antimicrobianas (CLEFF, 2008). Além disso, devido à problemática atual da resistência à terapia antimicrobiana, muitos estudos estão sendo realizados para encontrar novas moléculas ou opções terapêuticas que possam substituir ou complementar os tratamentos existentes (GIORDANI, 2013). Dentre as pesquisas conhecidas, destacam-se aquelas que buscam descobrir substâncias biológicas presentes em extratos de plantas medicinais, com propósitos profiláticos e curativos em infecções bacterianas (CLEFF, 2008). Vale ressaltar que o conhecimento tradicional e popular também serve como guia para pesquisas farmacológicas nessa área (MICHELIN et al., 2005).
A resistência das bactérias aos antimicrobianos é uma preocupação tanto na área médica quanto veterinária, devido ao uso inadequado e excessivo de antibióticos. Isso é um dos principais fatores que contribuem para a seleção de microrganismos resistentes, que estão se espalhando globalmente, tornando-se um problema para a saúde animal e humana (CALDAS, et al., 2022).
Na literatura, em várias culturas, é mencionado o amplo uso do avelós com propósitos medicinais, sendo reconhecido como um remédio popular valioso, com diversas propriedades terapêuticas (ORLANDA e VALE, 2015). Também tem sido estudada a atividade antimicrobiana do extrato vegetal de E. tirucalli L. frente a bactérias gram-negativas, incluindo Pseudomonas aeruginosa, Klebsiella sp, Proteus mirabilis e Shigela dysenteriae. e bactérias gram-positivas, como Bacillus subtilis, Staphylococcus aureus e Micrococcuus sp., bem como contra Candida albicans (Ibrahim et al. 2018). Estes estudos sugerem a presença de compostos antibióticos de amplo espectro na planta, conferindo-lhe propriedades antibacterianas e antifúngicas.
Neste sentido, o objetivo deste trabalho foi determinar a atividade antimicrobiana in vitro dos extratos vegetais da planta Avelós (Euphorbia tirucalli L) em cepas de microrganismos como: Candida albicans (ATCC 10231), Klebsiella pneumoniae (ATCC 10031), Staphylococcus aureus (ATCC 6538), Pseudomonas aeruginosa (ATCC 9027), Escherichia coli (ATCC 8739), isolados e identificados, que estão disponíveis para estudos no laboratório de biologia da associação de ensino, pesquisa e extensão BIOPARK.
2. Materiais e Métodos
A metodologia a ser utilizada no trabalho foi dividida em três etapas: obtenção do extrato, testes da atividade antifúngica e antibacteriana e incorporação em uma formulação, conforme mostra o fluxograma da Figura 1.
Figura 1- Fluxograma do processo de extração dos compostos do caule e látex da Avelós
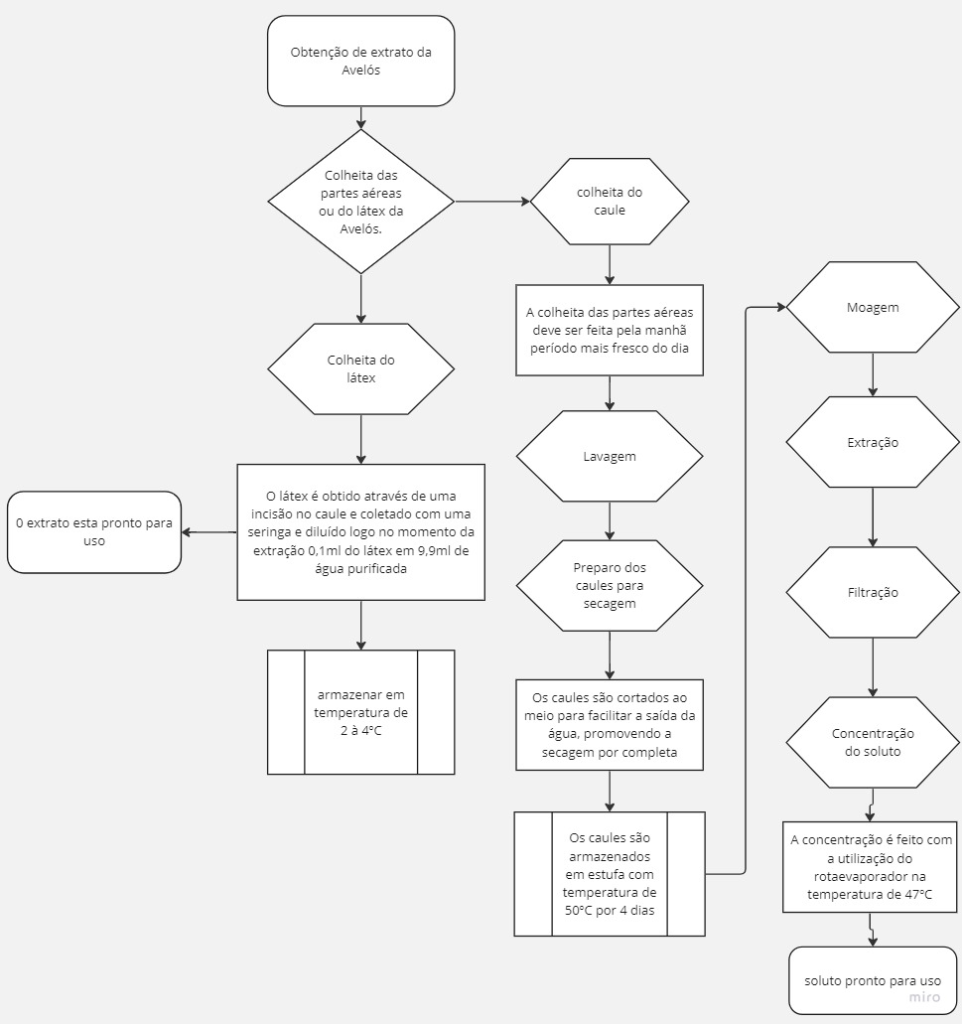
Fonte: o autor 2023
2.1. OBTENÇÃO DO EXTRATO
A planta Avelós usada neste estudo foi cultivada no viveiro de mudas da instituição de ensino BIOPARK Educação em Toledo, um município brasileiro localizado na região oeste do Paraná. Foi introduzido no viveiro com o propósito de realizar esta pesquisa. Para caracterizar a planta, utiliza-se o aplicativo “Picture This identificar Planta”.
A colheita ocorreu às 08h00 da manhã. Usando um alicate de poda, os ramos maiores foram retirados, seguidos pelos menores, resultando em menor fração da planta. Esses ramos foram então colocados em uma bacia e transportados para o laboratório de química 2, foram lavados com água potável para remover as sujidades como poeira, e os ramos foram classificados, eliminando aqueles que estavam infestados por pragas.
Os ramos da Avelós foram cortados ao meio, colocados em uma estufa de fluxo de ar, na temperatura de 50 ºC ao longo de três dias, teve uma perda de umidade de 5,43%, na análise de umidade realizada após a moagem teve um resultado de 10,55% de umidade. A moagem foi realizada em um moinho de facas (SOLAB SL-31), utilizamos o tamis de 1,50 mm. o extrato da planta foi armazenado em saco plástico em temperatura ambiente até a etapa de extração.
A extração teve a utilização do álcool etílico 90% como solvente extrator, que ficou em contato com estrato por 7 dias, utilizou-se 100 ml do solvente para 10g da planta, em seguida teve início a filtração, feito com a utilização do funil de Buchner, Kitassato e bomba de vácuo. A formação de vácuo abaixo do filtro de papel, suga assim a parte líquida para o kitassato e a parte sólida ficando retida no funil de Buchner, para formação de vácuo utiliza-se a bomba (QUIMIS 30 LPM 40 PSI). Logo o extrato passou a ser concentrado através da técnica de roto evaporação por pressão reduzida, o equipamento para essa atividade é o Evaporador Rotativo (FISATOM 803), com os parâmetros de rotação do balão em 50 RPM na temperatura de 47ºC, o processo durou 4 horas, o extrato foi armazenado na geladeira na temperatura de 4ºC, até a utilização na microbiologia.
Outro teste realizado foi com planta verde (sem passar pelo processo de secagem) os ramos foram triturados no liquidificador (60 g da planta) junto com álcool etílico a 99,8% (140 ml) e armazenado em um béquer por 24 horas, no dia seguinte foi filtrado e a parte retida no filtro foi colocado novamente em 140 ml de álcool por mais 24 horas de extração. Os extratos foram concentrados no rota-evaporador, e armazenados na temperatura de 4ºC, para posteriores testes na microbiologia.
A extração do látex é feita através de cortes no caule da Avelós, aspirado as gotículas de látex que se formar quando são feitos os cortes, com o auxílio de uma seringa já contendo 9 ml de água purificada, foi aspirado 1 ml de látex.
2.2. AVALIAÇÃO DA ATIVIDADE ANTIMICROBIANA
2.2.1. Inóculo Bacteriano
Para a análise antimicrobiana usaremos cepas de Candida albicans (ATCC 10231), Klebsiella pneumoniae (ATCC 10031), Staphylococcus aureus (ATCC 6538), Pseudomonas aeruginosa (ATCC 9027), Escherichia coli (ATCC 8739) presentes no Laboratório de Microbiologia da Faculdade Biopark. Os microrganismos foram reativados a partir de suas culturas originais e mantidos no meio líquido BHI (Brain Heart Infusion), em estufa a 35 °C por 24 horas. Em seguida os microrganismos foram cultivados em placas de petri com cerca de 25 ml de Ágar Sabouraud Dextrose (fungos) e Ágar Mueller Hinton (bactérias).
2.2.2. Atividade antifúngica e antimicrobiana
Os microrganismos foram diluídos em solução salina estéril 0,9% (10ml) e comparados com a turvação da escala 0,5 da escala Mcfarland. Em seguida. Adicionou-se 100 μL de cada solução, seguindo os padrões de turbidez, na superfície das placas de Petri contendo ágar Mueller Hinton para as bactérias e ágar Sabouraud para fungos. A semeadura foi realizada utilizando uma alça de Drigalsky em quatro direções: horizontal, vertical, diagonal e circular, com o objetivo de evitar o crescimento de colônias isoladas (Wayne, 2002).
As placas ficaram mantidas entreabertas na Cabine de Segurança Biológica por até 5 minutos, permitindo a absorção/evaporação do excesso de umidade (Wayne, 2002). Para determinar a concentração mínima Inibitória (CIM) dos extratos etanólicos, utilizou-se método de difusão em disco. Foi aplicado 10 μL dos extratos etanólicos da Euphorbia tirucalli L. do látex e da parte aérea – P.A. em diferentes concentrações nos discos 6mm de diâmetro brancos esterilizados. Em seguida, os discos foram colocados sobre o meio de cultura (Mueller Hinton e Sabouraud) previamente inoculado com a carga microbiana e fúngica (Chattopadhyay et al., 2002; Karaman et al., 2003).
Como controle positivo, para verificação da ação antimicrobiana e antifúngica, utilizou-se discos com 6mm de diâmetro contendo antibióticos, ciprofloxacino (CIP), Levofloxacino (LEV), Ceftazidima (CAZ), Vancomicina (VAN), Norfloxacina (NOR), Cefoxitina (CFO), Oxacilina (OXA), Nitrofurantoína (NIT) e Meropenem (MPM) para bactérias e Nistatina (NY) para fungo, enquanto o controle negativo consistiu no uso de discos com 6mm de diâmetro embebidos em álcool etílico a 99,8%, aplicados com a mesma proporção dos extratos em discos com 6mm de diâmetro brancos (10μL). Após deixar secar os discos para evaporação do solvente, as placas foram incubadas a 37 °C em estufa bacteriológica por 24 horas para as bactérias e 48 horas para os fungos. Os testes foram realizados em triplicata e os resultados serão expressos em milímetros (mm), calculando-se a média aritmética do diâmetro dos halos de inibição formados ao redor dos discos nas repetições. Para a medição dos halos, utilizou-se um paquímetro.
A interpretação dos resultados foi realizada comparando os diâmetros das zonas de inibição obtidos com os valores de referência para cada microrganismo e antibiótico/fármaco antifúngico. Os valores de sensibilidade ou resistência serão determinados com base em critérios estabelecidos, como os fornecidos pelo Clinical and Laboratory Standards Institute (CLSI).
3. Resultados e Discussão
Os resultados dos testes antibiograma são apresentados na Tabela 1. Pode-se observar que os resultados de controle positivo dos antibióticos e antifúngicos foram eficazes, todos tiveram efeitos de inibição frente aos microrganismos testados.
Tabela 1. Atividade dos antibióticos e antifúngico utilizados como controle frente aos microrganismos.
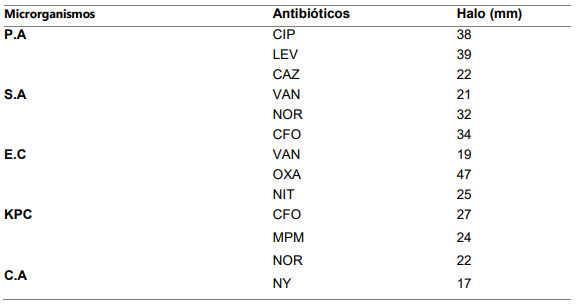
Fonte: autor (2023).
TABELA 2. Atividade dos extratos da planta frente aos microrganismos testados.
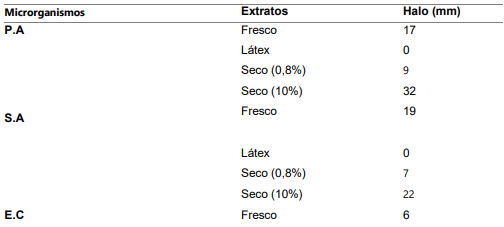
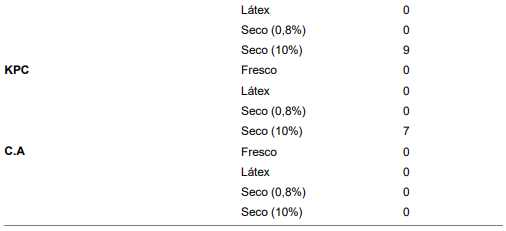
Fonte: autor (2023).
Os resultados na Tabela 2 mostraram que o extrato seco concentrado a 10% teve atividade antimicrobiana contra todas as bactérias testadas. O halo de inibição mais amplo foi observado para Pseudomonas aeruginosa, com 32,0 mm de diâmetro. Para S. aureus, KPC e E.coli, os halos de inibição foram de 22,0mm, 5,00 mm e 7,00 mm, respectivamente. No entanto, os extratos da planta não foram ativos contra C. albicans. Também para o Látex não houve inibição para nenhum microrganismo testado.
Um estudo realizado por Betim et al (2017) avaliou a atividade antimicrobiana de extratos etanolicos de avelós frente aos microrganismos Staphylococcus aureus, Shigella flexneri e Enteroccocus faecalis. Os resultados mostraram que os extratos apresentaram halos de inibição de 18,2 mm, 21,2 mm e 17,0 mm, respectivamente. Esses resultados corroboram com outros estudos que demonstraram a eficácia dos extratos de avelós contra um amplo espectro de microrganismos.
Outro estudo realizado em 2011 por Vale e Orlanda avaliou a atividade antibacteriana do extrato alcoólico de avelós fresco e seco. O estudo foi realizado com uma concentração de 0,09 mg/mL e com as seguintes bactérias patogênicas: Escherichia coli, Pseudomonas aeruginosa, Salmonella typhi, Staphylococcus aureus, Vibrio parahaemolyticus, Citrobacter freundii e Serratia odorífera.
Os resultados do estudo mostraram que o extrato alcoólico de avelós fresco inibiu o crescimento de todas as bactérias testadas, com halos de inibição variando de 7,00 mm a 19,00 mm. Já o extrato alcoólico de avelós seco inibiu o crescimento apenas de três bactérias: Pseudomonas aeruginosa, Salmonella typhi e Vibrio parahaemolyticus, com halos de inibição variando de 6,00 mm a 14,00 mm.
Estes estudos corroboram, mostrando que os extratos de avelós apresentam atividade antibacteriana contra um amplo espectro de microrganismos. No entanto, os resultados também mostram que a atividade antimicrobiana dos extratos pode variar de acordo com o método de extração, a concentração do extrato e o tipo de microrganismo. Tendo como melhor resultado neste trabalho o extrato seco (10%).
A atividade antimicrobiana dos extratos de avelós pode ser atribuída à presença de diversos compostos bioativos, incluindo saponinas, flavonóides, taninos e esteróides, conforme já mencionados no trabalho. Esses compostos podem atuar de diferentes maneiras para inibir o crescimento bacteriano, incluindo a inibição da síntese da parede celular, da membrana celular, da síntese de proteínas e do DNA (MACHADO 2007).
4. Conclusão
Pode-se concluir que os resultados deste estudo da atividade antimicrobiana, indicaram potencial de ação do extrato etanólico de avelós fresco e seco concentrado a 10% desse modo, ficou demonstrado que os extratos apresentaram potencial antibacteriano sobre o crescimento de Escherichia coli, Staphylococcus aureus e Pseudomonas aeruginosa.
O estudo sugere que compostos presentes na planta E. tirucalli podem ser usados para desenvolver novos medicamentos antimicrobianos. No entanto, são necessários mais estudos para entender como esses compostos funcionam e para avaliar sua segurança a longo prazo. Isso é importante porque a planta E. tirucalli é considerada tóxica.
5. REFERÊNCIAS
ALVES, E. M.; NEPOMUCENO, J. C. Avaliação do efeito carcinogênico do látex do avelós (Euphorbia tirucalli), por meio do teste para detecção de clones de tumor (warts) em Drosophila melanogaster. 2012; Perquirere. 9(2):125-40.
ARAÚJO, K. M. Identificação de compostos fenólicos presentes em extratos de euphorbia tirucalli l., e avaliação de sua atividade antioxidante e antibacteriana (Dissertação de mestrado). Parnaíba. Universidade Federal do Piauí. programa de pós-graduação em Biotecnologia. 2013
ARGENTA, S. C.; ARGENTA, L. C.; GIACOMELLI, S. R.; CEZAROTTO, V. S. Plantas Medicinais: Cultura Popular Versus Ciência Medicinal. Vivências: Revista Eletrônica de Extensão da URI, 2011.
AVELAR, B. A. Detecção in vitro de citocinas intracitoplasmáticas (interferon gama, fator de necrose tumoral, interleucina 4 e interleucina 10) em leucócitos humanos tratados com extrato bruto diluído de Euphorbia tirucalli. Dissertação (Mestrado). Programa Multicêntrico em Ciências Fisiológicas da Universidade Federal dos Vales do Jequitinhonha e Mucuri. Diamantina, 2010.
BETIM, F. C. M.; SOUZA, S. W.; BERGAMO, R. A. M.; DIAS, J. F. G. Estudo fitoquímico de Euphorbia tirucalli L. (avelós), atividade antimicrobiana e ensaios toxicológicos preliminares in vitro. Universidade Tuiuti do Paraná, Curitiba, PR, Brasil, (2017).
BESSA, O. G. Avaliação da atividade angiogênica e do potencial de cicatrização do látex da Euphorbia Tirucalli (Avelóz). 2010. 50p. Dissertação de mestrado – Pontifícia Universidade Católica de Goiás, Goiânia, 2010.
CALDAS, A. F.; OLIVEIRA, C. S.; SILVA. D. P.Resistência bacteriana decorrente do uso indiscriminado de antibióticos. Scire Salutis, v.12, n.1, p.1-7, 2022. DOI: http://doi.org/10.6008/CBPC2236- 9600.2022.001.0001. acessado em 22 de maio de 2023.
CHATTOPADHYAY, D.l. Antimicrobial and anti-inflammatory activity of folklore: Mallotus peltatus leaf extract. Journal of Ethnopharmacology, v. 82, n. 2-3, p. 229-237, 2002.
CLEFF, M. B. Avaliação da atividade antifúngica do óleo essencial de Origanum Vulgare L. frente a fungos de importância em veterinária com ênfase em candida spp. 2008.
DUTRA, R. C.; CLAUDINO, R.F.; BENTO, A.F.; MARCON, R.; SCHMIDT, E.C.; BOUZON, Z.L.; PIANOWSKI, L.F.; CALIXTO, J.B. Preventive and therapeutic euphol treatment attenuates experimental colitis in mice. 2011; PLos One, v.6 , n.11, p.1-15.
GIORDANI, C. Investigação de plantas medicinais e tóxicas em Pelotas-RS e determinação da atividade antifúngica frente a Malassezia pachydermatis. 2013.
HOLLAND, T. L.; ARNOLD, C.; FOWLER, J. V. G. Clinical Management of Staphylococcus aureus Bacteremia. A Review. JAMA 313(13): 1330-1341; 2014.
IBRAHIM, E.; KILANY, M.; MOSTAFA, O. M. S.; SHAKER, K. H.; ALSHEHRI, M.; M. ALSYAAD, K. M.; ALSHEHRI, A.; ALIKHAN, K.; NAHLAKOTB, M. Q. A.; GHRAMH, A. S. A. H.; DAJEM, S. M. TH1/TH2 chemokines/cytokines profile in rats treated with tetanus toxoid and Euphorbia tirucalli. Saudi Journal of Biological Sciences, Riyadh, In press, ago. 2018.
KARAMAN, I. Antimicrobial activity of aqueous and methanol extracts of Juniperus oxycedrus L. Journal of ethnopharmacology, v. 85, n. 2-3, p. 231-235, 2003.
LORENZI, H.; MATOS, F. J. A. Plantas medicinais no Brasil: nativas e exóticas. São Paulo, Plantarum, 2002. 560p.
LUCENA M. F. A.; ALVES M. Notas taxonômicas para Euphorbiaceae sl do Nordeste do Brasil. Hoehnea. 2010: 37, 71-85.
MACHADO, M,M. Perfil fitoquímico e avaliação dos principais efeitos biológicos e Imunológicos In Vitro da Euphorbia tirucalli L. (Dissertação de mestrado), Santa Maria, Programa de pós-graduação em ciências Farmacêuticas. Universidade Federal de Santa Maria, RS, Brasil, 2007.
MALI, P. Y.; PANCHAL, S. S. Euphorbia tirucalli L: review on morphology, medicinal uses, phytochemistry and pharmacological actives. Asian Pacific Journal of Tropical Biomedicine, Haikou, v. 7, n. 7, p. 603-613, jul. 2017.
MARLIÉRE, L. D. P.; RIBEIRO, A. Q.; BRANDÃO, M. G. L.; KLEIN, C. H.; ACURCIO, F. A. Utilização de fitoterápicos por idosos: resultados de um inquérito domiciliar em Belo Horizonte(MG), Brasil. Revista Brasileira de Farmacognosia. 2008; 18:754-60.
MARTINS, A. M. Avaliação das atividades citotóxica e antifúngica dos extratos orgânicos de Euphorbia tirucalli Linn. (aveloz)Recife: o autor, 2018.
MELO-REIS, P. R.; BEZERRA, L. S. A.; VALE, M. M. A.; CANHÊTE, R. F. R.; CHENCHEN, L. Avaliação da atividade mutagênica e antimutagênica do látex 62 de Synadenium umbellatum Pax pelo teste do micronúcleo em camundongos. Brazilian Journal of Biology, v. 71, n. 1, 2011.
OLIVEIRA, F. Fundamentos de farmacobotânica e de morfologia vegetal 3ª ed.Gokithi Akisue. São Paulo: Editora Atheneu, 2009.
OLIVEIRA, R. A. Avaliação da atividade genotoxica e antigenotoxica de Euphorbia tirucalli (Aveloz)[ manuscrito]/ Rodrigo Ansaloni de Oliveira. — 2017.
ORLANDA, J. F. F.; VALE, V. V. Análise fitoquímica e atividade fotoprotetora de extrato etanólico de Euphorbia tirucalli Linneau (Euphorbiaceae). 2015; Rev. bras. plantas med. v.17, p.730-736.
PALMIERI, R. R.; VARRICCHIO, M. C. B. N.; CAXITO, M. L. Ação Citotóxica e moduladora do extrato e do látex de Euphorbia Tirucalli L. (Avelóz) em células de melanoma. In. XXVII Jornada Giulio Massarani de Iniciação Científica, Artística e Cultural. UFRJ, Rio de Janeiro, 2005.
PETER, C. M.; PICOLI, T.; PERES, A. F.; CZERMAINSKI, L. A.; RIPOLL, M. K.; BRAGATO, M. S.; ZANI, J. L. Caracterização e sensibilidade de cepas de escherichia coli isoladas do leite proveniente de tanques resfriadores de pequenas propriedades do município de canguçu – RS. Science and Animal health-UFPEL. v.4 n.3 set/dez p. 310-322, 2016.
SANTOS, W. B.; ARAUJO, M. G. S.; SILVA, J. C.; BERNARDO, T. H. L.; BASTOS, M. L. A.; VERÍSSIMO, R. C. S. S. Microbiota infectante de feridas cirúrgicas: análise da produção científica nacional e internacional. Rev. Sobecc, São Paulo. Jan./mar: 46-51, 2016.
SECCO R. S. Flora da Reserva Ducke, AM, Brasil: Euphorbiaceae-Parte-I Rodriguésia, 2005; Revista do Jardim Botânico do RJ. 56(86):143-168 SELEEM D, PARDI V, MURATA RM.Review of flavonoids: A diverse group of natural compounds with anti-Candida albicans activity in vitro. 2017; Arch Oral Biol. Apr;76:76-83.
SIMÕES, C. M. O.; SCHENKEL, E. P.; MELLO, J. C. P.; MENTZ, L. A.; PETROVICH, P. R. Farmacognosia do produto natural ao medicamento, Porto Alegre,Artmed, 2017.
TOMAZZONE M. I.; NEGRELLE R. R. B.; CENTA M. L. Fitoterapia popular: a busca instrumental enquanto prática terapêutica. Texto Contexto enfermagem 2006.
TORRA J.E.B. Abordagem da carga bacteriana e da infecção nas feridas crônicas. En: Soldevilla, J.J, Torra, J.E (Eds). Atenção Integral nos Cuidados das Feridas Crônicas. Petrópolis,RJ, pg.121-158. EPUB, 2012.
TURNER, K. H.; TRIVEDI, U.; RUMBAUGH, K. P.; WHITELEY, M. Requirements for Pseudomonas aeruginosa acute burn and chronic surgical wound infection. PLoS Genet, v.10, n.7, 2014. Disponível em: < https://journals.plos.org/plosgenetics/article?id=10.1371/journal.pgen.1004518>. Acesso em: 25. maio. 2023.
VALE, V. V.; ORLANDA, J. F. F. Atividade antimicrobiana do extrato bruto etanólico das partes aéreas de Euphorbia tirucalli Linneau (Euphorbiaceae). Scientia Plena, 2011; v. 7, p. 1-6.
VARRICCHIO, M. C. B. N. Estudos integrados: Biotecnológia, toxicologia, Matabólitos Especiais e Ativividade antitumoral de Euphorbia tirucalli L” Disertação – Programa de pós Graduação em Biotecnologia vegetal, Universidade Federal do Rio de Janeiro. 2008.
VIEIRA, A. J. H.; SANTOS, J. I. Mecanismos de resistência de Candida albicans aos antifúngicos anfotericina B, fluconazol e caspofungina. Revista Brasileira de Analises Clinicas-RBAC.v9, 2016.
WACZUK, E. P.; PEREIRA, K. B.; MACHADO, M. M.; Oliveira, L. F. S. Aspectos etnobotânicos, fitoquímicos, toxicológicos e farmacológicos da Euphorbia Tirucalli L.: DOS RISCOS ÀS POSSIBILIDADES Euphorbia tirucalli L.: Dos riscos às possibilidades. 2012.; Acta ambiental catarinense v.9. (n. 1/2).
WAYNE, P. A. National committee for clinical laboratory standards. Performance standards for antimicrobial disc susceptibility testing, v. 12, p. 01-53, 2002.
