THE USE OF SODIUM-GLUCOSE COTRANSPORTER-2 (SGLT2) INHIBITORS IN HEART FAILURE: A LITERATURE REVIEW
REGISTRO DOI: 10.69849/revistaft/ch10202410311242
Christiano Lima de Lucena1;
Bráulio Cruz Melo2;
Letícia Rocha Sobral3;
Gustavo Fonseca Medina Pereira4;
José Luis Francisco Gomes Souza5;
Maria Luíza Gomes Souza6
RESUMO
A insuficiência cardíaca (IC) não é um diagnóstico patológico único, mas uma síndrome clínica causada por uma anormalidade estrutural e/ou funcional do coração, resultando em pressão intracardíaca elevada ou débito cardíaco inadequado em repouso ou durante o exercício. É uma condição clínica comum encontrada em vários ambientes de saúde, com um vasto impacto socioeconômico. No Brasil, a IC apresenta-se como a maior causa cardiovascular de morbidade hospitalar. Destarte, os estudos sobre insuficiência cardíaca desempenham um papel crucial no desenvolvimento de novos medicamentos, permitindo melhorias significativas na eficácia, segurança e tolerabilidade do tratamento, bem como na personalização dos cuidados para pacientes individuais. Avanços recentes na farmacoterapia levaram à evolução de novos agentes terapêuticos com diminuição nas taxas de hospitalização e mortalidade na IC. A atualização de 2023 das diretrizes da Sociedade Europeia de Cardiologia (ESC) recomenda (classe IA) a administração de inibidores do transportador de sódio-glicose 2 (SGLT2i) para pacientes com insuficiência cardíaca com fração de ejeção preservada (ICFEP) e FE levemente reduzida (ICFEI). Este trabalho tem como objetivo analisar o uso dos inibidores do cotransportador de sódio-glicose-2 (SGLT2i) na insuficiência cardíaca. Visando chegar a esses tópicos foram coletados artigos nas bases de dados PUBMED e SCIELO, e realizada uma análise a partir do material encontrado para assim conseguir explanar as informações relevantes para com o tema.
Palavras-chave: Insuficiência cardíaca; Inibidores do transportador de Sódio-Glicose-2; SGLT2
ABSTRACT
Heart failure (HF) is not a single pathological diagnosis, but a clinical syndrome caused by a structural and/or functional abnormality of the heart, resulting in elevated intracardiac pressure or inadequate cardiac output at rest or during exercise. It is a common clinical condition found in various healthcare settings, with a vast socio-economic impact. In Brazil, HF is the leading cardiovascular cause of hospital morbidity. Thus, heart failure studies play a crucial role in the development of new drugs, enabling significant improvements in the efficacy, safety and tolerability of treatment, as well as the personalization of care for individual patients. Recent advances in pharmacotherapy have led to the evolution of new therapeutic agents with a decrease in hospitalization and mortality rates in HF. The 2023 update of the European Society of Cardiology (ESC) guidelines recommends (class IA) the administration of sodium-glucose transporter 2 inhibitors (SGLT2i) for patients with heart failure with preserved ejection fraction (HFpEF) and mildly reduced EF (HFpEF). This study aims to analyze the use of sodium-glucose cotransporter-2 inhibitors (SGLT2i) in heart failure. In order to arrive at these topics, articles were collected from the PUBMED and SCIELO databases, and an analysis was carried out based on the material found in order to be able to explain the information relevant to the topic.
Keywords: Heart failure; Sodium-glucose transporter-2 inhibitors; SGLT2
1. INTRODUÇÃO
A Insuficiência Cardíaca (IC) é uma síndrome clínica que resulta de anomalias estruturais ou funcionais no coração, levando a aumento das pressões de enchimento ou um débito cardíaco inadequado, tanto em repouso quanto durante atividades. Conforme as diretrizes atualizadas pela Sociedade de Insuficiência Cardíaca da América e pela Sociedade Europeia de Cardiologia, a IC é classificada segundo a fração de ejeção do ventrículo esquerdo (FEVE). As categorias incluem IC com FE reduzida (FEVE ≤40%), IC com FE levemente reduzida (FEVE de 41% a 49%), IC com FE preservada (FEVE ≥50%) e IC com FE melhorada (FEVE ≤40% com aumento de pelo menos 10 pontos) (Sebastian et al, 2024).
No Brasil, a IC é a principal causa de hospitalização cardiovascular, sendo a isquemia a protagonista. Entre outubro de 2023 e março de 2024, cerca de 95.696 pacientes foram internados devido à IC, com a região Sudeste registrando o maior número de casos, totalizando aproximadamente 40.325 pacientes (DATASUS, 2024). A pesquisa e o desenvolvimento de novos tratamentos são essenciais para melhorar a eficácia, segurança e tolerabilidade dos medicamentos para IC, bem como para personalizar o tratamento para cada paciente.
Os sintomas comuns da IC incluem fadiga, dispneia, redução da tolerância ao exercício e congestão sistêmica ou pulmonar. A etiologia da IC é ampla e variada, exigindo uma avaliação detalhada para o diagnóstico. O tratamento geralmente foca em aliviar a congestão e estabilizar o estado hemodinâmico, independentemente da causa. O diagnóstico pode ser feito usando os Critérios Diagnósticos de Framingham, que exigem a presença de dois critérios maiores ou um maior e dois menores. Além disso, a IC é classificada em estágios pela American College of Cardiology (ACC) e pela American Heart Association (AHA), e a classificação funcional da New York Heart Association (NYHA) é usada para guiar o tratamento com base na gravidade dos sintomas (Malik et al, 2023).
Avanços recentes na farmacoterapia têm levado a novas opções de tratamento que diminuem as taxas de hospitalização e mortalidade na IC. Alguns estudos mais direcionados para essa temática como a EMPA-REG OUTCOME e DAPA-HF foram de grande importância para introdução dos inibidores da SGLT2 nas diretrizes atuais. A atualização de 2023 das diretrizes da Sociedade Europeia de Cardiologia recomenda o uso de inibidores do transportador de sódio-glicose 2 (SGLT2i) para pacientes com IC com fração de ejeção preservada (ICFEP) e levemente reduzida (ICFEI) (Bauersachs et al, 2023). Esses medicamentos são especialmente benéficos para pacientes com ICFEp e classes II-III da NYHA com sintomas frequentes ou hospitalizações (Starr et al, 2024). Além disso, as diretrizes de 2022 da AHA, ACC e Heart Failure Society of America (HFSA) também recomendam os inibidores de SGLT2 (como dapagliflozina e empagliflozina) para ICFEp (Faluk et al, 2024). Embora a empagliflozina mostre benefícios adicionais como perda de peso e redução da pressão arterial em diabéticos, a eficácia comparativa com a dapagliflozina para IC ainda não está completamente clara (Modzelewski et al, 2024).
Dessa forma, o presente estudo tem como objetivo realizar uma revisão de literatura acerca do uso do inibidor de cotransportador sódio-glicose-2 em pacientes com insuficiência cardíaca.
2. METODOLOGIA
O presente estudo trata-se de uma revisão bibliográfica, que refere o uso de inibidores da SGLT2 na insuficiência cardíaca. Foi realizada uma pesquisa de dados a partir de artigos em plataformas científicas como SciElo e Pubmed. Foram utilizados descritores “inibidores de cotransportador sódio-glicose-2 na insuficiência cardíaca”, “tratamento” e seus determinantes nos idiomas português e inglês.
A coleta de dados foi realizada entre outubro de 2023 a março de 2024 e foram selecionados os trabalhos primários publicados entre 2015 e 2024. Foram critérios de inclusão os artigos originais em português e inglês, realizados entre 2015 e 2024, e selecionados a temática proposta. Como critério de exclusão, não foram analisados os artigos que estavam indisponíveis na íntegra ou incompletos, duplicatas ou sem relação ao tema em foco.
O processo de seleção foi demonstrado na figura 1 abaixo:
Figura 1: Metodologia da pesquisa.
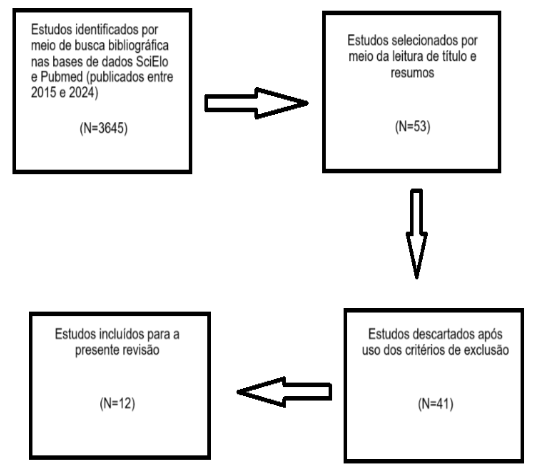
Descrição da figura 1: Estudos identificados por meio de busca bibliográfica nas bases de dados SciElo e Pubmed (publicados entre 2015 e 2024). Estudos selecionados por meio da leitura de título e resumos N=53. Estudos descartados após uso dos critérios de exclusão N=41. Estudos incluídos para a presente revisão N=12.
3. DISCUSSÃO
A insuficiência cardíaca (IC) não é um diagnóstico patológico único, mas uma síndrome clínica causada por uma anormalidade estrutural e/ou funcional do coração, resultando em pressão intracardíaca elevada ou débito cardíaco inadequado em repouso ou durante o exercício. Esta síndrome, segundo o novo relatório da Sociedade de Insuficiência Cardíaca da América, da Associação de Insuficiência Cardíaca da Sociedade Europeia de Cardiologia e da Sociedade Japonesa de Insuficiência Cardíaca, é classificada de acordo com a fração de ejeção do ventrículo esquerdo (FEVE). Inclui IC com FE reduzida (ICFER: FEVE ≤40%), IC com FE levemente reduzida (ICFEI: FEVE de 41% a 49%), IC com FE preservada (ICFEp: FEVE ≥50%) e IC com FE melhorada (HFIMPEF: FEVE de ≤40%, um aumento de 10 pontos em relação ao valor basal (Sebastian et al, 2024).
No Brasil, a IC apresenta-se como a maior causa cardiovascular de morbidade hospitalar, sendo a etiologia mais comum no país a isquêmica (Beatriz et al, 2022). Entre os períodos de outubro de 2023 e março de 2024 cerca de 95.696 pacientes estavam internados por insuficiência cardíaca, com maior índice na região sudeste, com cerca de 40.325 pacientes (DATASUS, 2024).
A etiologia da IC é variável e extensa. A sintomatologia dos pacientes geralmente são: fadiga e dispneia, tolerância reduzida ao exercício e congestão sistêmica ou pulmonar. Uma avaliação abrangente é necessária ao avaliar um paciente com IC. O manejo geral visa alívio da congestão sistêmica e pulmonar e estabilização do estado hemodinâmico, independente da causa (Malik et al, 2023).
Os Critérios Diagnósticos de Framingham para Insuficiência Cardíaca comumente usados exigem a presença de 2 critérios maiores ou 1 critério maior e 2 critérios menores para fazer o diagnóstico. Esta ferramenta clínica é altamente sensível para o diagnóstico de IC, mas tem uma especificidade relativamente baixa. Além disso, a ACC e a AHA juntos classificam a IC por estágios, sendo os 2 primeiros estágios assintomáticos e os 2 segundos classificados pela gravidade dos sintomas. Já a Classificação Funcional da New York Heart Association (NYHA) é usada para pacientes com sintomas de IC. Este sistema é determinado subjetivamente pelos médicos e é amplamente utilizado na prática clínica para direcionar a terapia (Malik et al, 2023).
Os estágios de insuficiência cardíaca ACC/AHA são divididos em: Estágio A: Sem sintomas, sem doença cardíaca estrutural ou sem evidência de biomarcadores cardíacos elevados, mas fatores de risco estão presentes. Os fatores de risco incluem hipertensão, diabetes, síndrome metabólica, medicamentos cardiotóxicos ou variante genética de cardiomiopatia. Estágio B: Os pacientes não apresentam sinais ou sintomas de IC, mas apresentam doença cardíaca estrutural, evidência de pressões de enchimento elevadas (por avaliação invasiva ou não invasiva) ou marcadores cardíacos persistentemente elevados na ausência de outras razões para marcadores elevados, como doença renal crônica ou miocardite. Estágio C: Pacientes com doença cardíaca estrutural e história atual ou pregressa de sintomas de IC. Estágio D: Pacientes com sintomas refratários que interferem na vida diária ou hospitalização recorrente, apesar da terapia médica direcionada e orientada pelas diretrizes (Malik et al, 2023).
Outrossim, é de suma importância entender a classificação funcional do NYHA. A classe funcional I da NYHA inclui pacientes com IC que são assintomáticos nas atividades da vida diária (ou seja, não apresentam limitações nas atividades físicas comuns). Pacientes em classe funcional II da NYHA apresentam leves limitações de atividade física; os pacientes sentem-se confortáveis em repouso, mas a atividade física normal resulta em sintomas de IC. Pacientes em classe funcional III da NYHA apresentam limitações marcantes de atividade física; os pacientes sentem-se confortáveis em repouso, mas menos atividades do que as normais causam sintomas de IC. A classe funcional ambulatorial IV da NYHA inclui pacientes incapazes de realizar qualquer atividade física sem sintomas de IC ou que apresentam sintomas de IC em repouso, mas que não estão acamados e não usam inotrópicos ou suporte circulatório mecânico (Giustino et al, 2020).
O tratamento da IC é realizado de forma individualizada, contando com o uso de diversas medicações. Por muito tempo o tratamento de ICFEr era realizado, a menos que houvesse contraindicações específicas, apenas com um β-bloqueador e um inibidor do receptor de angiotensina-neprilisina (INRA), inibidor da enzima de conversão da angiotensina (IECA) ou bloqueador do receptor de angiotensina (BRA) como terapia fundamental, com adição de um antagonista do receptor mineralocorticoide (ARM) em pacientes com sintomas persistentes. Ivabradina e hidralazina/dinitrato de isossorbida também têm um papel no tratamento de certos pacientes com ICFEr. No entanto, mais recentemente, os inibidores do cotransportador de sódio-glicose 2 (SGLT2) foram introduzidos no esquema do tratamento (Sean P Murphy, 2020).
A figura 2 abaixo demonstra a classe, nível de evidência e recomendação para o uso de inibidores de SGLT2 na insuficiência cardíaca de acordo com as diretrizes da Sociedade Brasileira de Cardiologia (SBC), Sociedade Europeia de Cardiologia (ESC) e Associação Americana do Coração (AHA):
Figura 2: Tabela de acordo com as diretrizes SBC, ESC e AHA.
Diretriz Classe Nível de Evidência Ano Recomendação Sociedade Brasileira de Cardiologia (SBC) I A 2021 Inibidores de SGLT2 (dapagliflozina ou empagliflozina) em pacientes com ICFEr sintomáticos diabéticos ou não já com dose máxima otimizada tolerada de betabloqueador, antagonista da aldosterona, iECA/BRA ou INRA para reduzir desfechos cardiovasculares e progressão da disfunção renal (SBC, 2021). Sociedade Europeia de Cardiologia (ESC) I A 2023 Inibidores de SGLT2 (dapagliflozina ou empagliflozina) em pacientes com ICFEp e ICFElr (FE levemente reduzida) sintomáticos para reduzir o risco de hospitalização por insuficiência cardíaca. Esta recomendação baseia-se nos ensaios EMPEROR-Preserved, DELIVER e uma meta-análise (ESC, 2023). Associação Americana do Coração (AHA) I
_________
IIA
_________
A2022
_________
2022Inibidores de SGLT2 (dapagliflozina e empagliflozina) em pacientes com ICFEr para reduzir o risco de hospitalização por insuficiência cardíaca. Esta recomendação baseia-se nos ensaios DAPA-HF e EMPEROR-Reduced (AHA, 2022).
____________________
Inibidores de SGLT2 (dapagliflozina e empagliflozina) em pacientes com ICFEp para reduzir o risco de hospitalização por insuficiência cardíaca (AHA, 2022).
Assim como ocorre com qualquer fármaco, o inibidor de SGLT2 passou por significativos avanços desde seu surgimento em 1835. O primeiro inibidor de SGLT foi a diidrocalcona florizina, que é um inibidor não seletivo de SGLT extraído de raízes de macieira. A dihidrochalcona florizina contém uma porção de glicose e uma aglicona na qual dois carbociclos aromáticos são unidos por um espaçador alquílico. Mais tarde, o O-glicosídeo aromático sergliflozina e o C-glicosídeo aromático dapagliflozina abriram oficialmente a era dos inibidores seletivos de SGLT. Os SGLT2 disponíveis são funcionalmente semelhantes, mas diferem em seletividade, eficácia e indicação. Por exemplo, empagliflozina, dapagliflozina e canagliflozina são 2.600, 1.200 e 150 vezes mais seletivos, respectivamente, para SGLT2 do que para SGLT1 (Huang et al, 2023).
Os inibidores da SGLT2 são amplamente utilizados no tratamento da Diabetes Mellitus. Evidências abundantes demonstraram que esses fármacos podem reduzir a hospitalização por insuficiência cardíaca (IC) em pacientes com ou sem diabetes. Um número crescente de estudos está sendo conduzido sobre os mecanismos de ação dos inibidores do SGLT2 (SGLT2i) na IC (Xie et al, 2023). Avanços recentes na farmacoterapia levaram à evolução de novos agentes terapêuticos com diminuição nas taxas de hospitalização e mortalidade na IC (Sebastian et al, 2024). Num ensaio clínico randomizado, a dapagliflozina reduziu a insuficiência cardíaca em 27% em pacientes com DM2 (diabetes mellitus tipo 2) com doença cardiovascular. A eficácia foi de 35% para a empagliflozina e 33% para a canagliflozina (Huang et al, 2023).
As formas como o SGLT2 funciona no coração não são totalmente compreendidas. O SGLT1 é expresso pelos cardiomiócitos e pode ser um alvo do SGLT2i que melhora a insuficiência cardíaca. Foi demonstrado que a inibição do SGLT1 com canagliflozina reduz a atividade da nicotinamida adenina dinucleotídeo fosfato (NADPH) oxidase nos cardiomiócitos, inibindo assim a produção de superóxido e diminuindo a inflamação. O SGLT2i pode ser útil como tratamento de primeira linha para insuficiência cardíaca que não é mediada apenas pelos seus receptores-alvo. Por exemplo, foi relatado que dapagliflozina e canagliflozina inibem diretamente o trocador Na+ /H+ -1 (NHE1) e anulam o aumento de Na+ citosólico em cardiomiócitos. A ativação direta da proteína quinase ativada por AMP (AMPK) pela dapagliflozina poderia reduzir a fibrose miocárdica induzida por lipopolissacarídeo (LPS). Outros estudos indicam que o SGLT2i pode atuar no canal de sódio cardíaco Nav1.5, melhorando a homeostase de sódio e cálcio, reduzindo a sobrecarga de cálcio e diminuindo arritmias. (Huang et al, 2023)
A empagliflozina, um inibidor do co-transportador 2 de sódio-glicose (SGLT-2), demonstrou eficácia na redução de hospitalizações por insuficiência cardíaca (IC) e morte cardiovascular em diabéticos tipo 2, tanto com quanto sem IC prévia. No estudo EMPA-REG, que envolveu 7.020 pacientes com histórico de doença cardiovascular, a empagliflozina reduziu a taxa de morte cardiovascular e outros eventos graves, comparado ao placebo, com uma redução significativa na mortalidade (3,7% vs. 5,9%, respectivamente). Em uma subanálise focada em IC, a empagliflozina reduziu as hospitalizações por IC em 35% e mostrou benefícios em pacientes com e sem IC prévia. Esses resultados confirmam a segurança e eficácia da empagliflozina, estabelecendo-a como uma opção benéfica para diabéticos tipo 2, especialmente em pacientes com IC (EMPA-REG, 2015).
No ensaio EMPEROR-Preserved recrutou-se 5.988 pacientes com IC (classe II–IV da NYHA) cuja FEVE era >40% e que tinham concentrações plasmáticas elevadas de peptídeo natriurético tipo B N-terminal (NT-proBNP) (>300 pg/mL para aqueles em ritmo sinusal ou >900 pg/mL para aqueles em fibrilação atrial). Eles foram randomizados para empagliflozina (10 mg uma vez ao dia) ou placebo. O desfecho primário foi um composto de morte CV ou hospitalização por IC. Em um acompanhamento mediano de 26,2 meses, a empagliflozina reduziu o desfecho primário (razão de risco [HR] 0,79, intervalo de confiança [IC] de 95% 0,69–0,90; P < 0,001). O efeito foi principalmente impulsionado por uma redução nas hospitalizações por IC com empagliflozina e não houve redução na morte CV. Os efeitos foram observados em pacientes com e sem diabetes mellitus tipo 2 (DM2). A maioria dos pacientes estavam utilizando IECA/BRA/INRA (80%) e betabloqueador (86%) e 37% estavam utilizando um ARM (ESC, 2023).
O estudo DELIVER relatou os efeitos da dapagliflozina (10 mg uma vez ao dia) em comparação com placebo em 6263 pacientes com IC (classe II–IV da NYHA). Os pacientes tinham que ter uma FEVE >40% no momento do recrutamento, mas aqueles que anteriormente tinham uma FEVE ≤40% que havia melhorado para >40% também foram inscritos. Pacientes ambulatoriais e internados hospitalizados por IC eram elegíveis. Concentrações elevadas de peptídeos natriuréticos também eram um critério de inclusão obrigatório (≥300 pg/mL em ritmo sinusal ou ≥600 pg/mL em fibrilação atrial). A dapagliflozina reduziu o desfecho primário de morte CV ou agravamento da IC (hospitalização por IC ou visita urgente à IC) (HR 0,82, IC de 95% 0,73–0,92; P < 0,001). Mais uma vez, o efeito principal foi devido a uma redução no agravamento da IC e não houve redução na morte CV. A dapagliflozina também melhorou a carga de sintomas. Os efeitos foram independentes do status do DM2. A eficácia da dapagliflozina foi consistente naqueles que permaneceram sintomáticos, apesar da melhora da FEVE, sugerindo que esses pacientes também podem se beneficiar da inibição do SGLT2. O benefício da dapagliflozina também foi consistente em toda a faixa de FEVE estudada. O uso de base de terapias para doença cardiovascular concomitante foi alto: 77% estavam em uso de um diurético de alça, 77% estavam em uso de IECA/BRA/INRA, 83% estavam em uso de betabloqueador e 43% estavam em uso de ARM (ESC, 2023).
Uma meta-análise subsequente de dados agregados dos dois ensaios (EMPEROR-Preserved e DELIVER) confirmou uma redução de 20% no desfecho composto de morte CV ou primeira hospitalização por IC (HR 0,80, IC de 95% 0,73–0,87; P < 0,001). A morte CV não foi reduzida significativamente (HR 0,88, IC de 95% 0,77–1,00; P = 0,052). A hospitalização por IC foi reduzida em 26% (HR 0,74, IC de 95% 0,67–0,83; P < 0,001). Houve reduções consistentes no desfecho primário em toda a faixa de FEVE estudada. Outra meta-análise de dados de pacientes individuais que incorporou dados do DAPA-HF (Dapagliflozina e prevenção de resultados adversos em insuficiência cardíaca) em HFEr com DELIVER confirmou que não havia evidências de que o efeito da dapagliflozina diferia pela fração de ejeção. Isso também mostrou que a dapagliflozina reduziu o risco de morte por causas CV (HR 0,86, IC 95% 0,76–0,97; P = 0,01) (ESC, 2023).
A atualização de 2023 das diretrizes da Sociedade Europeia de Cardiologia (ESC) recomenda (classe IA) a administração de inibidores do transportador de sódio-glicose 2 (SGLT2) para pacientes com insuficiência cardíaca com fração de ejeção preservada e fração de ejeção levemente reduzida (Bauersachs et al, 2023). Contudo, pacientes com ICFEP e classes II-III da NYHA com sintomas frequentes ou hospitalizações por insuficiência cardíaca são os que mais se beneficiam dos inibidores do SGLT2 (Starr et al, 2024). Além disso, com base nas diretrizes mais recentes de 2022 da AHA, ACC e da Heart Failure Society of American (HFSA) para o tratamento da IC, os inibidores de SGLT2 (Dapagliflozina ou empagliflozina) mostraram resultados promissores e foram recomendados como uma classe IIA, nível B, para o manejo da ICFEP (Faluk et al, 2024).
4. CONCLUSÃO
Conclui-se que a insuficiência cardíaca continua sendo uma complicação significativa para a saúde, apesar dos avanços tecnológicos e, consequentemente, dos avanços terapêuticos.
O diagnóstico precoce é crucial, visto que na maioria dos casos apresentará um melhor prognóstico ao iniciar o tratamento.
O tratamento da IC varia de acordo com a etiologia e gravidade dos sintomas, com opções que vão desde medidas conservadoras, como o uso iSGLT2, até intervenções invasivas, como troca de valva mitral (TVM). Embora existam diversas formas de tratamento, novas evidências sugerem que o uso dos iSGLT2, quando indicadas, trazem benefícios ao paciente.
Destarte, os estudos sobre insuficiência cardíaca desempenham um papel crucial para o desenvolvimento de novos medicamentos, permitindo melhorias significativas na eficácia, segurança e tolerabilidade do tratamento, bem como na personalização dos cuidados para pacientes individuais.
Portanto, é importante ressaltar a necessidade da continuidade dos estudos relacionados aos iSGLT2 não só como uma possibilidade de uso para a diabetes mellitus tipo2 (DM2), mas como uma forma de tratamento isolada da insuficiência cardíaca, ou seja, independente do paciente ter ou não DM2.
REFERÊNCIAS
- Sebastian SA, Co EL, Mahtani A, Padda I, Anam M, Mathew SS, Shahzadi A, Niazi M, Pawar S, Johal G. Heart Failure: Recent Advances and Breakthroughs. Dis Mon. 2024 Feb;70(2):101634. doi: 10.1016/j.disamonth.2023.101634. Epub 2023 Sep 12. PMID: 37704531.
- VALE, Beatriz França; FREITAS, Isabela Borges; FRANCO, Isadora Eloi. Epidemiologia das Internações Hospitalares por Insuficiência Cardíaca no Estado de Goiás. Brazilian Journal of Health Review, [S. l.], p. 1-14, 12 fev. 2022. DOI 10.34119/bjhrv5n1-239. Disponível em: file:///C:/Users/DELL/Downloads/admin,+ART.239.BJHR%20(1).pdf.
- Bauersachs J, Soltani S. Herzinsuffizienz: Leitlinien-Update der ESC 2023 [Heart failure: update of the ESC 2023 guidelines]. Herz. 2024 Feb;49(1):19-21. German. doi: 10.1007/s00059-023-05221-2. Epub 2023 Nov 14. PMID: 37962569.
- Starr JA, Pinner NA. The Impact of SGLT2 Inhibitors on Cardiovascular Outcomes in Patients With Heart Failure With Preserved Ejection Fraction. Ann Pharmacother. 2024 May;58(5):506-513. doi: 10.1177/10600280231189508. Epub 2023 Aug 5. PMID: 37542422
- Malik A, Brito D, Vaqar S, Chhabra L. Congestive Heart Failure. 2023 Nov 5. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan–. PMID: 28613623.
- Faluk M, Wardhere A, Thakker R, Khan FA. SGLT2 inhibitors in heart failure with preserved ejection fraction. Curr Probl Cardiol. 2024 Mar;49(3):102388. doi: 10.1016/j.cpcardiol.2024.102388. Epub 2024 Jan 4. PMID: 38184133.
- Modzelewski KL, Pipilas A, Bosch NA. Comparative Outcomes of Empagliflozin to Dapagliflozin in Patients With Heart Failure. JAMA Netw Open. 2024 May 1;7(5):e249305. doi: 10.1001/jamanetworkopen.2024.9305. PMID: 38696170; PMCID: PMC11066699.
- Giustino G, Lindenfeld J, Abraham WT, Kar S, Lim DS, Grayburn PA, Kapadia SR, Cohen DJ, Kotinkaduwa LN, Weissman NJ, Mack MJ, Stone GW. NYHA Functional Classification and Outcomes After Transcatheter Mitral Valve Repair in Heart Failure: The COAPT Trial. JACC Cardiovasc Interv. 2020 Oct 26;13(20):2317-2328. doi: 10.1016/j.jcin.2020.06.058. PMID: 33092705.
- Xie Y, Wei Y, Li D, Pu J, Ding H, Zhang X. Mechanisms of SGLT2 Inhibitors in Heart Failure and Their Clinical Value. J Cardiovasc Pharmacol. 2023 Jan 1;81(1):4-14. doi: 10.1097/FJC.0000000000001380. PMID: 36607775.
- Huang K, Luo X, Liao B, Li G, Feng J. Insights into SGLT2 inhibitor treatment of diabetic cardiomyopathy: focus on the mechanisms. Cardiovasc Diabetol. 2023 Apr 13;22(1):86. doi: 10.1186/s12933-023-01816-5. PMID: 37055837; PMCID: PMC10103501.
- SAUDE, Ministerio. DATA SUS. DATA SUS, 30 mar. 2024.
- Theresa A McDonagh,et al. ESC Scientific Document Group , 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC, European Heart Journal, Volume 44, Issue 37, 1 October 2023, Pages 3627–3639, https://doi.org/10.1093/eurheartj/ehad195. Disponível em: https://academic.oup.com/eurheartj/article/44/37/3627/7246292?login=false.
- JJV, McMurray et al. AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. American Heart Association, p. 1-138, 3 maio 2022. DOI 10.1161/CIR.0000000000001063. Disponível em: https://www.ahajournals.org/doi/pdf/10.1161/CIR.0000000000001063.
- BRAGA, : Fabiana G. Marcondes et al. Atualização de Tópicos Emergentes da Diretriz Brasileira de Insuficiência Cardíaca. Diretriz brasileira de insuficiência cardíaca (SBC), p. 1-39, 2021. DOI https://doi.org/10.36660/abc.20210367. Disponível em: https://abccardiol.org/wp-content/uploads/articles_xml/0066-782X-abc-116-06-1174/0066-782X-abc-116-06-1174.x81990.pdf.
- NOUEL, Ana et al. Efectos cardiovasculares de los inhibidores del cotransportador 2 de sodio-glucosa (ISGLT2): los mecanismos del beneficio en pacientes con insuficiencia cardíaca. Revista chilena de cardiología,, 2022. DOI http://dx.doi.org/10.4067/S0718-85602022000300198. Disponível em: https://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0718-85602022000300198&lang=en.
- AMERICAN HEART ASSOCIATION SCIENTIFIC SESSIONS (Orlando, EUA). EMPA-REG: Empaglifozina e a sua relação com insuficiência cardíaca. American Heart Association Scientific Sessions, [S. l.], p. 1-1, 7 nov. 2015. Disponível em: http://congresso.cardiol.br/aha15/artigos.asp?Id_noticia=295.
- Murphy SP, Ibrahim NE, Januzzi JL Jr. Heart Failure With Reduced Ejection Fraction: A Review. JAMA. 2020 Aug 4;324(5):488-504. doi: 10.1001/jama.2020.10262. Erratum in: JAMA. 2020 Nov 24;324(20):2107. doi: 10.1001/jama.2020.21736. PMID: 32749493.
1ORCID: https://orcid.org/0009-0006-8346-9649, Universidade Tiradentes, Brasil, E-mail: christiano_esporte01@hotmail.com;
2ORCID: https://orcid.org/0000-0002-5529-3352, Universidade Tiradentes, Brasil, E-mail: brauliomelo.cardio@gmail.com;
3ORCID: https://orcid.org/0009-0008-8894-9208, Universidade Tiradentes, Brasil, E-mail: leticia.rocha.sobral15@gmail.com;
4ORCID : 0009-0008-1755-8488, Universidade Tiradentes, Brasil, E-mail: gustavo.fonseca@souunit.com.br;
5ORCID: https://orcid.org/0009-0000-1453-0940, Universidade Tiradentes, Brasil, E-mail: Jlfgs.2000@hotmail.com;
6ORCID: https://orcid.org/0009-0009-4747-6675, Universidade Tiradentes, Brasil, E-mail: malu_gomessouza@hotmail.com
