REGISTRO DOI: 10.5281/zenodo.7998507
Daniel Gonsales Spindola¹
Mariana Aparecida de Sousa¹
Thais Matos Gomes de Sousa¹
Vitor Manoel de Araújo Pedro¹
Vitória Novais Porto¹
RESUMO: A nanotecnologia e o seu emprego no campo da biomedicina, em especial no tratamento e diagnóstico do câncer, tem sido foco de um crescimento exponencial, com grande impacto nos cuidados em saúde. A leucemia mieloide aguda (LMA) é uma das leucemias que mais atingem pessoas a nível mundial, com elevados índices de mortalidade, níveis de sofrimento físico e emocional e, encargos para o doente, família e sociedade. É uma doença complexa e a prática clínica convencional constitui um paradigma, visto que se trata de um tratamento extremamente agressivo, expondo o doente a medicamentos citotóxicos, não específicos, com elevada toxicidade sistêmica e efeitos adversos. A nanomedicina e a exploração das propriedades únicas das nanopartículas, apresenta a capacidade de melhorar a detecção e diagnóstico da LMA e aumentar a especificidade e efetividade no tratamento das células tumorais. Além disso, aliado a essa tecnologia, o emprego dos miRNA tem sido considerado, pois são importantes biomarcadores e desempenham um papel significativo sob muitos ângulos na evolução da LMA, abrangendo a diferenciação celular, a sua conservação e multiplicação. No entanto, esses recursos continuam a ser alvo de controvérsia e cepticismo por elementos das comunidades científicas e acadêmicas. Com nanoprodutos aprovados e utilizados em prática clínica e muitos outros em desenvolvimento e investigação em ensaios clínicos, a execução deste trabalho visa realizar uma revisão sistemática da literatura para compreender os conceitos de nanotecnologia e suas aplicações com miRNA, ponderando as vantagens e desvantagens da abordagem “nano” e a sua real aplicação à terapêutica oncológica.
Palavras chaves: Nanotecnologia, Nanomedicina, LMA, miRNA, Nanopartículas;
ABSTRACT: Nanotechnology and its use in the field of biomedicine, especially in the treatment and diagnosis of cancer, has been the focus of exponential growth, with great impact on health care. Acute myeloid leukemia (AML) is one of the most common leukemias affecting people worldwide, with high mortality rates, levels of physical and emotional suffering, and burdens to the patient, family, and society. It is a complex disease and conventional clinical practice is a paradigm, since it is an extremely aggressive treatment, exposing the patient to cytotoxic, non-specific drugs, with high systemic toxicity and adverse effects. Nanomedicine and the exploitation of the unique properties of nanoparticles, presents the ability to improve the detection and diagnosis of AML and increase the specificity and effectiveness in the treatment of tumor cells. In addition, allied to this technology, the employment of miRNAs has been considered, as they are important biomarkers and play a significant role from many angles in the evolution of AML, covering cell differentiation, cell conservation and multiplication. However, these resources continue to be the subject of controversy and skepticism by elements of the scientific and academic communities. With approved nanoproducts used in clinical practice and many others under development and investigation in clinical trials, the execution of this work aims to perform a systematic literature review to understand the concepts of nanotechnology and its applications with miRNA, weighing the advantages and disadvantages of the “nano” approach and its actual application to cancer therapeutics.
Keywords: Nanotechnology, Nanomedicine, AML, miRNA, Nanoparticles;
INTRODUÇÃO
1.1 Câncer
O câncer é um termo que engloba diversas doenças e é considerado um dos maiores problemas de saúde. Sua principal característica é um crescimento desenfreado com acelerada multiplicação de células anormais. Essas células se unem e formam os tumores, que podem invadir e se propagar para órgãos próximos, como também se disseminar para outras partes do corpo afastadas do foco inicial do tumor, processo denominado como metástase (OPAS, 2018).
A ocorrência e a letalidade do câncer vem crescendo no mundo. Na maior parte dos países, essa doença se encontra entre as quatro principais razões de morte antes dos 70 anos de idade. Em 2018 foram registrados 17 milhões de novos casos de câncer e 9,5 milhões de óbitos, com exceção dos casos de câncer de pele não melanoma. No Brasil, os dados mais recentes apontam que para cada ano entre 2020-2022 ocorrerão 450 mil novos casos de câncer, excluindo também as ocorrências de câncer de pele não melanoma (INCA, 2020).
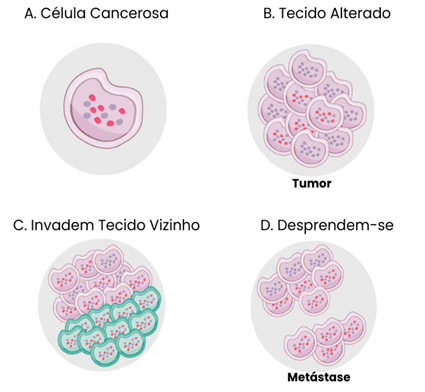
Figura 1 – Ilustração sobre o desenvolvimento do câncer. A) no câncer, as células sofrem mutações, ou seja, possuem alterações em sua estrutura genética. Na existência de qualquer erro, a célula alterada pode se tornar cancerosa; B) a célula cancerosa se multiplica de maneira exacerbada e desordenada. Dessa forma, o crescimento celular é constante e com esse acúmulo das células descontroladas, o tecido se altera e se originam os tumores malignos; C) nesse crescimento não controlado, o excesso de células tumorais podem invadir os tecidos vizinhos e esses tecidos invadidos também vão perdendo as suas funções; D) essas células, além de difundir-se para os tecidos vizinhos, também possuem o potencial de se desprenderem do tumor, podendo ganhar a corrente sanguínea e através dela se disseminar por todo o organismo, atingindo estruturas distantes do sítio primário do tumor. Esses novos focos do câncer são denominados de metástases. Fonte: Adaptado (INCA, 2022)
1.2 Leucemia
A leucemia representa cerca de 3,1% do total de óbitos por câncer em 2017, sendo o oitavo tipo de câncer com maior mortalidade. Entre 2022 e 2024, 33.000 novos casos serão registrados anualmente no Brasil. Embora a incidência de câncer ainda seja maior nos países desenvolvidos, as taxas de mortalidade são maiores nos países em desenvolvimento, o que se reflete em diferenças no perfil da doença e no acesso ao diagnóstico e tratamento (MELO, 2020).
As leucemias são caracterizadas de acordo com a origem da célula cancerosa, sendo mieloides e linfoides e se ramificam em agudas e crônicas conforme o período de crescimento. Entre o conjunto de leucemias, a leucemia mieloide corresponde a cerca de 40% dos diagnósticos e atinge principalmente indivíduos adultos do sexo masculino com idade superior a 60 anos. Em sua fase aguda, a leucemia mieloide apresenta um crescimento intenso de mieloblastos e esse acúmulo de células imaturas reduz o espaço para a produção hematopoética normal, acarretando, portanto, uma diminuição do número de plaquetas, hemácias e linfócitos (DOS SANTOS et al., 2019).
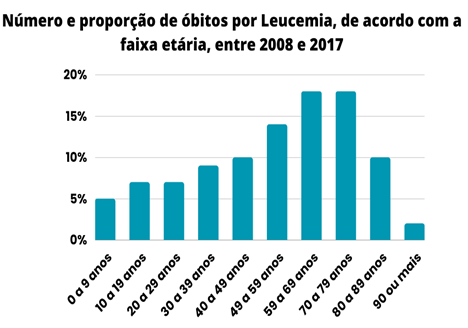
Figura 2 – Relação entre a porcentagem de óbitos por leucemia mieloide aguda e a faixa etária. Fonte: Adaptado (MELO, 2020)
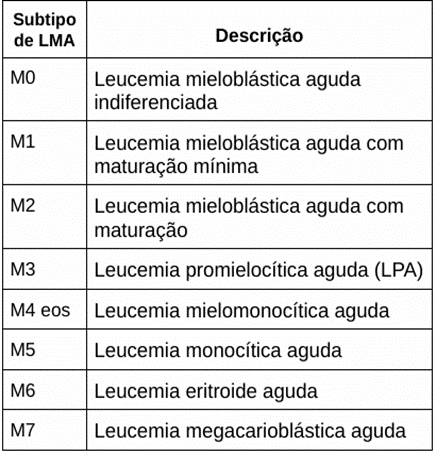
Em 1970, de acordo com a classificação franco-americana-britânica (FAB), a leucemia mieloide aguda (LMA) foi dividida em subtipos de M0 a M7, a partir do tipo de célula que a leucemia cresce e no estágio de maturidade. Essa divisão se fundamenta principalmente no aspecto das células de leucemia após serem coradas e vistas no microscópio (ACS, 2018).
Tabela 1 – Subtipos de leucemia mieloide aguda e as suas descrições.
1.3 Tratamentos para LMA
Embora existam novas pesquisas e avanços sobre o tratamento do câncer, atualmente, as terapias acessíveis se limitam a quimioterapia, radioterapia e cirurgia. Estes tratamentos apresentam diversos danos ao paciente, como alta toxicidade sistêmica, resistência aos fármacos e efeitos colaterais. Com os progressos na área da nanotecnologia, é esperado que as carências observadas no tratamento do câncer, como a falta de especificidade e a baixa biocompatibilidade sejam atenuadas, visto que os nanomateriais possuem propriedades únicas que trazem uma melhor interação físico-química dos componentes (GONÇALVES; HAAS, 2021).
1.4 miRNA e nanomaterial
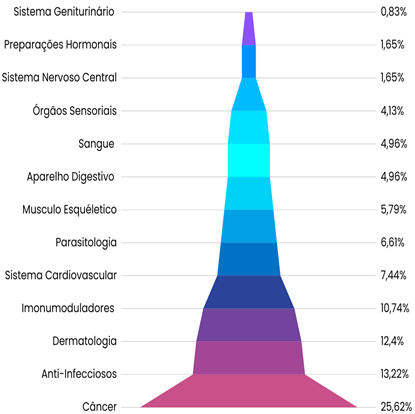
O tratamento do câncer é considerado difícil e agressivo. Por esta razão, têm sido realizadas numerosas pesquisas com o intuito de encontrar novas metodologias para tratar essa doença. Desse modo, na atualidade já é bem aceito que os microRNAs (miRNAs) atuam como supressores de tumor em diferentes subtipos de LMA e a sua interação com as nanopartículas acarretam em um melhor resultado na terapia. Os miRNAs são RNAs pequenos não codificantes que possuem aproximadamente de 20 a 24 nucleotídeos e a sua principal função é atuar na regulação gênica mediante a inibição do processo de tradução do RNA mensageiro (mRNA) (WALLACE; O’CONNELL, 2017). Já os nanomateriais dizem respeito aos componentes que possuem pelo menos uma de suas dimensões na ordem de 1 a 100 nanômetros e a sua utilização é essencial, uma vez que esse material, aliado a tecnologia, apresenta um campo promissor para terapias mais modernas. (HUPFFER; LAZZARETTI, 2019). Baseado nisso, no gráfico da figura 3 é possível perceber que para o câncer, a nanotecnologia é mais utilizada com 25,62% dos depósitos brasileiros (GIURIATTI et al., 2019).
Figura 3 – Gráfico com as aplicações terapêuticas da nanotecnologia brasileira. É notório que o maior investimento nacional, ao que se refere o uso da nanotecnologia, é na pesquisa do câncer. Fonte: Adaptado (GIURIATTI et al., 2019)
A leucemia mieloide aguda é uma doença grave que exige um rápido diagnóstico e tratamento. Em uma pesquisa realizada pelo Observatório de Oncologia, no período de 2008 a 2017, o Brasil apresentou 63.452 mortes em decorrência da leucemia, das quais 36% foram provocadas por LMA. Nesse estudo também foi possível observar que entre 2008 e 2017, o número total de óbitos aumentou cerca de 23% (MELO, 2020).Já em um panorama global, no ano de 2019, havia nos Estados Unidos aproximadamente 69.700 indivíduos portadores da LMA (NCI, 2022).
Ao verificar esses números e a crescente linha de pesquisa para achar novos métodos de tratamentos que sejam mais seguros e efetivos para essa doença, o uso do nanomaterial e o do miRNA tem se destacado. Visto que os procedimentos convencionais causam diversos efeitos adversos e é essencial descobrir novas técnicas que reduzem os danos causados e tragam, aliado ao tratamento, uma maior sobrevida ao doente.
OBJETIVOS
Geral:
Caracterizar através da revisão bibliográfica a ação do nanomaterial e do miRNA no diagnóstico e tratamento de leucemia mieloide aguda.
Específicos:
● Descrever o que é leucemia mieloide aguda;
● Estabelecer a interação entre o nanomaterial e o miRNA;
● Comparar os tratamentos convencionais de leucemia mieloide aguda com os novos métodos que utilizam as nanopartículas;
● Analisar a relevância do uso do nanomaterial e do miRNA no diagnóstico e tratamento de leucemia mieloide aguda.
METODOLOGIA
Neste estudo foi realizada uma revisão bibliográfica e teve como estratégia de busca a pesquisa de artigos científicos e revistas eletrônicas disponibilizados a partir da base de dados dos sites Scielo, PubMed e Google Acadêmico, utilizando como descritores de pesquisa: “leucemia” (leukemia), “miRNA”, “câncer” (câncer), nanomateriais” (nanomaterials), “diagnóstico” (diagnostic) e as suas combinações.
Inicialmente foram selecionadas as publicações que continham no título ou resumo os descritores mencionados. Após isso, foram utilizados parâmetros de inclusão e exclusão para verificar se os artigos se enquadravam no estudo.
Os critérios para inclusão foram os textos publicados entre 2017 e 2022 que abordavam sobre o diagnóstico e tratamento de leucemia mieloide aguda, sobre nanomateriais e miRNA e os textos que faziam ligação entre os temas. Com base nesses tópicos, foram incluídos os artigos oficiais e os de revisão que possuíam como idioma o português ou o inglês. Os estudos que foram publicados antes de 2017, os textos que eram restritos e os estudos de casos foram descartados.
Na primeira pesquisa utilizando os descritores foram encontrados 25 artigos. Em seguida, aplicou-se os critérios de inclusão e exclusão, e foram selecionados 10 textos. Por fim, após a leitura dos artigos escolhidos, foram analisadas e separadas as informações mais importantes para responder aos objetivos deste estudo.
DESENVOLVIMENTO
1.1 Leucemia Mieloide Aguda
Leucemia é o termo utilizado para se referir a um grupo de doenças malignas que afetam principalmente a produção dos glóbulos brancos, conhecidos também por leucócitos. A leucemia mieloide aguda (LMA), representa cerca de 80% das leucemias mundiais e a sua maior incidência no mundo ocorre nos Estados Unidos, Austrália e Europa Ocidental. Em 2016, foram registrados aproximadamente 20.000 casos somente nos Estados Unidos (DA SILVA MARQUES et al., 2018; OLIVEIRA et al., 2021).O processo de formação, desenvolvimento e maturação das células sanguíneas advém do sistema hematopoiético presente em cada indivíduo. Tal sistema é fundamental para a manutenção da vida, e por isso se inicia no saco vitelínico. Com o desenvolvimento fetal, a hematopoiese passa a ser realizada na medula óssea, localizada na parte interna dos ossos. As células-tronco estão anexas a essa estrutura e por serem indiferenciadas, é possível se modificarem e darem origem a diversas outras células. Através dessas modificações são formadas as células sanguíneas das linhagens mieloides e linfoides, conforme elucida a figura 4 (LOPES et al., 2022).
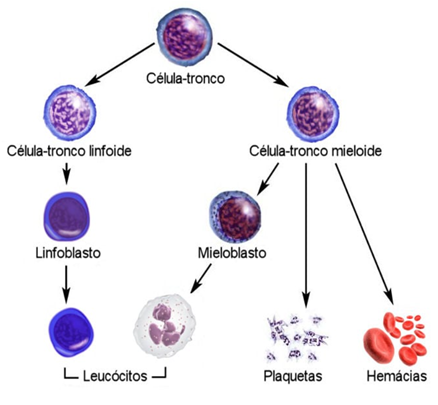
Figura 4 – Ilustração sobre a formação das células sanguíneas. As células-tronco hematopoiéticas podem se diferenciar e darem origem em duas linhagens diferentes de células sanguíneas. Uma das linhagens é chamada de linfoide e a célula-tronco linfoide dará gera as progênies dos linfócitos B e T. Já a célula-tronco da linhagem mieloide é responsável pela formação das hemácias, plaquetas, basófilos e eosinófilos. É importante mencionar que os neutrófilos e monócitos advêm de uma célula progenitora em comum. Fonte: Adaptado (PINHEIRO, 2022)
Quando saudáveis, essas células trabalham de maneira intensa, passando pelo processo de amadurecimento, divisão e morte e assim são substituídas por células novas. Com as mutações que podem ocorrer ocasionalmente, as atividades regulares da célula começam a acontecer de forma anormal, resultando em uma multiplicação exacerbada (LOPES et al., 2022). Na leucemia mieloide aguda, a doença se desenvolve a partir da proliferação rápida de células da linhagem mieloide, desencadeando o processo de anaplasia, onde as células perdem a capacidade de se diferenciar em células maduras, e dessa forma, se tornam incapazes de executar as suas funções normais. (LOPES et al., 2022). Para exemplificar, a figura 5 e 6 comparam um esfregaço sanguíneo normal e um esfregaço de LMA.
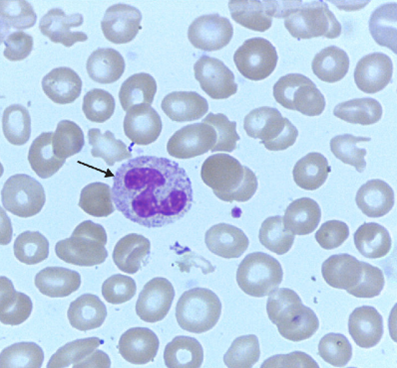
Figura 5 – Esfregaço sanguíneo com neutrófilo segmentado (seta) normal. Fonte: Adaptado (LACES, 2017)
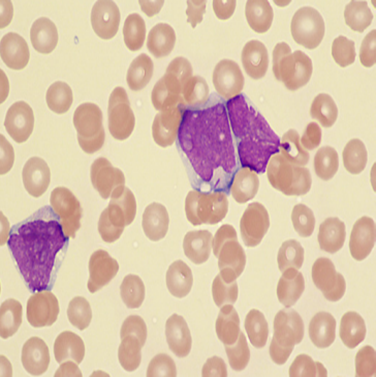
Figura 6 – Esfregaço sanguíneo de LMA com blasto (leucócito imaturo) apresentando um bastão de Auer. Fonte: BAIN; BENÉ, 2019.
Devido a esse acúmulo de células imaturas no sangue, a medula óssea perde a capacidade de formação de novas células. Desse modo, o indivíduo pode apresentar anemia, em razão da diminuição da produção de eritrócitos, hemorragia, em função da diminuição da produção de plaquetas e infecções frequentes, em consequência da falta de leucócitos (LOPES et al., 2022).
Os fatores de risco em pacientes que apresentam LMA são variados, podendo ser destacados: a exposição a radiação e produtos tóxicos como benzeno, pesticidas e herbicidas e alterações genéticas, como anemias de Falconi, Síndrome de Down e Síndrome de Kostman (OLIVEIRA et al., 2021).
1.2 Interação entre o nanomaterial e o miRNA
Os miRNAs são RNAs de cadeia simples que modulam a expressão gênica, sendo capazes de controlar diversos processos biológicos, como diferenciação, desenvolvimento e proliferação celular, além de atuar na apoptose (CORADDUZZA et al., 2022).
A manifestação desregulada de miRNA é considerada uma ocorrência precoce na origem de tumores, uma vez que, os miRNAs apresentam alta estabilidade, mesmo em circunstâncias extremas. Em decorrência dessa notável estabilidade, importante resistência a ambientes desfavoráveis e por apresentarem um perfil diferente de expressão em cada tipo de câncer, os miRNAs detém de uma ampla aptidão para atuar como biomarcadores não invasivos para a detecção precoce do câncer, aumentando, portanto, a taxa de sobrevida dos indivíduos com a doença (LOW et al., 2021).
Dentro desse contexto, uma visão fundamentada em nanotecnologia conseguiria associar a entrega e a detecção de miRNA e garantir um grande impacto no diagnóstico e tratamento do câncer (CORADDUZZA et al., 2022).
A nanotecnologia evidenciou diversas vantagens no diagnóstico e/ou tratamento do câncer, em função das propriedades das nanoestruturas. Esses materiais em escala nanométrica possuem maior reatividade, maior razão entre área de superfície e volume, fluorescência, coloração distinta e melhor condutividade elétrica, além de apresentarem características próprias devido à sua dimensão, configuração e composição (LANDIM; OMBREDANE; JOANITTI, 2022).
A utilização dos nanomateriais no desenvolvimento de biossensores eletroquímicos, colabora na identificação de várias substâncias, como metabólitos, antibióticos, câncer e biomarcadores de miRNA. Essas nanopartículas apresentam maior sensibilidade e menor limite de detecção, pois possuem uma estabilidade química considerável. Por dispor dessa característica e por serem usados como modificadores de eletrodos, o nanomaterial permite a detecção sensível do analito em concentrações mínimas (LOW et al., 2021).
Os biossensores são instrumentos inovadores para o diagnóstico clínico, principalmente para doenças oncológicas, e também estão envolvidos no tratamento, pois ajudam na compreensão dos procedimentos envolvidos na fisiopatologia e certificam o recurso terapêutico adequado ao paciente (CORADDUZZA et al., 2022).
1.3 Tratamentos para Leucemia Mieloide Aguda
Quando se trata de LMA, o tratamento padrão é a realização de quimioterapia, sendo dividida, geralmente, em duas etapas. A primeira é a indução do processo de remissão cujo objetivo é a mielossupressão e a segunda fase é a consolidação da remissão que pode ser seguida ou não por um transplante de células-tronco hematopoiéticas (TCTH). Esse tipo de quimioterapia é considerado o mais eficaz e tem o intuito de reparar as células sanguíneas. (SANTOS et al., 2019).
É notório que a condição de remissão completa (RC) não significa a cura permanente, mas que a doença não é detectada nos métodos diagnósticos usuais. Além disso, está estabelecido em estudos que a indução mielossupressora não é suficiente para impossibilitar as recidivas (SANTOS et al., 2019).
A célula afetada pela leucemia, ocasionalmente, sofre uma mutação no gene FLT3, que leva à fabricação da proteína também chamada de FLT3, cujo efeito é o desenvolvimento de células débeis. Por esta razão, os medicamentos que inibem a produção dessa proteína contribuem para o sucesso da terapia. Além do mais, os fármacos que inibem as proteínas de IDH também colaboram para diminuir as taxas de recaídas, pois ativam o amadurecimento celular, uma vez que o IDH afeta o desenvolvimento das células (LOPES et al., 2022).
A quimioterapia de indução, primeira fase do tratamento, utiliza como medicamento a antraciclina, por três dias e a citarabina por sete dias. Segundo a necessidade do paciente, a prescrição pode ser alterada ou podem ser utilizados outros fármacos (SILVA, 2022).
Conforme a American Cancer Society (ACS) (2018), as antraciclinas podem causar danos ao coração, por esta razão, não são recomendadas para indivíduos que apresentam problemas cardíacos. Já a citarabina, em altas doses, podem provocar secura nos olhos e acarretam problemas no equilíbrio e coordenação, pois também causam impactos no cérebro. Quando verifica-se a presença desses efeitos, é necessário reduzir ou interromper a dose do medicamento.
A quimioterapia é um tratamento agressivo que causa, em geral, vários efeitos adversos, como fadiga oncológica, náuseas e vômitos, perda do cabelo, diarreia e queda na imunidade. E nos primeiros meses, devido às altas doses dos medicamentos que causam a imunossupressão, nessa fase, ocorre a maior parte dos óbitos, em virtude da neutropenia, insuficiência renal e hemorragia alveolar (NEVES, 2021; DOS SANTOS et al., 2019).
Quando a quimioterapia de indução é promissora, é sugerido que o paciente alcançou a RC. Todavia, em casos de recidivas, o transplante de medula é o mais indicado (LOPES et al., 2022).
O TCTH é realizado, principalmente, por meio do enxerto alogênico, quando o material é resultante de um doador compatível ou proveniente do enxerto autólogo, quando a doação é oriunda do próprio receptor (SILVA; DE SOUZA, 2020).
O procedimento é feito com uma incisão na crista ilíaca posterior e é colhido 5ml de medula. No entanto, mesmo se a técnica for feita de forma correta e com o condicionamento adequado, alguns efeitos relacionados ao transplante podem ocorrer, como a doença do enxerto contra o hospedeiro, uma nova recidiva e o óbito (SILVA; DE SOUZA, 2020).
A quimioterapia é o tratamento mais utilizado, porém não é um tratamento específico para atingir somente as células sanguíneas. Essa terapia apresenta resistência intrínseca a fármacos e uma eficiência restrita, seja por causar efeitos colaterais em tecidos normais, seja pela insuficiência de oferecer concentrações satisfatórias do fármaco no tecido alvo. Baseado nesse princípio, o grande desafio concentra-se no desenvolvimento de um processo terapêutico para os diversos tipos de leucemia, com a diminuição dos efeitos secundários (COSTA; SILVA, 2017).
O avanço da utilização do nanomaterial proporciona um potencial elevado no desenvolvimento de novos métodos de tratamento para LMA. Assim sendo, tem sido proposto a utilização de nanopartículas para direcionar os medicamentos para alvos precisos presentes nas células afetadas pela doença, incluindo até mesmo a combinação com a quimioterapia padrão, pois essa técnica apresenta um aumento na eficácia do tratamento e na melhora da qualidade de vida (COSTA; SILVA, 2017).
Essa combinação aperfeiçoa o efeito do tratamento na região alvo, uma vez que os fármacos usuais possuem uma curta janela terapêutica em função da alta elevação no plasma e queda nas taxas de liberação, ocasionando doses irrelevantes no tecido de interesse e a existência de efeitos colaterais. No entanto, quanto o medicamento apresenta-se combinado com as nanopartículas, a liberação ocorre de forma moderada e o período de liberação se estende por dias ou até meses. As nanopartículas também podem ser magnéticas e dessa forma serem utilizadas encapsuladas com lipossomos. Esse procedimento permite que as partículas sejam conduzidas para um alvo exclusivo através de campos magnéticos externos e também podem ser empregadas como contraste para marcadores de células alvo em exames de imagem (COSTA; SILVA, 2017).
A prática clínica mais favorável com miRNA é o seu emprego como biomarcadores de doenças na LMA. A LMA apresenta diversos tipos e a classificação apropriada é indispensável para indicar o tratamento adequado. O perfil de expressão de miRNA é válido, pois pode colaborar na classificação da LMA com um acerto de > 95%. Além disso, os perfis de expressão também fornecem informações significativas relacionadas ao prognóstico e podem até presumir a sobrevida em algumas situações. O uso do miRNA tem um grande potencial terapêutico, pois são moléculas endógenas que bloqueiam diversos alvos, dessa forma, a mutação no local e a resistência sistêmica utilizando as terapias com miRNA seria improvável (WALLACE; O’CONNELL, 2017).
Os miRNAs, por serem específicos, se mostram relevantes na LMA, pois as suas diferentes expressões são utilizadas para subdividir os tumores em diferentes categorias de prognóstico, promovendo um melhor panorama comportamental da doença (SILVA, 2017).
Recentemente foi constatado o excelente desempenho da terapêutica baseada em miRNA na LMA. Um estudo feito com camundongos enxertados com linhagens de LMA humana validou a entrega de miR-29b através de nanopartículas lipídicas associadas com transferrina. Esse compartilhamento de miR-29b causou no camundongo a redução do crescimento das células leucêmicas e melhorou a sua sobrevida. Apesar de serem promissoras, a maior parte dos estudos ainda não obteve a importância clínica desejada (WALLACE; O’CONNELL, 2017).
1.4 Relevância do uso do nanomaterial e do miRNA
O potencial do nanomaterial e do miRNA de conduzirem processos celulares consideráveis, sendo capazes de agir em alvos específicos, elucida sua capacidade como uma ferramenta terapêutica viável (SILVA, 2017).
As tecnologias recentes de sequenciamento para encontrar genes associados à LMA vêm crescendo. Essa investigação utilizando nanomateriais e miRNA favorece de forma preponderante o prognóstico. A triagem das mutações no gene FLT3 tem revelado que esses marcadores também podem ser empregados para analisar a doença residual mínima, bem como atuar no avanço de novos agentes antileucêmicos (SILVA, 2021).
É importante mencionar que com o propósito de utilizar essas moléculas para fins terapêuticos, é crucial esclarecer algumas barreiras. O uso do nanomaterial e do miRNA podem apresentar dificuldades na entrega intracelular, o material pode se degradar na corrente sanguínea devido à ação das nucleases e pode mostrar pobre penetração nas células tumorais em razão das barreiras mecânicas (SILVA, 2017).
Sendo assim, é primordial a busca incessante de nanopartículas inteligentes, carreadores virais e lipossomas para garantir a ação efetiva dessas moléculas no tecido alvo (SILVA, 2017).
CONSIDERAÇÕES FINAIS
O tratamento da leucemia mieloide aguda ainda é um desafio. É notável que a nanotecnologia tem se tornado um campo de considerável importância no tratamento da LMA. Sob essa perspectiva, a estratégia nanotecnológica em conjunto com a ação dos miRNAs se mostram promissoras, visto que não só possibilitam o diagnóstico precoce, como também são adjuvantes em conduzir o agente ativo para as células tumorais, aprimorando a eficácia do tratamento, afinal, eles apresentam uma melhor absorção, um aumento do período de liberação do fármaco na corrente sanguínea e a possibilidade de monitorar o volume de distribuição.
Embora existam estudos reconhecendo a eficiência da utilização dos nanomateriais e do miRNA no tratamento de LMA, a escassez literária sobre o tema ainda se destaca. Logo, o envolvimento da comunidade científica deve ser urgente e imprescindível nas pesquisas que busquem promover novas erudições acerca do tratamento da leucemia mieloide aguda, pois o aumento da sobrevida dos pacientes com LMA vêm da perspectiva da combinação da utilização dos miRNAs com o progresso da nanotecnologia.
REFERÊNCIAS BIBLIOGRÁFICAS
- ORGANIZAÇÃO PAN-AMERICANA DA SAÚDE (OPAS). Folha informativa – Câncer. Brasília, OPAS, 2018. Disponível em: <https://www.paho.org/pt/topicos/cancer>. Acesso em: 19 de out., 2022.
- INSTITUTO NACIONAL DO CÂNCER (INCA). Estimativa 2020: Incidência de Câncer no Brasil. Rio de Janeiro, INCA, 2020. Disponível em: <https://www.inca.gov.br/estimativa/introducao>. Acesso em: 19 de out., 2022.
- MELO, N. Tendências da Mortalidade por Leucemia no Brasil. São Paulo: Observatório de Oncologia, 2020. Disponível em: <https://observatoriodeoncologia.com.br/mortalidade_leucemias/>. Acesso em: 19 de out., 2022.
- DOS SANTOS, Mirella Meireles Ferreira et al. Leucemia mieloide, aguda e crônica: diagnósticos e possíveis tratamentos. 2019.
- AMERICAN CANCER SOCIETY(ACS). Acute Myeloid Leukemia (AML) Subtypes and Prognostic Factors. Atlanta: American Cancer Society, 2018. Available at: https://www.cancer.org/cancer/acute-myeloid-leukemia/detection-diagnosis-staging/how-classified. html. Acesso em: 27 Nov., 2022.
- GONÇALVES, Laura Faustino; HAAS, Patrícia. Efetividade da Nanotecnologia para Medicamentos em Pacientes com Câncer: Revisão Integrativa da Literatura. Revista Brasileira de Cancerologia, v. 67, n. 3, 2021.
- WALLACE, Jared A.; O’CONNELL, Ryan M. MicroRNAs and acute myeloid leukemia: therapeutic implications and emerging concepts. Blood, The Journal of the American Society of Hematology, v. 130, n. 11, p. 1290-1301, 2017.
- GIURIATTI, Tiago et al. Análise do P&D Brasileiro com Uso da Nanotecnologia em Medicamentos para Uso Humano: pesquisas, tecnologias e produtos. Cadernos de Prospecção, v. 13, n. 1, p. 225-225, 2020. Acesso em: 27 de Nov., 2022.
- NATIONAL CANCER INSTITUTE (NCI). Cancer Stat Facts: Leukemia — Acute Myeloid Leukemia (AML). Bethesda: 2017. Disponível em: <https://seer.cancer.gov/statistics/preliminary-estimates/>. Acesso em: 19 de out., 2022.
- DA SILVA MARQUES, Erivaldo Marcos et al. Manifestações Clínicas e Diagnóstico Laboratorial da Leucemia Mieloide Aguda (LMA). Mostra Científica em Biomedicina, v. 3, n. 1, 2018.
- OLIVEIRA, Caroline Cirolini; CASTRO, Caroline Quintana; HÖRNER, Rosmari. Perfil epidemiológico de pacientes com leucemia mieloide aguda: Uma revisão integrativa. Saúde (Santa Maria), 2021.
- LOPES, Letícia Paula et al. Abordagens do tratamento da leucemia mieloide aguda: revisão integrativa Approaches to treatment of acute myeloid leukemia: integrative review. Brazilian Journal of Development, v. 8, n. 2, p. 9586-9601, 2022.
- PINHEIRO, Pedro. Leucemia: tipos, sintomas, e tratamento, 2022. Disponível em: https://www.mdsaude.com/hematologia/leucemia/. Acesso em: 30 Abr., 2023.
- BAIN, Barbara J.; BÉNÉ, Marie C. Morphological and immunophenotypic clues to the WHO categories of acute myeloid leukaemia. Acta haematologica, v. 141, n. 4, p. 232-244, 2019.
- LABORATÓRIO DE ANÁLISES CLÍNICAS E ENSINO EM SAÚDE (LACES). Atlas de hematologia. Goiás: Universidade Federal de Goiás – UFG, 2017. Disponível em: https://laces.icb.ufg.br/p/20026-leucocitos. Acesso em: 14 Abr., 2023.
- CORADDUZZA, Donatella et al. Role of Nano-miRNAs in Diagnostics and Therapeutics. International Journal of Molecular Sciences, v. 23, n. 12, p. 6836, 2022.
- LOW, Sze Shin et al. Recent progress in nanomaterials modified electrochemical biosensors for the detection of MicroRNA. Micromachines, v. 12, n. 11, p. 1409, 2021.
- LANDIM, Marcela G.; OMBREDANE, Alicia S.; JOANITTI, Graziella A. Aplicações da Nanotecnologia na prevenção, no diagnóstico e no tratamento do câncer. Nanotecnologia: considerações em materiais, saúde e meio ambiente (LMA), p. 220, 2022.
- SILVA, Gabriela Bomfim da. Os benefícios do exercício terapêutico para pacientes portadores de leucemia mieloide aguda hospitalizados durante a fase de tratamento quimioterápico. 2022. 43. Monografia. (Especialização em oncologia) – Hospital Central do Exército. Rio de Janeiro, 2022.
- AMERICAN CANCER SOCIETY (ACS). Chemotherapy for Acute Myeloid Leukemia (AML). Atlanta: American Cancer Society, 2018. Disponível em: https://www.cancer.org/cancer/acutemyeloidleukemia/treating/chemotherapy.html#references. Acesso em: 6 Nov., 2022.
- NEVES, Giovanna. A radioterapia pediátrica no tratamento da leucemia mielóide aguda: uma revisão bibliográfica. 2021.
- SILVA, Maria Jaenny Siqueira; DE SOUZA, Pâmella Grasielle Vital Dias. Desenvolvimento de doenças e complicações após transplante de medula óssea. Brazilian Journal of Development, v. 6, n. 12, p. 98279-98294, 2020.
- ASSOCIAÇÃO BRASILEIRA DE LINFOMA E LEUCEMIA (ABRALE). Manual – LMA. Tudo sobre a Leucemia Mieloide Aguda. São Paulo, 2020. Disponível em: https://www.abrale.org.br/wp-content/uploads/2020/11/Manual-de-LMA.pdf. Acesso em: 30 Abr., 2023.
- COSTA, Alessandro Mariano; SILVA, Viviane Viana. Estratégias nanotecnológicas para diagnóstico e tratamento do câncer. Revista Saúde e Meio Ambiente, v. 5, n. 2, p. 1-13, 2017.
- SILVA, Geilza Carla De Lima; DOS SANTOS, Alanna Silva; DA SILVA, Sabrina Barbosa. Micrornas no câncer: uma abordagem molecular, terapêutica e evolutiva. Anais II CONBRACIS. Campina Grande: Realize Editora, 2017. Disponível em: <https://editorarealize.com.br/artigo/visualizar/29417>. Acesso em: 04 Abr., 2023.
- SILVA, Flávia Martins; CONCEIÇÃO, Rogério Reis. Avanços e perspectivas no diagnóstico molecular da leucemia mieloide aguda: revisão sistemática. Rev. bras. anal. clin, p. 232-238, 2021.
- HUPFFER, Haide Maria; LAZZARETTI, Luisa Lauermann. Nanotecnologia e sua regulamentação no Brasil. Revista Gestão e Desenvolvimento, v. 16, n. 3, p. 153-177, 2019.
¹Universidade Anhembi Morumbi
