THE USE OF CYTOLOGY IN THE DIAGNOSIS OF DERMATOPHYTOSIS IN DOGS: REPORT OF FOUR CASES
REGISTRO DOI: 10.5281/zenodo.8397333
Nathali Roberta Alves Dos Santos¹
Alana Pereira Cabral de Souza2
Natália Lôres Lopes3
RESUMO
A dermatofitose é uma dermatopatia infecto-contagiosa causada por um dermatófito zoofílico mais comumente do gênero Microsporum canis. A transmissão ocorre através do contato direto do esporo da doença por meio do hospedeiro infectado ou portador assintomático, por fômites e restos epiteliais infectados no ambiente. Esta afecção é caracterizada por infecção do pelo, unha e estrato córneo que comumente acometem cães, gatos, outros animais domésticos e humanos. Cerca de 30% das infecções em humanos são de, mediante a transmissão realizada por um animal, representando assim, um risco potencial para as pessoas. Entretanto, o diagnóstico precoce desta doença favorece tanto o tratamento e o prognóstico do paciente, quanto a limitação da disseminação do fungo uma vez que tratado. A citologia corada por panótico é uma metodologia de diagnóstico que possui baixo custo, realizada de forma rápida e de simples execução, pois permite rapidez nas ações terapêuticas favorecendo o prognóstico do paciente, visto que a cultura fúngica mesmo sendo determinada como padrão ouro, demonstra resultados definitivos a partir de três semanas de cultivo. Contudo, o resultado positivo para dermatófitos na citologia, não exclui a realização da cultura fúngica para determinação da espécie e melhor aplicabilidade do tratamento. O objetivo do presente estudo é relatar quatro casos atendidos no Rio de Janeiro onde cães de raças e idades variadas apresentaram lesões cutâneas e após realização da citologia de pele pelo método de escarificação, foram diagnosticados com dermatofitose, com confirmação através de cultura fúngica. O uso da citologia por escarificação demonstrou ser efetivo na realização do diagnóstico de dermatofitose, sendo uma forma de possibilitar o início do tratamento de forma mais rápida.
Palavras-chave: Canino; citopatologia; dermatose; Microsporum canis; zoonose.
ABSTRACT
Dermatophytosis is an infectious dermatopathy caused by a zoophilic dermatophyte, most commonly of the genus Microsporum canis. Transmission occurs through direct contact of the disease spore via the infected host or asymptomatic carrier, via fomites and infected epithelial remains in the environment. This condition is characterized by infection of the hair, nails and stratum corneum and commonly affects dogs, cats, other domestic animals and humans. Around 30% of infections in humans are transmitted by an animal, thus representing a potential risk for people. However, early diagnosis of this disease favors both treatment and the patient’s prognosis, as well as limiting the spread of the fungus once it has been treated. Pancreatic cytology is a low-cost diagnostic method that is quick and simple to perform, as it allows for rapid therapeutic action and favors the patient’s prognosis, since fungal culture, even though it is determined as the gold standard, shows definitive results after three weeks of culture. However, a positive cytology result for dermatophytes does not exclude the need for a fungal culture to determine the species and improve treatment. The aim of this study is to report four cases seen in Rio de Janeiro where dogs of varying breeds and ages presented with skin lesions and, after skin cytology using the scarification method, were diagnosed with dermatophytosis, confirmed by fungal culture. The use of cytology by scarification proved to be effective in diagnosing dermatophytosis, and is a way of enabling treatment to be started more quickly.
Keywords: Canine; cytopathology; dermatosis; Microsporum canis; zoonosis.
INTRODUÇÃO
A dermatofitose é uma dermatopatia infecto-contagiosa causada por um dermatófito zoofílico da espécie Microsporum canis, Nannizia gypsea, Trichophyton mentagrophytes, sendo o Microsporum canis o agente mais recorrente.
Dificilmente a dermatofitose nos animais é ocasionada por dois diferentes tipos de fungos simultâneamente (MEDEIROS, 2009). O fungo causador da dermatofitose se insere na família Arthrodermataceae, onde são septados, filamentosos, hialinos e queratinolíticos (MUKHERJEE et al., 2003).
Os dermatófitos podem ser classificados a partir de seus hospedeiros, sendo geofílicos quando habitam e se multiplicam no solo quando associado a material queratinoso em decomposição e podem causar inflamação intensa nos pacientes acometidos; os que são classificados como zoofílicos são ambientados ao pelo e pele de animais, e os antropofílicos são adaptados à pele e anexos de humanos e causam pouca ou nenhuma reação inflamatória. Os dermatófitos zoofílicos e os antropofílicos são incapazes de se multiplicar no solo, e os zoofílicos frequentemente causam menos reação inflamatória (QUINN et al., 2005).
O contágio de forma direta do M. canis ocorre em 30% dos casos em humanos. (LARSSON et al., 1994). A transmissão ocorre através do contato direto do esporo da doença por meio do hospedeiro infectado, portador assintomático, e por fômites e restos epiteliais infectados no ambiente, como por exemplo, pentes, escovas, camas, que podem persistir durante anos sendo altamente resistentes ao calor (BETANCOURT et al., 2009; MACIEL; VIANNA, 2005). Contudo, os cães e gatos possuem papel importante na transmissão da doença mediante maior contato com humanos. Animais jovens, idosos e imunossuprimidos podem ser fonte de infecção da dermatofitose por serem frequentemente acometidos. (BICHARD; SHERDING, 2008). Os dermatófitos possuem hifas que se fragmentam e são responsáveis pela lesão da pele por destruir a queratina superficial, sendo elas, estruturas infecciosas que se desenvolvem e dão origem a mais hifas, chamadas também como artroconídios. Esta infecção pode ser facilitada se a pele tiver sofrido atritos como por exemplo picada de artrópodes, assim como o aumento da temperatura e umidade. Os artroconídios formam lesões circulares pois crescem centrifugamente a partir da lesão (QUINN et al., 2005).
Os metabólitos se propagam pela epiderme causando reação inflamatória e de hipersensibilidade, que são responsáveis pelo aparecimento das lesões (OLIVEIRA et al., 2015).
Nos animais domésticos, os sinais clínicos encontrados frequentemente são lesões circulares, alopecia, crostas, escamas e pode haver qualquer combinação de perda de pelo, pápulas, eritema, obstrução folicular, hiperpigmentação e mudanças no crescimento/aparência das unhas. A intensidade do prurido tem relação com a presença de ectoparasitas ou de reações de hipersensibilidade (NEVES et al., 2011). As lesões dermatológicas apresentam-se de forma localizadas, multi focais ou generalizadas. A manifestação dos sinais clínicos ocorre em torno de 21 dias após o contato com fungo, sendo a região da cabeça e extremidades mais comumente atingidas (RAMSEY; TENNANT, 2010; MORIELLO, 2014).
O diagnóstico desta afecção deve ser a junção do exame clínico, histórico detalhado do paciente, sinais clínicos, microscopia e cultura fúngica, com o objetivo de obter um diagnóstico preciso e evitar falsos positivos e negativos (LOPES; DANTAS, 2016). A cultura fúngica é o padrão ouro para o diagnóstico de dermatofitose determinado por Bond (2010), entretanto a citologia cutânea é um método simples, de baixo custo e que possibilita o diagnóstico rápido e sem complicações.
O exame citológico é realizado com frequência na rotina de exames dermatológicos que pode ser realizada pelo profissional médico veterinário ou encaminhada ao patologista clínico para comprovação. A citologia permite a diferenciação de diagnósticos infecciosos, neoplásicos e inflamatórios devido ao padrão e tipo celular observado em cada afecção. A citologia pode ser confeccionada a partir do método esfoliativo, aspirativo ou por imprint (YAĞMUR et al., 1997). Na citologia para pesquisa de dermatófito, é realizado o método esfoliativo, onde podem ser visualizados artroconídeos, que aparecem usualmente como esferas redondas e são envoltos por uma cápsula que limita a coloração e assim, o aparecimento de um halo claro e hifas que são estruturas filamentosas uniformes (MENDELSOHN; ROSENKRANTZ; GRIFFIN, 2006).
Em relação a cultura fúngica, as amostras podem ser obtidas por meio da escarificação, raspados de pele do paciente ou amostras de pelo coletadas por avulsão (BOURGUIGNON et al., 2013; CARDOSO; FRIAS; KOZUSNY-ANDREANI, 2013), além disso o resultado definitivo é obtido a partir de 3 semanas de incubação (LOPES; DANTAS, 2016). Apesar da citologia ser pouco difundida para o uso no diagnóstico da dermatofitose, a mesma representa uma relevância na intervenção da afecção, para o início do tratamento visto que a cultura fúngica, considerada padrão ouro por Bond (2010), apresenta resultado após 3 semanas de incubação.
DESCRIÇÃO DO CASO
CASO 1
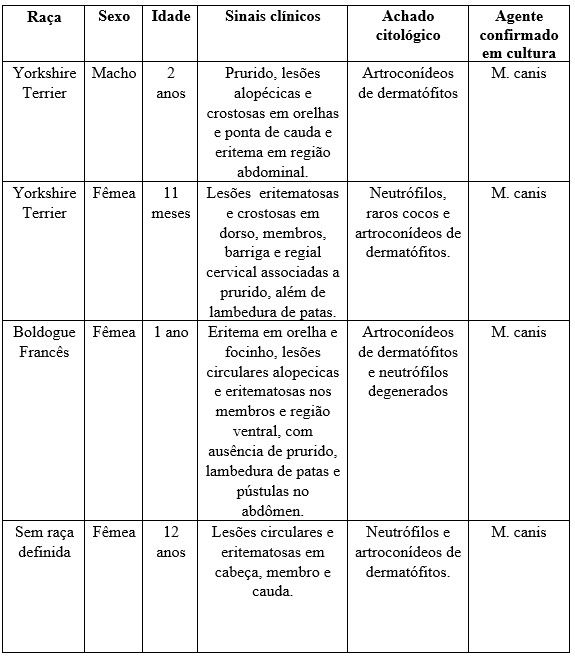
Foi atendido um cão, macho de dois anos e quatro meses de idade da raça Yorkshire Terrier. O cão apresentava histórico de prurido e lesões cutâneas recorrentes com queda de pelo acentuada. No exame físico, o paciente apresentou lesões alopécicas e crostosas em orelhas e ponta de cauda (FIGURA 1A e 1B) e eritema em região abdominal (FIGURA 1C).
A partir da suspeita de dermatofitose, foi realizado exame parasitológico de raspado cutâneo superficial e profundo (EPRC) com objetivo de descartar dermatopatias parasitárias, impressão em fita de acetato para observar a presença de possíveis agentes patogênicos e exame citológico de pele nas áreas de lesões, coletados pelo método de escarificação, que foram posteriormente depositados em lâminas de microscopia, corados com panótico rápido® e observados na objetiva de 100x.
No exame citológico observou-se numerosas estruturas redondas e ovóides de citoplasma basofílico com halo periférico, sendo compatível com artroconídeos de dermatófitos (Figura 1D). E com o objetivo de confirmar o diagnóstico observado na citopatologia de pele foi realizado a cultura fúngica para dermatófitos.
No exame parasitológico de raspado cutâneo e exame parasitológico de pelame descartou-se a presença de ácaros dos gêneros Sarcoptes spp. e Demodex spp. Na impressão com fita de acetato não foi constatado nenhum agente patogênico. Na cultura fúngica foi observado, após 30 dias da semeadura, a presença de fungos dermatófitos compatíveis com Microsporum canis, como demonstrado na tabela 1.
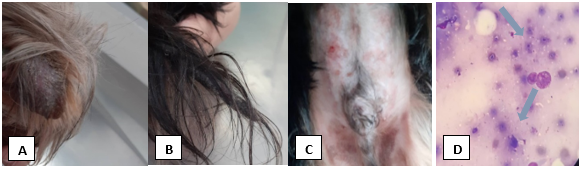
Figura 1A: Alopecia e crostas em pavilhão auricular de cão da raça Yorkshire Terrier diagnosticado com dermatofitose. Figura B: Cauda alopécia e crostosa de canino da raça Yorkshire Terrier diagnosticado com dermatofitose Figura C: Eritemas circulares em região abdominal de cão da raça Yorkshire Terrier diagnosticado com dermatofitose. Figura D: Fotomicrografia de avaliação citológica do cão, macho, demonstrando estruturas compatíveis com artroconídeos de dermatófitos, corado por panóptico rápido, aumento de 1000 x, como é demonstrado nas setas azuis.
Fonte: Arquivo Pessoal, 2021.
CASO 2
Uma cadela, fêmea de 11 meses de idade, da raça Yorkshire Terrier apresentava histórico de lesões eritematosas em dorso, membros, barriga e região cervical associadas a prurido, além de lambedura de patas como demonstra na tabela 1. No exame físico, foi constatada a presença de lesões crostosas em região cervical e membro posterior direito. (FIGURA 2A e 2B).
A partir da suspeita de dermatofitose, foi realizado exame parasitológico de raspado cutâneo superficial e profundo (EPRC) e impressão em fita de acetato para exclusão de ácaros onde o resultado foi negativo. Em seguida, foi realizado exame citológico das lesões, coletadas por escarificação, que foram posteriormente depositados em lâminas de microscopia e corados pelo método panótico rápido. Sendo analisados na ótica de 100x, onde foram observados neutrófilos, macrofagos, raros cocos e numerosas estruturas ovóides de citoplasma basofílico com halo periférico, sendo compatível com artroconídeos de dermatófitos (FIGURA 2C).
Contudo, com o objetivo de confirmar o diagnóstico observado na citopatologia de pele, foi realizada a cultura fúngica para dermatófitos. Sendo verificados, após 30 dias da semeadura, a presença de fungos dermatófitos compatíveis com Microsporum canis.
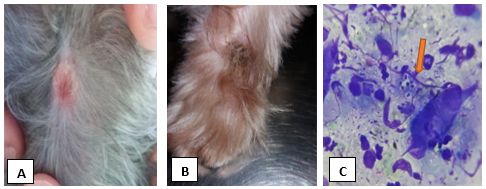
Figura 2A: Lesão circular e eritematosa em região cervical de cadela da raça Yorkshire Terrier diagnosticada com dermatofitose. Figura B: Lesão circular, crostosa em região de membro direito de cadela da raça Yorkshire Terrier diagnosticada com dermatofitose. Figura C: Fotomicrografia de avaliação citológica do cadela, demonstrando estruturas compatíveis com artroconídeos de dermatófitos, corado por panóptico rápido, aumento de 1000 x, como demonstra na seta vermelha.
Fonte: Arquivo pessoal, 2017.
CASO 3
Uma cadela, fêmea de um ano de idade, da raça Buldogue Francês, apresentava histórico de eritema em orelha e focinho. Após banho com shampoo com base de corticoide, o animal apresentou lesões circulares alopécicas e eritematosas nos membros e região ventral, com ausência de prurido e lambedura de patas (FIGURA 8 e 9) e pústulas no abdômen. Foi confeccionado impressão com fita de acetato para investigação de agentes patogênicos e citologia de pele através de escarificação, seguida pela deposição em lâminas, corados pelo método diff quick (panótico rápido®) e observação na objetiva de 100x.
A fita apresentou resultado negativo, contudo na citologia de pele foi observado estruturas circulares com halo periférico compatíveis com artroconídios e neutrófilos degenerados (FIGURA 10). Para confirmar o diagnóstico e identificar a espécie do agente, foi realizada a cultura fúngica para pesquisa de dermatófitos. Após 30 dias de cultivo, foi constatado a presença do dermatófito M. canis como demonstrado na Tabela 1.
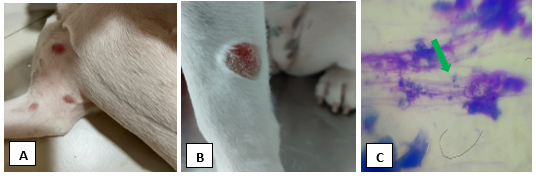
Figura 3A: Lesões esféricas e eritematosas em membro torácico de cadela da raça buldogue francês diagnosticada com dermatofitose. Figura B: Lesão circular e eritematosa em região de membro esquerdo de cadela da raça buldogue francês diagnosticada com dermatofitose. Figura C: Fotomicrografia de demonstrando estruturas circulares com halo periférico como demonstra em seta verde, realizado em exame citológico com aumento de 1000 x.
Fonte: Arquivo pessoal, 2023.
CASO 4
No Rio de Janeiro foi atendido uma cadela, fêmea de doze anos de idade da sem raça definida. A cadela apresentava histórico de lesões no corpo associadas a prurido. No exame físico, o paciente apresentou lesões circulares e eritematosas em cabeça (Figura 4A), membro e cauda (Figura 4B)
Foi realizado EPRC com objetivo de descartar dermatopatias parasitárias causadas por ácaros, por exemplo, dos gêneros Sarcoptes spp. e Demodex spp., onde o resultado foi negativo para ambos. Na impressão em fita de acetato, não apresentou agentes patogênicos. Foi realizado também exame citológico de pele, sendo as amostras obtidas das bordas das lesões, coletadas por escarificação, e depositados em lâminas de microscopia, corados com panóptico rápido® e observados na objetiva de 100x.
No exame citológico observou-se macrófagos, neutrófilos e numerosas estruturas redondas de citoplasma basofílico com halo periférico, sendo compatível com artroconídeos de dermatófitos (Figura 4C). E para confirmar o diagnóstico observado na citopatologia de pele foi realizado a cultura fúngica para dermatófitos onde após 30 dias da semeadura, a presença de fungos dermatófitos compatíveis com Microsporum canis.
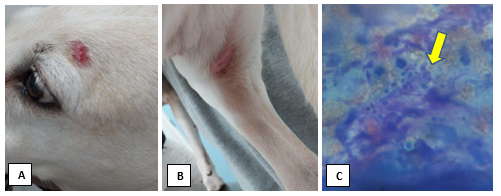
Figura 4A: Lesão eritematosa em região acima dos olhos em cadela sem raça definida diagnosticada com dermatofitose. Figura B: Lesão circular, eritematosa e alopécica em membro de cadela sem raça definida diagnosticada com dermatofitose. Figura C: Fotomicrografia de citologia de pele com aumento de 1000 x apresentando estruturas circulares com halo periférico como demonstra em seta amarela. Fonte: Arquivo pessoal, 2023.
Tabela 1: Demonstrativo dos dados obtidos dos pacientes diagnosticados com dermatofitose.
DISCUSSÃO
A predisposição da dermatofitose envolve cães da raça yorkshire terrier, esta raça está suscetível a forma generalizada da afecção (MASON; CARLOTTI, 2002) e também animais jovens, levando em consideração o estresse da prenhez e lactação devido ao quadro de imunossupressão (MEDEIROS; CREPALDI; TOGNOLI, 2009). Os cães supracitados no relato envolvem a raça yorkshire em 2 dos 4 casos e são em sua maioria cães jovens. O estudo de Miller et al. 2013, relata que as lesões destes animais são frequentemente em região de face, orelhas, patas e cauda, como descrito no presente artigo.
Nos animais domésticos, os sinais clínicos apresentados na dermatofitose são lesões circulares, alopecia, crostas, perda de pelo, pápulas, eritema, obstrução folicular, hiperpigmentação e mudanças no crescimento/aparência das unhas. (NEVES et al., 2011). Sendo estas lesões compatíveis com os casos relatados no trabalho, onde apresentaram alopecia, crostas, eritema, pápulas. Para o diagnóstico de dermatofitose canina, há diversos exames a serem realizados, contudo é essencial a exclusão de outras dermatopatias devido os sinais clínicos serem inespecíficos (MORIELLO et al., 2017).
Para isso, em todos os animais, foram realizados exames de triagem como o exame parasitológico de raspado cutâneo e impressão em fita de acetato, onde foram descartadas a presença de ácaros do gênero demodex e sarcoptes em todos os casos e sem demais agentes patogênicos. O diagnóstico da dermatofitose inclui a associação de achados clínicos e anamnese com exames complementares como a lâmpada de wood, exame citológico e cultura fúngica (MORIELLO et al., 2017). Entretanto a cultura fúngica é determinada por Bond (2010), padrão ouro para o diagnóstico de dermatofitose, pois a mesma é considerada a técnica mais sensível entre as disponíveis e demonstra a espécie do fungo causador da patogênese. Contudo, Robert e Pihet (2008) afirmam que a citologia pode ser utilizada como ferramenta auxiliar no diagnóstico da dermatofitose, podendo apresentar estruturas como artroconídeos e dermatófitos.
No presente estudo, foi realizado a metodologia de Morielo et al. (2017) onde foi feita a associação da citologia junto a cultura fúngica, pois a citologia corada pelo panótico rápido é uma metodologia de baixo custo, realizada de forma rápida e de simples execução, o que favorece o prognóstico visto que é possível a intervenção da doença com o início das ações terapêuticas, devido a cultura fúngica mesmo sendo determinada como padrão ouro, apresenta resultados definitivos apenas a partir de 21 dias de incubação, retardando o início do tratamento (LOPES; DANTAS, 2016).
Nos relatos descritos no presente estudo, foram encontrados artroconídeos de dermatófitos na citologia por escarificação, que ratifica o trabalho produzido por Moriello et al. (2017) onde descreve a visualização de estruturas compatíveis com artroconídios fúngicos e com o trabalho de Albanese e Caruso (2007) onde descrevem o mesmo padrão citológico em 90% de seus pacientes. Porém, o resultado da citologia não exclui a importância da realização da cultura fúngica para determinação da espécie e melhor aplicabilidade do tratamento (GUAGUÈRE; BENSIGNOR, 2005), assim como para acompanhamento da resposta terapêutica. Mediante isto, amostras de pele das lesões e pelos foram coletados dos quatro animais relatados e enviados ao laboratório para realização de cultura fúngica onde o agente M. canis foi confirmado em todos os casos relatados, sendo o agente dermatófito mais isolado e observado na rotina clínica (BALDA et al., 2007). O Microsporum canis é o agente mais comum e gera afecção em variados continentes como nas Américas, Europa, Ásia, África e Oceania (BETANCOURT et al., 2009)
CONCLUSÃO
O uso da citologia por escarificação demonstrou ser efetivo na realização do diagnóstico de dermatofitose nos casos relatados. A coloração panótico rápido tem um menor custo, uma execução facilitada e é um método simples e não invasivo, possibilitando assim, o uso na rotina da clínica veterinária. Além disso possibilita o início do tratamento de forma mais rápida. Mais estudos demonstrando a eficácia da técnica para essa enfermidade são necessários.
REFERÊNCIAS
ALBANESE, F.; CARUSO, C. Il Kerion dermatofitico: aspetti eziologi, clinici, diagnostici e terapeutici in 39 cani. Veterinaria, v. 21, n. 5, p. 1-10, 2007.
BALDA A.C.; OTSUKA M.; LARSSON C.E; A clinical trial using griseofulvin and terbinafine in the treatment of canine and feline dermatophytosis. Ciencia Rural, v. 37, p. 750, 2007.
BETANCOURT, O.; SALAS, V.; OTAROLA, A.; ZAROR, L.; SALAS, E.; NEUMANN, J. Microsporum canis en gatos dermatológicamente sanos em Temuco, Chile. Revista Iberoamericana de Micología, v. 26, n. 3, p. 206-210, 2009.
BIRCHARD, S. J.; SHERDING, R. G. Manual Saunders e clínica de pequenos animais. São Paulo: Roca, 2008.
BOND, R. Superficial veterinary mycoses. Clinics in Dermatology, v. 28, n. 2, p. 226–236, 2010.
BOURGUIGNON, E.; GUIMARÃES, L. D.; FERREIRA. T. S.; FAVARATO. E. S. Dermatology in dogs and cats. London: Insights from Veterinary Medicine, 2013. Cani. Veterinaria, v. 21, n. 5, p. 9-18, 2007.
CARDOSO, N. T.; FRIAS, D. F. R; KOZUSNY-ANDREANI, D. I. Isolamento e identificação de fungos presentes em pelos de cães hígidos e com sintomas de dermatofitose, no município de Araçatuba, São Paulo. Archives of Veterinary Science, v. 18, n. 3, p. 46-51, 2013.
GUAGUÈRE, É.; BENSIGNOR, E. Terapêutica dermatológica do cão. São Paulo: Roca, p. 196-199, 2005.
LARSSON, C. E.; NAHAS, C. R.; LEDON, A. L. B. P.; GAMBALE, W.; PAULA, C. R.; CORREA, B. Ringworm in domestic cats in São Paulo, Brazil, between 1981-1990. Feline Practice, v. 22, n. 1, p. 219-222, 1994.
LOPES, C. A.; DANTAS, W. M. F. Dermatofitose em cães e gatos – Revisão de literatura. Revista Científica Univiçosa, v. 8, n. 1, p. 292-297, 2016.
MACIEL, A. S.; VIANNA, A. J. Dermatofitose em cães e gatos – Parte 1. Clínica Veterinária, v. 56, n. 1, p. 48-56, 2005.
MASON, K.; CARLOTTI, D. Dermatophytosis workshop. Oxford: Blackwell Publishing, 2002.
MEDEIROS, F.; CREPALDI, N.; TOGNOLI, L. Dermatófitos – Revisão de Literatura. Revista Científica Eletrônica de Medicina Veterinária, v. 7, n. 12, p. 1-5, 2009.
MENDELSOHN, C.; ROSENKRANTZ, W.; GRIFFIN, C. E. Practical cytology for inflammatory skin diseases. Clinical techniques in small animal practice, v. 21, n. 3, p. 117–127, 2006.
MORIELLO, K. A.; COYNER, K. S; PATERSON, S.; MIGNON, B. Diagnosis and treatment of dermatophytosis in dogs and cats. Veterinary Dermatology, v. 28, n. 1, p. 266-295, 2017.
MORIELLO, K. Feline dermatophytosis: Aspects pertinent to disease management in single and multiple cat situations. Journal of Feline Medicine and Surgery, v. 16, n. 5, p. 419-431, 2014.
MUKHERJEE, P. K.; LEIDICH, S. D.; ISHAM, N.; LEITNER, I.; RYDER, N. S.; GHANNOUM, M. A. Clinical Trichophyton rubrum strain exhibiting primary resistance to terbinafine. Antimicrobial Agents and Chemotherapy, v. 47, n. 1, p. 82-86, 2003.
MILLER, W. H.; GRIFFIN C.; CAMPBELL, K. Small Animal Dermatology. 7 ed. Elsevier Health Sciences, p. 948, 2013.
NEVES, R. C. S. M.; DA CRUZ, F. A. C. S; LIMA, S. R.; TORRES, M. M; DUTRA, V.; SOUSA, V. R. F. Retrospectiva das dermatofitoses em cães e gatos atendidos no Hospital Veterinario da Universidade Federal de Mato Grosso, nos anos de 2006 a 2008. Ciencia Rural, v. 41, n. 8, p. 1-6, 2011.
OLIVEIRA, L. M. B; PINHEIRO A. Q.; MACEDO I. T. F.; SILVAI N. G.; MOREIRA O. C.; SILVA B.W.L.; Dermatofitose canina causada pelo fungo antropofílico Trichophyton tonsurans – Relato de caso. Revista Brasileira de Higiene e Sanidade Animal, v. 9, n. 1, p. 91-98, 2015.
QUINN, P. J.; MARKEY, B. K.; CATER, M. E.; DONNELLY, W.; LONARD, F. C. Microbiologia veterinária e doenças infecciosas. Porto Alegre: Artmed, 2005.
RAMSEY, I. K.; TENNANT, J. R. B. Manual de doenças infecciosas em cães e gatos. Sao Paulo: Roca, 2010.
ROBERT, R.; PIHET, M. Conventional methods for the diagnosis of dermatophytosis. Mycopathologia, v. 166, p. 295–306, 2008.
YAĞMUR, M.; ERSÖZ, C.; ERSÖZ, T. R.; VARINLI S. Brush technique in ocular surface cytology. Diagnostic Cytopathology, v. 17, n. 2, p. 88-91, 1997.
1Discente da graduação de Medicina Veterinária da Universidade Iguaçu (UNIG), Rio de Janeiro-RJ, Brasil.
2Discente da graduação de Medicina Veterinária da Universidade Iguaçu (UNIG), Rio de Janeiro-RJ, Brasil.
3Docente da graduação de Medicina Veterinária da Universidade Iguaçu (UNIG), Rio de Janeiro-RJ,Brasil (Orientadora)
