THE ELECTROCHEMICAL POTENTIAL IN THE ALGAE/ALGAE RELATIONSHIP AND ITS EXCRETION
REGISTRO DOI:10.5281/zenodo.13126665
Caetano, Elise Loren1
Meccheri, Fabrício Sebastiani2
RESUMO
Luigi Galvani, Alessandro Volta e Michael Faraday foram pioneiros no estudo da interação entre eletricidade e organismos vivos. Galvani observou correntes elétricas em rãs dissecadas, enquanto Volta atribui esse fenômeno à presença de metais e fluidos nos tecidos animais. Posteriormente, Faraday propôs que a condução elétrica ocorre por meio da decomposição e recomposição de moléculas. Considerando que as microalgas excretam polissacarídeos, que podem ser decompostos pela água e pela agitação da solução, são liberados íons e criados gradientes de densidade. Isso resulta na formação de agregados de cargas positivas (cátions) e negativas (ânions). Com base nesses princípios, foi desenvolvido um protótipo de sistema eletroquímico que envolveu a seleção de diferentes espécies de microalgas em soluções distintas, conectadas por eletrodos. O objetivo principal foi observar a relação entre as espécies de microalgas, o meio em que estão presentes e a voltagem gerada como resultado das interações eletroquímicas. Esse estudo contribuiu para uma compreensão mais aprofundada dos processos biológicos e químicos envolvidos na geração de eletricidade por organismos vivos e suas excreções.
Palavras-chaves: sistema eletroquímico; microalgas; fluxo de corrente; degradação e recomposição de polissacarídeos.
ABSTRACT
Luigi Galvani, Alessandro Volta and Michael Faraday were pioneers in the study of the interaction between electricity and living organisms. Galvani observed electrical currents in dissected frogs, while Volta attributed this phenomenon to the presence of metals and fluids in animal tissues. Later, Faraday proposed that electrical conduction occurs through the decomposition and recomposition of molecules. Considering that microalgae excrete polysaccharides, which can be decomposed by water and agitation of the solution, ions are released and density gradients are created. This results in the formation of aggregates of positive charges (cations) and negative charges (anions). Based on these principles, a prototype electrochemical system was developed that involved the selection of different species of microalgae in different solutions, connected by electrodes. The main objective was to observe the relationship between microalgae species, the environment in which they are present and the voltage generated as a result of electrochemical interactions. This study contributed to a deeper understanding of the biological and chemical processes involved in the generation of electricity by living organisms and their excretions.
Keywords: electrochemical system; microalgae; current flow using microalgae; degradation and recomposition of polysaccharides.
1 INTRODUÇÃO
A história da eletricidade remonta a Luigi Galvani (1737-1798), cujos experimentos com animais mortos demonstraram a geração de corrente elétrica e contração muscular quando nervos internos eram tocados por metal. Alessandro Volta (1745-1827) contribuiu ao atribuir a condução elétrica aos metais condutores e ao fluído presente nos tecidos animais, embora tenha subestimado a importância das substâncias eletrólitas (Brown & Galvani, 2007; Martins, 2000). Michael Faraday (1791-1867) posteriormente estabeleceu a relação entre eletricidade e eventos químicos, demonstrando que a condução elétrica ocorria por meio de reações químicas de decomposição e recomposição molecular (Whittaker, 1987).
Os processos químicos de decomposição e recomposição são fundamentais na biologia, como na fotossíntese, em que as algas liberam e absorvem elétrons. As algas, organismos fotossintetizantes, apresentam uma grande diversidade de adaptações morfológicas e fisiológicas, incluindo a produção de polímeros extracelulares como mucilagem, que servem como substrato para microrganismos heterotróficos (Freire-Nordi & Vieira, 1996).
Outro aspecto relevante é a decomposição e recomposição de compostos, processos químicos fundamentais que ocorrem na natureza. Durante a decomposição, um composto se fragmenta para formar pelo menos duas substâncias diferentes, enquanto na recomposição, duas ou mais substâncias reagem para formar um produto (Brown & Galvani, 2007). Esses processos são essenciais para a sobrevivência e o funcionamento dos ecossistemas, influenciando diretamente a dinâmica das populações e a disponibilidade de nutrientes (Meccheri, 2016).
Além disso, é importante destacar a complexidade dos ambientes naturais, onde há aparente homogeneidade que muitas vezes esconde uma grande diversidade de espécies e interações. Esse fenômeno é exemplificado pelo “Paradoxo do Plâncton”, destacado por Hutchinson (1961), que ressalta a coexistência de múltiplas espécies em um mesmo ambiente. Essa riqueza de interações e a complexidade dos processos biogeoquímicos nos ecossistemas aquáticos fornecem o contexto para investigar o potencial elétrico gerado pelas algas e suas interações (Odum & Barrett, 2007).
Esses processos resultam em gradientes de temperatura e densidade, afetando as concentrações de íons no meio e potencialmente gerando um potencial elétrico (Ticianelli & Gonzalez, 2013). Assim, este estudo visa investigar a possibilidade de uma relação alga/alga gerar uma carga energética, utilizando um sistema eletroquímico com três espécies de algas distintas.
2 METODOLOGIA
3.1 Organismos
Foram cedidas cepas de microalgas do banco de coleção de microalgas do Laboratório de Ficologia do Departamento de Botânica (DB) da Universidade Federal de São Carlos (UFSCar – SP), supervisionado pela Profa. Dra. Inessa Lacativa Bagatini.
-003 – Ankistrodesmus densus. Korshikov, 1953; Represa do Broa, 1979; IA2; Meio WC/c.
-009 – Chlamydomonas chlorastera. Etll; Represa do Broa, 1977; IB3; Meio F1.
-014 – Spondylosium pygmaeum. Rabenhorst; Lagoa do Infernão (EE, Jatai), 1987; IC2; Meio WC/c.
3.2 Preparo do meio de cultura
Para o preparo do meio foi utilizado a metodología de Guillard e Lorenzen (1972), no qual é adicionada 1mL de solução estoque a cada litro de água destilada para o meio Water Culture (WC), por fim se ajusta o pH para 7,0 e esterilizado por calor úmido em autoclave.
3.3 Cultivo das Espécies
As espécies mencionadas foram cultivadas em tubos de ensaio com meio sintético WC a pH 7,0 e temperatura de 23°C, sob um fotoperíodo de 12 horas e uma intensidade luminosa de aproximadamente 0,0010079726 µmol de fótons/s/m², medida utilizando um Quantameter Biospherical instrumentruments’ QSL-100. Os tubos foram esterilizados e as amostras inoculadas com uma pipeta Pasteur esterilizada em condições controladas de fluxo laminar, com esterilização adicional usando luz UV germicida. Este processo foi repetido a cada vinte dias para a manutenção das culturas (Guilard & Lorenzen, 1972).
3.4 Experimento Ⅰ: caracterização da curva de crescimento Ⅰ
Uma análise do crescimento de várias espécies de algas foi realizada por espectrofotometria ao longo de 22 dias. Após 20 dias, as amostras foram transferidas para meio sintético, e as densidades ópticas foram medidas em comprimentos de onda específicos, permitindo o monitoramento do crescimento. A replicação das amostras e medições sequenciais contribuíram para uma análise robusta dos dados. Os resultados foram representados graficamente em escala logarítmica, fornecendo percepções sobre a dinâmica de crescimento de cada espécie.
3.5 Experimento Ⅱ: caracterização da curva de crescimento Ⅱ
Na segunda fase do experimento, a metodologia foi repetida, mas com a adição de injeção de ar nos frascos de cultivo. Frascos Boyer de 1 L foram usados para cada espécie de microalga, equipados com rolhas de silicone contendo duas aberturas para tubos de vidro de borossilicato e filtros de 0,20 µm. O volume de meio sintético WC foi de 300 mL. Após a replicação das amostras em tubos de ensaio de 16 x 15 mm, estas foram transferidas para frascos Boyer de 500 mL por vinte dias, e posteriormente, para os frascos de 1 L. O crescimento foi monitorado ao longo de 25 dias, com medições de densidade óptica por espectrofotometria em intervalos regulares. Os dados foram analisados e plotados em gráficos lineares e logarítmicos para entender os padrões de crescimento em resposta à injeção de ar.
3.6 Experimento Ⅲ: Protótipo 1: Sistema Eletroquímico (Com fio de Aço Inox) – Relação alga/alga
Para o teste, um protótipo foi montado usando dois frascos Boyer de 1L, cada um com uma espécie de microalga. Os frascos foram conectados por um fio de aço inoxidável através de um tubo de borossilicato, inserido em uma rolha de silicone perfurada. Um dos furos foi usado para injeção de ar, conectado a um filtro de 0,20 µm, enquanto o outro foi para regulação de pressão, fechado com algodão para permitir apenas a entrada e saída de gases. Um conjunto de pontas de prova foi esterilizado antes da inserção da microalga. Após 20 dias de cultivo em tubos de ensaio de 16 x 15 mm, as microalgas foram transferidas para frascos de 500 mL e, após 24 horas, para os frascos de 1L. A medição de voltagem em corrente contínua (DC) começou após cinco dias e foi realizada durante cinco dias consecutivos.
3.7 Experimento Ⅳ: Protótipo 2: Sistema Eletroquímico (Com fio de Prata + fio de Aço Inox) – Relação alga/alga
Os métodos e materiais foram aprimorados com o uso de fios de prata devido à sua eficiência na condução elétrica, apesar do alto custo, optando por fios com áreas pequenas. Um suporte foi desenvolvido utilizando aço inoxidável, com pontas em formatos variados, como asas de borboleta, espirais e lisas, intercaladas até a ponta. Foi elaborada uma tabela com todas as possíveis combinações de dipolos utilizando microalgas, repetindo cada teste três vezes. Os protótipos foram testados com e sem injeção de ar e agitação magnética, com medições diárias ao longo de vinte dias úteis.
Os frascos Boyer de 1L foram montados com fios de prata sustentados por aço inoxidável, passando por tubos de borosilicato e rolhas de silicone. Um conjunto de ponta de prova foi esterilizado e inserido, dando início à medição de voltagem após cinco dias e prosseguindo por vinte dias, com medidas realizadas diariamente em dias úteis.
3.8 Experimento Ⅴ: infravermelho – ATR
Para a análise por espectroscopia ATR, foi utilizado o modelo Single Reflection ATR Accessory, que requer amostras secas devido à interferência da água na leitura. Amostras das espécies em fase de crescimento exponencial foram selecionadas e centrifugadas a 3.500 rpm por vinte minutos para separar as células do sobrenadante. Após remover o excesso de líquido, as amostras foram congeladas e, em seguida, liofilizadas a -55°C por quarenta e oito horas antes da análise no ATR.
4 RESULTADO E DISCUSSÃO
4.1 Experimento Ⅰ: caracterização da curva de crescimento Ⅰ
O estudo analisou a curva de crescimento das algas Ankistrodesmus densus e Clamydomonas chlorastera, pertencentes à classe Chlorophyceae. A Ankistrodesmus densus as quais apresentaram três fases distintas: adaptação inicial, crescimento exponencial e fase estacionária, com um aumento notável na absorvância entre 01/agosto e 04/agosto, seguido por um crescimento mais acelerado até 15/agosto. Por sua vez, a Clamydomonas chlorasteraI (Gráfico 1) passou por essas mesmas fases em um período mais curto em comparação com a Ankistrodesmus densus.
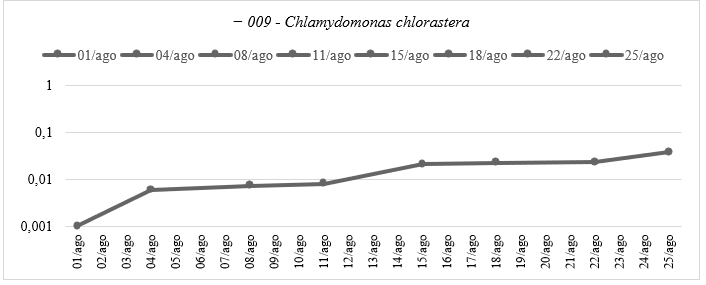
Gráfico 1: Curva de Crescimento da espécie Chlamydomonas chlorastera do Experimento Ⅰ: Caracterização da Curva de Crescimento Ⅰ – Absorbância pelo tempo do experimento, em escala logarítmica, elaborado pela autora.
Por outro lado, a espécie 009 exibiu valores mais baixos de absorvância em todas as datas de amostragem, sugerindo uma adaptação menos eficiente ao ambiente do laboratório. No caso da espécie Spondylosium pygmaeum, do grupo das Euglenophyta, observou-se um padrão de crescimento distinto (Gráfico 2), com uma fase lag prolongada após a inoculação, seguida por uma adaptação mais lenta em comparação com outras espécies, possivelmente devido ao revestimento macromolecular que atua como mecanismo de proteção (Bicudo & Menezes, 2020).
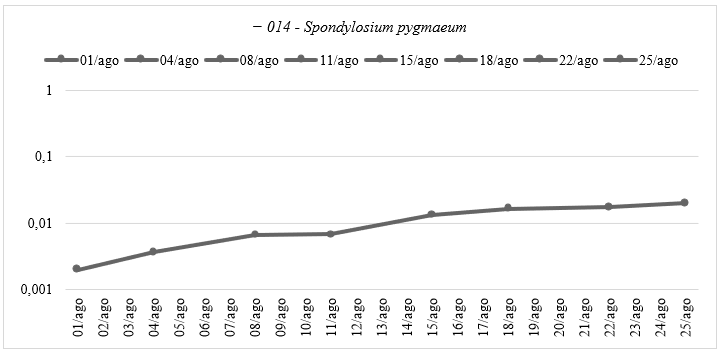
Gráfico 2: Curva de Crescimento da espécie Spondylosium pygmaeum do Experimento Ⅰ: Caracterização da Curva de Crescimento Ⅰ – Absorbância pelo tempo do experimento, em escala logarítmica, elaborado pela autora.
A espécie 014 apresentou um crescimento mais lento em comparação com as outras duas espécies estudadas. Entre 01/agosto e 04/agosto, há um aumento modesto na absorvância, indicando um início de crescimento, seguido por um aumento mais significativo entre 04/agosto e 08/agosto. A absorvância permanece estável entre 08/agosto e 15/agosto, possivelmente indicando uma fase de estabilização do crescimento, com aumentos contínuos de absorvância de 15/agosto a 25/agosto, sugerindo um crescimento progressivo. Este experimento permitiu distinguir os períodos de crescimento de cada espécie em suas fases Lag, Exponencial e Estacionária.
4.2 Experimento Ⅱ: caracterização da curva de crescimento Ⅱ
Uma segunda curva de crescimento foi realizada para compreender o crescimento das espécies em um ambiente maior, com a injeção de ar. Os gráficos gerados a partir da leitura de absorvância na faixa específica (λ680-λ750) forneceram informações sobre a tendência de crescimento ao longo do tempo. É essencial considerar que esses dados representam apenas uma faixa específica de leitura. A curva de crescimento para a espécie 003 (Ankistrodesmus densus) esta demonstrada no Gráfico 3.
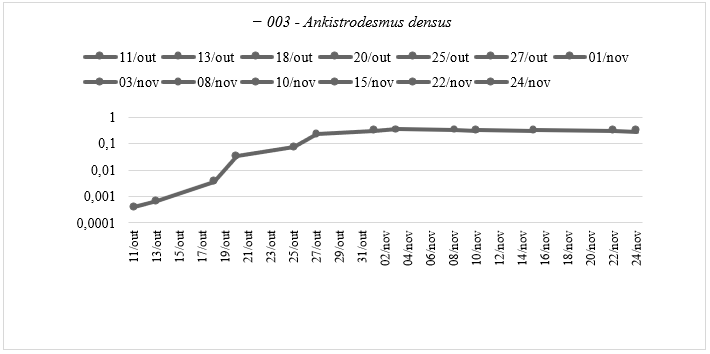
Gráfico 3: Curva de Crescimento da espécie Ankistrodesmus densus (003) do Experimento Ⅱ: Caracterização da Curva de Crescimento Ⅱ – Absorbância pelo tempo do experimento, em escala logarítmica, cada ponto de coleta se refere à um tempo de cultivo, elaborado pela autora.
A espécie 003 demonstrou um crescimento inicial lento entre 11/outubro e 18/outubro, seguido por um período de crescimento mais rápido entre 20/outubro e 01/novembro, e uma estabilização ou diminuição gradual do crescimento entre 01/novembro e 15/novembro. Comparando as duas séries de dados, observamos que a primeira curva (01/agosto a 25/agosto) começou com valores de absorvância mais altos em comparação com a segunda série (11/outubro a 24/novembro), indicando um crescimento inicial mais rápido nas primeiras datas da primeira amostragem devido ao maior volume de meio sintético WC fornecido. Ambas as séries mostram um aumento gradual na absorvância ao longo do tempo, sugerindo um crescimento contínuo das algas, embora a primeira curva tenha apresentado um nível mais alto de absorvância em comparação com a segunda.
Já os resultados para a curva de crescimento da espécie Chlamydomonas chlorastera (009) está representada no Gráfico 4.
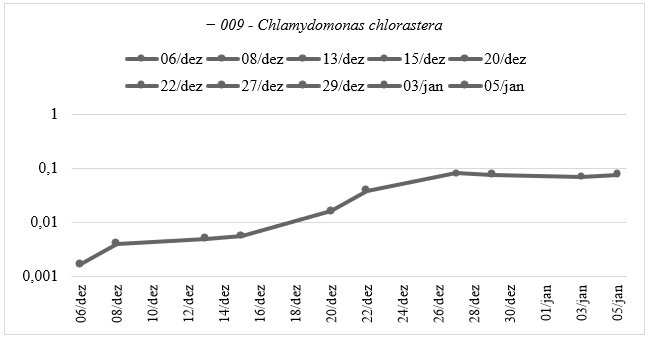
Gráfico 4: Curva de Crescimento da espécie Chlamydomonas chlorastera (009) do Experimento Ⅱ: Caracterização da Curva de Crescimento Ⅱ – Absorbância pelo tempo do experimento, em escala logarítmica, elaborado pela autora.
Na primeira curva de crescimento observamos um crescimento gradual ao longo do tempo, com valores de absorvância aumentando de forma constante. Na segunda curva de crescimento observamos um padrão de crescimento mais variável, com alguns valores de absorvância relativamente baixos, seguidos por um aumento mais pronunciado em datas posteriores. Ambos os conjuntos de dados sugerem que a 009 experimenta um crescimento mais significativo após um determinado ponto de tempo.
Os dados de da curva de crescimento para a espécie 014 está demonstrada no Gráfico 5.
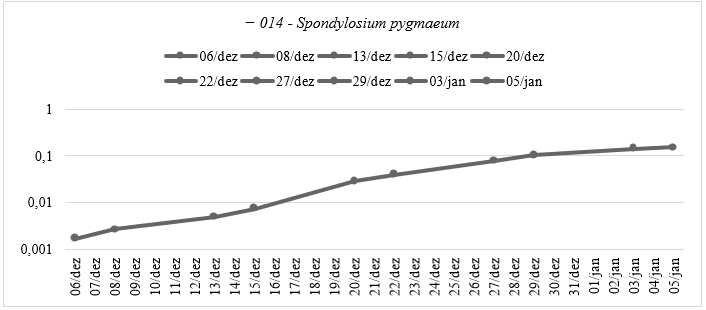
Gráfico 5: Curva de Crescimento da espécie Spondylosium pygmaeum (014) do Experimento Ⅱ: Caracterização da Curva de Crescimento Ⅱ – Absorbância pelo tempo do experimento, em escala logarítmica, elaborado pela autora.
O primeiro gráfico da 014 apresenta um aumento mais pronunciado na absorvância em um período relativamente curto (aproximadamente três semanas), enquanto nesta amostragem mostra um crescimento mais gradual e contínuo ao longo de um período mais longo (aproximadamente um mês). É importante lembrar que a absorvância é uma medida indireta do crescimento e da densidade celular.
4.3 Experimento Ⅲ: protótipo 1: sistema eletroquímico (com fio de aço inox) – relação alga/alga
Na tabela abaixo vemos os resultados obtidos através do voltímetro em um sistema contendo somente o meio WC, demonstrando que os resultados de voltagem obtidos a seguir vem do crescimento das microalgas no sistema eletroquímico.
Tabela 1: Números obtidos através da medição de voltagem e amperagem do meio de cultivo WC, utilizando um voltímetro e pontas de provas imersa na solução do Experimento Ⅲ: Protótipo 1: Sistema Eletroquímico (Com fio de Aço Inox) – Relação alga/alga, elaborado pela autora.
Medição de Voltagem e Amperagem contendo somente WC Voltagem – Corrente Contínua (DC) Amperagem – Corrente Contínua (DC) 200 200 m 20 m 200 m 0 00.1 0 0
Foi observado também a importância de um material mais eletricamente condutor no Gráfico 6.
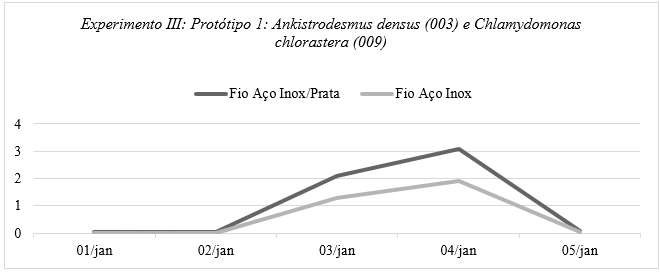
Gráfico 6: Números obtidos através da medição de voltagem e amperagem do sistema eletroquímico que continha Ankistrodesmus densus (003) em um polo e no outro Chlamydomonas chlorastera (009) utilizando um voltímetro e pontas de provas imersa na solução, por quantidade de tempo, contendo os valores máximos e mínimos obtidos no Experimento Ⅲ: Protótipo 1: Sistema Eletroquímico (Com fio de Aço Inox) – Relação alga/alga, elaborado pela autora.
4.4 Experimento Ⅳ: Protótipo 2: Sistema Eletroquímico (Com fio de Prata + fio de Aço Inox) – Relação alga/alga
Os valores expostos nos gráficos são a média do valor das tréplicas, então, foi feito tanto para os valores mínimos quanto para os valores máximos.
4.4.1 Protótipo 2: sistema desligado (sem injeção de ar e sem agitação)
Os dados de voltagem ao longo do tempo representados no Gráfico 7 mostram a variação dos valores de voltagem em diferentes datas. Foi analisado cada data e suas respectivas leituras de voltagem máxima e mínima:
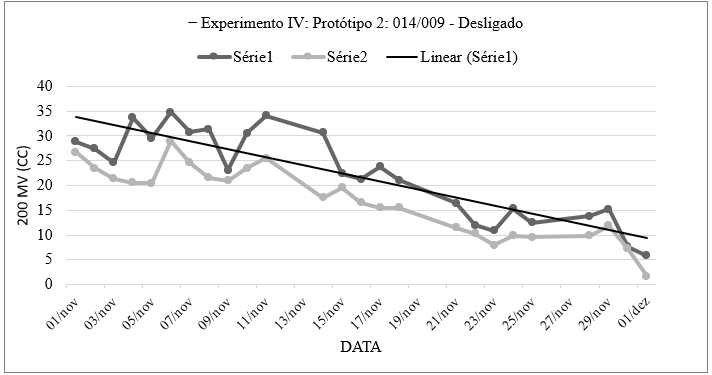
Gráfico 7: Números obtidos através da medição de voltagem e amperagem do sistema eletroquímico que continha Spondylosium pygmaeum (014) em um polo e no outro Chlamydomonas chlorastera (009) utilizando um voltímetro e pontas de provas imersa na solução, por quantidade de tempo, contendo os valores máximos e mínimos obtidos no 3.7. Experimento Ⅳ: Protótipo 2: Sistema Eletroquímico (Com fio de Prata + fio de Aço Inox) – Relação alga/alga, sem injeção de ar e sem agitação (R1a ↔ R1s + R2a ↔ R2s + R3a ↔ R3s, dividido por 3), elaborado pela autora.
Foram observadas flutuações significativas na voltagem ao longo do período analisado. Destacam-se picos de voltagem em 4 e 6 de novembro, com leituras máximas de 33,6 e 34,8 unidades, respectivamente. No entanto, em 1º de dezembro, registrou-se uma queda acentuada na voltagem, atingindo apenas 5,8 unidades, o mínimo do período. Os extremos foram observados em 6 de dezembro, com uma voltagem máxima de 34,8 unidades, e em 1º de dezembro, com um mínimo de 1,7 unidades. Essas variações indicam uma dinâmica significativa na produção de voltagem ao longo do tempo. O Gráfico 8 representa a continuidade das medições.
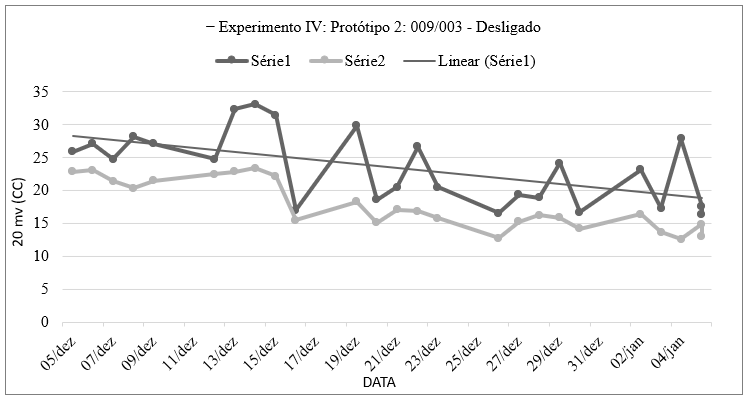
Gráfico 8: Números obtidos através da medição de voltagem e amperagem do sistema eletroquímico que continha Chlamydomonas chlorastera (009) em um polo e no outro Ankistrodesmus densus (003) utilizando um voltímetro e pontas de provas imersa na solução, por quantidade de tempo, contendo os valores máximos e mínimos obtidos no Experimento Ⅳ: Protótipo 2: Sistema Eletroquímico (Com fio de Prata + fio de Aço Inox) – Relação alga/alga, sem injeção de ar e sem agitação (R1a ↔ R1c + R2a ↔ R2c + R3a ↔ R3c, dividido por 3), elaborado pela autora.
Por meio do gráfico 8, observamos flutuações consideráveis na voltagem ao longo do período monitorado. Foi constatado variações nos períodos de 13 de dezembro, entre 16 e 19 de dezembro, 16 de dezembro e 26 de dezembro. Entretanto, em 04 de janeiro, observa-se uma das maiores diferenças entre voltagem máxima e mínima, com 27,9 e 12,6 unidades, respectivamente, sugerindo uma variação expressiva nesse dia.
4.4.2 Protótipo 2: sistema ligado (com injeção de ar e com agitação)
Os resultados provenientes da injeção de ar e agitação estão demonstrados no Gráfico 9.
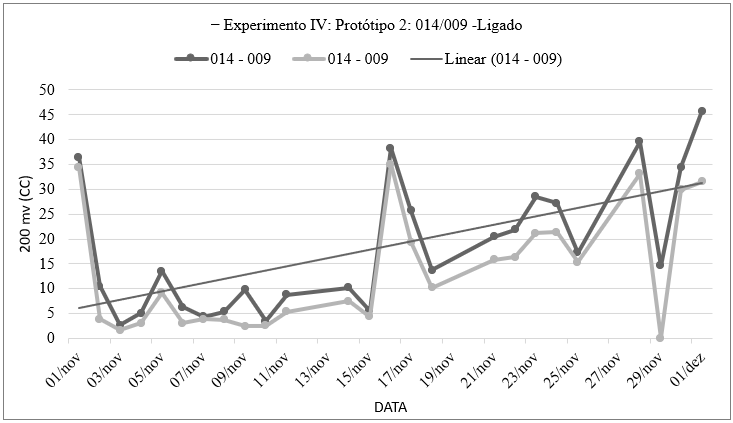
Gráfico 9: Números obtidos através da medição de voltagem e amperagem do sistema eletroquímico que continha Spondylosium pygmaeum (014) em um polo e no outro Chlamydomonas chlorastera (009) utilizando um voltímetro e pontas de provas imersa na solução, por quantidade de tempo, contendo os valores máximos e mínimos obtidos no Experimento Ⅳ: Protótipo 2: Sistema Eletroquímico (Com fio de Prata + fio de Aço Inox) – Relação alga/alga, com injeção de ar e com agitação (R1a+ ↔ R1s+ + R2a+ ↔ R2s+ + R3a+ ↔ R3s+, dividido por 3), elaborado pela autora.
De acordo com o exposto acima, em 01 de novembro, a voltagem variou entre 36,5 (máximo) e 34,5 (mínimo), indicando estabilidade. No dia seguinte, ocorreu uma flutuação mais acentuada, com valores de 10,5 (máximo) e 3,9 (mínimo). Em 16 de novembro, observou-se uma das maiores variações, com 38,3 (máximo) e 35,1 (mínimo). O dia 29 de novembro registrou uma voltagem mínima de 0. Por fim, em 01 de dezembro, a voltagem variou entre 45,7 (máximo) e 31,5 (mínimo), destacando uma variação significativa. O gráfico 10 representa a continuidade das medições.
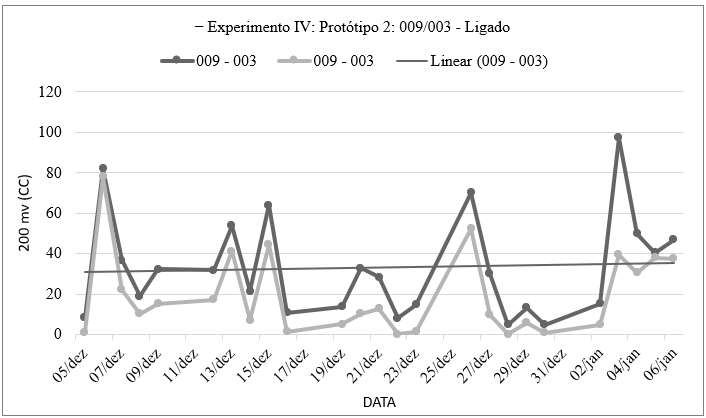
Gráfico 10: Números obtidos através da medição de voltagem e amperagem do sistema eletroquímico que continha Chlamydomonas chlorastera (009) em um polo e no outro Ankistrodesmus densus (003) utilizando um voltímetro e pontas de provas imersa na solução, por quantidade de tempo, contendo os valores máximos e mínimos obtidos no Experimento Ⅳ: Protótipo 2: Sistema Eletroquímico (Com fio de Prata + fio de Aço Inox) – Relação alga/alga, com injeção de ar e com agitação (R1a+ ↔ R1c+ + R2a+ ↔ R2c+ + R3a+ ↔ R3c+, dividido por 3), elaborado pela autora.
O gráfico 10 indica que a voltagem apresentou variações ao longo do período analisado, com diferenças moderadas a significativas entre os valores máximos e mínimos em diferentes datas. Essas flutuações indicam uma atividade metabólica variável das espécies de algas presentes no sistema eletroquímico. Durante a fotossíntese, reações redox podem gerar diferenças de potencial elétrico no sistema, enquanto a decomposição de moléculas complexas também pode influenciar as variações de voltagem (Vieira Et Al., 2008; Fogg, 1983).
Além disso, o tempo necessário para a formação do biofilme no eletrodo variou entre as espécies de algas estudadas. A Ankistrodesmus densus sp. (003) apresentou biofilme em dois dias, seguida pela Spondylosium pygmaeum sp. (014) no quinto dia e pela Chlamydomonas chlorastera sp. (009) somente no nono dia. Esses resultados sugerem diferentes taxas de colonização e adesão das espécies ao substrato.
4.5 Experimento Ⅴ: ATR
O comportamento do fluxo de elétrons também se deve a seus excretados, o qual ao analisamos no experimento do ATR, a Ankistrodesmus densus sp. (003) (Gráfico 11) e Chlamydomonas chlorastera sp. (009) (Gráfico 12) são pertencentes a classe Chlorophyceae e a Spondylosium pygmaeum sp. (014) (Gráfico 13) pertence a classe Conjugatophyceae, ambas apresentam em menores proporções monoméricas: a fucose, ramnose, N-acetil-galactosamina, N-acetil-glucosamina, manose, xilose, ácido galacturônico e ácido glucurônico (Meccheri, 2010; Giroldo,2003).
Gráfico 11: Composição do espectro bruto da cepa de Ankistrodesmus densus (003). Aquisição espectral do consumo de cada uma das partes do excretado algal, dentro do intervalo espectral de 1800 a 500 cm-1, elaborado pela autora.
Gráfico 12: Composição do espectro bruto da cepa de Chlomydomonas chlorastera (009). Aquisição espectral do consumo de cada uma das partes do excretado algal, dentro do intervalo espectral de 1800 a 500 cm-1, elaborado pela autora.
Gráfico 13: Composição do espectro bruto da cepa de Spondyosium pydmaeum (014). Aquisição espectral do consumo de cada uma das partes do excretado algal, dentro do intervalo espectral de 1800 a 500 cm-1, elaborado pela autora.
No contexto do exposto acima, vale ressaltar que em soluções aquosas, aldoses e cetoses raramente são encontradas na forma de cadeia aberta devido à formação de anéis pela reação de grupos alcoóis com grupos aldeídos ou cetônicos, resultando em hemiacetais e hemicetais mais estáveis (Costa & Menezes, 2015). Monossacarídeos livres tendem a tornar o meio mais alcalino ao capturar íons H+, enquanto dissacarídeos mantêm a capacidade de capturar íons H+ devido ao seu poder redutor (De Fátima, Muñoz & Alves, 2008)
Os efeitos indutivos e de ressonância são cruciais nas reações químicas, envolvendo atração ou doação de elétrons. O efeito indutivo atrai elétrons, enquanto o efeito de ressonância implica a reorganização de elétrons em compostos insaturados (Andrade, 2021). O potencial hidrogeniônico é influenciado pela presença de grupos funcionais e pela estrutura das moléculas, sendo afetado por fatores como o efeito indutivo e a estabilidade da base conjugada, o que pode alterar a acidez das moléculas (Costa & Menezes, 2015).
No contexto das algas, diferenças na composição dos polissacarídeos podem afetar o potencial hidrogeniônico, sendo que a injeção de ar em sistemas aquáticos também pode alterar o pH, influenciando a acidificação do meio (Meccheri, 2010; Fernandes, 2018). Este estudo considera o potencial biotecnológico das microalgas, enfatizando a importância de investigações interdisciplinares para compreender melhor seus aspectos ecológicos e eletroquímicos (Campbell Et Al., 2016; Buffle & Devitre, 1993).
5 CONSIDERAÇÕES FINAIS
Durante a fase de crescimento exponencial, os protótipos 014/009, 014/003 e 009/003 mostraram uma amplitude considerável de tensão elétrica, indicando crescimento constante. O tempo para atingir essa fase variou entre os protótipos: 003 em dois dias, 014 em cinco e 009 em nove, refletindo a influência dos carboidratos excretados. As relações entre os eletrodos variaram entre os pares de espécies. Apesar das dificuldades na medição, os dados confirmaram a viabilidade do sistema eletroquímico proposto, sugerindo melhorias futuras.
REFERÊNCIAS BIBLIOGRÁFICAS
ANDRADE, J. C. O. Carboxamidas derivadas do núcleo oxoquinolínico: uma revisão bibliográfica. 2021. Monografia (Graduação) – Universidade Federal Fluminense, Niterói, 2021. Disponível em: https://app.uff.br/riuff/bitstream/handle/1/25891/MFC%202021.1_JOICE%20CRISTINA%20DE%20OLIVEIRA%20ANDRADE.pdf.pdf?sequence=1&isAllowed=y. Acesso em: 21 mar. 2022.
BICUDO, C. E. M.; MENEZES, M. Gêneros de algas de águas continentais do Brasil: chave para identificação e descrição. São Carlos: Rima, 1970
BROWN, T. M.; GALVANI, L. Dicionário de biografias científicas. Rio de Janeiro: Contraponto, 2007.
BUFFLE, J., & DEVITRE, R. R. (1993). Chemical and biological regulation of aquatic systems. CRC press.
CAMPBELL, M., FARRELL, S., & MCDOUGAL, O. (2016). Biochemistry. https://books.google.com.br/books?hl=pt-BR&lr=&id=ROK5DQAAQBAJ&oi=fnd&pg=PP1&dq=CAMPBELL3B+FARRELL,+2016&ots=8u8GaKhQis&sig=FyOEd1MW4oaWf1H8_QJ2CAdhnVA.
COSTA, O. M. S.; MENEZES, A. S. E. J. Química orgânica I. Fortaleza: EdUECE, 2015.
DE FÁTIMA, A.; MUÑOZ, D. G.; ALVES, B. R. Química orgânica Ⅰ. Belo Horizonte: UFMG, 2008. Disponível em: https://www2.ufjf.br/quimicaead//files/2013/09/Qu%c3%admica_Org%c3%a2nica_I-EADQUI018.pdf. Acesso em: 13 out. 2022.
FOGG, G. E. The ecological significance of extracellular products of phytoplankton photosynthesis. Botanica Marina, Berlin, v. 26, p. 3-14, 1983. DOI: https://doi.org/10.1515/botm.1983.26.1.3
FREIRE-NORDI, C. S.; VIEIRA, A. A. H. Utilization of extracellular polysaccharides from Akistrodesmus densus Kors. (Chlorophyceae) by hetrophic bactéria. Revista de Microbiologia, São Paulo, v. 27, n. 1, p. 27-32, 1996.
GIROLDO, D. Especificidade em associação alga/bactéria vinculadas aos carboidratos excretados por três espécies fitoplanctônicas de um reservatório tropical eutrófico do estado de São Paulo (Barra Bonita). 2003. Dissertação (Mestrado) – Programa de Pós-Graduação em Ecologia e Recursos Naturais, Universidade Federal de São Carlos, São Carlos, 2003. Disponível em: https://repositorio.ufscar.br/bitstream/handle/ufscar/1706/tese_danilo_giroldo.pdf?sequence=1&isAllowed=y. Acesso em: 19 set. 2022
GUILLARD, R. R.; LORENZEN, C. J. Yellow-green algae with chlorophyllide C1, 2. Journal of Phycology, New York, v. 8, n. 1, p. 10-14, 1972. DOI: https://doi.org/10.1111/j.1529-8817.1972.tb03995.x.
MARTINS, R. A. O contexto da invenção e divulgação da pilha elétrica por Alessandro Volta. In: GOLDFARB, J. L.; FERRAZ, M. H. M. (ed.). Anais do VII Seminário Nacional de História da Ciência e da Tecnologia e da VII Reunião da Rede de Intercâmbios para a História e a Epistemologia das Ciências Químicas e Biológicas. São Paulo: Sociedade Brasileira de História da Ciência, 2000. p. 285-290.
MECCHERI, S. F. Produção e composição dos polissacarídeos extracelulares de Planktothrix agarhii (Cyanobacteria) e suas relações com bactérias no reservatório de Barra Bonita. 2010. Dissertação (Mestrado) – Programa de Pós-Graduação em Ecologia e Recursos Naturais, Universidade Federal de São Carlos, São Carlos, 2010. Disponível em: https://repositorio.ufscar.br/bitstream/handle/ufscar/2001/3192.pdf?sequence=1&isAllowed=y. Acesso em: 15 mar. 2022.
MECCHERI, S. F. Produção e composição dos polissacarídeos extracelulares de Planktothrix agarhii (Cyanobacteria) e suas relações com bactérias no reservatório de Barra Bonita. 2010. Dissertação (Mestrado) – Programa de Pós-Graduação em Ecologia e Recursos Naturais, Universidade Federal de São Carlos, São Carlos, 2010. Disponível em: https://repositorio.ufscar.br/bitstream/handle/ufscar/2001/3192.pdf?sequence=1&isAllowed=y. Acesso em: 15 mar. 2022.
MORI, C. C. Perfil dos ácidos graxos em espécies de microalgas de água doce da família Selenastraceae (Cholorophyta) como características quimiotaxonõmica e prospecção de aplicabilidade. 2016. Tese (Doutorado) – Programa de Pós-Graduação em Ecologia e Recursos Naturais, Universidade Federal de São Carlos, São Carlos, 2016. Disponível em: https://repositorio.ufscar.br/bitstream/handle/ufscar/8110/TeseCCM.pdf?sequence=1&isAllowed=y. Acesso em: 13 mar. 2022.
ODUM, E.; BARRETT, W. G. Fundamentos de ecologia. 5. ed. São Paulo: Cengage Learning, 2007.
PIEDRAS, R. F. Liberação de polissacarídeos extracelulares por Spondylosium pygmaeum (Desmidiaceae) em função do crescimento em diferentes fones de nitrogênio. 2007. Dissertação (Mestrado) – Programa de Pós-Graduação em Biologia de Ambientes Aquáticos Continentais, Fundação Universidade Federal do Rio Grande, 2007. Disponível em: https://sistemas.furg.br/sistemas/sab/arquivos/bdtd/0000010151.pdf. Acesso em: 13 mar. 2022.
TICIANELLI, A. E.; GONZALEZ, R. E. Eletroquímica: princípios e aplicações. 2. ed. São Paulo: Edusp, 2013.
VIEIRA, A. A. H. et al. Role of hydrophobic extracellular polyssacharide of Aulacoseira granulata (Bacillriphyceae) on agregate formation in a turbulent and hypertrophic reservoir. Limnology and Oceanography, Waco, v. 53, n. 5, p. 1877-1899, 2008. Disponível em: https://repositorio.furg.br/bitstream/handle/1/713/Role%20of%20hydrophobic%20extracellular%20polysacharide%20of%20aulacoseira%20granulata%20Bacillariophyceae%20on%20aggregate%20formation%20in%20a%20turbulent%20and%20hypereutrophic%20reservoir.pdf?sequence=1&isAllowed=y. Acesso em: 15 mar. 2022.
VIEIRA, H. H. Avaliação da universalidade de primers de marcadores moleculares para aplicação na classe Chlorophyceae (Chlorophyta). 2014. Dissertação (Mestrado) – Programa de Pós-Graduação em Ecologia e Recursos Naturais, Universidade Federal de São Carlos, São Carlos, 2014. Disponível em: https://repositorio.ufscar.br/bitstream/handle/ufscar/2108/6126.pdf?sequence=1&isAllowed=y. Acesso em: 13 mar. 2022.
WHITTAKER, E. A history of the theories of aether and electricity: The classical theories. Maryland: American Institute of Physics, 1987.
1 eliselorencaetano@gmail.com
2 meccher@gmail.com
