REGISTRO DOI: 10.5281/zenodo.10115994
Alyne Falcão Simões1
Giovanna Marinho Aquino1
Iago Figueiredo Cirilo1
Julia Gonçalves da Silva1
Larissa Rodrigues Gava1
Paulo Roberto Palma Urbano2
RESUMO
O transplante de células-tronco hematopoiéticas, mais conhecido com transplante de medula óssea, é uma terapia alternativa utilizada para o tratamento de diversos tipos de doenças, que consiste na substituição da medula óssea doente por células progenitoras normais. No pós-transplante, o paciente pode experimentar a neutropenia, condição em que os níveis de glóbulos brancos estão abaixo no normal, aumentando o risco de infecções bacterianas. As bactérias causadoras de infecções provocam respostas inflamatórias intensas e liberam toxinas – endotoxinas e exotoxinas -, que causam danos no microambiente medular e no nicho hematopoiético, além de alterar a composição das células, influenciando negativamente a regeneração tecidual. Afetam, portanto, a formação, a diferenciação e a proliferação das células-tronco hematopoiéticas, comprometendo a homeostase. Este trabalho teve como objetivo analisar o impacto das infecções bacterianas nas células-tronco hematopoiéticas, a fim de contribuir para a elucidação de estratégias terapêuticas e preventivas, considerando a importância dessa relação para a manutenção da saúde hematopoiética e, por conseguinte, do organismo como um todo. Para tanto, realizou -se uma revisão de literatura, englobando os principais estudos científicos e referências bibliográficas, sobre células-tronco e suas funções no organismo, transplante de células-tronco e seus tipos, sistema imunológico e suas respostas e a hematopoese.
Palavras-chave: Infecções, Células-tronco, hematopoiéticas, impacto.
ABSTRACT
Hematopoietic stem cell transplantation, better known as bone marrow transplantation, is an alternative therapy used to treat various types of disease, which consists of replacing diseased bone marrow with normal progenitor cells. Post-transplant, the patient may experience neutropenia, a condition in which white blood cell levels are below normal, increasing the risk of bacterial infections. The bacteria that cause infections provoke intense inflammatory responses and release toxins – endotoxinsand exotoxins – which cause damage to the bone marrow microenvironment and the hematopoietic niche, as well as altering the composition of the cells, negatively influencing tissue regeneration. They therefore affect the formation, differentiation and proliferation of hematopoietic stem cells, compromising homeostasis. The aim of thisstudy was to analyze the impact of bacterial infections on hematopoietic stem cells in order to help elucidate therapeutic and preventive strategies, considering the importance of this relationship for maintaining hematopoietic health and, consequently, that of the body as a whole. To this end, a literature review was carried out, covering the main scientific studies and bibliographical references on stem cells and their functions in the body, stem cell transplantation and its types, the immune system and its responses and hematopoiesis.
Keywords: Infections, stemcell, hematopoietic, impact.
INTRODUÇÃO
As células-tronco hematopoiéticas (CTH) são responsáveis pela manutenção da produção de diversos tipos de células sanguíneas e derivadas, como linfócitos T e B, neutrófilos, basófilos, eosinófilos, monócitos, macrófagos, plaquetas e natural killer.1 Portanto, são células eficazes no tratamento de diversas doenças do sangue como: leucemias, mielomas, doenças autoimunes e anemias, através da realização do transplante.1
O transplante de células tronco hematopoiéticas é utilizado rotineiramente como terapia alternativa, visto que as terapias convencionais nem sempre apresentam um prognóstico satisfatório. Independentemente de ser uma terapia alternativa, o transplante pode apresentar graves efeitos adversos aos pacientes como depressão das células imunológicas e infecções bacterianas, que podem resultar a óbito.
Complicação importante do transplante de CTH e associada a altas taxas de morbidade e mortalidade, a infecção bacteriana é causada pela invasão e multiplicações de bactérias do corpo que, pela liberação de toxinas, causam sérios impactos aos tecidos.
As bactérias causadoras de infecções provocam sérios danos nas células-tronco hematopoiéticas, podendo gerar complicações graves e até a morte do paciente submetido ao transplante, podendo ser influenciada pela utilização de novos agentes imunossupressores e medidas relacionadas ao procedimento.
A reflexão sobre este assunto é muito importante, pois, é muito pouco conhecido e discutido, gerando uma alta taxa de desinformação.
OBJETIVOS
Analisar impacto das infecções bacterianas nas células-tronco hematopoiéticas, a fim de contribuir para a elucidação de estratégias terapêuticas e preventivas, considerando a importância dessa relação para a manutenção da saúde hematopoiética e, por conseguinte, do organismo como um todo.
METODOLOGIA
Realizou-se uma pesquisa bibliográfica sobre o impacto das infecções bacterianas nas células- tronco hematopoiéticas, em bancos de dados, livros didáticos e artigos científicos encontrados nas plataformas Scielo, Pubmed, Google Scholar. Foram utilizados os descritores: “células-tronco”, “hematopoiéticas”, “infecções”, “bactérias”, “stem cells”, “hematopoese”, “sistema imunológico”. Todos os artigos relevantes, independentemente do idioma, foram considerados.
Realizou-se a leitura do conteúdo levantado e as principais informações foram organizadas e discutidas.
DESENVOLVIMENTO
1. HEMATOPOESE
A hematopoese (ou hematopoiese) é a formação das células sanguíneas (plaquetas, eritrócitos e leucócitos) que começa nas primeiras semanas de gestação, no saco vitelínico (local transitório), onde a camada interna do mesoderma extraembrionário origina células precursoras eritroides que irão formar as ilhas sanguíneas. Durante esse processo, é originado as células endoteliais que formam os canais vasculares.2,3,4
As células progenitoras desta fase possuem capacidade de enxertamento restrita aos embriões.5 A hematopoese definitiva, deriva de células mesodérmicas localizadas na região aorta-gônada-mesonefro (AGM). As células isoladas desta região possuem marcadores comuns hematopoiéticos e endoteliais (CD34, SLL, GATA-2, c-Kit, FLK-1), e originam tanto células do sangue quanto células endoteliais.5
No quinto mês de gestação, a hematopoese migra para a medula óssea (MO) e se torna o sítio hematopoiético mais importante durante a vida fetal, durante a infância e a vida adulta. Após o nascimento, as células-tronco hematopoiéticas (CTH) se alojam quase exclusivamente na medula óssea. Esta fase é dependente de SDF-1 e CXCR4, que são fundamentais no nicho hematopoiético.5 Depois dos 2 primeiros anos de vida, há substituição progressiva da MO dos ossos longos por gordura, a medula óssea gordurosa remanescente é apta a reversão para hematopoiética.3
A hematopoese inicia-se com uma célula-tronco pluripotente, que, por divisão assimétrica, tanto pode autorrenovar-se como também dar origem às distintas linhagens celulares.3
Estudos definem células-tronco (stemcells) como células que possuem capacidade ilimitada ou prolongada de auto renovação que conseguem produzir pelo menos um tipo de descendente alto diferenciado.6
Independentemente de sua origem, possuem três características que as distinguem dos outros tipos celulares:
a) são célulasindiferenciadas e não especializadas;
b) são capazes de se dividir e se autorrenovar indefinidamente;
c) são capazes de se diferenciar em células especializadas quando submetidas a certas condições fisiológicas ou experimentais. (SILVA JUNIOR, 2009, p. 53).
As fontes primordiais de CT encontram-se nos diferentes estágios do desenvolvimento humano: período embrionário, fetal e adulto. Conforme o estudo de Alexander Friedenstein, em 1966, foi estabelecido que na MO encontram-se dois tipos de CT: as CTH e as células-tronco mesenquimais (CTM), responsáveis pela manutenção de todos os tecidos do organismo.8 Elas podem ser extraídas da MO ou de outros tecidos e, em alguns casos, o seu número pode ser ampliado em laboratório para torná-las viáveis por meio da adição de fatores de crescimento.9
As CTH podem ser de origem embrionária, fetal ou adulto e são encontradas na MO, cordão umbilical (onde estão as CTH mais imaturas) ou no sangue periférico. São capazes de originar uma descendente celular responsável pela produção diária (Figura 1), têm capacidade de se autorrenovar e são multipotentes, ou seja, podem se diferenciar em linhagens linfoide, mieloide, eritrocitária e megacariótica.5
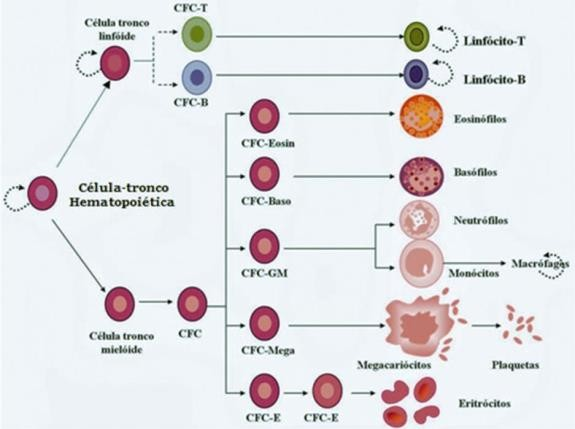
Figura 1: Divisão das células-tronco hematopoiéticas. CCB MED, 2021
Ao se autorrenovar, elas se dividem de forma assimétrica, originando uma CTH que repõe o seu estoque inicial e outra que irá progredir para a hierarquia hematopoiética.5 Após as divisões assimétricas, que amplificarão o conjunto de CT e progenitoras à diferenciação, as CTH que progredirem para a hierarquia, tornam-se células progenitoras bi ou monopotentes.5 Sob a influência do nicho celular, elas se diferenciarão em células maduras do sangue e do sistema linfoide.5
Essas células são bem caracterizadas pela seleção LKS (Lin- c-Kit+ Sca1) e pelo receptor de adesão CD34. O antígeno CD34 é uma glicoproteína transmembrana de aproximadamente 110kd, expressa nas células progenitoras hematopoiéticas, nas células endoteliais dos vãos de pequeno calibre e nos fibroblastos embrionários. Em ensaios clonogênicos, essas células são capazes de gerar todos os precursores das linhagens hematopoiéticas.9
Na medula óssea vermelha, formada por células fixas e por uma população de células livres (células precursoras do sangue), além de ser encarregada pela hematopoiese, localiza-se uma grande quantidade de CTH.9,10 Na MO, o estroma é responsável pelo suporte físico tridimensional e pela regulagem das suas atividades fisiológicas (sinalização, maturação e diferenciação).9
As células do estroma medular são responsáveis pela formação da matriz extracelular, dos fatores de crescimento G-CSF (Fator Estimulador de Colônias de Granulócitos), GM-CSF (Fator estimulador de Colônias de Granulócitos e Macrófagos) e SCF (Fator de Células-tronco) – necessários para a sobrevivência da célula-tronco – e pela produção de substâncias solúveis, como as citocinas IL-3, IL6, IL7 e IL-11.3,11Os fatores de crescimento hematopoiéticos são uma família de glicoproteínas que regulam a proliferação, diferenciação e a sobrevivência das CTH.3 Podem causar a proliferação celular, diferenciação, maturação, prevenir apoptose e afetar funções de células maduras.3 Além disso, a ação de um fator em uma célula pode estimular a produção de outro fator de crescimento ou receptor.3
Células-tronco mesenquimais (CTM) são críticas na formação do estroma. Junto com os osteoblastos, elas formam nichos (Figura 2) e fornecem os fatores de crescimento, molécula de adesão e citoquinas que dão suporte as CTH.3
As CTH são encontradas em microambientes especializados constituídos por células de suporte que promovem a manutenção das CT, por meio da produção de fatores que regulam a autorrenovação e a diferenciação celulares.5 O nicho hematopoiético é dividido por suas características anatômicas e funcionais, sendo elas o nicho osteoblástico (ou endosteal) e o nicho vascular.12 O nicho osteoblástico é coberto por osteoblastos que expressam fatores envolvidos na regulação da hematopoiese, como a angiopoetina e a trombopoetina, substâncias envolvidas na manutenção da quiescência das CTH, e por osteoclastos responsáveis pela reabsorção óssea, na regulação e localização das CTH.12,13,14,15 O nicho é encarregado de secretar ou ativar fatores envolvidos na função das CTH, mantendo-as em estado quiescente.12,13,14,15 O nicho vascular é composto pelas células endoteliais sinusoidais e, nesse microambiente, as células recebem estímulos para promover a proliferação e a diferenciação de CTH.12,13,14,15
De acordo com Thomas, o número de CTH na circulação pode ser aumentado com a quimioterapia e com a administração de fatores de crescimentos (GM_CSF ou G-CSF).16
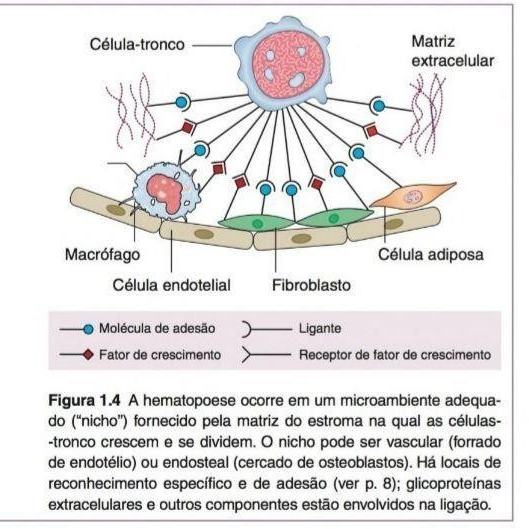
Figura 2: Nicho Hematopoiético. Fundamentos em Hematologia de Hoffbrand, 2018.
As moléculas de adesão são importantes para o desenvolvimento e na manutenção das respostas inflamatória e imunológica e para as interações de plaquetas e leucócitos com a parede dos vasos.5
1.1. TRANSPLANTE DE CÉLULAS-TRONCO HEMATOPOIÉTICAS
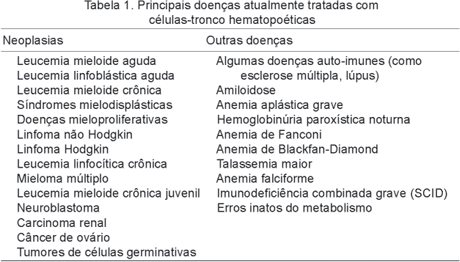
O transplante de células-tronco hematopoiéticas (TCTH), mais conhecido como transplante de medula óssea (TMO)17, é utilizado em vários tratamentos como uma terapia alternativa. Apresenta uma boa taxa de sucesso em uma grande variedade de neoplasias, síndromes e outras doenças, como pode se observar na Tabela 1.
O transplante consiste, basicamente, na substituição da MO doente, ou deficitária, por células progenitoras normais, para reconstituir uma nova medula, visando à reconstituição de todo o sistema hematopoiético.18 O TCTH é um tratamento que envolve a submissão do paciente à quimioterapia e/ou radioterapia, seguido de infusão de células progenitoras ou CTH.19
Fonte: Silva, Junior (2009, p.54)
O TCTH pode ser dividido em três tipos, dependendo de seu doador.
(1) Alogênico: quando as células são de um doador geneticamente distinto, seja HLA (Human Leukocyte Antigen) compatível ou não. Esse tipo de transplante apresenta algumas complicações imunológicas entre o receptor e o doador, como rejeição e doença do enxerto-contra-hospedeiro (DECH).
(2) Singênico: quando as células são recebidas de um irmão gêmeo, geneticamente idêntico ao receptor. Esse tipo de transplanate não apresenta nenhuma complicação imunológica.
(3) Autólogo: quando as células utilizadas são do próprio paciente, esse transplante apresenta menos risco que o alogênico, pois não existe nenhum tipo de reação imunológica entre doador e receptor.17,20,21,22
O transplante autólogo é dividido em três fases:
Fase pré: nessa etapa, acontece a avaliação médica, a coleta de exames e a avaliação clínica e a internação do paciente;
Fase trans: quando acontece a mobilização, coleta e armazenamento, condicionamento e a infusão de células; e
Fase pós-transplante: uma fase crítica que envolve várias considerações e cuidado como: neutropenia e risco de infecção, recuperação da MO, tratamento de complicações e reabilitação.18
A mobilização é utilizada para aumentar a quantidade de células no sangue periférico, a fim de realizar a coleta. A maneira mais efetiva de se promover a mobilização das células CD34+ envolve o uso de agentes quimioterápicos e fatores de crescimento hematopoiéticas. Essa associação produz um sinergismo, que resulta na maior mobilização de células.9,23
As células progenitoras são coletadas por aférese, processo de separação das células sanguíneas, em que o sangue do doador é centrifugado e seus componentes são separados com base nas diferenças de densidade.9 O volume coletado é encaminhado para o congelamento, pois é necessário de uma a duas coletas para atingir o número de células necessárias. Caso não se atinja a dose necessária para o transplante, programa-se uma nova mobilização.9
Uma das principais etapas do TCTH é a criopreservação das CT, que tem como objetivo preservar o tecido vivo de maneira que, ao ser reconstituído, ele se recupere com alto grau de viabilidade e integridade funcional, sem induzir toxicidades ao organismo do receptor. Os agentes crioprotetores atuam na inibição da formação de cristais de gelo, ao diminuir o gradiente osmótico ou pelo aumento da formação de vidro – vitrificação.9
O condicionamento representa a parte principal do transplante, uma vez que, nessa fase, o paciente recebe quimioterapia e/ou radioterapia em altas doses, para promover a destruição das células doentes e assim criar um espaço na MO para aceitar as células novas. A quimioterapia contribui para o fim das células tumorais, de modo que o sistema imunológico não ataque as células doadas.24,25
Para a infusão de CTH crio preservadas, o material passa pelo processo de descongelamento em banho-maria e é infundido imediatamente no receptor, a fim de minimizar a perda de biodisponibilidade das CTH.26,27,28,29
Os pacientes que irão realizar TCTH possuem acesso venoso central, utilizado na coleta de sangue para a realização de exames, infusão de medicamentos e hemoderivados.
A infusão de CTH ocorre através desse mesmo cateter central, como uma transfusão de sangue comum.30
- INFECÇÕES BACTERIANAS
Durante as primeiras semanas após o transplante, o paciente pode experimentar a neutropenia, uma condição em que os níveis de glóbulos brancos se apresentam abaixo do normal. A neutropenia aumenta significativamente o risco de infecções.31,32
As infecções são uma das principais complicações do TCTH e são resultados da profunda depressão na imunidade, causada por múltiplos fatores, incluindo a doença de base, tratamento anteriores, o regime de condicionamento, esquemas de imunossupressão para prevenção ou tratamento da DECH.5
No pós transplante imediato, particularmente nas primeiras quatro semanas, são comuns as infeções bacterianas, entre as quais, está a pancitopenia, a quebra da barreira mucosa induzida pelo regime de condicionamento e da pele em consequência de cateter intra-arterial.33
Na Tabela 2, é possível visualizar algumas das principais bactérias causadoras de infecções.

Fonte: Voltarelli , Julio C. (2010)
As toxinas bacterianas são substâncias que alteram o metabolismo normal das células hospedeiras e são classificadas em exotoxinas (produzidas pelas bactérias gram-positivas, sendo liberada com a lise das mesmas) e endotoxinas (produzidas pelas bactérias gram-negativas e que atuam como toxinas em circunstâncias especiais).34
As endotoxinas são lipopolissacarídeos (LPS) proteicos encontrados nas paredes de muitas bactérias gram-negativas e que são liberadas das células quando estas se desintegram. São menos tóxicas que as exotoxinas e não formam toxoides.35,36
O LPS consiste em polissacarídeos e lipídio A. O lipídio A é responsável pelas propriedades tóxicas que fazem com que qualquer infecção por bactérias gram negativas constitua um problema médico potencialmente grave.37
O LPS induz a liberação de substâncias vasoativas, ativa o sistema complemento pela via alternativa, através da ação sobre o componente C3, e ativa a cascata de coagulação, provocando obstrução intravascular. Todos esses processos podem resultar em instabilidade cardiovascular e hemodinâmica, levando a uma septicemia.38
O termo septicemia é então usado amplamente para definir um estado infeccioso generalizado devido à existência de microrganismos patogênicos e suas toxinas na corrente sanguínea. A sepse passa a ser definida como uma disfunção orgânica grave, potencialmente fatal, causada por uma resposta inadequada ou desregulada do hospedeiro à infecção.39
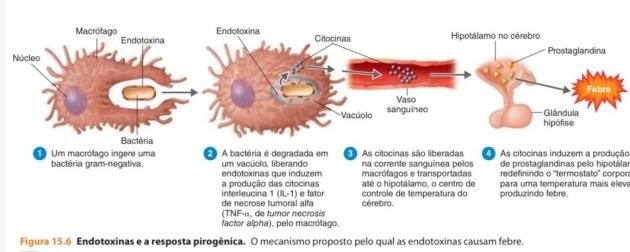
Figura 3: Endotoxinas e a Resposta Pirogênica Fonte: Tortora, Geraldo J (2017)
Já as exotoxinas são polipeptídios cujos genes frequentemente estão localizados em plasmídeos ou vírus bacterianos lisogênicos (bacteriófagos).40 Elas agem destruindo determinadas partes das células do hospedeiro ou inibindo certas funções metabólicas e estão entre as substâncias mais tóxicas conhecidas.39 Elas são divididas em três tipos principais com base em sua estrutura e função: (1) toxinas A-B, (2) toxinas danificadoras de membrana e (3) superantígenos.41
Muitas exotoxinas possuem uma estrutura em subunidades A-B (Figura 4). A subunidade A (ou ativa) possui atividade tóxica; enquanto a subunidade B (ou de ligação, do inglês, binding) é responsável pela ligação da exotoxina a receptores específicos da célula humana.40
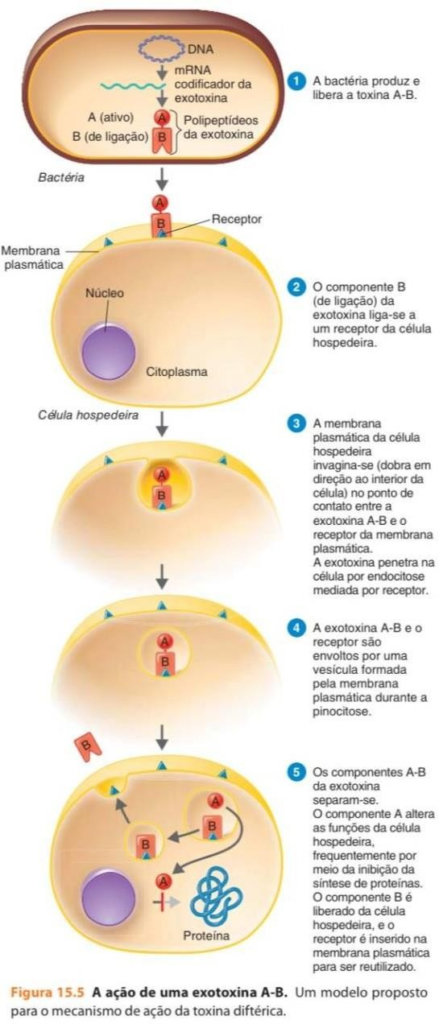
Figura 4: A ação de uma exotoxina A-B Fonte: Tortora, Geraldo J (2017)
As toxinas danificadoras de membrana causam a lise da célula hospedeira pela degradação da membrana plasmática.39,40,41
As exoenzimas são liberadas pelas bactérias a partir de estruturas especializadas denominadas “sistemas de secreção”. Alguns sistemas de secreção transportam as exotoxinas ao espaço extracelular, enquanto outros transportam diretamente para o interior das células de mamíferos. Aqueles que transportam as exotoxinas diretamente ao interior da célula de mamíferos são especificamente efetivos, uma vez que a exotoxina não sofre exposição aos anticorpos do espaço extracelular.40
Os superantígenos estimulam, de forma não específica, a proliferação de células imune denominadas células T. Em resposta aos superantígenos, as células T são estimuladas a liberar enormes quantidades de substâncias químicas denominas citocinas. Níveis extremamente altos de citocinas liberadas pelas células T circulam pela corrente sanguínea e desencadeiam vários sintomas, como febre, náusea, vômito, diarreia e, à vezes, choque ou até mesmo a morte.41
2.1. SISTEMA IMUNOLÓGICO
O sistema imune é formado por um conjunto de células e moléculas que cooperam para proteger o organismo de agentes infecciosos e também fornece um sistema de vigilância capaz de monitorar a integridade dos tecidos.42
Os mecanismos de defesa do hospedeiro são constituídos pela imunidade inata, responsável pela proteção inicial contra as infecções, e pela imunidade adquirida, que se desenvolve mais lentamente e proporciona uma defesa mais especializada e mais eficaz contra as infecções.43
O sistema imune inato constitui um sistema de defesa inespecífico mas extremamente efetivo.42 A imunidade inata baseia-se em um número limitado de receptores e proteínas secretadas que são codificadas na linhagem germinativa e que reconhecem características comuns de muitos patógenos.44
A primeira linha de defesa da imunidade é fornecida pelas barreiras epiteliais, células e antibióticos naturais presentes nos epitélios, que bloqueiam a entrada de microrganismos.43
Caso um patógeno seja bem sucedido na quebra da barreira anatômica, alguns mecanismos de imunidade inata começam agir rapidamente.44
O sistema imune inato reconhece componentes amplamente conservados dos agentes infecciosos (PAMP) e prepara uma ataque imediato, seja engolfando esses componentes ou por ação direta com enzimas destrutivas ou proteínas de ataque à membrana. Os atores principais da resposta imune inata são macrófagos, neutrófilos e proteínas bactericidas solúveis como complemento e lisozima.42
As respostas imunes adaptativas demoram mais tempo para alcançar o significado funcional, mas são adaptadas especificamente ao tipo de agente infeccioso. A resposta imune adaptativa é mediada principalmente pelos linfócitos T e B.42 As células da imunidade adquirida expressam receptores que reconhecem especificamente uma variedade muito maior de moléculas produzidas pelos organismos, assim como substâncias não infecciosas, chamadas de antígenos.43
Existem dois tipos de imunidade adquirida, a imunidade humoral e a imunidade celular. A imunidade humoral é mediada por anticorpos produzidos pelos linfócitos B, que são secretados na circulação para neutralizar e eliminar os microrganismos e as toxinas microbianas presentes fora da célula do hospedeiro, sangue e no lúmen dos órgãos mucosos.43
Os anticorpos possuem dois componentes principais, um encarregado de ligar-se ao antígeno específico e outro utilizado para ligar- se ao complemento, aos fagócitos, às células NK e a outros elementos.42
A imunidade celular é a defesa contra microrganismos intracelulares, e é mediada pelos linfócitos T, que ativam fagócitos para destruir os microrganismos ingeridos pelas células fagocitárias nas vesículas fagocíticas.42
CONSIDERAÇÕES FINAIS
As infeções bacterianas exercem um impacto significativo nas células-tronco hematopoiéticas. Elas podem desencadear respostas inflamatórias complexas que comprometem a homeostase, ou seja, as infecções afetam a formação das células sanguíneas (plaquetas, eritrócitos e leucócitos), através da liberação de citocinas inflamatórias durante a resposta imune, que pode modular a proliferação e diferenciação destas células, afetando a capacidade do organismo
Elas podem desencadear respostas inflamatórias complexas que comprometem a homeostase, ou seja, as infecções afetam a formação das células sanguíneas (plaquetas, eritrócitos e leucócitos), através da liberação de citocinas inflamatórias durante a resposta imune, que pode modular a proliferação e diferenciação destas células, afetando a capacidade do organismo de combater a infecção.
As infecções podem pertubar o microambiente da medula óssea, resultando na ativação de respostas imunes locais que liberam citocinas e quimiocinas inflamatórias. Portanto, essas mudanças prejudicam a produção das células-tronco e afetam algumas funções essenciais da medula óssea, como formação e regeneração do sangue.
Além disso, alteram a composição das células do estroma medular e do nicho hematopoiético, influenciando negativamente a regeneração tecidual e a hematopoiese.
Em resposta à infecção, são ativadas as células do sistema imune, como os macrófagos e os neutrófilos. No entanto, certas bactérias como Escherichia coli, possuem a capacidade de evadir ou suprimir a resposta imunológica, resultando em infeções persistentes ou crônicas, anemia e leucopenia.
Em resumo, é de extrema importância monitorar o paciente no pós-transplante, para que o mesmo não apresente um caso de neutropenia, aumentando as chances de infecções. E caso o paciente apresente uma infecção, deve-se imediatamente administrar ciclos de antibióticos para a eliminação destas bactérias causadoras de danos.
REFERÊNCIAS BIBLIOGRÁFICAS
- PERRY, M. J.; LI, L. Disrupting the Stem Cell Niche: Good Seeds in Bad Soil. Disponível em: https://www.cell.com/cell/fulltext/S0092-8674(07)00728- 3?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii% 2FS0. Acesso em: 16 set. 2023.
- TAICHMAN, R. S. Blood and bone: two tissues whose fates are intertwined to create the hematopoietic stem-cell niche. Blood, v. 105, n. 7, p. 2631–2639, 2005. Disponível em: Blood and bone: two tissues whose fates are inter twined to create the hematopoietic stem-cell niche – Science Direct Acesso em: 15 set. 2023.
- KONOPLEVA, M. Y.; JORDAN, C. T. Leukemia stem cells and microenvironment: Biology and therapeutic targeting. Journal of clinical oncology: official journal of the American Society of Clinical Oncology, v. 29, n. 5, p. 591–599, 2011. Leukemia Stem Cells and Micro environment: Biology and Therapeutic Targeting- PMC (nih.gov)Acesso em: 16 set. 2023.
- LEE-THEDIECK, C.; SCHERTL, P.; KLEIN, G. The extracellular matrix of hematopoietic stem cell niches. Advanced drug delivery reviews, v. 181, n. 114069, p. 114069, 2022. Disponível em: The extra cellular matrix of hematopoietic stemcel lniches -PMC(nih.gov)Acesso em: 21 set. 2023.
- THOMAS, ED. Bone marrow transplantation: a historical review. Medicina, Ribeirão Preto, 33: 209-218 july/sept. 2000. Disponível em: https://www.bing.com/ck/a?!&&p=91480e57e2f37629JmltdHM9MTY5NzA2OD gwMCZpZ3VpZD0wYTRiZjIyZi1kODdjLTY5OTAtMTY1Zi1lMWI1ZDk4NzY4MGQmaW5zaWQ9NTIwNQ&ptn=3&hsh=3&fclid=0a4bf22f-d87c-6990- 165fe1b5d987680d&psq=bone+marrow+transplantation+a+historical+review& u=a1aHR0cHM6Ly93d3cucmV2aXN0YXMudXNwLmJyL3JtcnAvYXJ0aWNsZS 9kb3dubG9hZC 83NjkwLzkyMjgvMTAyNjE&ntb=1 Acesso em: 15 set. 2023
- KHADDOUR, K.; HANA, C. K.; MEWAWALLA, P. Hematopoietic Stem Cell Transplantation.[s.l.] StatPearls Publishing, 2023. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK536951/ Acesso em: 02 out. 2023
- MATIAS, A. B. et al. Qualidade de vida e transplante de células-tronco hematopo éticas alogênico: um estudo longitudinal. Estudos de Psicologia(Campinas), v. 28, n. 2, p. 24 187–197, 2011. Disponível em SciELO – Brasil -Qualidade de vida e transplante de células-tronco hematopoéticas alogênico: um estudo longitudinal Qualidade de vida e transplante de células-tronco hematopoéticas alogênico: um estudo longitudinalAcesso em: 17 ago. 2023.
- FIGUEIREDO, T. W. B. et al. Reações adversas no dia zero do transplante de célulastronco hematopoéticas: revisão integrativa. Revista gaucha de enfermagem, v. 39, n. 0, p. e20180095, 2018. Disponívem em: https://www.scielo.br/j/rgenf/a/t5Z4Q5jzdwssZ8gnJpK5J8K/?lang=pt&format=p df Acesso em: 21 set. 2023.
- AZEVEDO, W.; RIBEIRO, M. C. C. Fontes de células-tronco hematopoéticas para transplantes. Medicina (Ribeirao Preto Online), v. 33, n. 4, p. 381–389, 2000. Disponível em Fontes de células-troncohematopoéticas para transplantes|Medicina (RibeirãoPreto) (usp.br)Acesso em: 08 set. 2023.
- CASTRO, C. G. DE, Jr; GREGIANIN, L. J.; BRUNETTO, A. L. Transplante de medula óssea e transplante de sangue de cordão umbilical em pediatria. Jornal de pediatria, v. 77, n. 5, 2001. Disponível em: . Acesso em: 01 set. 2023.
- SOARES FARIA, M. et al. PREVALÊNCIA DAS COMPLICAÇÕES NO TRANSPLANTE DE CÉLULAS-TRONCO HEMA-TOPOÉTICAS (TCTH): UMA REVISÃO SISTEMÁTICA PREVALENCE OF COMPLICATIONS IN HEMATOPOIETIC STEM CELL TRANSPLANTATION (HSCT): A SYSTEMATIC REVIEW., [s.d.]. Disponível em: https://cdn.publisher.gn1.link/rbm.org.br/pdf/v58a20.pdf#:~:text=As%20principa is%20complica%C3%A7%C3%B5es%20foram%20infec%C3%A7%C3%A3o% 2C%20doen%C3%A7a%20do%20enxerto,graves%20da%20mucosa%2C%20 fadiga%2C%20fal ha%20de%20enxertia%2C%20outras. Acesso em: 17 ago. 2023.
- CECYN, K. Z. [UNIFESP]. O perfil das moléculas de adesão na mobilização de células tronco hematopoéticas em doadores e pacientes com linfoma e mieloma múltiplo. 2008. Disponível em: O perfil das moléculas de adesão namobilização de células tronco hematopoéticas em doadores e pacientes com linfoma emielomamúltiplo (unifesp.br)Acesso em: 21 set. 2023.
- Cuidados de Enfermagem aos pacientes adultos submetidos a Transplante de Medula Óssea: uma revisão integrativa. [s.l: s.n.].
- HERTL, M. Transplante de células-tronco hematopoiéticas. Disponível em: Transplante de células-tronco hematopoiéticas – Imunologia; distúrbiosalérgicos – Manuais MSD edição para profissionais (msdmanuals.com). Acesso em: 15 set. 2023.
- FREIRE, N. C. B. et al. Reações adversas relacionadas à infusão de células tronco hematopoéticas. Revista de enfermagem UFPE on line, v. 9, n. 1, p. 391–398, 2015. Disponível em: https://periodicos.ufpe.br/revistas/index.php/revistaenfermagem/article/view/10 351 Acesso em: 20 ago. 2023.
- IKEDA, A. L. C.; BION, F. J. DA C.; ROSA, L. M. DA. Coleta e infusão de células- tronco hematopoiéticas: enfermagem, tecnologia e ensino-aprendizado. Rev.enferm. UFPE on line, p. 896–901, 2015. Disponível em: Coleta e infusão de células-tronco hematopoiéticas: enfermagem, tecnologia e ensino-aprendizado | Rev. enferm. UFPE on line;9 (2supl): 896-901, fev.2015. |BDENF (bvsalud.org)Acesso em: 18 ago. 2023.
- SANTOS, J. V. E. DOS. Infusão de células-tronco hematopoiéticas pelo enfermeiro: um relato de experiência. 2023. Disponível em: Infusão de células-tronco hematopoiéticas pelo enfermeiro: um relato de experiência | Manancial– Repositório DigitaldaUFSMAcesso em: 23 ago. 2023.
- ED., 1a . ASSISTÊNCIA DE ENFERMAGEM NO TRANSPLANTE AUTÓLOGO DE CÉLULAS TRONCO HEMATOPOÉTICAS DE SANGUE PERIFÉRICO. Disponível em: hemorio.rj.gov.br/Html/pdf/Protocolo_tmo.pdf. Acesso em: 21 set. 2023.
- LOPES, A.; CHAMMAS, R.; IYEYASU, H. Oncologia para Graduação. 3. ed. [s.l.] Editora Lemar, 2013.
- NETO, D. P. Fatores clínicos, econômicos e infecções em pacientes onco hematológicos submetidos a quimioterapia e/ou transplante de células tronco hematopoéticas. 2012. Disponível em: Meta dados do item: Fatores clínicos, econômicos e infecções em pacientes onco hematológicos submetidos a quimioterapia e/outransplante de células tronco hematopoéticas (ibict.br)Acesso em: 18 ago. 2023.
- NUCCI, M.; MAIOLINO, A. Infecções em transplante de medula óssea. Medicina(RibeiraoPretoOnline),v. 33, n. 3, p. 278–293, 2000. Infecçõesemtransplante de medula óssea | Medicina (Ribeirão Preto) (usp.br)Acesso em: 18 ago. 2023.
- PASQUINI, R. Fundamentos e Biologia do Transplante de Células Hematopoiéticas. In: ZAGO, M.A; FALCÃO, R.P; PASQUINI, R. Tratado de Hematologia. 1ª Edição. Disponível em: file:///C:/Users/TEMP/Downloads/Transplante%20de%20medula%20%C3%83%C2%B3ssea.pdfAcesso em: 10 out. 2023.
- FERNANDES, F. C. Endotoxinas em aviários. Revista Brasileira de Medicina do Trabalho,v. 3, n. 1, p. 22–28, 2005. Disponível em: https://www.rbmt.org.br/details/165/pt-BR/endotoxinas-em-aviarios Acesso em: 07 out. 2023.
- NOGUEIRA, V. A; FILHO, S. N. G. Microbiologia. Florianópolis, 2015
- FARHANA, A.; KHAN, Y. S. Biochemistry, Lipopolysaccharide.[s.l.] StatPearls Publishing, 2023. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK554414/ Acesso em: 07 out. 2023.
- BLACK, Jacquelyn G; BLACK, Laura J. Microbiologia –Fundamentos e Perspectivas. 2021 Disponível em: em: https://integrada.minhabiblioteca.com.br/#/books/9788527737326/. Acesso em: 16 out. 2023.
- MOLINARO, M. E; CAPUTO, G. F. L; AMENDOEIRA, R.R. M. Conceitos e Métodos para formação de profissionais em laboratórios de Saúde.2009
- SALOMÃO, Reinaldo. Infectologia –Bases Clínicas e Tratamento. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788527732628/. Acesso em: 16 out. 2023.
- LEVINSON, W. Microbiologia Médica e Imunologia. 10. ed. [s.l.] McGraw-Hill Medical, 2010. Disponível em: https://edisciplinas.usp.br/pluginfile.php/4979704/mod_resource/content/1/105.%202010.Microbiologia_Medica_e_Imunologia_Levinson_10._ed. www.meulivro.mobi.p df Acesso em: 08 out. 2023.
- TORTORA, Geraldo J.; FUNKE, Adriana R.; CASE, Christine L. Microbiologia.Grupo A, 2017. E-book. ISBN 9788582713549. Disponível em: 26 https://integrada.minhabiblioteca.com.br/#/books/9788582713549/. Acesso em: 10 out. 2023
- ROITT, I. M. Fundamentos de Imunologia. 12. ed. [s.l: s.n.]. Disponível em: Fundamentos de Imunologia (Roitt)12.ed.-www.meulivro.mobi.pdfAcesso em: 17. out. 2023
- ABUL ABBAS, K. Imunologia Basica. 3. ed. [s.l.] Elsevier Editora Ltda, 2009. Disponível em: Imunologia Básica – 4a ED – Abul Abbas.pdfAcesso em: 17. out. 2023
- MURPHY, K. ImunobiologiadeJaneway. [s.l: s.n.]. Disponível em: Imunobiologia de Janeway(Murphy) 8 .ed.–www.meulivro.mobi.pdf Acesso em: 17. out. 2023
1 Discente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil
2 Docente da Universidade Cruzeiro Do Sul, São Paulo / SP, Brasil
