REGISTRO DOI: 10.69849/revistaft/th10202502281506
Karla Lays Lima e Silva
Orientador : Dr. Luzinei dos Santos Monteiro
RESUMO
O perfil de pacientes da cirurgia vascular seja no âmbito ambulatorial ou hospitalar demanda uma atenção especial visto a grande maioria tratar-se de pacientes idosos, com comorbidades graves sobrepostas e de hábitos pouco saudáveis. O artigo apresentado tem o intuito de se debruçar sobre uma das queixas mais recorrentes na especialidade, a neuropatia periférica, e através de uma abordagem elucidativa, desde as repercussões metabólicas até o desenvolvimento de complicações graves com alto risco de amputação maior, correlacionar a manifestação clinica com a cadeia de eventos relacionada a presença de fatores de risco modificáveis como diabetes, hipertensão arterial sistêmica, síndrome metabólica e tabagismo que atuam sinergicamente na doença macro e microvascular.
Palavras-chave: neuropatia periférica, neuropatia diabética, doença arterial periférica e síndrome metabólica.
ABSTRACT
The profile of vascular surgery patients, whether in the outpatient or hospital setting, demands special attention, since the vast majority are elderly patients, with severe overlapping comorbidities and unhealthy habits. The article presented aims to focus on one of the most recurrent complaints in the specialty, peripheral neuropathy, and through an elucidative approach, from the metabolic repercussions to the development of serious complications with a high risk of major amputation, to correlate the clinical manifestation with the chain of events related to the presence of modifiable risk factors such as diabetes, systemic arterial hypertension, metabolic syndrome and smoking that act synergistically in macro and microvascular disease.
Keywords: peripheric neuropathy, diabetic neuropathy, peripheral arterial disease, metabolic syndrome.
1 INTRODUÇÃO
Desde o início do século XIX estudiosos buscam compreender e elucidar os mecanismos envolvidos nos distúrbios neurológicos a fim de propiciar melhora na qualidade de vida dos pacientes. Estudiosos como Augustus Waller (1850) descobriu e descreveu a degeneração walleriana, processo de degeneração de nervos lesionados. Jean Martin Charcot (1825-1893) se dedicou ao estudo de neuropatias associadas a doenças crônicas e associou a neuropatia à sífilis e ao diabetes; as contribuições de Wilhelm Erb propiciou o desenvolvimento de métodos de estudo eletrofisiológico para estudo de neuropatias periféricas; a colaboração de Joseph Jules Degerine se deu no campo dos estudos das neuropatias traumáticas e infecciosas; da parte de Hebert H. Seddon sua contribuição possibilitou a classificação para lesões nervosas periféricas. Paul Langerhans abriu caminho para compreensão da associação entre neuropatia e diabetes como fruto de seus estudos do pâncreas e diabetes.
O campo dessas constatações e seu papel crucial na promoção do bem-estar coletivo, especialmente ao abordar doenças crônicas e de elevada prevalência como a diabetes, leva a impactos que vão além do controle glicêmico e criam um alerta para as complicações graves envolvidas.
Atualmente se sabe que fatores de risco modificáveis como a síndrome metabólica, hipertensão, diabetes mellitus e o tabagismo, agravam complicações como a neuropatia periférica. Políticas públicas voltadas para a educação em saúde, cessação do tabagismo, controle pressórico, fornecimento de medicações adequadas para manejo de comorbidades e incentivo a estilos de vida saudáveis são essenciais para reduzir esses riscos e melhorar a qualidade de vida de pessoas com diabetes.
1.1 Neuropatia Periférica
De acordo com estudiosos sobre a temática é pertinente afirmar que a neuropatia periférica é uma condição resultante de danos aos nervos do sistema nervoso periférico (SNP) que consiste em uma extensa rede de fibras nervosas que se ramificam a partir do cérebro e da medula espinhal (que compõem o sistema nervoso central – SNC) e se estendem para todas as outras partes do corpo, incluindo órgãos, músculos, pele e vasos sanguíneos. Esses nervos periféricos atuam como linhas de comunicação, transmitindo sinais entre o SNC e o restante do organismo. Quando esses nervos são danificados, a comunicação é interrompida, levando a uma variedade de sintomas. (1)
O termo neuropatia periférica responde por uma vasta gama de condições patológicas, contudo diante do objetivo deste trabalho de conclusão de curso que visa abordar as principais condições envolvidas no perfil clínico de pacientes com Doença Arterial Periférica (DAP), será restrito a abordagem da neuropatia periférica diabética periférica que tem como padrão a Polineuropatia axonal crônica que se comporta com sintomas predominantemente axonais e pode ter algum grau de desmielinização. (2)
A Polineuropatia axonal crônica é uma condição irreversível e o manejo visa reduzir a velocidade de progressão da condição e previnir complicações como úlceras plantares (em pés diabéticos), artropatia, quedas e amputações. Cerca de 15-20% dos pacientes têm sintomas de dor que podem mais que limitar suas funções, podem reduzir a qualidade de vida destes. (3)
Figura 1 – História Natural da amputação maior de membros inferiores. Cada degrau da escada é alvo de intervenção para prevenção de amputações (5)
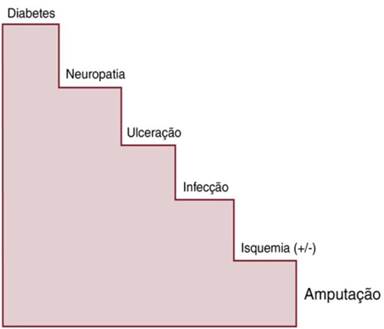
Fonte: Brito e Silva (2020).
Trata-se da maior causa de morbidade no diabetes. Pacientes com úlceras plantares diabéticas ocupam mais leitos que todos os pacientes com as demais complicações de diabetes. O risco de amputação de membro reportado foi de 11% em 25 anos de doença. O pico da neuropatia se correlaciona diretamente com o tempo de doença, sendo 50% dos pacientes acometidos após esse período. A Diabetes mellitus tipo 2 está muito mais associada com neuropatia que a Diabetes mellitus tipo 1 (26 versus 8 %). (4)
1.2 Fatores para o Diagnóstico e Constatação da (Neuropatia Axonal Crônica)
São fatores de risco para desenvolvimento de neuropatia axonal crônica: Duração da diabetes mellitus, Nível elevado de hemoglobina glicada, Hipertensão, Obesidade, Dislipidemia, Uso de cigarro/tabaco, Uso crônico de álcool, idade avançada, estatura. Sendo a duração e a severidade da hiperglicemia e da síndrome metabólica os fatores de risco mais importantes para o desenvolvimento de neuropatia. (6)
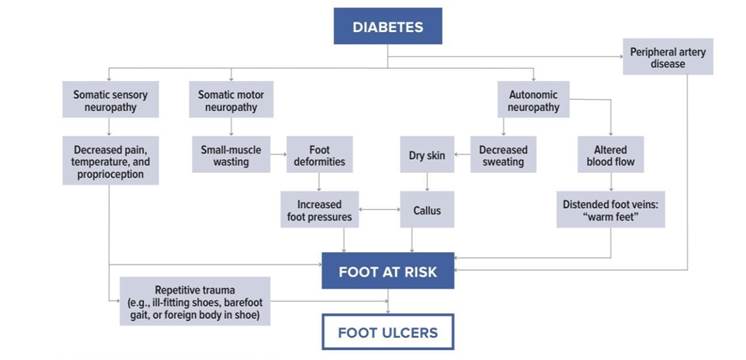
A Neuropatia Axonal Crônica (NAC) desenvolve-se por fatores inflamatórios, metabólicos e isquêmicos envolvidos na doença de base, tem evolução lenta, e está relacionada diretamente com o comprimento do axônio, apresentando início de sintomas em extremidades de MMII. Os sinais mais precoces da polineuropatia diabética refletem na perda gradual da integridade das fibras nervosas longas mielinizadas, curtas mielinizadas e desmielinizadas. A perda de fibras nervosas longas mielinizadas leva a perda/comprometimento da sensação vibratória e propriocepção e reduz reflexos como Aquileu, já a perda de fibras curtas mielinizadas leva a perda ou comprometimento da percepção de dor, toque suave e percepção de temperatura. (6)
2 OBJETIVO
O objetivo da pesquisa em questão é apresentar uma atualização das produções bibliográficas sobre a síndrome de neuropatia periférica como uma condição patológica ampla. E apresentar uma revisão abordando a etiopatogenia, diagnóstico, prevenção e atualização no tratamento tendo em vista sua íntima relação com fatores de risco modificáveis como hipertensão, diabetes mellitus, síndrome metabólica e tabagismo e realizar uma abordagem nos pontos de intervenção que devem ser enfatizados pelo médico cirurgião vascular junto ao público em seu escopo de atribuição frente ao quadro clínico do paciente.
3 METODOLOGIA
O percurso para a realização desta pesquisa envolveu um levantamento detalhado de artigos, livros e autores de respaldo sobre a temática. Foi realizado revisão bibliográfica extensa nas plataformas Pubmed, UptoDate, Scielo, Google Acadêmico, CAPES e Cochrane nos últimos 5 anos. E buscou-se ainda a complementação com trabalhos prévios que coadunem com a proposta deste artigo de grande impacto na temática abordada buscando explanar acerca de sua fisiopatologia, evolução clínica, métodos diagnósticos, manejo terapêutico atual e possíveis alvos terapêuticos futuros. Foram utilizadas as palavras chaves: neuropatia periférica, neuropatia diabética, doença arterial periférica e síndrome metabólica.
4 DISCUSSÃO: FISIOPATOLOGIA/ETIOPATOGENIA
A compreensão da patogênese da neuropatia diabética envolve múltiplas vias reguladas de diferentes maneiras que convergem com a disfunção mitocondrial e o comprometimento da produção de energia celular e dano oxidativo nos axônios. Como as mitocôndrias viajam pelo neurônio sensorial ao longo de todo o comprimento do axônio para suprir a demanda de energia axonal, a lesão metabólica ocorre tanto no corpo celular como na porção mais distal do axônio.
4.1 Os Mecanismos de Produção de Energia
A glicose e os lipídios circulantes servem como fonte de energia para o sistema nervoso periférico. A glicose, via glicólise, o ácido tricarboxílico (TCA) e os lipídios, via beta-oxigenação, produzem dois cofatores dinucleotídeos centrais para o metabolismo: Nicotinamida adenina dinucleotídeo reduzido (NADH) e flavina adenina dinucleotídeo reduzido (FADH2). Esses cofatores são transportados para as mitocôndrias como uma fonte de energia celular para produção de adenosina trifosfato (ATP) via fosforilação oxidativa. (6)
Figura 2 – Vias intracelulares envolvidas na fisiopatologia da neuropatia diabética
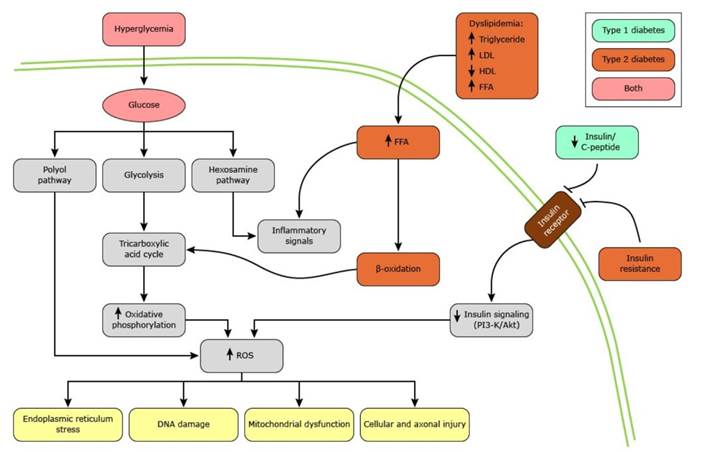
Fonte: Feldman e Shefner (2019).
Figura 3 – Funções celulares na produção de ATP (7)
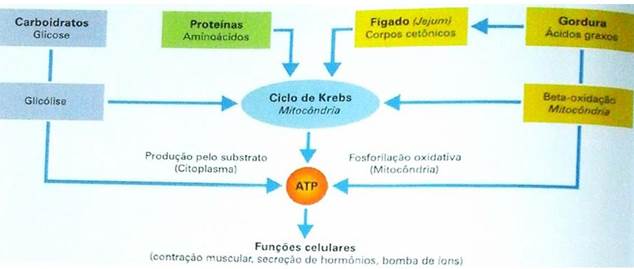
Fonte: Disponível em: https://sites.usp.br/lbbp/wp-content/uploads/sites/464/2019/03/AMNMetabolismo.pdf. Acesso em 20/12/24.
Os subprodutos naturais da fosforilação oxidativa são espécies reativas de oxigênio (ROS) incluindo superóxido dismutase, glutationa e catalase. Produzidas em níveis baixos, as ROS são necessárias para a fisiologia normal com papéis essenciais na imunidade e no tônus cardiovascular. O diabético tem excesso de glicose e lipídios circulantes que sobrecarregam a produção normal de ATP, resultando em aumento da produção de ROS, falha de energia e perda da função celular normal. Como exemplo: o aumento de ROS interrompe a função do retículo endoplasmático levando ao dobramento incorreto de proteínas e lesão celular. Além de dano mitocondrial direto, a interrupção da sinalização celular normal, gera danos celulares significativos e resulta em um ciclo vicioso de alimentação direta da falha de energia e perda da função normal. (6)
As mitocôndrias lesionadas não conseguem mais viajar pelos axônios e essa interrupção no tráfego axonal mitocondrial normal fundamenta o padrão de distal para proximal de dano axonal observado na neuropatia diabética (Dying-back) (6). O excesso de glicose é metabolizado pelas vias do poliol e da hexosamina. Na via do poliol, o acúmulo de sorbitol leva a depleção do fosfato de dinucleotídeo de nicotinamida adenina reduzida (NADPH). A via da hexosamina produz excesso de dinucleotídeos acetilados. Em ambos os casos esses subprodutos do excesso de energia levam ao aumento de ROS, perda de energia e inflamação. (6)
4.2 Via do poliol e hexosamina
Níveis sistêmicos elevados de glicose no diabetes levam a glicação de proteínas plasmáticas e teciduais e à formação de produtos finais de glicação avançada (AGE’s). Esse processo não enzimático forma AGE ‘s irreversíveis que se ligam ao receptor da superfície celular chamado RAGE (receptor para AGE).
Figura 4 – Papel das espécies reativas de oxigênio na lesão vascular (8)
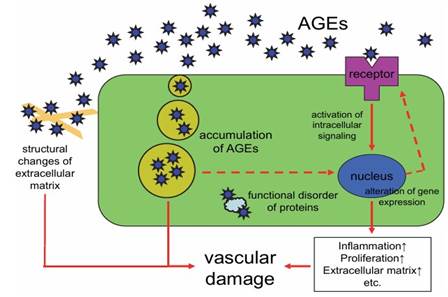
Fonte: Katakami et al. (2017).
A ativação de RAGE aumenta as ROS, promove inflamação neural, interrompe a sinalização celular e altera a expressão gênica normal no sistema nervoso periférico acentuando ainda mais a lesão neural.(6) Como diferentes deficiências metabólicas estão intimamente relacionadas ocorre um ciclo vicioso de avanço do metabolismo alterado, acúmulo de ROS e redução da defesa antioxidante. O conceito de falha bioenergética e estresse oxidativo fornece um mecanismo unificador para danos neurais e para o início e progressão da neuropatia diabética. (6)
Várias outras vias metabólicas foram estudadas no contexto da neuropatia diabética, inclusive como alvos terapêuticos. À luz da importância emergente da bioenergética na patogênese da neuropatia diabética, esforços terapêuticos futuros precisarão abordar tanto a homeostase energética quanto anormalidades específicas das vias metabólicas. (6)
4.3 Associação da Diabetes à Doença Aterosclerótica Multifatorial e sua Repercussão nas Estruturas Vasculares e Neurais de mmii
O diabetes resulta em um estado metabólico anormal com uma tendência aterotrombótica difusa e tem um público semelhantemente acometido pela DAP, as quais agem sinergicamente e conferem às alterações vasculares a maior causa de morbimortalidade nesse perfil de pacientes. As diretrizes da sociedade europeia de cardiologia sugerem que todos os pacientes diabéticos devem ser considerados de alto risco cardiovascular (5-10% de risco de doença cardiovascular fatal em 10 anos) e os pacientes com fatores de risco concomitantes como DAP são considerados de altíssimo risco cardiovascular (risco de 10 anos> = 10% doença cardiovascular fatal) e se beneficiam com tratamento agressivo da dislipidemia e hipertensão arterial sistêmica. (7)
O diabético é mais propenso ao processo de calcificação vascular, diferentemente das artérias coronárias onde a calcificação se dá na camada íntima, nas artérias de mmii coexistem na camada íntima causando redução progressiva da luz arterial e redução da perfusão de órgãos finais, e da camada média causando disfunção do músculo liso e da elastina, levando a redução da complacência vascular, aumentando a rigidez dos vasos e consequentemente a perfusão tecidual além de responder inadequadamente aos estímulos vasoconstrictores ou vasodilatadores. (8)
A neovascularização compensatória em resposta a isquemia crônica por estenoses e oclusões de grandes e médios vasos é prejudicada no paciente diabético e o padrão da doença aterosclerótica é comum aos não diabéticos porém se manifesta em pacientes mais jovens, com apresentação semelhante em homens e mulheres, com evolução mais rápida, caráter difuso, maior grau de calcificação da camada média e com distribuição característica por apresentar maior severidade em artérias infrageniculares. A macroangiopatia potencializa a isquemia neural e dessa forma a revascularização do membro poderia retardar ou estacionar a evolução da neuropatia. (9)
4.4 Associação da Diabetes e a Disfunção Microvascular
Quanto a esse aspecto é pertinente levar em consideração três fatores: o aumento da permeabilidade vascular; a alteração da autorregulação; e alteração do tono vascular associado às alterações microvasculares e metabólicas resultantes dos efeitos crônicos da hiperglicemia discutidos acima que culminam com alterações morfológicas na membrana basal, músculo liso e endotélio vascular. (5)
O espessamento da membrana basal dos capilares não reduz seu lúmen e o fluxo sanguíneo arteriolar pode manter-se normal ou até aumentado. No rim a glicosilação não enzimática reduz a carga elétrica na membrana basal resultando em transudação de albumina, aumento do mesângio e albuminúria. De maneira similar a retina responde ao aumento da permeabilidade capilar com a formação de exsudato macular. Em teoria o espessamento da membrana basal prejudicaria o trânsito celular e a migração de leucócitos em resposta à infecção. (5)
A redução do Óxido nítrico inativado por radicais livres gera perda da capacidade de vasodilatação da microcirculação em resposta ao estresse, prejudicando, por exemplo, a cicatrização de feridas.(5)
4.5 Isquemia Funcional
O fluxo sanguíneo total na microcirculação da pele do paciente diabético sem DAP é semelhante ao de pacientes não diabéticos, porém o fluxo capilar encontrase reduzido falando a favor de isquemia funcional da pele indicado também pela resposta hiperêmica máxima diminuída ao calor evidenciando a incapacidade de vasodilatação. (5)
Fatores neurogênicos desempenham papel importante na sua regulação em razão da inervação simpática dos shunts arteriovenosos. No diabético a neuropatia autonômica causa denervação simpática e perda de contração vascular efetiva, mantendo os shunts permanentemente abertos, o que reduz a circulação pelos capilares. (5)
Essa alteração pode ocorrer em pacientes com Diabetes tipo 1 e em pacientes com macrocirculação patente, respondendo com uma “isquemia capilar crônica”. Contudo no paciente diabético portador de DAP a isquemia é agravada, dificultando o aporte nutricional e a possibilidade de cicatrização de feridas. Também contribuem para o fenômeno de “isquemia capilar crônica” o balanço alterado entre vasoconstritores e vasodilatadores endógenos no nível pré-capilar gerando vasoconstrição e redução da circulação capilar e o aumento do fibrinogênio circulante com aumento da viscosidade sanguínea piorando a perfusão tecidual favorecendo o surgimento de úlceras. 5
4.6 Disfunção Endotelial
Devido a disfunção endotelial gerada pela diabetes, a síntese e liberação de substâncias responsáveis pelo tono vasomotor e na prevenção de trombose como prostaglandinas, endotelinas ou óxido nítrico encontram-se prejudicadas. Graças as respostas metabólicas a hiperglicemia crônica são geradas alterações na via do óxido nítrico (NO), aumento da produção e substâncias vasoconstrictoras, atividade diminuída da Na+/K+/ATPase e aumento dos produtos finais de glicosilação avançada. (5)
O fator de relaxamento derivado do endotélio (EDNO ou óxido nítrico derivado do endotélio) tem efeito vasodilatador causando relaxamento da musculatura lisa da parede arterial em resposta a estímulos de substâncias vasodilatadoras como a acetilcolina. (5)
A insulina modula a síntese e a liberação de EDNO tendo ação vasodilatadora por isso a resposta endotelial ao estímulo de vasodilatação se dá de maneira distinta em pacientes insulino dependentes e não insulino dependentes. Em ambos a resposta à acetilcolina está alterada o que poderia ser corrigido com a administração exógena de liberadores de óxido nítrico como o nitroprussiato de sódio nos pacientes insulino dependentes; já nos não insulino dependentes acreditase que existe uma resposta diminuída do músculo liso ao EDNO ou uma desativação acelerada no NO. (5)
Trazendo à tona a cadeia metabólica celular gerada pelo diabetes, sabemos que existe aumento na produção de radicais livres que contribuem para a disfunção endotelial e dificultam a vasodilatação via EDNO e a administração de “sequestradores de radicais livres” pode favorecer essa resposta ao invés de diminuí-la. (5)
A hiperlipidemia, comum nos pacientes diabéticos, é uma fonte tratável de radicais livres visto que a hiperglicemia gera radicais livres pela sua oxidação. Além de todos os fatores envolvidos na resposta vasodilatadora endotelial mencionados até aqui, os níveis elevados de AGE’s (produtos finais de glicosilação avançada é resultado de uma complexa e irreversível reação entre glicose e proteína que inibe a ação vasodilatadora do EDNO e favorecem a permeabilidade vascular por diminuir a carga elétrica da membrana basal. (5)
4.7 Pseudo-hipoxia Induzida pela Hiperglicemia e seu Impacto na Cicatrização de Feridas
A hiperglicemia mesmo não associada a DAP gera um estado de isquemia tecidual metabólica com menor utilização de oxigênio pelos tecidos visto a metabolização da glicose se dar preferencialmente pela via do sorbitol e não pela via glicolítica, gerando menor produção de energia e níveis elevados de frutose, sorbitol e lactato, prejudicando assim as funções neurais, do funcionamento da musculatura lisa e esquelética e propiciando o aumento da permeabilidade capilar o que acelera a aterogênese devido a entrada de lipídeos e proteínas na região subendotelial.
A menor utilização de oxigênio pelos tecidos no paciente diabético responde o fato de eles serem mais propícios a ulcerações nos pés que pacientes não diabéticos apesar de apresentarem medidas de tensão transcutânea de oxigênio semelhantes, ficando clara a importância do controle intensivo da glicemia para favorecer a cicatrização de feridas. (10)
4.7.1 Neuropatia
A isquemia nervosa foi inicialmente invocada na patogênese da polineuropatia diabética devido a evidência morfológica em biópsias do nervo sural, bem como presença de paredes espessadas dos vasos sanguíneos endoneurais e oclusões vasculares nas autópsias. A isquemia é secundária a disfunção endotelial bem documentada no diabetes, perda de vasodilatação e aumento de vasoconstrição. (2)
A isquemia em si tem consequências metabólicas que podem ser exacerbadas pela deficiência de insulina, hiperglicemia e a inflamação, esta última atuando especificamente na produção de reagentes de fase aguda e interleucinas que desempenham papel na lesão neurológica periférica. A hiperglicemia induz a conversão de glicose em sorbitol pelo aumento da atividade da enzima aldolaseredutase, impedindo a captação de mioinositol pela célula e a diminuição de mioinositol diminui a atividade da bomba de Na+/K+/ATPase culminando em perda da condução elétrica pelo neurônio, levando a achados de destruição axonal e a desmielinização segmentar de distribuição simétrica no sistema nervoso periférico, se apresentando inicialmente nos nervos sensitivos e após anos de evolução nos nervos motores. (5);(10)
A perda de peptídeos neurotróficos, a regeneração e a manutenção tônica é a causa do reparo prejudicado de fibras nervosas os quais incluem fator de crescimento nervoso, fator neurotrófico derivado do cérebro, neurotrofina-3 fatores de crescimento semelhantes à insulina e fator de crescimento endotelial vascular. Além disso, a insulina funciona como fator neurotrófico para neurônios periféricos e, portanto, a perda de insulina no diabetes tipo 1 pode comprometer a viabilidade e o reparo do nervo. (5)
A microangiopatia contribui fortemente com a neuropatia visto a sua contribuição na hipóxia neural por diminuição da irrigação endoneural, aumento da resistência vascular e diminuição da produção de óxido nítrico. (11)
A resposta a um trauma no diabético é prejudicada visto o comprometimento do reflexo axônico que por meio das fibras C nociceptivas transmite o estímulo para a medula espinhal e fibras C adjacentes e outros ramos axonais. (11) Duksal et al elucidaram o papel da inflamação na neuropatia sensitiva em pré diabeticos e diabéticos tipo 2 pois além de a constatação da condução do influxo nervoso nos nervos sural e plantar medial encontrar-se alterada, os níveis de fator de necrose tumoral alfa (pró inflamatório) encontrava-se elevado e os de interleucina10 (antiinflamatória) encontrava-se diminuída em relação ao grupo controle. (12)
4.7.2 Imunopatia
A imunopatia decorrente do estado hiperglicêmico se manifesta com redução significativa da fagocitose leucocitária, a quimiotaxia diminuída dos fatores de crescimento e citocinas e excesso de metaloproteinases o que favorece um estado inflamatório prolongado. A Hiperglicemia de jejum, associada a um ferimento aberto cria um estado hipercatabólico no organismo, e essa disfunção metabólica interfere na síntese proteica, funcionamento de fibroblastos e colágeno, comprometendo o reparo tecidual. A infecção interfere significativamente no controle glicêmico e a hiperglicemia diminui a resposta à infecção, gerando um ciclo vicioso. (13)
Os principais fatores de risco independentes para infecção no pé diabético são: Úlceras cutâneas que penetram até o plano ósseo, úlceras com duração a partir de trinta (30) dias, ulcerações recorrentes, úlceras de etiologia traumática e presença de DAP. (13)
4.7.3 Manifestação Clínica
A polineuropatia axonal crônica caracteriza-se pela perda sensorial simétrica distal, parestesias, cãibras, perda sensorial, dissociação tátil-térmica dolorosa (anestesia térmico dolorosa e sensibilidade tátil preservada), neuropatia dolorosa (queimação, sensação de agulhadas, choque, hiperestesia cutânea), sensação de queimação, fraqueza, diminuição da sensibilidade em pés e a diminuição ou abolição de reflexo Aquileu (mais precoce), com início dos sintomas em dedos dos pés e pés. Pode se apresentar como fraqueza leve, pode acometer nervos intercostais e topo da cabeça, com a perda de reflexos generalizado sendo um achado mais tardio. Tem padrão ascendente e no geral quando já ao nível de panturrilhas inicia o acometimento de mãos, está diretamente relacionada ao comprimento dos axônios, o envolvimento motor (fraqueza) segue o mesmo padrão, contudo mais tardiamente e em casos mais severos. Sintomas como formigamento e dor costumam ser piores a noite. (5)
Um volume considerável de pacientes é assintomático clinicamente, porém a condição pode ser detectada em exame neurológico simples para diagnóstico precoce e manejo adequado. No paciente com a clínica de “pé diabético” temos a associação da neuropatia sensitiva, motora e autonômica gerando uma série de alterações que favorecem o surgimento de úlceras com infecção sobreposta e aumentando substancialmente o risco de amputação. (5)
Figura 5 – Padrão em “Dying Back” da neuropatia axonal[1].
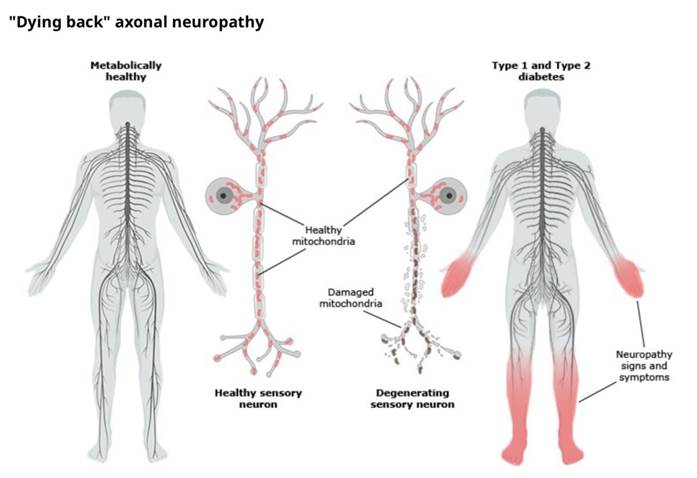
Fonte: Feldman e Shefner (2024).
A neuropatia determina alterações estruturais nos pés, como o envolvimento da musculatura intrínseca do pé (músculos lumbricais e interósseos) que culmina com a diminuição de força e posterior atrofia muscular e propiciando o surgimento da deformidade típica de “dedo em martelo” (dedos em dorsiflexão nas articulações metatarsofalangeanas com flexão nas articulações interfalangeanas com maior pressão na cabeça dos metatarsianos) a qual favorece o surgimento de ulcerações e
calosidades em dedos e em dorso de articulações interfalangeanas com risco de infecção. O comprometimento ósseo e articular dos pés também podedeterminar a queda dos arcos plantares do pé e o surgimento de novos pontos de pressão plantar, favorecendo o surgimento do que conhecemos como “mal perfurante plantar”. (14)
No paciente sem componente de DAP, as feridas apresentam-se em um pé com pulso arterial e perfusão normal ao exame físico e nesses casos o processo de reabsorção óssea é favorecido. A osteólise, processo que ocorre devido a exposição constante à pressão externa em um pé insensível, é observada principalmente em metatarsos e falanges, devendo ser diferenciada da osteomielite que se dá decorrente de um aprofundamento de processos infecciosos. (14)
Figura 6 – Deformidade do pé diabético devdo a neuropatia motora produz ponto de pressão em proeminências ósseas específicas (6)[2]
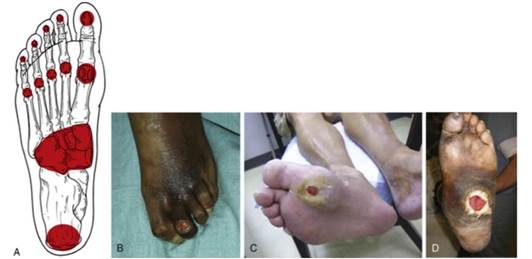
Fonte:Feldman e Shefner (2024).
Em fases mais avançadas há comprometimento ósseo e articular. O pé torna-se edemaciado, mais curto e alargado com o desabamento dos arcos. Deslocamentos ósseos expõem as cabeças dos metatarsianos a traumatismos excessivos e desviam a região protegida do pé que normalmente tem função de sustentação para áreas desprotegidas da superfície plantar, originando novos pontos de pressão e favorecendo o surgimento de calosidades e posteriores ulcerações. Subluxações, fraturas e destruição óssea no pé e tornozelo podem ocorrer devido pequenos traumas, podendo o paciente apresentar ausência de dor local e apenas hipertemia de pé e tornozelo. Esse quadro geral é conhecido como neuro-artropatia de Charcot ou “pé de Charcot”, conhecido na literatura como sendo decorrente de um processo inflamatório incontrolável que acomete pacientes previamente suscetíveis. (14)
O comprometimento de fibras autonômicas gera um estado de “autossimpatectomia” com a anidrose favorecendo o ressecamento e a descamação da pele e favorecendo o surgimento de rachaduras e fissuras principalmente no calcâneo. O pé pode se apresentar quente devido ao comprometimento autonômico apesar de poder ter ausência de pulso. (6)
O componente microangiopático com obstrução de troncos arteriais pode manifestar-se como claudicação intermitente na musculatura posterior da perna ou na região plantar do pé ou manifestar-se já como isquemia grave do pé com lesões tróficas indolores devido componente neuropático que retarda a busca por atendimento médico na maioria das vezes. Quando a isquemia se acentua o pé pode torna-se pálido ou cianótico, hipotérmico e eritro cianótico ao pender o membro, com dificuldade na movimentação de pododáctilos, podendo surgir lesões purpúricas cutâneas decorrentes de capilarite isquêmica sugerindo isquemia grave com alto risco de evolução para gangrena e necessidade de amputação. (6)
A microangiopatia se manifesta clinicamente com aparecimento de necroses cutâneas localizadas que evoluem para úlceras microangiopáticas, extremamente dolorosas e se localizam principalmente na face lateral ou posterior do terço inferior da perna, dorso do pé ou em região maleolar. (6)
Figura 7 – Úlceras microangiopáticas extensas (6)
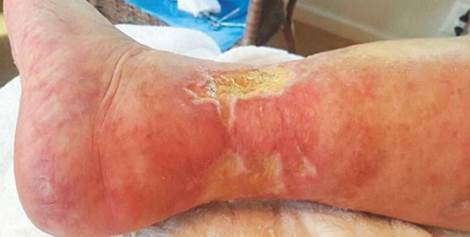
Fonte:Feldman e Shefner (2024).
Figura 8 – Queda do arco plantar em pé diabético neuropático (6)
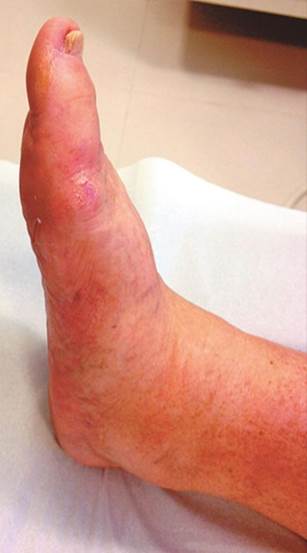
Fonte:Feldman e Shefner (2024).
Figura 9 – Aparecimento radiográfico de colapso de mediopé que gera padrão de “pé em mata borrão”. (6)
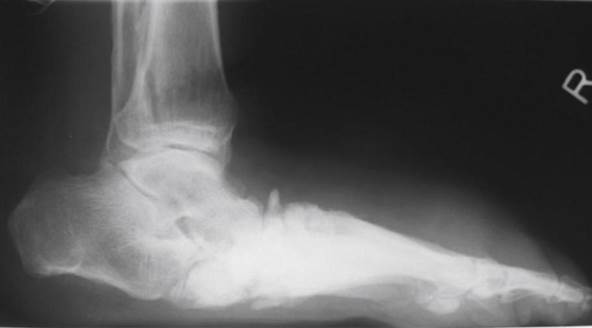
Fonte:Feldman e Shefner (2024).
Figura 10 – Reabsorção óssea em pé diabético (6)
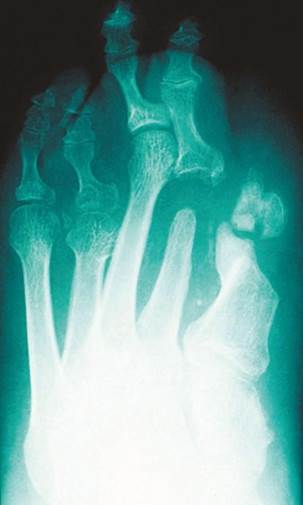
Fonte:Feldman e Shefner (2024).
Figura 11 – Pé neuropático com dedos em martelo (6)
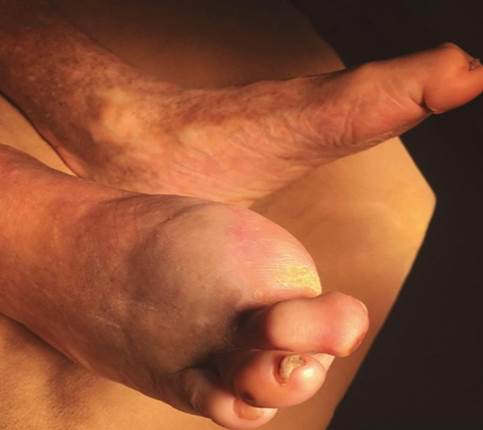
Fonte:Feldman e Shefner (2024).
Figura 12 – Úlcera plantar do pé diabético[3] (6)
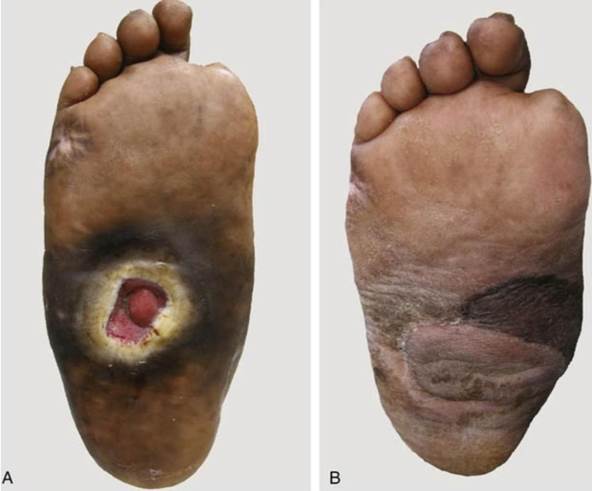
Figura 13 – Sequência de eventos envolvidos na formação de úlceras no pé diabético (15)
Fonte: Feldman Eva L, Shefner (2024).
5 RESULTADOS
De acordo com o material pesquisado, constata-se que no diabetes existe uma complexa gama de fatores metabólicos e vasculares que alteram o equilíbrio entre o dano e o reparo da fibra nervosa, homeostase metabólica, a produção energética e culmina com consequências devastadoras no funcionamento normal do organismo humano, quanto a neuropatia, leva ao funcionamento inadequado de fibras sensoriais, autonômicas e motoras distais culminando com a alterações de sensibilidade, capacidade de auto proteção, diminuição de propriocepção e finalmente ao comprometimento motor que fundamentam as manifestações clínicas da polineuropatia diabética
6 DIAGNÓSTICO
Questionar acerca de uso de álcool, presença de comorbidades, uso de quimioterápicos, sintomas virais recentes, presença de sintomas sistêmicos, uso de novas medicações, exposição a solventes, metais pesados ou outras potenciais toxinas, histórico familiar de doença neurológica, avaliação de deficiências vitamínicas (uso de metformina e vitamina B12 com aumento em cerca de 20% dos pacientes em 5 anos), história de cirurgia bariátrica, presença de síndromes desabsortivas para avaliação de outras etiologias, visto a neuropatia periférica diabética tratar-se de um diagnóstico de exclusão. Sinais e sintomas como perda distal de sensibilidade ao teste de monofilamento/alfinete, toque leve, vibração, frio e propriocepção, reflexos hipoativos ou ausentes, presença de úlcera plantar indolor falam a favor de doença neuropática periférica. O principal diagnóstico diferencial da polineuropatia periférica por diabetes são doenças do sistema nervoso central (espinha dorsal) com manifestação de formigamento e fraqueza de extremidades.(4)
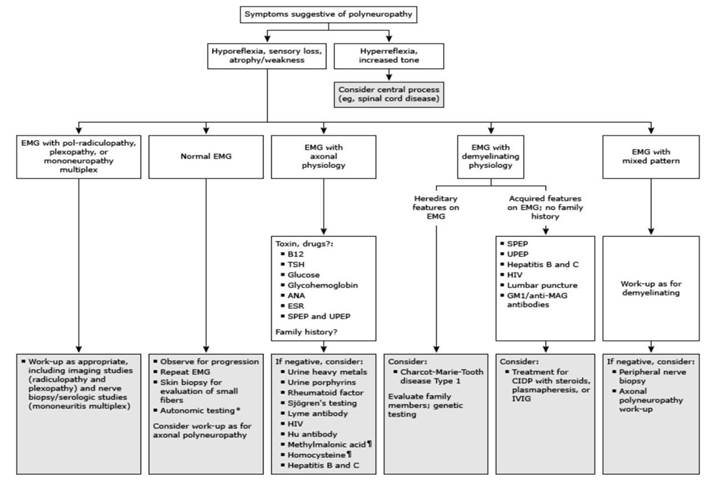
Em pacientes diabéticos com queixa neurológica em membros inferiores fora do padrão esperado (assimetria, ausência de relação com comprimento axonal, predominância motora, quadro agudo, envolvimento autonômico, apresentação inicial severa ou rápida progressão de sintomas, presença de ataxia sensorial) devese realizar investigação aprofundada junto ao profissional mais habilitado na investigação visto possivelmente tratar-se de outra etiologia neuropática. O estudo eletroneuromiográfico deve ser aventado para elucidar quanto a natureza da neuropatia: se neural ou muscular, axonal ou desmielinizante e se se trata de polineuropatia ou mononeuropatia periférica, complementando o exame físico.
O estudo eletroneuromiográfico de desordens desmielinizantes mostram: diminuição da velocidade de condução do nervo, dispersão do potencial evocado, bloqueio de condução e o prolongamento marcado das latências distais. Já o estudo de desordens axonais são caracterizados por: redução da amplitude do componente de potenciais de ação evocado com relativa preservação da velocidade de condução do nervo. (16)
No exame físico atentar para: i) Tipo de polineuropatia: axonal ou desmielinizante? e ii) Perfil de fibras nervosas envolvidas: Motoras? Sensitivas?
Como médico clínico ou cirurgião vascular assistente os principais testes disponíveis no nível ambulatorial para analisar a perda funcional de sensibilidade cutânea estão relacionados a percepção tátil em testes de avaliação de pressão e vibração. Vários testes são utilizados no diagnóstico da polineuropatia como: teste da sensação vibratória com diapasão de 128 Hz, teste da sensação dolorosa com estilete, teste da sensibilidade térmica, teste da sensação profunda com martelo (reflexo do tendão de Aquiles), teste do monofilamento, entre outros. Entre esses, o teste do monofilamento, por detectar as alterações na sensação do tato e da propriocepção, é o de escolha para definir um risco aumentado de ulceração, além disso, apresenta grande sensibilidade, boa especificidade, simplicidade e baixo custo. (17)
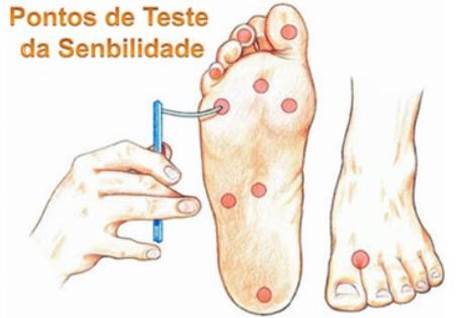
Teste do monofilamento (Semmes-Weinstein 10g): com o objetivo de avaliar sensibilidade pressórica, o monofilamento de Semmes-Weinstein é um instrumento manual contendo uma fibra de náilon com força de 10 gramas, que deve ser aplicado à planta do pé do paciente, a um ângulo de 90° e com pressão capaz de curvar o monofilamento mediante ao toque do aparelho em 10 regiões do pé (primeiro, terceiro e quinto dígitos plantares; primeira, terceira e quinta cabeça dos metatarsos plantares; laterais esquerda e direita do meio plantar; calcâneo e dorso entre primeiro e segundo dedos) com o paciente dizendo “sim”, a cada vez que perceber a aplicação da fibra. A incapacidade para distinguir o monofilamento em quatro pontos ou mais, é sugestiva de perda da sensação de proteção. (17);(68).
Diapasão de 128Hz: Com o intuito de avaliar a sensibilidade vibratória, o diapasão de 128HZ deve ser aplicado, de forma perpendicular, sobre a parte óssea dorsal da falange distal do hálux. Se houver incapacidade da percepção de vibração neste local, o teste deve ser repetido em segmentos mais proximais como o maléolo ou tuberosidade da tíbia. O teste é qualificado como positivo (sensibilidade vibratória preservada) quando, após três aplicações, a pessoa responde corretamente a pelo menos duas delas. (17); (68)
Figura 14 – Pontos de teste de sensibilidade do monofilamento de Semmes-Weinstein 10g (17)
Fonte: Nascimento et al. (2015).
Estudos mostram que a associação entre os testes de avaliação de sensibilidade pressórica (monofilamento de Semmes-Weinstein) e avaliação da sensibilidade vibratória (diapasão de 128Hz), há 100% de sensibilidade e 77% especificidade para diagnóstico de neuropati periférica diabética. (17) Em relação à avaliação do pé diabético, quanto ao risco para ulcerações e amputações, alguns autores preconizam a categorização do pé diabético segundo o National Institute of Diabetes & Digestive & Diasease. (17)
Quadro 1 – Categorias para ulceração e amputação segundo o National Institute of Diabetes & Digestive & Diasease. (17); (68)
| Pé diabético de baixo risco | Pé diabético de alto risco | ||
| Presença de todas as cinco condições abaixo | Presença de qualquer uma das condições abaixo | ||
| 1. Presença de sensibilidade protetora (percepção monofilamento 10g de Semmes- Weinstein) | 1. Ausência de sensibilidade protetora (percepção monofilamento 10g de Semmes-Weinstein) | ||
| 2. Presença de pulsos distais | 2. Ausência de pulsos distais | ||
| 3. Ausência de deformidades graves | 3. presença de deformidades graves | ||
| 4. Ausência de ulceração prévia | 4. Presença de ulceração prévia | ||
| 5. Ausência de amputação prévia | 5.Presença de amputação prévia | ||
| Fonte: Elaborado com base em Nascimento et al. (2015); Ochoa-Vigo e Pace (2005). | |||
Figura 15 – Fluxograma diagnóstico da polineuropatia (4)
Fonte: Rutkove e Shefner (2024).
Uma investigação extensa não é necessária em um paciente com sintomas leves que tenha uma causa subjacente conhecida de neuropatia (diabetes, abuso de álcool, quimioterápicos). E deve ser realizada em pacientes sem etiologia clara ou com sintomas graves e/ou rapidamente progressivos. Além disso uma avaliação diagnóstica completa deve ser buscada em pacientes com características atípicas de neuropatia periférica[4].
Quadro 2 – Testes laboratoriais na polineuropatia (6)
| Fisiopatologia predominantemente axonal |
| Testes iniciais |
| Glicose sérica e hemoglobina glicada |
| Vitamina B12 sérica |
| Eletroforese de proteínas séricas |
| Eletroforese de proteínas urinárias |
| Testes de função tireoidiana |
| FAN |
| Testes adicionais se história sugestiva |
| Sorologia para HIV |
| Testagem de metais pesados urinário e sérico |
| Porfirinas urinárias e séricas |
| Fator reumatoide |
| Teste de síndrome de Sjögren (anticorpos anti-Ro e anti-La) |
| Painel para síndromes paraneoplásicas (em pacientes com neuropatia sensorial) |
| Teste para doença de Lyme |
| Ensaio de ativação de transcetolase eritrocitária de vitamina B1 (tiamina) ou nível de sangue total |
| Níveis de ácido metilmalônico e homocisteína (em paciente com níveis séricos de vitamina B12 quase baixos) |
| Rastreio de hepatite (B e C) |
| Anticorpos anticitoplasma de neutrófilos (ANCA) |
| Hemograma completo com diferencial (a procura de eosinofilia) |
| Crioglobulinas |
| Fisiopatologia predominantemente desmielinizante |
| Testes iniciais |
| Eletroforese de proteínas séricas e urinárias com imunofixação |
| Rastreio para hepatite (B e C) |
| Punção lombar |
| Testes adicionais, se histórico sugestivo: |
| Anticorpos antiglicoproteína aasociada a mielina (MAG)(em paciente com sintomas predominantemente sensoriais ) |
| Anticorpos nodais e paranodais (por exempli: anti GM1, neurofascina 155, contactina-1 e anticorpos de proteína 1 associado a contactina) em pacientes com sintomas predominantemente motores |
| HIV |
| Teste genético para doença de Charcot-Marie-Tooth; geralmente, a eletrofisiologia também sugere uma condução hereditária |
Fonte:Feldman e Shefner (2024).
Quadro 4 – Outras causas de neuropatia periférica
| Doença | Observação | ||
| Metabólicas | |||
| Diabetes | Causa mais comum, contabilizando de 32- 53% dos casos* | ||
| Pré diabetes | Teste de tolerância a glicose tem alta sensibilidade | ||
| Doença renal crônica | Neuropatia particularmente severa quando a doença renal crônica é causada pelo diabetes | ||
| Doença hepática crônica | Neuropatia tipicamente leve | ||
| Idiopática | 24-27% de todos os casos * | ||
| Toxinas (álcool) | Segunda causa mais comum. Exige um questionário mais aprofundado | ||
| Hereditária | |||
| Doença de Charcot-Marie-Tooth tipo 1 | Neuropatia desmielinizante hereditária sensorial e motora | ||
| Doença de Charcot-Marie-Tooth tipo 2 | Neuropatia axonal hereditária sensorial e motora | ||
| Amiloidose familiar | Mutação mais comum da transtiretina | ||
| Nutricional | |||
| Deficiência de vitamina B12 | Nível de ácido metilmalônico é importante quando nível de vitamina B12 esta entre |
| 200-400 picogramas/ml | |||||
| Deficiência de vitamina B6 | Pode causar neuropatia quanto em níveis muito elevados ou muito baixos | ||||
| Deficiência de vitamina E | Pode causar ataxia cerebelar | ||||
| Deficiência de tiamina | Pode apresentar ataxia, oftalmoparesia e confusão mental | ||||
| Deficiência de Cooper | Algumas vezes presente com mieloneuropatia | ||||
| By pass gástrico | Algumas vezes difícil determinar fator causador | ||||
| Síndromes disabsortivas | Algumas vezes difícil determinar fator causador | ||||
| Medicações | |||||
| Quimioterápicos (Vincristina, Bortezomib, Cisplatina, Taxol) | Conhecer as doses terapêuticas de cada droga, evitando efeitos colaterais | ||||
| Amiodarona | Pode causar neuropatia desmielinizante | ||||
| Fenitoína | Após muitos anos de uso | ||||
| Nucleosídeos | Dificuldade em distinguir a causa da neuropatia (HIV versus medicação) | ||||
| Nitrofurantoína | Arriscado em estágios de disfunção renal | ||||
| Metronidazol | Geralmente após doses altas, intravenosas e por tempo prolongado | ||||
| Hidralazina | Evitar uso concomitante com vitamina B6 | ||||
| Isoniazida | Evitar uso concomitante com vitamina B6 | ||||
| Colchicina | Também pode causas miopatia | ||||
| Autoimune | |||||
| Artrite reumatoide | Também pode causar mononeurite múltipla | ||||
| Lupus | Também pode causar mononeurite múltipla | ||||
| Sindrome de Sjögren | Também pode causar mononeurite múltipla ou neuropatia sensorial | ||||
| Sarcoidose | Pode manifestar múltiplas síndromes neurológicas | ||||
| Amiloidose secundária | Diagnostico realizado através da biopsia de gordura ou do nervo sural | ||||
| Infecciosa | |||||
| HIV | Tratamento medicamentoso também causa neuropatia | ||||
| Hepatite B e C | Também pode causar mononeurite múltipla associada com poliarterite nodosa e | ||||
| crioglobulinemia | |||||
| Neoplásica | |||||
| Gamopatia monoclonal clinica não esclarecida | de | significância | A imunofixação aumenta a sensibilidade de detecção de paraproteinas | ||
| Mieloma múltiplo | Associado com paraproteinemia por IgG ou IgA | ||||
| Amiloidose primária | Diagnostico realizado com biopsia de gordura ou do nervo sural | ||||
Fonte:Feldman e Shefner (2024).
7 DISCUSSÃO E MANEJO
O tratamento da neuropatia periférica parte do manejo adequado da condição de base do paciente que culmina com o quadro neurológico. Após sua instalação a neuropatia já se trata de um quadro considerado irreversível e o manejo busca retardar a progressão e prevenir complicações como úlceras, artropatia e quedas.
O tratamento da dor neuropática no paciente diabético busca a melhora da funcionalidade nervosa e bloqueio da transmissão dos impulsos dolorosos sendo a maioria dos fármacos antineuríticos os antidepressivos tricíclicos, anticonvulsivantes, simpatomiméticos e agentes tópicos.
Além da dificuldade no manejo das drogas quanto à dose efetiva para cada paciente e a associação entre elas, a presença de efeitos adversos significativos e a refratariedade clínica a tais medicações motivam a busca por novas abordagens, que possam contribuir no manejo adequado da dor nessa população, uma vez que essa experiência interfere diretamente na qualidade de vida das pessoas, levandoas frequentemente à incapacidade e invalidez.
Nesse sentido, as terapias não farmacológicas como, a acupuntura, fototerapia com infravermelho monocromático, terapia a laser de baixa intensidade, neuroestimulação elétrica trans e percutânea, reike e estimulação eletromagnética (FREMS) têm sido utilizadas ainda que não haja consenso sobre a utilização das mesmas. (19)
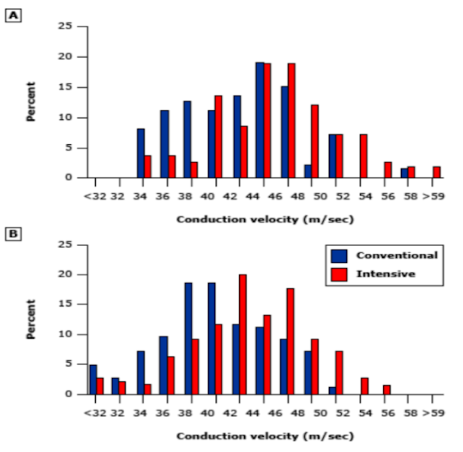
Em uma meta-análise do DCCT (The Diabetes Control and Complications Trial) e um ensaio adicional com 1228 pacientes com DM1, o controle aprimorado da glicemia reduziu o risco anual de neuropatia (diferença absoluta do risco -1,8%, IC 95% -2,6 a -1,1), a incidência de neuropatia clínica após 5 anos (8 versus 17%; risco relativo 0,46, ic 95% 0,33-0,63) e reduziu medidas de progressão de neuropatia como capacidade de percepção de vibração e a velocidade de condução nervosa evidenciou que um controle de glicemia intensivo retarda o surgimento de sintomas de neuropatia bem como de marcadores eletrofisiológicos. (20); (21); (22)
Em pacientes com diabetes tipo 2 o controle glicêmico tem um efeito mais modesto no curso da neuropatia. Uma meta análise de 4 ensaios clínicos com 6669 pacientes com diabetes tipo 2 encontrou uma tendência não significativa para uma pequena redução no risco anual de neuropatia com controle rigoroso de glicemia (0,58%, IC 95% -1,4-0,01). A falta de um efeito isolado maior no controle rigoroso da glicemia revela uma diferença na fisiopatologia da neuropatia no DM1 e no DM2, que se relaciona com componentes da síndrome metabólica, determinando a necessidade de uma abordagem com múltiplos alvos no DM2 como a normalização do perfil lipídico, controle da pressão arterial, de peso, glicêmico, modificações no estilo de vida, dieta saudável além de exercícios regulares. (23)
Figura 16 – Benefícios do controle glicêmico na neuropatia diabética no paciente
7.1 Manejo da Neuropatia
Em uma revisão sistemática de 20 ensaios clínicos, o exercício físico foi associado a melhorias na função, velocidades de condução nervosa e controle glicêmico em pacientes com neuropatia diabética já estabelecida.(24) Em um estudo retrospectivo caso controle com mais de 15000 adultos obesos com DM 2, a cirurgia bariátrica esteve associada a uma baixa taxa de neuropatia em cinco (5) anos (7 versus 21%), assim o advento da cirurgia bariátrica, tem um potencial redução na incidência de neuropatia, nefropatia e retinopatia além de outras complicações microvasculares. (25)
Gráfico ilustrando a velocidade de condução motora do nervo peroneal após cinco anos de tratamento antidiabético convencional (barras azuis) ou intensivo (barras vermelhas) para pacientes com diagnostico provável de neuropatia periférica (parte A) e em pacientes com diagnostico de neuropatia periférica já bem estabelecido (parte B). A velocidade de condução nervosa é significativamente maior em ambas as abordagens antidiabéticas intensivas). (16)
Inibidores da aldolase redutase (IAR): A aldolase redutase é um enzima que catalisa a conversão de glicose em sorbitol e o aumento na concentração de sorbitol além de outras alterações metabólicas ocorridas no interior do nervo são fatores que agravam a neuropatia. Reduzir a concentração de sorbitol (através da via do Poliol, ativada pela hiperglicemia) no nervo favorece a regeneração e fibras nervosas, melhoraria a condução através dessas fibras e diminuiria a parestesia e dor. (55)
A avaliação da dor não é um parâmetro adequado visto que a mesma pode diminuir enquanto a neuropatia progride e aumentar com a regeneração nervosa. Os inibidores da aldolase-redutase têm melhores resultados quando aplicados em fases iniciais e intermediárias da neuropatia quando apenas alteração de velocidade de condução nervosa e/ou sintomas neurológicos recentes estão presentes. São os dois mais conhecidos dessa classe de medicamentos: Tolrestat e Zolporestat. Podem causar elevação de enzimas hepáticas. Mais trabalhos devem ser realizados para o estudo da efetividade, dose terapêutica e possíveis riscos à saúde. (55)
Estudos demonstrarm que IAR’scomo o Zenarest, melhoraram a velocidade de condução nervosa e a morfologia dos nervos em pacientes com neuropatia diabética, indicado que a inibição da via do poliol pode reverter ou atenuar a progressão da neuropatia, além de melhorar as correntes de sódio nodais e a condução nervosa. Em comparação com a diosgenina que atua como neuroprotetor reduzindo o estresse oxidativo e inflamação, os IAR atuam diretamente na via metabólica atuando diretamente sobre as alterações que afetam a perfusão nervosa e neuronal. (55)
Inibidores de fosfodiesterase (iPDE): com foco nos subtipos PDE4 e PDE5, a literatura tem mostrado que os PDE’s através da modulação e vias de sinalização intracelular que afetam o estresse oxidativo, a inflamação e a apoptose podem ser elementos no tratamento da neuropatia periférica. O Sildenafil (inibidor de PDE5) mostrou melhorar a função neurológica em camundongos diabéticos, aumentando a espessura da bainha de mielina e melhorando a condução motora e sensorial atuando na via de sinalização cGMP/PKG. Já os inibidores de PDE4 como o Rolipram, demonstraram efeitos protetores contra a neurotoxicidade causada pela glicose em células PC12-um modelo in vitro para neuropatia diabética. (55)
Modulando os níveis de AMP cíclico podem reduzir o dano oxidativo, a neurodegeneração e a inflamação. O cilostazol mostrou-se capaz de restaurar morfológica e funcionalmente os nervos periféricos em ratos diabéticos por aumentar a atividade da bomba Na+/K+/ATPase e a produção de AMP cíclico e óxido nítrico nas fibras nervosas. Contudo mais estudos devem ser realizados para avaliação do uso da droga em seres humanos. (56); (59)
Gangliosídeos: experimentalmente essas substâncias podem promover rápida reinervação por aumentarem as comunicações axonais. São encontradas normalmente na membrana neuronal e se relacionam com receptores de neurotransmissores. Em humanos foi verificada discreta melhora na velocidade de condução nervosa, sem significado estatístico. (57)
Neurotrofinas: em estudos com animais, o uso de fator de crescimento de nervos mostrou resultados promissores, o que não se confirmou com pacientes com neuropatia periférica diabética. (58)
7.2 Manejo de Dor
Terapias medicamentosas: A escolha das medicações deve ser baseada no perfil do paciente, suas comorbidades, interações medicamentosas, efeitos colaterais e custo. A primeira linha de medicações utilizadas no manejo da neuropatia diabética dolorosa inclui antidepressivos (duloxetina, venlafaxina, amitriptilina e outros triciclicos) e gabapentinoides anticonvulsivantes (gabapentina e pregabalina). Pela via tópica a Capsaicina também pode ser utilizada apesar da baixa tolerabilidade. (3)
Inibidores Duais De Serotonina-Norepinefrina (ISRSN): são escolhas para pacientes de qualquer idade, no geral são bem toleradas e tomadas uma vez ao dia. Em pacientes jovens sem cardiopatia, antidepressivos tricíclicos são alternativas viáveis aos (ISRSN) e são preferidos em pacientes com insônia. (3)
Duloxetina: um ISRSN é a droga de primeira linha no tratamento da dor neuropática em pacientes diabéticos. Também atua no tratamento da depressão, fibromialgia e ansiedade. Seu efeito modulador de dor se deve a norepinefrina sináptica e pelos efeitos na percepção central de dor. A dose inicial recomendada para o tratamento de neuropatia diabética é 20-30mg/dia podendo ser gradualmente ajustada, observando-se tolerabilidade e resposta, até o máximo de 60-120mg/dia. Uma piora da dor pode ocorrer na primeira semana de tratamento. Deve-se orientar os pacientes a tomar em jejum afim de reduzir intolerabilidade gástrica. Não deve ser tomada com outro ISRSN ou tricíclicos, mas pode ser associado a pregabalina ou gabapentina. Efeitos colaterais comuns são: náusea, sonolência, tontura, redução de apetite, constipação, diaforese e disfunção sexual. Pode ocasionar aumento de peso, exacerbação da síndrome de pernas inquietas, que é comum em pacientes com neuropatia periférica e prejudicar o sono. (3)
Venlafaxina: trata-se de ISRSN, com espectro de ação similar a duloxetina, porém não tão bem estudado para o tratamento de neuropatia periférica, ainda assim sendo um bom substituto da duloxetina. Recomenda-se a dose inicial de 37,5 mg/dia com progressão de dose até a dose efetiva de 75-225 mg/dia. Efeitos colaterais comuns são: náusea, sonolência, tontura, diaforese, disfunção sexual, dispepsia, insônia. O aumento de pressão arterial e frequência cardíaca podem ocorrer. Pode ocasionar exacerbação da síndrome de pernas inquietas e não deve ser tomada com outro ISRSN ou tricíclicos, mas pode ser associado a pregabalina ou gabapentina.(3)
Gabapentinoides: são utilizados, por exemplo, em pacientes com síndrome de pernas inquietas. Gabapentina e pregabalina são similares quanto a efeitos colaterais e necessitam de ajuste renal. (3)
Pregabalina: Droga de primeira linha, alternativa aos antidepressivos, com perfil anticonvulsivante, ligante do alpha 2 delta e de características similares a gabapentina. A modulação da dor se dá pela inibição pré-sináptica da liberação de neurotransmissores excitatórios como glutamato, substância P, peptídeo relacionado ao gene da calcitonina (CGRP). A dose inicial para o quadro é de 75-150mg/dia, incrementar 75mg/dia a cada 3-7 dias. A dose máxima aprovada pelo FDA para neuropatia diabética é de 300mg/dia, contudo chega a se administrar 450mg/dia. Doses mais elevadas têm menor tolerabilidade e incremento adicional limitado. Efeitos colaterais comuns incluem: tontura, sonolência, edema periférico e ganho de peso. (3)
Gabapentina: Similar a pregabalina com custo menor. A dose inicial é de 100-300mg/dia em 1-3 tomadas/dia, podendo ser progressivamente aumentada até 900-3600mg/dia dividida em 3 tomadas. Os principais efeitos colaterais são: sonolência, tontura e ataxia. (3)
Tricíclicos: São drogas efetivas no tratamento de neuropatia periférica, contudo devem ser utilizadas com cautela para este propósito, pelo risco de efeitos colaterais graves. Deve-se realizar avaliação cardiológica previamente ao início do uso. O mecanismo de ação envolve a percepção central de dor via efeitos nas monoaminas sinápticas. A dose inicial para a amitriptilina ou nortriptilina é de 10-25mg/dia com graduação progressiva. (3)
Quadro 4. Farmacoterapia na neuropatia diabética dolorosa e comorbidades que influenciam na escolha de drogas (3)
| Classe da droga | Comorbidades que favorecem o uso | Comorbidades que não favorecem o uso |
| Inibidores seletivos da receptação de serotonina e norepinefrina Duloxetina Venlafaxina | Depressão Ansiedade | Síndrome das pernas inquietas Disfunção sexual (venlafaxina) Glaucoma de ângulo fechado |
| Antidepressivos tricíclicos • Amitriptilina | Depressão Ansiedade Insônia | Doenças cardíacas Intervalo QT prolongado Hipotensão ortostática |
| Nortriptilina Desipramina | Disfunção sexual Retenção urinária Glaucoma de Ângulo fechado | |
| Gabapentinoides Pregabalina Gabapentina | Síndrome das pernas inquietas Tremor essencial Insônia | Abuso de substâncias Edema periférico Doença pulmonar obstrutiva crônica |
Fonte: Feldman et al. (2024)
Terapias não medicamentosas no manejo da dor neuropática
Eletroestimulação: Em 2010 a Academia Americana de Neurologia avaliou o uso de “TENS” (estimulação elétrica nervosa transcutânea) para manejo de dor em distúrbios neurológicos e concluiu que é eficaz no tratamento de neuropatia diabética. A estimulação nervosa elétrica percutânea (agulhas com estimulação elétrica em frequência alternada de 15 e 30 Hz) foi utilizada para tratamento de dor em 50 pacientes adultos com neuropatia diabética dolorosa periférica, em estudo randomizado, placebo controlado (sham – somente agulhas) por 3 semanas. Cada série de tratamento foi administrada por 30 min, três vezes por semana. Os resultados mostraram que a diferença entre os escores de intensidade da dor (medida por meio de escala VAS (escala analógica de dor)) entre o grupo tratamento (intensidade de dor no início: M=6,2; dp=1,3 e na terceira semana M=2,6; dp=0,9) e o grupo controle (intensidade de dor início: M=5,2; dp=1,6 e após 3 semanas: M=4,8; dp=1,2), foi significativa. Diferença significativa também foi observada entre intensidade de dor e solicitação de analgésicos ao longo do tempo, mostrando que o grupo tratamento necessitou de menos analgésicos e obteve melhor controle álgico. Os autores do estudo ressaltaram que, embora os mecanismos precisos da analgesia por TENS ainda que não sejam totalmente claros, parecem guardar relação com a modulação neural e aumento de opióides endógenos. (3); (60)
FREMS (estimulação eletromagnética neural de frequência modulada): estudos revelaram redução significativa da dor, mediante estimulação eletromagnética neural por modulação da frequência (FREMS) em pacientes com neuropatia periférica, com idades entre 18 e 70 anos. Ademais, os autores apontaram melhoria na função de nervos periféricos e alertaram sobre a necessidade de pesquisas adicionais para confirmação dos benefícios dessa terapia (23). Um estudo randomizado, duplo-cego, placebo controlado, realizado com amostra de 31 pacientes diabéticos, com média de idade de 63,1 anos e tempo médio de doença de 15,9 anos, apontou aumento do fluxo sanguíneo cutâneo em situação de repouso, após duas séries de dez sessões de tratamento com estimulação neural eletromagnética por frequência modulada (FREMS), aplicada em sequência aleatória, no prazo máximo de 3 semanas. A técnica FREMS modula dinamicamente a frequência dos impulsos ajustando-os aos tecidos alvo, aumenta a perfusão sanguínea em pequenos vasos da pele e de nervos periféricos, reduz a dor neuropática por modular a atividade de nervos sensoriais e estimula a regeneração de fibras nervosas melhorando a condução de estímulos.(3); (60)
PEMF (campos eletromagnéticos pulsados): A exposição repetitiva e cumulativa dos campos eletromagnéticos pulsados em baixa frequência (PEMF) também foi utilizada com o objetivo de verificar eficiência na redução da dor neuropática em estudo multicêntrico, randomizado, duplo-cego, placebo controlado, do qual participaram 225 indivíduos com idades entre 18 e 87 anos, que apresentavam neuropatia diabética dolorosa (intensidade de dor moderada a grave (4 ou mais em Escala Analógica Visual de 0-10), com duração de 6 meses ou mais. Cada paciente utilizou dispositivos idênticos, gerando PEMF ou sham (placebo) durante 287 horas por dia nos pés, durante 3 meses, com dosimetria de 1800-G. Concluíram que não houve efeito positivo na modulação da dor na dosimetria e tempo utilizados; no entanto, alertaram para a necessidade de novas pesquisas com dosimetria maior (3000-5000G) e maior tempo de exposição, para investigar a influência da PEMF na regeneração nervosa. Os benefícios verificados em estudos mostraram: redução significativa de dor após sessões regulares, melhora da condução nervosa e redução de dormência e formigamento e diminuição da inflamação em tecidos nervosos danificados. Sua eficácia pode variar conforme a frequência utilizada, intensidade e duração do tratamento. (3); (60)
Estimulação da medula espinhal: Aprovado pelo FDA nos EUA para tratamento da dor neuropática diabética particularmente a estimulação de alta frequência (10kHz) tem demonstrado resultados promissores em ensaios clínicos randomizados com potencial de proporcionar alívio substancial da dor e melhorar a qualidade de vida em pacientes com dor neuropática refratária. Trata-se da estimulação elétrica pulsada através de eletrodos epidurais implantados via percutânea e distribuídos correspondendo a distribuição de dor. Mais estudos de alta qualidade são necessários para estabelecer protocolos padronizados e avaliar eficácia do tratamento a longo prazo, além do que a escolha entre estimulação de medula espinhal e estimulação elétrica nervosa transcutânea (TENS) pode depender da extensão da neuropatia, resposta a tratamentos anteriores e preferências do paciente. Nos estudos foram designados pacientes com refratariedade da dor a despeito da terapia medicamentosa. A modalidade pode ter uma taxa de resposta mais alta e um efeito mais duradouro que a estimulação de baixa frequência. A técnica utiliza um neuroestimulador implantado que envia estímulos elétricos para a medula espinhal modulando a transmissão da dor antes que ela chegue ao cérebro. Eletrodos são inseridos na região epidural da medula espinhal, geralmente entre as vertebras lombares ou torácicas a depender da área afetada e o paciente pode controlar a intensidade da estimulação por meio de um dispositivo externo. Os principais efeitos são: bloqueio da dor neuropática, modulação da atividade nervosa e melhora da circulação periférica. (2); (60)
Fotoestimulação: a literatura sugere que a fotobiomodulação (PBM) pode ser eficaz na redução da dor e na melhoria da função nervosa em pacientes com neuropatia periférica diabética, por melhorar a condução nervosa e consequentemente aliviar sintomas clínicos. A terapia com laser de baixa intensidade (LLLT), uma forma de PBM, tem mostrado resultados promissores sugerindo a capacidade de otimizar a regeneração axônica periférica e melhorar a função motora, sendo necessários mais estudos para confirmar a sua eficácia e segurança. (3, 62, 63, 65)
Em comparação com outras modalidades terapêuticas, o uso de PBM consiste numa opção não invasiva e potencialmente segura, porém que ainda necessita de evidências mais robustas para recomendação como tratamento de 1° linha. Já a estimulação elétrica com a TENS e a estimulação da medula espinhal já possuem mais embasamento teórico e prático em termos de eficácia para o uso no tratamento da neuropatia periférica dolorosa. (3, 61, 62, 64)
Figura 17 – Formulário de screening de neuropatia de Michigan (18)
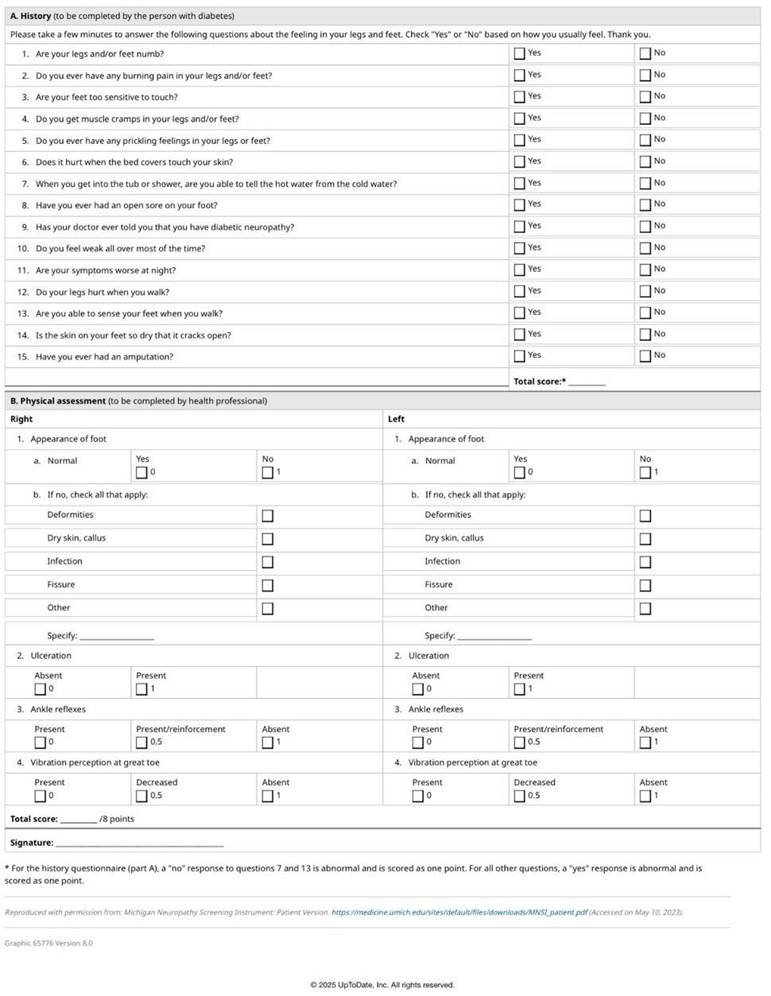
Fonte: Feldman et al. (2024).
Infravermelho, uma modalidade de fotoestimulação: Os efeitos do infravermelho monocromático, também foram investigados em estudo duplo-cego, placebo controlado. Os sujeitos receberam ativos do infravermelho monocromático ou um fictício durante 2 semanas e tiveram a sensibilidade nas extremidades avaliada por meio de Monofilamentos Semmes Weinstein (SWM) de 5,07 e 6,65 e o Michigan Neuropathy Screening Instrument (MNSI). Entre as 27 pessoas que participaram do estudo, nove foram insensíveis ao SWM 6,65 e 18 sensíveis, porém, insensíveis ao 5,07 SWM. A dor, mensurada por meio de uma Escala Analógica Visual, diminuiu progressivamente no grupo sensível ao SWM 6,65, e no grupo insensível a esse monofilamento, a redução da dor não foi significativa. 66 Os autores concluíram que o tratamento com infravermelho monocromático melhora a sensação nos pés de indivíduos com neuropatia periférica e, concomitantemente, reduz a dor neuropática. Vale lembrar que em estudo longitudinal de coorte com 2.239 participantes (média de idade igual a 73 anos), o infravermelho monocromático (MIRE) proporcionou redução da dor em 4,8 pontos (escala VAS) e melhora clínica significativa na sensação dos pés. (27, 62, 64)
Figura 18 – Escala visual analógica de dor (67)
Fonte: Disponível em: https://sl.bing.net/hnCXO9Q7dv2 Acesso em: 19 fev. 2025.
Acupuntura: Trata-se de uma terapia não medicamentosa, efetiva para controle de dor neuropática dolorosa, podendo ser utilizada em terapia multimodal no controle dos sintomas. A literatura médica sugere que a acupuntura pode ter efeitos benéficos na modulação da dor neuropática e na promoção da regeneração nervosa através de vários mecanismos, incluindo a modulação de neurotrofinas e remodelação do sistema nervoso. 28 A acupuntura pode modular a sinalização nervosa e o “crosstalk” neuroimune, o que pode contribuir para seus efeitos analgésicos em condições de dor neuropática. A acupuntura pode desempenhar um papel na gestão da neuropatia periférica potencialmente através da modulação de neuropeptídeos e neurotrofinas, promovendo a sobrevivência e função neuronal. No entanto, a variabilidade nos resultados dos estudos sugere a necessidade de mais pesquisas para se estabelecer protocolos de tratamento. (29, 30)
Cannabis: com evidências ainda limitadas e de qualidade variável, o papel do cannabis tanto na forma de tetrahidrocanabinol (THC) e canabidiol (CBD) quanto no manejo da neuropatia diabética tem sido objeto de estudo. Wallace et al (31).demonstrou que o uso de cannabis THC inalada resultou em redução dose dependente de dor neuropática controlado por placebo. Já outro estudo realizado por Wallace et al (32) sugeriu que existe uma janela terapêutica para os níveis plasmáticos de THC onde a redução de dor foi mais eficaz. Estudos com cannabis CDB não mostraram redução significativa de dor quando comparado ao placebo, contudo em modelos animais foi demonstrado que CDB atenuou a alodínia mecânica em ratos, sugerindo um potencial efeito antinociceptivo mediado pelo sistema serotoninérgico. (33)
Apesar do interesse no uso do cannabis no tratamento da dor neuropática a qualidade das evidências é considerada muito baixa e mais estudos são necessários para estabelecer sua eficácia e segurança bem como efeitos adversos potenciais como comprometimento cognitivo e efeitos psicoativos. (34)
7.3 Outras possibilidades de terapias
Antioxidantes
Ácido alpha lipoico (ALA ou acido tióctico): trata-se de uma terapia nutricional que utiliza o ácido alpha lipóico, um antioxidante com potencial de diminuir o estresse oxidativo, melhorar a fisiopatologia subjacente e reduzir a dor, administrado por via oral na posologia de 600mg/dia. É uma opção para pacientes refratários ou intolerantes a farmacoterapias de primeira linha. Vários estudos têm sido desenvolvidos com as formulações VO e IV, ambas resultando em redução considerável de sintomas de dor neuropática quando comparados ao placebo, além da melhora de sintomas como parestesia e dormência. Doses maiores que 600mg/dia foram associadas a sintomas de intolerância como náuseas, vômitos e vertigem, sem aumento na eficácia no controle de dor já sendo possível observar efeitos benéficos partir da segunda semana de uso. A combinação de Ácido alpha lipoico e coenzima Q10 (discutido abaixo) pode oferecer benefícios adicionais ao modular o estresse oxidativo e a apoptose. (35)
Coenzima q10 (ubiquinona): devidos suas propriedades antioxidantes e anti-inflamatórias, tem sido investigada como um tratamento adjuvante potencial para neuropatia diabética dolorosa. Estudos mostram seu benefício no tratamento da neuropatia diabética dolorosa quando utilizada em associação com outros tratamentos como a pregabalina em comparação ao uso isolado desta última. (36)
Em estudos com animais, mostrou efeitos profiláticos e antinociceptivos, prevenindo o desenvolvimento de dor neuropática diabética e reduzindo a alodínea mecânica e a hiperalgesia térmica graças a sua capacidade de reduzir o estresse oxidativo e a inflamação por modular fatores pro inflamatórios no sistema nervoso periférico e central. Em modelos experimentais, a combinação de ubiquinona com outros antioxidantes como o ácido alfa lipóico sugeriu um efeito sinérgico na modulação do estresse oxidativo e apoptose celular. (37)
Um estudo clínico em humanos demonstrou que a suplementação com ubiquinona além de reduzir o estresse oxidativo melhorou os escores de sintomas de neuropatia e parâmetros de condução nervosa, sem eventos adversos significativos. Em modelos experimentais, a combinação de ubiquinona com outros antioxidantes como o acido alfa lipoico sugeriu um efeito sinérgico na modulação do estresse oxidativo e apoptose celular. Apesar dos resultados promissores ainda são necessários mais estudos para confirmar a eficácia e a segurança da Ubiquinona como tratamento adjuvante da neuropatia periférica. (38)
Vitamina E: na forma de tocotrienóis tem sido estudada como uma intervenção potencial para a neuropatia diabética devido as suas propriedades antioxidantes e anti-inflamatórias na melhora da condução nervosa e por aumentar os níveis de fatores de crescimento nervoso, sugerindo um efeito neuroprotetor. Sua eficácia quanto ao sintoma álgico não é conclusiva, com as diretrizes da American Academy of Neurology indicando que não são mais eficazes que o placebo para melhora da dor. (39)
Óleo de prímula: Rico em ácido gama-linolênico (GLA) apresenta propriedades que podem melhorar a perfusão e a condução nervosa. Estudos em modelos animais mostraram que o tratamento cm óleo de prímula pode corrigir déficits na velocidade de condução nervosa e no fluxo sanguíneo endoneural. O GLA presente no óleo de prímula atua como precursor de prostaglandinas vasodilatadoras o que pode explicar sua eficácia na correção de déficits neurovasculares. Enquanto o ácido alfa lipoico demonstrou reduzir significativamente fatores e risco hemostáticos e lipídicos o óleo de prímula foi associado a aumento nesses fatores mostrando que apesar do efeito de melhora da função nervosa de ambos, seus mecanismos de ação diferem o que pode implicar na escolha do tratamento a depender dos fatores de risco cardiovasculares do paciente. A combinação de óleo de prímula com inibidores da aldolase-redutase mostrou efeitos sinérgicos na correção de déficit de condução nervosa e fluxo sanguínea em modelos animais, porém ainda são necessários tais efeitos em humanos. (40)
Figura 18 – Mecanismo de ação e proposta terapêutica para uso de Vitamina E, Àcido alfa lipóico e Ubiquinona na neuropatia diabética. (42)
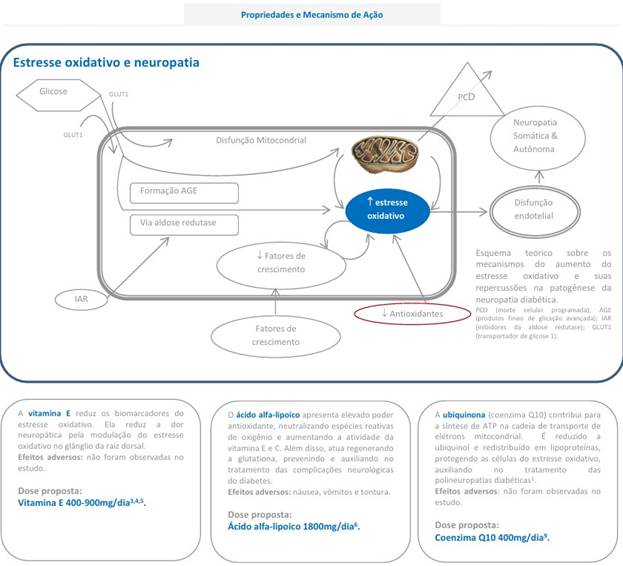
Fonte: Disponível em https://sistema.boticamagistral.com.br/app/webroot/img/files/Antioxidante%20e%20Neuropatia%20Diab%C3 %A9tica-%20Ed-converted.pdf Acesso em: 08 fev. 2025.
Àcido Valpróico: utilizado na dosagem de 500-1200mg/dia a droga foi testada em pequenos ensaios mostrando-se eficaz em relação ao placebo, contudo devido seus efeitos colaterais, teratogenicidade e por não ser utilizado em pacientes hepatopatas, além do perfil mais seguro dos gabapentinoides, não são drogas de escolha no tratamento da neuropatia diabética.
Carbamazepina: apesar da ausência de dados atuais, é aventada a possibilidade terapêutica visto sua eficácia no tratamento da neuralgia do nervo trigêmio.
Diosgenina: composto natura com propriedades antioxidantes e antiinflamatórias que tem sido estudada por seus efeitos neuroprotetores, especialmente no quadro de neuropatia periférica diabética. (43) Estudos em animais com neuropatia periférica diabética demonstraram que a diosgenina pode atenuar a dor neuropática e melhorar a função nervosa, possivelmente através da redução do estresse oxidativo e da inflamação provavelmente pela via de sinalização Nrf2/HO-1 (vide via em anexo )envolvida na defesa celular antioxidante. Atua também na arteriosclerose de Monckeberg por inibir a transdiferenciação osteocondrogênica das células musculares lisas vasculares, o que contribui para a calcificação vascular. Em modelos de insuficiência renal crônica a diosgenina mostrou reduzir a calcificação vascular , melhorar a função coronariana e aumentar a produção de óxido nítrico NO. (44) Apesar de as evidências se mostrarem promissoras quanto ao papel da diosgenina na neuropatia periférica, a maioria dos dados provém de estudos pré clínicos e mais pesquisas são necessárias para avaliar a aplicabilidade da diosgenina em seres humanos.
7.4 Drogas não recomendadas
Opióides: devido seu potencial de tolerância, dependência, overdose e pela condição tratar-se de uma doença crônica (utilização em longo prazo) não é recomendado sua utilização em casos de neuropatia periférica. Atualmente orientase encaminhamento para especialista em dor no caso de pacientes refratários às terapias convencionais. (45)
Topiramato: droga não eficaz para polineuropatia. 46
7.5 Prevenção de Complicações
Cuidados com os pés: A neuropatia diabética é a principal causa de desenvolvimento de úlceras e amputações nos pacientes diabéticos. A inspeção diária dos pés e identificação de pele ressecada, fissuras, calos plantares e sinais precoces de infecção entre os dedos ou ao redor das unhas são essenciais como cuidados preventivos.
Segurança e quedas: os pacientes portadores de neuropatia têm alto risco de quedas por instabilidade, visto a perda progressiva da propriocepção, dor nos pés, hipotensão ortostática devido disfunção autonômica, efeitos colaterais de medicações e deficiências funcionais relacionadas a idade. Apesar de não bem estudado nessa população específica, as intervenções possíveis incluem: atividades físicas em domicílio, terapia física e ocupacional e avaliação de possíveis fatores facilitadores de quedas ou outros acidentes no interior do domicílio, instalação de barras de apoio em banheiros, otimização de iluminação.
Fatores que dificultam o sucesso no tratamento: Em 2011 Melo et al avaliou a adesão do paciente portador da condição de “pé diabético” ao tratamento com o público atendido no Centro de Diabetes- Fortaleza, Ceará (estudo realizado com 45 pacientes). Dentre os participantes do estudo, a maioria possuía de 50 a 79 anos, sendo do sexo masculino, casados e com renda média de 1 a 2 salários mínimos. O acompanhamento deste grupo foi feito por um período de 5 a 15 anos, sendo que todos do grupo permaneceram no estudo por pelo menos 6 meses. O estudo apresentou também uma série de tratamentos caseiros utilizados pelos pacientes para o tratamento da neuropatia sendo os mais marcantes estão a aroeira, babosa, água de ameixa, açúcar e casca de cajueiro. O artigo concluiu que dentre os fatores que afastam o paciente do tratamento especializado estão a baixa escolaridade, o baixo nível econômico, déficit de conhecimento sobre a doença, além da grande dificuldade de acesso a centros de saúde, o que resulta em uma maior utilização de tratamentos não convencionais, como crenças populares e tratamentos caseiros, o que dificulta a cura da lesão. (47)
Baropodometria: é o estudo da pisada, das pressões exercidas por elas e da postura do corpo durante o movimento biomecânico. Elevadas pressões plantares podem ser fator causal de várias doenças e deformidades que acometem os pés como dores, fraturas por estresse, calosidades e ulcerações neuropáticas. A análise dessas pressões desempenha papel importante para uma proposta de prevenção aos transtornos dos membros inferiores, especialmente os que acometem os pés. O uso da baropodometria dinâmica computadorizada auxilia no diagnóstico de alterações podais medindo e quantificando as pressões nas diversas partes da planta do pé durante o apoio, permitindo assim mostrar a relação do pé com a postura durante a posição estática e a marcha. Estas pressões podem ser medidas com o paciente parado (fase estática) ou com o paciente caminhando (fase dinâmica) com o intuito de confeccionar calçados personalizados para o paciente com alteração na anatomia devido neuropatia em pés na tentativa de evitar o surgimento de úlceras em pés. (69)
8 CONCLUSÃO/CONSIDERAÇÕES FINAIS
As complicações vasculares são a maior causa de morbimortalidade nos pacientes diabéticos e exercem um impacto severo na saúde pública em termos de ocupação de leitos, tempo de internamento, evolução desfavorável para amputação e comprometimento social desses pacientes os quais acabam não retornando aos seus ambientes laborais.
O paciente vasculopata portador de DAP em geral apresenta concomitantemente diabetes melitus tipo 2, tem história atual ou previa de tabagismo, dislipidemia, disfunção renal e aumento de peso conferindo um perfil que favorece o desenvolvimento da neuropatia periférica e suas complicações.
O conhecimento para o manejo adequado, a identificação ainda que em paciente assintomático, a avaliação dos pés quanto a presença de úlceras, pulsos e a realização de exame neurológico básico a nível ambulatorial é essencial para a prevenção de complicações. A educação do paciente através de orientações dos médicos assistente, o controle de parâmetros da síndrome metabólica, o seguimento conjunto com médico clinico (seja da unidade básica de saúde ou de acompanhamento privado), endocrinologista, estomaterapeuta, quando necessário, cirurgião do trato digestivo; o fornecimento de medicações adequadas e acesso a terapias especializadas em casos de refratariedade a dor são imprescindíveis para o suporte adequado do paciente, manutenção deste em suas atividades sociais e laborais, redução de internamentos, melhora da sua qualidade de vida e conferem um investimento em saúde com impacto social significativo.
ANEXOS
DEFINIÇÃO DE SD. METABÓLICA: é um conjunto de condições que aumentam substancialmente o risco de doenças cardiovasculares, diabetes tipo 2 e outras complicações em saúde. Os critérios mais aceitos atualmente para o diagnóstico de síndrome metabólica são baseados na presença de pelo menos três dos cinco fatores de risco abaixo:
- Circunferência de cintura elevada (>88 cm na mulher e >102cm no homem);
- Níveis elevados de triglicerídeos (> ou igual a 150 mg/dl)
- Níveis reduzidos de colesterol HDL (< 40mg/dl em homens e <50mg/dl em mulheres)
- Pressão arterial elevada (pressão arterial sistólica 130mmHg e/ou pressão arterial diastólica 85mmHg)
- Glicemia de jejum elevada (> ou igual a 110mg/dl ou diagnóstico de diabetes)
Está diretamente associada a obesidade abdominal e envolve um estado de disfunção metabólica caracterizado por: resistência insulínica, hiperisulinemia e dislipidemia aterogênica. O manejo da síndrome metabólica envolve modificações do estilo de vida incluindo dieta saudável, atividade física e controle de peso como intervenções fundamentais. (51,52)
REFERÊNCIAS BIBLIOGRÁFICAS
FAGERBERG, S. E. et al. Neuropatia diabética: um estudo clínico e histológico sobre o significado das afecções vasculares. Acta Med Scand Suppl. 1959; 345; 1-97.
PINHEIRO, Fernanda Evelyn Rocha et al. Atualizações e abordagens clínicas da neuropatia diabética dolorosa no âmbito atual. Brazilian Journal of Health Review, Curitiba, v. 7, n.2, p. 01-25,mar./apr., 2024. doi: 10.34119/bjhrv7n2-170.
FELDMAN, Eva L; SHEFNER, M Jeremy; NATHAN, M David, GODDEAU, Richard P. Management of diabetic neuropathy. UptoDate. Acesso em 10/12/2024. Disponível em :< Management of diabetic neuropathy – UpToDate >
RUTKOVE, Seward B; SHEFNER, Jeremy M. Overview of polyneuropathy. Acesso em: 15/12/2024. Disponível em:< Overview of polyneuropathy – UpToDate .>
BRITO CJ; SILVA RM; ARAÚJO, EL. Cirurgia vascular: endovascular e angiologia. Quarta Edição. Rio de Janeiro-RJ: Thieme Revinter Publicações, 2020.2320 p 7831-7912.
FELDMAN Eva L; SHEFNER, Jeremy M. Pathogenesis of diabetic polyneuropathy. Acesso em: 20/12/2024. Disponível em < Pathogenesis of diabetic polyneuropathy – UpToDate >Disponível em: https://sites.usp.br/lbbp/wpcontent/uploads/sites/464/2019/03/AMN-Metabolismo.pdf. Acesso em: 20/12/24.
NAOTO, Katakami et al. Mechanism of Development of Atherosclerosis and Cardiovascular Disease in Diabetes Mellitus”. Advance publication Journal of Atherosclerosis and Thrombosis. Accepted for publication: august 17, 2017.
Published online: september 29, 2017.
Disponível em: https://animalia-life.club/qa/pictures/monckeberg-arteriosclerosis.Acesso em 20/12/24
BALLARD JL, EKE CC et al. “A prospective evaluation of transcutaneos oxygen measurements in the manegement of diabetic foot problems”. J. vascular surg 1995;22:485-92.”
VEVES A, AKBARI CM, et al. “Endothelial dysfunction and the expression. Of endotelial nitric oxide synthetase in diabetic neuropathy, vascular disease, and food ulceration.” Diabetes 1998; 47:457-63 . ”
DUKSAL T et al. “Role of inflammation in snesory neuropathy in prediabetes or diabetes.” Acta Neurol Scand 2016; 133 (5):384-90.
HOBIZZAL KB, WULCKICK DK. “Diabetic foot infections: current concept review”. Diabetic foot & ankle, 2012;3:18409.
“ROGERS LC et al. The Charcot Foot in Diabetes. Diabetes Care 2011;34:21232129”.
FELDMAN Eva L, SHEFNER Jeremy M. Epidemiology and classification of diabetic neuropathy. Acesso em: 17/12/2024. Disponível em:< Epidemiology and classification of diabetic neuropathy – UpToDate>.
MARTIN CL, ALBERS JW, POP BUSUI R, DCCT/EDIC Research Group. “overview of polineuropathy/epidemiology of diabetes interventions and complications study”. Diabetes care. 2014;37 (1):31hy 1995;38 (6)869 e NASCIMENTO et al. “Neuropatia diabética dolorosa – aspectos clínicos, diagnóstico e tratamento: uma revisão de literatura”. Revista UNINGÁ.Vol.43,pp.71-79 (Jan – Mar
2015). Vol.43,pp.71-79 (Jan – Mar 2015) Revista UNINGÁ. ISSN impresso: 1807-5053 I Online ISSN: 2318-0579
FELDMAN Eva L et al. Screening for diabetic polyneuropathy. Acesso em 14/12/2024. Disponível em < Screening for diabetic polyneuropathy – UpToDate>.
FRANCO , L C et al. “Terapias não farmacológicas no alívio da dor neuropática diabética: uma revisão bibliográfica”- Acta Paul Enferm 2011;24(2):284-8.
POP BUSUI R., BOULTON AJ, FELDMAN EL, BRIL V, FREEMAN R, MALIK RA, SOSENKO JM, ZIEGLER D. “Diabetic neuropathy: a position statement by the american diabetes association”. Diabetes care. 2017; 40(1):136).
CALLAGHAN BC, LITTLE AA, FELDMAN EL, HUGHES RA “Enhance glucose control for preventing and treating diabetic neuropathy.”. Cochrane database syst. Ver. 2012.
Effect of intensive diabetes treatment on nerve conduction in the Diabetes Control and Complications Trial. Ann Neurol. 1995 Dec;38(6):869-80. doi: 10.1002/ana.410380607. PMID: 8526459.
POP BUSUI R., BOULTON AJ FELDMAN EL, BRIL V, FREEMAN R, MALIK RA, SOSENKO JM, ZIEGLER D. “Diabetic neuropathy: a position statement by the american diabetes association.” Diabetes care. 2017; 40(1):136) .
STRECKMANN F, BALKE M, CAVALETTI G, TOSCANELLI A, BLOCH W, DÉCARD BF, LEHMANN HC, FAUDE O. “Exercise and neuropathy: systematic review with meta-analysis”. Sports Med. 2022.; 52 (5): 1043. Epub 2021 Dec 29.
O´BRIEN R, JOHNSON E, HANEUSE S, COLEMAN KJ, O´CONNOR PJ,FISHER DP et al. “Microvascular outcomes in patients with diabetes after bariatric surgery versus usual care: a matched cohort study”. ANN intern Med. 2018;169 (5):300. Epub 2018 aug 7.
DE VOS CC, MEIER K, ZAALBERG PB et al. “Spinal cord stimulation in pacientes with apinful diabetic neuropathy : a multicenter randomized clinical trial”. Pain. 2014; 155(11): 2426.
HARKLESS LB, DELELLIS S, CARNEGIE DH, BURKE TJ. “Improved foot sensitivity and pain reduction in patients with peripheral neuropathy after treatment with monochromatic infrared photo energy—MIRE”. J Diabetes Complications.2006;20(2):81-7).
CHO E, KIM W. “Effect of acunpuputure on diabetic neuropathy: a narrative review”. International Journal of Molecular Sciences. 2021;22(16):8575.doi:103390/ijms22168575.
CHEN Y et al. “Role of nerve signal transduction and neuroimmune crosstalk in mediating the analgesic effects of acupuncture for neuropathic pain”. Frontiers in Neurology. 2023;14:1093849.doi:103389/fneur.2023.1093849.
XIN MA et al. “Potential mechanisms of acupunture for neuropathic pain based on somatosensory system”. Front neuroscience, 2022 Sep 20;16:940343.doi:103389/fnins.2022.940343.PMID:36203799;PMCID:PMC9530146.
WALLACE MS, MARCOTTE TD, UMLAUF A, GOUAUX B, ATKINSON JH. Efficacy of Inhaled Cannabis on Painful Diabetic Neuropathy. J Pain. 2015 Jul;16(7):616-27. doi: 10.1016/j.jpain.2015.03.008. Epub 2015 Apr 3. PMID:25843054; PMCID: PMC5152762..
32 . WALLACE MS, MARCOTTE TD, ATKINSON JH, PADOVANO HT, BONN-MILLER M. A Secondary Analysis from a Randomized Trial on the Effect of Plasma Tetrahydrocannabinol Levels on Pain Reduction in Painful Diabetic Peripheral Neuropathy. J Pain. 2020 Nov-Dec;21(11-12):1175-1186. doi:10.1016/j.jpain.2020.03.003. Epub 2020 Jun 18. PMID: 32565122.
LEWIS M, BAROUTIAN S, HANNING SM. Phytocannabinoids for the Treatment of Neuropathic Pain: A Scoping Review of Randomised Controlled Trials Published Between 2012 and 2023. Curr Pain Headache Rep. 2024 Mar;28(3):109-118. doi: 10.1007/s11916-023-01196-1. Epub 2023 Dec 14. PMID: 38095748.
Efficacy of Inhaled Cannabis on Painful Diabetic Neuropathy. J Pain. 2015 Jul;16(7):616-27. doi: 10.1016/j.jpain.2015.03.008. Epub 2015 Apr 3. PMID: 25843054; PMCID: PMC5152762.
BAICUS C, PURCAREA A, VON ELM E et al. “alpha lipoic acid for diabetic peripheral neuropathy”. Cochrane database syst. Review. 2024; 1 (1): CD012967. Epub 2024 Jan 11”.
AMINI P, Sajedi F et al. “Coenzime Q10 as a potential Add-on treatment for patientes suffering from painful diabetic neuropathy: results of a placebo-controlled randomized trial.” European Journal of Clinical Pharmacology. 2022;78 (12):18991910. Doi: 10.1007/s00228-022-03407-x.
ZHANG YP, SONG CY, YUAN Y et al. “Diabetic Neuropathic Pain Development in type 2 Diabetic Mouse Model and the Prophylatic and Therapheutic Effects os Coenzyme Q10”. Neurobiology of disease. 2013; 58:169-78. Doi:10.1016/j.nbd.2013.05.003.
HERNÁNDEZ-OJEDA J et al. “The Effect of Ubiquinone in Diabetic polynueropathy: a Randomized Double-Blind Placebo-Controlled Study”.Journal od diabetes and Its Complications. 2012 Jl-Aug;26 (4):352-8.doi:10.1016/j.jdiacomp.2012.04.004.
HOR CP, FUNG WY, ANG HA, LIM SC, KAM LY, SIM SW, LIM LH, CHOON WY, WONG JW, CH’NG ASH, BEH KKM, WEE HC, ONG LM, KHAN NAK, SULAIMAN SAS, SHUAIB IL, BAKAR A, YUSOF Y, YUSOF YM, ABU BAKAR F, TANG WS, TEH HL, WAHID NA, SAAIDIN S, IDRIS N, YOON CK, ONG HN, GANAPATHY JT, LOO CE, SAMY MM, ZAINAL H, DHARAN SCS, OOI BY, TEOH PY, TYE YL, YEOH CA, LOW DW, LOOI I, YUEN KH. Efficacy of Oral Mixed Tocotrienols in Diabetic Peripheral Neuropathy: A Randomized Clinical Trial. JAMA Neurol. 2018 Apr 1;75(4):444-452. doi: 10.1001/jamaneurol.2017.4609. PMID: 29379943; PMCID: PMC5885181.
HOR CP, FUNG WY, ANG HA, LIM SC, KAM LY, SIM SW, LIM LH, CHOON WY, WONG JW, CH’NG ASH, BEH KKM, WEE HC, ONG LM, KHAN NAK, SULAIMAN SAS, SHUAIB IL, BAKAR A, YUSOF Y, YUSOF YM, ABU BAKAR F, TANG WS, TEH HL, WAHID NA, SAAIDIN S, IDRIS N, YOON CK, ONG HN, GANAPATHY JT, LOO CE, SAMY MM, ZAINAL H, DHARAN SCS, OOI BY, TEOH PY, TYE YL, YEOH CA, LOW DW, LOOI I, YUEN KH. Efficacy of Oral Mixed Tocotrienols in Diabetic Peripheral Neuropathy: A Randomized Clinical Trial. JAMA Neurol. 2018 Apr 1;75(4):444-452. doi: 10.1001/jamaneurol.2017.4609. PMID: 29379943; PMCID: PMC5885181.
HEAD RJ, MCLENNAN PL, RAEDERSTORFF D, MUGGLI R, BURNARD SL, MCMURCHIE EJ. “Prevention of nerve conduction deficit in diabetic rats by polyunsaturated fatty acids”. Am J Clin Nutr. 2000 Jan;71(1 Suppl):386S-92S. doi: 10.1093/ajcn/71.1.386s. PMID: 10618002.
Antioxidante e Neuropatia Diabética. Visita em: 08/02/25. Disponível em:<https://sistema.boticamagistral.com.br/app/webroot/img/files/Antioxidante%20e%20 Neuropatia%20Diab%C3%A9tica-%20Ed-converted.pdf>
KIASALARI Z et al. “Diosgenin Ameliorates Development of Neuropatic Pain in Diabetes Rats: involvement of Oxidate Stress and Inflammation.” Biomedicine&Pharmacotherapy =Biomedicine&Pharmacotherapie. 2017;86:654-61.doi:10.1016/j.biopha.2016.12.068.}
MANIVANNAN J et al. “Diosgenin interferes coronary vasoconstriction and inhibits osteochondrogenic transdifferenciation of aortic VSMC in CRF Rats.” Biochimie. 2014;102:183-7.doi:10.1016/j.biochi.2014.03.011.}.
BUSSE JW et al . “Opioids for chronic noncancer pain: a Systematic review and meta-analysis”. JAMA. 2018; 320 (23): 2448.”
WIFFEN PJ, DERRY S, LUNN MP, MOORE Ra. “Topiramate for neuropathic pain and fibromyalgia in adults.. Cochrane Database syst review. 2013.”
MELO, Elizabeth Mesquita; TELES, Mariana Silva; TELES, Rafaela Silva, Barbosa Islene Victor; STUDART, Rita Mônica Borges; OLIVEIRA, Margarida Mota de. “Avaliação dos fatores interferentes na adesão ao tratamento do cliente portador de pé diabético.” Rev. Enf. Ref. [Internet]. 2011 [acesso em 22 jun. 2020] ; serIII( 5 ):37-44. Disponível em: <https://scielo.pt/pdf/ref/vserIIIn5/serIIIn5a04.pdf>}.
KIEL, Douglas P.; SCHMADEER, Kenneth E. “Falls: prevention in communitydwelling older persons.” Acesso em: 01/02/25. Disponível em : Falls: Prevention in community-dwelling older persons – UpToDate.
FORTALEZA, et al. “Avaliação das pressões plantares em diferentes situações por baropodometria”. Colloquium Vitae, São Paulo, v.3, n.1, p.6-10, 2011.
“FITZGERALD J, ZIEGLER ME, GREEN PT, NEVILLE BM. “Calcified facial and maxillary arteries: incidental radiografic findings indicative of Monkeberg Arteriosclerosis”. Journal of the american Dental Association (1939).2021;152 (11):943-946.doi:10.1016/j.adaj.2021.04.018.”
NEELAND IJ, LIM S, TCHERNOF A, GASTALDELLI A, RANGASWAMI J, NDUMELE CE, POWELL-WILEY TM, DESPRÉS JP. Metabolic syndrome. Nat Rev Dis Primers. 2024 Oct 17;10(1):77. doi: 10.1038/s41572-024-00563-5. PMID: 39420195.
SCOTT M GRUNDY et al. 2018. AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: a Reporto f the american College of Cardiology/American heart Association Task Force on Clinical Practice Guidelines. Journal of the american College of Cardiology. 2019;73(24):e285 e350.doi:10.1016/j.jacc.2018.11.003)
Deumens R, Bozkurt A, Meek Mf, Marcus Mae, Joosten Eaj, Weis J, et al. “Repairing injured peripheral nerves: Bridging the gap”. Prog Neurobiol. 2010;92(3):245-76 }
BARTON MJ, MORLEY JW, STOODLEY MA, LAUTO A, MAHNS DA. “Nerve repair: toward a sutureless approach”. Neurosurgical review. 2014;37(4):585-95.
GREEENE DA, AREZZO JC, BROWN MB.”Effect of aldolase Reductase Inhibition on Nerve Conduction and Morphometry in Diabetic Neuropathy. Zenarestat study Group”. Neurology. 1999;53(3)580-91.doi:10.1212/wnl.53.33.580.
JIN R, et al.” Discovery of a novel Benzothiadiazine-Based Selective Aldolase Reductase Inhibitor as Potential Therapy for Diabetic Peripheral Neuropathy”. Diabetes. 2024; 73 (3):497-510.doi:10.2337/db23-0006
WANG L et al. “Phosphodiesterase -5 is a therapeutictarget for peripheral neuropathy in diabetic nice. Neuroscience”. 2011 OCt 13;193:399-410. Doi:10.1016/j.neuroscience.2011.07.039. Epub 2011 Jul 27.PMID:21820491;PMCID:PMC3391742
APFEL SC. “Neurotrophic factors in the therapy of diabetic neuropathy”. Am J Med 1999;107:34S-43S
ASAL NJ, WOJCIAK KA. “Effect of cilostazol in tretaing diabetes associated microvascular complications”. Endocrine 2017;56:240-44
DUBINSKY RM, MIYASAKI J. Assessment: efficacy of transcutaneous electric nerve stimulation in the treatment of pain in neurologic disorders (an evidence-based review); report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. 2010. In: Database of Abstracts of Reviews of
Effects (DARE): Quality-assessed Reviews [Internet]. York (UK): Centre for Reviews and Dissemination (UK); 1995-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK79257/
FRANCO , L C et al. “Terapias não farmacológicas no alívio da dor neuropática diabética: uma revisão bibliográfica”- Acta Paul Enferm 2011;24(2):284-8.
MUNIZ xc et al. “Efficacy of low level laser therapy in nerve injury repair – a new era in therapeutic agentes and regenerative tretaments. Neurologic al sciences: oficial jornal of the italian neurological Society and the italian Society of clinical neurophysiology.” 2021; 42 (10): 4029-4043. Doi:10.1007/s10072-021-05478-7.
LIN L, LI J, LIN J, TANG S, LI Y. Effectiveness and safety of low-level laser therapy in diabetic peripheral neuropathy: a protocol for a systematic review and meta-analysis. Syst Rev. 2021 Apr 2;10(1):96. doi: 10.1186/s13643-021-01656-y. PMID: 33810813; PMCID: PMC8017787.
BULA-OYOLA et al. Effectiveness of electrophysical modalitiies in the sensorimotor rehabitation of radial, ulnar and median neurophathies : a meta analysis. PloS One. 2021;16(3):e0248484.doi:10.1371/jornal.pone.0248484)
FAN X, YAN G, CAO J, ZHAO Y, WANG Y, WANG X, MI J. Effectiveness and safety of photobiomodulation therapy in diabetic peripheral neuropathy: Protocol for a systematic review and meta-analysis. PLoS One. 2024 Aug 26;19(8):e0308537. doi: 10.1371/journal.pone.0308537. PMID: 39186566; PMCID: PMC11346721.
LEONARD DR, FAROOQI MH, MYERS S. Restoration of sensation, reduced pain, and improved balance in subjects with diabetic peripheral neuropathy: a double-blind, randomized, placebo-controlled study with monochromatic nearinfrared treatment. Diabetes Care. 2004; 27(1):168-72.)
Escala Analógica Visual da Dor. Disponível em: https://www.bing.com/images/search?view=detailV2&ccid=n1Yu9Rtk&id=16D224724 2541EDA1C649364996373CEFA1F76B3&thid=OIP.n1Yu9Rtk2laAiieIqjzxnwHaBi&m ediaurl=https%3a%2f%2fenfermagemflorence.com.br%2fwpcontent%2fuploads%2f2018%2f06%2fescala_visual_anal%c3%b3gica_-_EVA.png&cdnurl=https%3a%2f%2fth.bing.com%2fth%2fid%2fR.9f562ef51b64da56 808a2788aa3cf19f%3frik%3ds3Yf%252bs5zY5lkkw%26pid%3dImgRaw%26r%3d0& exph=376&expw=1806&q=escala+anal%c3%b3gica+visual+eva&simid=6080483952 18346950&FORM=IRPRST&ck=BE8C07D9C6671D3723B533E8B387FC1F&selecte dIndex=1&itb=0&ajaxhist=0&ajaxserp=0. Acesso em: 11/02/25
OCHOA-VIGO, Kattia; PACE, Ana Emilia. Diabetic foot: strategies for prevention. Acta Paul Enferm., v. 18, n. 1, p. 100-109, Jan. 2005.
FORTALEZA et al. Avaliação Das Pressões Plantares Em Diferentes Situações Por Baropodometria. (2011). Colloquium Vitae. ISSN: 1984-6436, 3(1), 06-10.
[1] As mitocôndrias dos neurônios periféricos nos pacientes diabéticos são disfuncionantes devido a produção energética ineficaz conferida pelo estado hiperglicêmico e suas repercussões metabólicas. A energia necessária ao funcionamento axonal normal não é fornecida, levando a lesão axonal de “distal para proximal” “Dying Back” e se manifestando com sinais e sintomas de neuropatia periférica inicialmente em nervos sensitivos e posteriormente motores. (6)
[2] Legenda: A: pontos de pressão em proeminências ósseas específicas; B: dedos “em martelo” ou dedos “em garra”; C: mal perfurante plantarão nível de cabeça do primeiro metatarso; e D: colapso do médio pé ou “pé de Charcot”.
[3] A. Úlcera plantar do pé diabético com deformidade de Charcot. B. Cura de úlcera 12 semanas após a reconstrução do mediopé, retalho com a artéria medial plantar e enxertia de pele de espessura parcial. (6)
[4] EMG: eletroneuromiografia; VHS: velocidade de hemossedimentação ; SPEP: eletroforese de proteínas sérica; TSH: hormônio tireo-estimulante; ANA: anticorpos antinucleares; UPEP: eletroforese de proteínas na urina; HIV: vírus da imunodeficiência humana; CIDP: polineuropatia desmielinizantes inflamatória crônica; IVIG: imunoglobulina intravenosa. Incluindo resposta simpática da pele, inclinação da mesma, teste de intervalo R-R no ECG, Manobra de Valsalva em pacientes com níveis séricos de B12 quase normais.
