REGISTRO DOI: 10.69849/revistaft/ni10202410042155
Larissa Lorrane Lima1; Lucas Bispo de Santana2; Marta de Jesus Pereira Maulin3; Tamires Gonçalves de Paula Silva4; Silvio Luis Pereira de Sousa5
RESUMO
A neurocisticercose humana é uma condição infecciosa que afeta o sistema nervoso central, pertencentes a classe Cestoidea, ou Cestoda, Gênero Taenia. Taenia solium e a Taenia saginata são as espécies responsáveis pela doença em humanos e animais. O objetivo desse trabalho é a abrangência da doença com dados atuais sobre características gerais do helminto como, ciclo biológico do parasita, transmissão, incidência da doença, diagnósticos e tratamento em humanos e prevenção, através de revisões bibliográficas referentes à neurocisticercose humana. A contaminação em humanos ocorre devido a ingestão de ovos de Taenia em alimentos contaminados, classificando-a como uma zoonose. Devido o seu potencial zoonótico, é uma doença de interesse público e sua incidência deve ser investigada pelos profissionais de saúde, localização e quantidade de cisticercos pode ocasionar problemas graves neurológicos, provocando inúmeros sintomas como convulsões secundárias. Sua incidência é maior em determinadas regiões do país em que manejo sanitário e fiscalização são limitados. Para que medidas de controle da doença sejam tomadas, a estratégia fundamental é a interrupção do ciclo de vida do parasita, através de controle sanitário, como construção e adequação do saneamento básico, conscientização da população quanto a práticas de higiene, e aumento da fiscalização de animais de criação, uma vez que o ciclo biológico da doença acontece nos suínos e bovinos.
Palavras-chave: Zoonose; saúde pública; cisticerco; Taenia; neurocisticercose.
INTRODUÇÃO
A neurocisticercose é uma condição infecciosa que afeta o sistema nervoso central, incluindo o cérebro, a medula espinhal, transmitida através da ingestão acidental de ovos de Taenia por humanos (Rossi, et al., 2006).
Os helmintos são colonizadores do intestino delgado de humanos em sua forma adulta, e em sua fase larval ou metacestódeo, localiza-se em outros tecidos como órgãos internos e músculos de animais (Ribeiro, et al., 2012). Pertencentes a classe Cestoidea, ou Cestoda, Gênero Taenia. Taenia solium e a Taenia saginata são as espécies responsáveis pela doença em humanos, e em animais.
A contaminação é conhecida como heteroinfestação, em humanos ocorre devido a ingestão de ovos de Taenia, que são liberados no ambiente e através de alimentos, que são posteriormente ingeridos (Takayanagui, et al., 2001).
A localização e quantidade de cisticercos pode ocasionar problemas graves neurológicos, consiste em cisticercos localizados no cérebro de humanos acometidos, provocando inúmeros sintomas, e devido seu potencial zoonótico, é de interesse público (Nascimento, et al., 2022).
A prevenção da doença consiste em interromper o ciclo do parasita, que tem animais e humanos como hospedeiros intermediários e definitivos respectivamente, através da inclusão de notificação compulsória, fiscalização no comércio varejista e açougues (Takayanagui, et al., 2001).
OBJETIVOS
Desenvolver o artigo, tem como objetivo abrangência da doença e aos dados obtidos nos últimos anos, através de revisões bibliográficas e estudo exploratório de dados referentes à ocorrência da neurocisticercose humana, enfatizando: agente, ciclo, transmissão, patogenia, manifestações clínicas em humanos, ocorrência, diagnóstico e prevenção, e controle de zoonose.
PROCEDIMENTOS METODOLÓGICOS
A pesquisa foi feita através de artigos científicos e estudo exploratório baseado em coleta de dados em artigos, produções acadêmicas que tratam e analisam aspectos da neurocisticercose humana. Trata-se de uma pesquisa exploratória, quantitativa e documental de dados referentes à ocorrência da neurocisticercose humana, baseado em plataformas digitais como, PubMed, Google Acadêmico, SciELO. Utilizamos palavras chaves como: “Neurocisticercose”, “Taenia solium”, “Taenia saginata”, “saúde pública” entre outras.
RESULTADOS E DISCUSSÃO
A neurocisticercose é uma infecção parasitária que atinge o sistema nervoso humano causada pelas larvas císticas de Taenia solium. Tal condição é endêmica em diversos países tanto os desenvolvidos quanto os em desenvolvimento estando incluso a África Subssariana, a Europa Oriental, a América Latina e áreas específicas da Ásia, como determinadas regiões da China (Garcia, et al., 2021, apud Zhu et al., 2023).
Tendo como base um valor aproximação conservadora, o número estimado de infecções por neurocisticercose excederá os 20 milhões de pessoas no mundo todo. (Del Bruto, 2020; Garcia, et al., 2020 apud Zhu et al., 2023). Acabando por ser considerado como conservadora porque em muitos casos de neurocisticercose são subnotificadas ou não diagnosticadas.
As manifestações clínicas mais comuns são: crises epilépticas (62%), síndrome de hipertensão intracraniana (38%), meningite cisticercótica (35%), distúrbios psíquicos (11%), forma apoplética ou endarterítica (2,8%) e síndrome medular (0,5%). (Takayanagui, 1990). Segundo Thurman DJ, et al., 2018 (apud Wang et al., 2022) em áreas endêmicas, a estimativa é que 34% dos distúrbios convulsivos são atribuídos a neurocisticercose, sendo o sintoma mais frequente, variando de crises parciais até generalizadas.
De acordo com a Organização Mundial da Saúde (OMS) outro sintoma comum na neurocisticercose é a epilepsia, em todo o mundo é responsável por cerca de 30% de todos os casos de epilepsia em países onde o parasita é endêmico. Comunidades específicas, em associação entre neurocisticercose e epilepsia chega a 70%. Locais remotos e pobres tendo a doença presente, a epilepsia se torna difícil de ser diagnosticado e tratada.
Prosseguindo na Organização Mundial de Saúde (OMS), em 2015, o Grupo de Referência Epidemiológica da Carga de Doenças Transmitidas por Alimentos da OMS destacou o T. solium sendo uma das principais recorrências de mortes por doenças transmitidas por alimentos (Brasil, 2010). O total de pessoas afetadas pela neurocisticercose, incluindo casos sintomáticos e assintomáticos, variam entre 2,56 e 8,30 milhões, isso se baseia nos diversos dados sobre a prevalência da epilepsia. No entanto, 70% dos pacientes que possuem epilepsia possuem um prognóstico favorável com tratamento adequado.
As questões recorrentes a pobreza, a falta de conhecimento sobre a doença, infraestrutura de saúde deficiente e dificuldades de acesso a medicamentos, contribuem para que 75% das pessoas com essa condição recebam tratamento inadequado, ou nenhum tratamento. Segundo levantamento, concluiu que existe uma prevalência maior de pacientes em áreas rurais do que em áreas urbanas no Brasil, Peru e Venezuela, tendo um contraste com Chile e México (Schenone, et al., 1986 apud Mendes et al., 2005).
No Brasil, a neurocisticercose é encontrada nos estados de São Paulo, Minas Gerais, Paraná e Goiás. Segundo Takayanagui, 2001 a neurocisticercose acomete indivíduos de ambos os sexos, qualquer raça e com maiores casuísticas entre as faixas etárias de 11 e 60 anos.
Agente
Conhecida popularmente por solitária, os parasitas são colonizadores do intestino delgado dos animais e humanos em sua forma adulta, e em sua fase larval ou metacestódeo, localiza-se em outros tecidos como órgãos internos e músculos dos animais. Os helmintos são pertencentes ao Reino Animalia, Filo Platyhelminthes, a classe Cestoidea, ou Cestoda, compreende duas subclasses: a Cestodaria e a Eucestoda (Monteiro, 2024), Gênero Taenia. Taenia solium e a Taenia saginata são as espécies responsáveis pela doença em humanos e animais.
Ciclo Biológico
O ciclo biológico acontece devido a ingestão da forma larval ou metacestódeo do parasita, tendo como hospedeiro definitivo os humanos e hospedeiros intermediários, Taenia solium (suínos) e a Taenia saginata (bovinos), são espécies responsáveis pela doença em humanos, e em animais (Ribeiro, et al., 2012).
O complexo teníase-cisticercose refere-se à associação das duas doenças, onde teníase é a presença do verme adulto (Taenia adulta) nos hospedeiros definitivos, intestino dos humanos, e cisticercose são ovos de Taenia liberados nas fezes de humanos, e ingeridos através de alimentos e água contaminada (Ribeiro, et al., 2012).
Figura 1: Ciclo biológico da Taenia
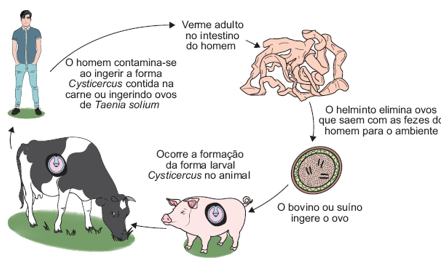
Figura 2: Ciclo de transmissão da neurocisticercose humana
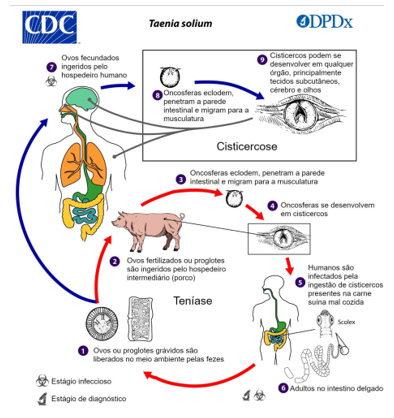
Transmissão
Cisticercose é a fase larval presente em órgãos e músculos dos animais suscetíveis, aqueles que ingeriram através dos alimentos os ovos ou proglótides grávidas, liberadas nas fezes de humanos portadores de teníase (Toledo, et al., 2018).
Após a ingestão dos ovos, sofre ação do suco gástrico e as larvas na parede intestinal migram para os músculos estriados esqueléticos, nos hospedeiros intermediários, podem sobreviver por anos, a neurocisticercose consiste em cisticercos localizados no cérebro de humanos acometidos (Takayanagui, et al., 2001).
Patogenia
A infecção humana ocorre quando ovos presentes em alimentos ou água contaminados são ingeridos, pelos animais e pelos humanos. No intestino, os ovos liberam oncosferas que penetram a parede intestinal e entram na circulação sanguínea. As oncosferas viajam pelo corpo e se estabelecem no sistema nervoso central, onde se desenvolvem em cisticercos.
Dentro do cérebro, os cisticercos passam por várias fases: Vesicular: Nesta fase inicial, os cisticercos são cistos cheios de líquido, contendo a larva viva. Eles provocam pouca resposta inflamatória e geralmente são assintomáticos. Coloidal: À medida que os cisticercos começam a se degenerar, eles desencadeiam uma resposta inflamatória significativa, resultando em edema cerebral. Esta fase está associada a sintomas graves, como convulsões e cefaleias. Granular-nodular: O cisto começa a colapsar e se transforma em um nódulo granulomatoso. A inflamação persiste, mas é menos intensa do que na fase coloidal. Calcificado: O cisto finalmente se calcifica, e a inflamação diminui. No entanto, as lesões calcificadas podem continuar a causar crises epilépticas devido ao tecido cicatricial (Deepika, et al., 2022, apud Dinçel et al., 2023).
A presença dos cisticercos no cérebro provoca uma resposta imunológica complexa. Inicialmente, células inflamatórias, como linfócitos, macrófagos e eosinófilos, infiltram-se ao redor dos cistos, formando granulomas. Citosinas pró-inflamatórias, são liberadas, contribuindo para o edema e a disfunção neurológica. A resposta imunológica pode variar dependendo da localização dos cistos e da imunocompetência do hospedeiro (Deepika, et al., 2022, apud Dinçel et al., 2023).
A patogenia da neurocisticercose é complexa envolvendo múltiplas fases de desenvolvimento dos cisticercos, além de uma resposta imunológica variável. A compreensão desses processos é essencial para o diagnóstico preciso e tratamento eficaz da doença, especialmente em regiões endêmicas.
Manifestações clínicas
Os sintomas da neurocisticercose estão ligados à mudanças no líquido cefalorraquidiano, compressões do parênquima encefálico, alterações vascular e toxicidade (Reis et. al., 2023). Tais manifestações podem variar conforme a forma do cisticerco (Cysticercus cellulosae ou Cysticercus acemosus) (Takayanagui, et al., 2001).
A localização e quantidade de cisticercos pode ocasionar problemas graves neurológicos, provocando inúmeros sintomas, os mais recorrentes: convulsões, crises epilépticas, síndrome de hipertensão intracraniana e medular, distúrbios psíquicos, forma apoplética ou endarteritíca, déficit cognitivo, cefaleia e meningite cisticercótica, com taxa de óbito de 26% (Nascimento, et al., 2023)
Diagnóstico
O diagnóstico da neurocisticercose humana baseia-se principalmente em exames de imagem e laboratoriais, ressonância magnética e tomografia computadorizada tem bastante eficácia para o diagnóstico definitivo da doença em humanos.
O paciente também pode ser submetido análise laboratorial, complementando o método diagnóstico como pesquisa de anticorpos específicos, antígeno homólogo, antígeno heterólogo, antígeno recombinante e sintético, detecção de antígeno circulante, técnicas moleculares, e teste rápidos (Togoro, et al., 2012).
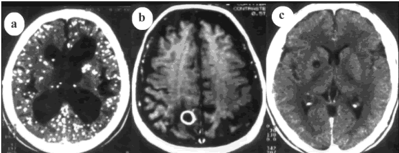
Técnica de Tomografia computadorizada e ressonância magnética apesar da sua importância no diagnóstico definitivo, pode ser limitada dependendo da localização dos parasitas, se alojados na cisterna basal subaracnoide ou os parasitas em fase de degeneração ou pré-calcificação (Togoro, et al., 2012).
Figura 3: Imagem de múltiplos cistos, em diferentes estágios de calcificação, em região de parênquima cerebral de pacientes acometidos, imagens obtidas através de RNM e TAC.
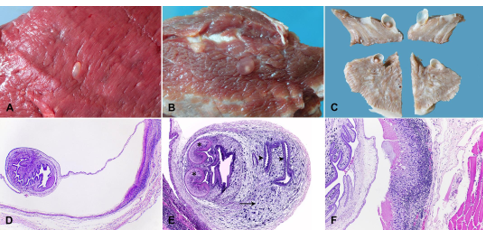
Devido à ausência de sintomas até o momento do abate, em animais o diagnóstico é post mortem, sendo possível visualizar na palpação e em cortes dos músculos da cabeça, diafragma, coração, língua, músculos do pescoço e intercostais. O exame post mortem é estabelecido pelo Regulamento de Inspeção Industrial e Sanitária de Produtos de Origem Animal – RIISPOA (Aquino, 2017).
Figura 4: Imagem macroscópica e microscópica de lesões em carcaça bovina.
Tratamento
A neurocisticercose é de difícil tratamento, e considerado recente, há duas décadas o tratamento era de cunho paliativo (Takayanagui, et al., 2001). Em humanos o tratamento visa controlar crises convulsivas, processos inflamatórios e alívio da pressão intracraniana causada pela presença dos cisticercos. Dentre as classes de medicamentos, estão presentes (antiepilépticos, corticoides, tratamentos cirúrgicos) prednisona ou dexametasona, para controle inflamatório, albendazol ou praziquantel, atua na diminuição das lesões, sendo albendazol mais eficaz e indicado no tratamento da neurocisticercose humana, portanto a terapêutica é uma incerteza no tratamento, elevando a importância da prevenção (Takayanagui, et al., 2001).
Prevenção
O controle da doença tem como estratégia fundamental a interrupção do ciclo de vida do parasita, visando impedir infecção dos seres humanos (Pereira et. al., 2006) através de controle sanitário, como construção e adequação do saneamento básico, conscientização da população quanto a práticas de higiene. Afinal os maus hábitos de higiene e o subdesenvolvimento pode ser um problema de saúde pública, no entanto, há poucas ações para promover a profilaxia em especial nos países em desenvolvimento.
Como a neurocisticercose é uma forma grave de uma doença parasitária, tornou-se uma doença de notificação compulsória no Brasil, exames pós-mortem em abatedouros possibilita a identificação da doença em animais (Pereira et. al., 2006). Os profissionais de saúde e laboratórios serão obrigados a notificar casos suspeitos ou confirmados de neurocisticercose humana as autoridades de saúde locais sempre de acordo com a legislação brasileira. No Brasil, pela falta de um programa nacional abrangente, as iniciativas de prevenção têm surgido principalmente de projetos regionais.
Segundo Organização Mundial da Saúde (OMS) para a prevenção, o controle e a erradicação (se possível) do T. solium, serão necessárias intervenções na saúde pública envolvendo tanto os setores veterinários quanto a saúde humana e ambiental, tendo em vista o potencial zoonótico da doença, é fundamental o controle e manejo adequado dos animais de produção, para que não há acesso as fezes humanas em locais de aglomeração e manejo precário (Pinto et. al., 2014). Ainda na Organização Panamericana da Saúde e a Organização Mundial da Saúde (OPS/OMS, 1994) elaborou uma estratégia para o controle de teníase/cisticercose:
– Imunização e terapia anti-helmíntica em suínos para prevenir a infestação por cisticercos de T. solium;
– Implementação de protocolos avançados na suinocultura visando minimizar a exposição dos suínos a resíduos humanos;
– Aprimoramento das condições de higiene para evitar o contato entre suínos (ou seres humanos) e ovos de T. solium presentes em fezes humanas e no ambiente;
– Rigorosa inspeção e cozimento adequado da carne suína para mitigar o risco de infecção humana;
– Tratamento da teníase em humanos;
– Programas educacionais de saúde para proporcionar práticas de higiene adequada.
Uma abordagem a longo prazo terá um conjunto de estratégias consideradas boas em relação a prevenção da teníase/cisticercose. Incluindo a implementação de legislação adequada, melhoria das condições de saneamento ambiental, educação sanitária da comunidade, modernização das práticas na suinocultura e uma inspeção de carne mais eficiente.
Já uma abordagem a curto prazo terá uma despesa mais elevada, que é associada à modernização de uma infraestrutura sanitária, e o ritmo lento do desenvolvimento socioeconômico e cultural, sendo justificável uma ação imediata em comunidades endêmicas. Podendo ser realizado através de programas de tratamento em massa da teníase na população (Almeida, 1995, apud Takayanagui et al., 2001).
É importante para a prevenção, o tratamento de portadores humanos, tratamento de suínos cisticercóticos e a vacinação destes. Um saneamento melhorado, a mudança de criação de suínos e os níveis mais elevados de conscientização da população. Tais recomendações devem se basear nas características especiais da área endêmica específica (Kysvsgaard, et al., 2005, apud Takayanagui, 2013).
Saúde pública
Em relação a notificação dos casos de neurocisticercose humana há um grande deficit, sua maior prevalência são nos estados de São Paulo, Minas Gerais, Paraná e Goiás, sendo 56% destes pacientes sendo da área rural (Ganc, et al., 2004), demonstrando maior incidência em determinadas regiões do país em que manejo sanitário e fiscalização são limitadas, e relacionada a falta de saneamento básico, maus hábitos de higiene, e regiões com limitações socioeconômicas, onde há exposição maior da população, caracterizando a doença como “doença da pobreza” (Reis et. al., 2023), sendo muitas vezes negligenciado problema em saúde pública (Agapejev, 2003).
O ministério da saúde recomendou a notificação compulsória da doença, portanto apenas a cidade de Ribeirão Preto (SP) e os estados Minas Gerais, Santa Catarina, Mato Grosso do Sul e Paraná, seguem a implementação do programa de controle, tendo em vista essa subnotificação, é possível que os dados estejam subestimados, dificultando a atuação dos órgãos públicos (Ganc, et al., 2004).
A notificação compulsória da doença, faz com que sua prevalência seja desatualizada, porém sinalizam uma diminuição em animais inspecionados pelo SIF, contudo, o consumo de carne oriundas de criação a abatedouros clandestinos, dificultam a exatidão dos dados (Pinto et. al., 2014).
Segundo estudos desenvolvidos em 2003, a faixa etária mais acometida foi de 11-60 anos, predominantemente entre 21 e 40 anos. Em crianças entre 6 a 9 anos, a NCC foi considerada pouco frequente (Agapejev, 2003).
O diagnóstico da cisticercose é realizado na inspeção post mortem que ocorre durante o abate nos matadouros, e apesar da sua importância na saúde pública, sua notificação não é obrigatória (Toledo, et al., 2018), somente é necessária notificação compulsória, limitando o controle e prevenção da doença.
Implementação de políticas públicas tem o objetivo de reduzir a ocorrência da doença, que é consideravelmente grave, com taxa de mortalidade por neurocisticercose 0,3% em relação a outras patologias, sendo considerado 27% causa primária de óbito e 26% secundário a doença (Ganc, et al., 2004).
CONCLUSÃO
A neurocisticercose é uma condição infecciosa que afeta o sistema nervoso central. Causada por um parasita helminto, é popularmente conhecido como solitária, Taenia solium e a Taenia saginata são responsáveis pela doença em humanos, e em animais. Por possuir ciclo em animais, é considerada uma zoonose, o ser humano contrai a doença após a ingestão de ovos de Taenia que foram liberados no ambiente, através de alimentos contaminados. Indivíduos portadores da doença podem ter vários sintomas, dentre eles a convulsão é a mais importante e deve ser tratada, o diagnóstico de imagem é o mais indicado para confirmação da doença.
Devido seu potencial zoonótico, é uma doença de interesse público, porém subnotificadas em várias regiões, devido a sua notificação compulsória, poucos estados enviam dados fidedignos aos órgãos públicos. Identificamos durante nossa pesquisa que há maior incidência em determinadas regiões do país em que manejo sanitário e fiscalização são limitados, e área rural.
A melhor forma de prevenção da doença é interromper o ciclo do parasita, através de medidas de saneamento básico, boa higiene dos alimentos, maior rigidez na fiscalização em abatedouros.
REFERÊNCIAS BIBLIOGRÁFICAS
AGAPEJEV, S. (2003). Aspectos clínico-epidemiológicos da neurocisticercose no Brasil: Análise crítica. Arquivos de Neuro-Psiquiatria, 61(3-B), 822-828.
AQUINO, Fernanda Martins de. Prevalência e Distribuição Espacial da Cisticercose e Fasciolose Bovina no Estado de Goiás. Dissertação (Mestrado em Ciência Animal) – Escola de Veterinária e Zootecnia, Universidade Federal de Goiás, Goiânia, 2017.
BROTTO, Wilson. Aspectos neurológicos da cisticercose. Arquivos de Neuro-Psiquiatria [online]. 1947, v. 5, n. 3
CENTERS FOR DISEASE CONTROL AND PREVENTION (CDC). Cysticercosis Life Cycle. Disponível em: https://www.cdc.gov/cysticercosis/spreads/index.html, Acesso em: 25 de maio de 2024.
DE ARRUDA PINTO, P.S., MONTEIRO, L.L., DIAS, F.S. and PINTO, M.S., 2006. Cisticercose suina: aspectos clinico-epidemiologicos, imunodiagnostico e controle. Bioscience Journal [online], vol. 20, no. 3.
DINÇEL, G. Ç.; EL-ASHRAM, S.; CARVALHO, L. M. M.; GRAHAM, D.; CASTELLANOS-HUERTA, I. A.; PETRONE-GARCIA, V. M.; TELLEZ-ISAIAS, G.; CENCI-GOGA, B. T.; GRISPOLDI, L. Neurocysticercosis: An Overview of Pathology and Pathogenesis. IntechOpen, 2023. Disponível em: https://www.intechopen.com/chapters/86533. Acesso em: 7 ago. 2024.
GANC, Arnaldo José; CORTEZ, Tâmara Leite; VELOSO, Paulo Potiara de Alcântara. A Carne Suína e Suas Implicações no Complexo Teníase-Cisticercose. 2004. Disponível em www.conhecer.org.br
MINISTÉRIO DA SAÚDE. Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Doenças Infecciosas e Parasitárias: Guia de Bolso. 8a edição revista. Série B. Textos Básicos de Saúde. Brasília, DF: Ministério da Saúde, 2010.
NASCIMENTO, T. A. T., MALACARNE JUNIOR, L. P., CAMARGO, R. P., VIANA, K. N. R., SILVA, J. B. DA, PAZ, C. V. DE A., SANTOS, E. M. DOS, & OLIVEIRA, K. W. de. (2023). Aspectos clínicos e tratamento da neurocisticercose. Revista Eletrônica Acervo Científico, 43. https://doi.org/10.25248/REAC.e11865.2023
NETTO, M. R. M.; GASPARETTO, E. L.; FAORO, L. N.; FILHO, J. S. R.; DE TONI, G. S.; NETO, A. de C.; TORRES, L. F. B. Neurocisticercose: estudo clínico e patológico de 27 casos de necrópsia. Arquivos de Neuropsiquiatria, v. 58, n. 3-B, 2000.
PANZIERA, W, VIELMO A, BIANCHI, R M. 2, ANDRADE, C. P. PAVARINI S P., SONNE. L, SOARES, J F E DRIEMEIER, D. (2017). Aspectos macroscópicos e histológicos da cisticercose bovina. Revista Eletrônica Scielo. Disponível em: https://www.scielo.br/j/pvb/a/GTVGCzDm8dCRywGJbkyJykf/abstract/?lang=pt, Acesso em 30 de maio de 2014.
PEREIRA, M.A.V. DA C.; SCHWANZ, V.S.; BARBOSA, C.G. (2006). Prevalência da cisticercose em carcaças de bovinos abatidos em matadouros-frigoríficos do Estado do Rio de Janeiro, submetidos ao controle do Serviço de Inspeção Federal (SIF-RJ), no período de 1997 a 2003. Arquivos do Instituto Biológico, São Paulo, v. 73, n. 1, p. 83-87, jan./mar.
REIS, V. V. et al. (2023). Neurocisticercose: uma revisão dos aspectos sociais, clínicos e fisiopatológicos. Brazilian Journal of Health Review, Curitiba, 6(2), 7765-7776.
RIBEIRO N. A. S.; TELLES E. O.; BALIAN S. C. O Complexo Teníase Humana-Cisticercose: ainda um sério problema de saúde pública / Revista de Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP / Journal of Continuing Education in Animal Science of CRMV-SP. São Paulo: Conselho Regional de Medicina Veterinária, v. 10, n. 1 (2012), p. 20–25, 2012.
ROSSI, Luiz Antonio; SESTARI, Adalberto; CERIONI Jr., Modesto. Cisticercose intradural-extramedular cerebral e espinhal: relato de caso e revisão da literatura. Radiologia Brasileira, v. 39, n. 5, p. 379-382, 2006.
SILVA, M.C.; CORTEZ, A.A.; Aquino-Cortez, A.; Valente, M.; Toniolli, R. (2007). Cisticercose suína, teníase e neurocisticercose humana no município de Barbalha, Ceará. Arq. Bras. Med. Vet. Zootec., v.59, n.2, p.371-375.
TAKAYANAGUI, O. M., & LEITE, J. P. (2001). Neurocisticercose / Neurocysticercosis. Revista da Sociedade Brasileira de Medicina Tropical, 34(3), 283-290.
TAKAYANAGUI, Osvaldo M. Neurocysticercosis. Arquivos de Neuro-Psiquiatria, v. 71, n. 9-B, p. 710-713, 2013.
TOGORO, Silvia Yukari; SOUZA, Edna Malona De; SATO, Neuza Satomi. Diagnóstico laboratorial da neurocisticercose: revisão e perspectivas. Bras Patol Med Lab, v. 48, n. 5, p. 345-355, outubro de 2012.
TOLEDO, R. C. C., FRANCO, J. B., FREITAS, L. S., KATIELLI, C., & FREITAS, A. R. F. de. (2018). Complexo teníase/cisticercose: uma revisão. Higiene Alimentar, 32(282/283), julho/agosto. Instituto Federal do Triângulo Mineiro. Campus Ituiutaba, MG.
WANG, Zhe et al. Neurocisticercose controle para prevenção primária de epilepsia: uma revisão sistemática. PATHOGENS AND GLOBAL HEALTH, v. 116, n. 5, p. 282–296, 2022. Disponível em: https://doi.org/10.1080/20477724.2021.2015869.
ZHU HX, LI YC, YANG XP, CHU YH, GUO W, CHEN RX, et al. Demographics and clinical characteristics of patients with neurocysticercosis: A retrospective study from Dali, China. Saudi J Med Med Sci 2023;11:283-91.
1Aluna do curso de Medicina Veterinária
2Aluno do curso de Medicina Veterinária
3Aluna do curso de Medicina Veterinária
4Aluna do curso de Medicina Veterinária
5Professor Orientador do curso de Medicina Veterinária
