TREATMENT MODALITIES AVAILABLE IN CASES OF INTRAORAL SQUAMOUS CELL CARCINOMA
REGISTRO DOI: 10.69849/revistaft/cl10202507211828
Ed Campos Vieira Neto1
Luiggi Eduardo Holtz1
Stéphanie Nantes Christo Machado1
Levy Anderson César Alves2
Kelly Cristine Tarquinio Marinho2
Hélio de Jesus Kiyochi Júnior2
Resumo: O carcinoma espinocelular (CEC) representa a neoplasia maligna mais frequente da cavidade bucal, sendo fundamental o conhecimento sobre diagnóstico e tratamento. Este trabalho objetivou apresentar as modalidades de tratamento e melhorias recentes para o CEC intraoral mediante revisão de literatura focada nas principais terapias conforme estadiamento e características clínico-histopatológicas. Para casos precoces ou baixo grau, a excisão cirúrgica mostrou-se como tratamento principal, com maior impacto na sobrevida. Esta modalidade recebe constantes inovações técnicas, porém a literatura destaca que quimioterapia e radioterapia como terapias adjuvantes têm apresentado melhores resultados ao considerar individualidades do paciente. Em casos avançados, observou-se que a combinação de cirurgia com esvaziamento cervical seletivo concomitante à quimiorradioterapia constitui uma das melhores opções, associada à terapia-alvo e imunoterapia. A combinação de modalidades representa a melhor abordagem terapêutica para esta patologia, ressaltando-se que cada paciente possui características únicas que devem ser consideradas no planejamento individualizado do tratamento.
Palavras-Chave: neoplasias bucais; carcinoma de células escamosas; protocolos antineoplásicos; neoplasia de cabeça e pescoço.
Abstract: Squamous cell carcinoma (SCC) represents the most frequent malignant neoplasm of the oral cavity, making knowledge of diagnosis and treatment fundamental. This study aimed to present treatment modalities and recent improvements for intraoral SCC through a literature review focused on the main therapies according to staging and clinical-histopathological characteristics. For early-stage or low-grade cases, surgical excision proved to be the primary treatment, with the greatest impact on survival. This modality receives constant technical innovations; however, the literature emphasizes that chemotherapy and radiotherapy as adjuvant therapies have shown better results when considering patient individualities. In advanced cases, it was observed that the combination of surgery with selective neck dissection concomitant with chemoradiotherapy constitutes one of the best options, associated with targeted therapy and immunotherapy. The combination of modalities represents the best therapeutic approach for this pathology, emphasizing that each patient has unique characteristics that must be considered in individualized treatment planning.
Keywords: mouth neoplasms; carcinoma, squamous cell; antineoplasic protocols; head and neck neoplasms.
METODOLOGIA
O presente trabalho consiste em uma revisão de literatura, que tem por finalidade descrever a modalidade de tratamentos disponíveis em casos de carcinoma espinhocelular intraoral. As informações presentes neste trabalho foram obtidas por meio de plataformas de pesquisas e bases de dados como PubMed e Embase. Para realização das pesquisas foram utilizados os descritores indexados na plataforma DECS/MESH: Carcinoma de Células Escamosas, Neoplasias Bucais, Modalidades de Tratamento. Os critérios de inclusão foram: artigos científicos, dissertações e TCC.
1. INTRODUÇÃO
O carcinoma espinocelular (CEC) é uma neoplasia maligna que representa mais de 90% das lesões cancerosas orais. Esta lesão pode corresponder à evolução de lesões potencialmente malignas da mucosa oral, como leucoplasia verrucosa proliferativa, eritroplasia, eritroleucoplasia e queilite actínica.¹
Clinicamente, o CEC caracteriza-se por ulceração persistente com bordas nítidas, elevadas e endurecidas, que não cicatrizam após 15 dias.² A análise anatomopatológica revela epitélio displásico com ilhas de células escamosas infiltrando o conjuntivo. O grau de diferenciação celular relaciona-se à malignidade: neoplasias bem diferenciadas demonstram no geral evolução mais lenta, enquanto neoplasias mal diferenciadas possuem maior associação com metástase precoce.1,3
Dados do INCA sugerem incidência de aproximadamente 11.200 casos anuais em homens e 4.000 em mulheres para o triênio 2020-2022. Mundialmente, a incidência é de 263.000 casos anuais, com números elevados no subcontinente indiano, França, Brasil e partes da África. 1,4,5
O diagnóstico precoce relaciona-se diretamente com tratamentos menos complexos e maior sobrevida.6 Contudo, a maioria dos casos é diagnosticada em estágios avançados (III e IV), aumentando a mortalidade. O atraso diagnóstico deve-se à demora na autopercepção clínica, procura tardia por atendimento especializado e prolongado período entre consulta inicial e exame anatomopatológico definitivo.7,8,9
Os tratamentos baseiam-se no sistema TNM, avaliando extensão do tumor primário (T), presença de metástases linfonodais (N) e metástases à distância (M). A combinação de cirurgia, quimioterapia e radioterapia constitui a tríade terapêutica principal, devendo ser adaptada ao prognóstico individual.1,10
Este trabalho objetiva revisar as modalidades de tratamento disponíveis para o CEC, elucidando técnicas e procedimentos recentes conforme o estadiamento da doença.
2. REVISÃO DE LITERATURA
2.1 CONCEITO E ETIOLOGIA
O carcinoma de células escamosas ou espinocelular (CEC) é um tumor maligno que representa 90 a 95% das lesões cancerosas orais, acometendo predominantemente homens de quinta a sétima década de vida. Relaciona-se com a evolução de lesões potencialmente malignas, como leucoplasia verrucosa proliferativa, fibrose submucosa oral, eritroplasia, eritroleucoplasia e queilite actínica.1,5,11
A etiologia do CEC é multifatorial, envolvendo agentes intrínsecos e extrínsecos. Os fatores intrínsecos incluem desnutrição, deficiência de vitamina A, anemia ferropriva e predisposição genética. A deficiência de ferro compromete a imunidade celular e produz mucosa atrófica, aumentando a suscetibilidade à malignização. Genes cancerosos hereditários e defeitos no reparo de DNA favorecem o desenvolvimento de oncogenes (como Tp53 mutado), potencializando os efeitos de fatores de risco extrínsecos.¹
Os principais fatores extrínsecos para o CEC são etilismo e tabagismo, sendo este último o principal fator etiológico de risco.1,12,13 O tabaco atua como iniciador através de substâncias carcinogênicas geradoras de radicais livres, causando danos oxidativos ao DNA, proteínas e lipídios, além de neutralizar antioxidantes endógenos responsáveis pela proteção celular. O álcool funciona como promotor, sendo metabolizado em acetaldeído carcinogênico, promovendo solubilização de carcinógenos e aumentando a permeabilidade epitelial oral. A associação tabaco-álcool eleva em 10 a 30 vezes o risco de desenvolvimento da doença, conforme confirmado por Leite et al.11 sobre o potencial sinérgico destes fatores.1,12,13
Outros agentes extrínsecos incluem radiação, microbiota e trauma recorrente. A radiação ultravioleta está associada ao câncer de lábio, com maior prevalência em países ensolarados e trabalhadores rurais. A radiação diminui a resposta imune, induz queratinócitos a produzirem citocinas, altera a função de apresentação antigênica das células de Langerhans e promove mutações cromossômicas, como no gene supressor TP53.1,14
Soares e Pereira (2018) destacam a associação entre papilomavirus humano (HPV) e câncer oral, com prevalência viral em pacientes com lesões cancerosas sem fatores de risco estabelecidos (tabaco e álcool), sendo os subtipos HPV 16 e 18 fortemente presentes em lesões cancerizáveis e no CEC, sugerindo papel no desenvolvimento do câncer oral e orofaríngeo.1,15
Apesar dos indícios, resultados permanecem inconclusivos sobre causalidade direta, não excluindo a importância da prevenção através de práticas sexuais protegidas e vacinação.1,15 Enquanto o estadiamento constitui o principal fator na tentativa de quantificar prognóstico para cânceres extraorais e intraorais, no carcinoma de orofaringe a presença do HPV representa o fator mais importante, seguido do estadiamento, pois tumores HPV-positivos apresentam melhor resposta à quimioterapia e/ou radioterapia.1
Embora o mecanismo de ação do trauma tecidual na carcinogênese não seja completamente elucidado, teorias sugerem que lesões crônicas facilitam a absorção de compostos cancerígenos, considerando o ambiente de elevada atividade mitótica expõe as células a maior risco de danos no DNA por agentes carcinogênicos. É necessária atenção diagnóstica para lesões orais, especialmente úlceras traumáticas (próteses mal adaptadas, hábitos parafuncionais), considerando potencial de malignização, principalmente em pacientes com outros fatores de risco.1,16,17
2.2 CLASSIFICAÇÃO DOS TUMORES MALIGNOS
A ambição pela busca de um sistema de classificação vem do propósito de criar um padrão de linguagem internacional que possibilita paralelos de diagnósticos e decisão de tratamentos clínicos sem ambiguidade, tendo como benefícios uma base de planejamento de diagnóstico, tratamento e indicação de prognóstico, auxiliar a troca de informações entre centros de tratamento e amparar presentes e futuras pesquisas sobre câncer. Com isso, a anotação taquigráfica é composta por 3 letras: T (extensão do tumor primário); N (comprometimento ou não de metástase em linfonodos regionais); M (ausência ou presença de metástase à distância), denominado, sistema “TNM”. 18
As definições de cada letra da anotação estão presentes e caracterizadas na tabela a seguir:
Tabela 1. Anotações taquigráficas da classificação do câncer e suas respectivas características.
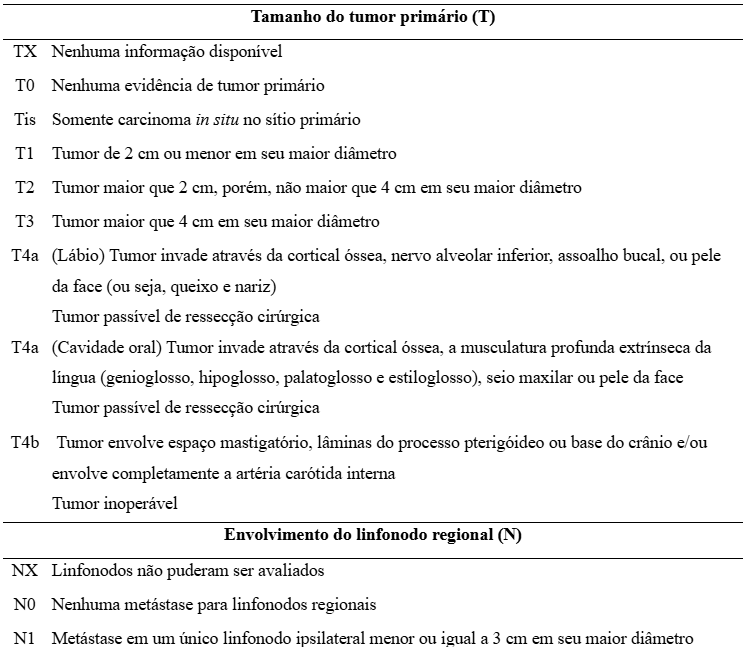

Fonte: Neville et al., 2016.
2.3 ESTADIAMENTO
O estadiamento do câncer é fundamental para o desenvolvimento de tratamento e prognóstico, sendo dividido em estágios após definição dos parâmetros T, N e M. Permite conhecer a extensão da doença e padronizar tratamentos disponíveis, onde valores crescentes da anotação refletem maior extensão cancerosa, pior estadiamento, prognóstico desfavorável e menor sobrevida.1,18
A grande variabilidade prognóstica observada no CEC onde alguns pacientes com estágio inicial adequadamente tratados desenvolveram recorrências locais, metástases e evoluíram para óbito, enquanto pacientes com estágio avançado demonstraram maior sobrevida motivou a implementação do fator profundidade de invasão (DOI – depth of invasion) na oitava edição do American Joint Committee on Cancer (AJCC). Esta modificação introduziu subdivisões “a” (lábio/cavidade oral) e “b” no parâmetro T, melhorando significativamente a precisão diagnóstica, terapêutica e prognóstica. O DOI também otimizou o planejamento pré-operatório através de exames radiológicos como tomografia computadorizada, ressonância magnética e PET-Scan, permitindo avaliação mais precisa da espessura tumoral e profundidade lesional.1,19,20
Os graus de estadiamento baseados no sistema TNM estão caracterizados na tabela abaixo, com respectivas taxas de sobrevida conforme locais acometidos:
Tabela 2. Taxa de sobrevida em cinco anos em pacientes com CEC em região maxilo-facial
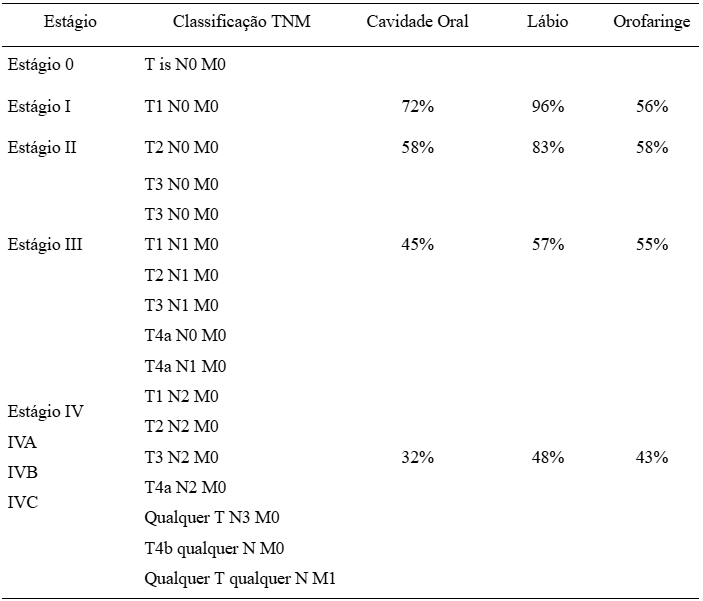
Fonte: Neville et al., 2016.
2.4 CARACTERÍSTICAS CLÍNICAS E RADIOGRÁFICAS
O carcinoma espinocelular intraoral apresenta maior frequência em língua e assoalho bucal, com menor incidência em gengiva, mucosa jugal e palato.1 O diagnóstico tardio resulta da falha na autopercepção do paciente devido à ausência ou mínima sintomatologia dolorosa das lesões iniciais, associada à baixa suspeição clínica do cirurgião-dentista frente a lesões potencialmente malignas e limitada abordagem preventiva. O diagnóstico precoce constitui fator determinante para melhor prognóstico e sobrevida, possibilitando tratamentos menos radicais e reduzindo comorbidades. É fundamental o olhar crítico frente às condições estomatológicas, considerando as variáveis apresentações clínicas do CEC decorrentes de seus cinco padrões de crescimento.6-8
O CEC apresenta três padrões morfológicos principais. O padrão leucoplásico/eritroplásico caracteriza-se por manchas brancas, vermelhas ou combinadas (eritroleucoplasia), sem ulceração, aumento volumétrico significativo ou destacamento à raspagem, compartilhando características clínicas com lesões potencialmente malignas. O padrão exofítico exibe superfície irregular com aumento de volume, aspecto vegetante, papilífero, ulcerado e endurecido à palpação, com diferentes graus de queratose, assemelhando-se clinicamente à queilite actínica crônica. O padrão endofítico apresenta caráter infiltrativo, invasivo, granulomatoso e ulcerado, com bordas endurecidas em “rolete”, compartilhando hipóteses diagnósticas com tuberculose oral, úlceras traumáticas crônicas ou infecções fúngicas como paracoccidioidomicose.1,21
Originando-se das células epiteliais, o CEC possui o exame clínico e a biópsia como procedimentos de maior relevância diagnóstica do que exames de imagem. Quando há destruição óssea subjacente, a radiografia revela imagem radiolúcida irregular com bordas mal definidas e aspecto “roído de traça”, caracterizando evolução rápida e infiltrativa, diferindo de lesões císticas que apresentam bordas nítidas e halo radiopaco circundante, indicando progressão lenta.1
A biópsia tem se mantido como procedimento padrão ouro, no diagnóstico de câncer bucal ao longo das últimas décadas, entretanto, técnicas diagnósticas não invasivas, como a Ressonância Nuclear Magnética, têm sido propostas como alternativas. A Ressonância Nuclear Magnética (RNM) constitui a modalidade de imagem para caracterização de tecidos moles, operando sem emissão de radiação ionizante e apresentando ausência de riscos biológicos documentados. Esta técnica proporciona dados precisos sobre a extensão da lesão, potencial invasão vascular de grande calibre e envolvimento com linfonodos, facilitando decisões terapêuticas. No contexto dos carcinomas da cavidade oral, a RNM desempenha função auxiliar ao possibilitar caracterização anatômica detalhada das estruturas regionais.22
Moreira (2017) demonstrou através de revisão sistemática e metanálise que a ressonância magnética nuclear (RMN) apresenta boa acurácia diagnóstica para câncer bucal, com altos valores de sensibilidade, especificidade e razões de verossimilhança nos três tipos avaliados (DW, DCE e Tradicional). A RMN constitui método não invasivo relevante para diagnóstico e acompanhamento, reduzindo biópsias desnecessárias, porém com custo financeiro elevado limitando seu uso rotineiro. Choi (2018) corrobora a precisão da RMN na avaliação de tumores malignos orais, incluindo o CEC.22,23
2.5 HISTOPATOLOGIA
Originando-se das células epidérmicas, a histopatologia do CEC apresenta epitélio com características displásicas em diferentes graus. Os graus I/II, denominados bem diferenciados, exibem diferenciação histológica madura com pouca diferença morfológica do tecido de origem, relacionando-se à progressão lesional mais lenta e menor agressividade. Os graus III/IV, mal diferenciados, apresentam alta displasia celular com morfologia significativamente diferente do tecido original, associando-se à progressão rápida e metástase precoce. A tabela ilustra dados anatomopatológicos relacionados à evolução cancerosa e similaridades das alterações celulares com lesões potencialmente malignas não evoluídas para câncer, demonstrando maior potencial de malignidade conforme aumento da gradação.1
Tabela 3. Características histopatológicas de acordo com a evolução da lesão cancerosa
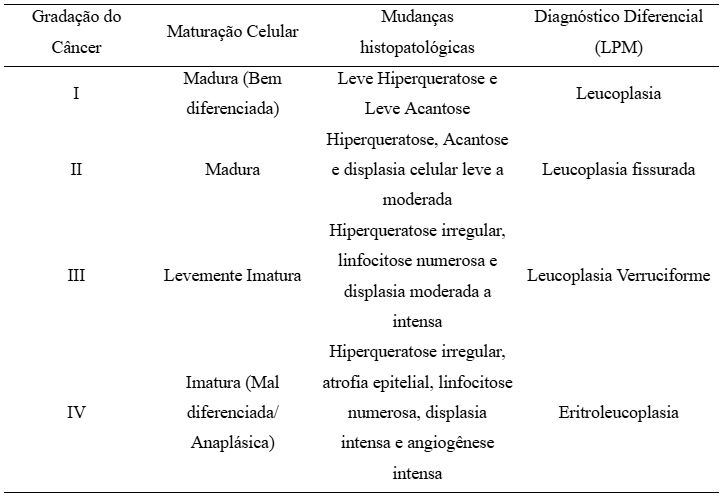
Fonte: Neville et al., 2016.
Azevedo (2020) analisou 953 lesões potencialmente malignas, incluindo leucoplasias (74,6%), queilites actínicas (15,2%), leucoeritroplasias (9,3%) e eritroplasias (0,8%), enfatizando a displasia epitelial (DE) como fator diagnóstico e prognóstico crucial.1,24,25 O estudo demonstrou que mais de 40% das lesões não apresentavam DE, 33,5% exibiam displasia leve, com displasias moderada e intensa em frequências decrescentes. Parâmetros histopatológicos como acantose, hiperparaqueratose, morfologia celular irregular, alterações nucleares e mitoses atípicas correlacionaram-se positivamente com o grau displásico e maior potencial de malignização. Contudo, a importância clínica da DE deve ser correlacionada com outras características histopatológicas, uma vez que sua presença isolada não assegura transformação maligna, exigindo análise histopatológica crítica e global.1,24,25
O fator mais valioso para predispor características prognósticas foi o DOI, cuja integração ao sistema TNM proporciona diagnósticos de melhor qualidade revelando que a gradação histológica seja constantemente aprimorada para maior relevância prognóstica. 19,20,21,26
É necessário cuidado na definição das medidas de DOI devido à subjetividade da aferição cirúrgica, sendo essencial padronizar procedimentos desde a biópsia, incluindo fixação adequada da peça e avaliação histopatológica criteriosa para obter resultados válidos.26-28
2.6 DIAGNÓSTICO
O diagnóstico do CEC baseia-se no exame clínico das características previamente discutidas, sendo confirmado por biópsia incisional, preferível à excisional em lesões suspeitas devido ao caráter infiltrativo e desconhecimento da extensão da invasão tecidual marginal. A biópsia tradicional com bisturi e análise histopatológica constitui padrão ouro para diagnóstico de lesões potencialmente malignas e cânceres orais, porém alguns pacientes demonstram receio pelo caráter invasivo, especialmente em lesões endofíticas sob mucosa aparentemente sadia.1,4,29
Ribeiro e Onofre (2021) analisaram métodos citológicos coadjuvantes, concluindo que a citologia esfoliativa com citometria de imagem de DNA (DNA-ICM) é minimamente invasiva, apresentando excelentes taxas de sensibilidade/especificidade e bons resultados no diagnóstico precoce de transformações malignas quando detectada aneuploidia de DNA, principal marcador de malignização no esfregaço bucal. Exames de imagem como tomografia computadorizada e ressonância magnética auxiliam avaliando extensão e profundidade lesional (DOI), possibilitando discussão terapêutica baseada no sistema TNM.1,4,29
Iida et al. (2018) demonstraram acurácia relevante da US para determinar DOI pré-operatório em lesões precoces de baixo grau, destacando sua disponibilidade como ferramenta diagnóstica auxiliar. Porém, mais estudos com imagens padronizadas são necessários para avaliar aplicabilidade em casos avançados e estabelecer a US como padrão diagnóstico.30,31
2.7 TRATAMENTO
O tratamento do CEC baseia-se no estadiamento clínico e localização, com casos precoces, moderados ou avançados diferindo na necessidade de associação de modalidades terapêuticas como excisão cirúrgica, radioterapia, quimioterapia, terapia alvo, imunoterapia e tratamento sistêmico, visando prognóstico favorável com menor comorbidade possível.1,4,32
Cheraghlou et al. (2018) realizaram estudo retrospectivo analisando tendências de sobrevida e prognóstico do câncer oral relacionadas aos tratamentos entre 1973-2014, e observaram melhora significativa de sobrevida associando algumas abordagens terapêuticas, como: utilização de quimio e radioterapia adjuvante ao tratamento cirúrgico em casos tardios; aumento da frequência e extensão do esvaziamento cervical seletivo em casos precoces e tardios; maior número de pacientes tratados em centros especializados em câncer, relacionados à melhor atenção e adesão terapêutica.33
A excisão cirúrgica é o tratamento mais comum para cânceres orais de baixo grau (T1, T2 e N0) em lesões intraorais ou carcinoma de vermelhidão labial. Bachar et al. (2012) Devido ao caráter infiltrativo do CEC, é necessário obter margem de segurança cirúrgica considerando dimensões, profundidade de invasão e presença de nódulos palpáveis.1, 33-36
Segundo Anderson et al. (2015), a margem cirúrgica (MC) é classificada histopatologicamente como “envolvida” (<1mm), “próxima” (1-5mm) ou “nítida” (>5mm), baseada na distância entre malignidade e tecido aparentemente sadio. A margem clínica aceita é de pelo menos 1cm da borda tumoral visível, quando possível. Kurita et al. (2010) e Bajwa et al. (2020) demonstraram que MC <1mm apresenta maior taxa de recidiva comparada às margens 1-5mm ou >5mm, com displasia severa constituindo fator isolado de recidiva. A radioterapia pós-operatória está indicada para MC “próxima” ou “envolta”, casos inoperáveis, tumores >10mm de espessura e casos avançados com nódulos palpáveis e infiltração óssea.1, 36-39
O DOI, representado pela distância da membrana basal até a porção mais profunda da invasão, constitui fator isolado de pior prognóstico, sendo relevante para discussão terapêutica visto que excisão cirúrgica apresenta elevada sobrevida em casos precoces (T1, T2 e DOI≤4mm). Para casos com DOI>4mm existe maior probabilidade de metástase linfonodal ou oculta, indicando esvaziamento cervical seletivo eletivo. Larson et al. (2019) demonstraram que em “high DOI” (>4mm) a presença de dois ou mais fatores histológicos (invasão perineural, linfovascular e WPOI-5) associa-se a maiores recorrências, sendo relevantes para indicação de esvaziamento cervical. Kozak et al. (2019) concluíram que “high DOI” isolado em casos de baixo risco (T1, T2 e N0) sem características patológicas de alto risco não aumenta recorrência local ou distante.1,27,28,32,40,41
Baba et al. (2020) demonstraram que o DOI radiológico (RMN/TC) apresenta variação 2-3mm maior que o DOI patológico, auxiliando na predição de esvaziamento cervical seletivo (ECS) em casos DOI>4mm conforme NCCN. Cramer et al. (2018) evidenciaram que biópsia de linfonodo sentinela apresenta sobrevida similar ao ECS com menor morbidade, necessitando mais estudos. Massey et al. (2018) concluíram que ECS deve ser reservado para cânceres estágio II devido à maior taxa de metástase oculta comparado ao T1. A radioterapia pode ser definitiva ou adjuvante, sendo pós-operatória indicada em casos avançados (III/IV), metástase linfonodal e parâmetros histológicos desfavoráveis (DOI>10mm, invasão perineural, WPOI-5). As técnicas 3D-CRT e IMRT representam avanços da radioterapia convencional, com Gupta et al. (2012) demonstrando menor toxicidade aguda e tardia (xerostomia, fibrose) com IMRT comparado ao 3D-CRT.28,32,35,39,42-48
Oliveira (2019) demonstrou que a radioterapia IMRT apresenta menores comorbidades por modular a dose conforme estrutura anatômica, poupando estruturas adjacentes ao tumor (EAT) comparado às técnicas 2D e 3D-CRT. A Intensity Modulated Proton Therapy (IMPT) constitui novo método utilizando prótons ao invés de fótons, caracterizando-se pela formação de “Bragg peak” que concentra dose máxima no tumor sem dose de saída, reduzindo significativamente exposição desnecessária das EAT comparado às técnicas convencionais baseadas em fótons.47-50. Estas diferenças estão demonstradas no gráfico abaixo:
Gráfico 1: comparação de radioterapia à base de fótons versus radioterapia à base de prótons em relação à taxa de penetração da radiação nos tecidos.
Fonte: Blanchard et al., 2018.
Moreno et al. (2019) destacam o IMPT como futuro do tratamento radioterápico em cânceres de cabeça e pescoço pela vantagem dosimétrica sobre IMRT.50 A quimioterapia em tumores avançados utiliza principalmente platina, 5-fluorouracil e taxanos, com terapia combinada apresentando melhor sobrevida que monoterapia, especialmente quando empregada concomitantemente à cirurgia.1,32,51 Trosman et al. (2020) não observaram melhora significativa de SLD em casos “alto risco” com quimioterapia adjuvante,52 enquanto Hartner (2017) não demonstrou benefício pós-cirúrgico.53 A quimioterapia de indução ainda requer análises sistemáticas para comprovar benefício clínico na sobrevida.1,53
As terapias moleculares, como o cetuximab, possuem maior especificidade contra células tumorais com menores efeitos colaterais que quimioterápicos clássicos. O cetuximab, aprovado pela FDA, é um anticorpo monoclonal que atua contra EGFR através de antagonismo competitivo, ativando fatores anti-tumorais e induzindo apoptose via ADCC, sendo sua efetividade dependente dos níveis de EGFR expressos. Gebre-Medhin et al. (2020) demonstraram que radioterapia com cisplatina apresentou melhor sobrevida e menor recorrência local que radioterapia com cetuximab em pacientes com câncer avançado (estadios III-IV). Contudo, Fukumoto et al. (2021) observaram taxa de sobrevida em 5 anos significativamente maior no grupo tratado com cetuximab pós-cirúrgico comparado aos grupos sem terapia ou com terapia tradicional, sugerindo efetividade em casos de alto risco para metástase, embora sejam necessários ensaios clínicos randomizados para confirmar esses achados.1,53-56
O regime TPEx (cisplatina, cetuximab e docetaxel) demonstrou menor tempo de tratamento e toxicidade significativamente reduzida comparado ao regime Extreme em casos de recorrência metastática, constituindo nova opção de primeira linha. A imunoterapia com pembrolizumab e nivolumab atua bloqueando PD-L1, proteína que inibe linfócitos T contra células cancerosas, sendo que Burtness et al. (2019) demonstraram benefício significativo da combinação pembrolizumab com quimioterapia em pacientes com alta expressão de PD-L1. Chen et al. (2020) evidenciaram eficácia terapêutica da combinação pembrolizumab com lenvatinib (inibidor de múltiplas quinases) em pacientes com recidivas metastáticas previamente tratados, sugerindo opção para casos não elegíveis ao tratamento tradicional. A crioterapia ou seção congelada (SC) representa técnica promissora no ato cirúrgico para casos de CEC com margens cirúrgicas inadequadas, sendo que Bulbul et al. (2020) e Kain et al. (2020) demonstraram resultados favoráveis em casos locais, precoces e N0, embora sejam necessários mais estudos para confirmar eficácia.32,57-61
3. DISCUSSÃO
Este trabalho baseou-se em guias de tratamento referenciado em artigos científicos, manuais do INCA e NCCN Guidelines, que enfatizam a importância de pacientes tratados em ensaios clínicos como ambiente adequado para aprendizado e melhoria de técnicas e protocolos de tratamento do carcinoma espinocelular intraoral. O compilado de estudos objetiva apresentar as diversas modalidades de tratamento para CEC, mencionando protocolos e tendências atualizadas1,4,32
A cirurgia está indicada para a maioria dos casos de CEC, considerando o estadiamento TNM da oitava edição da AJCC com inclusão do DOI nas decisões terapêuticas. Em lesões de baixo grau (estágio I, T1, T2, N0), a excisão cirúrgica foi a modalidade de maior importância para aumentar sobrevida, sendo que tumores “baixo risco” sem fatores histopatológicos desfavoráveis podem ser tratados apenas com cirurgia, mesmo com DOI <4mm. A margem de segurança aceita é de no mínimo 1 cm da borda visível do tecido maligno para obter margem patológica “nítida”, resultando em maior sobrevida livre de doença, menor recorrência e maior sobrevida total.20,32,34-38,41
A radioterapia pós-operatória é empregada em casos de margem patológica “envolta” ou “próxima”, displasia severa e/ou DOI >4mm. O ECS eletivo pode ser utilizado quando DOI é alto (>4mm) e/ou presença de metástase linfonodal (N1), sendo alguns autores sugerem reservá-lo para lesões estágio II, visto que lesões estágio I se beneficiam pouco da adição de ECS à excisão cirúrgica. A BLS representa opção experimental em casos precoces com menor comorbidade funcional comparada ao ECS, necessitando mais estudos comparativos para avaliar superioridade e indicações, enquanto a técnica de SC no ato cirúrgico demonstra melhor resposta em casos precoces (T1, T2) sem linfonodo palpável (N0). 27,28,32,39,40,43-45
A radioterapia pode ser empregada como tratamento definitivo em cânceres inoperáveis ou pós-operatoriamente, apresentando ampla gama de indicações na literatura. A RPO demonstra maior eficácia em lesões avançadas, sendo geralmente ministrada como terapia adjuvante ao tratamento cirúrgico e/ou quimioterapia. As técnicas radioterápicas mais utilizadas são 3D-CRT e IMRT, representando opção moderna com benefício de comorbidade tardia significantemente menor em relação à radioterapia convencional.1,32,35,39,46-48
A técnica de IMRT apresenta menor comorbidade tardia que 3D-CRT por poupar estruturas anatômicas tolerantes, enquanto a terapia baseada em prótons (IMPT) representa o futuro da radioterapia por produzir menor exposição às EAT com dose de entrada significantemente menor que IMRT e ausência de dose de saída, embora careça de estudos sistemáticos e apresente limitações econômicas e técnicas. A quimioterapia é empregada principalmente em casos avançados (estágios III-IV), geralmente associada à radioterapia pós-cirúrgica concomitantemente, sendo que em casos de “alto risco” de recorrência a cisplatina não demonstra benefício significativo, enquanto a quimioterapia de indução ainda carece de evidências que justifiquem sua aplicação.32,47-53
A terapia alvo com cetuximab constitui componente principal em protocolos de CEC avançado, sendo mais efetiva em lesões com alta expressão de EGFR, demonstrando que em câncer avançado localizado o protocolo cetuximab + radioterapia não apresentou superioridade sobre cisplatina + radioterapia, porém em casos de “alto risco” para metástase oculta a adição de cetuximab pós-cirúrgica resultou em sobrevida significantemente maior, sendo o protocolo “TPEx” superior ao “Extreme” em recorrência metastática pela substituição do 5-fluorouracil por docetaxel. A imunoterapia com pembrolizumab vem ganhando importância pelo menor perfil de efeitos colaterais, sendo indicada em casos metastáticos com alta expressão de PD-L1, e o protocolo pembrolizumab + lenvatinib demonstrou efeito terapêutico em recorrências metastáticas como alternativa ao tratamento convencional, embora ainda necessite de mais estudos em cânceres orais e apresente limitações econômicas.32,54-59
4. CONSIDERAÇÕES FINAIS
A combinação de modalidades terapêuticas representa uma das melhores abordagens para CEC oral, com a literatura enfatizando o foco nas peculiaridades individuais através de terapias direcionadas a fatores específicos do organismo, objetivando reduzir casos não tratáveis com terapias convencionais e proporcionando menor morbidade, maiores taxas de sobrevida e melhor qualidade de vida.
REFERÊNCIAS
- Neville BW et al. Patologia oral e maxilofacial. 4th ed. Rio De Janeiro: Elsevier; 2016.
- Rocha AS, Silva ARBW, Pimentel MG, Wanderley AEC, Leite IF, Neto MML. Carcinoma espinocelular do diagnóstico à adequação da cavidade oral: relato de caso. Revista Braz. J. Hea. Rev., Curitiba, v. 2, n. 6, p. 5464-5476 nov./dec. 2019.
- Soares TRA, Mamedes IF, Franco AV de M, Peixoto FB, Ferreira SMS. Carcinoma epidermóide causando grande destruição em mandíbula: relato de caso. Revista Eletrônica Acervo Saúde. 2018 Dec 18;(18):e119.
- Estimativa | 2020 Incidência de Câncer no Brasil [Internet]. Ministério da Saúde: Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA); 2019. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//estimativa-2020-incidencia-de-cancer-no-brasil.pdf.
- Fontes da Silva AA, Barros CCDS, Freitas de Morais E, Campos Pinheiro J, Galvão Barboza CA, Silva de Arruda Morais MDL. Perfil clínico-epidemiológico do Carcinoma Epidermoide Oral em pacientes adultos jovens dos 20 aos 45 anos: Revista da Faculdade de Odontologia – UPF [Internet]. 2019.
- Souza JGS, Sá MAB de, Popoff DAV. Comportamentos e conhecimentos de cirurgiões-dentistas da atenção primária à saúde quanto ao câncer bucal. Cadernos Saúde Coletiva [Internet]. 2016.
- Torres SV de S, Sbegue A, Costa SCB. A importância do diagnóstico precoce de câncer bucal em idosos. Rev Soc Bras Clin Med [Internet]. 2018.
- Campos de Araújo TLC de, Araújo Júnior JL de, Moreira Vieira E de A. A importância da visão clínica do cirurgião-dentista na detecção de lesões pré-malignas: relato de caso clínico. Archives of health investigation [Internet]. 2019.
- Mamani LC. Prevalência de carcinomas espinocelulares de boca diagnosticados no laboratório de anatomopatologia bucal da Unifal – MG no período de 1998 a 2019. 2021. 74 f. Dissertação (Mestrado em Ciências Odontológicas) – Universidade Federal de Alfenas, Alfenas, MG, 2021.
- Alencar ARP, Klug RJ, Siqueira VS. Metástase a distância em paciente com histórico de carcinoma espinocelular bucal. Revista Facitto Faculdade de Ciências do Tocantins 2020 Outubro – Ed. 19 Vol. 3. Págs. 42-51.
- Venturi BRM, Pamplona ACF, Cardoso AS. Carcinoma de células escamosas da cavidade oral em pacientes jovens e sua crescente incidência: revisão de literatura. Revista Brasileira de Otorrinolaringologia [Internet]. 2004.
- Batista, AB, Ignácio SA, Machado MÂN, Lima AAS de. Efeito do Tabagismo na Mucosa Bucal de Indivíduos Jovens: Análise Citomorfométrica. Revista Brasileira de Cancerologia [Internet]. 2021.
- Leite Rafaella B., Marinho Ana Carla O., Costa Beatriz L., Laranjeira Maria Beatriz V., Araújo Kleyber D. T., Cavalcanti Anaícla F. M.. The influence of tobacco and alcohol in oral cancer: literature review. J. Bras. Patol. Med. Lab. [Internet]. 2021.
- Juchem PP, Hochberg J, Ardenghy A, English R. Riscos à Saúde da Radiação Ultravioleta. Revista da Sociedade Brasileira de Cirurgia Plástica [Internet]. 1998.
- Soares ACR, Pereira CM. Revisão de literatura Associação do HPV e o Câncer Bucal. Revista Ciências e Odontologia. 2018 Nov;2(2):22–7.
- Baugh EH, Ke H, Levine AJ, Bonneau RA, Chan CS. Why are there hotspot mutations in the TP53 gene in human cancers? Cell Death & Differentiation [Internet]. 2017 Nov 3;25(1):154–60.
- Piemonte ED, Lazos JP, Brunotto M. Relationship between chronic trauma of the oral mucosa, oral potentially malignant disorders and oral cancer. Journal of Oral Pathology & Medicine. 2010 Apr 29;39(7):513–7.
- Sobin LH, Ch Wittekind, Brasil. Ministério da Saúde. Secretaria de Atenção À Saúde. Instituto Nacional de Câncer. TNM : classificação de tumores malignos [Internet]. Rio De Janeiro: Inca; 2004.
- Machado JR. Profundidade de invasão como fator prognóstico para o carcinoma de células escamosas oral. 2019 Feb [cited 2021 May 10]; Available from: https://repositorio.ufu.br/bitstream/123456789/25842/1/Profundidadeinvas%c3%a3ofator.pdf.
- Amin MB, Edge SB. AJCC cancer staging manual. 8th ed. Switzerland: Springer; 2017.
- Furtado LSFA, Sales JLAM, Fontes NM, Batista MIH de M, Carvalho AAT, Paulino MR. Câncer bucal, desordens potencialmente malignas e prevenção: uma revisão integrativa. Revista Família, Ciclos de Vida e Saúde no Contexto Social. 2019 Oct 7;7(4):479.
- Moreira MA. Acurácia da ressonância magnética no diagnóstico de câncer bucal: revisão sistemática e metanálise. 2016
- Choi IGG, Park M, Laurino FAR, Cortes ARG, Arita ES. Ressonância magnética para avaliação de tumores malignos da cavidade oral: uma revisão da literatura. Clinical and Laboratorial Research in Dentistry. 2018 Jul 4;
- Azevedo AB de. Desordens potencialmente malignas orais: análise clínica e patológica retrospectiva de 953 casos com ênfase na displasia epitelial oral. Universidade Estadual de Campinas [Internet]. 2020;1–54. Available from: http://repositorio.unicamp.br/jspui/handle/REPOSIP/348010.
- Geetha K, Leeky M, Narayan T, Sadhana S, Saleha J. Grading of oral epithelial dysplasia: Points to ponder. Journal of Oral and Maxillofacial Pathology : JOMFP [Internet]. 2015;19(2):198–204.
- Wunschel M, Neumeier M, Utpatel K, Reichert TE, Ettl T, Spanier G. Staging more important than grading? Evaluation of malignancy grading, depth of invasion, and resection margins in oral squamous cell carcinoma. Clinical Oral Investigations [Internet]. 2020 Jun 29;25(3):1169–82.
- Caldeira PC, Soto AML, Aguiar MCF, Martins CC. Tumor depth of invasion and prognosis of early‐stage oral squamous cell carcinoma: A meta‐analysis. Oral Diseases [Internet]. 2019 Oct 9;26(7):1357–65.
- Bulbul MG, Zenga J, Puram SV, Tarabichi O, Parikh AS, Varvares MA. Understanding approaches to measurement and impact of depth of invasion of oral cavity cancers: A survey of American Head and Neck Society Membership. Oral Oncology [Internet]. 2019 Dec;99:104461.
- Ribeiro MGM, Onofre ASC. Métodos adjuvantes citológicos aplicados na avaliação de diagnósticos e prognósticos das lesões orais. Estácio Saúde [Internet]. 2021;10(1).
- Tarabichi O, Bulbul MG, Kanumuri VV, Faquin WC, Juliano AF, Cunnane ME, et al. Utility of intraoral ultrasound in managing oral tongue squamous cell carcinoma: Systematic review. The Laryngoscope [Internet]. 2018 Aug 27;129(3):662–70.
- Iida Y, Kamijo T, Kusafuka K, Omae K, Nishiya Y, Hamaguchi N, et al. Depth of invasion in superficial oral tongue carcinoma quantified using intraoral ultrasonography. The Laryngoscope [Internet]. 2018 Oct 16;128(12):2778–82.
- Guidelines for Patients [Internet]. NCCN. [cited 2021 May 10]. Available from: https://www.nccn.org/patientresources/patient-resources/guidelines-for-patients.
- Cheraghlou S, Schettino A, Zogg CK, Judson BL. Changing prognosis of oral cancer: An analysis of survival and treatment between 1973 and 2014. The Laryngoscope [Internet]. 2018 Sep 7;128(12):2762–9.
- Bachar G, Goldstein DP, Barker E, Lea J, O’Sullivan B, Brown DH, et al. Squamous cell carcinoma of the buccal mucosa: Outcomes of Treatment in the modern era. The Laryngoscope [Internet]. 2012 Jun 11;122(7):1552–7.
- Wang Y, Wang S, Zhang B. A Population‐Based Analysis of Mucoepidermoid Carcinoma of the Oral Cavity. The Laryngoscope [Internet]. 2020 Jul 21;131(3).
- Anderson CR, Sisson K, Moncrieff M. A meta-analysis of margin size and local recurrence in oral squamous cell carcinoma. Oral Oncology [Internet]. 2015 May;51(5):464–9.
- Kurita H, Nakanishi Y, Nishizawa R, Xiao T, Kamata T, Koike T, et al. Impact of different surgical margin conditions on local recurrence of oral squamous cell carcinoma. Oral Oncology [Internet]. 2010 Nov;46(11):814–7.
- Bajwa MS, Houghton D, Java K, Triantafyllou A, Khattak O, Bekiroglu F, et al. The relevance of surgical margins in clinically early oral squamous cell carcinoma. Oral Oncology [Internet]. 2020 Nov;110:104913.
- Dixit S, Vyas RK, Toparani RB, Baboo HA, Patel DD. Surgery versus surgery and postoperative radiotherapy in squamous cell carcinoma of the buccal mucosa: A comparative study. Annals of Surgical Oncology [Internet]. 1998 Sep;5(6):502–10.
- Larson AR, Kemmer J, Formeister E, El‐Sayed I, Ha P, George J, et al. Beyond Depth of Invasion: Adverse Pathologic Tumor Features in Early Oral Tongue Squamous Cell Carcinoma. The Laryngoscope [Internet]. 2019 Aug 14;130(7):1715–20.
- Kozak MM, Shah J, Chen M, Schaberg K, von Eyben R, Chen JJ, et al. Depth of invasion alone as a prognostic factor in low‐risk early‐stage oral cavity carcinoma. The Laryngoscope. 2019 Jan 2;129(9):2082–6.
- Baba A, Hashimoto K, Kayama R, Yamauchi H, Ikeda K, Ojiri H. Radiological approach for the newly incorporated T staging factor, depth of invasion (DOI), of the oral tongue cancer in the 8th edition of American Joint Committee on Cancer (AJCC) staging manual: assessment of the necessity for elective neck dissection. Japanese Journal of Radiology [Internet]. 2020 Apr 30.
- Cramer JD, Sridharan S, Ferris RL, Duvvuri U, Samant S. Sentinel Lymph Node Biopsy Versus Elective Neck Dissection for Stage I to II Oral Cavity Cancer. The Laryngoscope [Internet]. 2018 Oct 3;129(1):162–9.
- Bittar RF, Ferraro HP, Ribas MH, Lehn CN. Predictive factors of occult neck metastasis in patients with oral squamous cell carcinoma. Brazilian Journal of Otorhinolaryngology [Internet]. 2016 Sep;82(5):543–7.
- Massey C, Dharmarajan A, Bannuru RR, Rebeiz E. Management of N0 neck in early oral squamous cell carcinoma: A systematic review and meta-analysis. The Laryngoscope [Internet]. 2018 Dec 20;129(8):E284–98.
- Brown JS, Shaw RJ, Bekiroglu F, Rogers SN. Systematic review of the current evidence in the use of postoperative radiotherapy for oral squamous cell carcinoma. British Journal of Oral and Maxillofacial Surgery [Internet]. 2012 Sep;50(6):481–9.
- Gupta T, Agarwal J, Jain S, Phurailatpam R, Kannan S, Ghosh-Laskar S, et al. Three-dimensional conformal radiotherapy (3D-CRT) versus intensity modulated radiation therapy (IMRT) in squamous cell carcinoma of the head and neck: A randomized controlled trial. Radiotherapy and Oncology [Internet]. 2012 Sep;104(3):343–8.
- Oliveira MEL de. Xerostomia decorrente da radioterapia no tratamento do câncer de cabeça e pescoço: uma revisão integrativa. Instituto federal de educação, ciência e tecnologica de santa catarina – câmpus Florianópolis. Departamento acadêmico de saúde e serviços curso superior de tecnologia em radiologia [Internet]. 2019;1–40. Disponível em: https://repositorio.ifsc.edu.br/bitstream/handle/123456789/1238/TCC_%20M%C2%AA%20Eduarda%20Lamb%20Oliveira.pdf?sequence=1&isAllowed=y#:~:text=A%20xerostomia%20%C3%A9%20um%20efeito,et%20al.%2C%202012.
- Blanchard P, Gunn GB, Lin A, Foote RL, Lee NY, Frank SJ. Proton Therapy for Head and Neck Cancers. Seminars in Radiation Oncology [Internet]. 2018 Jan;28(1):53–63.
- Moreno AC, Frank SJ, Garden AS, Rosenthal DI, Fuller CD, Gunn GB, et al. Intensity modulated proton therapy (IMPT) – The future of IMRT for head and neck cancer. Oral Oncology [Internet]. 2019 Jan;88:66–74.
- Furness S, Glenny A-M, Worthington HV, Pavitt S, Oliver R, Clarkson JE, et al. Interventions for the treatment of oral cavity and oropharyngeal cancer: chemotherapy. Cochrane Database of Systematic Reviews [Internet]. 2011 Apr 13; Disponível em: https://pubmed.ncbi.nlm.nih.gov/21491393/.
- Trosman SJ, Zhu A, Nicolli EA, Leibowitz JM, Sargi ZB. High‐Risk Cutaneous Squamous Cell Cancer of the Head and Neck: Risk Factors for Recurrence and Impact of Adjuvant Treatment. The Laryngoscope [Internet]. 2020 Feb 17;131(1).
- Hartner L. Chemotherapy for Oral Cancer. Dental Clinics of North America [Internet]. 2018 Jan;62(1):87–97.
- Nakamura H, Tamaki S, Yagyuu T, Yamakawa N, Hatake K, Kirita T. Relationship Between EGFR Expression in Oral Cancer Cell Lines and Cetuximab Antibody-dependent Cell-mediated Cytotoxicity. Anticancer Research [Internet]. 2019 Mar;39(3):1275–82.
- Gebre-Medhin M, Brun E, Engström P, Haugen Cange H, Hammarstedt-Nordenvall L, Reizenstein J, et al. ARTSCAN III: A Randomized Phase III Study Comparing Chemoradiotherapy With Cisplatin Versus Cetuximab in Patients With Locoregionally Advanced Head and Neck Squamous Cell Cancer. Journal of Clinical Oncology [Internet]. 2021 Jan 1;39(1):38–47.
- Fukumoto C, Sawatani Y, Shiraishi R, Zama M, Shimura M, Hasegawa T, et al. Effectiveness of cetuximab as preemptive postsurgical therapy for oral squamous cell carcinoma patients with major risk: a single‐center retrospective cohort study. Investigational New Drugs [Internet]. 2021 Jan 15;39(3):846–52.
- Guigay J, Fayette J, Mesia R, Lafond C, Saada-Bouzid E, Geoffrois L, et al. TPExtreme randomized trial: TPEx versus Extreme regimen in 1st line recurrent/metastatic head and neck squamous cell carcinoma (R/M HNSCC). Journal of Clinical Oncology [Internet]. 2019 May 20;37(15_suppl):6002–2.
- Burtness B, Harrington KJ, Greil R, Soulières D, Tahara M, de Castro G, et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. The Lancet [Internet]. 2019 Nov.
- Chen T-H, Chang PM-H, Yang M-H. Combination of pembrolizumab and lenvatinib is a potential treatment option for heavily pretreated recurrent and metastatic head and neck cancer. Journal of the Chinese Medical Association [Internet]. 2021 Mar 31;84(4):361–7.
- Bulbul MG, Zenga J, Tarabichi O, Parikh AS, Sethi RK, Robbins KT, et al. Margin Practices in Oral Cavity Cancer Resections: Survey of American Head and Neck Society Members. The Laryngoscope [Internet]. 2020 Aug 22;131(4):782–7.
- Kain JJ, Birkeland AC, Udayakumar N, Morlandt AB, Stevens TM, Carroll WR, et al. Surgical margins in oral cavity squamous cell carcinoma: Current practices and future directions. The Laryngoscope [Internet]. 2019 Apr 26;130(1):128–38.
1Faculdade de Odontologia da Universidade de Sorocaba (FOUNISO), Sorocaba, São Paulo.
2Faculdade de Odontologia da Universidade Paulista, Campus Sorocaba (FOUNIP), Sorocaba, São Paulo.
