MYOCARDITIS X COVID-19: A BIBLIOGRAPHIC REVIEW
MIOCARDITIS X COVID-19: UNA REVISIÓN BIBLIOGRÁFICA
REGISTRO DOI: 10.5281/zenodo.11137532
Anna Clara Santos Faria1
Barbara Cristina Braun2
Jean Carlos Fernando Besson3
Resumo
O surgimento do vírus Sars-Cov-2, popularmente chamado de Covid-19, muito preocupou não só a sociedade, mas também os órgãos de saúde de todo o mundo com as consequências a curto prazo, no entanto, atualmente, quem vem liderando são os efeitos a longo prazo. Desses, pode ser citado a miocardite, uma doença que se caracteriza pela inflamação do músculo cardíaco que pode ser causada por condições infecciosas e não infecciosas. Esse estudo visa explicar sobre a miocardite e o seu desenvolvimento, posteriormente, a indivíduos que foram contaminados pelo vírus Sars-Cov2, com enfoque nas crianças, que são sujeitas a uma baixa taxa de testes, sendo um problema visto que crianças infectadas com SARS-CoV-2 também estão em risco de desenvolver Síndrome Inflamatória Multissistêmica em Crianças (MIS-C). Dessa forma, essa pesquisa, que se caracteriza por uma revisão bibliográfica, recorreu como fonte de pesquisa aos bancos de dados da Pubmed, UpToDate, Citeseer, Science, entre outros, no idioma inglês. Sendo utilizados apenas publicações de livre acesso e estudos com relevância clínica até os dias atuais.
PALAVRAS-CHAVE: Sars-Cov-2, miocardite, MIS-C
Abstract
The emergence of the Sars-Cov-2 virus, popularly called Covid-19, greatly worried not only society, but also health bodies around the world with the short-term consequences, however, currently, those who come Leading the way are the long-term effects. Of these, myocarditis can be mentioned, a disease characterized by inflammation of the heart muscle that can be caused by infectious and non-infectious conditions. This study aims to explain myocarditis and its development, subsequently, in individuals who have been infected by the Sars-Cov2 virus, focusing on children, who are subject to a low rate of testing, being a problem since children infected with SARS- CoV-2 are also at risk of developing Multisystem Inflammatory Syndrome in Children (MIS-C). Thus, this research, which is characterized by a bibliographical review, used the databases of Pubmed, UpToDate, Citeseer, Science, among others, in the English language as a research source. Only open access publications and studies with clinical relevance to this day are used.
KEYWORDS: Sars-Cov-2, myocarditis, MIS-C
Resumen
La aparición del virus Sars-Cov-2, popularmente llamado Covid-19, preocupó mucho no sólo a la sociedad, sino también a los organismos de salud de todo el mundo con las consecuencias a corto plazo, sin embargo, en la actualidad, quienes vienen liderando el camino son los de largo plazo. -efectos a plazo. De estas se puede mencionar la miocarditis, una enfermedad caracterizada por la inflamación del músculo cardíaco que puede ser causada por afecciones infecciosas y no infecciosas. Este estudio tiene como objetivo explicar la miocarditis y su desarrollo, posteriormente, en individuos que han sido infectados por el virus Sars-Cov2, centrándose en los niños, quienes están sujetos a un bajo índice de pruebas, siendo un problema ya que los niños infectados con SARS-CoV- 2 también corren el riesgo de desarrollar el síndrome inflamatorio multisistémico en niños (MIS-C). Así, esta investigación, que se caracteriza por una revisión bibliográfica, utilizó como fuente de investigación las bases de datos de Pubmed, UpToDate, Citeseer, Science, entre otras, en idioma inglés. Sólo se utilizan publicaciones y estudios de acceso abierto con relevancia clínica hasta el día de hoy.
PALABRAS CLAVE: Sars-Cov-2, miocarditis, MIS-C
- Introdução
No final de dezembro de 2019, em Wuhan, capital da China, emergiu o primeiro caso de COVID-19, causado pelo vírus da Sars-Cov 2, se consolidando no final de 2020, desde então, o coronavírus se tornou um problema de saúde pública mundial. A propagação do covid-19 apanhou muitos governos de surpresa e revelou um despreparo da saúde pública mediante a situações de alta demanda. Por ser uma doença multissistêmica, as manifestações são variadas, no entanto, as consequências cardíacas foram mais comuns, sendo a miocardite.
A miocardite é a inflamação do músculo cardíaco, causada por condições infecciosas e não infecciosas, sendo a primeira via patógenos, principalmente virais e a segunda por autoimunidade, doenças específicas, drogas e genética. Os sintomas surgem leves como: dor torácica, dispneia, fadiga, palpitações, síncope (SURESH et al., 2022), no entanto, tem uma rápida evolução e consequentemente um agravo desses sintomas levando a taquicardia e insuficiência cardíaca de início agudo com choque cardiogênico (SIRIPANTHONG et al., 2020).
Para o desenvolvimento da miocardite de início ocorre a infecção viral e consequentemente a morte dos miócitos, subsequente tem-se a resposta imune inata composta por função de células T e como resultado uma resposta imune específica que resultará (FRADE et al., 2022) em lesões miocárdicas e que induzem arritmias e síndromes coronarianas agudas (SCA) levando à insuficiência cardíaca aguda e choque (SALABEI et al., 2022). Para o vírus entrar nas células, o SARS-COV 2 tem que se ligar ao receptor ECA2, o mesmo, é altamente específico para a covid (CHILAZI et al., 2021). Esses receptores para a proteína da enzima conversora de angiotensina 2, funcionam como porta de entrada para o vírus, mas também possuem papel protetor que é a degradação da angiotensina II em angiotensina 1-7 (VERDECCHIA et al., 2020).
Nos estágios iniciais da pandemia COVID-19, a proporção de casos confirmados entre crianças era relativamente pequena e pensava-se que as crianças raramente eram afetadas pelo SARS-CoV-2. No entanto, a partir de estudos foi indicado que a verdadeira incidência da infecção é subestimada devido à baixa taxa de testes em crianças. Mesmo com um diagnóstico desafiador, é necessário dar a devida importância para essa faixa etária, justamente porque crianças infectadas com SARS-CoV-2 também estão em risco de desenvolver Síndrome Inflamatória Multissistêmica em Crianças (MIS-C), uma condição rara, mas grave, associada à COVID-19 (NIKOLOPOULOU E MALTEZOU, 2022). Mais de 80% dos pacientes com MIS-C também apresentam alterações cardíacas incomuns e outros sintomas amplos, que podem confundir o diagnóstico (JIANG et al., 2020).
Como toda doença tem as suas especificidades, para a miocardite não seria diferente, neste caso é referido com os biomarcadores, esses justificam algumas manifestações clínicas da doença e são detectados nos respectivos exames laboratoriais (MONTERA et al., 2022). Deve-se compreender que, os biomarcadores permitem o rastreamento mais precoce da miocardite, bem como o tratamento mais precoce e uma melhor compreensão do curso da doença para pacientes específicos. Além disso, também podem fornecer um insight importante para a tomada de decisão diagnóstica e terapêutica (SURESH et al., 2022).
O presente estudo tem como objetivo descrever a relação da miocardite com o COVID19, tendo como público-alvo crianças e adolescentes. Bem como explicar a fisiopatologia da doença, juntamente com a Síndrome Inflamatória Multissistêmica em crianças, relacionando com os biomarcadores necessários para diagnóstico e tratamento.
- Fisiopatologia:
É notório a grande relevância do tema para a sociedade, tendo em vista que a pandemia trouxe não só consequências a curto prazo, mas também a longo prazo. Uma das implicações trazidas foram as manifestações clínicas pós infecção. Desse modo, sabe-se que a miocardite acomete o sistema cardiovascular podendo ser afetado direta ou indiretamente de forma grave, levando a lesões do miocárdio, arritmias, miocardite, insuficiência cardíaca congestiva, cardiomiopatia por estresse, síndrome coronariana aguda, a qual pode estar relacionada ao estado pró trombótico gerado pela doença e, até mesmo, choque cardiogênico (FERREIRA et al., 2021).
Acredita-se que o motivo pelo qual o coração é particularmente vulnerável ao vírus SARS-CoV-2 esteja relacionado ao mecanismo utilizado pelo vírus para obter a entrada de células. O receptor da enzima conversora de angiotensina 2 (ACE2), usado pelo vírus para obter acesso celular, é altamente expresso em tecidos cardiovasculares, incluindo miócitos cardíacos, células endoteliais, fibroblastos e células musculares lisas. Dessa forma, a interação viral direta através desses receptores suporta um efeito citotóxico direto do vírus sobre os cardiomiócitos (SALABEI et al., 2022).
A entrada do vírus SARS-CoV-2 na célula se dá pela ligação eficiente da proteína viral spike (S) ao receptor ACE2 que é uma glicoproteína. O processo de entrada viral se inicia com a ligação da porção N-terminal a uma bolsa do receptor ACE2. A partir disso, sucede a clivagem da proteína entre as unidades S1 e S2, que é operada pelo receptor protease transmembrana serina 2 (TMPRSS2), e após o descolamento de S1, a unidade S2 viral restante sofre um rearranjo conformacional que impulsiona e completa a fusão entre a membrana viral e celular, com subsequente entrada do vírus na célula, liberação de seu conteúdo, replicação e infecção de outras células (VERDECCHIA et al., 2020).
Os receptores de ACE2, tem um papel importante para a entrada do vírus na célula, no entanto, também exerce a função protetora essencial da ECA2 que é a degradação da angiotensina II em angiotensina 1-7, esta é bloqueada por inibidores seletivos da ECA2. A angiotensina II ela tem o papel de promover vasoconstrição, sintetizar aldosterona e elevar a pressão arterial, resultando em diversas reações adversas, com destaque para disfunção e hipertrofia do miocárdio, fibrose intersticial, inflamação aumentada, estresse oxidativo e distúrbios da coagulação sanguínea (TOBLER et al., 2022). Ademais, a angiotensina II também interfere na imunidade adaptativa ao ativar macrófagos e outras células do sistema imunológico, com consequente aumento da produção de IL-6, TNFα e outras citocinas inflamatórias (VERDECCHIA et al., 2020). Os receptores ACE2 reduzem os efeitos adversos da angiotensina II não apenas pela degradação da angiotensina II, eliminando ou limitando assim o seu potencial deletério, mas também pela geração de angiotensina 1-7, esta exerce numerosos efeitos salutares e opostos (“contra-reguladores”) aos da angiotensina II através de uma ligação eficiente com o receptor.
Além disso, subsequente a etapa da ligação do SARS- CoV-2 com a ECA2, é válido ressaltar que dentro da célula, o SARS-CoV-2 pode prejudicar a formação de grânulos de estresse, através de sua proteína acessória. E sem os grânulos de estresse, o vírus pode se replicar e danificar a célula (SIRIPANTHONG et al., 2020). Então, os linfócitos T virgens de tratamento podem ser preparados tanto para antígenos virais via células apresentadoras de antígenos, quanto para o cardiotropismo pelo HGF, produzido pelo coração. Sendo assim, o HGF liga-se c-Met, um receptor HGF em linfócitos T. Logo, os linfócitos T CD8 + primed migram para os cardiomiócitos e causam inflamação miocárdica através de citotoxicidade mediada por células (SIRIPANTHONG et al., 2020).
O vírus, pode se proliferar no sistema imunológico do hospedeiro e invadir os cardiomiócitos através de receptores específicos de replicação viral, que se persistirem, podem levar a inflamação miocárdica (TOBLER et al., 2022). Além disso, a ativação do sistema imune inato no coração é benéfica por seus efeitos antivirais, mas a ativação excessiva ou persistente pode levar a uma inflamação exagerada e/ou crônica que desencadeia destruição e remodelamento miocárdico, culminando em disfunção cardíaca (TSCHÖPE et al., 2020). Não só essa ativação excessiva do sistema imune, resulta em uma disfunção cardíaca, mas também a relação da miocardite viral sendo uma combinação da lesão celular direta com a citotoxicidade mediada por células do sistema imune, como os Linfócitos T, a ideia foi proposto por Esfandiarei e McManus8 , ambos acreditam que essa relação da miocardite viral com o sistema imune podem ser alavancadas pela síndrome da tempestade de citocinas. Do mesmo modo, essas citocinas, as quais são pró-inflamatórias, são liberadas na circulação e a ativação de linfócitos T é aumentada e libera ainda mais citocinas. Isso resulta em uma alça de feedback positivo de ativação imune e dano miocárdico (SIRIPANTHONG et al., 2020).
Outrossim, o estado pró-inflamatório aumentado em COVID-19 igualmente desempenha um papel no dano miocárdico. Essas pilhas pró-inflamatórios liberam citocinas tais como a proteína quimioattractant do monócyte 1 (MCP-1), uma citocina principal observada para aumentar significativamente após o início COVID-19. A mesma desempenha o papel de regulador principal da migração de monócitos/macrófagos para o local da infecção SARS-CoV-2. E o acúmulo dessas células do sistema imune ao redor de inclusões virais no miocárdio pode interromper a função cardíaca mecânica ou eletricamente (SALABEI et al., 2022). Já a interleucina-1β (IL-1β), outro regulador chave da resposta inflamatória, é fundamental na etiologia da COVID-19, pois ela pode estimular a liberação de IL-21, IL-17 e IL-22, que medeiam a proliferação e diferenciação celular que podem contribuir para o espessamento miocárdico levando à cardiomiopatia (SALABEI et al., 2022).
Com relação a entrada do SARS-CoV-2 e a fisiopatologia da miocardite, ocorrem processos que podem ser divididos em quadro agudo e crônico. A primeira é caracterizada por uma lesão direta aos cardiomiócitos, interrompendo a membrana plasmática e a condução elétrica, posteriormente uma infecção do pericárdio causando edema maciço, e consequentemente uma isquemia de doença microvascular por possível infecção dos pericitos. Já no segundo cenário, de miocardite crônica ou curada é comum o paciente apresentar arritmias por reentrada por fibrose miocárdica ou cicatrizes e até mesmo citocinas pró-inflamatórias predisponentes à arritmogenicidade. As citocinas pró-inflamatórias (por exemplo, IL-6) podem causar deslocamento da placoglobina, uma proteína desmossomal, da membrana do cardiomiócito. E isso poderia ser arritmogênico, já que a aderência inadequada célula-célula é postulada para danificar a membrana celular, levando à morte celular cardíaca e reposição fibrogordurosa (SIRIPANTHONG et al., 2020).
- QUADRO CLÍNICO E BIOMARCADORES
A patologia da miocardite é decorrente de uma inflamação do coração, que causa danos no miocárdio seguidos de remodelamento e fibrose, essa inflamação pode evoluir para cardiomiopatia dilatada, insuficiência cardíaca e, eventualmente, morte em muitos pacientes. A doença está mais comumente associada a etiologias virais, mas também pode ser causada por outros tipos de microrganismos (bactérias, fungos, protozoários), por doenças autoimunes, imunes sistêmicas e por drogas e outras substâncias (SURESH et al., 2022). A partir disso, demonstrou-se que a miocardite comprovada por biópsia está associada a mau prognóstico em pelo menos 30% dos pacientes, sendo uma das causas mais comuns de morte súbita cardíaca em faixas etárias mais jovens (SURESH et al., 2022).
Dentre as manifestações está associada a uma ampla gama de apresentações, desde elevação assintomática de biomarcadores até arritmias ventriculares ou supraventriculares graves, disfunção ventricular esquerda e insuficiência cardíaca (RAHMAN, 2022). Em relação aos biomarcadores observa-se, principalmente, níveis elevados de peptídeos natriuréticos, troponinas, mioglobina, proteína C reativa, interleucinas e ferritina, que é o resultado de lesão miocárdica (RAHMAN, 2022). Não só esses biomarcadores, mas também outros como contagem de leucócitos, velocidade de hemossedimentação (VHS) e proteína C reativa (PC-R), funcionam como marcadores inflamatórios e podem estar elevados em pacientes com miocardite.
É válido ressaltar que esses biomarcadores permitem o rastreamento mais precoce da miocardite, bem como o tratamento mais precoce e uma melhor compreensão do curso da doença para pacientes específicos. Na busca, para identificar novos biomarcadores que possam satisfazer alguns critérios como: ter boa sensibilidade e especificidade, custo-efetivo para obtê-lo, capacidade de determinar prognóstico, identificar fatores específicos de fase e etiologia e informar opções de tratamento (ASKIN et al., 2020). Ademais, os biomarcadores oportunizam novas terapêuticas, como os microRNA circulantes para miocardite aguda. Esses microRNA, têm sido encontrados elevados no contexto de miocardite, e têm relação na regulação inflamatória, nas vias de resposta à lesão cardíaca e diferenciação de várias células imunes importantes. Outrossim, sabe-se que ao mimetizar esses miRNAs ou silenciá-los, dependendo de sua função, para atenuar os sintomas da miocardite e assim, controlar a inflamação e a progressão da doença (SURESH et al., 2022).
Em um estudo sobre infecção por SARS-CoV-2 e miocardite publicado por Jaiswal et al, a maioria dos pacientes apresentou tosse (61,9%), seguida de febre (60,4%), falta de ar (53,2%) e dor torácica (43,9%). Os marcadores inflamatórios estavam elevados em 97,8% dos pacientes, enquanto os biomarcadores cardíacos estavam elevados em 94,8% dos pacientes incluídos (RAHMAN, 2022). Os sintomas clínicos, podem incluir desde dor torácica, dispneia, fadiga, palpitações e síncope, até mesmo Complicações cardiovasculares agudas incluindo arritmia, miocardite, síndrome coronariana aguda, hipertensão pulmonar e disfunção do VD (PARUMS, 2022). A partir disso, surgiram estudos que evidenciam como as crianças e adolescentes são suscetíveis à infecção por SARS-CoV-2, mas uma grande porcentagem de crianças é assintomática ou pré-sintomática, portanto, a verdadeira incidência da infecção é subestimada devido à baixa taxa de testes em crianças (NIKOLOPOULOU E MALTEZOU, 2022). De certo modo, não apresentar sintomas dificulta o diagnóstico, o que demonstra um sério problema pois mais de 60% dos pacientes hospitalizados por COVID-19 apresentam sinais claros de lesão miocárdica, com entre 20% e 63% dos pacientes apresentando dano cardíaco aumentado, como evidenciado por níveis específicos de biomarcadores (DAEMS et al., 2022). Esses pacientes hospitalizados apresentaram uma variedade de disfunções cardíacas, incluindo: anormalidades da motilidade segmentar do ventrículo esquerdo (23,7%); disfunção ventricular (ventrículo direito 26,3%; ventrículo esquerdo 18,4%); disfunção diastólica (13,2%) e derrame pericárdico (7,2%) (DAEMS et al., 2022).
- Síndrome Inflamatória Multissistêmica em Crianças (MIS-C)
De modo geral, os fatores de risco para o desenvolvimento de doenças graves entre crianças infectadas com SARS-CoV-2 incluem idade, carga viral e comorbidades crônicas (JIANG et al., 2020). Acerca disso, a patologia, nomeada como Síndrome Inflamatória Multissistêmica em Crianças (MIS-C) é uma condição rara, mas grave, associada à COVID-19 que foi relatada em crianças (NIKOLOPOULOU E MALTEZOU, 2022). É uma condição hiper inflamatória grave em crianças e adolescentes (idade entre < 21 anos) associada à infecção antecedente pelo coronavírus 2 da síndrome respiratória aguda grave (SARS-CoV-2), caracterizada por febre, sintomas gastrointestinais, como dor abdominal e diarreia, e complicações cardíacas, como miocardite e aneurismas das artérias coronárias (MILLER et al., 2022). A MIS-C pode começar semanas depois de uma criança estar infectada com SARS-CoV-2, geralmente 2-6 semanas após a infecção, e pode acarretar sintomas mais graves como o choque e falência de múltiplos órgãos, exigindo cuidados intensivos (MILLER et al., 2022).
A fisiopatologia da MIS-C ainda não está clara e os possíveis mecanismos incluem: anticorpos ou reconhecimento de células T de autoantígenos (mimetismo viral do hospedeiro) resultando em autoanticorpos, reconhecimento de anticorpos ou células T de antígenos virais expressos em células infectadas, formação de complexos imunes que ativam a inflamação e sequências de superantígenos virais que ativam células imunes do hospedeiro (JIANG et al., 2020). Assim, a resposta imune é desencadeada, principalmente pelos neutrófilos, que desempenham mecanismos funcionais relacionados com a formação de armadilhas extracelulares de neutrófilos (NETs).
As armadilhas extracelulares de neutrófilos (NETs) são semelhantes a uma rede de DNA livre de células, histonas e conteúdo de grânulos de neutrófilos, incluindo proteínas e enzimas microbicidas que estão envolvidos na fisiopatologia de uma ampla gama de estados inflamatórios e pró-trombóticos, como sepse, trombose e insuficiência respiratória. A geração de NETs pelos neutrófilos, chamada NETose, pode ser estimulada por muitos vírus. Embora sua principal função seja capturar o vírus, os TNEs induzidos por vírus podem desencadear reações inflamatórias e imunológicas de maneira descontrolada, levando a uma resposta inflamatória sistêmica exagerada, semelhante à hiperinflamação observada na MIS-C (JIANG et al., 2020). A Figura 1 apresenta de forma didática o mecanismo de ação da MIS-C.
Figura 1 – Mecanismo de ação da MIS-C
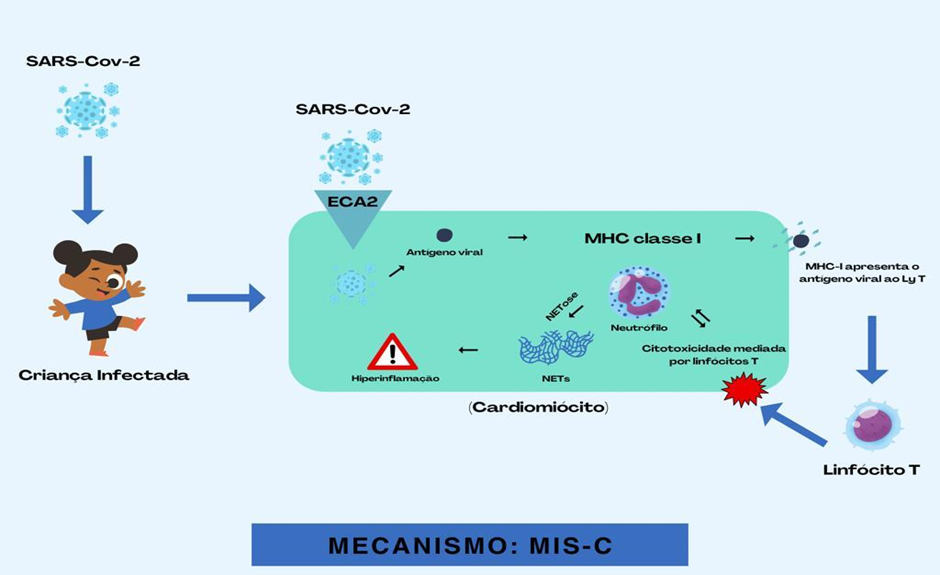
A criança contrai o Sars-Cov-2. À medida que o vírus invade o corpo da pessoa, ele se conecta aos receptores ECA2 do Cardiomiócito e adentra na célula. Dessa forma, o antígeno viral é apresentado ao linfócito T pelo MHC-I. Isso desencadeia a resposta inflamatória, especialmente pelos Neutrófilos que produzem as NETs, as quais provocam reações inflamatórias e imunológicas excessivas e incontroláveis, resultando em uma resposta inflamatória sistêmica exagerada.
- DIAGNÓSTICO E TRATAMENTO
A miocardite é uma das mais importantes causas de morte cardiovascular aguda e requer diagnóstico precoce e tratamento agressivo para salvar o paciente (AYKAC et al., 2018). O diagnóstico precoce da miocardite poderia permitir o tratamento imediato, o que poderia melhorar os resultados nos pacientes, e que evitaria a progressão para cardiomiopatia dilatada, insuficiência cardíaca e, finalmente, morte nos pacientes (SURESH et al., 2022). Além disso, sabe-se que a miocardite afeta uma faixa etária específica, que são as crianças/jovens e acerca disso, os médicos devem estar cientes da possibilidade de descompensação circulatória em crianças com outras infecções com a influenza, por exemplo, e reconhecer pacientes com miocardite por influenza que apresentaram sintomas e sinais cardíacos sutis, podem ser ofuscados por manifestações sistêmicas da infecção por influenza subjacente em muitos casos clínicos (AYKAC et al., 2018).
Muitas vezes é difícil diagnosticar miocardite com base em sintomas clínicos, por isso opta-se por exames específicos também (SURESH et al., 2022). Os métodos atuais de diagnóstico de miocardite, incluindo exames de imagem e biópsia endomiocárdica, são invasivos, caros e muitas vezes não são feitos precocemente o suficiente para afetar a progressão (SURESH et al., 2022). Além disso, a biópsia endomiocárdica pode estar sujeita a viés/erro amostral e é invasiva. Tanto a American Heart Association (AHA) quanto a Sociedade Europeia de Cardiologia (ESC) recomendam a biópsia endomiocárdica (BEM) como a ferramenta diagnóstica definitiva para miocardite, mas ambas as sociedades reconhecem as limitações da BEM em termos de experiência necessária, risco de disseminação contagiosa e taxa de falso-negativos (SIRIPANTHONG et al., 2020). A biópsia endomiocárdica é considerada o exame padrão ouro, que é mais invasivo, e que pode ser estudada quanto à evidência de inflamação por inspeção visual da infiltração leucocitária e subtipagem com imunohistoquímica (FERREIRA et al., 2021).
O tratamento mais indicado é com antivirais, foi apresentado um novo medicamento, o tocilizumabe, um anticorpo monoclonal anti-receptor de IL-6, está sendo testado em um ensaio clínico randomizado e controlado multicêntrico que recruta pacientes COVID-19 com níveis elevados de IL-6. Esse anticorpo pode ser benéfico no contexto da síndrome da tempestade de citocinas e ajudar a reduzir a inflamação miocárdica (SIRIPANTHONG et al., 2020). No entanto, sabe-se que a mortalidade e morbidade podem ser observadas, apesar do suporte cardíaco precoce e do tratamento antiviral (AYKAC et al., 2018). Dessa forma, os dados mostram que a vacinação é a melhor estratégia de proteção, não só para infecções, mas também para as suas complicações (AYKAC et al., 2018).
- CONCLUSÃO
Tendo em vista os aspectos observados nesta revisão, conclui-se que a miocardite está intimamente relacionada a complicações frente à infecção pelo SARS-CoV-2, por meio de manifestações clínicas e biomarcadores. No entanto, é uma patologia com muitos mecanismos não esclarecidos e consequentemente, muitas lacunas. Posto isso, há uma dificuldade em se obter informações mais precisas sobre a doença, uma vez que, as literaturas são singulares e limitadas.
Levando-se em conta o que foi observado, recomenda-se que, para estudos futuros, seja realizada uma observação mais detalhada a fim de explicar a fisiopatologia de forma mais precisa. Afinal, o diagnóstico precoce da miocardite poderia permitir o tratamento imediato, o que poderia melhorar os resultados nos pacientes, e assim evitar a progressão da doença. Considerando uma vantagem significativa, a favor de preservar o paciente e evitar possíveis óbitos.
REFERÊNCIAS:
ASKIN, Lutfu; TANRđVERDI, Okan; ASKIN, Husna Sengul. O Efeito da Doença de Coronavírus 2019 nas Doenças Cardiovasculares. Arquivos Brasileiros de Cardiologia, [S.L.], v. 114, n. 5, p. 817-822, maio 2020. Sociedade Brasileira de Cardiologia. http://dx.doi.org/10.36660/abc.20200273.
AYKAC, Kubra; OZSUREKCI, Yasemin; KAHYAOGLU, Pinar; BASARANOGLU, Sevgen T.; ERTUGRUL, Ilker; ALP, Alpaslan; CENGIZ, Ali B.; KARA, Ates; CEYHAN, Mehmet. Myocarditis associated with influenza infection in five children. Journal Of Infection And Public Health, [S.L.], v. 11, n. 5, p. 698-701, set. 2018. Elsevier BV. http://dx.doi.org/10.1016/j.jiph.2018.05.003.
CHILAZI, M.; DUFFY, E. Y.; THAKKAR, A.; MICHOS, E. D.. COVID and Cardiovascular Disease: what we know in 2021. Current Atherosclerosis Reports, [S.L.], v. 23, n. 7, p. 1-12, 13 maio 2021. http://dx.doi.org/10.1007/s11883-021-00935-2.
DAEMS, Margo; LIESENBORGHS, Laurens; BOUDEWIJNS, Robbert; SIMMONDS, Steven J.; KRAISIN, Sirima; VAN WAUWE, Jore; CUIJPERS, Ilona; RAMAN, Jana; GEUENS, Nadèche; VAN BUYTEN, Tina. SARS-CoV-2 infection causes prolonged cardiomyocyte swelling and inhibition of HIF1α translocation in an animal model COVID-19. Frontiers In Cardiovascular Medicine, [S.L.], v. 9, p. 1-14, 17 out. 2022. Frontiers Media SA. http://dx.doi.org/10.3389/fcvm.2022.964512.
FERREIRA, Izabella Guedes; AZEVEDO, Ana Carolina Tassara; DURIGUETO, Ana Flávia Amaral; SÓTER, Isabella Maise de Andrade Rodrigues; SIMÕES, Juliana de Oliveira Miranda; SOARES, Laura Lustosa; FERREIRA, Thiago Santiago. COVID-19 e miocardite: uma possível consequência cardíaca após a infecção pelo sars-cov-2. Revista Eletrônica Acervo Saúde, [S.L.], v. 13, n. 9, p. 1-8, set. 2021. Revista Eletronica Acervo Saude. http://dx.doi.org/10.25248/reas.e8454.2021.
FRADE, G. L. F.; TROGO, J. F.; SILVA, M. J. G. da; BICALHO, J. N. de S. M.; ALMEIDA, B. R. C.; NORONHA, V. A. P.; REZENDE, T. T.; SILVA, R. L. da. Miocardite: uma revisão da literatura. Brazilian Journal Of Development, [S.L.], v. 8, n. 10, p. 65386-65397, 4 out. 2022. http://dx.doi.org/10.34117/bjdv8n10-030.
JIANG, Li; TANG, Kun; LEVIN, Mike; IRFAN, Omar; MORRIS, Shaun K; WILSON, Karen; KLEIN, Jonathan D; A BHUTTA, Zulfiqar. COVID-19 and multisystem inflammatory syndrome in children and adolescents. The Lancet Infectious Diseases, [S.L.], v. 20, n. 11, p. 276-288, nov. 2020. Elsevier BV. http://dx.doi.org/10.1016/s1473-3099(20)30651-4.
MILLER, Allison D; ZAMBRANO, Laura D; YOUSAF, Anna R; ABRAMS, Joseph y; MENG, Lu; WU, Michael J; MELGAR, Michael; OSTER, Matthew e; CATO, Shana e Godfred; BELAY, Ermias D. Multisystem Inflammatory Syndrome in Children—United States, February 2020–July 2021. Clinical Infectious Diseases, [S.L.], v. 75, n. 1, p. 1165-1175, jul. 2022. Oxford University Press (OUP). http://dx.doi.org/10.1093/cid/ciab1007.
MONTERA, Marcelo Westerlund; MARCONDES-BRAGA, Fabiana G.; SIMÕES, Marcus Vinícius; MOURA, Lídia Ana Zytynski; FERNANDES, Fabio; MANGINE, Sandrigo; OLIVEIRA, Amarino Carvalho de; SOUZA, Aurea Lucia Alves de Azevedo Grippa de; IANNI, Bárbara Maria; ROCHITTE, Carlos Eduardo. Diretriz de Miocardites da Sociedade Brasileira de Cardiologia – 2022. Arquivos Brasileiros de Cardiologia, [S.L.], v. 119, n. 1, p. 143-211, jul. 2022. Sociedade Brasileira de Cardiologia. http://dx.doi.org/10.36660/abc.20220412.
NIKOLOPOULOU, Georgia B.; MALTEZOU, Helena C.. COVID-19 in Children: where do we stand?. Archives Of Medical Research, [S.L.], v. 53, n. 1, p. 1-8, jan. 2022. Elsevier BV. http://dx.doi.org/10.1016/j.arcmed.2021.07.002.
ØSTERGAARD, L. SARS CoV‐2 related microvascular damage and symptoms during and after COVID‐19: consequences of capillary transit⠰time changes, tissue hypoxia and inflammation. Physiological Reports, [S.L.], v. 9, n. 3, p. 1-12, fev. 2021. http://dx.doi.org/10.14814/phy2.14726.
PARUMS, Dinah V.. Cardiovascular Complications at One Year After SARS-CoV-2 Infection are Independent of Underlying Cardiovascular Risk Factors or Severity of COVID-19. Medical Science Monitor, [S.L.], v. 28, p. 9370481-9370482, 1 maio 2022. International Scientific Information, Inc.. http://dx.doi.org/10.12659/msm.937048.
PATEL, J. M.. Multisystem Inflammatory Syndrome in Children (MIS-C). Current Allergy And Asthma Reports, [S.L.], v. 22, n. 5, p. 53-60, 22 mar. 2022. http://dx.doi.org/10.1007/s11882-022-01031-4.
RAHMAN, Atifur. Myocarditis and related complications of SARS-CoV-2 infection. Australian Journal Of General Practice, [S.L.], v. 51, n. 9, p. 661-665, 1 set. 2022. The Royal Australian College of General Practitioners. http://dx.doi.org/10.31128/ajgp-02-22-6325.
SALABEI, Joshua K.; ASNAKE, Zekarias T.; ISMAIL, Zeeshan H.; CHARLES, Kipson; STANGER, Gregory-Thomas; ABDULLAHI, Abdullahi H.; ABRAHAM, Andrew T.; OKONOBOH, Peters. COVID-19 and the cardiovascular system: an update. The American Journal Of The Medical Sciences, [S.L.], v. 364, n. 2, p. 139-147, ago. 2022. Elsevier BV. http://dx.doi.org/10.1016/j.amjms.2022.01.022.
SIRIPANTHONG, Bhurint; NAZARIAN, Saman; MUSER, Daniele; DEO, Rajat; SANTANGELI, Pasquale; KHANJI, Mohammed Y.; COOPER, Leslie T.; CHAHAL, C. Anwar A.. Recognizing COVID-19–related myocarditis: the possible pathophysiology and proposed guideline for diagnosis and management. Heart Rhythm, [S.L.], v. 17, n. 9, p. 1463-1471, set. 2020. Elsevier BV. http://dx.doi.org/10.1016/j.hrthm.2020.05.001.
SURESH, Abhilash; MARTENS, Pieter; TANG, W. H. Wilson. Biomarkers for Myocarditis and Inflammatory Cardiomyopathy. Current Heart Failure Reports, [S.L.], v. 19, n. 5, p. 346-355, 1 ago. 2022. Springer Science and Business Media LLC. http://dx.doi.org/10.1007/s11897-022-00569-8.
TOBLER, Diana L.; PRUZANSKY, Alix J.; NADERI, Sahar; AMBROSY, Andrew P.; SLADE, Justin J.. Long-Term Cardiovascular Effects of COVID-19: emerging data relevant to the cardiovascular clinician. Current Atherosclerosis Reports, [S.L.], v. 24, n. 7, p. 563-570, 4 maio 2022. Springer Science and Business Media LLC. http://dx.doi.org/10.1007/s11883-022-01032-8.
TSCHÖPE, Carsten; AMMIRATI, Enrico; BOZKURT, Biykem; CAFORIO, Alida L. P.; COOPER, Leslie T.; FELIX, Stephan B.; HARE, Joshua M.; HEIDECKER, Bettina; HEYMANS, Stephane; HÜBNER, Norbert. Myocarditis and inflammatory cardiomyopathy: current evidence and future directions. Nature Reviews Cardiology, [S.L.], v. 18, n. 3, p. 169-193, 12 out. 2020. Springer Science and Business Media LLC. http://dx.doi.org/10.1038/s41569-020-00435-x.
VERDECCHIA, Paolo; CAVALLINI, Claudio; SPANEVELLO, Antonio; ANGELI, Fabio. The pivotal link between ACE2 deficiency and SARS-CoV-2 infection. European Journal Of Internal Medicine, [S.L.], v. 76, p. 14-20, jun. 2020. Elsevier BV. http://dx.doi.org/10.1016/j.ejim.2020.04.037.
1 Universidade Cesumar, Brasil
E-Mail: Ra-22026202-2@Alunos.Unicesumar.Edu.Br
2 Universidade Cesumar, Brasil
E-Mail: Bbraun@Alunos.Unicesumar.Edu.Br
3 ORCID: Https://Orcid.Org/0000-0002-2545-7184
E-Mail: Jean.Besson@Docentes.Unicesumar.Edu.Br
