DIAGNOSTIC METHODS FOR HYPERADRENOCORTICISM IN DOGS: NARRATIVE REVIEW
REGISTRO DOI: 10.69849/revistaft/ar10202411101628
PORTO, Willians Malveira¹
FRANCA, Rubens Rossati²
MELO, Lilian Chama³
SAMPAIO, Philipe dos Santos⁴
GIARETTA, Tania de Oliveira⁵
RESUMO
O objetivo desta pesquisa foi investigar e avaliar os métodos de diagnóstico utilizados para o hiperadrenocorticismo em cães, analisando a literatura disponível nos últimos 20 anos. A metodologia empregada foi revisão bibliográfica qualitativa e exploratória, realizada através das bases de dados PUBMED, MEDLINE, BVS, SCOPUS, PERIÓDICOS, BIBLIOTECA ABERTA USP e SCIELO. Foram utilizadas palavras-chave como “cães”, “cão”, “hiperadrenocorticismo”, “endócrino”, “endocrinopatia” e “Cushing” para identificar estudos relevantes. A análise de conteúdo dos artigos selecionados revelou que os métodos diagnósticos variam de acordo com a suspeita clínica e incluem anamnese detalhada, exame clínico minucioso e exames laboratoriais básicos e de imagem. A escolha entre testes de supressão e de estimulação hormonal depende da origem suspeita da condição, sendo o teste de supressão com baixa dose de dexametasona altamente sensível para detectar hiperadrenocorticismo, enquanto o teste de estimulação com ACTH é crucial para diferenciar entre origens. A confirmação diagnóstica envolve também a ultrassonografia abdominal para visualização das glândulas adrenais e a identificação de possíveis massas, fundamental a guiar o tratamento adequado e determinar o prognóstico do paciente.
Palavras-Chave: Cães, Tratamento, Hiperadrenocorticismo, Diagnósticos.
ABSTRACT
The objective of this research was to investigate and evaluate the diagnostic methods used for hyperadrenocorticism in dogs by analyzing the available literature from the past 20 years. The methodology employed was a qualitative and exploratory literature review, conducted through databases such as PUBMED, MEDLINE, BVS, SCOPUS, PERIÓDICOS, BIBLIOTECA ABERTA USP, and SCIELO. Keywords such as “dogs,” “canine,” “hyperadrenocorticism,” “endocrine,” “endocrinopathy,” and “Cushing” were used to identify relevant studies. The content analysis of the selected articles revealed that diagnostic methods vary according to the clinical suspicion and include detailed anamnesis, thorough clinical examination, and basic and imaging laboratory tests. The choice between suppression and stimulation hormone tests depends on the suspected origin of the condition, with the low-dose dexamethasone suppression test being highly sensitive for detecting hyperadrenocorticism, while the ACTH stimulation test is crucial for differentiating between origins. Diagnostic confirmation also involves abdominal ultrasonography to visualize the adrenal glands and identify possible masses, which is essential for guiding appropriate treatment and determining the patient’s prognosis.
Abstract: Dogs, Treatment, Hyperadrenocorticism, Diagnosis.
1 INTRODUÇÃO
O hiperadrenocorticismo espontâneo, ou ainda síndrome de Cushing, é disendocrinia relativamente comum na espécie canina (Rubin; Carr, 2017). É definido pela presença de sinais clínicos e anormalidades bioquímicas resultantes de um excesso crônico de glicocorticoides. Refere-se aos casos em que o excesso é causado, assim, pela secreção excessiva de hormônio adrenocorticotrófico (ACTH) por tumor na hipófise, conhecido como hiperadrenocorticismo hipofisário (Rubin; Carr, 2017).
A condição foi descrita pela primeira vez em humanos em 1932 pelo neurocirurgião Harvey Cushing e começou a ser descrita em cães na década de 1950 (Sykes, 2013). Desde então, diversificadas pesquisas foram conduzidas e artigos publicados sobre esta síndrome (Cushing). O entendimento da patogênese, o desenvolvimento de métodos diagnósticos e o manejo ao longo do tempo melhoraram a compreensão da doença, melhorando as condições de vida e aumentando a expectativa de vida dos cães afetados. Estudos de diversificadas décadas descrevem os sinais clínicos, as anormalidades bioquímicas associadas à síndrome de Cushing e as opções terapêuticas possíveis (Prélaud, 2018; Sykes, 2013).
Justificadamente, esta pesquisa visa aprofundar o entendimento dessa condição em cães, mas aplicando à área técnica, conduzindo entendimento acerca de meios e procedimentos que auxiliam na tomada de decisão e de diagnóstico da patologia. Assim, tem contribuição direta com a ciência, mas também com os próprios animais que, por muitos, hoje, são considerados entes familiares. Nesse caso, o foco central reside em análise de literatura, face aos instrumentos de diagnóstico, da síndrome de Cushing. Esta pesquisa também se justifica pela necessidade de atualizar e ampliar o conhecimento científico existente sobre o hiperadrenocorticismo canino e assim, objetivou-se investigar, avaliar e apresentar diferentes métodos diagnósticos descritos na literatura para o hiperadrenocorticismo em cães, conforme metodologia a seguir.
2 METODOLOGIA
O método utilizado foi de revisão bibliográfica, qualitativa (que investigou o conteúdo bem como resultados objetivos, sejam quantitativos ou qualitativos de pesquisas), exploratória (tendo em vista que aprofundou um determinado assunto) e narrativa, pois teve em seu enfoque a apresentação de metodologias sem, especialmente, a rigidez metodológica que é exigida para as revisões sistemáticas.
A busca de artigos, publicações, livros, entre outros documentos, foi realizada através das seguintes bases de dados: PUBMED, MEDLINE, BVS e SCOPUS (para compor artigos aceitos na pesquisa) e PERIÓDICOS, BIBLIOTECA ABERTA USP e SCIELO para acessar tanto livros quanto artigos científicos na área. O lastro temporal definido foi: últimos 20 anos, em que pese as seguintes palavras-chaves aplicadas (em português e em inglês): “cães”, “cão”, “hiperadrenocorticismo”, “endócrino”, “endocrinopatia” e “Cushing”. Referências de todas as publicações foram encontradas também foram investigadas a fim de compor a análise final, que foi desenhada a partir da análise de conteúdo, de Bardin (2011).
3 DISCUSSÕES E RESULTADOS
O diagnóstico insurge de diferentes perspectivas conforme a literatura aqui consultada. Em tempo, as próximas subseções trabalham diretamente com as abordagens bem como com os pré-requisitos que foram encontrados.
3.1 – EXPLORAÇÃO ENDÓCRINA:PRÉ-REQUISITOS
Quando sistema está deficiente, o organismo desenvolve mecanismos compensatórios endócrinos, nervoso e imunológico, que interagem entre si. Portanto, o diagnóstico de uma endocrinopatia como o hiperadrenocorticismo deve ser abordado de maneira abrangente. Alé m disso, os efeitos hormonais variam de indivíduo para outro, dependendo do estado fisioló gico ou das doenças intercorrentes presentes (Rubin; Carr, 2017).
A suspeita diagn óstica começa com uma coleta detalhada da hist ó ria clí nica e anamnese (para detectar poliúria-polidipsia, letargia, polifagia etc.). Em seguida, segue-se para um exame clínico minucioso e os exames complementares básicos (hemograma, bioquí mica e urinálise). Com base nesses resultados e sua correta interpretação, a escolha dos testes endócrinos é feita dependendo da força da suspeita (Rubin; Carr, 2017).
Em cães, existe um hiperadrenocorticismo funcional em resposta a qualquer tipo de estresse. O estresse induz uma secreção aumentada de cortisol 20 a 70 minutos após o início do evento estressante, e esse evento pode ser difícil de detectar e pode se prolongar. Portanto, é necessário levar isso em consideração nos resultados e evitar o estresse o máximo possível antes e durante a coleta, para diferenciar um hiperadrenocorticismo primário ou funcional (Soetart, 2018; De Souza et al., 2017).
Qualquer tipo de estresse (seja instantâneo ou crônico, cognitivo/emocional e orgânico), por meio de estímulos externos ou internos, leva a modificações na secreção hormonal. Se o estresse persistir, os glicocorticoides não conseguem mais exercer um feedback negativo na secreção de CRH pelo hipotálamo e de ACTH pela hipófise (Rubin; Carr, 2017).
Isso resulta em superprodução de ACTH, que pode levar à hipertrofia do córtex das adrenais, resultando em hiperadrenocorticismo funcional crônico com secreção desregulada de glicocorticoides pelas glândulas adrenais. Isso geralmente resulta em hiperreatividade ao ACTH (Soetart, 2018). Em casos de doença crônica, pode ocorrer inflamação, levando a um aumento na secreção de mediadores da inflamação (IL-1, IL-6 e TNF-alpha), resultando em aumento na secreção de cortisol (Turnball; Rivier, 1999; Rubin; Carr, 2017).
É necessário considerar as interações hormonais, tudo o que as regula e que participa de seu bom funcionamento (receptores, proteínas transportadoras etc.), para escolher os testes adequados e diagnosticar corretamente hiperadrenocorticismo, não só hiperadrenocorticismo funcional. Para interpretar os resultados, é necessário medir a proteinemia e a albuminemia, pois as proteínas transportadoras desempenham um papel importante na ação hormonal. De fato, a quantidade de proteínas transportadoras está relacionada à concentração de hormônios livres. Quanto menos proteínas transportadoras estiverem disponíveis, mais hormônios estarão na forma livre, mais capazes de se ligar, assim, aos seus receptores nos diferentes órgãos-alvo (Jaillardon, 2020; Rubin; Carr, 2017).
Hormônios estão presentes em quantidades pequenas no sangue, com concentrações da ordem de 109 a 1012 mmol/L. A sua dosagem é imunológica e baseada na ligação anticorpo- específico-hormônio (Jaillardon, 2020). A dosagem de cortisol é feita em tubo seco, coletando amostra em tubo seco, pois é uma dosagem imunológica: centrifugação dentro de uma hora após a coleta, seguida de refrigeração por até 24 horas e/ou congelamento a – 20°C; a urina pode ser armazenada por até quatro dias a 4°C ou por mais tempo a -20°C (Rannou, 2018).
A dosagem de ACTH é feita em tubo EDTA coletando-se amostra em tubo EDTA para evitar os efeitos das proteases contidas no plasma (Behrend et al., 2013). Ao realizar uma dosagem, é importante considerar a precisão do teste. A precisão refere-se à capacidade de fornecer o mesmo resultado quando um parâmetro é medido várias vezes no mesmo espécime (em condições analíticas iguais ou diferentes em vários ciclos de medição) (Jack; Watson, 2018). É definida pelo coeficiente de variação (CV): % CV = desvio padrão/média x 100. Esta precisão é especialmente importante quando o resultado da dosagem está próximo de um valor limiar. Um teste com precisão aceitável tem um CV inferior a 15%. Para a interpretação, deve-se usar valores de referência do instrumento automático ou do laboratório, e não dados da literatura (Rannou, 2018; Jack; Watson, 2018).
O ACTH e os glicocorticoides, como os outros hormônios, são secretados de forma pulsátil e suas concentrações variam ao longo do dia. Portanto, uma única medição é difícil de se interpretar. Para superar assim essas variações temporais nas concentrações, é possível usar análogos hormonais que estimulam ou inibem a secreção de cortisol, tornando o resultado da dosagem interpretável (Rannou, 2018; Jack; Watson, 2018). Se o análogo hormonal tem efeito estimulador, a concentração de cortisol medida é a máxima, e vice-versa se o análogo tem efeito inibidor, a concentração de cortisol medida é a mínima (Jaillardon, 2020). A abordagem diagnóstica diante de uma suspeita de hiperadrenocorticismo é sistemática, dependendo da força da suspeita (Valentin, 2018).
3.2 – CONTEXTO CLÍNICO POUCO SUGESTIVO
Se os sinais clínicos e/ou as anormalidades fisiológicas e bioquímicas comuns estiverem ausentes, é aconselhável realizar um diagnóstico por exclusão. Isso envolve o teste do índice cortisol/creatinina urinária (ICCU), que possui de fato boa sensibilidade, mas especificidade moderada. Um resultado negativo exclui eficazmente o hiperadrenocorticismo devido ao seu alto valor preditivo negativo. Se positivo, outros testes devem ser realizados.
As concentrações de cortisol e creatinina são medidas na urina, e o ICCU reflete a excreção urinária de cortisol ao longo de algumas horas (Jack; Watson, 2018; Jaillardon, 2018). Para reduzir o risco de falsos positivos devido ao estresse, a coleta de urina pode ser feita pelo proprietário, pelo menos dois dias após a consulta, de preferência pela manhã. Deve-se considerar também tratamentos em curso que possam reduzir a secreção de cortisol (como tratamento com progestágenos), podendo diminuir o ICCU. Este teste é pouco invasivo, econômico e fácil de realizar (Rannou; Rosenberg, 2014; Feldman et al., 2014).
3.3 – CONTEXTO CLÍNICO SUGESTIVO
Com base na literatura aqui apresentada, recomenda-se realizar testes específicos nos seguintes casos: contexto clí nico sugestivo: um ou mais sinais clí nicos comuns estão presentes com mais ou menos anomalias biológicas fisiológicas compatíveis. Quanto mais sinais clínicos e biológicos forem compatíveis, maior será a suspeição e a indicação para realizar assim testes espec í ficos (Sykes, 2013; Freiche; Hernandez, 2020); descoberta incidental de uma massa na adrenal ou hipertrofia adrenal (Sykes, 2013; Freiche; Hernandez, 2020; Feldman et al., 2015); e cão diabético que não responde a altas doses de insulina, para o qual a resistência à insulina não é atribuída a outra causa (Behrend et al., 2013). Em tempo, a abordagem diagnóstica inclui a confirmação do hiperadrenocorticismo, o diagnóstico etioló gico e a identificação de possíveis complicações (Valentin, 2018).
3.4 – CONTEXTO CLÍNICO SUGESTIVO
Existem dois testes para detectar hiperadrenocorticismo, a saber: teste de supressão com baixa dose de dexametasona e teste de estimulação com ACTH. O teste de supressão com baixa dose de dexametasona: 0,01 mg/kg de dexametasona é administrado por via intravenosa. O cortisol é medido antes da injeção, às T+4h e T+8h. Normalmente, a dexametasona induz um feedback negativo no eixo hipotálamo- hipofisário por pelo menos oito horas, resultando em uma diminuição significativa na secreção de cortisol (Feldman; Nelson, 2013).
No caso de hiperadrenocorticismo de origem hipofisária, esse feedback será de curta duração e a concentração de cortisol será acima de 40 a 50 nmol/L pelo menos às T+8h, de acordo com os laboratórios (Feldman; Nelson, 2013; Sykes, 2013; Freiche; Hernandez, 2020; Behrend et al., 2013). Se a origem for adrenal, a secreção de cortisol é relativa e independente de ACTH e a concentração de cortisol também será acima do valor limite. É recomendável não alimentar o cão durante o teste. Este teste tem uma alta sensibilidade, entre 85 e 100%, e boa especificidade (44 a 73%) (Feldman; Nelson, 2013).
No entanto, deve-se ter cuidado com o hiperadrenocorticismo funcional e o estresse, que podem resultar em falsos positivos. Portanto, de fato, é teste de escolha para confirmar hiperadrenocorticismo espontâneo em caso de forte suspeita. Não deve ser usado se houver suspeita de hiperadrenocorticismo iatrogênico (Rannou; Rosenberg, 2014; Sykes, 2013). Falsos negativos também podem ocorrer devido à metabolização/excreção urinária aumentada de cortisol induzida pela dexametasona (Findlings et al., 2004).
Em cinco cães com hiperadrenocorticismo de origem hipofisária, resultados atípicos (invertidos) foram observados: a concentração de cortisol estava acima do limite em T+4h, mas abaixo em T+8h. Isso ainda sugere hiperadrenocorticismo, mas nesses casos outros testes devem ser realizados (Mueller et al., 2006). Teste de estimulação com ACTH: 250 μg/cão ou 5 μg/kg de ACTH sintético é administrado por via intravenosa ou intramuscular. Moléculas usadas são tetracosactida ou cosintropina. A medida da concentração de cortisol é feita antes da injeção e 1h a 1h30 após. Em cães com espontâneo, a secreção de cortisol é exacerbada após a injeção, resultando em uma concentração maior que nos cães saudáveis (valor pós- estimulação de mais de 500 a 700 nmol/L, dependendo dos laboratórios) (Sykes, 2013).
Este teste também é o padrão ouro ao diagnóstico de hiperadrenocorticismo iatrogênico: nesses casos, não haverá resposta após a injeção (insuficiência corticotrópica). É recomendável não alimentar o cão durante o teste. Este teste tem menor sensibilidade que o anterior: 57 a 63% quando a origem é adrenal e 80 a 83% quando é hipofisária (Findlings et al., 2004). Portanto, deve ser preferencialmente usado quando há suspeita iatrogênica e considerado como teste de segunda intenção em outros casos. Sua especificidade varia de 59 até 93%. Também deve-se estar atento aos falsos positivos (Deswarte; Benchekroun, 2015).
Várias causas além do hiperadrenocorticismo iatrogênico devem ser consideradas, pois podem explicar um resultado abaixo do limite e resultar em falso negativo (Feldman et al., 2014): má concentração/utilização/conservação de tetracosactida, amostragem e/ou dosagem de cortisol não realizadas dentro do tempo correto, administração recente de glucocorticoides, cetoconazol, progestágenos ou qualquer outro produto que induza à diminuição da secreção de cortisol, tumor adrenal secreta precursores de cortisol ou progestágenos (que podem se ligar aos receptores de glucocorticoides e ter efeitos semelhantes) (Feldman; Nelson, 2013). Escolha de testes específicos a serem utilizados deve ser ponderada com base na força da suspeita de hiperadrenocorticismo, para diagnosticar de forma mais confiável possível a síndrome de Cushing (Figura 1), conforme Deswarte; Benchekroun, 2015).
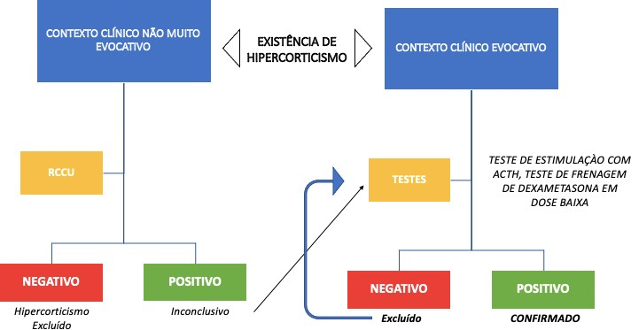
Figura 1. Método Diagnóstico para Hiperadrenocorticismo Espontâneo Canino
Fonte: Elaborado pelo Autor (2024)
A Figura 1 apresenta as dinâmicas que podem ser diretamente realizadas para um amplo diagnóstico canino. Com isto, vez identificado hiperadrenocorticismo, é necessário determinar sua origem (Freiche; Hernandez, 2020). Em tempo, tem-se o diagnóstico etiológico na subseção a seguir.
3.5 – DIAGNÓSTICO ETIOLÓGICO
Os exames de imagem são ferramentas úteis para abordar a origem etiológica, sendo a ultrassonografia abdominal inicialmente relevante (Valentin, 2018). Não por menos, algumas técnicas são possíveis. Ultrassonografia abdominal: inicialmente, permite visualizar as glândulas suprarrenais e avaliar sua simetria. Classicamente, no hiperadrenocorticismo adrenal, uma das glândulas apresenta massa ou aumento difuso, enquanto a glândula contralateral está atrofiada. No hiperadrenocorticismo hipofisário, ambas as adrenais têm tamanho normal a aumentado e são simétricas. Essas duas situações geralmente permitem suspeitar fortemente da etiologia (Prélaud, 2018; Deswarte; Benchekroun, 2015), fundamentalmente.
Em outros casos, como uma massa adrenal sem atrofia contralateral, ou ainda duas massas bilaterais, é impossível determinar a origem (massas podem ser tumores ou hiperplasias secundárias a um tumor hipofisário). Estamos então diante de uma “assimetria adrenal ambígua” (Valentin, 2018; Deswarte; Benchekroun, 2015).
A pesquisa indica que, em caso de assimetria clássica, uma espessura máxima de cinco milímetros para a glândula menor é considerada para concluir uma origem adrenal, com sensibilidade de 100% e especificidade de 96%. A medição da espessura deve ser feita no polo caudal, em corte sagital, onde é máxima (Lhermette; Sobel, 2018). O diagnóstico só pode ser feito se o operador de imagem for experiente e se ambas as glândulas estiverem adequadamente visualizadas (Deswarte; Benchekroun, 2015).
Na presença de massa(s) adrenal(ais) visível(is), deve-se, assim, procurar invasão local, especialmente da veia cava caudal, artérias e veias renais e frênicas-abdominais, além da aorta, o que constitui um critério de malignidade. Metástases, principalmente nos rins, fígado, linfonodos e músculos sublombares, também devem ser investigadas. Uma ecografia Doppler pode revelar distúrbios de fluxo associados a trombos. A presença de mineralização em uma massa não permite concluir se é benigna ou maligna, nem determinar, desta forma, a origem do hiperadrenocorticismo (Deswarte; Benchekroun, 2015).
A ecografia abdominal também permite visualizar outras anomalias relacionadas ao hiperadrenocorticismo, como hepatomegalia ou cálculos urinários (Sykes, 2013). Tomografia computadorizada abdominal: permite uma melhor visualização das adrenais, sua estrutura, tamanho, possíveis massas, etc (Touzet; Sonet, 2018).
Tem indicações semelhantes às da ecografia abdominal, mas oferece uma avaliação mais precisa e abrangente da extensão local, especialmente útil para potencial suprarenalectomia. Uma tomografia computadorizada torácica também pode ser recomendada para avaliar a extensão (Deswarte; Benchekroun, 2015; Behrend et al., 2013; Feldman et al., 2014).
Ressonância magnética de crânio ou do encéfalo: este exame é indicado se houver suspeita de tumor hipofisário (por exemplo, pela presença de sinais centrais nervosos) ou se diagnosticado por outros testes. Permite caracterizar o tamanho do tumor (orientação para micro ou para macroadenoma), útil para escolha de tratamento futuro e também prognóstico (Deswarte; Benchekroun, 2015; Behrend et al., 2013; Feldman et al., 2014).
Tomografia computadorizada de crânio: tem as mesmas indicações que a ressonância magnética, mas apenas visualiza tumores grandes que ultrapassam a sela túrcica. Tem a vantagem de poder ser realizada simultaneamente com a tomografia abdominal. O uso de uma tomografia dinâmica que avalia a irrigação sanguínea aumenta a sensibilidade na detecção de massas, independentemente de seu tamanho (Deswarte; Benchekroun, 2015; Behrend et al., 2013; Feldman et al., 2014). A imagem das estruturas do crânio também é indicada em casos de resultados não concordantes de testes relacionados à origem hipofisária ou adrenal (Behrend et al., 2013). Diante de resultados inconclusivos após uma ecografia abdominal, por exemplo, existem outros meios diagnósticos etiológicos que envolvem dosagens (Behrend et al., 2013).
Teste de supressão com baixa dose de dexametasona: uma vez diagnosticado Cushing, uma etapa opcional é utilizar os resultados deste teste para tentar especificar a origem hipofisária ou adrenal. Uma supressão relativa identifica uma origem hipofisária. Os critérios de uma supressão relativa são: uma cortisolemia inferior a 50% do valor basal (T0) em T+4h e/ou T+8h e/ou um valor inferior a 40 nmol/L em T+4h (Benchekroun et al., 2010). Com esses critérios, apenas metade dos cães com hiperadrenocorticismo hipofisário são identificados, provavelmente devido a supressões parciais, escapes ou resultados invertidos observados em muitos cães com comprometimento hipofisário, que não atendem aos critérios. Dois casos relatados de cães com tumor adrenal atenderam a pelo menos um dos critérios (Snyder; Johnson, 2014; Norman et al., 1999). A falta de supressão não permite concluir a origem, podendo ocorrer tanto em origem hipofisária quanto adrenal (Behrend et al., 2013).
Teste de supressão com alta dose de dexametasona: tem o mesmo princípio que o teste de supressão com baixa dose, mas desta vez a dose é 10 vezes maior: 0,1 mg/kg. Os critérios para concluir uma origem hipofisária são: uma concentração de cortisol abaixo de 40 nmol/L ou uma concentração inferior a 50% do valor basal em T+4h e/ou T+8h (Prelaud, 2018). Entre cães com hiperadrenocorticismo de origem hipofisária, 14% não apresentam nenhuma supressão com baixa dose, mas apresentam com alta dose (Behrend et al., 2013). Assim, além de cães com hiperadrenocorticismo de origem adrenal, aproximadamente 25% daqueles com hiperadrenocorticismo de origem hipofisária não apresentam critérios para hipercorticismo hipofisário, seja com supressão de baixa ou alta dose de dexametasona. Esta falta de supressão pode ser explicada pela presença de um macroadenoma hipofisário (Behrend et al., 2013; Snyder; Johnson, 2014; Behrend et al., 2013; Prelaud, 2018).
A associação com o teste de concentração de creatinina e cortisol urinário é possível. Duas amostras de urina são coletadas em dois dias consecutivos de manhã, seguidas pela administração de três doses altas de dexametasona oral a intervalos de 6-8 horas.
Dosagem basal de ACTH plasmático: o teste é simples e baseia-se em um fato de que, na doença adrenal, o feedback exercido pelos glicocorticoides sobre o eixo hipotálamo- hipofisário resulta na redução da produção e secreção de ACTH. Ao contrário, na doença hipofisária, a secreção de ACTH é normal ou aumentada. De fato, a principal desvantagem é a instabilidade do ACTH à temperatura ambiente, degradado por proteases plasmáticas. A coleta deve ser feita em um tubo de EDTA e a centrifugação idealmente a frio e dentro de 15 minutos (Snyder; Johnson, 2014; Prelaud, 2018).
O plasma deve então ser coletado e imediatamente congelado até a análise. A adição de aprotinina (inibidor de proteases) permite a conservação à temperatura ambiente, mas é compatível apenas com certas técnicas de dosagem (Snyder; Johnson, 2014; Behrend et al., 2013). Pode haver resultados contradit ó rios com outros testes, explicados pela secreção descontínua e não regular de ACTH, erros técnicos, estresse, secreção ectópica de ACTH ou ainda secreção de cortisol induzida por alimentos (Snyder; Johnson, 2014; Galac et al., 2005; Galac et al., 2018). A interpretação também pode ser complicada se o tumor adrenal for concomitante com uma lesão hipofisária (Jaillardon, 2018). O processo decisório para o diagnóstico etiológico é resumido na Figura 2.
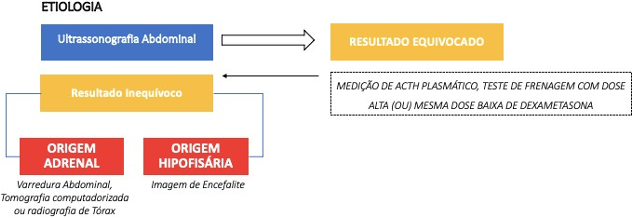
Figura 2. Diagnóstico Etiológico do Hiperadrenocorticismo Canino
Fonte: Elaborado pelo Autor (2024)
O modelo de Figura 2 foi adaptado de Deswarte; Benchekroun (2015) e, em tempo, as etapas em verde à esquerda do esquema são principalmente indicadas se a cirurgia adrenal está sendo considerada ou se um macroadenoma hipofisário está sendo procurado. Relevante ainda mencionar que, para além dele, existe uma ferramenta biológica que orienta o diagnóstico entre micro e macroadenoma hipofisário: trata-se da dosagem plasmática dos precursores do ACTH (POMC e pro-ACTH), cuja concentração está correlacionada ao tamanho do tumor. Este teste não está disponível rotineiramente. De fato, exames de imagem do encéfalo continuam sendo indispensáveis (De Fornel-Thibaud, 2009; Feldman et al., 2015).
3.5 – BUSCA POR POSSÍVEIS COMPLICAÇÕES
Por fim, é necessário realizar outros exames, se ainda não foram feitos, para investigar possíveis complicações e conforme o contexto clínico (Valentin, 2018; Seymour; Duke- Novakovski, 2017; Fabres; Benchekroun, 2020). Esses testes incluem exame de urina para cultura (ECBU) para procurar por infecção urinária, um exame completo de urina para relação proteína/creatinina (RPCU) para detectar proteinúria, medição da pressão arterial, dosagem de glicemia em jejum com ou sem dosagem das frutosaminas para detectar diabetes mellitus, etc (Valentin, 2018; Seymour; Duke-Novakovski, 2017).
4 CONSIDERAÇÕES FINAIS
Esta pesquisa, que discutiu os métodos de diagnóstico de hiperadrenocorticismo em cães – evidenciou diferentes abordagens para a tarefa complexa e multifacetada de diagnóstico dessa condição endocrinológica. Já de antemão, percebeu-se que a avaliação inicial envolve ampla anamnese detalhada e exame clínico minucioso, seguidos por exames básicos de laboratório. A escolha dos testes endócrinos é crucial e depende da força da suspeita clínica, considerando que o estresse pode influenciar significativamente os resultados.
A importância de considerar os efeitos do estresse é destacada, uma vez que pode induzir respostas hormonais que complicam a interpretação dos resultados. Essa variabilidade hormonal demanda cuidado na escolha dos métodos de diagnóstico para, assim, diferenciar hiperadrenocorticismo primário de funcional. A integração de informações sobre interações hormonais, incluindo a função das proteínas transportadoras, é crucial para uma interpretação precisa dos testes diagnósticos.
Não por menos, os métodos de diagnóstico incluem tanto os testes de supressão quanto de estimulação, cada um com suas especificidades e indicações. O teste de supressão com baixa dose de dexametasona é altamente sensível para detectar hiperadrenocorticismo espontâneo, enquanto o teste de estimulação com ACTH é crucial para diferenciar entre origens hipofisária e adrenal da condição. A interpretação dos resultados deve levar em consideração não apenas os valores absolutos de cortisol, mas também os padrões pulsáteis de secreção hormonal, fundamentalmente.
A confirmação do diagnóstico requer uma abordagem sistemática que inclui avaliação ultrassonográfica abdominal para determinar as possíveis origens da doença. A ultrassonografia permite a visualização das glândulas adrenais e a identificação de possíveis massas, ajudando, ainda, a guiar a decisão de tratamento adequado. A diferenciação entre hiperadrenocorticismo adrenal e hipofisário é essencial para o manejo clínico e prognóstico do paciente. Além da diferenciação diagnóstica, identificação de complicações associadas ao hiperadrenocorticismo, como invasão vascular e metástases, é crucial a planejar intervenções terapêuticas adequadas. A tomografia computadorizada pode ser indicada para avaliar a extensão local da doença, proporcionando uma visão mais detalhada das estruturas envolvidas.
Em tempo, o diagnóstico de hiperadrenocorticismo em cães requer, assim, abordagem integrada que combina história clínica detalhada, exames laboratoriais completos e técnicas de imagem precisas. A precisão na escolha e também na interpretação dos métodos diagnósticos é fundamental para garantir um manejo clínico eficaz e melhorar o prognóstico e qualidade de vida dos pacientes afetados por esta condição endócrina.
REFERÊNCIAS
ALMEIDA, Alcides Vieira de. Dos aprendizes artífices ao Instituto Federal de Santa Catarina. Florianópolis: Publicações do IF-SC, 2010.
BEHREND, E.; KOOISTRA, H.; NELSON, R.; REUSCH, C.; SCOTT-MONCRIEFF, J. Diagnosis of spontaneous canine hyperadrenocorticism: 2012 ACVIM consensus statement (Small Animal). Journal of Veterinary Internal Medicine, v. 27, n. 6, p. 1292-1304, 2013.
DESWARTE, A.; BENCHEKROUN, G. Diagnostic de l’hypercorticisme canin. Le Point Vétérinaire, v. 46, n. 359, p. 56-62, 2015.
FELDMAN, E. C.; NELSON, R. W.; REUSCH, Claudia; SCOTT-MONCRIEFF, J. C. Canine and Feline Endocrinology. 4. ed. Philadelphia: Saunders, 2015.
FELDMAN, E. C. et al. Trilostane dose versus body weight in the treatment of naturally occurring pituitary-dependent hyperadrenocorticism in dogs. Journal of Veterinary Internal Medicine, v. 26, n. 4, p. 1078-1080, 2014.
FELDMAN, E. C.; NELSON, R. W. Use of low- and high-dose dexamethasone tests for distinguishing pituitary-dependent from adrenal tumor hyperadrenocorticism in dogs. Journal of the American Veterinary Medical Association, v. 209, n. 4, p. 772-775, 2013.
FELDMAN, E.; NELSON, R. Canine and Feline Endocrinology and Reproduction. 3. ed. Philadelphia: Saunders, 2013.
FINDLINGS, J. W.; RAFF, H.; ARON, D. C. The low-dose dexamethasone suppression test: a reevaluation in patients with Cushing’s syndrome. The Journal of Clinical Endocrinology & Metabolism, v. 89, n. 3, p. 1222-1226, 2004.
FREICHE, V; HERNANDEZ, J. Gastro–entérologie canine et féline. New York: Elsevier Masson, 2020.
JACK, C. M.; WATSON, P. M. Veterinary Technician’s Daily Reference Guide: Canine and Feline. 2. ed. Ames: Wiley-Blackwell, 2018.
JAILLARDON, L. L’exploration endocrinienne: un challenge pour le praticien. Le Point Vétérinaire, v. 412, p. 14-19, 2020.
LHERMETTE, P.; SOBEL, D. BSAVA Manual of Canine and Feline Endoscopy and Endosurgery. 1. ed. Gloucester: BSAVA, 2018.
MUELLER, C.; SIEBER-RUCKSTUHL, N.; WENGER, M.; KASER-HOTZ, B.; REUSCH, C. E. Low-dose dexamethasone test with ‘inverse’ results: a possible new pattern of cortisol response. Veterinary Record, v. 159, n. 15, p. 489-491, 2006.
PRÉLAUD, P. Abrégés vétérinaires: Allergologie canine. New York: Elsevier Masson, 2018.
RANNOU, B. Interpretation of results in endocrinology: technical prerequisites. In: JAILLARDON, L. Modernizing clinical endocrinology in domestic carnivores. Le Point Vétérinaire, v. 49, p. 16-21, 2018.
RANNOU, B.; ROSENBERG, D. Diagnosis of hypercorticism and monitoring of trilostane treatment in the absence of available Synachtène. PratiqueVet, v. 49, n. 111, p. 50-52, 2014.
RUBIN, S.; CARR, A. Canine Internal Medicine Secrets. 1. ed. St. Louis: Mosby, 2017.
SEYMOUR, C.; DUKE-NOVAKOVSKI, T. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia. 2. ed. Gloucester: BSAVA, 2017.
SNYDER, L. B. C.; JOHNSON, R. A. Canine and Feline Anesthesia and Co-Existing Disease. 1. ed. Ames: Wiley-Blackwell, 2014.
SOETART, N. Effet du stress sur les fonctions endocrines. In: JAILLARDON, L. Moderniser l’endocrinologie clinique chez les carnivores domestiques. Le Point, v. 49, p. 24-29, 2018.
SYKES, J. E. Canine and Feline Infectious Diseases. Philadelphia: Elsevier, 2013.
TOUZET, C.; SONET, J. Interpretation of adrenal gland ultrasound abnormalities in dogs. Pratique Vet, v. 53, n. 157, p. 154-157, 2018.
TURNBULL, A. V.; RIVIER, C. L. Regulation of the hypothalamic-pituitary-adrenal axis by cytokines: Actions and mechanisms of action. Physiological Reviews, v. 79, p. 1-71, 1999.
VALENTIN, S. Diagnostic management of canine Cushing’s syndrome. Technique, v. 156, p. 6-9, 2018.
¹Willians Malveira Porto, Graduado em Ciências Contábeis pela Universidade Anhembi Morumbi (UAM), MBA em Controladoria pela Business School São Paulo (BSP), Graduando em Medicina Veterinária na Faculdade das Américas (FAM).
²Rubens Rossati Franca Junior, Graduado em Medicina pela Faculdade de Medicina do ABC (FMABC), Graduando em Medicina Veterinária na Faculdade das Américas (FAM).
³Lilian Chama de Melo, Graduanda em Medicina Veterinária na Faculdade das Américas (FAM).
⁴Philipe dos Santos Sampaio, Graduando em Medicina Veterinária na Faculdade das Américas (FAM).
⁵Tania de Oliveira Giaretta, Graduanda em Medicina Veterinária na Faculdade das Américas (FAM).
