REGISTRO DOI: 10.5281/zenodo.11557952
Gillian Dolinski1
Orientador: Prof. Dr. Lair Ribeiro2
RESUMO
Durante a menopausa, a redução da produção hormonal está ligada ao surgimento de diversos sintomas e ao desenvolvimento de patologias. Um exemplo é a relação entre as mudanças hormonais e o aumento do risco de doenças cardiovasculares, alterações significativas nos níveis de glicemia em jejum, colesterol total, triglicerídeos e HDL-c; destacando, ainda, a preocupação com a obesidade. A menopausa, pode ocasionar a perda ou fragilização dos cabelos, osteoporose e complicações relacionadas. A pele também é = afetada pelos hormônios, especialmente os estrógenos, que são responsáveis pela espessura, níveis de hidratação, coloração e regulação da produção de óleo. A função sexual pode se deteriorar à medida que a menopausa avança, tendo como sintomas mais relatados a diminuição do desejo sexual, falta de lubrificação vaginal e dispareunia, uma complicação comum da síndrome geniturinária da menopausa. A síndrome geniturinária resulta da deficiência de estrogênio no trato geniturinário feminino, afetando a vagina, lábios, uretra e bexiga. Outro enfrentamento, que pode surgir, é o risco de câncer de mama, embora a menopausa em si não cause câncer de mama, a idade avançada é um fator de risco significativo. Do mesmo modo, a queda abrupta do estrogênio na menopausa, hormônio essencial para a saúde bucal, desencadeia uma série de desafios para a mulher. Essa mudança hormonal, aliada à predisposição genética, torna o sistema bucal mais suscetível a diversos problemas. A firmeza dos dentes e gengivas, antes garantida pelo estrogênio, fragiliza-se, aumentando o risco de cáries, doenças periodontais e até mesmo perda óssea. Além disso, a diminuição da produção de saliva, também influenciada pelo estrogênio, gera boca seca, sensação de ardência e maior proliferação de bactérias, agravando ainda mais a situação. As evidências atuais apontam diversos benefícios da terapia de reposição hormonal, incluindo a melhora dos sintomas geniturinários, dos distúrbios da função sexual e a redução do risco de doença cardiovascular, além de uma melhor qualidade de vida. Bem-estar e menopausa devem andar paralelamente, assim emerge a fisioterapia como um meio de prevenir e aliviar os sintomas por meio de exercícios de alongamento, fortalecimento muscular com carga, treinamento da musculatura do assoalho pélvico, prevenção ou melhora da incontinência urinária, recuperação da função sexual, conscientização corporal e postural. A menopausa é uma fase natural da vida, e com acompanhamento de profissionais especializados e um plano personalizado, as mulheres podem navegar por essa jornada com mais saúde e qualidade de vida.
Palavras-chave: Menopausa. Sintomas. TRH. Fisioterapia. Saúde Oral.
ABSTRACT
During menopause, the reduction in hormonal production is linked to the emergence of various symptoms and the development of pathologies. An example is the relationship between hormonal changes and increased risk of cardiovascular diseases, significant alterations in fasting blood glucose levels, total cholesterol, triglycerides, and HDL-C; also highlighting concerns regarding obesity. Menopause can lead to hair loss or weakening, osteoporosis, and related complications. The skin is also affected by hormones, especially estrogen, which are responsible for thickness, hydration levels, coloration, and regulation of oil production. Sexual function can deteriorate as menopause advances, with the most reported symptoms being decreased sexual desire, lack of vaginal lubrication, and dyspareunia, a common complication of menopausal genitourinary syndrome. Genitourinary syndrome results from estrogen deficiency in the female genitourinary tract, affecting the vagina, labia, urethra, and bladder. Another challenge that may arise is the risk of breast cancer, although menopause itself does not cause breast cancer, advanced age is a significant risk factor. Similarly, the abrupt decrease in estrogen during menopause, an essential hormone for oral health, triggers a series of challenges for women. This hormonal change, combined with genetic predisposition, makes the oral system more susceptible to various problems. The firmness of the teeth and gums, previously ensured by estrogen, weakens, increasing the risk of cavities, periodontal diseases, and even bone loss. Furthermore, the decrease in saliva production, also influenced by estrogen, leads to dry mouth, a burning sensation, and increased proliferation of bacteria, further aggravating the situation. Current evidence points to several benefits of hormone replacement therapy, including improvement in genitourinary symptoms, sexual dysfunction, and reduction in the risk of cardiovascular disease, as well as a better quality of life. Well-being and menopause should go hand in hand, thus physiotherapy emerges as a means of preventing and alleviating symptoms through stretching exercises, muscle strengthening with resistance, training of the pelvic floor muscles, prevention or improvement of urinary incontinence, restoration of sexual function, body awareness, and postural training. Menopause is a natural phase of life, and with the guidance of specialized professionals and a personalized plan, women can navigate through this journey with better health and quality of life.
Keywords: Menopause. Symptoms. HRT. Physiotherapy. Oral Health.
1. INTRODUÇÃO
A menopausa é o término natural e definitivo da menstruação devido à diminuição dos níveis de estrogênio, não relacionado a uma condição patológica. O termo “menopausa” deriva do grego, com “pausis” significando pausa e “men” referindo-se ao mês. O diagnóstico ocorre quando há ausência de menstruação por doze meses consecutivos, indicando o fim do período reprodutivo e fértil da mulher (MCNEIL, 2021).
Na maioria das mulheres, a menopausa ocorre entre os 45 e 55 anos de idade, com uma idade média, no Brasil, por volta dos 48 anos (APM, 2024). Esse período é marcado por uma série de mudanças hormonais significativas, principalmente a diminuição dos níveis de estrogênio e progesterona, que são produzidos pelos ovários. Com o envelhecimento, as mulheres experimentam uma redução no número de folículos ovarianos devido à atresia e à ovulação (HALL, 2015). Esse processo é acompanhado por um declínio nas células da granulosa do ovário, que anteriormente eram responsáveis pela produção predominante de estradiol e inibina B. Além disso, os níveis do hormônio antimülleriano, outro hormônio secretado pelas células da granulosa do ovário, também diminuem (TANBO, FEDORCSAK, 2021).
Com a redução da inibição exercida pelo estrogênio e pelas inibinas A e B sobre as gonadotrofinas, a produção do hormônio folículo-estimulante (FSH) e do hormônio luteinizante (LH), aumenta. Esse aumento é parte do processo que leva à menopausa. Ademais, a diminuição dos níveis de estrogênio interfere no funcionamento do eixo hipotálamo-hipófise-ovariano (TANBO, FEDORSAK, 2021). Como consequência, pode ocorrer uma falha no desenvolvimento do endométrio, levando a ciclos menstruais irregulares até que a menstruação cesse completamente (TALAULIKAR, 2022).
Machaty, Miller, Zhang (2021) explicam, que, durante a perimenopausa, é comum observar um encurtamento da fase folicular como um dos primeiros sintomas menstruais. Isso resulta em menstruações mais frequentes. Posteriormente, a duração do ciclo menstrual tende a aumentar, os ciclos podem se tornar anovulatórios, ocasionando, em alguns casos, um sangramento uterino anormal durante a perimenopausa. Eventualmente, ocorre a interrupção da menstruação. Também, como os níveis de testosterona não sofrem mudanças significativas no início da menopausa, pode ocorrer um aumento relativo na proporção de testosterona em relação ao estrogênio, levando a sintomas de excesso de andrógenos.
A menopausa pode ser desencadeada por processo natural ou procedimentos cirúrgicos, como a remoção bilateral dos ovários (ooforectomia). Tratamentos para certas condições médicas, como endometriose, quimioterapia, radioterapia e doenças crônicas como HIV-AIDS, ou terapias com agentes antiestrogênicos, também podem levar à menopausa. Este trabalho de revisão se concentrará na menopausa natural (HARLOW et al., 2012).
Embora mais de 78,4% das mulheres, no Brasil, experimentem sintomas da menopausa, as experiências individuais podem variar consideravelmente (APM, 2024), pois, uma série de fatores pode influenciar os processos fisiológicos associados à menopausa. Isso abrange aspectos como dieta, tabagismo, etnia, condições médicas preexistentes, nível de atividade física, histórico socioeconômico, índice de massa corporal e saúde ginecológica geral (TALAULIKAR, 2022).
Para Mangione et al. (2022), além dos sintomas vasomotores comuns, a menopausa pode impactar diversos sistemas do corpo, incluindo o urogenital, psicogênico e cardiovascular. À medida que as mulheres vivem mais, é importante notar que passam aproximadamente 40% de suas vidas nos anos pós-menopausa, o que pode representar mais de 30 anos para a maioria delas.
Além dos sintomas físicos e emocionais, a menopausa também pode estar associada a mudanças no corpo da mulher, como aumento do risco de osteoporose devido à perda de massa óssea, e possivelmente aumento do risco de doenças cardiovasculares devido às mudanças nos níveis de lipídios no sangue (MCNEIL, MERRIAM, 2021).
É importante reconhecer que a menopausa não é uma condição patológica, mas sim uma transição natural na vida de uma mulher. No entanto, os sintomas podem afetar significativamente a qualidade de vida e, é por isso que muitas optam por buscar tratamento para aliviar esses sintomas.
Os profissionais de saúde devem adotar uma abordagem que inclua uma escuta atenta e qualificada, oferecendo cuidados completos e levando em consideração a diversidade das orientações sexuais, além de incentivar a autonomia da mulher. Uma avaliação minuciosa e individualizada é essencial para identificar os fatores subjacentes às dificuldades relatadas, muitas vezes não mencionadas explicitamente, o que pode significar influenciar o resultado das intervenções adotadas (MINISTÉRIO DA SAÚDE, 2008).
Assim, a decisão sobre o melhor curso de tratamento deve ser individualizada e baseada nos sintomas específicos, histórico médico e preferências da paciente. Além do tratamento dos sintomas, é importante que as mulheres passem por avaliações de saúde regulares durante a menopausa, incluindo exames de saúde óssea, cardíaca e ginecológica, para monitorar e gerenciar qualquer risco de saúde associado a essa fase da vida.
2. OBJETIVOS
Objetivo Geral:
– Realizar uma análise da literatura consultando artigos e estudos previamente conduzidos sobre a menopausa e seus sintomas.
Objetivos Específicos:
– Identificar os sintomas mais prevalentes da menopausa;
– Avaliar os fatores de risco associados à ocorrência de sintomas durante a menopausa;
– Investigar as opções de tratamento disponíveis para aliviar os sintomas da menopausa;
– Explorar o impacto psicossocial da menopausa na qualidade de vida das mulheres;
– Analisar as estratégias de prevenção e manejo de complicações de saúde associadas à menopausa;
– Avaliar a eficácia de intervenções, como mudanças no estilo de vida e terapias complementares, no manejo dos sintomas da menopausa;
– Averiguar a importância da fisioterapia em mulheres menopausadas;
– Verificar os problemas de saúde oral que podem ser ocasionados pela menopausa.
3. METODOLOGIA
Trata-se de uma pesquisa de revisão da literatura, de metodologia descritiva, apresentada de modo qualitativo.
A coleta de dados foi realizada por meio de busca eletrônica na National Library of Medicine (PUBMED), na Scientific Electronic Library Online (SCIELO) e na Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS). Para compilar as buscas foram utilizados Descritores em Ciências da Saúde (DeCS): Menopausa, Sintomas, Terapia de Reposição Hormonal, Fisioterapia, Saúde Oral.
Os operadores booleanos OR e AND também foram usados junto com descritores durante a realização da coleta de dados.
Para os critérios de inclusão foram utilizados artigos completos em língua portuguesa e inglesa publicados nos últimos 30 anos, relatos de experiência, estudos de revisão, livros e dissertações disponíveis eletronicamente e que obedeçam à temática supracitada. Referente aos critérios de exclusão estão: pesquisas duplicadas e que não tenham relação com a temática apresentada.
4. REFERENCIAL TEÓRICO
4.1 FISIOLOGIA E REPRODUÇÃO FEMININA
O sistema reprodutivo feminino desempenha várias funções importantes, incluindo a produção de óvulos, a regulação de hormônios sexuais e o suporte ao desenvolvimento dos óvulos fertilizados até que se tornem fetos prontos para o parto (DAS, DETOUNE, 2023). O período reprodutivo de uma mulher começa com a menarca, que é o primeiro ciclo menstrual, e termina com a menopausa, definida como a cessação da menstruação por 12 meses consecutivos. Durante os anos reprodutivos, os óvulos são liberados do ovário em um ciclo regular, com a possibilidade de serem fertilizados pelos espermatozoides masculinos. Esse processo de liberação de óvulos é uma parte normal do ciclo menstrual (RUTH, DAY, HUSSAIN, MARTÍNEZ-MARCHAL et al., 2021).
Como expõem Jensen et al. (2010):
A mulher apresenta, ao longo da vida, diferentes ciclos hormonais que têm início na puberdade – com a menarca – e se estendem até a menopausa, quando termina a ciclicidade. A liberação dos hormônios femininos pelos ovários, sob estímulo hipofisário, determinam os diferentes períodos do ciclo hormonal feminino. O estrogênio e a progesterona são hormônios importantes no ciclo biológico feminino e determinam as características sexuais secundárias, a liberação do óvulo, manutenção da gestação e do comportamento feminino.
Os gametas femininos têm sua origem em células germinativas. Durante o desenvolvimento fetal, as ovogônias passam por divisões celulares rápidas até atingirem cerca de 7 milhões de células germinativas por volta do sétimo mês de gestação. Após esse ponto, o número dessas células diminui rapidamente, com a maioria das oogônias se degenerando, enquanto as que restam, chamadas de oócitos primários, entram na primeira fase da divisão celular meiótica. Essas células entram na prófase I e permanecem em estado de dormência até a menarca (RIMON-DAHARI et al., 2016; MACHATY, MILLER, ZHANG, 2017).
Cada ovócito é cercado por um folículo primordial composto por células da granulosa e da teca. À medida que os folículos primordiais amadurecem, as células da granulosa se multiplicam, formando camadas concêntricas ao redor do ovócito, que por sua vez aumenta drasticamente de tamanho (RIMON-DAHARI et al., 2016). Com o início da menarca, grupos limitados de ovócitos retomam periodicamente a meiose e continuam a se desenvolver. No momento da fertilização, os ovócitos estão na fase de metáfase II. O ovócito se transforma em um óvulo quando expulsa seu segundo corpo polar, e a meiose é reiniciada quando o óvulo é ativado por um espermatozóide (RUTH et al., 2021).
A menarca é o marco do primeiro ciclo menstrual de uma mulher, caracterizado pelo início do sangramento menstrual. Este evento ocorre durante a puberdade e é precedido pelo desenvolvimento das mamas, crescimento de pelos nas axilas e região pubiana, e um aumento repentino na estatura. No início de cada ciclo menstrual, vários folículos primordiais nos ovários femininos iniciam o processo de desenvolvimento. Um desses folículos se torna dominante e continua a crescer, enquanto os outros folículos se tornam atrésicos, interrompendo seu desenvolvimento (CARLSON, SHAW, 2019). O folículo dominante evolui para um folículo de Graaf, onde a meiose I é completada e o óvulo não está mais na prófase I. Durante a ovulação, o folículo de Graaf libera o óvulo do tecido circundante, e o folículo vazio se transforma no corpo lúteo. Se a fertilização não ocorrer, o óvulo é eliminado do útero junto com o revestimento secretora do endométrio, sob a influência da diminuição dos níveis de progesterona, resultando no sangramento menstrual (MACHATY, MILLER, ZHANG, 2017). Caso ocorra fertilização, o óvulo fecundado se fixa na parede do endométrio, sendo que a manutenção desse revestimento é inicialmente assegurada pela progesterona secretada pelo corpo lúteo, até que a placenta assuma essa função (CARLSON, SHAW, 2019).
Figura 1 – Estrutura do ovário e desenvolvimento de folículos
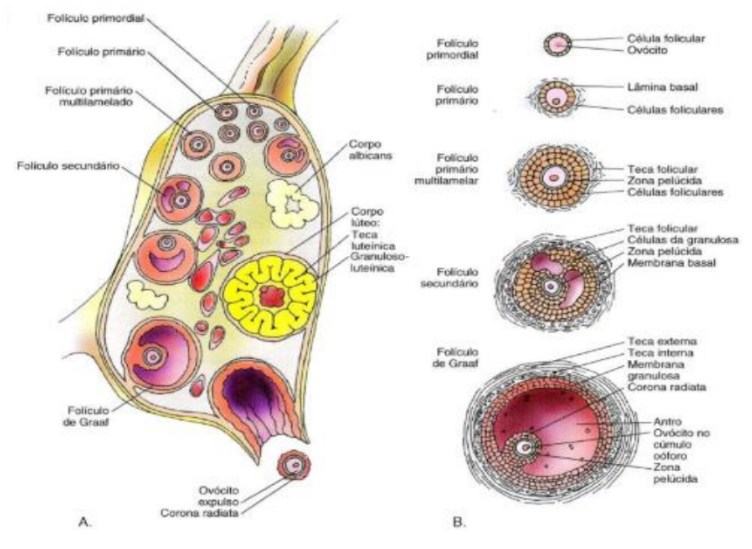
Fonte: Marcuso (2018)
O ciclo menstrual regular se divide em duas fases principais: a folicular e a lútea, com a ovulação acontecendo entre elas. A fase folicular se inicia com a menstruação e termina pouco antes do aumento do hormônio luteinizante (LH). Por outro lado, a fase lútea se inicia com o aumento do LH e termina com o início da menstruação. Um ciclo menstrual típico tem a duração de cerca de 28 dias, sendo a fase lútea com duração de 14 dias, enquanto a fase folicular varia mais em seu curso (KARAPANOU, PAPADIMITRIOU, 2010).
O início da fase folicular é caracterizado por baixos níveis séricos de estradiol e progesterona. A ausência de feedback inibitório permite um aumento nos níveis pulsáteis de GnRH (hormônio liberador de gonadotrofina), o que leva a aumentos nos níveis de FSH (hormônio folicular estimulante) e LH (luteinizante) (MEDEIROS et al., 2007). Esse aumento nos níveis de FSH estimula a maturação folicular, resultando no crescimento contínuo de um número selecionado de folículos (DUDAS, MERCHENTHALER, 2006).
O crescimento desses folículos resulta no aumento dos níveis de FSH e estradiol. No final da fase folicular, o folículo dominante emerge e atinge um tamanho de aproximadamente 20-25 mm. O aumento do estradiol induz o espessamento do endométrio para prepará-lo para a possível implantação de um óvulo fertilizado (ADAMS, TAYLOR, SCHOENFELD, 2004). Quando os níveis de estradiol atingem um ponto crítico, o efeito de feedback negativo do estradiol sobre o LH se converte em um efeito de feedback positivo, desencadeando um aumento significativo na concentração de LH (e um aumento menor nos níveis de FSH). Cerca de 36 horas após o pico de LH, ocorre a liberação do ovócito do folículo dominante, que então segue em direção ao útero através da trompa de Falópio (DUDAS, MERCHENTHALER, 2006).
Kami, Vidigal e Macedo (2017, p. 357) explicam:
Ao longo dos últimos anos as variações desses hormônios sexuais femininos têm sido alvo de muitas pesquisas. Nesse sentido, a literatura reporta que a fisiologia feminina parece ser afetada por alterações hormonais cíclicas decorrentes do ciclo menstrual, no qual estrogênio e progesterona, além da regulação da função reprodutiva, apresentam ações sobre o sistema nervoso central (SNC). Estudos apontam que esses hormônios sexuais podem apresentar influência sobre os neurotransmissores como GABA, serotonina e glutamato, via ação nos receptores de membrana, sendo capazes de influenciar diferentes regiões cerebrais com alteração da percepção sensorial e respostas motoras.
O corpo lúteo, que é o tecido folicular remanescente após a liberação do ovócito, secreta progesterona, o que inibe a liberação de LH e FSH e estimula a formação do endométrio secretor (ADAMS, TAYLOR, SCHOENFELD, 2004). Na ausência de fertilização, a diminuição nos níveis de LH contribui para a queda nos níveis de progesterona e estradiol. No caso de fertilização, quando o ovócito se implanta no endométrio, ele libera gonadotrofina coriônica, que mantém o corpo lúteo e, consequentemente, a produção de progesterona (STOCCO, TELLERIA, GIBORI, 2007). Na Figura 2, um modelo referente ao controle hormonal do ciclo menstrual.
Figura 2 – Controle hormonal do ciclo menstrual
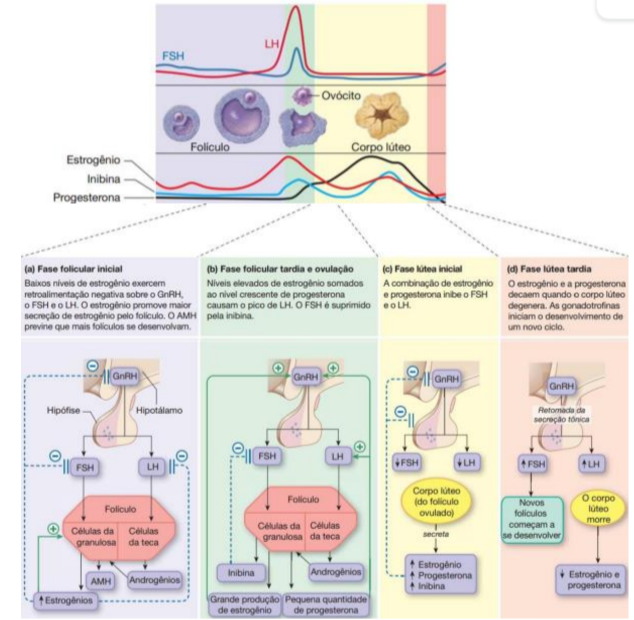
Fonte: Marcuso (2018)
À medida que a mulher envelhece, as aberturas normais ou tubos foliculares do corpo são fechados (atresia), o que reduz o número de gametócitos. Como resultado, na época da menopausa, uma mulher pode ter apenas algumas centenas a alguns milhares de gametócitos restantes. O ovário produz três hormônios: estrogênio, progesterona e andrógenos. Entre os estrogênios, estrona (E1), estradiol (E2) e estriol (E3). De maneira concisa, as ações fisiológicas do estrogênio são (Figura 3):
Figura 3 – Ações fisiológicas do estrogênio
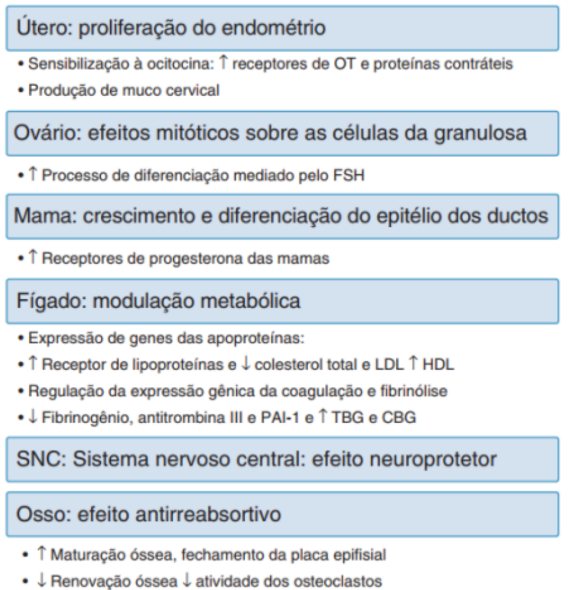
Fonte: FEBRASGO (2010)
Já a progesterona, conforme Taraborrelli (2015), desempenha um papel de suma importância no ciclo menstrual, na reprodução e na biossíntese de hormônios esteróides, figurando como um componente fisiológico de caráter essencial. Adicionalmente, suas intervenções no sistema nervoso central e no sistema imunológico fortalecem a significância da progesterona para a saúde integral do organismo. Uma compreensão aprimorada desse hormônio é fundamental devido às suas vastas implicações clínicas para a saúde humana. A progesterona também exerce uma influência significativa no desenvolvimento da glândula mamária e influencia a função do sistema nervoso central e do sistema cardiovascular.
Os androgênios são um grupo de hormônios esteróides principalmente conhecidos por seu papel no desenvolvimento e função dos órgãos sexuais masculinos. No entanto, eles também desempenham papéis importantes no corpo da mulher, embora em quantidades muito menores em comparação com os homens (ROSATO et al., 2022). Ainda, segundo Rosato et al. (2022), os androgênios mais comuns incluem a testosterona, a dihidrotestosterona (DHT) e a dehidroepiandrosterona (DHEA). Na mulher, os androgênios são produzidos principalmente nas glândulas supra-renais e, em menor quantidade, nos ovários.
Apesar de serem considerados hormônios “masculinos”, os androgênios têm várias funções essenciais no corpo feminino. Abaixo uma adaptação de Labrie (2010) sobre as funções:
1. Desenvolvimento dos órgãos sexuais: Durante a puberdade, os androgênios contribuem para o crescimento e desenvolvimento dos órgãos sexuais femininos, como o clitóris e os lábios menores.
2. Libido e função sexual: Desempenham um papel na libido e na função sexual das mulheres, embora em uma medida menor do que nos homens. Eles influenciam o desejo sexual e a resposta aos estímulos sexuais.
3. Produção de hormônios: São precursores de outros hormônios, como os estrógenos, que desempenham um papel importante no ciclo menstrual e na saúde reprodutiva feminina.
4. Saúde óssea: Em quantidades adequadas, os androgênios também são importantes para a saúde óssea das mulheres. Eles ajudam a manter a densidade óssea e podem ajudar a prevenir a osteoporose.
5. Massa muscular e composição corporal: Os androgênios podem influenciar a composição corporal das mulheres, promovendo o desenvolvimento da massa muscular e ajudando a regular a distribuição de gordura corporal.
4.2 CLIMATÉRIO
O climatério é o período da vida que se inicia com o declínio da atividade ovariana e se estende até o fim da função ovariana. De acordo com essa definição, o período engloba a perimenopausa, a menopausa e o pós-menopausa. Segundo a Organização Mundial da Saúde (OMS), o climatério é descrito como uma etapa biológica da vida, não sendo considerado um processo patológico. Este período engloba a transição entre os estágios reprodutivo e não reprodutivo da mulher, compreendendo a passagem da menacme para a velhice, sendo caracterizado pela redução na produção dos hormônios estrogênio e progesterona pelos ovários. A menopausa, que marca o início deste estágio, é identificada como o último ciclo menstrual reconhecido após um intervalo de doze meses sem menstruação, geralmente ocorrendo entre os 48 e 50 anos de idade (MINISTÉRIO DA SAÚDE, 2008).
Figura 4 – Representação esquemática e descrição das fases do climatério

Fonte: Ministério da Saúde (2008)
Conforme Castro (1999) e Zampiere et al. (2009), à medida que a mulher se aproxima do período climatérico, há um aumento significativo na produção de FSH pelo hipotálamo, impulsionado pela secreção de inibina, um marcador folicular ovariano. Isso pode resultar em uma hiperestimulação folicular, aumentando a probabilidade de ovulações precoces. Consequentemente, os ovários produzem estrogênio de maneira insuficiente para manter a funcionalidade do sistema reprodutivo feminino e dos órgãos sexuais.
Conforme o Ministério da Saúde, o climatério é definido como o período entre os 40 e os 65 anos de idade e é dividido em três fases: pré-menopausa, perimenopausa e pós menopausa. A pré-menopausa geralmente começa após os 40 anos, marcada pelo declínio nos níveis de progesterona e pela diminuição da fertilidade em mulheres que ainda têm ciclos menstruais regulares ou semelhantes aos da vida reprodutiva. A perimenopausa ocorre dois anos antes da última menstruação e continua até um ano após, caracterizada por ciclos menstruais irregulares e alterações endócrinas. Por fim, a pós-menopausa começa um ano após a última menstruação (MINISTÉRIO DA SAÚDE, 2008).
Durante o climatério, as mudanças endócrinas resultantes, principalmente da diminuição da função ovariana, são de grande relevância. Essas alterações incluem a insuficiência do corpo lúteo, que nas fases iniciais leva a irregularidades menstruais. Não apenas a falência ovariana, mas também modificações no hipotálamo e na hipófise contribuem para essas mudanças. À medida que o climatério progride e a menopausa se instala, ocorre uma redução significativa, quase total, nos níveis dos hormônios progesterona, estradiol e inibina, como destacado pela FEBRASGO (2010).
Os sintomas experimentados pelas mulheres durante o climatério não são influenciados apenas pelas mudanças hormonais, mas também por fatores sociais e psicológicos. Além disso, os antecedentes ginecológicos são considerados um fator associado aos sintomas, como destacado por Brasil (2008) e Alves et al. (2021).
A diminuição hormonal durante o período climatérico pode resultar em sintomas metabólicos desconfortáveis ou até mesmo no desenvolvimento de algumas patologias. Essas alterações afetam todos os sistemas do organismo, sendo que um dos primeiros sinais apresentados pela mulher é a irregularidade no ciclo menstrual, que reflete a disfunção ovariana. Os ciclos menstruais podem variar desde sangramentos de baixa intensidade até sangramentos abundantes, ou até mesmo apresentar períodos de amenorreia (SOBRAC, 2004).
Assunção et al. (2017), sublinham que, os sintomas durante o climatério podem ser classificados em curto prazo, destacando-se fogachos e palpitações, e em longo prazo, destacando-se osteoporose e doenças cardiovasculares. É importante ressaltar que durante esse período os sintomas emocionais são comuns e podem causar mais impacto do que os sintomas físicos, afetando diretamente a qualidade de vida e provocando alterações sociais, biológicas e psicológicas. Portanto, as mulheres necessitam de orientação adicional sobre cuidados e a adoção de hábitos saudáveis, incluindo a prática de atividade física, que pode contribuir para o bem-estar físico e melhorar a autoestima feminina.
A menacme marca o início da transição para a menopausa e é caracterizada principalmente pela amenorreia por um período de 3 meses em mulheres com mais de 45 anos de idade, sem alteração na regularidade dos ciclos menstruais anteriores. Por outro lado, a perimenopausa é caracterizada pela amenorreia de 3 a 11 meses em mulheres com mais de 45 anos de idade. Logo, tanto a menacme quanto a perimenopausa são frequentemente marcadas pelas manifestações vasomotoras, como ondas de calor e sudorese, que representam sintomas agudos. A síndrome climatérica pode persistir além do término do climatério, na fase pós-menopausal, na qual predominam sintomas crônicos decorrentes das alterações causadas pelo envelhecimento e pelo déficit hormonal. As principais manifestações nesta fase incluem atrofia urogenital e tegumentar, além da aceleração dos processos de osteoporose e aterosclerose (SANTOS et al., 2017).
4.2.1 Desafios do climatério
Ao contrário da menopausa, um evento específico que define a cessação da menstruação, o climatério se estende por um período mais amplo, geralmente entre os 40 e 55 anos. Durante essa fase, a mulher experimenta uma série de mudanças hormonais, principalmente na produção de estrogênio e progesterona, que podem gerar diversos sintomas físicos e emocionais (PIECHA et al., 2018).
Conforme descrito por Silva et al. (2014), muitas mulheres não estão cientes do período pelo qual estão passando e podem não reconhecer os sinais e sintomas característicos dessa fase da vida. O autor destaca que uma série de fatores influenciam as mudanças físicas, emocionais, psicológicas e ambientais durante o climatério. Esses sintomas têm um impacto significativo na qualidade de vida das mulheres, e a percepção delas sobre si mesmas é um fator determinante na forma como encaram o climatério.
Nos estudos de Piecha et al. (2018) e Silva et al. (2014), foi observado que as mulheres consideram o climatério como o ponto inicial da velhice, e essa transição é frequentemente encarada de forma negativa. Elas podem não estar preparadas para vivenciar essa nova etapa da vida, que traz consigo mudanças corporais e estéticas perceptíveis.
Segundo as autoras, o processo de envelhecimento é uma experiência individual, mas a sociedade impõe às mulheres um padrão de beleza que as torna desconfortáveis com as mudanças na pele, como ressecamento e alterações no cabelo, incluindo mudanças na coloração. Isso pode resultar em uma diminuição da autoestima feminina, afetando também sua qualidade de vida.
Cada mulher vivencia o climatério de forma única, com manifestações de sinais e sintomas variados. Essa experiência pode ser influenciada pelo nível de instrução e pela preparação da mulher para as mudanças corporais que ocorrem durante esse período. Estudos demonstram que muitas mulheres atravessam essa fase em silêncio, pois não reconhecem as alterações que estão ocorrendo, o que contribui para uma percepção negativa do climatério (SILVA, 2015). Vale ressaltar que Santos (2017), concorda com essa perspectiva e observa que a busca por tratamento medicamentoso se torna frequente entre essas mulheres, o que evidencia a falta de informação sobre o climatério. É importante destacar que o climatério não é uma doença, mas sim um período natural pelo qual as mulheres passam.
Os fogachos, ou ondas de calor, acompanhados de sudorese, são mencionados por Piecha et al. (2018) como sintomas presentes em qualquer fase do climatério, causando desconforto e alterações no humor. O autor também observa o surgimento de sintomas como palpitações e cefaleias associadas a esses episódios. Lucena et al. (2014) afirmam que esses sintomas, como os fogachos, são os mais frequentes e característicos durante o climatério, requerendo atenção e apoio dos relacionamentos interpessoais, que desempenham um papel fundamental nessa fase. É importante que a família compreenda esse processo, pois além dos sintomas físicos, como irritabilidade, ansiedade e depressão, também estão presentes. A diminuição do desejo sexual, a diminuição da atividade sexual e da lubrificação natural podem estar relacionados à redução do hormônio estrogênio ou, conforme observado por Piecha et al. (2018), aos sentimentos das mulheres em relação à sua autoimagem e ao processo de envelhecimento.
A existência de uma grande estereotipação feminina na sociedade, na qual envelhecer é associada à perda de vitalidade e saúde. Um aspecto importante relacionado à alteração é a diminuição da libido e da lubrificação vaginal, que são fenômenos fisiológicos. A redução da lubrificação natural causa grande desconforto e é uma das principais causas da dispareunia, levando muitas mulheres, mesmo com libido presente, a optarem por não manter relações sexuais ativas e satisfatórias devido ao desconforto causado pela secura vaginal (FERNANDES et al., 2016).
De acordo com Santos et al. (2017), as transformações individuais de cada mulher durante o climatério estão intimamente ligadas à forma como cada uma vivencia sua sexualidade. Durante essa fase, a sexualidade feminina não depende apenas de fatores biológicos, mas também de aspectos psicológicos e culturais que influenciam a maneira como cada mulher compreende e vivencia o período climatérico.
Fernandes et al. (2015) destacam o ganho de peso associado ao processo de envelhecimento, o qual impacta a autoestima e a qualidade de vida da mulher durante o climatério. Em seu estudo, os autores ressaltam que o aumento ponderal pode chegar a até 20% da gordura corporal, o que está relacionado às mudanças hormonais que ocorrem no organismo e resultam em alterações na distribuição de gordura corporal. Esse aumento de peso também está associado ao risco de doenças cardiovasculares, osteoporose e outros problemas de saúde, podendo acarretar também desafios psicossociais, que afetam diretamente os relacionamentos. Santos et al. (2017) afirmam que para promover uma transição saudável e com bem-estar durante essa fase, é essencial adotar uma alimentação equilibrada, praticar exercícios físicos e receber acompanhamento de uma equipe multidisciplinar.
Em suma, o climatério é uma fase de mudanças e desafios para a mulher, mas também pode ser um momento de crescimento pessoal e autodescoberta. Com o apoio adequado e o manejo eficaz dos sintomas, muitas mulheres atravessam essa fase com saúde e bem-estar.
4.3 A BASE BIOLÓGICA DA MENOPAUSA
A menopausa é um processo natural e inevitável que ocorre no envelhecimento feminino, caracterizado pelo fim da capacidade reprodutiva devido à cessação da função ovariana. Este fenômeno é acompanhado por uma redução na produção periférica e cerebral de hormônios sexuais, como estrogênio e progesterona (NELSON, 2008; DAVIS et al., 2015). Estes hormônios desempenham um papel fundamental na regulação da função metabólica e interagem com diversos neurotransmissores, incluindo serotonina, dopamina, ácido λ-aminobutírico e glutamato (BARTH, VILLRINGER, SACHER, 2015). As concentrações reduzidas desses hormônios durante a menopausa têm sido correlacionadas ao surgimento de doenças específicas. Além disso, as mudanças hormonais durante este período estão implicadas nas disparidades sexuais observadas em distúrbios cerebrais que se manifestam em idosos (NELSON, 2008).
De acordo com Muka et al. (2016, p. 6), a menopausa pode se manifestar de diferentes formas, dependendo da causa e/ou momento em que ocorre o fim da menstruação:
Menopausa natural: ocorre quando a atividade dos ovários da mulher diminui gradualmente, levando ao fim da menstruação. Para a maioria das mulheres, isso acontece entre os 45 e 55 anos de idade. À medida que os ovários reduzem a produção dos hormônios estrogênio, progesterona e testosterona, o corpo reage e se ajusta a essas mudanças.
Menopausa prematura ou precoce: a menopausa prematura se refere à interrupção da menstruação antes dos 40 anos de idade, enquanto a menopausa precoce ocorre antes dos 45 anos. Essas condições podem ser influenciadas por diversos fatores, como consumo de álcool, distúrbios endócrinos, quimioterapia, defeitos cromossômicos, doenças autoimunes e distúrbios da tireoide.
Menopausa cirúrgica ou induzida: Às vezes, a menopausa pode ser induzida por ações deliberadas, como cirurgia ou medicamentos que afetam os ovários. Uma histerectomia ou outra intervenção cirúrgica que remova ou danifique os ovários resultará em uma menopausa abrupta. Geralmente, as mulheres podem prever esse tipo de menopausa e planejar com antecedência o tratamento dos sintomas repentinos que surgem. Uma histerectomia que remove apenas o útero pode não afetar os ovários e, portanto, não resultará em menopausa; a menopausa cirúrgica ocorre somente quando os ovários também são removidos. A quimioterapia ou a radiação durante o tratamento do câncer podem induzir o fechamento dos ovários, levando a uma menopausa temporária.
Durante a menopausa, a diminuição na produção hormonal está associada a um aumento na ocorrência de sintomas vasomotores, tais como ondas de calor, secura vaginal, osteoporose, declínio cognitivo, irritabilidade, ansiedade e distúrbios de humor (MAKI, 2007; ROSANO et al., 2017). Quando a menopausa é desencadeada por procedimentos cirúrgicos, os sintomas adversos podem ser mais intensos em comparação com a menopausa natural. As mudanças que ocorrem durante a menopausa são influenciadas por fatores genéticos, nutricionais, socioculturais e demográficos, resultando em impactos diferenciados na qualidade de vida das mulheres que estão passando por essa fase (TUCKER et al., 2016).
Lui Filho et al. (2015), apontam que recentes dados têm correlacionado a idade em que ocorre a menopausa com as taxas de mortalidade. Mulheres que entram na menopausa em uma idade mais precoce tendem a apresentar uma taxa de mortalidade mais alta por várias causas, incluindo doenças cardiovasculares. Por outro lado, aquelas que experimentam a menopausa em uma idade mais avançada mostram uma maior taxa de mortalidade devido a certos tipos de câncer ginecológico que são hormônio-dependentes.
A análise dos fatores ligados à idade em que ocorre a menopausa possui diversas implicações tanto clínicas quanto epidemiológicas. A menopausa tardia está relacionada a um menor risco de osteoporose e doenças cardiovasculares, porém está associada a uma maior frequência de câncer de mama, ovário e endométrio. Além disso, mulheres na faixa dos 40 anos frequentemente desejam entender quando irão passar pela menopausa, quais características podem predispor a uma menopausa mais precoce e se circunstâncias ou estilo de vida podem influenciar esse período (PEDRO et al., 2003).
Vários estudos têm indicado que o tabagismo, baixo nível socioeconômico e baixo peso corporal estão ligados à menopausa precoce. Por outro lado, fatores que resultam em menos ciclos ovulatórios ao longo da vida reprodutiva, como ter filhos, usar contraceptivos hormonais e ter ciclos menstruais sem ovulação, tendem a adiar a idade em que a menopausa ocorre. Portanto, compreender os fatores relacionados à idade em que ocorre a menopausa pode fornecer insights sobre essas associações e sugerir medidas preventivas.
Além disso, os fatores que influenciam a idade da menopausa podem variar em diferentes populações devido às características distintas (LUI FILHO et al., 2015).
4.3.1 O Risco de doença cardiovascular na menopausa
Como já colocado, durante a menopausa, a mudança fisiológica mais marcante é a diminuição dos níveis de estrogênio endógeno e a consequente interrupção da função ovariana. O estrogênio desempenha um papel protetor no coração, e sua diminuição pode aumentar o risco de doenças cardiovasculares (DCV) em mulheres após a menopausa (BACHMANN, 2001). A idade em que ocorre a menopausa (seja natural ou cirúrgica) é uma variável importante na relação entre o tipo de menopausa e o desenvolvimento de doenças cardiovasculares (DCV).
A menopausa precoce tem sido associada a um aumento do risco de mortalidade por DCV (MUKA et al., 2016). Há evidências de que a histerectomia em mulheres com 50 anos ou menos aumenta o risco de doenças cardiovasculares mais tarde na vida, e a menopausa cirúrgica pode amplificar ainda mais o risco de doença cardíaca coronária e acidente vascular cerebral. Isso sugere que pode haver uma interação entre o tipo e a idade da menopausa no risco de desenvolvimento de DCV (COLPANI et al., 2018).
Alencar et al. (2021, p. 1192) analisam que:
À medida que as mulheres envelhecem, ocorrem mudanças no perfil metabólico que afetam a composição e distribuição do tecido adiposo, contribuindo para o aumento de peso e o desenvolvimento de processos ateroscleróticos. Vários fatores de risco estão associados às doenças cardiovasculares, incluindo idade, obesidade, tabagismo, hipertensão arterial, dislipidemia, diabetes, histórico familiar, estresse e falta de atividade física. A exposição a esses fatores de risco cardiovasculares pode levar à disfunção endotelial.
Lakatta (2003) acentua que o envelhecimento vascular, caracterizado por disfunção endotelial e enrijecimento de grandes artérias elásticas, é um importante fator de risco para o desenvolvimento de DCV. Nas mulheres, as mudanças significativas no ambiente hormonal durante a transição da menopausa estão associadas a alterações adversas nos fatores de risco de doenças cardiovasculares (DCV), como pressão arterial elevada, perfil lipídico desfavorável, aumento da gordura abdominal e resistência à insulina. Para Alpert et al. (2018), essa combinação de fatores pode contribuir para a aceleração do envelhecimento vascular desde o final da perimenopausa até a pós-menopausa.
Várias explicações podem ser propostas para as associações observadas entre os sintomas da menopausa e o envelhecimento vascular. O estrogênio desempenha um papel importante na regulação da síntese e captação da serotonina, que tem efeitos neuromoduladores, termorreguladores e cardiovasculares. Durante a transição da menopausa, os níveis de estrogênio flutuam e diminuem, o que pode afetar a atividade da serotonina (IANCU et al., 2014).
Em estudo realizado por Melo et al. (2018), com o objetivo de identificar fatores de risco cardiovasculares entre as mulheres climatéricas com e sem doença arterial coronariana (DAC), concluiu-se que, a hipertensão arterial sistêmica (HAS) é mais comum em mulheres na fase inicial da pós-menopausa. Além disso, o sedentarismo foi relatado como um comportamento predominante entre as mulheres estudadas. A prática regular de atividade física tem sido associada a efeitos benéficos no sistema cardiovascular, incluindo a preservação da função endotelial e a biodisponibilidade do óxido nítrico, contribuindo para um envelhecimento mais saudável. Também, o exercício físico pode ajudar a reduzir o risco de desenvolver diabetes mellitus (DM) e hipertensão. Mulheres diabéticas têm um risco significativamente maior de doença arterial coronariana em comparação com aquelas que não têm diabetes.
Foi observado que mulheres com doença arterial coronariana (DAC) apresentaram alterações significativas nos níveis de glicemia em jejum, colesterol total, triglicerídeos e HDL-c. No entanto, a média dos níveis de LDL-c permaneceu dentro da faixa considerada normal. A menopausa em si parece contribuir para o aumento do colesterol total, LDL-c e triglicerídeos, o que é observado com o avanço da idade, especialmente em mulheres. Isso ressalta a importância do LDL-c como um fator de risco cardiovascular (MELO et al., 2018). As mulheres na pós-menopausa têm uma tendência ao ganho de peso e são suscetíveis a alterações no metabolismo lipídico. Essas mudanças podem estar relacionadas à redução dos níveis de estrogênio, o que pode resultar em aumento dos níveis de colesterol total, lipoproteínas e triglicerídeos. Isso contribui para um perfil lipídico altamente favorável ao desenvolvimento de aterosclerose, especialmente quando associado a diabetes mellitus e hipertensão (KLEIN et al., 2004).
Para Castelo-Branco et al. (2006), Esses fatores aumentam o estresse oxidativo comprometendo as células endoteliais, este comprometimento inicial é apenas funcional, decorrente do processo inflamatório local; com o passar do tempo, vão acontecendo alterações estruturais nos vasos, e essas lesões facilitarão os fenômenos tromboembólicos apresentados clinicamente como infarto do miocárdio, acidente vascular cerebral e outros eventos isquêmicos.
O acúmulo de gordura abdominal é reconhecido como um importante fator de risco cardiovascular, muitas vezes mais relevante do que a quantidade total de gordura corporal. Isso se deve à maior produção de citocinas pela gordura visceral em comparação com a gordura periférica. A obesidade pode estar associada independentemente à disfunção endotelial, tanto em pacientes com angiografia coronariana normal quanto naqueles com doença arterial coronariana leve (MELO et al., 2018).
Vargas et al. (2021) asseveram que, a deficiência de estrogênio, embora muitas vezes subestimada, representa um ciclo importante na vida das mulheres, com alterações significativas nos sinais e sintomas da menopausa relacionados às doenças cardiovasculares. Como as doenças cardíacas podem ter um impacto profundo na qualidade de vida, é crucial que políticas públicas dediquem atenção especial a essa questão, visando prevenir o surgimento e atenuar o agravamento dessas condições.
É fundamental que as mulheres estejam atentas às mudanças que ocorrem durante o climatério/menopausa, pois isso pode contribuir significativamente para a prevenção de diversos sintomas associados. Além disso, ao reduzir os riscos de doenças cardiovasculares, garante-se uma melhor qualidade de vida para as mulheres à medida que envelhecem, promovendo assim um cuidado mais abrangente com a saúde feminina (VARGAS et al., 2021).
Estudos clínicos e epidemiológicos têm evidenciado que mulheres na pós menopausa, especialmente aquelas com obesidade abdominal (avaliada pela circunferência da cintura), apresentam um risco maior de desenvolverem insuficiência cardíaca, em comparação com homens ou mulheres sem obesidade abdominal. Essa análise examina dados clínicos que sustentam a existência de uma conexão mecanicista entre a perda de estrogênio e a obesidade. Além disso, são discutidos os possíveis mecanismos celulares e moleculares pelos quais o estrogênio pode exercer uma proteção contra diferentes tipos celulares, depósitos de tecido adiposo e funções negativas de adipócitos, que podem contribuir para o desenvolvimento da Disfunção Diastólica do Ventrículo Esquerdo (DDFVE) e da Insuficiência Cardíaca com Fração de Ejeção Preservada ICFEP (ALENCAR et al., 2021).
A seguir, na Figura 5, o diagrama esquemático ilustrando a interação entre a perda de estrogênio e a obesidade na insuficiência cardíaca. Após a menopausa, ocorre uma redistribuição da gordura do tipo subcutâneo para o visceral em mulheres. A obesidade abdominal, identificada pelo aumento da circunferência da cintura, é um importante fator de risco para o desenvolvimento de ICFEP, possivelmente relacionado a um aumento na síntese e liberação de adipocinas, as quais desempenham papéis cruciais na inflamação cardíaca, estresse oxidativo e disfunção metabólica. Por outro lado, a produção de adiponectina pelos adipócitos brancos, que tem efeitos benéficos na sensibilidade à insulina e na função cardiovascular, é notavelmente reduzida em indivíduos obesos. Anormalidades nas adipocinas, juntamente com a perda de estrogênio, podem contribuir para o desenvolvimento de ICFEP, promovendo inflamação cardíaca, estresse oxidativo e levando à hipertrofia cardíaca concêntrica, remodelação, rigidez e disfunção diastólica (ALENCAR et al., 2021).
Figura 5 – Diagrama sobre a perda de estrogênio, obesidade e doença cardíaca.
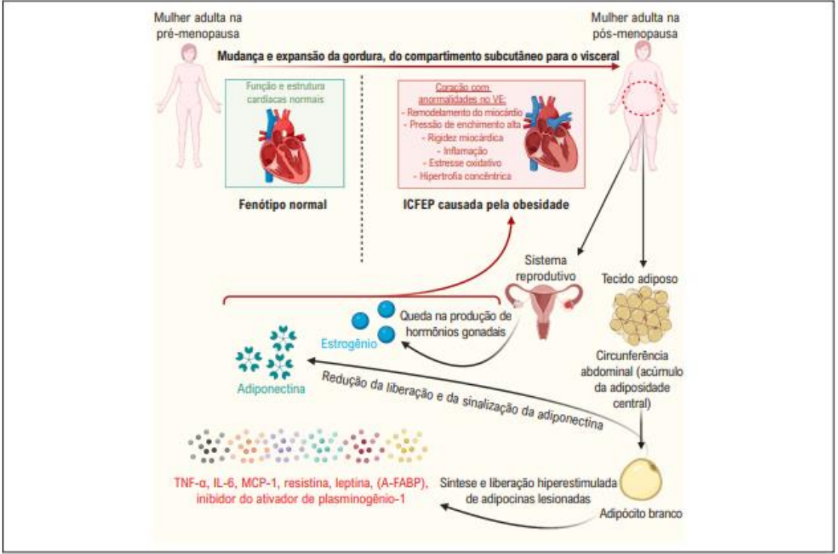
Fonte: Alencar et al. (2021)
Em síntese, de acordo com Brown e Clegg (2010), com a chegada da menopausa, a diminuição dos níveis de estrogênio resulta na desativação dos receptores de estrogênio na gordura subcutânea, ao passo que os receptores de andrógenos na gordura visceral tornam se relativamente mais ativos. Isso contribui para a relação inversa entre os níveis de estrogênio e a quantidade de gordura visceral.
Como exposto, o risco de doenças vasculares na menopausa pode crescer devido ao aumento de peso e obesidade, a seguir discorre-se sobre esse fator, que é bastante preocupante, tanto pelos médicos, quanto pelas mulheres menopausadas.
4.3.2 Os mecanismos da obesidade na menopausa
A menopausa frequentemente suscita inúmeras inquietações entre as mulheres, sendo uma das mais significativas o temor do aumento de peso. É amplamente reconhecido que a obesidade e a síndrome metabólica ocorrem com uma frequência três vezes maior em mulheres durante este estágio da vida do que antes da menopausa (KWAŚNIEWSKA et al., 2012).
A obesidade emerge como uma das preocupações mais destacadas ligadas à menopausa, transcendendo suas ramificações médicas para abraçar também implicações sociais e econômicas significativas. Durante o climatério, as mulheres podem experimentar um aumento de peso de aproximadamente 0,8 kg por ano, e após a menopausa, observa-se um aumento de 20% na gordura corporal. Além disso, ocorre uma mudança no padrão de distribuição da gordura corporal, com o perfil androide, caracterizado pelo acúmulo de gordura visceral, tornando-se mais prevalente do que o perfil ginoide, que é dominante durante o período reprodutivo da mulher (LORENZI et al., 2005).
Paiva (2014) apud Oliveira e Reis (2019):
A obesidade perimenopausal parece contribuir com o aumento do risco de morbimortalidade em mulheres nesse período, destacando-se doenças cardiovasculares. O índice de massa corporal feminino tem aumento de seus valores entre 50 e 59 anos, período que coincide com a menopausa. Supõe-se que a maior tendência de ganho de peso entre as mulheres climatéricas pode estar relacionada À baixa concentração de estrogênio característica desta fase. Além disso mulheres nessa fase podem apresentar modificação Na distribuição de gordura corporal, corroborando com os achados de que há acúmulo de gordura central entre as mulheres no climatério e menopausa. Também com a menopausa há a diminuição da lipólise abdominal havendo consequentemente maior acúmulo de gordura nesta região.
A incidência de obesidade entre mulheres de 55 a 64 anos é o dobro daquela observada em mulheres de 18 a 24 anos, e altas taxas de sobrepeso (33,6%) e obesidade (30,1%) foram registradas entre mulheres no climatério, resultados que confirmam os dados sobre ganho de peso (LORENZI et al., 2005). Além disso, sugere-se que o Índice de Massa Corporal (IMC) feminino atinge seus valores mais elevados entre os 50 e 59 anos de idade, coincidindo com a transição para a menopausa. Estudos com mulheres na pós-menopausa revelaram uma prevalência de excesso de peso (sobrepeso e obesidade) acima de 69% (BRASIL, 2016).
No Brasil, estudos com mulheres de 50 anos ou mais revelaram uma variedade de prevalências de excesso de peso, variando entre 35,2% e 76,3% (SILVA, ROCHA, CALDEIRA, 2018). Em outras pesquisas, foi observado que mulheres durante o climatério apresentaram prevalências de excesso de peso de 63,9% e 74,2% (FRANÇA et al., 2018).
Os mecanismos subjacentes ao aumento do peso corporal, frequentemente manifestado como obesidade central, durante a menopausa ainda não estão completamente compreendidos. Embora a queda abrupta nos níveis de estrogênio parece ser uma causa evidente, é importante considerar também a influência dos fatores ambientais. As principais causas das mudanças na composição corporal associadas à menopausa estão resumidas na Figura 6.
Figura 6 – Principais causas das mudanças na composição corporal associadas à menopausa.
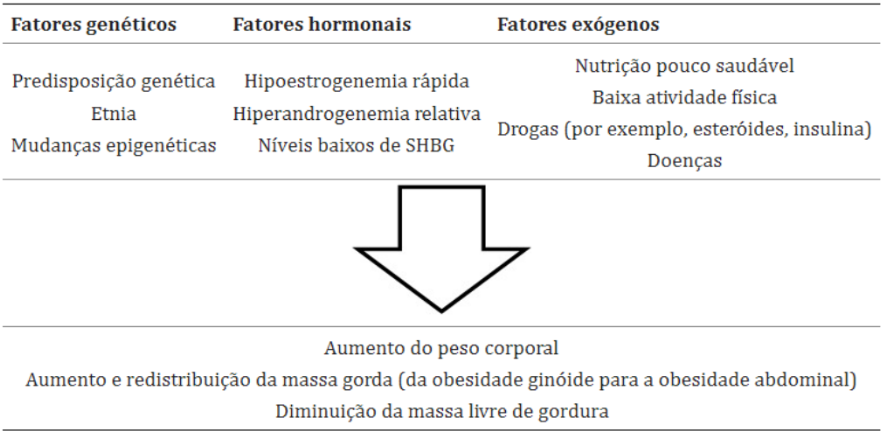
Fonte: Kozakowski et al. (2017)
Kozakowski et al. (2017), explicam que, os estrogênios nas mulheres desempenham um papel crucial no acúmulo de gordura no tecido subcutâneo, especialmente nas regiões glútea e femoral. Para exercer seu efeito biológico, os estrogênios se ligam a receptores pertencentes à família dos receptores nucleares. Esses receptores, denominados ERα e ERβ, são, na verdade, fatores de transcrição que regulam a expressão de genes-alvo. Além da ação genômica, acredita-se que os estrogênios também possam exercer efeitos por meio de um mecanismo não genômico, que depende da ativação de receptores específicos localizados na membrana celular. Além disso, outros hormônios sexuais, como os andrógenos, têm sido associados ao acúmulo de gordura abdominal.
Assim, a transição para a menopausa desencadeia o desenvolvimento da obesidade, acompanhado pela redistribuição da gordura de uma localização metabolicamente favorável (ginoide) para uma menos favorável (abdominal). Esse fenômeno é impulsionado pela relativa hiperandrogenemia em um contexto de deficiência de estrogênios. Além disso, a redução da produção hepática de globulina ligadora de hormônios sexuais contribui para aumentar a biodisponibilidade de andrógenos, intensificando ainda mais esse processo (DONATO et al., 2006).
Devido à aromatização da testosterona e androstenediona em estrona (E1), estradiol (E2) e estriol (E3), os níveis desses hormônios são mais elevados em mulheres obesas na pós-menopausa do que em indivíduos não obesos. Como resultado, a massa de gordura visceral aumenta em cerca de 44% durante a menopausa, enquanto a massa de gordura ginoide aumenta aproximadamente 32% (PANOTOPOULOS et al., 2007). Os estrogênios produzidos pela aromatase não estão associados à proteção da sensibilidade à insulina e das doenças cardiovasculares. Em vez disso, há um aumento do risco de diabetes tipo 2, hipertensão e dislipidemia, juntamente com uma maior incidência de doenças cardiovasculares em mulheres após a menopausa (KOZAKOWSKI et al., 2017).
4.3.2.1 Metabolismo do tecido adiposo e a influência dos hormônios sexuais
A ativação do receptor ERα no tecido adiposo modula a atividade metabólica dos adipócitos. De maneira geral, os receptores ERα desempenham um papel crucial nos efeitos benéficos dos estrogênios na distribuição do tecido adiposo, no metabolismo da glicose e na resposta inflamatória (LUGLIO, 2014). Contudo, o metabolismo do tecido adiposo é predominantemente regulado pelo sistema adrenérgico. A ativação dos receptores adrenérgicos do tipo β estimula a lipólise, enquanto a estimulação dos receptores α2A resulta em ação antilipolítica, contribuindo para o armazenamento de gordura. Estudos mostraram que o estradiol aumenta a expressão dos receptores α2A no tecido adiposo subcutâneo em mulheres, sem afetar esses receptores na gordura visceral (PEDERSEN et al., 2004).
Por outro lado, observou-se que a ativação dos receptores ERα pode estimular os receptores adrenérgicos β no tecido visceral, o que intensifica a lipólise, resultando na redução da massa gorda abdominal. Além disso, os estrogênios promovem a oxidação da gordura nos músculos esqueléticos e inibem a lipogênese tanto no fígado quanto nos músculos (FORYST-LUDWIG, KINTSCHER, 2010). Consequentemente, é razoável prever que a diminuição dos níveis de estrogênio durante a menopausa possa levar a um aumento na quantidade de gordura visceral. Por sua vez, a obesidade abdominal desempenha um papel fundamental na origem da resistência à insulina e da síndrome metabólica. A gordura visceral é vista como um possível elo entre o estágio da menopausa e o grau de resistência à insulina (KOZAKOWSKI et al., 2017).
Entretanto, essa ligação ainda não está totalmente compreendida. Em certos estudos, foi observada uma falta de efeito direto da menopausa no desenvolvimento da resistência à insulina (DAVIS et al., 2012). Por outro lado, diversos autores destacaram essa relação, embora muitas vezes os grupos de estudo não tenham sido devidamente comparados em termos de IMC ou circunferência da cintura (KALYANI et al., 2009). A questão da sensibilidade à insulina em mulheres após a menopausa é de extrema importância, visto que os distúrbios metabólicos mais graves, como elevação da glicose pós-prandial, hipertrigliceridemia, níveis aumentados de proteína C reativa e interleucina 6 (IL-6), além de baixos níveis de Apo A1 e colesterol HDL, são comumente observados em mulheres após a menopausa que apresentam obesidade abdominal e resistência à insulina (PICHÉ et al., 2005).
A associação entre o nível de obesidade visceral e a resistência à insulina é influenciada não apenas pelos estrogênios, mas também pelos níveis de outros hormônios sexuais. Especificamente, a testosterona livre pode induzir resistência à insulina tanto diretamente como indiretamente, ao promover o aumento da obesidade abdominal (SUTTON-TYRRELL et al., 2005). Os baixos níveis de SHBG também desempenham um papel significativo no desenvolvimento da resistência à insulina em mulheres após a menopausa. Por outro lado, a elevação dos níveis de insulina estimula a produção de andrógenos através da ativação do citocromo P450c17α, uma enzima crucial na biossíntese de andrógenos ovarianos (KOZAKOWSKI et al., 2017).
Barros et al. (2009), apontam que as gonadotrofinas elevadas durante a menopausa representam outro fator crucial que influencia os mecanismos de estimulação da síntese de andrógenos. No entanto, estudos demonstraram que a administração de estrogênios a animais após a ovariectomia normaliza o peso corporal, que havia aumentado como resultado da remoção das gônadas, e restaura a sensibilidade à insulina, mas somente na presença de ERα. Isso reforça o papel fundamental dos estrogênios na regulação do equilíbrio energético.
Os efeitos clinicamente significativos e mensuráveis da ação dos hormônios sexuais no metabolismo da gordura corporal incluem seu impacto nos níveis de lipídios sanguíneos. Em mulheres após a menopausa, os estrogênios ajudam a manter um perfil lipídico favorável, enquanto o aumento dos níveis de andrógenos têm um efeito aterogênico (SHELLEY et al., 2008).
4.3.2.2 Impacto dos estrogênios no apetite
O sistema nervoso central (SNC), especialmente no hipotálamo, desempenha um papel contínuo no controle do apetite e do equilíbrio energético. Nessa área, encontram-se núcleos como os arqueados, ventromediais e paraventriculares. A ativação de neurônios específicos nessas regiões pode gerar efeitos orexígenos ou anorexígenos, ou seja, estimular ou reduzir o apetite. Na região hipotalâmica, ocorre a expressão de ambos os tipos de receptores de estrogênio, especialmente o ERα. A ativação do ERα nos neurônios hipotalâmicos produtores de proopiomelanocortina (POMC) inibe o apetite em animais de experimentação (NESTOR et al., 2014).
Na presença de estrogênios, a expressão do neuropeptídeo Y (NPY), um peptídeo orexígeno produzido no hipotálamo, é inibida (REBOUÇAS, LEAL, SÁ, 2016). Além disso, os estrogênios reduzem a atividade da grelina, o peptídeo orexígeno mais potente, predominantemente originado do estômago, mas também produzido localmente no hipotálamo (DAFOPOULOS et al., 2010). Assim, de forma geral, os estrogênios desempenham um papel na regulação central do equilíbrio energético, agindo no sistema nervoso central para diminuir o apetite. Pode-se presumir que a rápida diminuição dos níveis desses hormônios contribuiria significativamente para o aumento do apetite (KOZAKOWSKI et al., 2017).
Ainda segundo os autores, o aumento de peso durante a menopausa é comum e amplamente atribuído às mudanças hormonais que ocorrem nesse período. No entanto, é importante considerar também outros fatores que podem contribuir para esse fenômeno. Estes incluem influências genéticas e ambientais, tais como mudanças no estilo de vida (como uma dieta pouco saudável e falta de atividade física), condições médicas preexistentes (como a doença de Cushing e o hipotiroidismo), uso de certos medicamentos (como corticosteroides, insulina e glitazonas), bem como outros fatores ainda não identificados (KOZAKOWSKI et al., 2017).
Dessa forma, é plausível que a reposição hormonal possa ajudar a prevenir o ganho de peso e normalizar distúrbios metabólicos. De fato, há várias evidências indicando que a terapia de reposição hormonal pode reduzir a obesidade, diminuir a gordura abdominal (rearranjando a distribuição de gordura corporal), baixar os níveis de glicose e insulina em jejum, melhorar o perfil lipídico no sangue e, como resultado, reduzir o risco de doenças cardiovasculares (GRODSTEIN et al., 2000; SCHIERBECK et al., 2012).
A vida após a menopausa pode ser um período dedicado ao desenvolvimento dos próprios interesses, à prática de atividades físicas, à reflexão sobre o estilo de vida e à adoção de comportamentos saudáveis. Certamente, eventos como doenças cardiovasculares, hipertensão, diabetes, hiperlipidemia, risco de câncer de mama, osteoporose ou incontinência urinária estão fortemente relacionados ao peso corporal, à nutrição, à atividade física e às escolhas de estilo de vida. Mulheres que seguem uma dieta hipercalórica, rica em gordura, e que inclui álcool, mas é pobre em fibras e micronutrientes, durante um período de 12 anos, têm um aumento de 3-4 vezes no risco de desenvolver obesidade abdominal e síndrome metabólica (MILLEN et al., 2006). Por outro lado, uma dieta de restrição calórica, que exclui fast food e carboidratos, mas é rica em peixes marinhos, produtos dietéticos, frutas e vegetais, oferece proteção contra a obesidade e distúrbios metabólicos (NEUHOUSER et al., 2012).
Em relação a isto, o Manual de Atenção à Mulher no Climatério/Menopausa aponta:
A promoção da alimentação saudável e a manutenção do peso adequado são fundamentais para promover a saúde e o bem-estar durante toda a vida da mulher, principalmente no período do climatério. A alimentação equilibrada é importante para manter todas as funções do organismo em boas condições. Esta é uma fase em que o crescimento e o desenvolvimento orgânico já se efetivaram e a alimentação estimulará e manterá o funcionamento adequado dos diversos órgãos e sistemas. Vale ressaltar que o consumo inadequado de alimentos pode contribuir para agravos, como a osteoporose, e o consumo em excesso podem comprometer a saúde com o surgimento da obesidade que, além de ser uma doença crônica, pode aumentar os riscos para o desenvolvimento de hipertensão arterial, Diabetes mellitus e outras. Estas doenças constituem algumas das principais causas de morbimortalidade na população adulta brasileira (MINISTÉRIO DA SAÚDE, 2008, p. 48).
Kozakowski et al. (2017), expõem que, as diretrizes das sociedades científicas sobre o estilo de vida durante a menopausa destacam a importância de combinar uma dieta saudável com exercícios físicos. A falta de atividade física durante esse período pode acelerar o processo de envelhecimento e aumentar o risco de doenças cardiovasculares e osteoporose. A adoção de hábitos de exercício em conjunto com uma dieta adequada ajuda a promover uma maior perda de peso. Estudos demonstraram que mulheres na menopausa que adotam comportamentos que incluem uma alimentação saudável e atividade física mais intensa conseguem reduzir efetivamente o peso corporal, principalmente a gordura corporal, enquanto mantêm a massa isenta de gordura e até mesmo aumentam a massa óssea.
4.3.3 Osteoporose primária e a menopausa
A osteoporose é uma condição multifatorial que afeta o esqueleto, caracterizada pela diminuição da densidade mineral óssea (DMO) e pela deterioração da microarquitetura do tecido ósseo, resultando em fragilidade óssea. Segundo os padrões da OMS, a osteoporose é caracterizada por um T-score igual ou inferior a -2,5, enquanto a osteopenia é definida por um T-score entre -1,0 e -2,5. As áreas preferenciais de avaliação incluem o colo do fêmur e a coluna lombar (SANDHU, HAMPSON, 2011). A DMO diminui com a idade, levando à prevalência mais alta de osteoporose primária em mulheres cerca de 10-15 anos após a menopausa e em homens idosos, geralmente em torno dos 75-80 anos de idade. Com o aumento da expectativa de vida da população, a osteoporose e as fraturas relacionadas a ela estão se tornando rapidamente questões de saúde pública significativas, representando um ônus econômico considerável para os recursos dos serviços de saúde (KANIS et al., 2004).
É importante atingir o máximo de massa óssea para garantir uma boa saúde dos ossos e desempenhar um papel fundamental na prevenção da osteoporose e das fraturas que podem ocorrer mais tarde na vida. Estudos mostram que um aumento de 10% no pico de massa óssea poderia reduzir as fraturas de quadril em até 30% (SANDHU, HAMPSON, 2011). O aumento da massa óssea começa na infância e continua ao longo da idade adulta, alcançando o auge em torno dos 20 anos para a coluna e o quadril, enquanto outros ossos, como o rádio, atingem o pico por volta dos 40 anos. Após esse período, é comum ocorrer uma diminuição na massa óssea. Aos 70 anos, a massa óssea geralmente diminui em torno de 30-40% (STYRKARSDOTTIR et al. 2009).
De acordo com Nunes et al. (2022, p. 832):
O pico de massa óssea (PMO) é um importante determinante da saúde óssea na vida adulta. Um aumento no PMO no valor de 10% pode reduzir o risco de fraturas osteoporóticas durante a vida adulta em 50%. A infância, a adolescência e o início da idade adulta são marcados por um acúmulo contínuo de massa óssea. Esse acúmulo é mais intenso nos dois primeiros anos de vida e, posteriormente, na adolescência, sendo que o PMO ocorre no começo da terceira década de vida, em torno dos 25 anos de idade.
Styrkarsdottir et al (2009) acordam, que o pico de massa óssea é principalmente influenciado por fatores genéticos. Diversas variantes genéticas relacionadas à massa óssea foram identificadas em estudos, como as relacionadas à proteína 5 associada ao receptor de lipoproteína de baixa densidade (LRP5), osteoprotegerina (OPG), esclerostina (SOST), receptor de estrogênio 1 e o ativador do receptor de NF-κB (RANK) na via genética. Além disso, o equilíbrio hormonal desempenha um papel crucial na regulação do acúmulo de massa óssea, com destaque para o estrogênio. Outros fatores, como nutrição, tabagismo e atividade física, também podem influenciar o processo de acumulação de massa óssea (BONJOUR et al., 2009).
Os ossos saudáveis dependem de um processo contínuo de remodelação, o qual é essencial para manter a densidade óssea. Estima-se que cerca de 10% do tecido ósseo seja renovado anualmente por meio desse processo. Os osteoclastos, responsáveis pela reabsorção óssea, e os osteoblastos, que formam o osso, são os dois tipos de células que compõem a unidade multicelular do osso. Eles trabalham em conjunto para regular o equilíbrio entre a reabsorção e a formação óssea (LERNER, 2006). O processo normal de remodelação óssea passa por cinco fases distintas: a fase de repouso, a fase de ativação, a fase de reabsorção, a fase de reversão e a fase de formação. Inicialmente, os osteoclastos são atraídos para a superfície do osso, criando um ambiente ácido entre a célula e o osso, permitindo a dissolução e reabsorção do conteúdo mineral. Em seguida, os osteoclastos sofrem apoptose e os osteoblastos entram em cena, depositando colágeno que posteriormente é mineralizado para formar novo tecido ósseo. Este processo é regulado por vários hormônios, incluindo o paratormônio, a calcitonina, a 1,25(OH)2-vitamina D3 e o estrogênio (LEWIECKI, 2008).
O estrogênio influencia os ossos por meio dos seguintes mecanismos: 1) reduzindo a sensibilidade da massa óssea ao hormônio da paratireoide, diminuindo assim a reabsorção óssea; 2) aumentando a produção de calcitonina, que inibe a reabsorção óssea; 3) acelerando a reabsorção de cálcio pelo intestino; 4) reduzindo a excreção de cálcio pelos rins; e 5) exercendo efeitos diretos nos ossos, uma vez que existem receptores de estrogênio presentes neles (BARTL et al., 2009).
Durante a menopausa, a deficiência de estrogênio prejudica o ciclo normal de renovação óssea. Isso pode ser atribuído à presença de receptores de estrogênio nas células progenitoras dos osteoclastos e nos próprios osteoclastos multinucleados. Como resultado, a atividade de reabsorção osteoclástica aumenta, enquanto a atividade osteoblástica diminui.
Consequentemente, a quantidade de osso reabsorvido supera a quantidade depositada, resultando em uma perda líquida de osso (BARTL et al., 2009). O aumento global na reabsorção óssea ocorre devido a um efeito de inibição enfraquecido, decorrente da redução do estrogênio disponível, tanto na osteoclastogênese quanto na atividade dos osteoclastos. O impacto estimulador do estrogênio na formação óssea é ainda menos compreendido, embora possa ser mediado por elementos responsivos ao receptor de estrogênio presentes nos promotores de genes envolvidos na biossíntese da matriz óssea, como o colágeno tipo I, ou citocinas consideradas cruciais para a interligação entre reabsorção óssea e formação óssea (LERNER, 2006).
Figura 7 – Diminuição da massa óssea em homens e mulheres
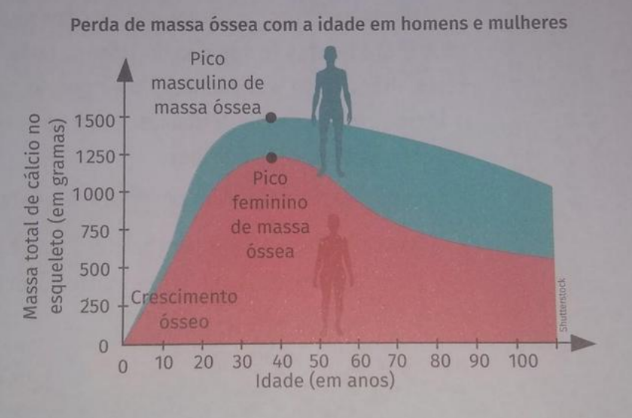
Fonte: Brainly (2020)
Rogers et al. (2002) explicam que, há duas etapas específicas de perda óssea em mulheres: a primeira, que começa principalmente no osso trabecular, tem início durante a menopausa. Originada pela falta de estrogênio, essa fase se caracteriza por um aumento desproporcional na reabsorção óssea em comparação com a formação. É comumente conhecida como perda óssea relacionada à menopausa. Após 4-8 anos, uma segunda fase se segue, caracterizada por uma perda contínua e mais gradual de osso trabecular e cortical, atribuída principalmente à diminuição da formação óssea. Essa fase é conhecida como perda óssea relacionada à idade, sendo a única fase que também afeta os homens.
A principal ameaça à saúde decorrente da osteoporose são as fraturas osteoporóticas, que geralmente ocorrem em locais associados à baixa densidade mineral óssea, como coluna, quadril, punho, úmero ou costelas, principalmente após os 50 anos de idade. Essas fraturas osteoporóticas tendem a ocorrer em uma sequência temporal específica, com fraturas da extremidade inferior do rádio sendo o primeiro sinal por volta dos 50 anos, seguidas por fraturas vertebrais entre 60 e 75 anos e fraturas de quadril geralmente após os 70 anos (LEWIECKI, 2008). As fraturas osteoporóticas podem resultar em perda de mobilidade e independência, redução da qualidade de vida e complicações graves, como pneumonia ou doença tromboembólica. Isso representa um ônus significativo tanto em termos econômicos quanto de saúde pública (CAWTHON, 2011).
A incidência de osteoporose e fraturas associadas é mais alta entre mulheres após a menopausa do que em homens idosos, principalmente devido à importância do estrogênio na preservação da saúde dos ossos. Uma mulher de 60 anos têm um risco vitalício de fratura de cerca de 44%, quase o dobro do risco de um homem da mesma idade, que é de 25% (YAJUN et al., 2014).
Radominski et al. (2017), citam que identificar esse grupo de pessoas em risco por meio do diagnóstico e tratamento precoces é fundamental. A última orientação brasileira para o tratamento da osteoporose em mulheres após a menopausa foi publicada em 2002. Desde então, novas abordagens de diagnóstico da osteoporose surgiram, juntamente com novos medicamentos com mecanismos de ação atualizados que foram incluídos nas opções terapêuticas disponíveis. Devido à alta incidência de causas secundárias de osteoporose, muitas vezes subclínicas, é recomendável que todos os pacientes sejam submetidos a uma avaliação laboratorial mínima antes de iniciar qualquer tratamento. Essa avaliação deve incluir um hemograma completo, níveis de cálcio, fósforo, fosfatase alcalina, função tireoidiana e dosagem de 25 (OH) vitamina D sérica, além de uma calciúria de 24 horas. Também é aconselhável realizar uma radiografia simples lateral da coluna torácica e lombar, juntamente com a medição da densidade mineral óssea na coluna lombar e no fêmur proximal.
É importante abordar os fatores de risco modificáveis em mulheres após a menopausa, o que inclui incentivar a prática regular de atividade física, cessação do tabagismo e redução do uso de medicamentos sedativos e hipnóticos. Além disso, outras medidas que podem ajudar a preservar a massa óssea também devem ser consideradas. A implementação de estratégias para minimizar o risco de quedas é de extrema importância, como o uso de apoios e tapetes antiderrapantes no banheiro, a eliminação de pisos escorregadios e tapetes soltos, o aumento da iluminação e a atenção especial às escadas e degraus (RADOMINSKI et al., 2017).
4.3.4 Queda de cabelo devido à menopausa
Em muitas mulheres, a menopausa e a queda de cabelo frequentemente se encontram. Durante esse período, o organismo passa por mudanças hormonais notáveis, principalmente uma redução nos níveis de estrogênio. Essa alteração hormonal pode resultar em diversos sintomas, incluindo perda ou fragilização dos fios capilares. Os mecanismos exatos por trás desse processo são complexos e podem incluir predisposições genéticas, modificações no ciclo de crescimento capilar e sensibilidade aos andrógenos. Durante a menopausa, a perda de cabelo pode se manifestar de várias maneiras, como afinamento generalizado dos fios ou aumento da divisão capilar. É essencial notar que nem todas as mulheres experimentam uma queda significativa de cabelo nesse período, e a gravidade dos sintomas pode variar de uma pessoa para outra (RINALDI, et al., 2023).
Em condições fisiológicas na cabeça há 80% de cabelo em crescimento (anágeno), 1% no período de involução do folículo piloso (catágeno) e o restante da porcentagem é cabelo em período de repouso (telógeno). Dependendo de vários fatores, o número e a densidade do cabelo das mulheres podem mudar não apenas durante a doença, mas também em condições fisiológicas, entre outras no período da menopausa. A perda diária de cabelo não deve exceder 70-100 cabelos, mas torna-se um problema quando a perda é superior a 100 cabelos diários durante um período superior a algumas semanas (GOLUCH-KONIUSZY, 2016, p. 56).
Com base em evidências recentes, é sugerido que a fase de transição para a menopausa esteja associada à redução dos folículos pilosos, visto que estudos estimam que cerca de 50% das mulheres experimentarão esse sintoma (KAMP et al., 2022). Diversas pesquisas também indicaram que a diminuição nos níveis de estrogênio durante a menopausa pode influenciar as mudanças na saúde dos cabelos, incluindo afinamento, perda de volume e alterações na textura. Além disso, esses estudos destacam uma maior prevalência de queda e rarefação capilar durante a menopausa em comparação com o período pré-menopausa (FABBROCINI et al., 2018; GASSER et al., 2021).
Herskovitz e Tosti (2013), explicitam que, durante o período que antecede a menopausa, as mulheres experimentam uma diminuição fisiológica nos níveis sanguíneos de estrogênio, enquanto os níveis de andrógenos aumentam naturalmente, o que pode contribuir para a queda de cabelo de origem androgênica. A perda de cabelo em mulheres costuma se manifestar como um afinamento difuso dos fios, especialmente na região central e na testa, e ocasionalmente também nas áreas parietal e occipital.
Em 2018, Fabbrocini e sua equipe observaram que mulheres pós-menopausa com alopecia androgenética apresentavam níveis mais reduzidos de estrogênio e níveis mais elevados de andrógenos, como testosterona e diidrotestosterona, em comparação com mulheres na mesma fase sem perda capilar. Contudo, o mecanismo preciso ainda carece de investigações adicionais, o que também se aplica à avaliação da eficácia da terapia de reposição hormonal (TRH).
O estradiol pode ter um impacto significativo no desenvolvimento e ciclo de vida dos folículos capilares ao se conectar aos receptores de estrogênio. Essa ligação influencia a atividade da aromatase, uma enzima fundamental que converte andrógenos em estrogênios (KHUNGER et al., 2019). O estradiol estende a fase anágena do ciclo capilar, promovendo o crescimento dos fios ao aumentar a produção de fatores de crescimento vitais, os quais estimulam a multiplicação de queratinócitos nos folículos capilares. Essa explicação ajuda a compreender a diminuição na regeneração, no crescimento e na espessura dos cabelos, além do enfraquecimento observado durante a menopausa (THASNEEM et al., 2022). Em contraste com a rápida diminuição dos níveis de estrogênio e progesterona, a produção de androgênios, que já é relativamente baixa nas mulheres, diminui gradualmente durante a menopausa e o envelhecimento. Os androgênios desempenham um papel importante na regulação do crescimento capilar e na produção de sebo nas unidades pilossebáceas (MIRMIRANI, 2011). O aumento proporcional dos androgênios durante a menopausa pode levar ao hiperandrogenismo clínico, caracterizado pelo aumento do tamanho das glândulas sebáceas e pela alopecia androgenética feminina, que segue um padrão específico, devido a uma diminuição localizada na renovação e no crescimento dos cabelos. Fatores genéticos e ambientais, como exposição ao ambiente, podem agravar essa condição (TOBIN, 2009; MIRMIRANI, 2011).
O desafio da queda de cabelo em mulheres durante a menopausa requer um diagnóstico preciso seguido por um tratamento adequado. Cerca de 20-60% das mulheres enfrentam esse problema antes dos 60 anos (HERSKOVITZ, TOSTI, 2013). Dado que as mudanças no equilíbrio hormonal do corpo são a principal causa dessa perda capilar nesse estágio da vida, é sensato apoiar as mulheres nutricionalmente. Os nutrientes presentes em diferentes grupos de alimentos servem como precursores na produção de hormônios esteroides e também desempenham um papel fundamental na formação, crescimento e manutenção dos cabelos na superfície da pele (SHAPIRO, 2007).
A seguir, os principais nutrientes que têm um papel fundamental na formação, desenvolvimento e saúde dos cabelos.
a) Proteínas
Proteínas de alta qualidade, que incluem aminoácidos como cisteína e metionina, desempenham um papel fundamental na produção de queratina. A falta de proteína na dieta, ou uma ingestão calórica insuficiente, pode afetar negativamente a saúde do cabelo, levando a problemas como fragilidade, fraqueza e queda, além de alterações na estrutura do cabelo (JEN, YAN, 2010). Os folículos capilares podem diminuir de tamanho. A queratina, que é a substância principal que compõe a haste e protege os cabelos, é produzida por células chamadas queratinócitos nas camadas mais profundas e externas da pele. As fibras de queratina, que estão entrelaçadas dentro da haste capilar (no córtex), são responsáveis pela flexibilidade dos cabelos. A presença de queratina na camada de proteção dos cabelos mantém sua integridade e brilho, então, quando ela está ausente, os cabelos tendem a se dividir em duas partes (MARKIEWICZ-ŻUKOWSKA, 2010).
b) Gorduras
As gorduras ingeridas na alimentação desempenham um papel na produção de hormônios esteroides, derivados do colesterol, e, portanto, têm impacto na manutenção dos pelos na pele. Os ácidos graxos saturados presentes na dieta podem intensificar esse efeito, aumentando a produção de sebo. Os componentes da camada protetora da pele e seus derivados, como ceramidas, esteróis, fosfolipídios e ácidos graxos livres, desempenham um papel importante na saúde da pele e dos pelos (PAPPAS, 2009). A falta desses elementos no corpo feminino pode resultar na redução da hidratação dos cabelos, podendo levar até mesmo à queda de cabelo devido à condição inadequada dos folículos capilares. Uma ingestão insuficiente de ácidos linoleico e linolênico, além de ácidos graxos poli-insaturados de cadeia longa, que são componentes essenciais da camada mais externa da pele, pode contribuir para a perda de cabelo (JAROSZ, 2012).
c) Carboidratos
Os carboidratos também têm impacto na saúde dos cabelos. Estudos mostraram que o consumo de alimentos altamente processados, que são ricos em açúcares simples, é um dos fatores indiretos que contribuem para a queda excessiva de cabelo. Uma dieta com alto teor de açúcares simples estimula a produção de sebo pelas glândulas sebáceas. Normalmente, o sebo é benéfico para o cabelo, mas quando sua produção é excessiva, pode se tornar um substrato para microrganismos presentes na pele, levando à decomposição dos triacilgliceróis contidos nele. Isso resulta na liberação de ácidos graxos irritantes, causando inflamação. Esse excesso de ácidos graxos, produzido dessa forma, aumenta ainda mais a produção de sebo, o que pode levar a distúrbios na queratinização (JAMES, GIBSON, CLELAND, 2020).
Além disso, uma alimentação rica em açúcares simples pode resultar em níveis inadequados de glicose e insulina no sangue, o que contribui diretamente para o aumento da produção de andrógenos pelos ovários. Indiretamente, isso ocorre pela supressão da síntese de SHBG no fígado e do fator de crescimento semelhante à insulina (IGF-1) ligado à proteína tipo 1. A insulina tem um efeito direto no crescimento do cabelo e também aumenta a concentração de DHT no folículo capilar, levando à sua miniaturização (NABAIE et al., 2009). Por isso, é recomendado que a dieta feminina inclua alimentos ricos em carboidratos complexos, com baixo índice glicêmico e carga, e que também sejam fontes de fibras, as quais auxiliam na regulação do metabolismo de carboidratos e lipídios no corpo (WEICKERT, PFEIFFER, 2008).
d) Vitaminas
As vitaminas são fundamentais para a saúde dos cabelos, incluindo a vitamina C, as vitaminas do complexo B e as vitaminas A e D.
Ragunatha et al. (2008) explica que a falta de vitamina C na alimentação pode afetar a estrutura da haste capilar, podendo levar a um aumento na atividade das células do folículo piloso, resultando em uma produção excessiva de queratina que pode obstruir o orifício do folículo.
Pesquisas sobre o metabolismo da vitamina D revelaram a presença do receptor específico VDR nos tecidos intestinais. Este receptor faz parte da família dos receptores esteroides. O complexo 1,25(OH)2D3/VDR atua como um fator de transcrição essencial para manter a saúde capilar. Estudos em modelos animais demonstraram que a ativação do receptor VDR desempenha um papel significativo no ciclo de crescimento do folículo capilar, especialmente no início da fase anágena, e isso ocorre independentemente dos níveis de cálcio e fósforo na dieta (LOVE, RASHID, MIRMIRANI, 2010).
O ácido pantotênico, também conhecido como vitamina B5, desempenha várias funções importantes na saúde capilar. Ele ajuda a prevenir o envelhecimento prematuro dos cabelos e pode restaurar sua cor natural. Além disso, o ácido pantotênico é essencial para o crescimento adequado dos cabelos, pois desempenha um papel na divisão celular dos folículos pilosos. Ele também proporciona hidratação adequada aos cabelos, possui propriedades anti-inflamatórias, protege os cabelos, regula a atividade das glândulas sebáceas e promove a produção de melanina (RUSHTON et al., 2012).
Shih et al. (2009) esclarecem que a falta de vitamina A na alimentação pode resultar em uma diminuição na velocidade do ciclo de regeneração e síntese celular. Devido à sua natureza lipossolúvel, a vitamina A desempenha um papel importante na hidratação e proteção dos cabelos, tornando-os mais resistentes à fragilidade.
e) Minerais
Dentre os minerais, os que mais influenciam o crescimento e fortalecimento do cabelo são: Zn, Fe, Cu, Se, Si, Mg e Ca.
O zinco desempenha um papel fundamental no metabolismo dos carboidratos, proteínas e gorduras, e também exerce influência sobre os folículos capilares e o crescimento do cabelo. Atua como um ativador enzimático, promovendo a conversão de proteínas que contêm ligações sulfídricas essenciais para a estruturação da fibra capilar (KIL et al., 2013).
O ferro, como parte da hemoglobina, proporciona energia às células da matriz, que estão envolvidas em processos de divisão e diferenciação, essenciais para a produção de cabelo. Ele também desempenha um papel crucial no funcionamento das enzimas responsáveis pela estruturação e velocidade de crescimento dos cabelos (PARK et al., 2013).
O cobre é um cofator das amoxidases, que são ligações essenciais para fortalecer a estrutura da fibra de queratina, garantindo sua resistência. Contribui para fortalecer o cabelo, influenciando o desenvolvimento da estrutura adequada. Sua falta na dieta pode levar à redução do número de pontes de enxofre, que são responsáveis pela resistência e elasticidade dos cabelos, podendo resultar em cabelos quebradiços e fracos (DRISCOLL et al., 2010).
O selênio atua em diversas atividades biológicas, incluindo defesa antioxidante, produção de hormônios da tireoide, síntese de DNA, fertilidade e reprodução. O cabelo recebe principalmente esses minerais através da corrente sanguínea e é capaz de absorver selênio em sua matriz durante o processo de queratinização (MEHDI et al., 2013). De igual forma, o silício, também, desempenha um papel importante no crescimento e brilho dos cabelos. É encontrado nos alimentos na forma de ácido silícico, presente em grãos e seus produtos integrais, como arroz, aveia, farelo e pães integrais (WICKETT et al., 2007).
O magnésio auxilia na transformação das proteínas, influenciando os processos de divisão, crescimento e maturação das células. Portanto, sua deficiência pode contribuir direta ou indiretamente para a queda de cabelo (GODFREY et al., 2013). O cálcio é outro elemento que possui um papel importante na manutenção da saúde capilar, sendo que as mulheres, especialmente durante o período da perimenopausa, estão suscetíveis à sua deficiência (WLAŹLAK et al., 2018).
4.3.5 Alterações na pele durante a menopausa
Piérard et al. (2014), explica que, a relação entre a qualidade da pele e o processo da menopausa é estreita. A pele, sendo um dos maiores órgãos do corpo, sofre significativamente com o processo de envelhecimento e menopausa. É diretamente influenciada pelos hormônios, especialmente pelos estrógenos, que desempenham um papel importante na sua espessura, hidratação, pigmentação e regulação da produção de óleo. Os estrógenos também estimulam a renovação celular na derme e promovem a síntese de colágeno e elastina na epiderme, proporcionando maior elasticidade à pele. Com o início do estado de deficiência de estrógeno durante a menopausa, o metabolismo celular na derme é afetado, resultando em alterações compatíveis com o envelhecimento da pele.
Barbosa (2011, p. 29) reitera que:
A menopausa marca uma fase significativa na vida da mulher, caracterizada por uma série de alterações hormonais, com uma diminuição notável nos níveis de estrogénio, sendo particularmente impactante na saúde da pele . Esta mudança hormonal leva a uma redução na produção de colágeno, componente chave na manutenção da elasticidade e firmeza da pele. À medida que os níveis de colágeno diminuem, a pele pode ficar mais fina, menos elástica e mais propensa ao desenvolvimento de rugas.
Grande parte dos cuidados direcionados às mulheres que entram na menopausa se concentra em problemas relacionados aos ossos e ao coração. Contudo, é importante notar que a pele também passa por mudanças notáveis durante esse período. A diminuição dos níveis de estrogênio resulta em diversas transformações orgânicas, incluindo uma redução na produção de colágeno, o que acarreta no processo de envelhecimento cutâneo (PIÉRARD, 2006).
As transformações hormonais e a diminuição da função ovariana, marcadas pela queda nos níveis de estradiol, são responsáveis por muitas das alterações observadas durante o climatério. Esses desequilíbrios hormonais podem desencadear ondas de calor, manifestadas como sensações intensas de calor na pele, especialmente no rosto, acompanhadas por suores abundantes. Existem amplas evidências indicando que a redução das propriedades mecânicas da pele está associada a um envelhecimento gradual (GILCHREST, 2013).
A aparência visível da idade frequentemente está associada à condição da pele do rosto. Nas regiões expostas ao sol, as características principais do envelhecimento são frequentemente chamadas de fotoenvelhecimento (GILCHREST, 2013). Normalmente, há mudanças graduais que resultam em pigmentação irregular, seguida por perda gradual de elasticidade, ressecamento e formação de rugas na pele. Além disso, os desequilíbrios hormonais têm um papel evidente no afinamento da camada dérmica que ocorre durante a diminuição dos níveis de estrogênio na menopausa (SYED et al., 2013; PIÉRARD, 2006).
Os hormônios influenciam o ritmo do processo de envelhecimento e contribuem para diversas irregularidades cutâneas, além de influenciarem o desenvolvimento de dermatoses crônicas (SYED et al., 2013). O envelhecimento da pele relacionado aos hormônios ocorre simultaneamente ao envelhecimento cronológico e à exposição ao sol. Entre os vários hormônios, os sexuais têm um papel significativo no processo de envelhecimento. A pele parece servir como um mapa para os receptores de estrogênio e androgênio, com concentrações mais altas desses hormônios na superfície facial, membros inferiores e região genital (PIÉRARD, 2006).
A pele representa aproximadamente 15% do peso corporal em adultos e é composta por uma camada epidérmica e dérmica, formada por células cutâneas e uma matriz extracelular. Logo abaixo da derme está o tecido subcutâneo, que constitui a terceira camada da pele (FEBRASGO, 2010). A derme é uma camada de células subjacentes, separadas pela matriz extracelular, e é composta principalmente por colágeno. Outros componentes vitais incluem tecidos elásticos, células de gordura, mastócitos, vasos sanguíneos, músculos lisos e estriados, e nervos. A espessura da derme varia conforme a região do corpo em que se encontra (PIÉRARD, 2006).
O colágeno presente na derme representa entre 70% e 80% do peso seco da pele e cerca de 30% do total de proteínas do corpo. Junto com a elastina, o colágeno é responsável por conferir à pele suas propriedades estruturais e elásticas características (PIÉRARD et al., 2014). A matriz extracelular da pele é composta por uma variedade de proteínas e glicosaminoglicanos, organizados em uma rede. Esses componentes da rede fornecem os materiais necessários para a produção de novo colágeno e elastina. Os fibroblastos desempenham um papel crucial na comunicação entre as células e o espaço extracelular, incluindo a interação com hormônios como andrógenos e estrogênios (PIÉRARD, 2006; PIÉRARD et al., 2014; BISOGNIN et al., 2015).
As mudanças na pele durante a menopausa variam de mulher para mulher. Enquanto algumas experienciam alterações graduais, para a maioria, as mudanças cutâneas são marcantes e ocorrem rapidamente à medida que a produção de estrogênio diminui. Esse declínio hormonal desencadeia transformações cosméticas, como o surgimento de rugas e a perda de firmeza, além de alterações estruturais, como o afinamento da camada epidérmica (BARBOSA, 2011). A sensação de ressecamento da pele geralmente é o primeiro sintoma, seguido pela diminuição da firmeza e elasticidade, já que o colágeno, principal componente da pele, é geralmente perdido a uma taxa acelerada durante a menopausa (PIÉRARD et al., 2014).
A pele desempenha diversas funções essenciais que impactam a saúde geral do corpo. É um órgão fundamental na proteção contra infecções causadas por agentes microscópicos, como bactérias. As mudanças que começam durante o climatério diminuem a capacidade de defesa da pele, aumentando o risco de infecções e comprometendo sua capacidade de se recuperar de lesões. Isso resulta em um significativo aumento da morbimortalidade associado à redução da capacidade protetora da pele (PIÉRARD, 2006).
Além disso, as mudanças cosméticas que ocorrem durante o climatério podem desencadear efeitos psicológicos significativos, uma vez que a aparência da pele está intimamente ligada às percepções de beleza, podendo impactar a autoimagem das mulheres. Como resultado, elas podem experimentar uma redução na autoconfiança e efeitos negativos na qualidade de vida (FIROOZ, SADR, BABAKOOHI, 2009). Estudos sobre distúrbios da pele que começam durante o climatério indicam que a qualidade de vida pode ser afetada, já que isso pode interferir na vida profissional, nas relações sociais e íntimas, levando até mesmo ao isolamento social e a dificuldades sexuais (BARBOSA, 2011).
Mesmo durante a menopausa, cada tipo de pele requer um tratamento específico de acordo com suas características individuais. O equilíbrio hormonal desempenha um papel fundamental na manutenção da saúde da pele, pois esse período é caracterizado por flutuações hormonais significativas que a afetam diretamente. Como mencionado, a redução nos níveis de estrogênio é especialmente marcante devido ao seu impacto na diminuição da produção de colágeno, resultando em perda de elasticidade, aumento de rugas e ressecamento cutâneo (PIÉRARD, 2006).
4.3.5.1 Manejo da pele na menopausa
É fundamental fornecer orientações claras para as pacientes a fim de que compreendam melhor essa transição fisiológica e saibam como gerenciar os sinais e sintomas durante a menopausa, promovendo assim uma melhor qualidade de vida para as mulheres (THE NAMS, 2017). À medida que a perspectiva de longevidade se torna mais relevante, tornam-se cada vez mais importantes as orientações individuais e coletivas para mulheres que estão se aproximando da menopausa. Recomenda-se uma abordagem que promova um estilo de vida saudável (MINISTÉRIO DA SAÚDE, 2016).
Na perspectiva da promoção da saúde durante a menopausa, é necessário ajustar a alimentação considerando os macronutrientes que influenciam a saúde da pele (NAMAZI et al., 2019). É fundamental priorizar o aumento da ingestão de proteínas e buscar fontes específicas de aminoácidos, como cisteína, lisina e triptofano, enquanto se evita o consumo excessivo de doces e carboidratos refinados, que elevam os níveis de glicose e podem aumentar o risco de diabetes tipo 2. Além disso, é possível considerar a inclusão de suplementos orais e nutracêuticos para garantir uma complementação adequada dos nutrientes na dieta durante esse período (BRASIL, 2008).
Após a menopausa, a suplementação com aminoácidos é essencial, não apenas para a saúde da pele, mas também para a manutenção da massa muscular. Um derivado da leucina chamado β-hidroxi β-metilbutirato (HMB) tem sido empregado com sucesso em contextos clínicos, ajudando no aumento da massa magra (HUANG et al., 2018). Em um estudo realizado em mulheres sedentárias na pós-menopausa, a suplementação oral com arginina, glutamina e HMB por quatro semanas resultou na redução da gordura visceral e na melhoria da textura da pele, possivelmente devido ao aumento na produção de colágeno. A ingestão de peptídeos bioativos, frequentemente dipeptídeos e tripeptídeos específicos obtidos de diferentes fontes de colágeno, pode promover o estímulo à produção de colágeno (PÉREZ SÁNCHEZ et al., 2018).
Alimentos que contêm fitoestrogênios, como isoflavonas e lignanas, podem ajudar a reduzir o impacto negativo das mudanças hormonais durante a menopausa. Embora tenham uma estrutura e função semelhantes ao estradiol, o que sugere uma interação com os receptores de estrogênio, os fitoestrogênios geralmente exercem um efeito mais sutil (RZEPECKI et al., 2019).
Uma excelente fonte alimentar desses ácidos graxos essenciais são os óleos de peixe. A baixa ingestão desses óleos pode impactar a composição da camada mais externa da pele, resultando em maior perda de água e comprometimento da função de barreira. Além disso, a falta desses nutrientes pode levar ao aumento de certas proteínas queratinosas, como as queratinas K6 e K16, e também da queratina associada à inflamação, K17 (PÉREZ SÁNCHEZ et al., 2018; HUANG et al., 2018).
A adição de coenzima Q10 (CoQ) por meio de suplementação tem sido associada à prevenção parcial de danos cardiovasculares e cerebrais, graças aos seus efeitos bioenergéticos e antioxidantes. Evidências sugerem que a CoQ pode ajudar na restauração da atividade mitocondrial, o que contribui para a redução do declínio cognitivo em mulheres após a menopausa (PÉREZ-SÁNCHEZ et al., 2018). A CoQ presente na derme, epiderme e nos lipídios da camada córnea diminui à medida que envelhecemos e devido à exposição à radiação ultravioleta. A reposição dessa coenzima é crucial para melhorar as características da pele durante o envelhecimento natural e na menopausa. Outro antioxidante que oferece benefícios vasculares para mulheres na menopausa é o extrato de Pinus pinaster, frequentemente utilizado para tratar alterações pigmentares na pele (CIRILLI et al., 2021).
Identificar e tratar a deficiência de vitamina D em mulheres após a menopausa pode melhorar sua saúde geral, especialmente considerando a alta prevalência de doenças musculoesqueléticas nessa fase. Além disso, as alterações no metabolismo e na composição corporal que ocorrem durante a menopausa podem afetar a síntese de vitamina D pela pele, sua função fisiológica e a prevenção da osteoporose (WONGKHANKAEW, PONGSATHA, 2021).
A participação frequente em atividade física estimula a microcirculação, o que tem efeitos benéficos na saúde da pele, na capacidade cardiorrespiratória e na diminuição dos fogachos (MINISTÉRIO DA SAÚDE, 2016). Além de atenuar a intensidade dos sintomas vasomotores, o exercício físico promove a produção de irisina, contribuindo para a melhoria da qualidade de vida durante a menopausa e podendo desempenhar um papel relevante na redução da depressão e na melhora da percepção da imagem corporal (NAMAZI et al., 2019). É recomendado incentivar a realização de 150 minutos de atividade aeróbica de intensidade moderada por semana, juntamente com exercícios de fortalecimento muscular. A prática de ginástica pélvica e os exercícios de Kegel são úteis para fortalecer o assoalho pélvico e os músculos vaginais, podendo ajudar a prevenir a incontinência urinária e a urgência miccional (BRASIL, 2008). Em relação à dermocosmética, é essencial harmonizar as necessidades da pele durante a perimenopausa e a pós-menopausa com os ingredientes ativos apropriados (ANTELO et al., 2023). A seguir, está a representação modificada da pirâmide que aborda a saúde e a estética da pele, destacando os componentes dermatológicos tópicos relevantes durante a menopausa, conforme ilustrado na Figura 8.
Figura 8 – Adaptação da pirâmide da saúde e beleza da pele
Fonte: Antelo et al. (2023)
A base da pirâmide compreende ativos destinados à proteção e reparação da pele contra os danos provocados pelos fatores ambientais, incluindo proteção solar e antioxidantes. Esses desempenham um papel crucial no combate ao envelhecimento acelerado pelos hormônios sexuais, especialmente durante a perimenopausa e os primeiros anos da pós-menopausa (KRUTMANN et al., 2017; PASSERON et al., 2020).
Para mitigar os danos causados pelo sol na pele, é recomendado que as mulheres usem diariamente um protetor solar de amplo espectro (UVB, UVA1/UVA2). Quanto aos antioxidantes, sugere-se a aplicação tópica de vitaminas C, E e B3 (niacinamida), além de polifenóis. A vitamina C (ácido L-ascórbico puro), em concentrações de 5 a 15%, exerce um efeito antienvelhecimento quando aplicada topicamente. Isso ocorre devido à sua capacidade de estimular a produção de colágeno I, colágeno III e enzimas essenciais na síntese de colágeno, enquanto inibe a metaloproteinase-1 (KRUTMANN et al., 2017).
A vitamina E (tocoferol) desempenha um papel protetor na pele contra os efeitos prejudiciais do estresse oxidativo causado pela exposição à radiação UV, luz visível, infravermelho e poluição, como demonstrado em testes realizados in vitro. Por outro lado, a niacinamida (vitamina B3) aplicada topicamente regula o metabolismo celular e o processo de regeneração da pele. Além disso, ela reduz a resposta inflamatória, possui propriedades antienvelhecimento e despigmentantes ao inibir a transferência de melanossomas dos melanócitos para os queratinócitos (ZOUBOULIS et al., 2019).
A utilização de polifenóis através da aplicação tópica tem sido reconhecida como significativa durante a menopausa devido aos seus efeitos antioxidantes, anti-inflamatórios e imunomoduladores. Os benefícios da aplicação tópica de isoflavonas na pele de mulheres pós-menopausa incluem a melhoria da secura da pele, o aumento da espessura, a redução das rugas faciais, o aumento da viabilidade dos fibroblastos, o aumento da concentração de ácido hialurônico e a produção de colágeno tipos I e III (ZOUBOULIS et al., 2019; DRAELOS, 2021).
O resveratrol, um polifenol não flavonoide, oferece benefícios que incluem propriedades anti-inflamatórias e antioxidantes. Ele ajuda a proteger contra os danos causados pela radiação UV e pelo estresse oxidativo, reduzindo a expressão dos fatores de transcrição AP-1 e NF-kB. Além disso, o resveratrol diminui a proliferação de fibroblastos, o que contribui para o aumento do colágeno tipos I, II e III. Também inibe a melanogênese e ativa a sirtuína 1 (CHOE et al., 2018).
No meio da pirâmide estão os ativos transformadores, que promovem a renovação celular e a hidratação da pele. Os retinoides são exemplos desses ativos, conhecidos por sua capacidade de estimular a síntese de colágeno e reduzir a expressão de MMP-1. A tretinoína é um retinoide amplamente reconhecido por seu papel na redução dos sinais de envelhecimento da pele causados pela exposição aos raios UV, como rugas, perda de elasticidade e pigmentação. É frequentemente utilizada em mulheres na fase do climatério, desde que acompanhada de cuidados apropriados para a recuperação e proteção da barreira cutânea (BLUME-PEYTAVI et al., 2012; ZOUBOULIS et al., 2019). Os retinoides, principalmente a tretinoína, têm o potencial de aumentar a produção de hormônios esteroides em vários tecidos esteroidogênicos, tanto clássicos quanto não clássicos, cujo equilíbrio hormonal é afetado durante o climatério. A regulação da atividade esteroidogênica nos queratinócitos, a nível local, desempenha um papel crucial na fisiologia e na manutenção da saúde da pele (BOCHEVA, SLOMINSKI, SLOMINSKI, 2019).
O retinol é amplamente empregado como um agente antienvelhecimento, influenciando o metabolismo do colágeno com menor probabilidade de causar irritação cutânea em comparação com a tretinoína. Estudos demonstraram que o tratamento com uma formulação contendo retinol a 0,4% resultou em aumento do total de GAGs na pele, conforme determinado por imunomarcação (BOCHEVA, SLOMINSKI, SLOMINSKI, 2019; ZOUBOULIS et al., 2019).
O tratamento tópico com AHA contribui para a renovação celular da pele e promove o aumento do conteúdo total de GAGs e ácido hialurônico, fatores correlacionados com uma melhor qualidade e hidratação da pele. O ácido glicólico é o principal ativo desse grupo, que, além de sua ação renovadora, ajuda a uniformizar a tonalidade e a textura da pele (WANG, NEO, BETTS, 2021).
Durante e após a transição menopausal, a pele requer uma significativa reposição do seu conteúdo hídrico (BRINCAT, MUSCAT, GALEA, 2005). Os ativos tópicos de destaque incluem óleos vegetais derivados de sementes de girassol, damasco, argan, coco, karité e farelo de arroz, caracterizados por suas elevadas concentrações de ácidos graxos ômega-3, ômega-6 e ômega-9. Estes óleos vegetais promovem a lipogênese epidérmica e contribuem para a restauração da função de barreira cutânea, tanto no âmbito corporal quanto facial (HUANG et al., 2018).
Ainda para Huang et al. (2018), os ácidos graxos são cruciais nas respostas inflamatórias, seja como componentes dos fosfolipídios das membranas celulares ou como mediadores lipídicos solúveis, demonstrando influência na regulação da cicatrização da pele. Estudos indicam que os ácidos graxos ômega-9 apresentam uma capacidade superior de promover a cicatrização de feridas em comparação com outros tipos. Além de acelerar o processo de cicatrização, os ácidos graxos poli-insaturados ômega-3 e ômega-6 podem beneficiar a função de barreira da pele, suprimir a inflamação e hiperpigmentação causadas pela exposição aos raios ultravioleta e reduzir a secura da pele. O ácido linoleico, pertencente à família ômega-6, destaca-se por estimular a síntese de ceramidas na epiderme. Por sua vez, os ácidos graxos ômega-3 têm o potencial de modular a resposta imune da epiderme através das células T, interagindo com os receptores toll-like e ativando cascatas de caspase que contribuem para o alívio de dermatoses inflamatórias. A aplicação tópica oferece uma abordagem direta e eficaz para fornecer ácidos graxos poli e monoinsaturados à pele, resultando em uma maior biodisponibilidade em comparação com a administração oral.
Os polissacarídeos desempenham um papel significativo na derme das mulheres durante o período peri e pós-menopausa, contribuindo para o aumento do conteúdo de glicosaminoglicanos (GAGs), o que é essencial para restaurar o turgor da pele e reduzir a flacidez cutânea. Um dos tipos mais conhecidos de GAGs é o ácido hialurônico (DRAELOS, 2021), e o uso regular de formulações contendo HA tem demonstrado reduzir a profundidade das rugas, a flacidez e a desidratação da pele, ao mesmo tempo em que melhora a função de barreira cutânea, sendo considerado um ativo seguro. O HA de alto peso molecular não consegue penetrar efetivamente na pele, mas o desenvolvimento de formulações contendo fragmentos de HA de diferentes tamanhos pode melhorar sua capacidade de penetração cutânea (WANG, NEO, BETTS, 2021).
No topo da pirâmide, estão incluídos ativos que visam estimular e beneficiar a derme, abordando as principais preocupações da pele durante a menopausa. O Pro-xylane® é um C-xilosídeo que desempenha um papel crucial na indução e estímulo da produção de glicosaminoglicanos (GAGs) na derme, promovendo a redensificação desse compartimento e aumentando o teor de água na matriz extracelular da pele (DRAELOS, 2021). Além disso, na junção dermoepidérmica, o Pro-xylane® estimula a síntese de microfilamentos de ancoragem na membrana basal, como o colágeno IV, colágeno VII e laminina 5, e componentes da derme papilar, como o procolágeno I e a fibrilina 1, fortalecendo assim a adesão e coesão entre as camadas da pele. Isso resulta em um aumento da densidade cutânea e acelera o transporte dos fatores de crescimento e nutrientes, proporcionando uma pele pós menopausa mais hidratada (VASSAL-STERMANN et al., 2012).
Um estudo clínico comparativo entre um dermocosmético contendo Pro-xylane® a 3% e um creme hidratante, realizado em 238 mulheres na pós-menopausa ao longo de 60 dias de aplicação diária, demonstrou uma melhora significativa na firmeza, densidade, luminosidade e homogeneidade da pele (BOULOC et al., 2017). A aplicação tópica de polipeptídeos, compostos por cadeias de aminoácidos, demonstrou ter a capacidade de estimular a síntese de colágeno e ativar o metabolismo dérmico. Existem três principais famílias de polipeptídeos: os peptídeos inibidores de sinal, os transportadores e os neurotransmissores (ZOUBOULIS et al., 2019).
Em relação às tecnologias, as mulheres na menopausa muitas vezes procuram procedimentos estéticos devido às alterações estruturais na pele que enfrentam nessa fase. O uso de toxina botulínica, preenchimentos, peelings, laser, ultrassom microfocado e radiofrequência pode ser benéfico para melhorar a qualidade da pele durante esse período (ZOUBOULIS et al., 2019). Além disso, os procedimentos para a região geniturinária, visando a saúde funcional e a estética, estão se tornando mais populares. Isso inclui preenchimentos nos grandes lábios, peelings, laser vaginal, radiofrequência e o uso de produtos tópicos para manter a hidratação adequada da área (WLAŹLAK et al., 2018).
4.3.6 Sintomas Psicológicos em Relação à Menopausa
As mulheres durante a menopausa apresentam uma ampla variedade de sintomas psicológicos, como problemas de memória e concentração, depressão, ansiedade, insônia, fadiga e irritabilidade, resultando em um alto nível de sofrimento, que pode prejudicar a capacidade de enfrentamento e reduzir a qualidade de vida (WILBUR et al., 2006). Além disso, sintomas neuropsiquiátricos graves podem indicar o desenvolvimento de condições relacionadas à idade, como comprometimento cognitivo associado à doença de Alzheimer, especialmente durante os estágios iniciais, mas são frequentemente interpretados erroneamente como parte do processo natural de envelhecimento, o que pode levar a problemas de saúde significativos não detectados (CASALETTO et al., 2019).
Esquecimento e dificuldades de atenção, processamento mental e fluência verbal, manifestadas pela dificuldade em encontrar palavras, são problemas cognitivos frequentemente relatados por mulheres durante a menopausa e a transição para a menopausa (GAVA et al., 2019). O declínio na memória é o segundo sintoma mais comum associado à menopausa, após os sintomas vasomotores e a rigidez articular, e a intensidade desses sintomas pode ser bastante preocupante (MAKI, HENDERSON, 2016).
A deficiência de estrogênio ocasiona alterações na estrutura e função cerebral, contribuindo para sintomas de envelhecimento cognitivo e aumentando a suscetibilidade à doença de Alzheimer, especialmente em indivíduos com predisposição genética (GAVA et al., 2019). O estrogênio, um neuroesteróide com diversos efeitos neuroprotetores, interage com as células cerebrais por meio de seus receptores de estrogênio (ERs) β e α, amplamente distribuídos, para regular processos fundamentais para o funcionamento executivo e a memória. Isso inclui a transdução de sinais e neurotransmissão (por exemplo, de acetilcolina, serotonina, noradrenalina e glutamato) no córtex pré-frontal, plasticidade sináptica, produção de fatores neurotróficos como o fator de crescimento nervoso, crescimento de neuritos, neurogênese no giro denteado, reparo de DNA, produção mitocondrial de trifosfato de adenosina e síntese de antioxidantes internos (HUSSAIN et al., 2018; MINAMI et al., 2016).
Sintomas de depressão, ansiedade e distúrbios do sono são comuns durante a transição da meia-idade em mulheres e podem estar associados ao desempenho cognitivo (MAKI, HENDERSON, 2016). No entanto, esses sintomas não explicam totalmente o declínio da memória observado durante a menopausa. As mulheres apresentam um maior risco de depressão em comparação com os homens, e esse risco aumenta com o avanço da idade. Durante a transição da menopausa, o risco de desenvolver transtornos depressivos maiores é de duas a quatro vezes maior em comparação com mulheres na pré-menopausa (LLANESA et al., 2012).
Mulheres na perimenopausa frequentemente experimentam uma variedade de sintomas depressivos, incluindo mudanças de humor, falta de motivação, anedonia (falta de sensação de prazer) e distúrbios do sono, os quais podem ter um impacto significativo na qualidade de vida (SOARES, 2020). De acordo com um estudo de grande escala, realizado por Shea et al. (2020), aproximadamente 18,4% das mulheres de meia-idade que vivem na comunidade no Canadá foram diagnosticadas com depressão, conforme avaliado pela Escala de Depressão Curta-10 do Centro de Estudos Epidemiológicos. Mulheres que entraram na menopausa antes dos 40 anos de idade mostraram uma prevalência mais elevada de depressão, com uma razão de chances de 1,45 e um intervalo de confiança de 95%.
A diminuição dos níveis de estrogênio durante a menopausa pode levar a distúrbios de humor, afetando a produção de fatores neuroprotetores importantes, como o fator neurotrófico derivado do cérebro. Além disso, essa diminuição hormonal pode interferir na neurotransmissão, afetando a síntese de catecolaminas, como a noradrenalina, e regulando positivamente o receptor 5-HT2A da 5-hidroxitriptamina (serotonina) (SANTORO, EPPERSON MATHEWS, 2015; GAVA et al., 2019). O receptor 5-HT2A também desempenha um papel importante na regulação da temperatura corporal, influenciando o ponto de ajuste térmico. Essa regulação está diretamente relacionada aos sintomas vasomotores, como ondas de calor e suores noturnos, que são experimentados por cerca de 85% das mulheres na perimenopausa (SANTORO, EPPERSON MATHEWS, 2015; MAKI, HENDERSON, 2016).
Esses sintomas, além de serem desconfortáveis, representam um fator de risco significativo para distúrbios do sono, ansiedade e/ou sintomas depressivos (LLANESA et al., 2012; SHEA et al., 2020). Porém, os desequilíbrios de humor que afetam as mulheres durante a menopausa estão associados a uma série de fatores além das mudanças hormonais, como sintomas geniturinários, menor nível de educação, etnia não branca, histórico de tabagismo, histórico de ansiedade e depressão pós-parto, nuliparidade, obesidade, estresse causado por eventos de vida, falta de apoio social, luto, baixa autoestima, desemprego, exposição a múltiplos estressores e estratégias inadequadas de enfrentamento (SIMON, 2020; GAVA et al., 2019). A falta de energia e fadiga, que são relatados por uma proporção significativa de mulheres na menopausa, variando entre 43,9% e 64,7%, estão intimamente ligados à sensação de exaustão e esgotamento, o que pode ter um impacto substancial na qualidade de vida das mulheres afetadas (MEYER et al., 2016; CHIU, TSAO, LIN, 2020).
A fadiga é caracterizada pela sensação de falta de energia, cansaço, redução da motivação e capacidade de realizar até mesmo as atividades mais simples. Pode incluir uma sensação avassaladora de exaustão física e mental, mesmo na ausência de esforço físico óbvio. A fadiga patológica representa um nível exacerbado da fadiga comum, podendo ser desencadeada por condições médicas subjacentes generalizadas (LARKIN, MARTIN, 2017). A relação entre fadiga e estresse é complexa e passa por mudanças significativas durante a transição da menopausa. A fadiga crônica é considerada uma condição relacionada ao estresse, envolvendo várias disfunções sistêmicas que afetam a homeostase e prejudicam a capacidade das mulheres de se recuperarem da fadiga e do estresse (CONVERSO et al., 2019).
Sob o ponto de vista de Meyer et al. (2016), as pesquisas sobre a fadiga específica da menopausa, definida principalmente pelo reconhecimento dos sintomas associados à transição da menopausa em vez de ser atribuída à insônia ou depressão, são relativamente limitadas. No entanto, as evidências indicam uma forte associação entre a fadiga na menopausa e a presença de sentimentos negativos, como humor deprimido e estresse percebido, durante esse período.
Ainda, de acordo com Meyer e seus colaboradores (2016), é importante que mulheres menopausadas recebam intervenções específicas para promover processos de recuperação energética, uma vez que, estudos demonstram que a fadiga específica da menopausa pode ser aliviada por meio de tratamentos, que sejam agentes promotores da vigília e estimulantes do sistema nervoso central.
A primeira revisão sistemática envolvendo a menopausa e o risco de desenvolver depressão e ansiedade foi realizada por Alblooshi, Taylor e Gill (2023). Os autores, após o estudo concluíram que, tanto as flutuações diretas nos níveis de hormônio esteroide durante a transição da menopausa, quanto os fatores biopsicossociais são importantes na depressão associada à menopausa. A seguir, uma descrição dos principais achados na pesquisa.
O estudo Women’s Health Across the Nation, revelou que estar na perimenopausa aumenta significativamente o risco de recorrência de transtorno depressivo maior (TDM), mas não de TDM novo, em comparação com o estado pré-menopausal. Estar na perimenopausa mais que dobrou o risco de depressão durante o período de acompanhamento, em comparação com o estado pré-menopausal (BROMBERGUER et al., 2015). Freeman et al. (2006), observaram, em sua pesquisa, um aumento de quatro vezes na incidência de depressão em mulheres sem histórico prévio de depressão durante a transição para a menopausa, em comparação com o estado pré-menopausa. Além disso, foi constatado que o diagnóstico de TDM tinha mais que o dobro da probabilidade de ocorrer em mulheres sem histórico de depressão pré-menopausa.
Pesquisa realizada por Mulhall, Andel e Anstey (2018), mostrou que estar na perimenopausa estava correlacionado a um aumento significativo no risco de sintomas depressivos em comparação com a pré-menopausa. Além disso, foi observado que mulheres na perimenopausa apresentavam um risco aumentado de desenvolver depressão e ansiedade, mesmo sem histórico anterior de transtorno depressivo ou ansiedade.
A Universidade de Harvard conduziu um estudo o qual revelou que mulheres na pré menopausa, sem histórico anterior de Transtorno Depressivo Maior, apresentaram quase o dobro de probabilidade de desenvolver sintomas depressivos durante a perimenopausa, em comparação com aquelas sem registro prévio de depressão (COHEN et al., 2006). Da mesma forma, o Projeto de Saúde das Mulheres na Meia-idade de Melbourne constatou que mulheres durante a transição para a menopausa e na fase inicial da pós-menopausa tinham um risco aumentado de manifestar sintomas depressivos e variações de humor em comparação com aquelas em estágios mais avançados da pós-menopausa (CAMPBELL et al., 2017).
Pimenta e colaboradores (2012), demonstraram que mulheres na fase de transição para a menopausa (perimenopausa) apresentaram níveis significativamente mais altos de sintomas psicológicos em comparação com mulheres na fase anterior à menopausa (pré-menopausa). Por outro lado, Almeida et al. (2016), observaram que o estado reprodutivo não teve impacto na prevalência de TDM, mas identificaram que, quando comparada à fase pré-menopausa, a perimenopausa esteve associada a um maior risco de desenvolver sintomas depressivos.
A prevalência de depressão e/ou ansiedade após a menopausa foi examinada em vinte e dois estudos, dos quais cinco identificaram um aumento significativo na prevalência desses distúrbios em mulheres na fase pós-menopausa. Um estudo transversal realizado na Itália mostrou que os sintomas depressivos foram significativamente mais frequentes em mulheres após a menopausa em comparação com aquelas na fase pré-menopausa (AMORE et al., 2007).
Um estudo prospectivo longitudinal conduzido em Nova Jersey, EUA, indicou que mulheres deprimidas enfrentam maiores desafios para lidar com os sintomas e as mudanças físicas durante a transição da menopausa. Além disso, aquelas que experimentam sintomas mais intensos da menopausa tinham maior probabilidade de desenvolver sintomas depressivos durante essa fase de transição (STRAUSS, 2011). Juang e consócios (2005), observaram uma relação significativa entre depressão, ansiedade e a presença de fogachos, uma parte dos sintomas vasomotores, tanto em mulheres na perimenopausa quanto na pós-menopausa. Essa associação permaneceu estatisticamente significativa mesmo após considerar o nível educacional e a presença de insônia.
Como se pode observar, segundo Alblooshi, Taylor e Gill (2023), um dos principais fatores de risco para a depressão durante a menopausa foi identificado como uma história prévia de doença depressiva, indicando uma recorrência da depressão existente. Os sintomas vasomotores, como insônia e fogachos, mostraram uma forte associação com o surgimento de novos casos de depressão e ansiedade, bem como com a reativação de episódios depressivos anteriores. Além disso, eventos sociais adversos recentes ou estressores da vida cotidiana, juntamente com uma predisposição prévia à depressão e ansiedade, como o neuroticismo, foram identificados como fatores que aumentam o risco de desenvolver depressão durante a menopausa.
4.3.7 A menopausa e a sexualidade
As mudanças fisiológicas que ocorrem durante a menopausa e afetam a resposta sexual são principalmente influenciadas pelo estrogênio. Um dos efeitos mais notáveis ocorre na resposta ao orgasmo: a função nervosa é afetada devido à diminuição dos níveis de estrogênio durante a menopausa, o que pode resultar em um atraso na resposta do clitóris e em uma diminuição ou ausência de orgasmo (VALENÇA et al., 2020). Além disso, a falta ou atraso na lubrificação vaginal, uma diminuição na resposta sexual (como congestão reduzida ou ausente na parte externa da vagina) e contrações uterinas dolorosas (em algumas mulheres na pós-menopausa de 60 a 70 anos) podem complicar ainda mais a experiência sexual. O impacto psicológico dessas mudanças na função sexual pode ser variado e bastante perturbador tanto para as mulheres quanto para seus parceiros (DAMSTED, 2013).
Rosato et al. (2022), explicitam que, com o passar do tempo, os níveis de andrógenos em mulheres na pós-menopausa diminuem. O efeito desse declínio na libido varia de acordo com a sensibilidade biológica individual da mulher à testosterona, sua história sexual e diversos outros fatores. Cerca da metade das mulheres na pós-menopausa continua a produzir quantidades consideráveis de testosterona pelos ovários, enquanto a outra metade tem uma produção ovariana insignificante desse hormônio. Nas mulheres na pós-menopausa que ainda produzem testosterona, os níveis desse hormônio podem ser cerca de 50% mais baixos do que nas mulheres mais jovens na pré-menopausa. O tecido estromal ovariano na pós-menopausa é responsável pela secreção de testosterona, embora produza pouca ou nenhuma androstenediona.
A investigação clínica em mulheres que experimentaram a interrupção da produção ovariana de testosterona tem proporcionado evidências sobre o impacto desse hormônio na libido feminina. Um estudo amplamente reconhecido, conduzido por Sherwin, explorou os efeitos no humor, na memória e na libido antes e depois da ooforectomia cirúrgica em mulheres sem histórico de distúrbios depressivos. Os resultados revelaram que mulheres na menopausa cirurgicamente induzida, que receberam terapias contendo estrogênio testosterona, relataram níveis superiores de desejo e excitação sexual, assim como uma frequência aumentada de fantasias sexuais, em comparação com aquelas tratadas apenas com estrogênio ou placebo após a cirurgia (SHERWIN, 1996).
Outro estudo sobre terapia de reposição hormonal em mulheres pós-menopausa comparou o uso isolado de estrogênio com a combinação de estrogênio e testosterona, observando que somente o grupo de tratamento combinado demonstrou melhorias na libido. Essas descobertas sugerem que a reposição de testosterona pode ser benéfica para a função sexual em mulheres após a menopausa, compensando a deficiência desse hormônio (DAVIS, 1999).
Para Ornat et al. (2013), os desafios fisiológicos devem ser tratados de forma independente da presença de doença psiquiátrica, pois ambos podem influenciar de maneira interconectada a libido e a atividade sexual. Por exemplo, a redução na frequência do coito devido à dor durante o sexo (dispareunia) pode ser erroneamente atribuída a problemas de relacionamento, quando, na realidade, as questões fisiológicas da menopausa podem estar contribuindo para a mudança na libido. Da mesma forma, a diminuição da libido devido a baixos níveis de testosterona pode resultar em conflitos conjugais semelhantes, levando os profissionais de saúde a diagnosticar erroneamente um problema psicológico como a causa principal da falta de desejo sexual.
Ainda, em conformidade com o autor supracitado, muitos medicamentos usados para tratar condições psiquiátricas podem ter como efeito colateral a redução da libido ou a dificuldade em alcançar o orgasmo. Considerando que a depressão e os transtornos de ansiedade são mais comuns em mulheres e frequentemente não são tratados, é provável que transtornos psiquiátricos coexistentes possam surgir em pacientes de meia-idade. (ORNAT, et al., 2013).
Não se pode obliterar que as influências culturais exercem uma função crucial na autopercepção feminina, podendo afetar tanto sua psicologia quanto seu desejo sexual. As posturas sociais em relação à sexualidade na fase madura da vida têm um efeito considerável no modo como as mulheres se comportam. A importância dada à expressão da sexualidade feminina pode mudar após a menopausa, dependendo das normas culturais e sociais predominantes (VALENÇA, 2010).
Assim, as variações no desejo e na performance sexual durante o climatério podem ser resultado de diversos fatores, como alterações anatômicas e fisiológicas, condições psicológicas, problemas na relação conjugal ou uma combinação destes elementos. Para uma intervenção efetiva, é fundamental realizar uma avaliação detalhada dos aspectos que influenciam a sexualidade e adotar uma abordagem terapêutica integrada. Ao personalizar o tratamento de acordo com as necessidades individuais, as mulheres na fase madura podem descobrir maneiras de aprimorar sua vida sexual, se assim desejarem (ORNAT, et al., 2013).
4.3.7.1 A saúde sexual feminina
A sexualidade humana é influenciada por uma variedade de fatores, que incluem aspectos psicológicos, biológicos, relacionais e socioculturais. Essa complexidade é ainda mais pronunciada no caso das mulheres. A resposta sexual feminina é notadamente intrincada, resultante da interação entre respostas neuroemocionais, busca por intimidade emocional e variações significativas nos níveis hormonais (VIGNOZZI, MASEROLI, 2019). A saúde sexual é definida como um estado de bem-estar físico, emocional, mental e social relacionado à sexualidade. Vai além da simples ausência de disfunção ou doença. A Organização Mundial da Saúde reconhece a sexualidade feminina não apenas como um aspecto crucial da saúde da mulher, mas também como um direito humano fundamental (WHO, 2002).
Embora muitas vezes se assuma que as mulheres perdem o interesse sexual após a menopausa, a realidade é que a sexualidade continua a ser um aspecto moderadamente ou extremamente importante para muitas mulheres na meia-idade. No entanto, é preocupante que uma parcela muito pequena delas tenha relatado discutir seus problemas sexuais em um contexto médico, em comparação com os homens (DAMSTED, 2013).
É amplamente reconhecido que a função sexual tende a deteriorar-se com o avanço da menopausa, independentemente da idade. Os sintomas mais comumente relatados incluem baixo desejo sexual (40–55%), falta de lubrificação vaginal (25–30%) e dispareunia (12–45%), que é uma das complicações da síndrome geniturinária da menopausa (DAMSTED, 2013). A disfunção sexual nessa fase da vida é influenciada por uma ampla gama de fatores predisponentes, precipitantes e mantenedores, que podem ter origens biológicas, psicológicas e socioculturais (GRAZIOTTIN, LEIBLUM, 2005).
Na verdade, as mulheres mais velhas enfrentam barreiras adicionais para acessar informações e assistência profissional relacionadas à sexualidade, o que resulta na busca e no recebimento raro de tratamento adequado. Infelizmente, essas barreiras frequentemente incluem inadequações e deficiências por parte dos provedores de saúde, como falta de tempo, falta de conhecimento específico, preocupações com sua própria confiança e habilidades, medo de causar desconforto, desconforto pessoal e estereótipos sobre a falta de necessidades e comportamentos sexuais adequados para a idade (CARUSO, RAPISARDA, CIANCI, 2016).
Pesquisas realizadas por Avis et al. (2000) e Nappi (2008) documentaram a prevalência de queixas sexuais de mulheres na menopausa em diferentes continentes ao longo das últimas duas décadas. Em estudo observacional prospectivo de Dennerstein, Dudleye, Burger (2001), com mais de 430 mulheres australianas (idades entre 45 e 55 anos), foram observadas mudanças significativas na função sexual, incluindo diminuição da capacidade de resposta sexual, frequência sexual reduzida, aumento da secura vaginal e problemas com os parceiros, com uma queda significativa associada à idade e à menopausa. Durante a transição da menopausa, a prevalência de disfunção sexual variou entre 42% e 88%.
Figura 9 – Fatores que possivelmente afetam a função sexual na menopausa
Fonte: Graziottin e Leiblum (2005)
Avis et al. (2000) observaram que as mulheres na pós-menopausa relataram menos desejo sexual do que aquelas na pré-menopausa. Similarmente, tanto as mulheres na peri quanto na pós-menopausa relataram menos excitação em comparação com quando estavam na faixa dos 40 anos. Por fim, dados de um inquérito europeu com 1.805 mulheres na pós menopausa (entre 50 e 60 anos) mostraram que 34% delas se queixaram de redução do desejo sexual, 53% manifestaram menos interesse em sexo, e 71% afirmaram que manter uma vida sexual era importante (NAPI, 2008).
Worsley et al. (2017), alertam que, embora estudos populacionais indicam que muitas mulheres enfrentam uma diminuição no funcionamento sexual durante o envelhecimento e a transição da menopausa, esse não é o caso para todas as mulheres. Além disso, é crucial entender como os aspectos psicossociais e o ambiente hormonal influenciam na manutenção de uma vida sexual saudável durante a menopausa.
4.3.7.2 Síndrome geniturinária da menopausa
A síndrome geniturinária (SG) da menopausa, anteriormente denominada atrofia vulvovaginal, é uma condição que engloba uma série de sinais e sintomas decorrentes da deficiência de estrogênio no trato geniturinário feminino, abrangendo a vagina, os lábios, a uretra e a bexiga. Estes sintomas incluem secura, queimação e irritação na região genital, bem como problemas urinários como disúria, noctúria, urgência e infecções do trato urinário recorrentes, além de sintomas sexuais como dor durante a relação sexual e falta de lubrificação. Embora seja mais comum em mulheres durante a menopausa, pode também ocorrer em outras situações de baixos níveis de estrogênio (PORTMAN, GASS, 2014).
Cagnatti et al. (2019) apontam que, a SGU da menopausa afeta mulheres durante e após a menopausa, com incidência variando de 36% a quase 90%. Este problema também é observado em anos anteriores à menopausa, com uma taxa de 19% em mulheres entre 40 e 45 anos. Diferentemente de outros sintomas da menopausa, que costumam ser temporários e diminuem ao longo do tempo. Há uma tendência a se agravar com a idade e a prolongar-se com períodos mais longos de baixos níveis de estrogênio, caso não seja tratada de maneira apropriada. Os sinais clínicos incluem redução do turgor e da elasticidade vaginal, diminuição dos pequenos lábios, perda de rugas vaginais, palidez, vermelhidão, aumento da fragilidade vaginal com hematomas e pequenos pontos vermelhos (DIBONAVENTURA et al., 2015).
A identificação da condição é principalmente clínica e conduzida através de uma anamnese e de um exame ginecológico. Os sintomas mais frequentemente associados à atrofia genital incluem ressecamento vaginal (55%), dor durante a relação sexual (44%) e irritação genital (37%), os quais podem afetar significativamente a função sexual (59%) (KINGSBERG et al., 2013).
Ainda, conforme Kingsberg et al. (2013), o diagnóstico é principalmente clínico e feito através da entrevista médica e do exame ginecológico. Os sintomas mais frequentes da atrofia genital incluem secura vaginal (55%), dor durante o sexo (44%) e irritação genital (37%), afetando a função sexual em 59% dos casos. É imprescindível que os médicos investiguem ativamente essas queixas durante a anamnese, pois, como mencionado anteriormente, muitas mulheres podem não mencionar esses sintomas por conta própria. Além disso, é possível realizar medições do pH vaginal utilizando uma fita colorimétrica, bem como avaliar o Índice de Saúde Vaginal e o Índice de Maturação Vaginal (FEBRASGO, 2022).
Para aliviar os sintomas leves e moderados da Atrofia Genital Específica durante a menopausa, as terapias de primeira linha recomendadas são o uso de lubrificantes e hidratantes. Os lubrificantes podem reduzir a dor e facilitar a penetração vaginal, minimizando o atrito durante o ato sexual. Embora possam aliviar o desconforto vaginal e aumentar o prazer sexual, não são capazes de reverter as alterações atróficas da mucosa vaginal (EDWARDS, PANAY, 2016). Já os hidratantes vaginais, ao contrário dos lubrificantes, devem ser utilizados regularmente, de duas a três vezes por semana. Eles contêm um polímero que adere à parede vaginal por até três dias, liberando gradualmente moléculas de água para o tecido vaginal. Esses produtos são bioadesivos e podem conter ácidos como poliacrílico, hialurônico ou policarbofila. Alguns hidratantes também incluem ácido lático para ajustar o pH vaginal (SANTOS et al., 2021).
Em relação aos sintomas persistentes, o tratamento mais eficaz para essa condição é a administração de terapia estrogênica vaginal, que promove o restabelecimento do trofismo vulvovaginal. No Brasil, as opções disponíveis para uso vaginal incluem o 17-β-estradiol, o promestrieno e o estriol. Recomenda-se uma aplicação intravaginal inicial à noite durante 14 dias, seguida de uma aplicação de manutenção duas a três vezes por semana enquanto os sintomas persistirem. Além disso, as terapias baseadas em energia, como laser e radiofrequência, são outra opção a ser considerada (FEBRASGO, 2022).
Isto posto, o diagnóstico da síndrome geniturinária da menopausa é essencial, pois pode ter um impacto significativo na qualidade de vida das mulheres; sendo preciso que os profissionais de saúde sejam proativos ao questionar sobre a presença de sintomas durante a anamnese e prescrever tratamento quando indicado.
4.3.8 O câncer de mama e a menopausa: riscos e prevenções
O câncer de mama representa um grande desafio para a saúde pública e é o tipo mais comum de câncer entre as mulheres globalmente. No Brasil, é a principal causa de mortalidade por câncer entre as mulheres, com variações regionais significativas. Em 2021, a taxa de mortalidade ajustada por idade foi de 11,71 óbitos a cada 100.000 mulheres, com base na população mundial (INCA, 2023).
A menopausa não causa câncer de mama. No entanto, o risco de desenvolver câncer de mama aumenta com a idade. É mais comum em pessoas com mais de 50 anos que já passaram pela menopausa (8 em cada 10 casos) em comparação com outras faixas etárias. À medida que se envelhece, mutações podem potencialmente acumular-se nas células, incluindo aquelas que podem aumentar o risco de cancro da mama. Além disso, na pós menopausa, o estrogênio é produzido principalmente pelo tecido adiposo, que constitui uma proporção maior do seio. Isso significa que os níveis de estrogênio na mama podem ser mais elevados, o que pode aumentar o risco de câncer de mama (HEER et al., 2020).
De acordo com Silva (2020), é fundamental compreender os fatores de risco específicos associados à menopausa, bem como implementar medidas preventivas para diminuir a probabilidade de desenvolvimento desse câncer. Para Guedes et al. (2020), as abordagens preventivas podem abranger desde a adoção de um estilo de vida saudável, com alimentação balanceada e prática regular de exercícios, até a avaliação de opções médicas, como a terapia de reposição hormonal. Contudo, é importante ressaltar que cada mulher é única, e a estratégia mais adequada deve ser personalizada, considerando seu histórico médico, fatores de risco individuais e preferências pessoais.
Como já exposto, é amplamente reconhecido que o risco de câncer de mama aumenta com a idade, sendo mais prevalente em mulheres após a menopausa. Essa associação sugere uma ligação entre a transição para a menopausa e o aumento desse risco (ALBUQUERQUE, 2021). Guedes et al. (2020) ressalta que os hormônios desempenham um papel crucial nessa relação. A exposição prolongada a níveis elevados de estrogênio e progesterona durante a vida reprodutiva está correlacionada com um maior risco de câncer de mama. Também, o histórico familiar de câncer de mama é outro fator crucial a ser considerado. O autor menciona que mulheres com parentes de primeiro grau afetados pela doença têm um risco aumentado, sugerindo uma possível predisposição genética (ALVES et al., 2021).
No contexto da prevenção, Azevedo et al. (2021) explanam que há consenso sobre a importância de adotar um estilo de vida saudável. Isso envolve manter um peso adequado, praticar atividade física regularmente, seguir uma dieta equilibrada, limitar o consumo de álcool e evitar o tabagismo. De igual forma existe um entendimento claro sobre a importância de manter um estilo de vida saudável. Isso envolve manter um peso adequado, praticar atividades físicas regularmente, adotar uma dieta equilibrada, limitar o consumo de álcool e evitar o tabagismo (DINIZ, 2021).
Para Guedes et al. (2020), o rastreamento mamográfico regular é considerado fundamental para a detecção precoce do câncer de mama, o que, por sua vez, melhora as chances de tratamento bem-sucedido. Programas de rastreamento eficazes, especialmente direcionados a mulheres após a menopausa, são enfatizados em vários estudos. Lima et al. (2020) complementam acordando que o rastreamento mamográfico regular é uma ferramenta essencial para a detecção precoce do câncer de mama e, consequentemente, para um tratamento mais eficaz. Muitos estudos ressaltam a necessidade de programas de rastreamento apropriados, especialmente para mulheres após a menopausa.
A detecção precoce do câncer de mama é mais desafiadora em mulheres pré menopausadas devido à densidade mamária, resultando frequentemente na identificação de cânceres em estágios mais avançados. Por último, os desfechos da doença em mulheres afetadas pelo câncer de mama variam entre pacientes mais jovens e mais velhas. Portanto, investigar o impacto do câncer de mama e suas tendências em relação ao status menopausal é crucial para orientar iniciativas de prevenção, detecção e planejamento de cuidados de saúde (HEER et al., 2020). Como expõe Diniz (2020), em termos de conscientização e educação, muitas mulheres não estão cientes dos riscos e das medidas preventivas disponíveis. Portanto, programas de educação e conscientização desempenham um papel crucial na disseminação de informações precisas.
Para Heer et al. (2020), distinguir o ônus do câncer de mama pelo status menopausal é importante por várias razões. Em primeiro lugar, este tumor hormonal da glândula mamária apresenta características moleculares únicas e causas distintas em idades pré e pós menopausais. Por exemplo, enquanto o excesso de peso corporal é um fator de risco para o câncer de mama pós-menopausa, a relação com o câncer pré-menopausa é menos clara, com algumas pesquisas sugerindo uma associação inversa. Em segundo lugar, os diferentes subtipos moleculares do câncer de mama (que se diferenciam em termos de fatores de risco, manejo terapêutico e prognóstico) também apresentam perfis de incidência distintos em relação à idade no momento da menopausa; e, por fim, no quesito de saúde pública e atendimento aos pacientes, há uma grande discrepância no tamanho das populações femininas em risco de câncer de mama pré e pós-menopausa entre os países, influenciada pelas características demográficas da população.
Devido a isso, os autores supracitados realizaram o primeiro estudo que investigou e avaliou a carga global de incidência e mortalidade por câncer de mama em 2018 e as tendências de incidência ao longo de um período de 15 anos. Para isso incluíram, na pesquisa, mulheres diagnosticadas com câncer de mama invasivo, definido com o código CID-10 C50, classificando o status menopausal através da idade no momento do diagnóstico ou da morte como um proxy, pois os registros de câncer não obtêm rotineiramente informações sobre a menopausa. Foram definidos casos e mortes pré menopausa como aqueles que surgiram em mulheres com menos de 50 anos; casos e mortes pós-menopausa foram classificados como aqueles que ocorreram a partir dos 50 anos de idade.
No total, aproximadamente 2,1 milhões de casos de câncer de mama foram diagnosticados em mulheres em todo o mundo em 2018, resultando em uma Taxa de Incidência Padronizada por Idade (TIPI) de 19,7 casos de câncer de mama na pré menopausa por 100.000 e 152,6 casos na pós-menopausa por 100.000 mulheres. Em países de baixa e média renda, foi observado um peso significativo do câncer de mama pré menopausa. Por exemplo, mais da metade (55,2%) de todos os casos de câncer de mama em países com baixo Índice de Desenvolvimento Humano (IDH) ocorreram em mulheres pré menopausa; essa proporção diminuiu à medida que o nível de desenvolvimento aumentou, com apenas 20,7% dos casos de câncer de mama ocorrendo antes dos 50 anos em países com IDH muito alto. Apesar dessa redução, os países com IDH muito alto apresentaram as maiores Taxas de Incidência Padronizadas por Idade (TIPIs) tanto para câncer de mama pré menopausa (30,6 por 100.000) quanto para câncer de mama pós-menopausa (253,6 por 100.000), aproximadamente o dobro das TIPIs correspondentes em países de renda média (HEER et al., 2020).
HEER et al. (2020), observaram que os padrões de incidência do câncer de mama pós-menopausa provavelmente se devem a mudanças no estilo de vida e a fatores reprodutivos que estão diretamente ligados ao câncer de mama. Por exemplo, o risco de câncer de mama após a menopausa aumenta consideravelmente com o aumento do índice de massa corporal e da gordura abdominal.
Com o aumento da prevalência da obesidade em todo o mundo, com mais de 15% dos adultos classificados como obesos na maioria dos países, é provável que as tendências crescentes na incidência observadas neste estudo sejam o resultado do crescente impacto da obesidade como um fator de risco para o câncer em escala global (NEUHOUSER et al., 2012). Além disso, o consumo de álcool, a falta de atividade física e, embora em menor grau, o uso de terapia de reposição hormonal também contribuem para o aumento do risco de câncer de mama (YOULDEN et al., 2012).
O aumento na incidência de câncer de mama na pós-menopausa pode ser atribuído, em parte, à implementação de programas de rastreamento do câncer de mama. A crescente incidência de câncer de mama na pré-menopausa é mais desafiadora de explicar, pois os fatores de risco não são totalmente compreendidos; no entanto, é provável que os fatores reprodutivos desempenhem um papel importante. A ter menos filhos, ou nenhum, e adiar a maternidade estão associados a um menor risco de câncer de mama triplo-negativo, mas a um maior risco de câncer de mama de início precoce, especialmente tumores com receptores hormonais positivos. Esses fatores de risco reprodutivo estão se tornando mais comuns em países em transição, onde o aumento na incidência de câncer de mama na pré-menopausa tem sido mais pronunciado (HEER et al., 2020).
Compreender a conexão entre a menopausa e o câncer de mama é fundamental para capacitar as mulheres a tomar decisões bem fundamentadas sobre sua saúde durante essa fase da vida. Educação e iniciativas de promoção da saúde são fundamentais para proteger e promover o bem-estar das mulheres, permitindo que elas enfrentam a menopausa com confiança e cuidado. Ao mantermos esforços contínuos na conscientização e na pesquisa, podemos trabalhar para diminuir os riscos e garantir uma transição pela menopausa e além de forma mais saudável e tranquila.
4.4 TERAPIA DE REPOSIÇÃO HORMONAL NA MENOPAUSA
Como mencionado ao longo deste trabalho, a menopausa é comumente associada a uma variedade de sintomas físicos e mentais desagradáveis, incluindo ondas de calor, suores noturnos, insônia, ansiedade, depressão, diminuição da libido, secura vaginal e dificuldade de concentração. Cerca de 80% das mulheres na menopausa experimentam esses sintomas, sendo que as ondas de calor e os suores noturnos afetam aproximadamente 70% das mulheres de meia-idade (AVIS et al., 2015). Isso tem um impacto significativo no dia a dia e na qualidade de vida das mulheres (STUENKEL, 2021). As diretrizes clínicas indicam que os sintomas vasomotores da menopausa geralmente duram de 6 meses a 2 anos. No entanto, novas pesquisas sugerem que, para muitas mulheres, esses sintomas podem persistir por uma década ou até mais (NAPPI et al., 2021).
Por mais de meio século, a terapia de reposição hormonal tem sido empregada para tratar mulheres na menopausa que sofrem de ondas de calor e outros sintomas associados. A TRH é reconhecida como o tratamento mais eficaz para o manejo dos sintomas vasomotores e para melhorar a qualidade de vida. Os principais hormônios utilizados na THM são o estrogênio e o progestágeno, sendo este último necessário apenas para mulheres com útero. Esses hormônios estão disponíveis em diversas formas, como comprimidos, adesivos para a pele, gel de estrogênio, implantes, entre outras opções (MEHTA et al., 2021).
A terapia hormonal é primariamente recomendada para aliviar os sintomas vasomotores e a atrofia vulvovaginal, além de prevenir a osteoporose e fraturas associadas a ela (BABER et al., 2016; WENDER et al., 2014). O manejo dos sintomas vasomotores é considerado uma razão primária para o uso da terapia hormonal (TH), especialmente em mulheres sintomáticas com menos de 60 anos e menos de 10 anos após a menopausa, uma recomendação amplamente aceita nos consensos recentes sobre TH para a menopausa. Uma revisão abrangente publicada na Cochrane Library, que analisou 24 ensaios clínicos, revelou que a terapia com estrogênio resultou em uma redução de 75% na frequência e de 87% na intensidade dos sintomas vasomotores em comparação com o placebo, independentemente da adição de progestagênio (MACLENNAN et al., 2004).
A terapia hormonal tem o potencial de melhorar o risco cardiovascular devido aos seus efeitos benéficos na função vascular, nos níveis lipídicos e no metabolismo da glicose. Dados atuais sugerem que os benefícios da terapia hormonal superam os riscos, com menos eventos de doença cardiovascular em mulheres saudáveis na peri e pós-menopausa inicial (BABER et al., 2016). Para mulheres saudáveis com sintomas e com menos de 60 anos de idade ou aquelas que estão dentro de 10 anos após a menopausa, é importante considerar os efeitos positivos da terapia hormonal na doença cardiovascular (DCV) e na mortalidade geral, em comparação com o leve aumento no risco de tromboembolismo venoso (TEV).
Pardini (2013) explica que, o grau de associação entre terapia hormonal da menopausa (THM) e câncer de mama permanece controverso. No entanto, o único dado considerado com nível de evidência A é que a administração de estrógeno isolado ou em combinação com progesterona aumenta a percentagem de densidade mamária (PMD), enquanto o raloxifeno diminui o risco de câncer de mama. O “International Breast Cancer Intervention Study” (IBIS) demonstrou uma redução de 13,7% na PMD com o uso de tamoxifeno, comparado a 7,3% no grupo placebo durante quatro anos e meio de acompanhamento. Nas mulheres que apresentaram uma redução de 10% ou mais na PMD, o risco de câncer de mama foi reduzido em 52% em comparação com o grupo placebo (p < 0,01).
Além disso, o uso da terapia hormonal parece estar associado a uma redução do risco de diabetes tipo 2, devido à diminuição da resistência à insulina não relacionada ao índice de massa corporal (IMC) (THE NAMS, 2017). No estudo WHI, foi observada uma redução significativa na incidência de diabetes, com uma queda de 19% entre as usuárias de terapia hormonal combinada e de 14% entre aquelas que usaram estrogênio isolado. Estima-se uma redução de 11 casos por 1.000 mulheres entre 50 e 59 anos após cinco anos de uso (WENDER et al., 2014).
Com o uso da terapia hormonal, houve uma redução de aproximadamente 40% na incidência de diabetes, juntamente com níveis mais baixos de glicose em jejum e hemoglobina glicada. No entanto, esses resultados não são considerados suficientes para recomendar a terapia hormonal para a prevenção primária do diabetes (THE NAMS, 2017). Portanto, para mulheres saudáveis sem doença cardiovascular estabelecida, existem evidências de benefícios cardiovasculares ao iniciar a terapia hormonal durante a transição menopausal ou nos primeiros anos após a menopausa, durante o que é chamado de “janela de oportunidade”. Por outro lado, há um aumento do risco cardiovascular quando a terapia hormonal é iniciada em mulheres com muitos anos de menopausa (WENDER et al., 2014).
Sobre a atrófica vulvovaginal, um exame da Cochrane Library (LETHABY et al., 2016), incorporando informações de 30 estudos clínicos randomizados envolvendo 6.235 mulheres, indicou que os estrogênios aplicados topicamente na vagina são mais eficazes na redução dos sintomas de atrofia vaginal em comparação com o uso de placebo ou géis não hormonais.
As evidências atuais apontam para outros benefícios da terapia hormonal, incluindo a melhora dos sintomas geniturinários, dos distúrbios da função sexual e a redução do risco de doença cardiovascular, além de uma melhor qualidade de vida para mulheres na pós menopausa. No entanto, embora esses benefícios sejam reconhecidos, eles geralmente não são considerados suficientes para recomendar o uso da terapia hormonal na ausência das indicações já estabelecidas (WENDER et al., 2014).
A terapia hormonal sistêmica ou a aplicação local de estrogênio podem melhorar a satisfação sexual ao aumentar a lubrificação vaginal, o fluxo sanguíneo e a sensibilidade da mucosa vaginal, além de reduzir a dor durante a relação sexual. No entanto, há poucas evidências que demonstram um efeito significativo da terapia hormonal no interesse sexual, excitação, orgasmo ou desejo sexual hipoativo, independentemente de seu impacto no tratamento de outros sintomas da menopausa (THE NAMS, 2017). A TH não apresentou associação com um aumento na atividade sexual, conforme indicado por uma análise secundária do estudo WHI sobre atividade sexual. Quando a terapia hormonal sistêmica é indicada para aliviar os sintomas vasomotores e a paciente relata diminuição da libido, as formulações transdérmicas são preferidas à via oral. Isso se deve ao fato de que a administração oral aumenta os níveis de globulina carreadora (NAHAS, NAHAS-NETO, 2019).
A terapia hormonal é eficaz na prevenção da perda óssea associada à menopausa e na redução da incidência de fraturas relacionadas à osteoporose, incluindo fraturas vertebrais e do quadril (BARBER et al., 2016).
Sobre isso Pardini (2014) esclarece:
O estrógeno isolado ou associado à progesterona é eficaz na prevenção da perda óssea associada à menopausa e na redução da incidência de fratura vertebral e não vertebral, incluindo pacientes de baixo risco. Embora a magnitude do declínio na renovação óssea esteja relacionada aos níveis de estrogênio, a reposição em baixas doses também tem influência positiva na massa óssea da maioria das mulheres. Com base nas evidências, a THM é a terapia de primeira linha para mulheres pós-menopausadas que apresentam alto risco de fratura e estejam abaixo dos 60 anos de idade, na presença ou não de sintomas menopausais com a mesma efetividade dos bisfosfonatos. O efeito protetor da THM sobre a densidade mineral óssea diminui após suspensão do hormônio. Iniciar a THM com dose padrão não é recomendado para fins exclusivos de prevenção de fratura após os 60 anos de idade. O raloxifeno, modulador seletivo do receptor de estrógeno, aumenta a massa óssea e reduz a incidência de fratura vertebral, mas não reduz a fratura de quadril.
Uma análise abrangente do efeito da terapia hormonal na prevenção e tratamento da osteoporose, envolvendo 57 ensaios clínicos randomizados, demonstrou que a terapia hormonal foi eficaz em manter ou melhorar a densidade mineral óssea (DMO), resultando em um aumento médio de 6,8% na DMO da coluna lombar e de 4,1% no colo do fêmur ao longo de dois anos (WELLS et al., 2002).
De acordo com os resultados do estudo WHI, o uso de terapia hormonal combinada ou de estrogênios isolados resultou em uma redução de 4,9 e 5,9 fraturas por 1.000 mulheres ao longo de cinco anos, respectivamente. Com base nesses dados, a terapia hormonal pode ser recomendada para a prevenção e tratamento da osteoporose em mulheres de alto risco antes dos 60 anos de idade ou nos primeiros anos após a menopausa (WENDER et al., 2014).
Rozenberg, Vandromme e Antoine (2013), asseveram que a terapia de reposição estroprogestativa tem sido associada à redução do risco de câncer colorretal. O mecanismo exato pelo qual isso ocorre ainda não é totalmente compreendido, embora haja várias observações indicando uma influência hormonal sobre o tecido do cólon. O estrógeno parece reduzir a concentração de ácidos biliares, que são considerados promotores de alterações malignas no cólon. Também é hipotetizado que os progestágenos possam exercer um efeito antiproliferativo no ciclo celular das células do cólon. No entanto, na prática clínica, a terapia hormonal da menopausa não deve ser prescrita com o objetivo específico de prevenir o câncer colorretal.
A existência de sintomas relacionados à menopausa está fortemente ligada a uma redução na qualidade de vida, conforme indicado por instrumentos de avaliação específicos. A terapia hormonal pode contribuir para uma melhor qualidade de vida em mulheres na fase peri e pós-menopausa que apresentam sintomas, proporcionando melhorias nos sintomas vasomotores, nas disfunções sexuais, nos distúrbios do sono e do humor (HAIS et al., 2003).
Com relação à via de administração, Pardini (2014) explica que, quando o estradiol e o progestógeno são administrados por vias não orais, evita-se o metabolismo de primeira passagem pelo fígado. Isso resulta em um menor potencial de estimulação das proteínas hepáticas, fatores de coagulação e perfil metabólico neutro, o que pode ser mais benéfico em termos de risco cardiovascular e eventos tromboembólicos. Estudos demonstraram um menor risco de tromboembolismo venoso com o uso de estradiol por via transdérmica em comparação com a via oral. No entanto, ainda não está confirmado se essa diferença se deve ao efeito distinto do estradiol sobre os fatores de coagulação sintetizados no fígado.
Por outro lado, a administração oral tem um impacto maior na redução dos níveis de colesterol LDL, o que pode ser uma vantagem para mulheres com hipercolesterolemia e triglicerídeos normais, considerando que estes últimos podem aumentar com a medicação. A administração vaginal de progestagênios resulta em concentrações locais adequadas no útero e oferece uma boa proteção endometrial, enquanto os níveis sistêmicos de progestágeno são menores. A combinação do uso não oral de estradiol com um progestágeno intrauterino pode melhorar a aderência ao tratamento e reduzir os riscos da terapia hormonal da menopausa. No entanto, são necessários estudos de alta qualidade para confirmar essa hipótese. O uso vaginal de estradiol é preferido no tratamento isolado dos sintomas urogenitais (PARDINI, 2014).
Figura 10 – Vias de administração de estrógeno
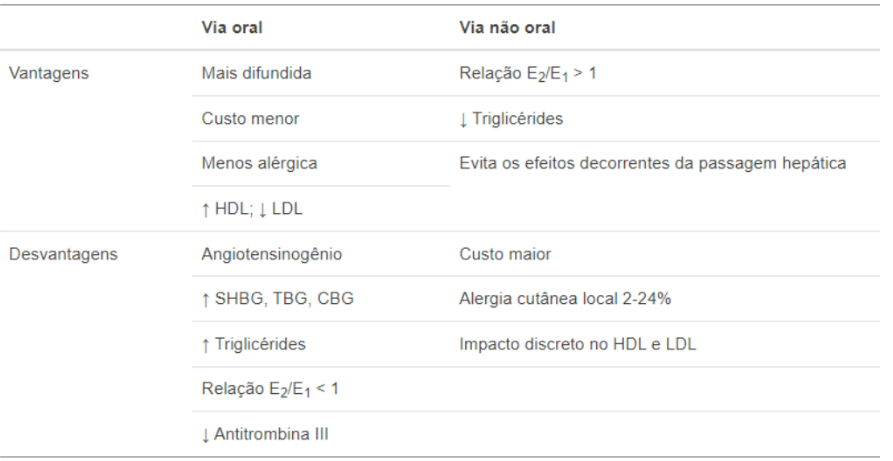
Fonte: Pardini (2014)
Araújo et al. (2007) explicam que, os estrógenos utilizados na terapia de reposição podem ser classificados em naturais e sintéticos. Os estrógenos conjugados são um tipo de hormônios naturais extraídos da urina de éguas prenhes, que são posteriormente processados para uso em mulheres. Eles incluem estradiol, estrona, sulfato de estrona e estrógenos derivados do anel B insaturado. Os efeitos biológicos dos estrógenos conjugados resultam da combinação de sulfato de estrona, sulfato de equilina e seus metabólitos. Os sintéticos incluem o etinilestradiol, mestranol, quimestrol e dietilestilbestrol. Sua eficácia elevada e forte impacto no metabolismo hepático são atribuídos à sua lenta conversão em metabólitos inativos, sendo posteriormente eliminados nas fezes e na urina na forma de sulfatos e glicuronídios.
Conforme Lente e Velasque (2015), a escolha de iniciar ou não a terapia de reposição hormonal durante a menopausa deve ser feita em conjunto pelo médico e pela paciente, levando em consideração as implicações da diminuição natural dos níveis de estrogênio, os possíveis efeitos colaterais e as contraindicações associadas a esse tratamento. Isso é importante para determinar se os benefícios superam os custos envolvidos. A principal razão para considerar a terapia hormonal na menopausa é para aliviar os sintomas comuns dessa fase, como ondas de calor e problemas genito-urinários, além de prevenir a osteoporose em pacientes com risco elevado. Se a terapia hormonal for escolhida, é essencial realizar um acompanhamento médico rigoroso ao longo do tratamento devido aos seus potenciais efeitos colaterais. No caso de a paciente optar por não utilizar a terapia hormonal, outras opções de tratamento, como fitoestrógenos, podem ser recomendadas.
4.5 BENEFÍCIOS DA FISIOTERAPIA NA MENOPAUSA
A fisioterapia na menopausa é importante na promoção da saúde e do bem-estar das mulheres que atravessam essa fase de transição. Os fisioterapeutas são profissionais especializados no tratamento dos sintomas, avaliando sua especificidade, saúde do assoalho pélvico, mobilidade, postura, qualidade do sono e uma série de outros fatores. Com base nesta avaliação, é criado um plano de tratamento personalizado (MORAIS, NASCIMENTO, SILVA, 2023).
Baracho, Almeida e Guimarães (2007) destacam que a fisioterapia tem como objetivo aprimorar a qualidade de vida durante o climatério, atuando na prevenção e tratamento da incontinência urinária, osteoporose e doenças cardiovasculares, além de aliviar os sintomas vasomotores, os distúrbios emocionais, como, problemas no sistema musculoesquelético. A menopausa geralmente causa dores e fraqueza. A fisioterapia pode reduzir esses sintomas, aumentando a força e o condicionamento físico geral, ajudando a tratar a dor e o desconforto nas articulações, permitindo que as mulheres permaneçam ativas e combatam a atrofia muscular.
Dugan et al. (2006) afirmaram em seu estudo que dores e incômodos estão significativamente e de forma independente relacionados ao estado de pós-menopausa. Mitchell e Woods (2010), em um estudo comparativo, concluíram que a gravidade da dor nas costas aumenta conforme as mulheres avançam nos estágios de transição da menopausa. Szoeke et al. (2008) observaram que a porcentagem de mulheres com dores nas costas aumentou de 44% para 59%, e que há uma relação positiva entre um índice de massa corporal mais elevado e um maior desconforto na coluna.
Os estudos mencionados indicam que mulheres com sintomas intensos da menopausa são particularmente vulneráveis à dor crônica nas costas. No entanto, pouca atenção tem sido dada à lombalgia e a diversos problemas nas articulações periféricas, que também são comuns durante este período da vida das mulheres. Além disso, a dor na coluna compromete o bem-estar mental das pacientes, pois interfere nas atividades cotidianas das mulheres (WANG, 2017; GRABOVAC, DORNER, 2019).
Para Andrade, Moreira e Santos (2023), o fisioterapeuta assume um papel fundamental na jornada contra a dor, atuando tanto na prevenção quanto no tratamento dos sintomas. Através de uma abordagem personalizada e individualizada, o profissional orienta a realização de atividades físicas, alongamentos, fortalecimento muscular, treino de marcha e equilíbrio, visando alcançar objetivos específicos para cada paciente.
Baracho (2018), aponta que, a menopausa, também, pode provocar alterações na saúde pélvica, incluindo incontinência urinária, prolapso de órgãos pélvicos e disfunção sexual. Intervenções fisioterapêuticas, como treinamento muscular do assoalho pélvico são consideradas como primeira linha de tratamento. Isso inclui, uma avaliação completa engloba diversos aspectos, como histórico clínico, análise da postura e da musculatura, observação dos padrões de movimento, além da avaliação da força, resistência muscular e mobilidade articular dos tecidos moles. No caso da avaliação do assoalho pélvico, ela se concentra na funcionalidade, equilíbrio, mobilidade e integridade dos músculos e tecidos conectivos.
Durante a avaliação, os músculos do assoalho pélvico são examinados manualmente para verificar a capacidade de contração e relaxamento, bem como a presença de pontos dolorosos. Os testes de força muscular são realizados pressionando-se o dedo contra os músculos pélvicos e observando a resistência oferecida durante as contrações. Essa resistência é geralmente avaliada usando a Escala de Oxford, que classifica a força muscular em seis níveis, desde ausência de contração a contração forte e resistente (BO, SHERBURN, 2005).
Em linhas gerais, as intervenções fisioterapêuticas visam alcançar os objetivos estabelecidos, podendo englobar uma variedade de abordagens, tais como: terapia manual; treinamento funcional (coordenação muscular, força e resistência, flexibilidade e relaxamento); aplicação de agentes mecânicos, físicos ou eletroterapêuticos; além de documentação e coordenação do tratamento (BARACHO, 2018).
De acordo com Hay-Smith (2011), no contexto da fisioterapia do assoalho pélvico, é imprescindível possuir conhecimento aprofundado sobre disfunções sexuais. O fisioterapeuta deve ser capaz de selecionar tratamentos adequados para cada paciente, levando em consideração as especificidades de cada caso. Ao optar por um determinado tratamento ou intervenção fisioterapêutica, o profissional deve estar atento à qualidade do tratamento, considerando especialmente a intensidade e as possíveis consequências do mesmo.
As terapias mais comuns para fortalecer, relaxar e tonificar os músculos do assoalho pélvico são as técnicas de terapia ativa.
Os exercícios de Kegel se tornaram amplamente conhecidos desde a década de 1950, quando o ginecologista Arnold Kegel estabeleceu a relação entre disfunções do assoalho pélvico e a fraqueza muscular perineal. Ele observou que os sintomas melhoraram significativamente, e em alguns casos desapareciam completamente, com a prática de exercícios destinados a fortalecer esses músculos. Kegel foi pioneiro no desenvolvimento do treinamento muscular do assoalho pélvico, que consiste em exercícios projetados para aumentar a força das contrações musculares perineais. A eficácia desses exercícios foi amplamente comprovada (BARACHO, ALMEIDA, GUIMARÃES, 2007).
Os exercícios de Kegel podem ser realizados de diversas maneiras, porém todos têm em comum a contração e o relaxamento repetidos dos músculos do assoalho pélvico. Essa prática tem como objetivo aumentar a força e a resistência muscular, melhorar os sintomas da dispareunia e prevenir ou reduzir a incidência de incontinência urinária e outros problemas associados (BO, SHERBURN, 2005).
Os exercícios com cones vaginais constituem um método de treinamento muscular do assoalho pélvico. Eles permitem que os pacientes desenvolvam consciência e fortaleçam a musculatura perineal por meio da contração das fibras musculares. Estes exercícios envolvem o uso de pesos em formato de cone, inseridos transvaginalmente. Cada cone possui um peso gradualmente diferente, embora tenham o mesmo tamanho, e devem ser mantidos na vagina, agindo como pequenos tambores, durante vários minutos enquanto a pessoa está em pé ou caminha (GAMEIRO et al., 2010).
Ainda, segundo os autores supracitados, após a introdução do cone na vagina, ele geralmente desce ligeiramente devido ao próprio peso. A sensação de “perda” do peso provoca uma leve contração dos músculos do assoalho pélvico, ajudando a manter o cone no lugar. Essa simples contração, combinada com o aumento gradual do peso dos cones, fortalece efetivamente os músculos do assoalho pélvico. As mulheres costumam notar melhorias no tônus muscular após 2 ou 3 semanas, e o programa completo geralmente dura de 2 a 3 meses.
O biofeedback é uma técnica utilizada durante os exercícios musculares do assoalho pélvico, onde uma máquina monitora e exibe as contrações musculares em forma de sinais gráficos ou acústicos. Isso permite que tanto o paciente quanto o fisioterapeuta recebam um retorno instantâneo do treinamento. As vantagens do biofeedback na reabilitação do assoalho pélvico são diversas. Ele ajuda a aumentar a consciência dos músculos envolvidos, permite que o paciente avalie seus próprios exercícios, motiva os pacientes durante o processo de reabilitação e pode ser adaptado de acordo com as necessidades individuais de cada pessoa (KOH et al., 2008). Focaliza principalmente nas fibras de contração lenta para promover um tônus perineal adequado e aliviar a dor, e sua introdução do nas técnicas de reabilitação do assoalho pélvico demonstrou melhorias significativas nos resultados terapêuticos, tornando-se assim uma das técnicas mais eficazes para a recuperação perineal (MORKVED, 2002).
A termoterapia envolve a aplicação local de calor acima dos níveis normais de temperatura corporal, com o objetivo de tratar os tecidos musculares. Essa técnica se baseia na lei fundamental da termodinâmica, que estabelece que o calor é a energia que movimenta as moléculas de um material. Para utilizá-la de maneira eficaz, é importante considerar que a temperatura corporal não é uniforme. Na superfície, a temperatura da pele pode variar entre 29˚C e 34˚C, dependendo da região do corpo, enquanto em níveis mais profundos, a temperatura corporal se mantém constante, em torno de 37˚C. Para otimizar a elasticidade do tecido, seria mais benéfico combinar a termoterapia com a aplicação de tensão na área afetada, especialmente se essa tensão fosse prolongada e consistente. O relaxamento muscular induzido pelo calor reduz a resistência ao alongamento dos tecidos, facilitando o processo de alongamento e aumentando a flexibilidade do colágeno. Tanto o calor quanto o alongamento influenciam o tecido conjuntivo de maneira a acelerar a síntese de colágeno (MURINA, BIANCO, RADICI, 2008).
Se a termoterapia fosse utilizada em conjunto com a corrente elétrica, seria possível aliviar a dor, relaxar e fortalecer os músculos, diminuir a inflamação e promover a regeneração de tecidos danificados, entre outros benefícios. Ultrassom, luz infravermelha e ondas curtas estão entre as terapias mais comuns empregadas nesse contexto (CASTRO et al., 2008).
Já a eletroestimulação é o uso de corrente elétrica para induzir a contração dos músculos, com o objetivo principal de melhorar a funcionalidade do assoalho pélvico. Esta técnica tem sido empregada por mais de 50 anos no tratamento da dor e da incontinência urinária. É comprovado que uma contração muscular eficaz do assoalho pélvico pode ser alcançada estimulando-se os nervos por meio de eletrodos vaginais. Além disso, teoricamente, a característica fundamental da eletroestimulação é sua capacidade de inibir o músculo detrusor por meio da contração voluntária dos músculos do assoalho pélvico (MURINA, BIANCO, RADICI, 2008).
Depressão e insônia também são sintomas da menopausa e podem afetar negativamente a saúde, bem-estar e atividades diárias, levando a um declínio na qualidade de vida geral (SANTORO et al., 2021). A depressão é um distúrbio de humor marcado por sentimentos de tristeza, perda de interesse ou prazer, além de diversos outros sintomas emocionais e físicos. Em mulheres na menopausa, a depressão ocorre devido às flutuações e à queda dos níveis de estrogênio no corpo. Pesquisas indicam que mulheres sem histórico prévio de depressão têm um risco elevado de desenvolver depressão durante a menopausa, com uma prevalência de 16% para novos casos de depressão e/ou ansiedade (AHLAWAT et al., 2019).
Além disso, a menopausa tem um impacto negativo na qualidade do sono, resultando em insônia. A insônia é um distúrbio do sono caracterizado pela dificuldade em adormecer ou manter o sono. Uma pesquisa com mais de 12.000 mulheres, realizada no estudo Saúde da Mulher ao Redor da Nação (SWAN), revelou que quase 40% das mulheres enfrentam dificuldades para dormir durante a transição da menopausa (SANTORO et al., 2021).
A fisioterapia é uma intervenção que tem sido sugerida como eficaz na melhoria da insônia e da depressão em mulheres na menopausa. Estudos realizados por Kravitz et al. (2003) e TIMUR et al. (2010) confirmaram que a fisioterapia desempenha um papel eficaz no tratamento dos sintomas da menopausa, sem efeitos adversos à saúde. Ela aumenta os níveis de hormônios como a serotonina e a concentração sérica do fator neurotrófico derivado do cérebro, reduzindo assim a depressão e melhorando o sono, sem causar alterações no estresse oxidativo.
Uma revisão anterior conduzida por Sternfeld et al. (2014) sugere que o exercício tem um efeito positivo na saúde mental, influenciando diversos mecanismos biológicos. Esses mecanismos incluem o aumento da liberação de neurotransmissores, a maior ativação parassimpática e a distração de estímulos estressantes. Como resultado, o exercício contribui para uma melhor qualidade de vida e pode aliviar os sintomas vasomotores experimentados durante a menopausa.
No estudo de Takahashi et al. (2019), vários mecanismos plausíveis foram propostos para explicar o impacto do exercício na saúde mental e nos biomarcadores de depressão. A pesquisa descobriu que o aumento da atividade física diária aumentou significativamente as concentrações do fator neurotrófico derivado do cérebro em mulheres na pós-menopausa.
Santoro et al. (2021), explicam que a qualidade de vida está estreitamente relacionada à qualidade do sono, e as mulheres na menopausa frequentemente enfrentam insônia, o que impacta significativamente sua vida diária. A conexão entre o sono e os sintomas depressivos é bem documentada, com a dificuldade para adormecer fortemente associada ao desenvolvimento subsequente de depressão.
A prática diária de atividade física por pelo menos 12 semanas ou três sessões por semana durante 6 meses pode ter um impacto positivo nas alterações de humor, depressão e saúde física em mulheres na menopausa. Além disso, incorporar uma rotina de alongamentos pelo menos cinco dias por semana, especialmente antes de dormir, pode melhorar a qualidade do sono e ter efeitos positivos nos sintomas da menopausa e depressivos (TAKAHASHI et al., 2019).
4.6 MENOPAUSA E SAÚDE ORAL
A menopausa impacta os tecidos orais de maneira semelhante à forma como afeta outros sistemas do corpo. As mudanças na cavidade oral resultam tanto do envelhecimento quanto do hipoestrogenismo. A histologia da mucosa oral é comparável à da mucosa vaginal, compartilhando também uma resposta similar aos estrogênios. Receptores de hormônios sexuais foram identificados na mucosa oral e nas glândulas salivares (THOMPSON et al., 2001; VÄLIMAA et al., 2004).
Friedlander (2002), explica que o estrogênio pode influenciar a mucosa oral de forma direta ou por meio de mecanismos neurais, afetando assim a saúde periodontal em mulheres na menopausa. Entre os problemas orais possíveis estão a redução da saliva, resultando em xerostomia, síndrome da ardência bucal, aumento na incidência de cáries, disestesia, alterações no paladar, gengivite atrófica, periodontite e osteoporose mandibular (CAO et al., 2007). A seguir, os problemas orais mais frequentes na fase da menopausa.
a) Síndrome da boca ardente
A sensação de queimação na mucosa oral é conhecida e estudada há várias décadas, como síndrome da boca ardente (SBA), uma condição comum em mulheres na pós menopausa. Os sintomas podem variar de desconforto a dor intensa. Embora várias condições, como líquen plano, candidíase e infecções virais, apresentam sintomas semelhantes, na síndrome da boca ardente a mucosa permanece essencialmente normal (MERSKEY, BOGDUK 1994). Wardrop et al. (1989), investigaram a relação entre desconforto oral e menopausa em 149 mulheres. A prevalência de desconforto oral foi significativamente maior em mulheres na perimenopausa e pós-menopausa (43%) comparado às mulheres na pré-menopausa (6%). Os resultados também revelaram uma associação entre desconforto oral e sintomas psicológicos em mulheres na menopausa. Um estudo de caso-controle realizado por Gao et al. (2009), investigou a possível ligação entre a síndrome da queimação bucal e as alterações hormonais. Os resultados revelaram que mulheres menopausadas com SBA apresentavam níveis significativamente mais altos de hormônio folículo estimulante (FSH) e níveis mais baixos de estradiol em comparação com mulheres na menopausa sem sintomas orais.
Uma pesquisa feita por Ben Aryeh et al. (1996) explorou a relação entre os sintomas da menopausa, tanto orais quanto sistêmicos, e a saúde bucal de mulheres em pré menopausa. O estudo envolveu 154 mulheres atendidas em clínicas de menopausa antes da terapia de reposição hormonal (TRH). Os resultados revelaram uma prevalência preocupante de desconforto oral entre as mulheres participantes. Aproximadamente 45% a 60% das mulheres relataram pelo menos um sintoma oral relacionado à menopausa, como boca seca, sensação de queimação, alterações no paladar e dificuldade para mastigar. O estudo também encontrou uma forte correlação entre os sintomas sistêmicos da menopausa, como ondas de calor, calafrios, insônia e alterações de humor, e os sintomas orais. As mulheres que relataram mais sintomas sistêmicos da menopausa também apresentaram maior prevalência de desconforto oral. Além disso, identificaram alterações significativas na composição da saliva das mulheres em pré-menopausa em comparação com um grupo de controle de mulheres mais jovens. Essas alterações podem contribuir para o desenvolvimento de problemas de saúde bucal, como cáries e doenças periodontais.
b) Saliva e Xerostomia
Outro sintoma frequente observado em mulheres na menopausa é a boca seca, ou xerostomia. A intensidade e a frequência desse sintoma não necessariamente correspondem à quantidade de saliva produzida pelas glândulas salivares. A saliva é crucial para a defesa contra a cárie, e a diminuição do seu fluxo pode promover a proliferação de microrganismos na boca, comprometendo a saúde bucal. As glândulas salivares possuem receptores para hormônios sexuais, e esses hormônios podem ser detectados na saliva (TIVIS et al., 2005; VÄLIMAA et al., 2004).
As taxas de fluxo salivar estão relacionadas ao nível de estrogênio no organismo. Mulheres na pós-menopausa apresentam taxas de fluxo salivar mais baixas em comparação com mulheres que ainda menstruam. Minicucci et al. (2013), conduziram um estudo sobre as taxas de fluxo salivar em mulheres na menopausa e compararam esses dados com os de mulheres na pré-menopausa. O teste de estimulação de absorção química foi utilizado para avaliar o fluxo salivar. Cada participante contribuiu com três amostras de saliva: S1, saliva não estimulada; S2, saliva inicialmente estimulada com duas gotas de ácido cítrico 2,5%; e S3, saliva superestimulada com duas gotas de ácido cítrico 2,5% a cada 30 segundos durante 2 minutos. O grupo de mulheres na pós-menopausa apresentou um fluxo salivar menor apenas nas amostras S2 e S3. Essa redução na taxa de fluxo salivar pode estar associada à ocorrência de xerostomia.
Yalcin et al. (2006), em pesquisa com 348 mulheres em uma clínica de menopausa para avaliar suas queixas bucais, identificaram a secura oral como o sintoma mais comum, sendo significativamente mais prevalente em mulheres que não faziam uso de Terapia de Reposição Hormonal (TRH). Em outra pesquisa realizada na Turquia, os autores investigaram a saliva de um grupo reduzido (n=14) de mulheres na menopausa e um número equivalente de controles na pré-menopausa. Eles observaram uma diminuição no fluxo salivar durante a menopausa, com um aumento associado quando a TRH era utilizada. No entanto, o pH salivar, os eletrólitos e as concentrações de cálcio não foram afetados por essas mudanças.
Sewón et al. (2000), também chegaram a conclusões similares. Além disso, um estudo realizado no Irã investigou a taxa de fluxo salivar e a composição em 42 mulheres na menopausa, divididas entre aquelas com e sem xerostomia (21 casos e 21 controles, respectivamente). Os resultados revelaram que a concentração média de cálcio foi significativamente maior nos casos do que nos controles (AGHA-HOSSEINI et al., 2007).
O mesmo autor e seus colaboradores conduziram um estudo caso-controle com 38 mulheres na menopausa (idade entre 41 e 77 anos) que sofriam de secura oral, comparando com um número igual de controles assintomáticos. A análise das concentrações salivares de beta-estradiol revelou que os casos apresentavam concentrações hormonais significativamente mais baixas em comparação com os controles (AGHA-HOSSEINI et al., 2009). E, ainda em outra pesquisa, Agha-Hosseini et al. (2011) investigaram a relação entre a densidade mineral óssea (DMO) da coluna lombar e a secura oral em 60 mulheres na menopausa. Eles observaram uma correlação negativa significativa entre a DMO e a xerostomia.
c) Menopausa e Saúde Periodontal
Mascarenhas et al. (2003) explicam que o periodonto é composto por estruturas de suporte dos dentes, incluindo gengiva, ligamento periodontal, cemento e osso alveolar. Os hormônios esteroides sexuais desempenham um papel fundamental na saúde do periodonto, influenciando os mediadores inflamatórios, a permeabilidade vascular e o crescimento e diferenciação de fibroblastos. Nos tecidos periodontais, os osteoblastos e os fibroblastos possuem receptores de estrogênio, que respondem a diferentes níveis hormonais em diversos estágios da vida reprodutiva, impactando assim a saúde do periodonto. A incidência e a gravidade da doença periodontal são mais comuns em mulheres na pós-menopausa, e diversos fatores contribuem para esse aumento (YALCIN et al. 2006). Scardina e Messina (2012), investigaram a microcirculação oral em 27 mulheres pós-menopáusicas e compararam com um grupo controle. Seu estudo revelou diferenças significativas entre os casos e os controles em parâmetros vasculares, como diâmetro das alças, tortuosidade dos vasos na mucosa labial e densidade da mucosa periodontal, todos os quais aumentam a predisposição para a inflamação.
A osteoporose, caracterizada pela diminuição da densidade mineral óssea (DMO) e fragilidade óssea, não se limita ao esqueleto esquelético. Evidências científicas demonstram uma forte correlação entre a osteoporose sistêmica e a perda óssea alveolar, a estrutura óssea que sustenta os dentes (FRIEDLANDER, 2002). Um estudo realizado por Kribbs em 1990, corrobora a relação entre osteoporose e perda dentária. Ficou constatado que mulheres com osteoporose avançada apresentavam um risco três vezes maior de perder dentes em comparação com mulheres sem a doença.
A reabsorção óssea alveolar, o processo natural de remodelação óssea após a extração dentária, pode ser mais intensa em mulheres na pós-menopausa em comparação com mulheres na pré-menopausa. Pesquisas demonstram essa tendência, mas os resultados ainda são inconsistentes, necessitando de mais pesquisas para uma conclusão definitiva (IMIRZALIOGLU et al., 2012). Alguns estudos, como o de Bergström et al. (2010), observaram uma reabsorção óssea alveolar significativamente maior em mulheres na pós- menopausa em comparação com mulheres na pré-menopausa. Outros, como a de Ortman et al. (2002), não encontraram um efeito significativo da menopausa na reabsorção óssea alveolar após a extração dentária.
Um estudo transversal realizado por Sultan e Rao (2014) investigou a relação entre osteopenia na menopausa e doença periodontal em 80 mulheres na pós-menopausa com periodontite crônica generalizada. O estudo envolveu a avaliação de diversos parâmetros periodontais e ósseos. Os autores realizaram um exame periodontal completo, incluindo o índice de placa (quantidade de placa bacteriana presente na superfície dos dentes), o índice gengival (inflamação e sangramento da gengiva) e a perda clínica de inserção (reabsorção do tecido ósseo que sustenta os dentes). Essa pesquisa revelou que a idade da paciente, o tempo decorrido desde a menopausa e o índice de massa corporal (IMC) apresentavam uma correlação significativa com a DMO (densidade mineral óssea), medida através da radiografia de mão e punho. No entanto, a perda clínica de inserção e a perda óssea alveolar, indicadores da doença periodontal, não apresentaram correlação significativa com a DMO.
d) TRH e saúde oral
A literatura científica também foi explorada para investigar os benefícios da terapia de reposição hormonal (TRH), com estrogênio e progestógeno, no tratamento de sintomas e sinais orais em mulheres na pós-menopausa. Um estudo realizado por Volpe et al. (2000), avaliou o efeito dos estrogênios conjugados na melhora dos sintomas orais em mulheres na pós-menopausa. As participantes relataram desconforto oral, e os resultados demonstraram que a TRH com estrogênios conjugados proporcionou uma melhora significativa em mais de 50% das pacientes, tanto em sintomas subjetivos (relato das pacientes) quanto em sinais objetivos (observações clínicas).
A relação entre a menopausa e o desconforto oral é complexa e nem todas as mulheres experimentam os mesmos sintomas. Estudos como o de Forabosco et al. (2003), demonstram que a efetividade da terapia de reposição hormonal (TRH) no tratamento do desconforto oral na menopausa pode variar entre as mulheres. Os resultados indicaram que a TRH foi eficaz na melhora dos sintomas em apenas algumas pacientes, sugerindo que a relação entre o desconforto oral e a falta de estrogênio pode ser individualizada.
Tarkkila et al. (2002), investigaram a prevalência de sintomas orais autoavaliados em mulheres na menopausa. O estudo envolveu 3.173 mulheres e utilizou um questionário para avaliar a presença e a intensidade de boca seca e dor na boca. Foi observado em 40% das mulheres o sintoma de boca seca e 15% a consideraram um problema grave. A dor na boca foi relatada por 25% das participantes, sendo 8% considerado um problema grave. A pesquisa também teve foco no efeito da terapia de reposição hormonal (TRH) com estrogênio no tratamento dos sintomas orais. No entanto, os resultados não demonstraram um efeito significativo da TRH na prevenção ou melhora da boca seca ou da dor na boca.
Yalcin et al. (2007), avaliou o pH salivar e os níveis de eletrólitos em mulheres na pós-menopausa com ou sem TRH. Os resultados não demonstraram diferenças significativas entre os grupos, sugerindo que a TRH não influencia esses parâmetros salivares de forma direta. O estudo também investigou o efeito de suplementos de alendronato (medicamento para osteoporose) e cálcio na saliva das mulheres. Novamente, não foram observadas alterações nos parâmetros salivares com o uso dos suplementos isoladamente.
Um ponto interessante do estudo é que a combinação de TRH com alendronato e cálcio apresentou um efeito positivo no fluxo salivar das mulheres que relataram sintomas orais. Essa sinergia entre os diferentes tipos de tratamento sugere que uma abordagem multifacetada pode ser mais eficaz no manejo dos sintomas orais relacionados à menopausa (YALCIN et al., 2007).
Em outro estudo com 190 mulheres, López-Marcos et al. (1999), observaram impacto da TRH na saúde periodontal. Em investigação realizada por Ueda et al. (2000) com 330 mulheres na pós-menopausa, sugeriu-se que o estrogênio pode fortalecer a inserção periodontal, diminuindo a perda óssea e aumentando a retenção dentária, com correlação positiva entre tempo de uso da TRH e número de dentes remanescentes. Em acompanhamento de 2 anos realizado por Tarkkila et al. (2005), observou-se que a TRH reduziu a presença de patógenos periodontais (Porphyromonas gingivalis e Tannerella forsythia), mas não se correlacionou com o estado periodontal geral.
Relevante citar um estudo abrangente feito por Allen et al. (2013), o qual investigou a relação entre terapia de reposição hormonal, a osteoporose e os custos do atendimento odontológico em mulheres na pós-menopausa. A análise, que incluiu 20 estudos e 13.735 participantes, revelou que a TRH pode ter um papel significativo na redução de custos odontológicos para mulheres com osteoporose na pós-menopausa. O estudo observou que mulheres na pós-menopausa com osteoporose que não faziam uso da TRH apresentavam uma incidência significativamente maior de resultados dentários adversos, como perda óssea alveolar, perda dentária e doenças periodontais.
As mulheres na pós-menopausa com osteoporose que não faziam uso da TRH também incorreram em custos de atendimento odontológico mais elevados em comparação com aquelas que recebiam TRH. Essa diferença nos custos pode ser atribuída à maior necessidade de tratamentos odontológicos para lidar com os resultados dentários adversos mais frequentes nesse grupo. Os resultados sugerem que a terapia de reposição hormonal pode ser uma ferramenta útil para reduzir o risco de problemas dentários e os custos associados ao tratamento desses problemas (ALLEN et al., 2013).
CONCLUSÃO
Como se pôde observar no presente estudo, a menopausa é uma fase natural na vida de uma mulher, geralmente ocorrendo entre os 45 e 55 anos de idade, marcada pela interrupção da menstruação devido à diminuição dos hormônios femininos, como estrogênio e progesterona. Durante esse período de transição, várias características, sintomas e opções de tratamento podem surgir.
Os sintomas da menopausa podem variar em intensidade e duração de mulher para mulher. Fogachos, caracterizados por uma sensação súbita de calor intenso que irradia pelo corpo, acompanhada frequentemente de sudorese e palpitações cardíacas, são comuns. Além disso, alterações de humor, problemas de sono, secura vaginal e mudanças na libido também são sintomas frequentes relatados durante a menopausa.
Existem várias opções de tratamento disponíveis para aliviar os sintomas da menopausa. A terapia hormonal de reposição (TRH) é uma opção comum para aliviar fogachos, secura vaginal e alterações de humor, e continua sendo uma modalidade terapêutica dominante na medicina climatérica. A principal habilidade médica é a capacidade de escolher a preparação ideal de TRH para um determinado paciente. Essa escolha é baseada na compreensão dos vários efeitos clínicos e metabólicos da terapia de reposição hormonal, dependendo da composição, dosagem e método de aplicação.
Além da TRH, medicamentos não hormonais, como antidepressivos e medicamentos para pressão arterial, podem ser prescritos para aliviar sintomas específicos. Mudanças no estilo de vida, como dieta balanceada, exercícios regulares, redução do estresse e cessação do tabagismo, também são recomendadas para ajudar a reduzir os sintomas e melhorar a qualidade de vida durante a menopausa.
Um processo terapêutico extremamente importante para mulheres na menopausa é a fisioterapia. Ela ajuda a mitigar os sintomas físicos e emocionais associados a essa fase, como dores musculares, rigidez e fadiga, que podem afetar negativamente o bem-estar geral. Além disso, a prática regular de exercícios fisioterapêuticos pode melhorar a mobilidade e a força muscular, facilitando a realização das atividades diárias e promovendo uma sensação de autonomia e confiança. De igual forma, a fisioterapia desempenha um papel importante na regulação hormonal, através de exercícios específicos que podem aumentar os níveis de serotonina e de fator neurotrófico derivado do cérebro, ambos associados à melhora do humor e à redução dos sintomas depressivos. Outro benefício significativo é a melhora da qualidade do sono, pois a atividade física regular pode ajudar a regular os padrões de sono, aliviando a insônia que muitas mulheres na menopausa experimentam.
Outro fator que é fundamental destacar, é o de que a saúde bucal é um aspecto importante do bem-estar geral das mulheres, e merece atenção especial durante a menopausa. Ao compreender as mudanças hormonais e seus impactos orais, e ao tomar medidas preventivas e de tratamento adequadas, as mulheres podem manter uma boca saudável e prevenir complicações que podem afetar sua qualidade de vida.
Através do exposto, torna-se pontual que as mulheres menopausadas, discutam suas opções de tratamento com um profissional de saúde para desenvolver um plano personalizado que leve em consideração sua saúde geral, histórico médico e preferências individuais. Além disso, o apoio emocional e o entendimento por parte da família e amigos durante essa fase de transição podem ser fundamentais para ajudar as mulheres a enfrentarem os desafios da menopausa com mais facilidade.
REFERÊNCIAS BIBLIOGRÁFICAS
ADAMS, J. M. et al. The mid-cycle gonadotropin peak in normal women occurs in the face of an unchanged pulse frequency of gonadotropin-releasing hormone. J Clin Endocrinol Metab., v. 79, n. 3, p. 858-864, 1994.
AGHA-HOSSEINI, F. Relationship between 17 beta-estradiol stimulated saliva and sensation of oral dryness in maturitas. Menopause, v. 62, p. 197-199, 2009.
AGHA-HOSSEINI, F. Relationship between bone mineral density of the lumbar spine and sensation of oral dryness in menopause. Menopause, v. 18, p. 625-628, 2011.
AGHA-HOSSEINI, F. et al. Stimulated the rate and composition of total salivary flow in menopausal women with a sensation of oral dryness. Oral Dis., v. 13, p. 320-323, 207.
AHLAWAT, P. et al. Prevalence of Depression and its Association with Sociodemographic Factors in Postmenopausal Women in an Urban Resettlement Colony of Delhi. J Midlife Health, v. 10, n. 1, p. 33-36, 2019.
ALBLOOSHI, S.; TAYLOR, M.; GILL, N. Does menopause elevate the risk for developing depression and anxiety? Results from a systematic review. Australas Psychiatry, v. 31, n. 2, p. 165-173, 2023.
ALBUQUERQUE, M. S. et al. Câncer de mama após a menopausa: associação com fatores reprodutivos e de estilo de vida em mulheres brasileiras. Revista Brasileira de Epidemiologia, v. 24, 2021.
ALENCAR, A. et al. Relações entre a Redução de Estrogênio, Obesidade e Insuficiência Cardíaca com Fração de Ejeção Preservada. Arq Bras Cardiol., v. 117, n. 6, p. 1191-1201, 2021.
ALLEN, N. G. et al. The impact of hormone replacement therapy on osteoporosis and dental care costs in postmenopausal women: A systematic review and meta-analysis. Menopause, v. 20, n. 11, p. 1215-1223, 2013.
ALMEIDA, O. P. et al. Depressive symptoms in midlife: the role of the reproductive phase. Menopause, v. 23, n. 6, p. 669-675, 2016.
ALMEIDA, M. C. Menopausa e Câncer de Mama: Estratégias de Prevenção. 2ª edição. São Paulo: Editora Saúde da Mulher, 2017.
ANDRADE, M. K. O.; MOREIRA, A. C. A.; SANTOS, J. F. A importância da fisioterapia preventiva nas alterações posturais do idoso. Research, Society and Development, v. 12, n. 14, e70121444574, 2023.
ALVES, J. et al. Fatores de risco para o câncer de mama em mulheres na pós-menopausa. Revista Brasileira de Epidemiologia, v. 24, e210006, 2021.
AMORE, M. et al. Sexual and psychological symptoms in the climacteric years. Maturitas, v. 56, n. 3, p. 303-311, 2007.
ANTELO, D. et al. Impacts of the exposome on the skin of menopausal women: from physiology to management. Surg Cosmet Dermatol., v. 15, e20230240, 2023.
ARAÚJO, J. N. L. C.; ATHANAZIO, D. A. Terapia de reposição hormonal e o câncer do endométrio. Cad. Saúde Pública, v. 23, n. 11, p. 2613-2622, 2007.
ASSOCIAÇÃO PAULISTA DE MEDICINA – APM. Média de idade da mulher entrar na menopausa no Brasil é 48 anos; somente metade delas faz tratamento. Disponível em: <https://www.apm.org.br/sem-categoria/media-de-idade-da-mulher-entrar-na-menopausa- no-brasil-e-48-anos-somente-metade-delas-faz-tratamento/>. Acesso em 16 abr. 2024.
ASSUNÇÃO, D. F. S. et al. Qualidade de vida de mulheres climatéricas. Rev. Soc. Brasileira de clínica médica, v. 15 n. 2 p. 80-83, 2017.
AVIS, N. E. et al. Is there an association between menopausal status and sexual functioning?Menopause, v. 7, p. 297-309, 2000.
AVIS, N. E. et al. Duration of menopausal vasomotor symptoms during the menopausal transition. JAMA International Med, v. 175, p. 531-539, 2015.
BABER, R. J. et al. Recommendations on women’s midlife health and menopause hormone therapy. Climacteric, v. 19, n. 2, p. 109-150, 2016.
BACHMANN, G. Physiological aspects of natural and surgical menopause. J Reprod Med., v. 46, p. 307-315, 2001.
BARACHO, E. Fisioterapia aplicada à mulher. 6 ed. Rio de Janeiro: Editora Guanabara Koogan, 2018.
BARACHO, E.; ALMEIDA, M. B. A.; GUIMARÃES, T. A. A importância da Fisioterapia durante o climatério e terceira idade. Fisioterapia Aplicada à Obstetrícia, Uroginecologia e Aspectos de Mastologia. 4. ed. Rio de Janeiro: Guanabara Koogan, 2007, p. 465472.
BARBOSA, F. S. Modelo de Impedância de Ordem Fracional para a Resposta Inflamatória Cutânea. Dissertação de Mestrado. Universidade Federal do Rio de Janeiro, 2011.
BARROS, R. P. et al. Participation of ERalpha and ERbeta in glucose homeostasis in skeletal muscle and white adipose tissue. I’m J Physiol Endocrinol Metab., v. 297, E124- 133, 2009.
BARTL, R. et al. Osteoporosis: Diagnosis, Prevention, Therapy. JAMA, v. 285, n. 6, p. 785-795, 2009.
BARTH, C.; VILLRINGER, A.; SACHER, J. Sex hormones affect neurotransmitters and shape the adult female brain during periods of hormonal transition. Frontiers in Neuroscience, v. 9, p. 37, 2015.
BEN ARYEH, H. et al. Oral complaints related to menopause. Maturitas, v. 24, p. 185-189, 1996.
BERGSTRÖM, J. et al. Association between osteoporosis and alveolar bone loss: A cross – sectional study on postmenopausal women. European Journal of Oral Implantology, v. 13, n. 2, p. 182-189, 2010.
BISOGNIN, P. A. et al. O climatério na perspectiva de mulheres. Enfermeira Global, n. 39, p. 168-180, 2015.
BLUME-PEYTAVI, U. et al. Skin academy: hair, skin, hormones and menopause – current status/knowledge on the management of hair disorders in menopausal women. Eur J Dermatol., v. 22, n. 3, p. 310-318, 2012.
BO, K.; SHERBURN, M. Assessment of female pelvic floor muscle function and strength. Physiotherapy, v. 85, p. 269-282, 2005.
BOCHEVA, G.; SLOMINSKI, R. M.; SLOMINSKI, A. T. Neuroendocrine aspects of skin aging. Int J Mol Sci., v. 20, n. 11, p. 2798, 2019.
BONJOUR, J. P. et al. The importance and relevance of peak bone mass in the prevalence of osteoporosis. Public Health Mex., v. 51, S5-S17, 2009.
BOULOC, A. et al. A compensating skin care complex containing pro-xylane in menopausal women: results from a multicentre, evaluator-blinded, randomized study. Acta Derm Venereol., v. 97, n. 4, p. 541-542, 2017.
BRAINLY. A osteoporose é uma doença comum em idosos, em que os ossos perdem cálcio, ficam mais frágeis e podem sofrer fraturas facilmente. (2020). Disponível em:<https://brainly.com.br/tarefa/31684779>. Acesso em 25 mar. 2024.
BRASIL. Ministério da Saúde – Instituto Nacional de Câncer. Dados e números sobre câncer de mama. Relatório Anual 2023. Disponível em: <https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//relatorio_dados-e- numeros-ca-mama-2023.pdf>. Acesso em: 02 fev. 2024.
BRASIL. Ministério da Saúde. Secretaria de Atenção à Saúde. Departamento de Ações Programáticas Estratégicas. Manual de atenção à mulher no climatério/menopausa. Brasília, DF; 2008.
BRASIL. Secretaria de Atenção à Saúde Departamento de Ações Programáticas Estratégicas. Normas Manuais Técnicos Série Direitos Sexuais Direitos Reprodutivos – Caderno SA; 2008.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Vigitel Brasil 2015: Vigilância de Fatores de Risco e Proteção para Doenças Crônicas por Inquérito Telefônico. Brasília (DF), 2016.
BRASIL. Ministério da Saúde, Instituto Sírio-Libanês de Ensino e Pesquisa. Protocolos da Atenção Básica: saúde das mulheres. 1st Ed. MS/CGDI; 2016.
BRINCAT, M.; MUSCAT, B. Y.; GALEA, R. Estrogens and the skin. Climacteric., v. 8, n. 2, p. 110-123, 2005.
BROMBERGER, J. T. et al. Risk factors for major depression during midlife among a community sample of women with and without prior major depression: Are they the same or different? Psychol Med., v. 45, n. 8, p. 1653-1664, 2015.
BROWN, L. M.; CLEGG, D. J. Central effects of estradiol in the regulation of food intake, body weight, and adiposity. J Steroid Biochem Mol Biol., v. 122, n. 3, p. 65-73, 2010.
CAGNACCI, A. et al. Vaginal atrophy across the menopausal age: results from the ANGEL study. Climacteric., v. 22, n. 1, p. 85-89, 2019.
CAMPBELL, K.E. Dennerstein L, Finch S, et al. Impact of menopausal status on negative mood and depressive symptoms in a 20-year longitudinal sample. Menopause, v. 24, n. 5, p. 490-496, 2017.
CAO, M. et al The expression of estrogen receptors and the effects of estrogen on human periodontal ligament cells Methods. Clin Pharmacol, v. 29, p. 329-335, 2007.
CARLSON, L. J.; SHAW, N. D. Development of ovulatory menstrual cycles in adolescent girls. J Pediatr Adolesc Gynecol., v. 32, n. 3, p. 249-253, 2019.
CARUSO, S.; RAPISARDA, A. M.; CIANCI, S. Sexuality in menopausal women. Curr. Opinion. Psychiatry., v. 29, p. 323-330, 2016.
CASALETTO, K. B. et al. Cognitive aging is not created equally: Differentiating unique cognitive phenotypes into “normals adults. Neurobiol., v. 77, p. 13-19,2019.
CASTELO-BRANCO, C. et al. Age at menopause in Latin America. Menopause, v. 13, n. 4, p. 706-712, 2006.
CASTRO, M. N. Climatério e Menopausa. Actualização Clínica. Clinical update, v. 3, n. 2, p. 67-83, 2009.
CASTRO, R. A. et al. Ensaio simples-cego, randomizado e controlado de treinamento muscular do assoalho pélvico, estimulação elétrica, cones vaginais e nenhum tratamento ativo em Manejo da Incontinência Urinária de Esforço. Clínicas, v. 63, p. 465-472, 2008.
CAWTHON, P. M. Gender differences in osteoporosis and fractures. Clin Orthop Relat Res., v. 469, p. 1900-1905, 2011.
CHIU, H. H.; TSAO, L. I.; LIN, M. H. Suffering an exhausting life like burning both ends of a candle – Women with menopausal fatigue. Internal. J. Nurse, v. 5, p. 95-102, 2020.
CHOE, S. J. et al. Psychological stress deteriorates skin barrier function by activating 11β- Hydroxysteroid dehydrogenase 1 and the HPA Axis. Sci Rep., v, 8, n. 1, p. 6334, 2018.
CIRILLI, I. et al. Role of coenzyme Q10 in health and disease: an update on the last 10 years (2010-2020). Antioxidants, v. 10, n. 8, p. 1325, 2021.
COHEN, L. S. et al. Risk of new onset depression during the menopausal transition: the Harvard study of moods and cycles. Arch Gen Psychiatry, v. 64, n. 4, p. 385-390, 2006.
COLPANI, V. et al. Lifestyle factors, cardiovascular disease, and all-cause mortality in middle-aged and older women: a systematic review and meta-analysis. Eur J Epidemiol., v. 33, n. 9, p. 831-845, 2018.
CONVERSO, D. et al. The relationship between menopausal symptoms and burnout. Cross- sectional study among nurses. BMC Women’s Health, v. 19, p. 190-192, 2019.
DAFOPOULOS, K. et al. The effect of estrogens on plasma ghrelin concentrations in women. J Endocrinol Invest., v. 33, p. 109-112, 2010.
DAMSTED, P. Female Sexual Function in Midlife in Kirana. The EFS and ESSM Clinical Sexology Program. 1st edition. Medix Publishers, Amsterdam, Netherlands: 2013.
DAS, A.; DESTOUNI, A. Novel insights into reproductive ageing and menopause from genomics. Hum Reprod., v. 38, n. 2, p. 195-203, 2023.
DAVIS, S.R. Androgenic treatment in women. Med J Aust, v. 170, n. 11, p. 545-549, 1999. DAVIS, S. R. et al. Menopause. Nature reviews. Primaries on diseases, v. 1, e.15, 2015.
DAVIS, S. R. et al. The contribution of SHBG to HOMA-IR variation does not depend on endogenous estrogen or androgen levels in postmenopausal women. Clin Endocrinol., v. 77, p. 542-547, 2012.
DENNERSTEIN, L.; DUDLEY, E.; BURGER, H. Are changes in sexual functioning during midlife due to aging or menopause? Fertile Sterile, v. 76, p. 456-460, 2001.
DINIZ, A. G. et al. Menopausa e fatores de risco para o câncer de mama: estudo caso- controle em Goiânia, Goiás, Brasil. Cadernos de Saúde Pública, v. 37, n. 1, 2021.
DONATO, G. B. et al. Association between menopausal status and central adiposity measured at different cut-off points of waist circumference and waist-hip ratio. Menopause, v. 13, p. 280-285, 2006.
DRISCOLL, M. S. et al. Nutrition and the harmful side effects of nutritional supplements. Clin Dermatol., v. 28,
DUDAS, B.; MERCHENTHALER, I. Three-dimensional representation of the neurotransmitter systems of the human hypothalamus: inputs of the gonadotrophin hormone-releasing hormone neuronal system. J Neuroendocrinol, v. 18, n. 2, p. 79-95, 2006.
DUGAN, S. A. et al. Musculoskeletal pain and menopausal status. Clin J Pain, v. 22, n. 4, p. 325-331, 2006.
EDWARDS, D.; PANAY, N. Treating vulvovaginal atrophy/genitourinary syndrome of menopause: how important is vaginal lubricant and moisturizer composition? Climacteric, v. 19, n. 2, p. 151-161, 2016.
FABBROCINI, G. et al. Female pattern hair loss: a clinical, pathophysiological and therapeutic review. International J. Women’s Dermatol, v. 4, p. 203-211, 2018.
FEBRASGO, Federação Brasileira das Associações de Ginecologia e Obstetrícia. Manual de Orientação em Climatério. Rio de Janeiro, 2010. Disponível em: <https://www.febrasgo.org.br/images/arquivos/manuais/Manuais_Novos/Manual_Clim aterio.pdf>. Acesso em: 23 fev. 2024.
FEBRASGO, Federação Brasileira das Associações de Ginecologia e Obstetrícia. Síndrome geniturinária da menopausa. Número 3 – Março 2022. Disponível em: <https://www.febrasgo.org.br/images/pec/vitamina-d/FPS-N3-Marco-2022—portugues.pdf>. Acesso em 14 mar. 2024.
FERNANDES, L. T. B. et al. Atuação do Enfermeiro no Gerenciamento do Programa de Assistência Integral à Saúde da Mulher. Revista brasileira de ciências da saúde, v. 20, n 3, p. 219-226, 2016.
FIROOZ, A.; SADR, B.; BABAKOOHI, S. Variation of skin biophysical parameters with age, gender and body region. Scientific World Journal, v. 20, n. 12, p. 386-936, 2012.
FORABOSCO, V. et al. Oral discomfort in postmenopausal women: Relationship to estrogen deprivation and effect of hormone replacement therapy. Menopause, v. 10, n. 2, p. 178-184, 2003.
FRANÇA, A. P. et al. Fatores associados à obesidade geral e ao percentual de gordura corporal em mulheres no climatério da cidade de São Paulo, Brasil. C. Saúde Colet., v. 3, n. 11, p. 3577-3586, 2018.
FREEMAN, E. W. et al. Associations of hormones and menopausal status with depressed mood in women without a history of depression. Arch Gen Psychiatry, v. 63, n. 4, p. 375- 382, 2006.
FRIEDLANDER, A. H. The physiology, medical management and oral implications of. Am Dent Assoc., v. 133, p. 73-81, 2002.
FORYST-LUDWIG, A.; KINTSCHER, U. Metabolic impact of estrogen signaling through ERalpha and ERbeta. J Steroid Biochem Mol Biol., v. 122, p. 74-81, 2010.
GAO, J. et al. A case-control study on etiological factors involved in patients with burning mouth syndrome. J Oral Pathol Med., v, 38, p. 24-28, 2009.
GASSER, S. et al. Impact of progesterone on skin and hair in menopause. A comprehensive review. Climacteric., v. 24, p. 229-235, 2021.
GILCHREST, B. A. Photoaging. J Invest Dermatol, v.133, p. 2-6, 2013.
GODFREY, S. et al. Metals in female scalps worldwide and their impact on perceived hair health. Int J Cosmet Sci., v. 35, p. 264-274, 2013.
GRABOVAC, I.; DORNER, T. E. Association between low back pain and various daily activities: Activities of daily living, work ability and sexual function. Vienna Klin Wochenschr, v. 131, p. 541-543, 2019.
GRAZIOTTIN, A.; LEIBLUM, S. R. Biological and psychosocial pathophysiology of female sexual dysfunction during the menopausal transition. J. Sex Med., v. 2, p. 133-145, 2005.
GRODSTEIN, F. et al. A prospective, observational study of postmenopausal hormone therapy and primary prevention of cardiovascular disease. Ann Intern Physician., v. 133, p. 933-941, 2000.
GUEDES, R. et al. Prevalência e fatores associados à terapia de reposição hormonal entre mulheres na pós-menopausa: estudo de base populacional em Pelotas, Rio Grande do Sul, Brasil. Cadernos de Saúde Pública, v. 37, n. 8, 2021.
HAY-SMITH, E. J. et al. Comparison of pelvic floor muscle training approaches for urinary incontinence in women. Cochrane Database of Systematic Reviews, n. 7, 2011.
HALL, J. E. Endocrinology of Menopause Salon. Endocrinol Metab Clin North Am., v, 44, n. 3, p. 485-496, 2015.
HARLOW, S. D. et al. Collaborative Group. Executive summary of the Workshop Stages of Reproductive Aging +10: addressing the unfinished agenda of staging reproductive aging. Climacteric, v. 13, n. 2, p. 105-114, 2012.
HAYS, J. et al. Wo-men’s Health Initiative Investigators. Effects of estrogen plus progestin on health-related quality of life. N Engl J Med., v, 348, n. 19, p. 1839-1854, 2003.
HEER, E. et al. Global burden and trends in premenopausal and postmenopausal breast cancer: a population-based study. The Lancet, v. 8, p. 1027-1037, 2020.
HERSKOVITZ, I.; TOSTI, A. Female pattern hair loss. Int J Endocrinol Metab., v. 11, e9860, 2013.
HUANG, T. H. et al. Cosmetic and therapeutic applications of fish oil’s fatty acids on the skin. Mar Drugs, v. 16, n. 8, p. 256, 2018.
HUSSAIN, A. et al. The mechanisms of dietary phytoestrogen as a potential treatment and prevention agent against Alzheimer’s disease. Critical. Rev. Eucarioto. Expr. Gen., v. 28, p. 321-327, 2018.
IANCU, M. E. et al. Favorable changes in arterial elasticity, left ventricular mass, and diastolic function after significant weight loss following laparoscopic sleeve gastrectomy in obese individuals. Obes Surg., v; 24, n. 3, p. 364-370, 2014.
IMIRZALIOGLU, P. et al. Correlation between residual ridge resorption and radiomorphometric índices. Gerodontology, v. 29, e536-542, 2012.
JAMES, M. J.; GIBSON, R. A.; CLELAND, L. G. Dietary polyunsaturated fatty acids and production of inflammatory mediators. I’m J Clin Nutr., v. 71, s1, p. 343-348, 2020.
JAROSZ, M. Nutritional standards for the Polish population – change. Warsaw: Żywności i Żywienia Institute, v. 6, n. 1, p. 119-123, 2012.
JEN, M.; YAN, A. C. Syndromes associated with nutritional deficiency and excess. Clin Dermatol., v. 28, p. 669-685, 2010.
JENSEN, E. V. et al. Estrogen action: a historic perspective on the implications of considering alternative approaches. Physiology Behavior, v. 99, n. 2, p. 151-162, 2010.
JUANG, K. D. et al. Hot flashes are associated with psychological symptoms of anxiety and depression in peri- and post-, but not pre-menopausal, women. Maturitas, v. 52, n. 2, p. 119-126, 2005.
KALYANI, R. R. et al. The Association of Endogenous Sex Hormones, Adiposity, and Insulin Resistance with Incident Diabetes in Postmenopausal Women. J Clin Endocrinol Metabl., v. 94, p. 4127-4135, 2009.
KAMI, A. T.; VIDIGAL, C. B.; MACEDO, C. S. G. Influência das fases do ciclo menstrual no desempenho funcional de mulheres jovens e saudáveis. Fisioter Pes., v. 24, n. 4, p. 356- 362, 2017.
KAMP, E. et al. Menopause, Skin and Common Dermatoses. Part 1: Hair Disorders. Clinic. Exp. Dermatol., v. 17, p. 2110-2116, 2022.
KANIS, J. A. et al. The diagnosis of osteoporosis. J Bone Miner Res., v. 9, p. 1137-1141, 2004.
KARAPANOU, O.; PAPADIMITRIOU, A. Determinants of menarche. Reprod Biol Endocrinol., v. 8, p. 115, 2010.
KHUNGER, N. et al. Acne – Challenges and Solutions. International J. Women’s Health, v. 11, p. 55-567, 2019.
KIL, M. S. et al. Analysis of serum zinc and copper concentrations in hair loss. Ana Dermatol., v. 25, p. 405-409, 2013.
KINGSBERG, S.A. et al. Vulvar and vaginal atrophy in postmenopausal women: findings from the REVIVE (REal Women’s VIews of Treatment Options for Menopausal Vaginal ChangEs) survey. J Sex Med. v. 10, n. 7, p. 1790-1799, 2013.
KLEIN, S. et al. Clinical implications of obesity with specific focus on cardiovascular disease. A statement for professionals from the American Heart Association council on nutrition, physical activity, and metabolism. Circulation, v. 110, p. 2952-2967, 2004.
KOH, C. E. et al. Systematic review of randomized controlled trials on the effectiveness of biofeedback for pelvic floor dysfunction. British Journal of Surgery, v. 95, p. 1079-1087, 2008.
KOZAKOWSKI, J. et al. Obesity in menopause – our negligence or an unfortunate inevitability? Prz Menopauzalny, v. 16, n. 2, p. 61-65, 2017.
KRAVITZ, H. M. et al. Sleep difficulty in women at midlife: a community survey of sleep and the menopausal transition. Menopause, v. 10, n. 1, p. 19-28, 2003.
KRIBBS, P. J. Comparison of the mandibular bone in normal and osteoporotic women. J Prosthet Dent., v. 63, p. 218-222, 1990.
KRUTMANN, J. et al. The skin aging exposome. J Dermatol Sci., v. 85, n. 3, p. 152-161, 2017.
KWAŚNIEWSKA, M. et al. Smoking, menopausal transition and metabolic syndrome in women. Menopause, v. 19, p. 194-200, 2012.
LABRIE, F. DHEA, important source of sex steroids in men and even more in women. Prog Brain Res., v. 182, p. 97-148, 2010.
LAKATTA, E. G. So! What’s aging? Is cardiovascular aging a disease? J Mol Cell Cardiol., v. 83, p. 1-13, 2015.
LARKIN, D.; MARTIN, C. R. The interface between chronic fatigue syndrome and depression: a psychobiological and neurophysiological enigma. Neurophysiol. Clinic., v. 47, p. 123-129, 2017.
LENTE, C.; VESLASQUE, L. F. L. Efeitos da terapia hormonal na menopausa: Revisão de literatura. Biosaúde, v. 17, n. 2, p. 74-81, 2015.
LERNER, U. H Bone remodeling in postmenopausal osteoporosis. J. Dent Res., v. 85, p. 584-595, 2006.
LETHABY, A. et al. Local oestrogen for vaginal atrophy in postme-nopausal women. Cochrane Database Syst Rev., v. 8, n. 8, 2016.
LEWIECKI, E. M. Prevention and treatment of postmenopausal osteoporosis. Obstet Gynecol Clin N Am., v. 35, p. 301-315, 2008.
LIMA, A. et al. Câncer de Mama na Pós-Menopausa: Diagnóstico e Tratamento. São Paulo: Editora Brasileira, 2020.
LÓPEZ-MARCOS, A. et al. Effect of hormone replacement therapy on periodontal status in postmenopausal women. Journal of Clinical Periodontology, v. 26, n. 11, p. 780-784, 1999.
LORENZI, D. R. S. et al. Prevalência de sobrepeso e obesidade no climatério. Rev Bras Ginecol Obstet., v. 27, n. 8, p. 479-484, 2005.
LOVE, K. T.; RASHID, R. M.; MIRMIRANI, P. Does it matter? The role of vitamin D in hair disorders and the hair follicle cycle. Dermatol Onl. J., v. 16 n. 3, 2010.
LUCENA, C. T. et al. Percepção de mulheres no climatério sobre a sua sexualidade. Revista da Universidade Vale do Rio Verde, v. 12, n. 1, p. 28-37, 2014.
LUGLIO, H. F. Regulation of estrogen and body weight in women: the role of estrogen receptor alpha (ER-α) in adipocyte lipolysis. Acta Med Indonesia, v. 46, p. 333-338, 2014.
MACHATY, Z.; MILLER, A. R.; ZHANG, L. Egg activation at fertilization. Adv Exp Med Biol., v. 95, v. 3, p. 1-47, 2017.
MACLENNAN, A. H. et al. Oral oestrogen and combined oestrogen/progestogen therapy versus placebo for hot flushes. Cochrane Database Syst Rev., v. 4, CD002978, 2004.
MAKI, P. M. Menopause and cognition. Treatment of Postmenopausal Women: Basic and Clinical Aspects. Burlington: Academic Press; 2007.
MAKI, P. M.; HENDERSON, V. W. Cognition and the menopausal transition. Menopause, v. 23, p. 803-805, 2016.
MASCARENHAS, P. et al. Influence of sexual hormones on the periodontium. J Clin Periodontol., v. 30, p. 671-681, 2003.
MANGIONE, C. M. et al. Hormone therapy for the primary prevention of chronic conditions in postmenopausal people: US Preventive Services Task Force Recommendation Statement. JAMA, v. 328, n. 117, p. 1740-1746, 2022.
MARCUSO, Simone. Sistema Reprodutor Feminino. (2018). Disponível em: <https://professor.ufrgs.br/simonemarcuzzo/files/sistema_reprodutor_feminino.pdf>. Acesso em 20 abr. 2024.
MARKIEWICZ-ŻUKOWSKA R. Supplements for hair health. Med Estet Anti-Aging, v. 2, p. 31-35, 2010.
MCNEIL, M. A.; MERRIAM, S. B. Menopause. Ann Intern Physician., v. 174, n. 7, p. 97- 112, 2021.
MEDEIROS, S. F. et al. Modificações dos níveis de gonadotrofinas durante a vida reprodutiva. Rev Bras Ginecol Obstet., v. 29, n. 1, p. 48-55, 2007.
MEHDI, Y. et al. Selenium in the environment, metabolism, and involvement in bodily functions. Molecules, v. 18, p. 3292-3311, 2013.
MEHTA, J. et al. Risks, benefits and treatment modalities of hormonal therapy in menopause: current concepts. Frontal endocrinol., v. 12, p. 564-581, 2021.
MELO, L. Perfil epidemiológico de mulheres idosas atendidas no Grupo de apoio à prevenção da incapacidade funcional. Rev. Br. de Prom. Saúde, v. 22, n. 4, p. 251-258, 2018.
MERSKEY, H.; BOGDUK, N. Classification of Chronic Pain. Seattle. Wa Iasp Press: p. 59-71, 1994.
MEYER, F. et al. Armodafinil for fatigue associated with menopause: an open trial. Menopause, v. 23, p. 209-214, 2016.
MILLEN, B. E. et al. Nutritional risk and metabolic syndrome in women: opportunities for preventive intervention from the Framingham Nutrition Study. I’m J Clin Nutr., v. 84, p. 434-441, 2006.
MINAMI, A. et al. Improvement of neurological disorders in postmenopausal model rats by administration of royal jelly. Climacteric, v. 19, p. 568-573, 2016.
MINICUCCI, E. M. et al. Assessing the impact of menopause on salivary flow and xerostomia. Aust Dent J., v. 58, p. 230-234, 2013.
MIRMIRANI, P. Hormonal changes in menopause: do they contribute to a ‘midlife hair crisis’ in women? Sr. J. Dermatol., v. 165, s.3, p. 7-11, 2011.
MITCHELL, E. S.; WOODS N. F. Pain symptoms during the menopausal transition and early postmenopause. Climacteric, v. 13, n. 5, p. 467-478, 2010.
MORAIS, A. B.; NASCIMENTO, V. J . S.; SILVA, K. C. C. Importância da Fisioterapia nas Alterações na Menopausa. Revista Foco, v.16, n. 9, p. 01-23, 2023.
MORKVED, S. et al. Effect of adding biofeedback to pelvic floor muscle training to treat urodynamic stress incontinence. Obstetrics and Gynecology, v. 100, p. 730-739, 2002.
MUKA, T. Association of Age at Onset of Menopause and Time Since Onset of Menopause With Cardiovascular Outcomes, Intermediate Vascular Traits, and All-Cause Mortality: A Systematic Review and Meta-analysis. JAMA Cardiol., v. 1, n. 7, p. 767-776, 2016.
MULHALL, S.; ANDEL, R.; ANSTEY, K. J. Variation in symptoms of depression and anxiety in middle-aged women according to menopausal status. Maturitas, v. 108, p. 7-12, 2018.
MURINA, F.; BIANCO, V.; RADICI, G. Transcutaneous electrical nerve stimulation to treat vestibulodynia: a randomizem controlled trial. BJOG, v. 115, p. 1165-1170, 2008.
NABAIE, L. et al. Androgenic alopecia and insulin resistance: are they really related? Clin Exp Dermatol., v. 34, p. 694-697, 2009.
NAHAS, E. A.; NAHAS-NETO, J. Terapêutica hormonal: benefícios, riscos e regimes terapêuticos. São Paulo: Federação Brasileira das Associações de Ginecologia e Obstetrícia (Febrasgo); 2018.
NAMAZI, M. et al. Social determinants of health in menopause: an integrative review. Int J Womens Health., v. 11, p. 637-647, 2019.
NAPPI, R. E. et al. Women’s perceptions of sexuality around menopause: results from a European telephone survey. EUR. J. Obsteto. Gynecol. Reproduction Biol., v. 137, p. 10- 16, 2008.
NAPPI, R. E. et al. Global cross-sectional survey of women with vasomotor symptoms associated with menopause: prevalence and burden on quality of life. Menopause, v. 28, p. 875-882, 2021.
NELSON, H. D. Menopause. The Lancet, v. 371, p. 760-770, 2008.
NESTOR, C. C. et al. Cross talk between reproduction and energy homeostasis: central impact of estrogen, leptin and kisspeptin signaling. Horm Mol Biol Clin Investig., v. 17, p. 109-128, 2014.
NEUHOUSER, M. L. et al. A low-fat dietary pattern and risk of metabolic syndrome in postmenopausal women: the Women’s Health Initiative. Metabolism, v. 61, p. 1572-1581, 2012.
NUNES, C, R. et al. Pico de Massa Óssea e Níveis de Exercício Físico em Estudantes Universitários. Revista da AMRIGS, v. 66, n. 3, p. 831-838, 2022.
OLIVEIRA, N. S.; REIS, M. C. G. A influência da atividade física em mulheres no climatério. Revista de Enfermagem Faciplac. 2019.
ORNAT, L. et al. Sexual function, life satisfaction and menopausal symptoms in middle- aged women. Maturitas, v. 75, p. 261-269, 2013.
ORTMAN, K. C. et al. Alveolar ridge resorption following tooth extraction: A longitudinal study in edentulous patients. Journal of Periodontology, v. 73, n. 12, p. 1443-1452, 2002.
PAIVA, L. C. Prevalência de osteoporose em mulheres na pós menopausa e associação com fatores clínicos e reprodutivos. RBGO, v. 25, nº 7, p. 507-512, 2003.
PANOTOPOULOS, G. et al. Weight gain during menopause. Hum Reprod., v. 12, s.1, p. 126-133, 2007.
PAPPAS, A. Epidermal surface lipids. Dermatoendocrinol, v. 1, p. 72-76, 2009.
PARDINI, D. Terapia de reposição hormonal na menopausa. Arq Bras Endocrinol Metab., v. 58, n. 2, p. 172-181, 2014.
PARK, S. Y. et al. Iron plays a certain role in patterned hair loss. J Korean Med Sci., v. 28. p. 934-938, 2013.
PASSERON, T. et al. Clinical and biological impact of the exposome on the skin. J Eur Acad Dermatol Venereol., v. 34. S. 4, p. 4-25, 2020.
PEDERSEN, S. B. et al. Estrogen controls lipolysis by upregulating alpha2A-adrenergic receptors directly in human adipose tissue through the estrogen receptor alpha. Implications for female fat distribution. J Clin Endocrinol Metab., v. 89, p. 1869-1878, 2004.
PEDRO, A. et al. Idade de ocorrência da menopausa natural em mulheres brasileiras: resultados de um inquérito populacional domiciliar. Cad. Saúde Pública, v. 19, n. 1, p. 17- 25, 2003.
PÉREZ-SÁNCHEZ, A. et al. Nutraceuticals for skin care: A comprehensive review of human clinical studies. Nutrients, v. 10, n. 4, p. 403-406, 2018.
PICHÉ, M. E. et al. Contribution of abdominal visceral obesity and insulin resistance to the cardiovascular risk profile of postmenopausal women. Diabetes, v. 54, p. 770-777, 2005.
PIECHA, V. H. et al. Percepções de mulheres acerca do climatério. Rev. FunCare Online, v. 10, n. 4, p. 906-912, 2018.
PIÉRARD, G. E. The dilemma of aging climacteric skin. Dermatology, v. 193, p. 273-274, 2006.
PIÉRARD, G. et al. Asymmetric facial skin viscoelasticity during climacteric aging. Clin Cosmet Investig Dermatol., v. 11, n. 7, p. 111-118, 2014.
PIMENTA, F. et al. Menopausal symptoms: do life events predict the severity of peri- and post-menopausal symptoms? Maturitas, v. 72, n. 4, p. 324-331, 2012.
PORTMAN, D.J.; GASS, M. L; Vulvovaginal Atrophy Terminology Consensus Conference Panel. Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Women’s Sexual Health and the North American Menopause Society. Menopause, v. 21, n. 10, p. 1063-1068, 2014.
RAGUNATHA, S. et al. Diffuse non-scarring alopecia of the scalp: an indicator of early childhood scurvy? Ped Derm., v. 25, p. 644-646, 2008.
REBOUÇAS, E. C.; LEAL, S.; SÁ, S. I. Regulação da expressão de NPY e α-MSH pelo estradiol no núcleo arqueado de ratas Wistar: estudo estereológico. Neurol Res., v. 38, p. 740-747, 2016.
RESLAN, O. M.; KHALIL, R. A. Vascular effects of menopausal estrogenic hormone therapy. Rev recent clinical trials, v. 7, p. 47-70, 2012.
RIMON-DAHARI, N. et al. Ovarian folliculogenesis. Problem cell results vary, v. 58, p. 167-190, 2016.
RINALDI, F. et al. The Menopausal Transition: Is the Hair Follicle “Going through Menopause”? Biomedicines, v. 14, n. 11, p. 30-41, 2023.
ROGERS, A. et al. Circulating estradiol and osteoprotegerin as determinants of bone turnover and bone density in postmenopausal women. J Clin Endocrinol Metab., v. 87, p. 4470-4475, 2002.
ROSANO, G. M. et al. ¿Es la enfermedad cardiovascular en mujeres diferente a la de los hombres? El papel de las hormonas sexuales. Climático, v. 20, n. 2, p. 125-128, 2017.
ROSATO, E. et al. Revisiting the physiological role of androgens in women. Expert Rev Endocrinol Metab., v. 14, n. 6, p. 547-561, 2022.
ROZENBERG, S.; VANDROMME, J.; ANTOINE, C. Postmenopausal hormone therapy: risks and benefits. Nat Rev Endocrinol., v. 9, p. 216-227, 2013.
RUSHTON, D. H. et al. Causes of hair loss and the evolution of hair rejuvenation. Int J Cosmet Sci., v. 24, p. 17-23, 2002.
RUTH, K. S. et al. Genetic insights into biological mechanisms governing human ovarian ageing. Nature, v. 596, e7872, p. 393-397, 2021.
RZEPECKI, A. K. et al. Estrogen-deficient skin: the role of topical therapy. Int J Womens Dermatol., v. 5, n. 2, p. 85-90, 2019.
SANDHU, S. K.; HAMPSON, G. The pathogenesis, diagnosis, investigation and treatment of osteoporosis. J Clin Pathol., v. 64, p. 1042-1050, 2011.
SANTORO, N.; EPPERSON, C. N.; MATHEWS, S. B Menopause symptoms and their management. Endocrinol. Metab. Clinic, v. 44, p. 497-515, 2015.
SANTORO, N. et al. The Menopause Transition: Signs, Symptoms, and Management Options. J Clin Endocrinol Metab., v. 106, n. 1, p. 1-15, 2021.
SANTOS, L. M. et al. Síndrome do Climatério e qualidade de vida: Uma percepção das mulheres nessa fase da vida. Revista APS, v. 10, n.1, p. 20-26, 2017.
SANTOS, C. C. et al. Hyaluronic acid in postmenopause vaginal atrophy: a systematic review. J Sex Med., v. 18, n. 1, p. 156-166, 2021.
SCARDINA, G. A.; MESSINA, P. Oral microcirculation in postmenopause: a possible correlation with periodontitis. Gerodontology, v. 29, e1045-1051, 2012.
SCHIERBECK, L. L. et al. Effect of hormone replacement therapy on cardiovascular events in recently postmenopausal women: randomized trial. BMJ, v. 345, e6409, 2012.
SEWÓN, L. et al. The effect of hormone replacement therapy on salivary calcium concentrations in menopausal women. Arch Oral Biol., v. 45, p. 201-206, 2000.
SHAPIRO, J. Clinical practice: Hair loss in women. N Engl J Med., v. 357, p. 1620-1630, 2007.
SHIH, M. E. U. et al. Esterification of retinol by DGAT1 is essential for retinoid homeostasis in murine skin. J Biol Química, v. 284, p. 4292-4299, 2009.
SHEA, A. K. et al. Depression, hormone therapy, and the menopausal transition among women aged 45 to 64 years using Canadian Longitudinal Study on aging baseline data. Menopause, v. 27, n. 7, p. 763-770, 2020.
SHELLEY, J. M. et al. Relationship of endogenous sex hormones with lipids and blood pressure in middle-aged women. Ann Epidemiol., v. 8, p. 39-45, 2008.
SHERWIN, B. B. Impact of progestins on women’s mood and cognition. Presented at: North American. Menopause Society, v. 49, p. 26-28, 1996.
SILVA, E. F. Movimento feminista e de mulheres e a construção do PAISM: experiências no Centro de Saúde Santa Rosa. Saúde/Debate, v. 39, n. 106, p. 893-903, 2015.
SILVA, V. H.; ROCHA, J. S. B.; CALDEIRA, A. P. Fatores associados à autopercepção negativa de saúde em mulheres climatéricas. Ciênc Saúde Colet., v. 23, n. 5, p. 1611-1620, 2018.
SILVA, M. A. A Relação entre a Menopausa e o Risco de Câncer de Mama. Rev. Brasileira de Saúde da Mulher, v. 20, n. 2, p. 45-58, 2020.
SOARES, C. N Uma nova visão do humor, dos hormônios e da menopausa. Menopausa, v. 27, p. 371-373, 2020.
SOBRAC – Associação Brasileira de Climatério. Terapêutica hormonal na peri e na pós- menopausa. Consenso da SOBRAC; p. 5-39, 2004.
STERNFELD, B. et al. Effectiveness of exercise for menopausal symptoms: a randomized controlled trial. Menopause, v. 21, n. 4, p. 330-338, 2014.
STOCCO, C.; TELLERIA, C.; GIBORI, G. The molecular control of corpus luteum formation, function and regression. Endocr Rev., v. 28, n. 1, p. 117-149, 2007.
STRAUSS, J. R. The reciprocal relationship between menopausal symptoms and depressive symptoms: A 9-year longitudinal study of midlife American women. Maturitas, v. 70, n. 3, p. 302-306, 2011.
STUENKEL, C. A. Managing vasomotor symptoms of menopause in older women. Maturitas, v. 143, p. 36-40, 2021.
STYRKARSDOTTIR, U. Novel sequence variants associated with bone mineral density. Nat Genet., v. 41, p. 15-17, 2009.
SULTAN, Y.; RAO, N. S. Association between menopausal osteopenia and chronic periodontitis in postmenopausal women. Journal of Clinical Dentistry, v. 25, n. 2, p. 59- 64, 2014.
SUTTON-TYRRELL, K. et al. Sex hormone-binding globulin and free androgen index are related to cardiovascular risk factors in multiethnic premenopausal and perimenopausal women enrolled in the Study of Women Across the Nation (SWAN) Circulation, v. 111, p. 1242-1249, 2005.
SYED, D. N. et al. MicroRNAs in the skin’s response to UV radiation. Current drug targets, v. 14, p. 1128-1134, 2013.
SZOEKE, C. E. et al. The relationship of reports of aches and joint pains to the menopausal transition: a longitudinal study. Climacteric, v. 11, p. 55-62, 2008.
TAKAHASHI, M. et al. Effects of increasing daily physical activity on mental health and biomarkers of depression in postmenopausal women. J Phys Ther Sci, v. 31, n. 4, p. 408- 413, 2019.
TALAULIKAR, V. Menopausal transition: Physiology and symptoms. Best practice Res Clin Obstet Gynaecol., v. 81, p. 3-7, 2022.
TANBO, T. G.; FEDORCSAK, P. Z. Can the time to menopause be predicted? Acta Obstet Gynecol Scand., v. 100, n. 11, p. 1961-1968, 2021.
TARABORRELLI, S. Physiology, production and action of progesterone. Acta Obstet Gynecol Scand, v. 94, s.161, p. 8-16, 2015.
TARKKILA, S. L. et al. Oral symptoms and menopause: A population-based study. Menopause, v. 9, n. 3, p. 238-244, 2002.
TARKKILA, S. L. et al. Effect of hormone replacement therapy on subgingival microflora in postmenopausal women. Menopause, v. 12, n. 3, p. 393-400, 2005.
THASNEEM, K. et al. Genes linked to early menopause and the pathogenesis of its associated diseases: a systematic review. Fertile Middle East. Soc. J., v. 27, n. 2, p. 2-11, 2022.
THE NAMS. Hormone Therapy Position Statement Advisory Panel. The 2017 hormone therapy position statement of The North American Menopause Society. Menopause, v. 24, n. 7, p. 728-753, 2017.
THOMPSON, I. O. et al. A Comparative Light Microscopy, Electron Microscopy, and Chemical Study of the Human Vaginal and Buccal Epithelium. Arch Oral Biol., v. 46, p. 1091-1098, 2001.
TIMUR, S.; SAHIN N. H. The prevalence of depression symptoms and influencing factors among perimenopausal and postmenopausal women. Menopause, v. 17, p. 545-551, 2010.
TIVIS, L. J. et al. Saliva versus serum estradiol: Implications for research studies using postmenopausal women. Biol Psychiatry, v. 29, p. 727-732, 2005.
TOBIN, D. J. Aging of the Hair Follicle Pigmentation System. International J. Trichol., v. 1, p. 83-93, 2009.
TUCKER, P. E. et al. The effects of preoperative menopausal status and hormone replacement therapy (HRT) on sexuality and quality of life after risk-reducing salpingo- oophorectomy. Maturitas, v. 85, p. 42-48, 2016.
UEDA, M. et al. Effects of estrogen replacement therapy on alveolar bone loss in postmenopausal women. Journal of Bone and Mineral Research, v. 15, n. 10, p. 1758- 1764, 2000.
VALENÇA, C. N et al. Mulher no climatério: reflexões sobre desejo sexual, beleza e feminilidade. Saúde e Sociedade, v. 19, n. 2, p. 273-285, 2010.
VÄLIMAA, H. et al. Estrogen receptor beta is the predominant estrogen receptor subtype in human oral epithelium and salivary glands. J Endocrinol., v. 180, p. 55-62, 2004.
VARGAS, B. R. et al. Associação entre doenças cardiovasculares e sinais/sintomas do climatério em mulheres atendidas em uma Unidade Básica de Saúde. Revista Kairós- Gerontologia, v. 24, n. 1, p. 651-667, 2021.
VASSAL-STERMANN, E. et al. A new C-Xyloside induces modifications of GAG expression, structure and functional properties. PLoS One, v. 7, n. 12, p. 79-83, 2012.
VIGNOZZI, L.; MASEROLI, E. Hormones and sexual behavior. In: Petraglia F., Fauser BCJM, editors. Endocrinology Female Reproductive Dysfunction. Springer, v. 9, n. 1, p. 1849-1852. 2019.
VOLPE, A. R., et al. Effects of conjugated equine estrogens on oral comfort in postmenopausal women. Journal of the American Dental Association, v. 131, n. 1, p. 58- 63, 2000.
WANG, Y. X. J. Menopause as a potential cause for higher prevalence of low back pain in women than in men of the same age. J Orthop Transl., v. 8, p. 1-4, 2017.
WANG, S. T.; NEO, B. H, BETTS, R. J. Glycosaminoglycans: sweet as sugar targets for topical skin anti-aging. Clin Cosmet Investig Dermatol., v. 14, p. 1227-1246, 2021.
WARDROP, R. W. et al. Oral discomfort in menopause Oral. Surg Oral Med Oral Pathol., v. 67, p. 535-540, 1989.
WEICKERT, M. O.; PFEIFFER, A. F. H. Metabolic effects of dietary fiber consumption and diabetes prevention. J Nutr., v. 138, p. 439-442, 2008.
WELLS, G, et al. Osteoporosis Methodology Group and The Osteoporosis Research Advisory Group. Meta-analyses of therapies for postmenopausal osteoporosis. V. Meta- analysis of the ef-ficacy of hormone replacement therapy in treating and preventing osteoporosis in postmenopausal women. Endocr Rev., v. 23, n. 4, p. 529-539, 2002.
WENDER, M. C. et al. Associação Brasileira de Climatério. Consenso Brasileiro de Terapêutica Hormonal da Menopausa. São Paulo: Leitura Médica, 2014.
WHO. Defining Sexual Health: Technical Consultation Report on Sexual Health. Geneva. Switzerland: 2002.
WICKETT, R. R. et al. Effect of oral intake of choline-stabilized orthosilicic acid on tensile strength and hair morphology in women with fine hair. Arch Dermatol Res., v. 299, p. 499- 505, 2007.
WILBUR, J. et al. Menopausal transition symptoms in middle-aged women living with fibromyalgia and chronic fatigue. Women’s Health Care Int., v. 27, p. 600-614, 2006.
WLAŹLAK, E. et al. Analysis of calcium concentration in hair of perimenopausal women. Prz Menopauzalny, v. 1, p. 51-54, 2018.
WONGKHANKAEW N, PONGSATHA S. A cross sectional study of serum vitamin D levels in perimenopausal and postmenopausal women working outdoors or indoors. J Med Assoc Tha, v. 104, n. 11, p. 1807-1813, 2021.
WORSLEY R et al. Prevalence and predictors of low sexual desire, sexually related personal distress, and hypoactive sexual desire dysfunction in a community sample of middle-aged women. J. Sex. Med., v. 14, p. 675-686, 2017.
YA-JUN H. et al. Meta-analysis on the prevalence rate of osteoporosis in middle-aged and elderly people in China. Chin J Eng Res, v. 18, p. 1129-1134, 2014.
YALCIN, F. et al. Oral health in postmenopausal Turkish women. Oral Health Prev Dent., v. 4, p. 227-233, 2006.
YALCIN, S. et al. The effect of hormone replacement therapy, alendronate, and calcium on salivary parameters in postmenopausal women. Journal of Clinical Dentistry, v. 18, n. 2, p. 117-122, 2007.
YOULDEN, D. R. et al. The descriptive epidemiology of female breast cancer: an international comparison of screening, incidence, survival, and mortality. Cancer Epidemiology, v. 36, p. 237-248, 2012.
ZAMPIERI, M. F. M. et al. O processo de viver e ser saudável das mulheres no climatério. Esc Anna Nery Rev. Enferm., v. 13, n.2, p. 305-312, 2009.
ZOUBOULIS, C. C. et al. Aesthetic aspects of skin aging, prevention, and local treatment. Clin Dermatol., v. 37, n. 4, p. 365-372, 2019
