REGISTRO DOI: 10.5281/zenodo.10207804
Matheus Trindade Rios;
Ana Oclenidia Dantas Mesquita.
Resumo:
A infecção por Candida Auris representa uma problemática mundial, determinada pela sua capacidade de desenvolver mecanismos de tolerância farmacológica que lhe confere múltipla resistência a diferentes classes de antifúngicos disponíveis no mercado. Considerando emergência e o potencial patogênico do Candida Auris, o presente trabalho tem por objetivo analisar os mecanismos de resistência farmacológica do Candida Auris. Trata-se de uma revisão sistemática realizada por meio da consulta de bases de dados do PubMed, ao qual foram selecionados 16 estudos para revisão. A análise indica que o Candida Auris apresenta alta capacidade mutagênica responsável pela formação de biofilmes, o funcionamento de bombas de efluxo, a alteração dos alvos farmacológicos e o aumento da tolerância ao estresse celular causado pelos antifúngicos. Constatou-se que a resistência não é onipresente e relaciona-se ao clado de origem e ao local de coleta da amostra. O Candida Auris é uma espécie pouco estudada, o que torna imprescindível mais estudos sobre os mecanismos moleculares envolvidos na resistência farmacológica.
Palavras-chave: Candida Auris, resistência antifúngica, mecanismos de resistência farmacológica, mutação genética.
Introdução:
O Candida Auris é um patógeno humano capaz de provocar infecções invasivas com altas taxas de mortalidade, e resistência, possui pelo menos três classes antifúngicas diferentes. A evidência atual sugere que o C. Auris emergiu de países no leste asiático ou simultaneamente em partes da Ásia e da África, com o primeiro caso descrito no Japão em 2009. No Brasil, o primeiro caso de C. Auris foi identificado em 2020 em um hospital do estado da Bahia, desde então já foram notificados pelas autoridades sanitárias de saúde 47 casos e 4 leveduras ambientais oriundas do estado do Pernambuco totalizando 51 isolados de C. Auris (Melo et al., 2023).
Seu alto potencial de patogenicidade e multirresistência aos antifúngicos utilizados na prática clínica tornou a infecção por C. Auris uma ameaça mundial a saúde pública (Shastri et al., 2020). A infecção e a colonização por C. Auris é descrita principalmente em pacientes de unidades de terapia intensiva, transplantados, com comorbidades ou com a imunidade comprometida. A sua elevada capacidade de colonização e permanência em superfícies, dispositivos e equipamentos médicos, contribui para a sua disseminação em ambiente hospitalar, sendo difícil sua eliminação, já que pode colonizar também a pele dos profissionais de saúde (Allert et al., 2022).
Em virtude da complexidade e da demora em determinar o sequenciamento genético do C. Auris e a inviabilidade da aplicação de métodos convencionais empregados rotineiramente nas análises clínicas, a identificação biomolecular do C. Auris pode ser comprometida, o que dificulta o enfrentamento adequado e a adoção de uma abordagem clínica favorável ao paciente (Mizusawa et al., 2017). Outros fatores de risco relevantes são a exposição aos antibióticos de amplo espectro, o uso de cateteres venosos centrais, urinários, cirurgia abdominal, fístulas abdominais, uso de antifúngicos, e o uso de imunossupressores (Vinayagamoorthy et al., 2022).
A resistência antifúngica é generalizada em várias amostras isoladas provenientes dos cinco continentes, os espécimes estudados apresentam diferentes graus de resistência aos medicamentos indicados para o tratamento da cândida.spp, que inclui a classe de fármacos antifúngicos: azóis, derivados poliênicos e equinocandinas. Estima-se que 90% das amostras isoladas de C. Auris adquiriram resistência a pelo menos uma classe de antifúngicos, enquanto 30 a 40% são resistentes a duas classes de antifúngicos e cerca 4% é pan-resistente (resistente as três principais classes de antifúngicos) (Carolus et al., 2021).
O C. Auris é capaz de se tornar resistente a cada droga ou a combinações de drogas antifúngicas, cepas multirresistes trazem maiores limitações de opções para o tratamento farmacológico. A resistência aos antifúngicos do C. Auris é atribuída a sua alta capacidade mutagênica impulsionada por fatores ecológicos, como o avanço do urbanismo em detrimento das áreas florestais, o aquecimento global, o emprego exacerbado de antifúngicos na agricultura, e outras questões envolvendo o uso irracional de antibióticos, a atividade humana e a globalização (Jacobs et al., 2022).
Considerando a emergência do C. Auris como patógeno e seu potencial sem precedentes de adquirir resistência a multidrogas, o presente trabalho tem por objetivo analisar os mecanismos de resistência do C. Auris aos antifúngicos disponíveis e expor novas perspectivas de tratamento farmacológico.
Metodologia
Elaborou-se uma revisão sistemática mediante artigos de base de dados eletrônicos, sendo selecionados publicações entre os anos 2015 e 2023, no idioma Inglês. Utilizou-se como base de coleta de dados o repositório digital PubMed, as seguintes palavras-chaves foram empregas: cândida auris, multi-drugs resistance, epidemiology, pan-resistance, imune responses, pathogenicity, agrupados aos pares.
A estratégica de busca adotada consiste na combinação do descritor primário (Candida Auris) e secundários (multi-drugs, resistance, pan-resistance, epidemiology, imune responses, pathogenicity) (Tabela 1).
Base de Dados Descritor Primário Operador Booleanos Descritor Secundário PubMed Canida Auris AND Multi-drugs ResitanceImmune responses Pathogenicity Pan-resistance Epidemiology
Foi estabelecido como critério de inclusão os artigos íntegros, completos, disponíveis de forma gratuita, no espaço temporal delimitado, e que contemplasse os objetivos do estudo. Foram excluídos artigos de revisão, teses, dissertações, monografias, artigos com busca repetida, ou artigos que disponibilizassem somente o resumo para consulta.
Foram identificados 1.764 artigos relacionados aos descritores escolhidos para a pesquisa. Após a leitura e avaliação dos títulos e resumos, foram selecionados 53 estudos dos quais ao fim da leitura, apenas 16 atenderam aos critérios determinados (Figura 1.). Das publicações selecionadas, predominaram ensaios laboratoriais in vitro, testes de susceptibilidade antifúngica e análises de mutações genéticas (Tabela 2).
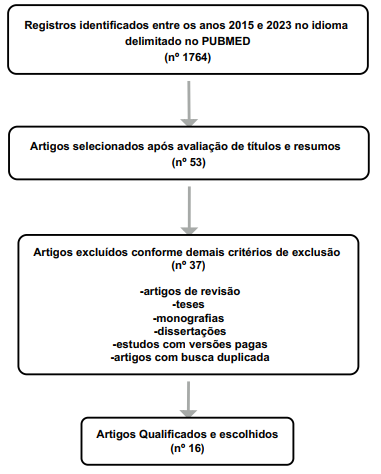
Figura 1. Fluxograma do processo de seleção
Tabela 2. Características dos estudos incluídos na revisão.
Chowdhary et al., 2018 Análise de susceptibilidade antifúngica Índia Choe et al., 2018 Análise Molecular de transmissão de multi-resistência farmacológica Estados Unidos Chatterjee et al., 2015 Análise genômica de patógeno multirresistente Índia Escandón et al., 2019 Análise epidemiológica molecular em resistência a Anfotericina B Colômbia Healey et al., 2018 Análise de mutações no gene ERG11 Estados Unidos Jacobs et al., 2022 Caracterização, susceptibilidade antifúngica e combinações farmacológicas Estados Unidos Carolus et al., 2021 Análise genômica dos mecanismos de multi-resitência farmacológica Bélgica Ami et al., 2017 Análise de Multi-resistência farmacológica Israel Adams et al., 2018 Susceptibilidade antifúngica a amostras hospitalares e ambientais Estados Unidos Larkin et al., 2017 Fatores de virulência, crescimento, atividade antifúngica, morfologia e formação de biofilmes Estados Unidos Romera et a., 2019 Formação de biofilmes e susceptibilidade a fármacos antifúngicos Espanha Chow et al,. 2020 Análise genômica da evolução e expansão global do Candida Auris Estados Unidos Sharma et al., 2016 Sequenciamento genético de isolados multi-resistentes Índia Kim et al., 2019 Análise genética e implicações da mutação Hsp90 na tolerância a azóis Estados Unidos Day et al., 2018 Análise dos mecanismos de tolerância ao estresse antifúngico em mutações no gene Hog1 Reino Unido Alfouzan et al., 2020 Análise molecular epidemiológica Kuwait
Resultados
A resistência a ação farmacológica tornou-se evidenciada pela determinação da concentração inibitória mínima (CIM) pelo método de microdiluição em calda seguindo os critérios determinados pela Clinical & Laboratories Standards Institute (CLSI). Para avaliação e investigação dos mecanismos de resistência prevaleceram os estudos de sequenciamento da base genética, análise filogenética, extração de DNA, PCR alelo específico, expressão genética, indução a aquisição de resistência antifúngica in vitro e ontologia genética.
Atualmente há cerca 304 cepas variantes de C. Auris sequenciadas, que estão divididas em quatro clados principais distribuídos geograficamente em: (I) Sul da Ásia, (II) Leste da Ásia, (III) Sul da África e (IV) América do Sul. Deste total, 7,0% dos isolados são referidos como resistentes a equinocandinas, 23% a Anfotericina B e 80% ao Fluconazol.
Das amostras analisadas, as que demonstraram resistência a uma ou mais classes farmacológicas eram provenientes de unidades hospitalares, coletados de fístulas intra-abdominais, cateteres, acessos, líquido do pericárdio, pele, axila sangue e urina. As amostras obtidas a partir de leveduras ambientais mostraram ser susceptíveis a ação de equinocandinas e triazóis em concentração inibitória mínima (CIM) baixas.
De modo geral, os artigos avaliados reportaram como mecanismos de resistência: mutações missense, aneuploidiais e não sinônimas que confere alterações nos alvos farmacológicos, a expressão de genes envolvidos no funcionamento de bombas de efluxo e a formação de biofilmes que impedem o acesso da droga ao seu alvo celular local. Vale destacar que nas pesquisas avaliadas, predominou a resistência secundária, observada em pacientes e amostras que foram expostos previamente a antifúngicos, antibióticos ou a imunossupressores.
Foram relatadas mutações que substituíam o gene (ERG11) por (K143R) e (CDR1), promovendo respectivamente modificações nas vias de síntese do ergosterol e a regulação de bombas de efluxo, sendo associado a resistência farmacológica a classe dos azóis. Uma deleção no códon do gene TAC1b (exerce controle positivo sobre o gene CDR1) resultou na expressão de transportadores ABC (ATP-binding cassete) envolvidos no transporte de moléculas através de membranas biológicos, contribuindo assim para o efluxo de triazóis. Chowdhary et al. (2018) atribuem as substituições (K143R) e (Y132F) a elevadas CIM ao Fluconazol (32 a 64g/ml) e ao Voriconazol (0,5 a 2g/ml). Contudo um estudo com cepas de C. Auris selvagens, demonstraram CIMs suscetíveis de 16 g/ml para Fluconazol e 0,12 g/ml para Voriconazol (Kelly et al., 2018).
Cepas resistentes ao Fluconazol são mais propensas a desenvolver mecanismos de resistência a ação de Equinocandinas. Ensaios realizados por Hans et al. (2021) demonstraram o surgimento de mutações independentes em amostras que adquiriram resistência prévia ao Fluconazol, uma deleção de códon (ttcttg/ttgjFL635L) no gene FKS1 e duas mutações missenses, uma no gene PEA2 (gAt/gTtjD367V), e outra no gene CIS2 (Gca/AcajA27T).
Jacobs et al. (2022) e Hans et al. (2021) indicam que a monorresistência a Caspofungina emergiu de duas mutações no gene FKS1: uma mutação missense (atG/atAjM690I), e a mesma supressão no códon (ttcttg/ttgjFL635L), e uma mutação missense (atG/atAjL207I) no gene ERG3 que codifica o esterol D5,6-desaturase. As alterações no gene FKS1 parecem modificar a subunidade catalítica do alvo farmacológico das equinocandinas a b(1,3) D-glucano sintase.
O surgimento dessas mutações foi acompanhado de uma redução drástica da susceptibilidade a Caposfungina,representada por um aumento de 500 vezes a CIM50 de 0,125mg/ml para 64mg/ml, com as alterações no gene CIS2 e ERG3 levando a CIM50 superiores aos 64mg/ml.
Com relação a flucitosina (5-FC), as células da C. Auris desenvolveram mutações em genes envolvidos na absorção e metabolismo da 5-FC. Mutações nos genes FCY1, FUR1 e ADE17, limitam a conversão de 5-FC para 5-FU resultando em resistência a flucitosina (Jacobs et al., 2022).
Os mecanismos por trás da resistência a ação da Anfotericina B no tratamento de candidemia por C. Auris ainda não estão completamente esclarecidos. Potenciais mecanismos de resistência a Anfotericina B incluem o polimorfismo de nucleotídeo único em 5 lócus gênicos diferentes (utg4_968953/ utg5_821828/ utg4_160118/ utg4_352365/ utg3_385439). A mutação utg5_821828 codificou um fator de transcrição semelhante ao FLO8, também associado a resistência do Candida Albicans a anfotericina B pela formação de biofilmes. Na mutação utg4_968953 houve uma substituição do aminoácido isoleucina pelo aminoácido treonina implicando em um gene previsto como transportador de membrana (Escandón et al., 2018).
A análise genômica realizada por Hans et al. 2021, revelou novas mutações no gene MEC3 responsáveis por reduzir em duas vezes a susceptibilidade à anfotericina B (CIM50 de 2 mg/ml para uma CIM50 de 4 mg/ml). Entretanto a mutação FLO8 não alterou a susceptibilidade à anfotericina B nas concentrações em que foram expostas.
Discussão
O C. auris é classificada como um filo Ascomycota (ascósporos) pertencente à família Saccharomycetaceae do gênero Candida, a virulência é atribuída a sua capacidade de adesão as células hospedeiras incluindo a secreção de enzimas fosfolipases, proteinases e a formação de agregados celulares protegidos por uma matriz glucana. As espécies de C. auris não costumam formar hifas ou pseudohifas, entretanto ocasionalmente há relatos de formações rudimentares de hifas (Larkin et al., 2017).
O alinhamento de sequências completo realizado por Chatterjee et al. (2015) revelou uma discrepância genômica das espécies de C. auris em comparação a outras espécies de Candida. spp patogênicas (C.albicans, C. glabrata, C. lusitanie e C. parapsilosis). Considerando a alta variabilidade genômica do C. auris, estudos apontam para a presença de proteínas ortológas funcionais de genes responsáveis por caracterizar mecanismos de resistência antifúngica, encontrados em outras espécies de fungos.
Esses achados incluem transportadores ortológos responsáveis pela regulação positiva de transportadores ABC (ATP-binding cassete) e pela transcrição do gene MDR1, semelhantes aos mecanismos de resistência expressos pelo C. Albicans. A expressão destas bombas de efluxo justifica a baixa susceptibilidade dos antifúngicos ao C. Auris.
Também é conservado o gene Hog1, implicado no aumento da tolerância de fungos patogênicos a produtos químicos fungicidas e a peptídeos antifúngicos, e a presença de dois ortólogos de aspartil proteases que são conhecidos por desenvolver fatores de virulência que desempenham um papel na formação de biofilmes (Day et al., 2018). Diferentemente das outras espécies de Candida spp., o C. Auris demonstrou evolução em múltiplos mecanismos conhecidos por estarem envolvidos na resistência antifúngica.
Os fármacos Triazóis são conhecidos por fazerem parte do tratamento de uma variedade de espécies de Candida. spp, devido a sua capacidade de inibir a conversão do lanosterol em ergosterol, componente essencial para a constituição da parede celular do fungo. No entanto o uso extensivo em tratamentos de longa duração, levou ao surgimento de mutações no gene ERG11 e K143R, comumente relatados em diversos isolados (Chow et al., 2019). A resistência aos Triazóis é descrita majoritariamente ao Fluconazol, e com menos frequência ao Voriconazol e a outros fármacos da classe.
Os fungos assim como outros microrganismos, apresentam grupos de proteínas responsáveis pelo funcionamento de bombas de efluxo, os quais evitam o acúmulo de altas concentrações de antifúngicos, reduzindo seus efeitos (Lockhart, 2019). Dentre os estudos analisados, a expressão de proteínas transportadoras ABC (ATP-binding cassete), é o principal mecanismo de bomba de efluxo associado a resistência do C. Auris aos Triazóis.
A regulação dessas bombas de efluxo, seria o resultado de uma deleção no códon do gene TAC1b, que exerce controle positivo sobre o gene CDR1, que atua no transporte de moléculas em membranas biológicas, observado principalmente em amostras multi-resistentes de C. Auris (Hans et al., 2021). As mutações no gene ERG11 e K143R estariam mais relacionadas a alterações na codificação do C-14-a-desmetilase, principal alvo farmacológico dos triazóis (Kim et al., 2019).
Recentemente, foram descobertos outros mecanismos de resistência do C. auris aos Triazóis, relacionados a mutações no gene HSP90. Kim et al. (2019), implica que o HSP90 promove alterações morfológicas em fungos, suprimindo a transição da fase de levedura para a fase filamentosa, sendo essencial para o crescimento do C. auris e para sua tolerância clínica aos Triazóis. O HSP90 estabiliza a célula em resposta ao estresse causado por antifúngicos, e sua inibição mostrou reduzir a tolerância do C. auris ao Fluconazol exercendo uma ação fungicida.
A resistência prévia aos Triazóis parece ser um fator importante para a aquisição de resistência a Polienos e Equinocandinas. A resistência aos Polienos é frequentemente rara na maioria das espécies de Candida. Spp, a Anfotericina B é o único fármaco da classe avaliado nos estudos de resistência ao C. auris, entretanto o mecanismo molecular por trás dessa resistência ainda não está esclarecido. Os mecanismos mais prováveis indicam, alterações nas vias de síntese de ergosterol incluindo mutações nos genes ERG2, ERG3, ERG6, FLO8 (Escandón et al., 2018).
A Anfotericina B interage com ergosterol presente na membrana celular dos fungos, formando poros iônicos que vazam o conteúdo intracelular. A teorização principal prediz que a exposição aos fármacos Triazóis reduzem a concentração de ergosterol ou induzem a alterações nas vias de síntese de ergosterol resultando em resistência aos Polienos, isso se deve a duas alterações no gene ERG11 e ERG3 (Chowdhary et al., 2018).
Hans et al. (2021) associa as mutações no gene MEC3 a redução da susceptibilidade da Anfotericina B ao C. auris, porém o mecanismo por trás dessa resistência não está claro. A conjectura principal aponta que o gene MEC3 estaria relacionado ao reconhecimento de danos e reparo do DNA, o que pode prevenir a apoptose pós exposição a Anfotericina B, já que um dos modos de ação da Anfotericina B inclui a atividade citotóxica por meio da carbonilação de proteínas e danos ao DNA (Carolus et al., 2021).
Em relação a classe das equinocandinas, a resistência foi observada e avaliada predominantemente nos fármacos Caposfungina e Micafungina. Para exercer sua ação, as equinocandinas inibem a B-1,3-D-glucano sintase, um polissacarídeo responsável pela biossíntese do principal elemento estrutural da parede celular dos fungos. A codificação de genes FKS1, FKS2 e FKS3 geram alterações na enzima alvo das Equinocandinas (β-1,3-d-glucano sintase), o que confere resistência e falhas clínicas no tratamento (Perlin, 2015).
Apesar de amostras resistentes ao Fluconazol demonstrarem ser mais susceptíveis a adquirir resistência a Equinocandinas, o mecanismo de resistência as Equinocandinas é altamente específico e distinto dos Triazóis. No geral as mutações no gene FKS, ocorrem em três locais denominados “hotspots”, outrossim novas substituições de codons emergem no gene FKS1 e no gene ERG3 sendo associado a resistência em Triazóis e Equinocandinas (Alfouzan et al., 2020).
O papel que as mutações no gene CIS2 desempenham a respeito da resistência a equinocandinas permanece obscurecido. Hans et al., 2021 aponta que o gene CIS2 é envolvido na biogênesi da parede celular de fungos, na degradação de glutationa e na detoxificação de xenobióticos. A hipótese principal é que as alterações nesse gene neutralizam o estresse oxidativo provocado por medicamentos antifúngicos.
A resistência do C. Auris a Flucitosina pode ser designida como primária quando reduz a absorção do fármaco e secundária quando limita a conversão da 5FC em 5FU. A flucitosina (5FC) deve penetrar a célula fúngica por uma permease citosina específica e sofrer ação metabólica no interior da célula, sendo convertida em 5-fluorouracila (5-FU) e 5-fluorodesoxiuridina 5′-monofosfato que interropem a síntese de DNA (Jacobs et al., 2022).
As mutações não sinônimias no gene FCY2 alteram a permease purina-citosina, transportador que age na absorção da flucitosina, já as deleções sofridas no gene FUR1 e no gene ADE17 observadas em amostras pan-resistens, reduzem a conversão da 5FC em 5FU, provavelmente por alterar as vias de biossíntese de purinas, por meio da expressão de atividades da uracil fosforibosiltransferase e do ribonucleotídeo 5-aminoimidazol-4-carboxamida (Jacobs et al., 2022). Todavia ainda carecem estudos e experimentos para a confirmação desses mecanismos.
O aumento de cepas multirresistentes aos fármacos antifúngicos, é um alarme mundial para a saúde pública, reduzindo as opções terapêuticas disponíveis. O acúmulo de mutações que desencadearam a pan-resistência, é o resultado de exposições prolongadas a antifúngicos e antibióticos de amplo espectro principalmente aplicados na profilaxia, e prediz um risco sem precedentes de infecção e transmissão do C. auris em unidades de saúde. A microbiota natural desses pacientes é drasticamente alterada e perturbam o equilíbrio em relação a colonização e disponibilidade de receptores celulares o que torna o meio favorável para a ação oportunista do C. auris (Kumar et al., 2016).
Por se tratarem de fármacos antifúngicos que apresentam ação fungistática em relação ao C. Auris, a imunidade desempenha um papel crucial na eliminação do microorganismo. Desse modo o uso de imunossupressores como a Ciclosporina e Glicocorticóides, compromete a ação desempenhada pelos neutrófilos e macrófagos, principais células de defesa empregadas contra invasões por fungos (Pharkjaksu et al., 2022).
Wang et al. (2022) aponta que o C. Auris pode ter desenvolvido mecanismos de evasão da imunidade inata suprimindo produção de citocinas (IL-1β and IL-1RA), reduzindo a resposta inflamatória através da formação de uma camada externa de manano que oculta os receptores B-glucano. Essa supressão das vias inflamatórias, compromete a eficácia final do tratamento com antifúngicos de ação fungistática, que atuam inibindo o crescimento fúngico enquanto o sistema imunológico se encarrega de erradicar a infecção.
A sinergia entre fármacos antifúngicos efetuada in vitro, provou reduzir a CIM em algumas cepas, sendo as combinações mais eficientes entre Caspofungina e Anfotericina B, e Flucitosina e Anfotericina B, todavia foi notificado o surgimento de cepas resistentes que se mostraram indiferentes as cobinações farmacológicas (Brein et al., 2020). Nessa perspectiva, novas classes de medicamentos vem sendo desenvolvidos.
O Ibrexafungerp é o primeiro medicamento da classe dos triterpenoídes, que desmonstrou alta atividade in vitro contra o C. Auris, com ação semelhante aos medicamentos da classe das equinocandinas. Tambem é estudado alternativas para o tratamento de candidiase invasa por C. Auris com o medicamento Fosmanogepix, um inibidor da sítese da proteína ancorada glicosilfosfatidilinositol (Hoenigl et al., 2021). Têm se estudado a capacidade do composto Arylamidine T-2370 um inibidor da respiração celular (promove disfunção mitôcondrial), ser empregado como medicamento para o tratamento da infecção por C. Auris (Wiederhold et al., 2020).
Conclusão
O C. Auris, demonstrou alta capacidade de mutação e desenvolvimento de novos mecanismos de resistência farmacológica, que o tornaram apto a sobreviver ao estresse provocado pelos antifúngicos. Ao mesmo tempo, a variação genética do C. Auris em diferentes clados, dificulta o estudo dos mecanismos moleculares por trás da resistência a diferentes classes farmacológicas. A resistência do Candida Auris aos antifungicos mostrou não ser onipresente, e depende do local de infecção, exposição farmacológica e do Clado de origem. Até o momento, não há um regime de tratamento ideal, nem protocolos terapêuticos que possam orientar os profissionais de saúde, somente estudos in vitro com novas classes farmacológicas promissoras. Embora a infecção por C. Auris se apresente com altas taxas de mortalidade e um certo grau de risco para a saúde pública, a espécie ainda é pouco estudada. É necessário estudos mais aprofundados sobre os mecanismos de resistência e fatores moleculares envolvidos na tolerância farmacológica do C. Auris.
Referências
ADAMS, Eleanor; QUINN, Monica; TSAY, Sharon; POIROT, Eugenie; CHATURVEDI, Sudha; SOUTHWICK, Karen; GREENKO, Jane; FERNANDEZ, Rafael; KALLEN, Alex; VALLABHANENI, Snigdha; HALEY, Valerie; HUTTON, Brad; BLOG, Debra; LUTTERLOH, Emily; ZUCKER, Howard. Candida auris in Healthcare Facilities, New York, USA, 2013–2017. Emerging Infectious Diseases, New York, v. 24, n.10, out. 2018
ALFOUZAN, Wadha; AHMAD, Suhail; DHAR, Rita; ASADZADEH, Mohammad; ALMERDASI, Noura; ABDO, Naglaa M.; JOSEPH, Leena; GROOT, Theun; Alali, Walid Q.; KHAN, Ziauddin; MEIS, Jacques F.; AL-RASHID, Mohammad R. Molecular Epidemiology of Candida Auris Outbreak in a Major Secondary-Care Hospital in Kuwait. Journal of Fungi, v. 6, n. 307, nov. 2020.
ALLERT, Stefanie; SCHULZA, Daniela; KAMMERA, Philipp; GROßMANNB, Peter; WOLFB, Thomas; SCHÄUBLEB, Sascha; PANAGIOTOU, Gianni; BRUNKE, Sascha; HUBE, Bernhard. From environmental adaptation to host survival: Attributes that mediate pathogenicity of Candida auris. Taylor & Francis Group, v. 13, n. 1, p. 191-214, 2022.
AMI, Ronen Bem; BERMAN, Judith; NOVIKOV, Ana; BASH, Edna; MEYOUHAS, Yael Shachor; ZAKIN, Shiri; MAOR, Yasmin; TARABIA, Jalal; SCHECHNER, Vered; ADLER, Amos; FINN, Talya. Multidrug-Resistant Candida haemulonii and C. auris, Tel Aviv, Israel. Medscape Education, Tel Aviv, v. 23, n. 2, fev. 2017.
CAROLUS, Hans; PIERSON, Siebe; MUÑOZ, José F.; SUBOTI, Ana; Cruz, Rita B.; CUOMO, Christina A.; DIJCKA, Patrick Van. Genome-Wide Analysis of Experimentally Evolved Candida auris Reveals Multiple Novel Mechanisms of Multidrug Resistance. American Society for Microbiology, v. 12, n. 02, mar./abril. 2021.
CHATTERJEE, Sharanya; ALAMPALLI, Shuba Varshini; NAGESHAN, Rishi Kumar; CHETTIAR, Sangeeta Joshi; TATU, Utpal S. Draft genome of a commonly misdiagnosed multidrug resistant pathogen Candida auris. BMC Genomics, Karnataka, v. 16, p. 686, 2015.
CHOW, Nancy A.; GADE, Lalitha; TSAY, Sharon V.; FORSBERG, Kaitlin; GREENKO, Jane A.; SOUTHWICK, Karen L.; BARRETT, Patricia M.; KERINS, Janna L. Multiple introductions and subsequent transmission of multidrug-resistant Candida auris in the USA: A molecular epidemiological survey. Lancet Infect Dis, Atlanta, v. 18, n. 12, p. 1377-1384, dez. 2018.
CHOW, Nancy A.; MUÑOZ, José F; GADE, Lalitha; BERKOW Elizabeth L.; LI, Xiao; WELSH, Rory M.; FORSBERG, Kaitlin; LOCKHART, Shawn R.; ADAM, Rodney; ALANIO, Alexandre; ALASTRUEY-IZQUIERDO, Ana; ALTHAWADI, Sahar; ARAÚZ, Ana B.; BEN-AMI, Ronen; BHARAT, Amrita; CALVO, Belinda; DESNOS-OLLIVIER, Marie; ESCANDÓN, Patricia; GARDAM, Dianne; GUNTURU, Revathi; HEATH, Christopher H.; KURZAI, Oliver; MARTIN, Ronny; LITVINTSEVA, Anastasia P.; CUOMOB, Christina A. Tracing the Evolutionary History and Global Expansion of Candida auris Using Population Genomic Analyses. American Society for Microbiology, v. 11, n.02, abril. 2020.
CHOWDHARY, Anuradha; PRAKASH, Anupam; SHARMA, Cheshta; KORDALEWSKA, Milena; KUMAR, Anil; SARMA, Smita; TARAI, Bansidar; SING, Ashutosh; UPADHYAYA, Gargi; YADAV, Priyanka; SINGH, Pradeep K.; KHILLAN, Vikas; SACHDEVA, Neelam; PERLIN, David S.; MEIS, Jacques F. A multicentre study of antifungal susceptibility patterns among 350
Candida auris isolates (2009–17) in India: role of the ERG11 and FKS1
genes in azole and echinocandin resistance. Journal of Antimicrobial Chemotherapy, Delhi, v .73, p. 891-899, jan. 2018.
DAY, Alison M.; MCNIFF, Megan M.; DANTAS, Alessandra da Silva; GOW, Neil A. R.; QUINN, Janet. Hog1 Regulates Stress Tolerance and Virulence in the Emerging Fungal Pathogen Candida auris. American Society for Microbiology, Aberdeen, v. 03, n. 05, out. 2018.
ESCANDÓN, Patricia; CHOW, Nancy A.; CACERES, Diego H.; GADE, Lalitha; BERKOW, Elizabeth L.; ARMSTRONG, Paige; RIVERA, Sandra; MISAS, Elizabeth; DUARTE, Carolina; MEISSNER, Heather Moulton; WELSH, Rory M.; PARRA, Claudia; PESCADOR, Luz Angela; SALCEDO, Nohora Villalobos Soraya; BERRIO, Indira; VARÓN, Carmen; BODE, Andrés E.; LOCKHART, Shawn R.; JACKSON, Brendan R.; LITVINTSEVA Anastasia P.; BELTRAN, Mauricio; CHILLER, Tom M. Molecular Epidemiology of Candida auris in Colombia Reveals a Highly Related, Countrywide Colonization With Regional Patterns in Amphotericin B Resistance. Clinical Infectious Diseases, v. 68, n. 01, p. 15-21, mai. 2019.
HEALEY, Kelley R.; KORDALEWSKA, Milena; ORTIGOSA, Cristina Jiménez; SINGH, Ashutosh; BERRÍO Indira; CHOWDHARY, Anuradha; PERLIN, David S. Limited ERG11 Mutations Identified in Isolates of Candida auris Directly Contribute to Reduced Azole Susceptibility. American Society for Microbiology, v. 62, n. 10, out. 2018.
HOENIGL, Martin; SPRUTE, Rosanne; EGGER, Matthias; ARASTEHFAR, Amir; CORNELY Oliver A.; KRAUSE, Robert; LASS-FLÖRL, Cornelia; PRATTES, Juergen; SPEC, Andrej; THOMPSON, George R.; WIEDERHOLD, Nathan; JENKS, Jefrey D. The Antifungal Pipeline: Fosmanogepix, Ibrexafungerp, Olorofm, Opelconazole, and Rezafungin. Drugs, v. 81, n. 15, p. 1703-1729, out. 2021.
JACOBS, Samantha E.; JACOBS, Jonathan L.; DENNIS, Emily K.; TAIMUR, MeenakshiRana; PATEL, Dhruv; Gitman, Melissa; PATEL, Gopi; SCHAEFER, Sarah; IYER, Kishore; Moon, Jang; ADAMS, Victoria; LERNER, Polina; Walsh, Thomas J.; ZHU, YanChun; ANOWER, Mohammed Rokebul; VAIDYA, Mayuri M.; CHATURVEDI, Sudha; CHATURVEDI, Vishnu. Candida auris Pan-Drug-Resistant to Four Classes of Antifungal Agents. American Society for Microbiology, New York, v. 66, n. 07, jul. 2022.
KIM, Sang Hu; IYER, Kali R.; PARDESHI, Lakhansing; MUÑOZ, José F.; ROBBINS, Nicole; CUOMO, Christina A.; WONG, Koon Ho; COWENA, Leah E. Genetic Analysis of Candida auris Implicates Hsp90 in Morphogenesis and Azole Tolerance and Cdr1 in Azole Resistance. American Society for Microbiology, v. 10, n. 01, jan./fev. 2019.
KUMAR Anil; PRAKASH Anupam; SINGH Ashutosh; KUMAR Harish; HAGEN Ferry; Meis Jacques F.; CHOWDHARY, Anuradha. Candida haemulonii species complex: an emerging species in India and its genetic diversity assessed with multilocus sequence and amplified fragment-length polymorphism analyses. Emerging Microbes and Infections, v. 5, n. 49, fev. 2016.
LARKIN, Emily; HAGER, Christopher; CHANDRA, Jyotsna; MUKHERJEE, Pranab K.; RETUERTO, Mauricio; SALEM, Iman; LONG, Lisa; ISHAM, Nancy; KOVANDA, Laura; ESODA, Katyna Borroto; WRING, Steve; ANGULO, David; GHANNOUMA, Mahmoud. The Emerging Pathogen Candida auris: Growth Phenotype, Virulence Factors, Activity of Antifungals, and Effect of SCY-078, a Novel Glucan Synthesis Inhibitor, on Growth Morphology and Biofilm Formation. American Society for Microbiology, New Jersey, v. 61, n. 5, mai. 2017.
LOCKHART, S.R. Candida auris and multidrug resistance: Defining the new normal. Fungal Genet and Biology, v. 131, n.103243, 2019.
Melo, Camylla Carvalho de; Sousa, Bruna Rodrigues; Costa, Gisela Lara da; Oliveira, Manoel Marques Evngelista; Neto, Reginaldo Gonçalves de Lima. Colonized patients by Candida auris: Third and largest outbreak in Brazil and impact of biofilm formation. Frontiers, jan. 2023.
O’ BREIN, Brittany; LIANG Jiali; CHATURVEDI, Sudha; JACOBS, Jonathan L.; CHATURVEDI, Vishnu. Pan-resistant Candida auris: New York subcluster susceptible to antifungal combinations. The Lancet Microbe, v. 1, n. 5, set. 2020.
PERLIN, David S. Mechanisms of echinocandin antifungal drug resistance. Department of Health & Human Services USA, v. 1354, n. 1, p. 1-11, set. 2015.
PHARKJAKSU, Sujiraphong; BOONMEE, Nawarat; MITRPANT, Chalermchai; NGAMSKULRUNGROJ, Popchai. Immunopathogenesis of Emerging Candida auris and Candida haemulonii Strains. Journal of Fungi, v. 7, n.725, set. 2021.
ROMERA, David; CORREA, John J. A.; GADEA, Ignacio; SANDOVAL, Lourdes V.; RODRÍGUEZ, Julio García; ESTEBAN, Jaime. Candida auris: a comparison between planktonic and biofilm susceptibility to antifungal drugs. Jornal of Medical Microbiology, Madrid, v. 68, p. 1353-1358, jul. 2019.
SHARMA, C.; KUMAR, N.; PANDEY, R.; MEIS, J. F.; CHOWDHARY, A. Whole genome sequencing of emerging multidrug resistant Candida auris isolates in India demonstrates low genetic variation. Elsevier Ltd, Delhi, v. 13, p. 77-82, 2016.
SHASTRI, Prakash S.; SHANKARNARAYAN, Shamanth A.; OBEROI, Jaswinder; RUDRAMURTHY, Shivaprakash M.; WATTAL, Chand.; CHAKRABARTI, Arunaloke. Candida auris candidaemia in an intensive care unit – prospective observational study to evaluate epidemiology, risk factors, and outcome. Journal of Critical Care, v. 57, p. 42-48, jun. 2020.
VINAYAGAMOORTHY, Kalaiselvi; PENTAPATI, Kalyana Chakravarthy; PRAKASH, Hariprasath. Prevalence, risk factors, treatment and outcome of multidrug resistance Candida auris infections in Coronavirus disease (COVID-19) patients: A systematic review. Wiley Mycoses, v. 65, p. 613-624, fev. 2022.
WANG Y.; ZOU Y.; CHEN X.; LI H.; YIN Z.; ZHANG B.; XU Y.; ZHANG Y.; ZHANG R.; HUANG X.; YANG W.; XU C.; JIANG T.; TANG Q.; ZHOU Z.; JI Y.; LIU Y.; HU L.; ZHOU J.; ZHOU Y.; ZHAO J.; LIU N.; HUANG G.; CHANG H.; FANG W.; CHEN C.; ZHOU D. Innate immune responses against the fungal pathogen Candida auris. Nature Communications, Shangai, n. 13, p.35-53, 2022.
WIEDERHOLD, Nathan P.; Najvar, Laura K.; Jaramillo, Rosie; Olivo, Marcos; Patterson, Hoja; Connell, April; Fukuda, Yoshiko; Mitsuyama, Junichi; Catano, Gabriel; Patterson; Thomas F. The Novel Arylamidine T-2307 Demonstrates In Vitro and In Vivo Activity against Candida auris. American Society for Microbiology, Texas, v. 64, n. 3, fev. 2020.
