AGGRESSION AND DEFENSE MECHANISM ABOUT P53 IN BREAST CANCER
REGISTRO DOI: 10.5281/zenodo.8428027
Ana Claudia Jose dos Santos1;
Barbara Batista Braga1;
Orientador: Danilo Dias da Silvia2.
RESUMO
O câncer de mama é uma doença genética que ocorre devido a proliferação desordenada das células mamárias que sofreram mutações em partes específicas do genoma. No genoma existem proto-oncogenes que são responsáveis por fazerem a proliferação celular, mas quando há sua ativação errônea em células normais, eles se tornam oncogenes, que são versões mutadas defeituosas das proto-oncogenes, fazendo com que as células percam o controle da divisão celular. Uma das principais proteínas no câncer de mama é a P53, uma proteína codificada pelo gene TP53, localizada no braço curto do cromossomo 17 (17p13.1), é um gene supressor de tumor, podendo se transformar em um oncogene caso ela sofra uma mutação. As mutações no gene P53 ocorrem em mais de 50 tipos diferentes de tumores, incluindo os de bexiga, cérebro, mamas, entre outros. As mutações deste gene são encontradas em cerca de 40% dos casos de câncer da mama, em 50% das ocorrências de câncer do pulmão e em 70% dos cânceres colorretais. Tais dados demonstram que o gene P53 é extremamente importante em todas as etapas da tumorigênese. Sendo assim o objetivo deste trabalho é apresentar uma revisão da literatura sobre a carcinogênese humana e de que forma a P53 atua no câncer de mama. Para tal, foi realizada uma revisão sistemática dessa literatura, sendo utilizados as principais bases de dados. Os dados coletados reforçam a importância da P53 na tumorigênese, evidenciando que a proteína P53 está comumente mutada na maioria dos tumores, perdendo sua função de “guardião do genoma” e atuando como oncogene”.
Palavras chaves: câncer de mama, P53.
ABSTRACT
Breast cancer is a genetic disease that occurs due to the disordered proliferation of mutated breast cells. There are proto-oncogenes that are responsible for making cell proliferation, but when they are activated in normal cells, they become oncogenesis, which are defective mutated versions of proto-oncogenesis, with the purpose of transforming normal cells into cancer cells. One of the main proteins in breast cancer is P53, an oncoprotein encoded by the TP53 gene, located on the short arm of chromosome 17 (17p13.1, is a tumor suppressor gene, but it could also be a proto oncogene, if so suffer a mutation. Mutations in the P53 gene occur in more than 50 different types of tumors, including those in the bladder, brain, breast, etc. Mutations in this gene are found in about 40% of breast cancer cases in 50% of the occurrences of lung cancer and 70% of colorectal cancers. Such data demonstrate that the P53 gene is extremely important in all stages of tumorigenesis. Therefore, the objective of this paper is to present a review of the literature on human and carcinogenesis how P53 acts in breast cancer. For this purpose, a systematic review of this literature was carried out, using the main databases. The data collected reinforce the importance of P53 in tumorigenesis, showing that the protein P53 is commonly mutated in most tumors, losing its “guardian of the genome” function and acting as an oncogene”.
Keywords: breast cancer, P53.
INTRODUÇÃO
O desenvolvimento caótico de células anormais mamárias pode se transformar em câncer de mama. Este é encontrado com maior incidência em mulheres no mundo, são cerca de 2,3 milhões de novos casos estimados para 2020, representando 24,5% dos casos novos de câncer em mulheres. (01)
Assim como os outros cânceres o seu tratamento depende bastante de o quão cedo ocorreu o diagnóstico, cerca de 90% dos casos são descobertos pela própria mulher (ou pelo homem, mas são representados por 1% dos casos) através de nódulos, principal manifestação da doença, ou por outros sintomas como pele com aspecto de “casca de laranja”, saída espontânea de líquido anormal pelos mamilos, entre outros.
É sempre bom ressaltar que mulheres, independentemente da idade, devem ser estimuladas a conhecer o seu corpo para assim ter conhecimento do que é normal ou não em sua mama, além de ser recomendado pelo Ministério da Saúde que mulheres entre 50 e 69 anos realizem o exame de mamografia de rastreamento (exame realizado quando não há sinais nem sintomas suspeitos) a cada dois anos. Mamografia é uma radiografia das mamas feita por um equipamento de raios X chamado mamógrafo, capaz de identificar alterações suspeitas de câncer antes do surgimento dos sintomas, ou seja, antes que seja palpada qualquer alteração nas mamas. Atualmente no Brasil o câncer de mama é o mais relatado depois do câncer de pele não melanoma, com taxas mais elevadas nas regiões sul e sudeste, com base nos bancos de dados ocorrerão 66.280 casos novos de doenças. (01).
Como mecanismo de rastreamento precoce, podemos utilizar a bioinformática, que é a associação da computação com a biologia focadas em tratar dados biológicos. Como cita Pacheco (02), segundo Setúbal “A bioinformática depende de recursos computacionais. A genômica e as derivadas da genômica são áreas de investigação alicerçadas numa geração de dados de grande volume e esse volume de dados tem aumentado exponencialmente ao longo dos anos”
Uma das principais proteínas no câncer de mama é a P53 gene supressor tumoral, de origem plasmática, que é sintetizada pela própria célula. Ela tem como função de agir bloqueando o ciclo celular, realizando o reparo do DNA, assim como induzir a apoptose celular, mas quando ocorre a falha na expressão do gene P21, sua proteína irá agir como um bloqueador do ciclo celular, fazendo com que pare a célula no ciclo G1 para a reparação do DNA ou até mesmo a apoptose. Assim a P53 não é mais um gene supressor, ela se torna um oncogene.
Estudos comprovam que a presença dessa proteína está presente no câncer de mama com muita frequência. Em estudos analisados foi constatado que a proteína tende a formar agregados anômalos quando sofrem mutação, desempenhando um papel crucial no desenvolvimento do câncer. O mesmo grupo já tinha observado que esses agregados anômalos de P53 estão presentes no câncer de mama, ovário e próstata.
Segundo Godone (03) “As alterações genéticas associadas com o câncer de mama podem ser classificadas quanto ao grau de penetração em: mutações de alta penetrância (raros na população em geral), mutações de penetrância moderada (elevação moderada de risco) e polimorfismos de baixa penetrância (associação comum nas populações)”.
DESENVOLVIMENTO
O câncer de mama é uma doença genética que ocorre devido a proliferação desordenada das células mamárias que sofreram mutações. No início da neoplasia, pode acontecer a ativação errônea dos proto-oncogenes, tornando-os oncogêneses, concomitante a isso, podem ocorrer inibições dos genes supressores de tumor, levando a progressão tumoral. A P53 é um gene supressor de tumor, mas ela também pode ser um proto-oncogenes, se por um acaso ela sofrer uma mutação. (03)
As mutações gênicas afetam a constituição química dos genes; cromossômicas afetam a estrutura do gene não a constituição; genômica afetam o conjunto do cromossomo; mutação missense – (maioria das mutações alterando a P53, como resultado de mutações pontuais, a proteína tem sua meia vida aumentada e se acumula nas células tumorais) alteração na base de DNA, ou seja, a codificação do aminoácido será incorreta; mutação nosense – (mais rara, porém pode alterar a P53 e a ocorrência de uma proteína truncada) trabalha mais no processo de deleção de porções do gene ou inserção de nucleotídeos o que pode levar a um stop códon em P53. (04).
Segundo publicações do Instituto Nacional do câncer (INCA), “no Brasil, as estimativas de incidência de câncer de mama para o ano de 2019 são de 59.700 casos novos, o que representa 29,5% dos cânceres em mulheres, excetuando-se o câncer de pele não melanoma”. “Em 2016, ocorreram 16.069 mortes de mulheres por câncer de mama no país”.
Ou seja, a partir desse dado percebemos que apesar dos avanços que tivemos na área da medicina, o câncer de mama ainda deve ser muito estudado e técnicas ainda mais elaboradas para o prognóstico devem ser feitas. Dessa maneira, o presente trabalho focará na relação existe entre os marcadores tumorais entre eles a P53 e o desenvolvimento do câncer.
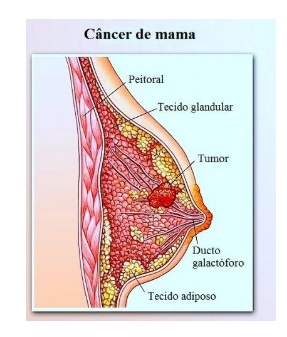
Fonte: https://www.fisioterapiaparatodos.com/p/doencas-da-mama/carcinoma-de-mama/
Figura 1: representação do câncer de mama
É uma proteína considerada supressora tumoral, que é sintetizada pela própria célula, o seu peso molecular 53kDa, 393 aminoácidos, ela está localizada no braço curto do cromossomo 17 na região P13.1, seu objetivo principal é bloquear o ciclo celular, realizando o reparo do DNA, assim como induzindo a apoptose celular, ela tem a capacidade de envolver vários genes na regulação do ciclo celular e quando ocorre a falha na expressão do gene P21, sua proteína agirá como um bloqueador do ciclo celular realizando com que a célula pare no ciclo G1 para a reparação do DNA ou até mesmo a apoptose. Assim a P53 não é mais um gene supressor, ela se torna uma onco-proteína, já que ela é incapaz de controlar a proliferação celular, fazendo que seja difícil o reparo do DNA.
Estudos comprovam que a presença dessa proteína está ligada ao câncer de mama com muita frequência. Sua ativação está presente em diversas alterações de estresse celular no qual recebe o título de “guardiã do genoma”. (01)
Consequentemente, o P53 mutante é considerado um antígeno “estranho” pelo sistema imunológico e desencadeia uma resposta imunológica que resulta na produção de anticorpos auto-anti-P53. A detecção de P53 mutante no DNA do paciente, ou anticorpos auto-anti-P53 no soro do paciente, portanto, pode ser usada para o diagnóstico precoce de vários tipos de tumores nos quais a mutação do P53 ocorre em um estágio inicial do desenvolvimento do tumor.
Talvez o mais importante, as mutações do P53 podem ter um valor preditivo para o tratamento do câncer, como a radioterapia e a maioria das quimioterapias, que danificam o DNA e induzem a apoptose ou senescência mediada pelo P53. Como as mutações em P53 muitas vezes prejudicam sua capacidade de induzir apoptose em resposta a danos no DNA, resultando em resistência celular à terapia do câncer, a detecção da mutação de P53 teria um valor preditivo para a terapia do câncer; no entanto, os desafios permanecem em traduzir esse conhecimento em um ambiente clínico. (05)
No início do ciclo mitótico, o gene P53 ativa transcricionalmente o gene P21, induzindo a síntese da proteína, na qual tem a função de inibir a ação das quinases dependentes da cíclica (CDKs), fazendo com que as células parem na fase G1 do ciclo celular até que o DNA seja reparado completamente.
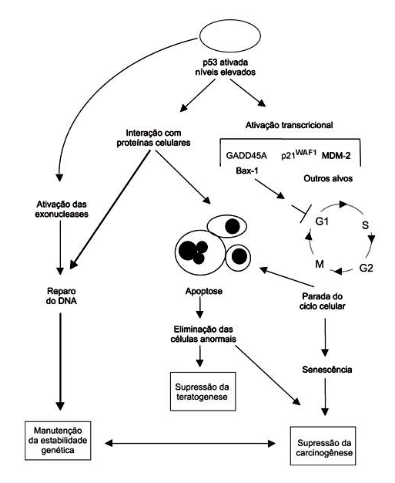
Fonte: https://www.scielo.br/j/rbhh/a/tQx5pXCDC7FCt84qXFYXNFR/
Figura 2: Ação da proteína P53 na supressão tumoral
A proteína P53 irá ativar o gene Growth Arrest DNA Damage Inducille (GADD-45) que corrigirá a lesão no DNA. Quando a reparação do DNA é finalizada a P53 será degradada pela ação da proteína MDM-2, produto do gene mouse double minute 2 (mdm-2). Nas células que apresentam mutação e inativação da P53 não irá ocorrer a parada do ciclo celular necessária para o reparo do DNA, assim as células instáveis tendem a acumular mutações e rearranjos cromossômicos adicionais, levando uma rápida proliferação de clones de células com DNA mutado e transformação neoplásica. (06).
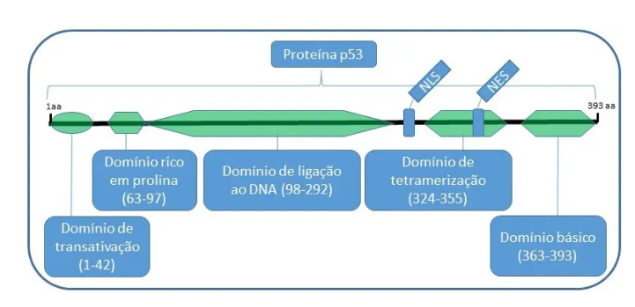
Fonte: https://blog.varsomics.com/p53-a-proteina-guardia-do-genoma-e-suas-implicacoes-na-tumorigenese/
Figura 3: representação da estrutura da P53
As mutações no gene P53 ocorrem em mais de 50 tipos diferentes de tumores, incluindo os de bexiga, cérebro, mamas, entre outros. As mutações deste gene são encontradas em cerca de 40% dos casos de câncer da mama, em 50% das ocorrências de câncer do pulmão e em 70% dos cânceres colorretais.
O câncer de mama é uma patologia em que alterações nos mecanismos de proliferação celular e apoptose levam a alterações no processo de regulação do ciclo celular e na regulação das alterações cromossômicas.
O gene P53 está comumente mutado no câncer humano e a sua proteína mutada perde a função, atuando como oncogene, além da modificação de suas características funcionais, a meia-vida, que em condições normais é de aproximadamente 20 minutos, aumenta para várias horas acumulando-se no núcleo celular, caracterizando-se a super expressão.
Existem evidências de que a super expressão da P53, está envolvida na progressão do câncer de mama, e que ocorre sua associação com o pior prognóstico com o valor da presença da proteína P53 no carcinoma de mama é motivo para muitos estudos, alguns pesquisadores concluem que a expressão da proteína P53 não tem valor prognóstico independente.
Porém, a importância do significado deste valor de grau histológico tem sido demonstrada em inúmeros estudos, desta forma, a avaliação da combinação de fatores prognósticos pode ser de utilidade na prática clínica, para fazer o acompanhamento dos pacientes com câncer de mama.
Em um estudo relatado na Revista Brasileira de Ginecologia e Obstetrícia, postada em 28 de agosto de 2006 foi avaliado a associação da presença da proteína P53 no carcinoma mamário ductal invasivo com o grau histológico e o grau nuclear, já que os últimos citados são fatores já presentes no câncer de mama. (07)
A gravidade do problema do câncer de mama exige cada vez mais que entendamos melhor seus fatores de prognose para orientar o tratamento adequado e compreender sua evolução, existem vários fatores, alguns dos quais têm valores estabelecidos e seguros que podem ser usados na rotina clínica, no entanto, outros ainda são causa de importante controvérsia e se tornaram alvo de muitos estudos. (07)
Por meio de um grande número de estudo, a relação entre o aumento do nível da proteína P53 e a agressividade dos tumores tem sido comprovada, e o mau prognóstico da doença está relacionado à recorrência patológica precoce e baixa sobrevida, apesar disso a imuno-detecção de P53 no câncer de mama ainda é um método controverso devido à falta de padronização levando a heterogeneidade de resultados. (07)
Segundo o artigo sobre genética do câncer de mama hereditário de Cleidemar Moura Marafon (08) “A proteína P53 é sintetizada a partir do gene TP53, localizado no cromossomo 17, e é conhecida como um fator de transcrição envolvido no apoptose e na interrupção do ciclo celular, mediada por checkpoints’. O gene TP53 é um gene supressor tumoral, particularmente importante na regulação da transição da fase G1, impedindo a entrada na fase S do ciclo celular em casos de danos no DNA.”
No mesmo artigo há também a correlação entre outros marcadores tumorais, como o BRCA-1, o qual em conjunto com a TP53 faria o desenvolvimento do tumor, sabendo que, o produto da BRCA estimularia a atividade da P53.
Contudo, com a mutação desse gene haveria a resistência a apoptose e o controle dos danos celulares se perderia dando ainda mais espaço para as células cancerígenas. Assim sendo, é importante ressaltar que no desenvolvimento dos tumores nas mamas pode-se relacionar mais de um marcador tumoral.
Em um primeiro momento, foram analisados os receptores de estrogênio e progesterona, sabendo que uma parte considerável dos tumores na mama são regulados por hormônios esteroides, consequentemente percebeu-se que, os tumores que responderam a terapia hormonal expressavam altos níveis de receptores de estrogênio, enquanto os que não responderam tiveram níveis que beiravam o indetectável.
Notou-se que as mulheres que tiveram boa resposta a terapia hormonal apresentavam um quadro de prognóstico mais benéfico, entretanto os resultados para receptores hormonais são maiores em mulheres pós-menopausa, ou seja, está associado a idade da paciente. Os métodos utilizados para detecção são os testes bioquímicos e imuno-histoquímicos.
Posteriormente, a cerbb-2, (08), marcadores tumorais revisão de literatura “O oncogene CerbB-2 pertence a uma família de receptores de membrana cujo domínio extracelular pode ser identificado, dosado em cultura ou liberado na circulação.
Estudos associam a cerbb-2 a P53, as quais quando estão com a expressão aumentada estão fortemente associadas ao câncer de mama, sabendo que quando o paciente está com esses dois fatores atenuados o prognóstico seria bem mais complexo, haja vista que, como esses fatores estão elevados não há mais um controle na proliferação celular e com o não funcionamento correto delas teremos um ativador que trabalha em prol das células cancerosas.
Dessa maneira, a P53 desempenha o papel fundamental na reparação de DNA e caso não consiga reparar induz a célula a apoptose, prevenindo assim que nosso corpo acumule ou até mesmo permita a circulação de células com um péssimo funcionamento. Vale enfatizar que, quando sua expressão está ampliada, possivelmente está associada a níveis mais elevados de agressividade.
BIOTECNOLOGIA: USO DA BIOINFORMÁTICA NOS PROGNÓSTICOS E DIAGNÓSTICOS DE CÂNCER
Os tumores em geral recebem uma classificação tradicional, porém além dessa classificação, há estudos que estão se utilizando de marcadores biológicos moleculares para amplificar a caracterização do câncer e pontualmente encontrar diagnósticos mais precisos.
Segundo Godone (03) cita Espinosa (2011) “a análise do perfil genético no câncer de mama tem recebido crescente atenção nos últimos anos como ferramenta para fornecer informação prognóstica e preditiva da doença”.
Atualmente há estudos mais efetivos para a utilização de análises moleculares como uma forma de classificar o câncer de mama em um nível clínico, sendo assim possível a identificação de diversos subtipos de tumores com base no perfil genético.
Como característica, o objetivo do nosso estudo é revisar a literatura e identificar possíveis formas de identificação de câncer de mama no seu estágio inicial, desta forma analisando os principais marcadores moleculares.
Um marcador é considerado como preditivo quando nos dá informações relevantes para a triagem de pacientes suscetíveis a certo tratamento, e ainda considerado como prognóstico quando o paciente for reincidente na doença ou não.
Marcadores moleculares estão associados a propriedades biológicas envolvidas na transformação celular neoplásica, crescimento tumoral e processo de metástase e assim fornecem informações relevantes a respeito da evolução clínica da doença. Nosso caso de estudo é o p53, um gene supressor tumoral, que codifica uma fosfoproteína nuclear que desempenha um papel importante no controle do ciclo celular, no reparo do DNA e na indução do apoptose.
Godone (03) ainda cita Brenton, 2005: “estes tumores exibem alta taxa de mutação no gene TP53 (4080%) e geralmente são carcinomas grau 3 e linfonodos positivos.
Segundo estudos, Magalhães (09) toma como conclusão “o gene TP53 apresentou maior valor de WNL nas redes de células-tronco cancerosas (CTC), metástase originada do câncer de mama (MM) e na rede do câncer de mama (CM). Em CTC e MM, o gene TP53 foi o único gene do grupo A (grupo portador do maior WNL), enquanto na rede de CM o grupo A foi composto pelos genes TP53 e PIK3C.
Essa colocação demonstra o poder de identificação do gene P53 no auxílio a novas descobertas de câncer de mama, sua associação às causas, pode ajudar a identificar precocemente a doença possibilitando prognósticos de tratamentos.
Magalhães (09) “Também foram evidenciadas interações com genes relacionados à carcinogênese, como o gene supressor de tumor TP53, o fator de transcrição e oncogene STAT3, os receptores de fator de crescimento epidérmico (EGFR e ERBB2), bem como com genes que participam do processo de metástase, como FN1, MMP2 e MMP9.”
Fica claro que o P53 tem como função o controle do ciclo celular, quando há dano ao DNA a P53 entra em ação, ela é uma proteína supressora de tumorigênese, reconhecida como guardiã do genoma, porém quando há falha nesse processo de correção do ciclo celular e a P53 perde a capacidade de iniciar a apoptose, há a disfunção do processo e a tumorigênese.
Existem várias razões que justificam o título de “guardião do genoma” do gene P53. Seu envolvimento, direto ou indireto, tem sido observado na etiopatogenia de praticamente todas as neoplasias humanas, incluindo as leucemias e linfomas. Conhecer seus mecanismos de ação é fundamental para compreender os aspectos moleculares da carcinogênese. (10)
Na China, foram lançados dois medicamentos de terapia gênica baseados na P53, conhecidos como Gendicine e Oncorine H101, que atuam no câncer de cabeça e pescoço e nasofaringe, estes são reconhecimentos da atuação do P53 na carcinogênese.
Ter conhecimento da alteração no P53 permite indicar tratamentos terapêuticos com mais assertividade, visto que já medicações que atuam em acordar o gene P53 para que ele faça sua atuação causando a apoptose das células, porém com ele modificado a terapêutica só causa mais desarranjos, esta é uma das notáveis pontuações no prognóstico terapêutico visando um prognóstico utilizando a bioinformática e os marcadores biotecnológicos.
CONCLUSÃO
Tendo vista dos argumentos observados a proteína P53 é um gene supressor tumoral importante para a defesa do corpo humano pois tem como função ser um ponto de controle genético para a parada do ciclo celular em resposta a danos no DNA, ou seja, ela “trabalhará” para que não ocorra a proliferação das células anormais, porém quando sua proteína é mutada ela perde a função e aumenta a probabilidade de atuar como oncogene.
Dessa maneira, revisando os artigos e referências citadas ao longo desse trabalho, concluímos que o câncer de mama é um tema de extrema relevância, devido ao grau de mortalidade e no percentual de mulheres que ainda morrem com essa doença todos os anos, mesmo com os avanços nos tratamentos e no diagnóstico.
Diversos estudos relacionam as mutações em P53 e o desenvolvimento do câncer, o que auxilia na criação de métodos de prognósticos mais rápidos, tendo em vista que, quando a P53 está em seu funcionamento normal tem apenas 6 minutos de vida média aproximadamente, entretanto quando mutada tende a se acumular dentro da célula, ou seja, seria uma das formas de detectar precocemente o desenvolvimento anormal das células, evidenciando a necessidade de expandir mais pesquisas acerca do tema.
REFERÊNCIAS BIBLIOGRÁFICAS
(01) INSTITUTO NACIONAL DE CÂNCER (INCA). ABC do Câncer: abordagens básicas para o controle do câncer. [Internet]. Rio de Janeiro, 2011. Acesso em 2023, abril 21. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/abc_do_cancer.pdf
(02) Pacheco D. Laboratório de Bioinformática une computação e biologia na solução de problemas. [Internet] São Paulo. 2019, jun. Jornal da USP. Universidade de São Paulo. Acesso em: 2023, abr 18. Disponível em: https://jornal.usp.br/ciencias/laboratorio-de-bioinformatica-une-computacao-e-biologia-na-solucao-de-problemas/
(03) Godone RLDN. Identificação de Marcadores Moleculares para Diagnóstico, Predição e Prognóstico de Câncer de Mama. [Tese de Doutorado]. Recife. 2018. Universidade Federal de Pernambuco. Centro de Biociências. Acesso em: 2023, abr 18. Disponível em: https://repositorio.ufpe.br/bitstream/123456789/32876/
(04) Klumb CE, Junior GBC. Avaliação dos métodos de detecção das alterações do gene e proteína P53 nas neoplasias linfoides. [artigo]. 24 (2). São Paulo: Revista Brasileira de Hematologia; 2002. Disponível em: https://doi.org/10.1590/S1516-84842002000200008
(05) Liu Xin-Yuan, Pestka Sidney, Shi Yu-Fang, editores. Avanços recentes na pesquisa e terapia do câncer. Local desconhecido: Elsevier; 2012. 674 p. ISBN: 978-0-12-397833-2
(06) Júnior Geraldo Barroso Cavalcant, Klumb Claudete Esteves, Maia Raquel C. P53 e as hemopatias malignas. Revista Brasileira de Cancerologia: INCA. 2012; 419-427.
(07) Abreu DCB. Imunodetecção da proteína p53 em câncer de mama. Um importante fator prognóstico? [Dissertação de Mestrado]. Goiânia: Universidade Católica de Goiás; 2008. 90 s. Pós-graduação em Genética.
(08) Marafon CM. Genética do câncer de mama hereditário. [Internet]. Salvador. v. 6, n. 1, p. 86-90, jan./abr. 2007. Revista de Ciências Médica e Biológicas. Universidade Federal da Bahia. Disponível em: http://repositorio.ufba.br/ri/handle/ri/20476
(09) Magalhães DOL. Identificação e análise de redes de genes envolvidos no câncer de mama e células-tronco cancerosas. [Tese de Mestrado]. Belo Horizonte. 2018. Faculdades Promove. Acesso em 2023, abr 21.
(10) Fett-Conte AC, Salles ABCF. A importância do gene p53 na carcinogênese humana. A importância do gene p53 na carcinogênese humana. [Internet]. Edição Especial. São José do Rio Preto. Revista Brasileira de Hematologia. 2002. Disponível em: https://doi.org/10.1590/S1516-84842002000200004
1Centro Universitário das Faculdades Metropolitanas Unidas – FMU, Av. Santo Amaro, 1239, Vila Nova Conceição, São Paulo, SP, CEP 04505-002;
2Laboratório as Bases Genéticas dos Tumores da Tiroide, Disciplina de Genética, Departamento de Morfologia e Genética, Universidade Federal de São Paulo, São Paulo, SP, CEP 04039-032
