REGISTRO DOI:10.5281/zenodo.11657358
Weskley Souza Dos Santos1
Renata Dionísio Nunes De Oliveira1
Yasmine Pi Lien Wang1
Icariane Barros De Santana Araújo1
Aline Gabrielle De Oliveira Mendes2
RESUMO
As hérnias de parede abdominal são protrusões resultantes da perda da integridade do tecido estrutural da parede do abdome. Dentre os fatores de risco podemse citar tabagismo e tensão mecânica. Estas se constituem como uma das entidades cirúrgicas mais incidentes, representando um grande volume para o sistema de saúde pública, que ainda encontra alguns obstáculos para absorver toda a demanda em tempo adequado. Diante disso, este trabalho busca reunir as principais táticas de manejo desta doença, através de uma revisão de literatura atual, discorrendo sobre o diagnóstico, manejo inicial, preparo pré-operatório, tratamento cirúrgico e controle pós-operatório dos principais tipos de hérnias, sendo estas as umbilicais e epigástricas, inguinocrurais e incisionais.
Palavras–chave: Hérnia. Revisão de literatura. Parede abdominal. Hérnia umbilical. Hérnia inguinal. Hérnia incisional.
1. INTRODUÇÃO
Hérnia é definida como uma protrusão anormal de um órgão ou tecido através de um defeito em suas adjacências. Embora possa ocorrer em diversos sítios do corpo humano, estes defeitos mais comumente envolvem a parede abdominal. (TOWNSEND et al, 2022, p.1105).
A maioria das hérnias resulta de uma perda da integridade mecânica do tecido estrutural da parede do abdome. O resultado é um defeito na habilidade dos músculos e tendões da parede abdominal em conter as vísceras e sustentar o tronco. (FRANZ, 2006). As hérnias da parede do abdome ocorrem apenas em sítios nos quais a aponeurose e a fáscia não são recobertas pela musculatura estriada. Os locais afetados com mais frequência incluem as regiões inguinal, femoral e umbilical; linha alba; porção inferior da linha semilunar; e áreas de incisões prévias. (TOWNSEND et al, 2022, p.1105). Sabe-se que 5% da população desenvolverá uma hérnia, sendo aproximadamente 75% dos casos na região inguinal, dois terços dos quais são hérnias indiretas e o terço restante, diretas. (AMARAL et al, 2023).
Dentre os fatores de risco para a formação das hérnias podem ser inclusos o tabagismo e histórico familiar importante, que indica uma predisposição genética. Além disso, há também evidências de que a tensão mecânica, como tosse crônica ou levantamento de peso, pode induzir a modificações patológicas na função celular e molecular do tecido estrutural. (FRANZ, 2006). É sabido também que outros fatores de risco como diabetes mellitus tipo II, obesidade, doença pulmonar obstrutiva crônica, cirrose e doenças prostáticas têm um impacto negativo em áreas de cicatrização de qualquer cirurgia abdominal prévia, aumentando a chance de complicações e recorrência de hérnias. (EVERLING et al, 2020).
As hérnias de parede abdominal constituem-se como umas das entidades cirúrgicas mais incidentes. Referida como o procedimento cirúrgico mais comum no mundo, a hernioplastia inguinal contabiliza aproximadamente 2.800 casos a cada milhão de habitantes nos Estados Unidos e Europa. Apenas no país norte-americano, os reparos cirúrgicos de hérnias inguinais superam a contagem de 800 mil casos por ano, e as correções de hérnias ventrais/incisionais somam mais de 400 mil cirurgias anualmente, com a projeção de aumento anual de 11 mil casos. (ZAHIRI et al, 2018). No Brasil, é estimado que o número de casos de hérnias de parede abdominal gire em torno de 290 mil por ano, sendo 54% localizadas na região inguinal. (EVERLING et al, 2020).
A maioria das hernioplastias são realizadas de forma eletiva, porém cirurgias de urgência são necessárias no tratamento de hérnias estranguladas ou com outras complicações. Sob essas circunstâncias, estudos realizados nos Estados Unidos demonstraram que pacientes submetidos a herniorrafias de urgência apresentam elevadas taxas de mortalidade e readmissão, além de custos hospitalares maiores. (AMARAL et al, 2023). Comparado com outras populações de estudo, a quantidade destas cirurgias de urgências no Brasil pode chegar a números até quatro vezes maiores, o que demonstra a dificuldade que ainda há no nosso sistema em atender suficientemente essa demanda de forma eletiva. Este indicador tem grande valia, de forma que pode ser utilizado como referência para resultado de ações futuras em vista do aprimoramento do sistema como um todo. (EVERLING et al, 2020).
2. DESCRIÇÃO
2.1. HÉRNIAS UMBILICAIS E EPIGÁSTRICAS
- DIAGNÓSTICO E MANEJO INICIAL
Não há disponível uma classificação que caracterize os tamanhos de hérnias umbilicais e epigástricas de forma satisfatória. De forma geral, enquanto as primeiras são definidas como hérnias primárias com o defeito localizado na linha média no centro do anel umbilical, as últimas são definidas como aquelas cujo centro do defeito se localiza na linha média no trecho acima do umbigo até o apêndice xifoide. Ambas podem ser classificadas em pequenas (até 1 cm), médias (de 1 a 4 cm) e grandes (acima de 4 cm), baseado no diâmetro do defeito. (HENRIKSEN et al, 2020).
Na maioria dos casos, o diagnóstico destes tipos de hérnias dá-se apenas pelo exame físico. Todavia, o estudo de imagem pré-operatório pode ser necessário em pacientes com dor abdominal sem hérnia palpável ou em pacientes obesos para avaliação do tamanho do defeito e planejamento cirúrgico. Apesar de evidências limitadas, sugerese considerar o estudo de imagem através de ultrassonografia de abdome ou tomografia computadorizada nestes casos em que há dúvida diagnóstica. (HENRIKSEN et al, 2020).
Para hérnias umbilicais e epigástricas assintomáticas, uma estratégia de watchful waiting pode ser considerada, mesmo com dados limitados na literatura. Já para os casos sintomáticos, recomenda-se realizar a otimização do paciente de risco antes do reparo cirúrgico eletivo. (HENRIKSEN et al, 2020).
As complicações de ferida operatória são as mais comuns nos reparos destes tipos de hérnia. Sabe-se que tabagismo e obesidade aumentam o risco de complicações de ferida cirúrgica no geral, porém, ao se tratar especificamente de hérnias umbilicais e epigástricas, estes dados são limitados. Ainda assim, a recomendação é que haja a cessação do tabagismo por 4 a 6 semanas e a perda de peso a um IMC abaixo de 35 kg/m2 antes do tratamento cirúrgico eletivo. (HENRIKSEN et al, 2020).
- PREPARO PRÉ-OPERATÓRIO
Há evidências insuficientes que recomendem rotina de antibioticoprofilaxia para reduzir os índices de infecção do sítio cirúrgico. Todavia, esta é uma complicação significante nos reparos de hérnias umbilicais e epigástricas, especialmente quando há uso de tela; nestas situações, dada como dose única perioperatória, a antibioticoprofilaxia pode ser útil. (HENRIKSEN et al, 2020).
Em relação aos fios utilizados nos reparos, também não há evidências suficientes, porém recomenda-se que seja dada preferência a fios de absorção lenta ou não-absorvíveis. De toda forma, a técnica de sutura pode ser a de preferência do cirurgião. (HENRIKSEN et al, 2020).
- TRATAMENTO CIRÚRGICO
Uma das maiores tomadas de decisões dos cirurgiões diante de um reparo aberto de uma hérnia umbilical está relacionada ao uso de tela. O seu uso e as indicações precisas das técnicas com tela e sem tela continuam sendo debatidas ainda sem um claro consenso. (APPLEBY et al, 2018).
Ainda há controvérsias em relação à necessidade do uso de telas nos casos em que as hérnias apresentam tamanho menor que 1 cm, tendo em vista a limitação nas evidêncas. Além disso, muitos cirurgiões se preocupam com a necessidade de aumentar o defeito para realizar a inserção da prótese. (BARBOSA et al, 2021). Somado a isso, podem ser consideradas outras vantagens da técnica sem tela: risco reduzido de infecção do sítio cirúrgico, ausência do risco de migração de tela, menor tempo cirúrgico e fácil realização sob efeito de anestesia local. (ZOE TAO et al, 2020). Dessa forma, nestes casos de hérnias menores que 1 cm, pode-se considerar um reparo sem tela em uma decisão em consenso com o paciente. (HENRIKSEN et al, 2020). A técnica de Mayo foi o método mais utilizado nestas correções cirúrgicas. (BARBOSA et al, 2021). Essa técnica, primeiramente descrita em 1901, caracteriza-se por um fechamento fascial em uma orientação transversa, utilizando dois planos de sutura sobre o leito horizontal.(APPLEBY et al, 2018).
A maioria das hérnias umbilicais e epigástricas são de tamanho pequeno ou médio e, comprovadamente, o reparo aberto com uso de tela reduz a taxa de recorrências sem aumentar as complicações, excetuando-se os casos citados acima, para os quais ainda carecem evidências suficientes. (HENRIKSEN et al, 2020). Diante disso, para pacientes adultos e saudáveis, damos sempre preferência ao uso de telas nas hérnias com defeito maior que 1 cm, sem deixar de levar em consideração os aspectos individuais de cada paciente como a presença de comorbidades, IMC, reserva funcional e imunocompetência. (BARBOSA et al, 2021).
De forma geral, em relação aos reparos de hérnia ventral com prótese, não há consenso do local ideal para o posicionamento da tela, devendo ser baseado no cenário clínico. Ter conhecimento sobre as potenciais vantagens e desvantagens de cada técnica é essencial. No geral, técnicas inlay têm índices maiores de recorrência e, portanto, não devem ser realizadas rotineiramente. Técnicas sublay têm a vantagem do uso das forças corporais para auxiliar a manutenção da malha no local apropriado e permitir uma cobertura maior da falha sem a necessidade de criação de retalhos subcutâneos extensos, que podem aumentar os índices de infecção de ferida. As técnicas onlay podem ser apropriadas em alguns casos mas requerem dissecção de retalhos subcutâneos para sobreposição adequada da tela e podem evoluir com exposição da prótese em situações de infecção de ferida. (APPLEBY et al, 2018).
O tamanho ótimo da malha para hérnias umbilicais e epigástricas pequenas e médias não tem sido objeto de estudo mas, para reparos abertos, é sugerido uma sobreposição da tela de 2 cm além do defeito nas hérnias pequenas e 3 cm nas hérnias de tamanho médio. Uma abordagem laparoscópica pode ser considerada nos reparos de defeitos múltiplos ou em pacientes obesos. Hérnias umbilicais e epigástricas grandes (maiores que 4 cm) são raras, e devem ser abordadas da mesma forma que hérnias incisionais, com uso de tela. (HENRIKSEN et al, 2020).
2.2. HÉRNIAS INGUINOCRURAIS
- DIAGNÓSTICO E MANEJO INICIAL
Um abaulamento na região inguinal é o principal achado diagnóstico na maioria das hérnias inguinais. A maioria dos pacientes terá dor associada ou um vago desconforto na região, mas um terço dos sintomas não apresentará sintomas. Essas hérnias não costumam ser extremamente dolorosas a não ser que estejam encarceradas ou estranguladas. Na ausência de achados físicos, causas alternativas para a dor devem ser consideradas. (TOWNSEND et al, 2022, p.1110).
O diagnóstico da hérnia inguinal é clínico em sua grande maioria, apresentando 74,5% de sensibilidde e 96% de especificidade na associação da história clínica e do exame físico, sem a necessidade de outros métodos de avaliação. Mediante dúvidas diagnósticas ou de possíveis diagnósticos diferenciais, exames de imagem devem ser solicitados. Apesar de não haver consenso qual exame é o padrão ouro, a ultrassonografia deve ser a escolha inicial, tendo em vista seu baixo custo, fácil acesso e eficácia. Na persistência da dúvida diagnóstica, a ressonância magnética tem resultados superiores à tomografia computadorizada. (CLAUS et al, 2019).
O motivo para definição do momento da cirurgia é o prejuízo na qualidade de vida do paciente que a presença da hérnia pode causar. Dessa forma, muitos pacientes podem ser observados de forma segura com chances muito baixas de apresentar complicações (como encarceramentos ou necessidade de cirurgia de urgência). Deve-se ressaltar que, ainda assim, cerca de 70% dos pacientes desenvolverão sintomas durante a observação e solicitarão a cirurgia em um período de cerca de dois anos. Todavia, existem subgrupos de pacientes que se beneficiarão de uma programação breve de cirurgia no momento do diagnóstico devido alguns fatores de risco que indicam o surgimento precoce de sintomas e consequente necessidade de abordagem cirúrgica. Fazem parte deste grupo pacientes do sexo feminino, que têm dor ao realizar atividades extenuantes, constipação crônica, prostatismo, pacientes casados e pacientes classificados como ASA 1 ou 2. (CLAUS et al, 2019).
Em resumo, indica-se o tratamento cirúrgico para pacientes do sexo masculino com hérnias inguinocrurais sintomáticas e para pacientes do sexo feminino com hérnias inguinocrurais, independente de sintomas. A observação clínica pode ser considerada como alternativa para pacientes do sexo masculino, assintomáticos ou com poucos sintomas, que apresentem comorbidades graves ou com risco cirúrgico elevado.
- PREPARO PRÉ-OPERATÓRIO
Não há dados significativos que recomendem antibióticos profiláticos de rotina, tanto nas vias abertas quanto laparoscópicas, porém há condições especiais que aumentam o risco de desenvolvimento de infecção de sítio cirúrgico, como pacientes de alto risco (ASA 3 ou 4). Nestes casos, recomenda-se o uso de cefalosporina de primeira geração como antibioticoprofilaxia. (CLAUS et al, 2019).
Em relação à tricotomia pré-operatória, as evidências mostram que o índice de infecções do sítio cirúrgico é independente de sua realização. Todavia, quando necessária, esta deve ser realizada imediatamente antes da cirurgia. (CLAUS et al, 2019).
Por fim, para diminuir o risco de lesão vesical, a bexiga deve ser esvaziada antes de um reparo videolaparoscópico ou em correções abertas de hérnias inguinoescrotais. Caso o paciente não consiga ou já esteja anestesiado, deve-se providenciar um cateterismo ou sondagem vesical, com retirada do dispositivo o mais breve possível no pós-operatório. (CLAUS et al, 2019).
- TRATAMENTO CIRÚRGICO
Ao escolher uma técnica para correção das hérnias inguinocrurais, objetiva-se baixo índice de complicações, rápida curva de aprendizado, recuperação breve e resultados reproduzíveis com bom custo-benefício. Não há uma técnica universal, porém a maioria dos cirurgiões concorda que a utilização da tela na cirurgia alcança esses quesitos. As principais publicações endossadas pelas mais importantes sociedades de hérnia no mundo trazem o melhor nível de evidência com o grau mais forte de recomendação a favor do uso de tela nos reparos de hérnias inguinais. (CLAUS et al, 2019).
Técnicas sem tela devem ser reservadas a cirurgiões ou serviços com experiência vasta, sendo a técnica de Shouldice a mais recomendada, tendo em vista que, dentre as técnicas abertas, o uso de tela reduz significativamente a recorrência das hérnias. Mesmo em casos de encarceramento ou estrangulamento, recomenda-se o uso da malha quando a ferida operatória for considerada limpa. Evita-se seu uso apenas quando há contaminação do campo operatório, seja por perfuração intestinal, peritonite ou abscesso. Nas técnicas videoendoscópicas, o uso de tela é mandatório. Por fim, recomenda-se fortemente o uso de telas em casos recidivados. (CLAUS et al, 2019).
Por apresentar resultados clínicos excelentes e ser simples de aprender e reproduzir, a técnica de Lichtenstein é considerada o padrão ouro das técnicas abertas. Apesar de ter baixos índices de recorrência, os principais locais de recidivas são os extremos anatômicos da região: próximo ao púbis, nas recidivas diretas, e próximo ao anel inguinal profundo, nas indiretas. Com a retração da tela durante o processo de cicatrização, pode haver uma exposição de uma possível falha na parede posterior na região mais medial do reparo; recomenda-se, portanto, que a tela tenha um tamanho mínimo de 6 x 14 cm e ultrapasse o tubérculo púbico medialmente em 2 cm. De outro modo, é recomendado também que as alças lateral e medial, criadas após a abertura da porção superior da tela para a confecção da passagem do funículo espermático devem ser suturadas entre si com fio de polipropileno a fim de se calibrar o conteúdo do funículo de forma adequada, formando um novo anel inguinal profundo. Além disso, a alça medial deve cruzar e recobrir anteriormente a alça lateral a ser fixada no ligamento inguinal. (CLAUS et al, 2019).
Quando comparadas com as técnicas abertas, as abordagens endoscópicas apresentam menor desconforto pós-operatório em certos grupos de pacientes. Indivíduos jovens e ativos se beneficiam mais de uma cirurgia videolaparoscópica devido ao menor tempo de convalescença, podendo ter um retorno breve às atividades laborais. (CLAUS et al, 2019). Pacientes com recorrência após um reparo aberto, história prévia de cirurgia ou radioterapia pélvica, bilateralidade e pacientes do sexo feminino também fazem parte destes grupos com maior recomendação de técnicas endoscópicas. (SIMONS et al, 2018). Em idosos, não há diferenças significativas de vantagens em relação à dor pósoperatória no período inicial, sendo preferível nestes casos as técnicas abertas. (GOMES et al, 2021).
O sucesso do reparo endoscópico das hérnias inguinocrurais consiste no detalhamento técnico relacionado à anatomia do orifíco miopectíneo de Fruchaud. É importante que seja realizada uma abertura adequada do flap peritoneal a fim de facilitar o fechamento posterior. (CLAUS et al, 2019). A incisão no peritônio deve se estender de forma elíptica do ligamento umbilical medial à espinha ilíaca anterossuperior. É importante que seja feita pelo menos a 4 cm do defeito, direto ou indireto, para permitir a alocação de uma prótese grande que se sobreponha todos os potenciais locais de hérnia. (FURTADO et al, 2019).
A partir deste ponto, deve-se partir para a dissecção do espaço pré-peritoneal, seguindo a sequência: zona 1, correspondente à área lateral aos vasos epigástricos inferiores e vasos espermáticos, até a identificação do músculo psoas e da espinha ilíaca anterossuperior; zona 2, medial aos vasos epigástricos inferiores, devendo-se estender a dissecção a todo espaço pré-vesical até a identificação do ligamento pectíneo e ultrapassando cerca de 2 cm da sínfise púbica, a fim de criar espaço suficiente para acomodação da malha; e zona 3, que compreende ao passo que exige maior atenção devido à mobilização do peritônio sobre os vasos deferentes e espermáticos, região na qual onde mais comumente se localizam os vasos ilíacos externos. A dissecção do peritônio e do espaço pré-peritoneal é dada por completa quando os elementos que compõem o Y invertido (vasos epigástricos inferiores, ducto deferente e vasos espermáticos) são visualizados, assim como o músculo iliopsoas, púbis e ligamento de Cooper. (FURTADO et al, 2019).
Ao aplicar a tela, devem ser utilizadas malhas grandes que recubram todo o orifício miopectíneo de Fruchaud, com tamanho mínimo de 15 cm no eixo látero-medial e de 10 a 12 cm no eixo ântero-posterior, devendo não conter nenhum tipo de fenda. (CLAUS et al, 2019).
A fixação da tela deve respeitar a anatomia dos nervos da região posterior do canal inguinal em sua posição no triângulo da dor. A fixação lateral deve ser feita cerca de 3 cm acima do trato ílio púbico. Na região medial da tela, a fixação deve ser realizada junto ao ligamento de Cooper, sínfise púbica e linha alba. Se houver disponibilidade, deve-se dar preferência aos métodos de fixação atraumática, como colas ou selantes, por estarem associados à menor dor pós-operatória. (CLAUS et al, 2019).
Quando há bilateralidade, ao invés de uma única tela grande, é mais fácil realizar a implantação de duas telas, sendo estas sobrepostas de 1-2 cm na linha média acima da sífise púbica. (CLAUS et al, 2019).
A síntese do flap peritoneal deve ser feita preferencialmente com fio absorvível, e sempre da direita para a esquerda, pois permite a realização de pontos contínuos com mais ergonomia. (CLAUS et al, 2019).
- CONSIDERAÇÕES PÓS-OPERATÓRIAS
Evidências demonstram que não há associação entre a retomada de atividades físicas normais precocemente e o surgimento de recidivas, quando se usa tela nos reparos de hérnia inguinal. Dessa forma, os pacientes podem reassumir suas atividades normais assim que se sentirem aptos, ou seja, quando não houver mais desconforto local com dor. A média de tempo gira em torno de três a sete dias para realização de atividades do cotidiano sem que o paciente sinta restrições. Para atividades laborais que não envolvam carregamento de peso, um período de repouso de apenas uma ou duas semanas é aceitável. Contudo, para a realização de atividades, tanto físicas quando laborais, que exijam esforço físico e com pesos excessivos, deve-se aguardar um período de quatro a seis semanas. (CLAUS et al, 2019).
A incidência de seromas é de 7% e geralmente evoluem bem sem necessidade de descompressão. Os hematomas, que têm incidência de 8%, no entanto, podem gerar repercussões hemodinâmicas ou outras consequências, podendo, por vezes, necessitar de tratamento específico. Diante disso, não recomenda-se o uso de drenos durante o procedimento cirúrgico, devendo reservá-los a casos com fatores de risco conhecidos, como o uso crônico de anticoagulantes, coagulopatias e grandes sangramentos difusos no intraoperatório. (CLAUS et al, 2019).
Pacientes que evoluem com dor pós-operatória com duração superior a três meses ou mais após uma hernioplastia, sem outras causas aparentes, são considerados com dor crônica pós-operatória. Atenção deve ser dada àqueles do grupo de risco: jovens, sexo feminino, reparo aberto, história prévia de dor pós-operatória, intervalo inferior a três anos de cirurgia prévia, complicações pós-operatórias como hematoma e infecções e reparo de recidivas. A esses casos que evoluem com dor crônica, deve-se adotar uma abordagem multidisciplinar inicialmente (inclusive com seguimento pela equipe do Ambulatório da Dor). O manejo inicial pode ser realizado com medicações orais, bloqueios regionais e ablação nervosa, devendo-se reservar o tratamento cirúrgico a causas específicas de dor crônica pós-hernioplastia, que inclui ressecção de nervos presos e remoção de tela ou suturas na dor relacionada a estas. (CLAUS et al, 2019).
2.3. HÉRNIAS INCISIONAIS
- DIAGNÓSTICO
De todas as hérnias, as incisionais podem ser as mais desafiadoras e difíceis de tratar. Elas ocorrem como resultado de um tensão excessiva e cicatrização inadequada de uma incisão prévia. Estas hérnias aumentam ao longo do tempo, desencadeando dor, obstrução intestinal, encarceramento e estrangulamento. Obesidade, idade avançada, desnutrição, ascite, gravidez e condições que aumentam a pressão intra-abdominal são fatores que predispõem o desenvolvimento destas hérnias. (TOWNSEND et al, 2022, p.1122).
Doenças pulmonares crônicas e diabetes mellitus também têm sido reconhecidos como fatores de risco. Medicamentos como corticoides e agentes quimioterápicos e infecções de sítio cirúrgico podem contribuir para uma cicatrização inapropriada e aumentar o risco de se desenvolver uma hérnia incisional. (TOWNSEND et al, 2022, p.1122).
Estes grandes defeitos de parede abdominal podem também resultar da impossibilidade de fechamento primário durante o procedimento cirúrgico inicial devido a edema de alças intestinais, empacotamento abdominal, peritonite e múltiplas laparotomias. (TOWNSEND et al, 2022, p.1122).
Grandes hérnias podem evoluir com perda de domicílio, que ocorre quando o conteúdo visceral não mais se encontra dentro da cavidade abdominal. (TOWNSEND et al, 2022, p.1122). Além disso estas hérnias se acompanham de uma redução acentuada do tecido músculo-aponeurótico da parede abdominal, atrofia da musculatura larga do abdome com perda das suas funções anatômica e fisiológica, determinando um comprometimento respiratório e visceral grave. (SPERANZINI, 2010).
Apesar de o diagnóstico das hérnias ser clínico, os exames de imagem desempenham um papel importante no manejo de hérnias complexas. As imagem podem ajudar no planejamento cirúrgico, determinando o tamanho e o conteúdo da hérnia, o volume do saco herniário, a proximidade da hérnia com estruturas ósseas ou mesmo atrofia muscular associada; esses exames orientam a necessidade de medidas pré ou intraoperatórias para aumentar a complacência/volume da cavidade abdominal, definem o melhor posicionamento e método de fixação da tela, além de prever riscos e resultados operatórios. (CLAUS et al, 2022).
Ainda que haja algumas imprecisões, a maioria dos estudos comparativos apontam a tomografia computadorizada como o método de escolha, tendo em vista a ausência do fator operador-dependente. A ultrassonografia tem baixo custo e grande disponibilidade, além de ser dinâmico, possibilitando a realização de manobras para aumentar a pressão abdominal a fim de identificar os locais de dor e abaulamento; todavia, sua precisão depende do operador e as imagens geradas usualmente têm pouco valor para o cirurgião. A ressonância magnética, além de ser cara e menos disponível, não possui estudos que evidenciem sua superioridade em relação à tomografia na avaliação dos defeitos da parede abdominal. (CLAUS et al, 2022).
A fim de orientar cirurgiões e radiologistas, alguns estudos foram realizados, com o objetivo de criar orientações sobre as descrições fundamentais para uma avaliação adequada da parede abdominal, sendo proposto um modelo de relatório que padronize as informações relevantes: o relatório DECOMP (sigla que corresponde a Defeito, Conteúdo, Musculatura, evento Prévio). (CLAUS et al, 2022). Uma breve descrição será apresentada na sequência, de acordo com o proposto por Claus et al::
Protocolo Geral para tomografia
Os parâmetros técnicos não diferem de uma tomografia de abdome habitual. Todavia, merece ser dada atenção em alguns pontos relacionados ao uso do contraste e manobras durante o exame.
De forma geral, a administração de contraste intravenoso não é fundamental para a avaliação dos defeitos da parede. Entretanto, na suspeita de encarceramento e estrangulamento, o contraste endovenoso pode evidenciar sinais de comprometimento ou alterações no suprimento vascular do conteúdo herniário. Da mesma forma, durante o pós-operatório, exames contrastadas só são necessários nos casos de coleção abdominal em que há suspeita de infecção, a qual pode ser diferenciada com o contraste.
Manobras de Valsalva só são necessárias em dúvidas diagnósticas, pois essa medida não fornece informações adicionais em casos com diagnóstico bem estabelecido. Apesar de haver ainda opiniões contrárias, o diagnóstico de perda de domicílio deve ser feito durante o exame sem Valsalva. Relatório DECOMP
DEFEITO:
1) Localização do defeito
A localização precisa do defeito herniário é fundamental para o planejamento e execução do procedimento cirúrgico. A cicatriz umbilical, o apêndice xifoide e a sínfise púbica devem ser utilizados como marcos de referência nas hérnias da linha média; e, nas hérnias laterais, a margem costal, a crista ilíaca e as linhas semilunar e média.
A proximidade dessas hérnias a estruturas ósseas geralmente torna o reparo mais complexo, pois a musculatura nessas áreas tem menor complacência, assim como há maior dificuldade para criação de espaço para sobreposição e fixação da tela. Esses dados podem modificar a técnica operatória, posição planejada da tela e método de fixação.
2) Tamanho do defeito
Necessita-se fazer uma medida linear das maiores dimensões dos eixos longitudinal e transversal da hérnia, pois isto permite classificá-la (pequena/média/grande), ajudando a prever o grau de dificuldade do fechamento fascial.
A classificação da European Hernia Society é a recomendada.
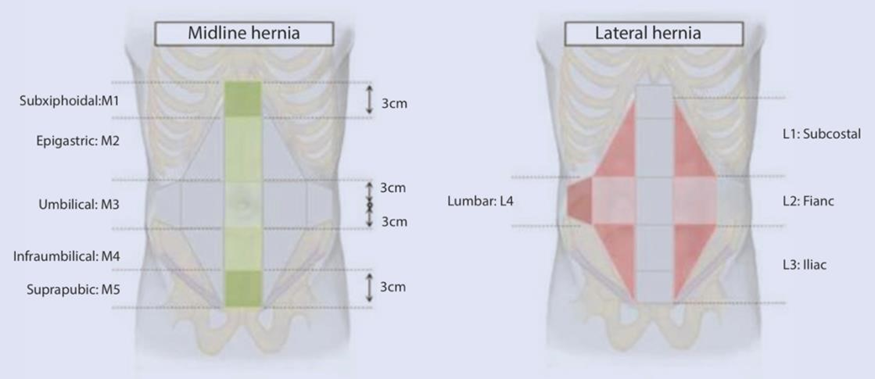
Imagem 1. Classificação da European Hernia Society. (Muysoms et al, 2009).
Desta forma, o cirurgião consegue definir a melhor abordagem operatória a ser empregada (aberta ou laparoscópica); indicar medidas de preparo pré-operatório do paciente, como aplicação de toxina botulínica ou pneumoperitôneo progressivo; avaliar a necessidade de técnicas de separação de componentes; e definir o tamanho e o tipo de tela a ser aplicada.
3) Quantidade de defeitos
Devem ser providas informações sobre os locais e as distâncias entre as extremidades de todos os defeitos, para evitar que aqueles menores, não diagnosticados pelo exame físico, passem despercebidos durante a cirurgia.
CONTEÚDO
4) Presença de vísceras
A presença de vísceras dentro do saco herniário pode trazer informações importantes em relação ao risco maior de complicações, como obstruções, e de gravidade, como estrangulamento. Isso auxilia na definição do planejamento ou mesmo da necessidade da cirurgia. Ademais, nos casos em que há vísceras no saco herniário, há associação com maior dificuldade cirúrgica durante sua dissecção e maior risco de lesões iatrogênicas, quando comparadas com os casos em que há apenas gordura como conteúdo do saco.
5) Presença de encarceramento ou entrangulamento
O encarceramento do conteúdo herniário indica maior dificuldade cirúrgica e, apesar de seu diagnóstico ser geralmente clínico, alguns aspectos tomográficos podem aumentar suspeita de sua presença. Sacos herniários com colos estreitos em defeitos pequenos de parede, líquido presente dentro do saco e espessamento parietal (maior ou igual a 4 mm) ou distensão do segmento intestinal herniado com dilatação das alças intestinais a montante são fatores que devem gerar atenção à possibilidade de cirurgia de urgência.
Uma intervenção de urgência também deve ser considerada na suspeita de estrangulamento do conteúdo herniário, que pode ser sugerida na tomografia através de achados como espessamento da parede intestinal com hipo ou hiperatenuação em relação ao habitual, hipocaptação parietal de contraste intravenoso, pneumatose intestinal e ingurgitamento de vasos mesentéricos com obliteração do plano adiposo mesentérico do segmento herniado.
6) Relação volumétrica entre saco herniário e cavidade abdominal
O saco herniário e a cavidade abdominal são considerados estruturas de formato elíptico, tendo seus volumes calculados através do produto entre as medidas dos eixos longitudinais (crânio-caudal – CC –, transversal – T – e ântero-posterior – AP) e a constante de volume, através da fórmula simplificada: CC x T x AP x 0,52.
A partir deste cálculo, utiliza-se o método descrito por Tanaka e cols. e calculase a razão entre o volume do saco herniário e o volume da cavidade abdominal. Quando o resultado gera um valor acima de 25%, define-se que há perda de domicílio na hérnia ventral. Esta informação é fundamental para que seja considerado que pode não haver espaço suficiente para reduzir completamente o conteúdo herniário, o que pode causar importante restrição respiratória por compressão diafragmática, ou mesmo desenvolver síndrome compartimental abdominal. Além disso, o risco de recorrência e evisceração são consideravelmente elevados. Com essa avaliação prévia, o cirurgião pode utilizar diversas estratégias pre-operatórias para tentar amenizar as consequências desta condição.
MUSCULATURA
7) Presença de diástase de retos abdominais
A diástase dos músculos retos abdominais é geralmente assintomática. Todavia, sua presença representa uma fraqueza da linha média da parede abdominal, o que pode gerar um risco aumentado de recorrência ou abaulamento da hérnia no período pósoperatório.
8) Largura dos músculos retos
Pode-se prever a necessidade de separação de componentes musculares em hérnias de linha média através da medida transversal da largura do músculo reto abdominal de cada lado. Quando a razão entre a soma das larguras dos retos abdominais e o tamanho do defeito é menor que 1, há elevada probabilidade de separação de componentes. Todavia, quando o resultado da razão é maior que 2, essa necessidade reduz significativamente.

Imagem 2. Relação entre a medida do defeito (DS) e a largura dos músculos retos (RR e LR). À esquerda, desenho esquemático; à direita, imagem de TC. (Claus et al, 2022).
9) Presença de ruptura ou atrofia muscular
Pacientes com histórico de intervenção cirúrgica prévia podem apresentar fragilidade muscular, atrofia, denervação ou perda de tecido muscular, podendo resultar em um defeito na parede sem a formação de uma hérnia propriamente dita (pseudohérnia). Esses achados não só interferem no planejamento cirúrgico, como também nos resultados funcionais e estéticos pós-operatórios.
10) Presença de hérnia intraparietal
Existem hérnias, principalmente na parede lateral do abdome, que podem se desenvolver sem defeito em todos os grupos musculares. Nestes casos, o conteúdo herniário está contido entre as camadas musculares da parede do abdome e, durante o procedimento cirúrgico, podem não ser identificadas pelo cirurgião ao ver a camada miofascial superior intacta.
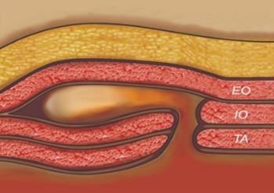
Imagem 3. Desenho esquemático de uma hérnia intraparietal. EO – músculo oblíquo externo; IO – músculo oblíquo interno; TA – músculo transverso abdominal. (Claus et al, 2022).
EVENTOS PRÉVIOS
11) Sinais de manipulação ou complicações cirúrgicas prévias
A avaliação da presença de tela ou pontos de fixação podem indicar manipulação cirúrgica prévia e, desta forma, possibilidade de maior complexidade técnica em uma nova abordagem. Além disso, a avaliação de coleções ou trajetos fistulosos na imagem é importante para definição de etapas cirúrgicas para resolução da infecção crônica ou reação de corpo estranho antes de uma nova tentativa de reparo definitivo com uma nova prótese.
- MANEJO INICIAL
A prevalência de defeitos complexos de parede abdominal e de necessidade de reparos de defeitos herniários continua a crescer, assim como a proporção de tais pacientes com comorbidades sérias. Estudos identificaram que idade, gênero, índice de massa corporal (IMC), comorbidades e tabagismo têm grande associação com o índice de eventos desfavoráveis de sítio cirúrgico e com complicações em geral. (RAMASWAMY, 2023).
O reparo de grandes hérnias incisionais é uma cirurgia complexa que requer dissecções extensas, ressecção de telas, manejo de lesões cicatricias ou pele atrófica, remoção de fístulas, separação de componentes ou confecção de retalhos, que demandam uma abordagem multiprofissional, com cirurgiões experientes e especialmente treinados. Essas cirurgias tendem a ser mais complexas devido às elevadas taxas de comorbidades e outros fatores de risco que estes pacientes apresentam, que os predispõem a um ciclo vicioso de complicações e, consequentemente, recorrências. Estes desfechos adversos apresentam grande impacto nos custos, qualidade de vida e recursos hospitalares e, nos casos de insucesso do reparo cirúrgico, será necessário um novo procedimento. (GROOVE et al, 2021).
Com os crescentes estudo e cuidado deste perfil de pacientes com necessidades cada vez mais complexas, os cirurgiões buscam submeter ao procedimento cirúrgico aquele grupo de pacientes que se aproxima de condições ótimas no perioperatório. Isso permite tempo para um planejamento pré-operatório completo, otimização fisiológica e psicológica do paciente e tomada de decisões técnicas em relação ao procedimento. (GROOVE et al, 2021). Devido aos riscos e custos das complicações pós-operatórias, especialmente infecções de sítio cirúrgico, tem-se sugerido que a otimização préoperatória deve ser até mais importante que a técnica cirúrgica, embora que, na realidade, seja a combinação das duas que provavelmente proporcione os melhores desfechos. (RAMASWAMY, 2023).
Pacientes tabagistas têm altas taxas de recorrência, além de complicações respiratórias e infecciosas, reoperação, readmissão e morte. Dessa forma, o manejo préoperatório destes indivíduos deve contemplar o controle do tabagismo. O aconselhamento de interrupção do tabagismo durante o período pré-operatório de um reparo de hérnia tem se mostrado efetivo em quase 20% dos indivíduos, além disso, a privação do tabagismo no período de 4 semanas antes do procedimento reduz os índices de complicações de 41% para 21%. (RAMASWAMY, 2023).
Os métodos mais eficazes de atingir a cessação do tabagismo durante o préoperatório, e manter a longo prazo, envolve programas que combinem a farmacoterapia com terapia cognitivo-comportamental, com taxas de sucesso que chegam a até 40% de abstinência de pelo menos 1 ano no período pós-cirúrgico. (RAMASWAMY, 2023).
A hiperglicemia perioperatória tem sido associada com altos índices de complicações pós-cirúrgicas e custos hospitalares de pacientes no geral. Embora esteja claro que este controle glicêmico perioperatório seja de grande importância, ainda é difícil dicernir se o controle do histórico glicêmico interfere nos desfechos dos reparos de hérnia. De toda forma, apesar dos dados conflitantes do valor preditivo da hemoglobina glicada (HbA1c), especialistas recomendam evitar reparos eletivos de hérnia com valores de HbA1c superiores a 8%, com controle perioperatório naqueles com taxas acima de 6,5%. (RAMASWAMY, 2023).
Inúmeros estudos associam a obesidade com complicações perioperatórias, incluindo volumosa perda sanguínea intraoperatória, tempo cirúrgico prolongado, complicações cardiopulmonares, eventos tromboembólicos, intercorrências e infecções de sítio cirúrgico e formação e recorrência de hérnias incisionais. (PETERMAN, 2021).
Em indivíduos obesos, a relativa hipoperfusão e isquemia que ocorre no excesso de tecido adiposo subcutâneo pode tornar a ferida operatória mais suscetível a infecções. Essa suscetibilidade a infecção pode ser ainda mais pronunciada nesta população porque a perfusão tecidual subótima não permite uma distribuição apropriada dos antibióticos pré-operatórios. Isto pôde ser evidenciado em pacientes submetidos a cirurgias colorretais eletivas, onde a incidência de infecções de sítio cirúrgico foi superior em pacientes com IMC ≥ 30 kg/m2, apesar da antibioticoprofilaxia. (KAOUTZANIS et al, 2013). Idealmente, o risco atribuído à obesidade pode ser amenizado através da perda ponderal no pré-operatório, com o mais recomendado sendo um IMC inferior a 40 kg/m2. (PETERMAN, 2021).
Dentre as opções para atingir o IMC pré-operatório ótimo incluem perda de peso autodirecionada, através de abordagem multidisciplinar, farmacoterapia, intervenções endoscópicas ou procedimentos cirúrgicos. (PETERMAN, 2021).
O aconselhamento ao paciente sobre a perda de peso isoladamente é insuficiente. Programas multidisciplinares são mais bem sucedidos. Estudos com dietas poupadoras de proteína, com auxílio médico especializado em perda de peso, resultaram em significante perda de peso e uma redução do IMC de 9kg/m2 em um período médio de 17 meses. Adicionalmente, terapia farmacológica para obesidade pode também atingir um redução de peso de 5% a 10% em 1 ano. (PETERMAN, 2021).
Inequivocamente, a redução de peso por métodos cirúrgicos é superior ao manejo medicamentos em atingir uma perda de peso sustentada e remissão ou melhora em comorbidades. A cirurgia bariátrica neoadjuvante pode reduzir o risco de recorrência de hérnia, complicações de ferida e morbidade medicamentosa. (PETERMAN, 2021).
Contudo, o reparo da hérnia ventral em pacientes obesos pode ainda ser ofertado, sem a necessidade da redução de peso pré-operatória, nos casos em que os paciente sejam inelegíveis à cirurgia bariátrica, altamente sintomáticos ou cuja morfologia da hérnia prediga elevado risco potencial de encarceramento. (PETERMAN, 2021).
- PREPARO PRÉ-OPERATÓRIO
Em poucas ocasiões recomenda-se o preparo mecânico do cólon, podendo ser realizado em casos em que há presença de múltiplas aderências ou se o conteúdo herniário tiver alças intestinais. Recomenda-se, no entanto, a passagem de sonda nasogástrica, principalmente nas abordagens laparoscópicas, com o objetivo de se evitar acidentes de punção na passagem dos trocartes. (MARKOVIC et al, 2016).
No que concerne à profilaxia com antibióticos, aos pacientes que serão realizados implante de tela, deve-se administrar uma dose de cefalosporina de primeira geração durante a indução anestésica. Àqueles alérgicos a cefalosporinas, recomenda-se a substituição por vancomicina ou clindamicina. (MARKOVIC et al, 2016).
Pacientes com defeitos complexos de parede abdominal podem se beneficiar de uma pré-habilitação da parede previamente ao reparo cirúrgico. Dentre as alternativas, pode-se optar por algumas das estratégias que auxiliam na melhora da funcionalidade da parede abdominal, seja reduzindo a retração muscular causada pela hérnia ou aumentando o volume da cavidade abdominal. São elas o pneumoperitôneo progressivo e a aplicação intraparietal de toxina botulínica.
Pneumoperitôneo progressivo
Inicialmente descrito na década de 1940, esse procedimento objetiva aumentar o volume da cavidade abdominal, de modo a facilitar a reintrodução das vísceras ocas herniadas pela diminuição do edema mesentérico crônico, redução das vísceras e, com isso, propiciar o fechamento sem tensão da parede abdominal. Além disso, permite a melhora progressiva da função diafragmática e tem a vantagem de promover ainda no pré-operatório lise de aderências intra-abdominais. (SPERANZINI, 2010).
Esse procedimento consiste na injeção diária de 500 a 1000 mL de ar ambiente ou óxido nitroso na cavidade abdominal, através de um cateter previamente implantado, sendo titulada a quantidade adequada através dos sintomas do paciente ou de medidas de pressão. O tempo de realização de pneumoperitôneo progressivo é variável, porém a maioria varia em torno de 14 e 30 dias. Dentre os efeitos colaterais atribuídos a este procedimento, são comuns náuseas, dor no ombro, dispneia e dor no sítio de punção.(RAMASWAMY, 2023).
Toxina botulínica
A toxina botulínica A é um inibidor da liberação da acetilcolina que, no uso do manejo terapêutico de hérnias complexas, permite a paralisia dos músculos laterais, permitindo o fechamento fascial da parede abdominal em combinação com uma separação de componetes. Essa paralisia química permite o alongamento dos músculos, com ganho médio de até 6,3 cm de extensão lateral da parede abdominal, sendo 3,2 cm em cada lado. (RAMASWAMY, 2023).
- TRATAMENTO CIRÚRGICO
Antes da escolha da técnica, deve-se atentar aos recursos disponíveis na instituição, além de se considerar os aspectos individuais de cada paciente, devendo-se realizar a tomada de decisão em conjunto com o paciente, evidenciando os benefícios e riscos de cada técnica, além das possibilidades de desfechos pós-operatórios.
Técnicas laparoscópicas
As correções laparoscópicas, quando comparadas com os reparos abertos, apresenam menores índices de infecções de ferida operatória, devendo-se, portanto, ser consideradas em pacientes com maior risco de infecções. Todavia, em relação à dor pósoperatória, os resultados são semelhantes em ambas modalidades a longo prazo. (MARKOVIC et al, 2016).
Nessas correções o recomendado é que seja utilizada tela dupla face, com tamanho de, no mínimo, 3 a 4 cm maior que o da hérnia, permitindo a sobreposição completa da tela em relação ao defeito da parede abdominal. O tratamento do saco peritoneal e a colocação de drenos não são obrigatórios. (MARKOVIC et al, 2016).
Situações especiais podem representar contraindicações para o reparo laparoscópico de hérnias incisionais: presença de enxertos de pele abdominal, fístulas enterocutâneas ativas, necessidade de remoção de prótese prévia, defeitos muito grandes, defeitos menores que 3 cm, defeitos pequenos com sacos herniários grandes e hérnia encarcerada ou estrangulada. (MARKOVIC et al, 2016).
Técnicas abertas
É aceitável a correção primária de hérnias incisionais com a utilização apenas dos próprios tecidos apenas em hérnias pequenas (menores que 3 cm). Hérnias maiores sempre se beneficiarão do uso de prótese na correção do defeito. (MARKOVIC et al, 2016).
Durante o fechamento das aponeuroses, suturas muito próximas das bordas da ferida, muito distantes uma das outras e sob muita tensão, são fatores que aumentam a probabilidade de deiscência. Dessa forma, o que se recomenda para reduzir as chances desta complicação é utilizar fios monofilamentares e de material não absorvível (como o polipropileno), e a sutura deve ser contínua ou com pontos separados, desde que os pontos estejam próximos (1 a 1,5 cm de distância) e ancorados em boa quantidade de tecido aponeurótico (com um distância da borda da aponeurose de cerca de 2 cm).(MARKOVIC et al, 2016).
Dentre as opções disponíveis de posicionamento de tela, temos:
- Técnica onlay: consiste no posicionamento da tela sobre a aponeurose anterior do abdome, logo abaixo do subcutâneo na região pré-fascial. Recomenda-se a sobreposição de tela além do defeito com, pelo menos, 5 cm em cada margem e sua fixação com múltiplas suturas de fio absorvível, de preferência poliglactina, o que permite uma maior área de contato entre a tela e a parede, facilitando sua integração completa e diminui o vetor resultante de força sobre todos os pontos da parede. (MARKOVIC et al, 2016).
- Técnica inlay: consiste no posicionamento da tela nas bordas do defeito ou da parede. Devido aos altos índices de recorrência e da menor taxa de integração do material sintético à parede abdominal, dentre outros resultados insatisfatórios, essa técnica tem entrado em desuso. (MARKOVIC et al, 2016).
- Técnica sublay ou retromuscular: originalmente denominada Rives-Stoppa, consiste, de forma simplificada, no posicionamento da tela entre a face posterior do músculo reto abdominal e sua bainha posterior, após sua dissecção ampla, tratamento do saco herniário e fechamento do defeito. Estudos demonstram que tal abordagem apresenta menores taxas de recidiva quando comparados com os reparos onlay. (MARKOVIC et al, 2016).
- Técnica intraperitoneal: apresenta uma maior resistência à pressão abdominal, tendo em vista que a pressão da cavidade força a prótese contra a parede abdominal. O principal problema consiste no risco potencial de lesões viscerais, o que gera a necessidade de uso de telas especiais, compostas com dupla face, adequadas para o contato com a cavidade peritoneal sem risco de aderências intestinais. Tem como indicação as grandes hérnias incisionais, as multirrecidivadas, quando existirem lesões intra-abdominais associadas e em pacientes obesos. (MARKOVIC et al, 2016).
- CONSIDERAÇÕES PÓS-OPERATÓRIAS
Drenos abdominais devem ser utilizados, principalmente nas cirurgias abertas, quando se opta por grandes dissecções, e devem permanecer enquanto houver débito elevado (acima de 100 a 150 mL), sendo retirados quando se reduz a 20 ou 30 mL, geralmente no 4º ou 5º dia de pós-operatório. (MARKOVIC et al, 2016; SPERANZINI, 2010).
Pacientes que evoluem com íleo adinâmico devem ser inicialmente manejados de modo conservador, com administração de líquidos, repouso intestinal e/ou descompressão gástrica. (MARKOVIC et al, 2016).
Medidas de tromboprofilaxia devem ser realizadas àqueles doentes restritos ao leito, através de heparinização e, se necessário, medidas mecânicas, como meias elásticas. (MARKOVIC et al, 2016).
O recomendável é que o paciente receba alta em uso de uma cinta abdominal, a qual deve ser utilizada por, pelo menos 3 meses. O retorno às atividades diárias ocorre em média após 10 dias, sendo que a maioria dos pacientes volta às atividades normais em torno de três a seis meses. (MARKOVIC et al, 2016; SPERANZINI, 2010).
Das complicações pós-operatórias, o seroma é a mais esperada, e a maioria tem resolução espontânea; a drenagem é necessária apenas em casos de persistência. De outro modo, a complicação mais grave é a infecção da prótese. Ocorre mais comumente em pacientes com lesões cutâneas prévias, como úlceras ou reação por corpo estranho de cirurgias anteriores, que podem levar à extrusão da tela. Antes de se planejar uma nova intervenção com utilização de prótese, o processo infeccioso deve ser tratado. Pode ser tentada uma combinação de antibióticos, drenagem percutânea, desbridamento e terapia com pressão negativa. Quando há falha nestas abordagens, a retirada da prótese deve ser realizada. (MARKOVIC et al, 2016).
REFERÊNCIAS
TOWNSEND, C. et al. Sabiston: Textbook of Surgery: The Biological Basis of Modern Surgical Practice. 21ª Edição. Elsevier Inc, 2022.
FRANZ, M. G. The biology of hernias and the abdominal wall. Hernia, n. 10, p. 462471, 2006.
AMARAL, D. O. et al. Urgency hospitalizations for inguinal hernia in Brazil from 2010 to 2019: mortality and costs in the public health system. ABCD Arq Bras Cir Dig, v. 36, p. 1738, 2023.
EVERLING, E. M. et al. Open vs laparoscopic hernia repair in the Brazilian Public Health System. An 11-year nationwide population-based study. Arq Gastroenterol, n. 57, p. 484-490, 2020.
ZAHIRI, H. R. et al. Abdominal Wall Hernia. Current Problems in Surgery, v. 8, n. 55, p. 286-317, 2018.
HENRIKSEN, N. A. et al. Guidelines for treatment of umbilical and epigastric hernias from the European Hernia Society and Americas Hernia Society. British Journal of Surgery, v. 107, n. 3, p. 171-190, 2020.
APPLEBY, P. W. et al. Umbilical Hernia Repair: Overview of Approaches and Review of Literature. Surgical Clinics of North America, v. 98, n. 3, p. 561-576, 2018.
BARBOSA, C. A. et al. Hérnia umbilical primária: melhor manejo operatório no adulto. Revitas USP, Medicina (Ribeirão Preto), v. 54, n. 1, 2021.
ZOE TAO, B. A. et al. Hernia Size and Mesh Placement in Primary Umbilical Hernia Repair. The American Surgeon, v. 0, n. 0, p. 1-9, 2020.
CLAUS, C. M. P. et al. Orientações da Sociedade Brasileira de Hérnia (SBH) para o manejo das hérnias inguinocrurais em adultos. Rev Col Bras Cir, v. 46, n. 4, 2019.
SIMONS, M. P. et al. International guidelines for groin hernia management. Hernia, v. 22, n. 1, p. 1-165, 2018.
GOMES, C. A. et al. Liechtenstein versus correção de hérnia laparoscópica transabdominal pré-peritoneal (TAPP): um estudo comparativo prospectivo com foco nos resultados pós-operatórios em uma unidade de cirurgia geral. ABCD Arq Bras Cir Dig, v. 34, n. 4, p. 1642, 2021.
FURTADO, M. et al. Sistematização do reparo da hérnia inguinal laparoscópica (TAPP) baseada em um novo conceito anatômico: Y invertido e cinco triângulos. ABCD Arq Bras Cir Dig, v. 32, n. 1, p. 1426, 2019.
SPERANZINI, M. B. et al. Grandes hérnias incisionais. ABCD Arq Bras Cir Dig, v. 23, n. 4, p. 280-286, 2010.
CLAUS, C. M. P. et al. Relatório DECOMP: Respostas que os cirurgiões esperam de um exame de imagem da parede abdominal. Rev Col Bras Cir, v. 49, 2022.
DIETZ, U. A.; BINGENER-CASEY, J. Classification of ventral and incisional hernias. In: Laparo-endoscopic Hernia Surgery. Springer, Berlin, Heidelberg, 2018.
RAMASWAMY, A. Preoperative Optimization for Abdominal Wall Reconstruction. Surgical Clinics of North America, v. 103, n. 5, p. 917-933, 2023.
GROOVE, T. N. Perioperative optimization in complex abdominal wall hernias: Delphi consensus statement. BJS Open, v. 0, n. 0, 2021.
PETERMAN, D. E.; WARREN, J. A. Ventral Hernia Management in Obese Patients. Surgical Clinics of North America, v. 101, n. 2, p. 307-321, 2021.
KAOUTZANIS, C. Risk factors for postoperative wound infections and prolonged hospitalization after ventral/incisional hernia repair. Hernia, v, 19, n. 1, p. 113-123, 2015.
MARKOVIC, A. Hérnia Incisional: proposta de um fluxograma que oriente o tratamento. J. Health Biol Sci, v. 4, n. 4, p. 257-264, 2016.
1 Médico Cirurgião Geral formado pelo Serviço de Cirurgia Geral do Hospital Dr. Carlos Macieira/MA.
2 Médico Cirurgião Geral formado pelo Serviço de Cirurgia Geral do HU-UFMA.
