REGISTRO DOI: 10.5281/zenodo.8371438
Laila Feld
Valeska Davi Caldoncelli de Andrade
Henrique Alberto Portella Pasqualette
Renato de Souza Bravo
RESUMO
INTRODUÇÃO: O câncer de mama é a principal causa de morte por câncer na população feminina e o rastreio mamográfico é a ferramenta capaz de diminuir a mortalidade por esta doença. A mamografia, no entanto, tem sensibilidade limitada em parcelas da população feminina. A mamogafia contrastada ou angiomamografia agrega à mamografia o estudo funcional do tecido mamário, proporcionando uma avaliação mais acurada e reduzindo as limitações do método. A comprovação da acurácia deste método tem potencial de melhorar a eficácia do rastreio do câncer de mama, através de um exame com potencial de agregar a alta performance diagnóstica permitida pelo estudo das alterações relacionadas a angiogênese tumoral e à facilidade de realização do método, uma vez que se trata de um exame acessível, rápido e de fácil interpretação.
OBJETIVOS: Este estudo prospectivo para validação de método diagnóstico coletou dados retrospectivos e prospectivos. Teve com objetivo analisar a performance diagnóstica da mamografia com contraste na detecção do câncer de mama, correlacionando os achados de imagem observados neste método com os resultados histopatológicos (padrão ouro) de amostras de biópsias percutâneas de lesões mamárias identificadas na mamografia e/ou ultrassonografia.
MATERIAL E MÉTODOS: Este estudo baseia-se em amostra que compreende pacientes encaminhadas ao Cepem, clínica de diagnóstico por imagem que abrigou este projeto, para realização de biópsias percutâneas orientadas por estereotaxia ou ultrassonografia, dirigidas a lesões mamárias previamente identificadas. Estas pacientes realizaram a mamografia com contraste na mesma ocasião em que foram submetidas aos procedimentos percutâneos. Os resultados da mamografia com contraste foram correlacionados com o diagnóstico histopatológico obtido nos espécimes das biópsias, avaliando-se assim a capacidade do método na detecção de lesões malignas das mamas.
RESULTADOS: Cento e noventa e oito mulheres com 208 lesões compoem esta amostra, tendo sido diagnosticadas 156 (75,4%) lesões benignas e 51 (24,6%) tumores malignos. As lesões malignas diagnosticadas neste estudo dividiram-se em 35 (16,9%) tumores invasivos e 16 (7,7%) carcinomas ductais in situ. Quarenta e três dentre as 51 lesões malignas demonstraram realce anômalo na CEM, com apenas um dos 35 cânceres invasivos não apresentando realce pelo contraste na CEM, pois tratava-se de lesão localizada fora do campo mamográfico. Os demais sete casos com realce ausente corresponderam a CDIS manifestados por calcificações suspeitas sem realce. Nesta amostra o realce na CEM demonstrou sensibilidade de 84,3%, especificidade de 78,2%, valor preditivo positivo de 55,8%, e valor preditivo negativo de 93,8%. O estudo combinado CEM e mamografia digital exibe sensibilidade de 98%, especificidade de 78%, valor preditivo positivo de 59% e valor preditivo negativo de 99%.
CONCLUSÕES: A CEM é uma técnica combinada, que agrega a informação morfológica fornecida pela mamografia com a avaliação funcional das mamas, identificando tecidos com neoangiogênese, através do uso de meio de contraste. Nesta casuística, observamos elevada sensibilidade da CEM na detecção de neoplasia maligna das mamas, comparável a RM, considerada o método diagnóstico de maior sensibilidade para a detecção de câncer de mama. A performance do método alvo de estudo foi semelhante às descrições encontradas na literatura vigente, apontando para a possibilidade de ampla utilização desta ferramenta no diagnóstico por imagem do câncer de mama, sendo relevante ressaltar o custo relativamente baixo e exequibilidade do exame na prática clínica.
Palavras-chave: mamografia com contraste, angiomamografia, CEM, câncer de mama, mamografia digital, ressonância magnética.
ABSTRACT
INTRODUCTION: Breast cancer is the leading cause of cancer death in the female population and mammographic screening is a tool capable of reducing mortality from this disease. Mammography, however, has limited sensitivity in parts of the female population. Contrast mammography or angiomammography adds to mammography the functional study of breast tissue, providing a more accurate assessment and reducing the limitations of the method. Proof of the accuracy of this method has the potential to improve the effectiveness of breast cancer screening, through an exam with the potential to add the high diagnostic performance allowed by the study of changes related to tumor angiogenesis and the ease of performing the method, since that it is an accessible, fast and easy to interpret exam.
OBJECTIVES: This prospective study to validate a diagnostic method collected retrospective and prospective data. It aimed to analyze the diagnostic performance of contrast-enhanced mammography in the detection of breast cancer, correlating the imaging findings observed in this method with the histopathological results (gold standard) of percutaneous biopsy samples of breast lesions identified in mammography and/or ultrasonography.
MATERIAL AND METHODS: This study is based on a sample comprising patients referred to Cepem, the diagnostic imaging clinic that hosted this project, for percutaneous biopsies guided by stereotaxy or ultrasound, directed to previously identified breast lesions. These patients underwent contrast-enhanced mammography at the same time they underwent percutaneous procedures. The results of contrast mammography were correlated with the histopathological diagnosis obtained from the biopsy specimens, thus evaluating the method’s ability to detect malignant breast lesions.
RESULTS: One hundred and ninety-eight women with 208 lesions compose this sample, with 156 (75.4%) benign lesions and 51 (24.6%) malignant tumors. The malignant lesions diagnosed in this study were divided into 35 (16.9%) invasive tumors and 16 (7.7%) ductal carcinomas in situ. Forty-three of the 51 malignant lesions demonstrated anomalous enhancement on CEM, with only one of the 35 invasive cancers not showing contrast enhancement on CEM, as it was a lesion located outside the mammographic field. The remaining seven cases with absent enhancement corresponded to DCIS manifested by suspicious calcifications without enhancement. In this sample, CEM enhancement showed a sensitivity of 84.3%, specificity of 78.2%, positive predictive value of 55.8%, and negative predictive value of 93.8%. The combined CEM and digital mammography study exhibits a sensitivity of 98%, specificity of 78%, positive predictive value of 59%, and negative predictive value of 99%.
CONCLUSIONS: CEM is a combined technique that combines the morphological information provided by mammography with the functional assessment of the breasts, identifying tissues with neoangiogenesis through the use of contrast medium. In this series, we observed a high sensitivity of CEM in the detection of malignant neoplasm of the breasts, comparable to MRI, considered the most sensitive diagnostic method for the detection of breast cancer. The performance of the target method of study was similar to the descriptions found in the current literature, pointing to the possibility of wide use of this tool in the imaging diagnosis of breast cancer. It`s also important to emphasize the relatively low cost and feasibility of the exam in clinical practice.
Keywords: contrast-enhanced, mammography, angiomammography, CEM, breast cancer, digital mammography, magnetic resonance imaging.
1. INTRODUÇÃO
O câncer de mama é a principal causa de morte por câncer na população feminina mundial, tendo sido estimados 2,3 milhões de novos casos em 2020, o que representa 24,5% de tumores malignos em mulheres, conforme dados do Instituto Nacional do Câncer (INCA). Ainda de acordo com o INCA, para o ano de 2022, foram estimados 66.280 novos casos no Brasil, o que corresponde a uma taxa ajustada de incidência de 43,74 casos por 100 mil mulheres (1). Este instituto informa uma previsão de incidência bruta de 104,69 casos por 110 mil mulheres no estado do Rio de Janeiro para o mesmo período, configurando a maior incidência entre os estados da federação. Com exceção dos cânceres de pele não melanoma, é o tumor maligno mais incidente nas mulheres no país, tendo incidência e mortalidade crescentes a partir dos 40 anos de idade. A incidência de câncer de mama apresentou um aumento de 20% nos últimos anos, observando-se tendência ao aumento do diagnóstico em mulheres com menos de 50 anos. Além disto, observando-se a mortalidade proporcional por câncer na população feminina em 2019 no país, os óbitos por câncer de mama correspondem a 16,1% do total, ocupando o primeiro lugar nesta estatística (1).
A Sociedade Brasileira de Mastologia recomenda que se evite a obesidade e o consumo de álcool, como formas de redução do risco de desenvolvimento do câncer de mama, uma vez que estão associados a maior probabilidade desta doença. A exposição a radiação ionizante antes dos 35 anos de idade também constitui fator de risco. Entretanto, as estratégias de prevenção primária têm papel bastente limitado, em virtude da relação do câncer de mama com diversos fatores de risco e com caracteres genéticos (2).
A principal ferramenta de impacto na redução da mortalidade pelo câncer de mama é o seu diagnóstico precoce, ainda em estágios subclínicos e portanto a sua prevenção secundária. A constatação da abrangência desta enfermidade na população torna ainda maior e mais relevante o desafio do aprimoramento da eficácia dos programas de rastreio da doença. Os esforços se concentram no sentido de se alcançar diagnósticos cada vez mais precoces, ampliando as possibilidades de diminuição da mortalidade por esta enfermidade.
O único método que comprovadamente diminui a mortalidade pelo câncer de mama é a mamografia e portanto os programas de rastreio se baseiam na realização deste exame nos mais diversos países. A história da mamografia tem início em 1913, por meio de estudos radiológicos de peças de mastectomias e a demonstração da sua correlação com achados histopatológicos, realizados por Albert Salomon, cirurgião alemão (3). A partir deste trabalho, inúmeros estudos foram desenvolvidos acerca do assunto, culminando com a publicação de Robert Egan, em 1962, que descrevia a detecção de 53 tumores malignos em 2000 mamografias realizadas (3). Durante as décadas seguintes aconteceu progressiva melhora da qualidade das imagens, estabelecimento de parâmetros técnicos, fabricação de filmes específicos, a proposta do sistema de padronização dos laudos pelo Colégio Americano de Radiologia, com a formulação do ACR-BI-RADS (American College of Radiology Breast Imaging Reporting and Data System), adotado no Brasil a partir de 1998, e o advento da mamografia digital, nos anos 2000.
No Brasil, em 1990, o Ministério da Saúde engaja-se na primeira campanha de prevenção do câncer de mama (4). O alvo dos programas de rastreamento é a população feminina nas faixas etárias de maior incidência da doença, havendo variações dentre os países, sobretudo no tocante a periodicidade da realização do exame. A Sociedade Brasileira de Mastologia preconiza que o exame seja feito anualmente em todas as mulheres a partir dos 40 anos, considerando a população geral. Para a população com risco elevado de câncer de mama, não existem dados que estabeleçam exatamente um programa específico, devendo a estratégia de prevenção secundária desta doença ser pensada individualmente.
Embora a mamografia seja a modalidade capaz de reduzir a mortalidade pelo câncer de mama, sua sensibilidade na população geral varia de 75% a 80%, sendo especialmente menor no caso de mamas densas, mais comuns em mulheres jovens, podendo variar de 30% a 48% neste grupo (5). Mesmo com o advento mamografia digital, que representou a eliminação do processamento de filmes e artefatos, melhora na organização e armazenamento da informação e ainda aumento da sensibilidade em mulheres na pré e peri-menopausa, grandes estudos randomizados falharam em demonstrar melhora substancial na acurácia diagnóstica em subgrupos específicos (6).
Esta limitação impulsionou o desenvolvimento e inclusão de outros métodos de imagem complementares nas rotinas de rastreio suplementar e diagnóstico do câncer de mama. Assim consolidaram-se como ferramentas importantes na identificação e manejo das neoplasias das mamas a ultrassonografia, a tomossíntese mamária e notadamente a ressonância magnética (RM), cujo uso iniciou-se nos anos 1990. Sendo esta última a primeira modalidade na imagenologia mamária a utilizar meio de contraste endovenoso, a RM demonstrou ser o método de maior sensibilidade na detecção do câncer de mama (80% a 97,8%, de acordo com os estudos atuais) (7). A RM tornou-se assim o melhor exame para o rastreio de mulheres de alto risco, para a mensuração de extensão de doença maligna comprovada e de avaliação de resposta a quimioterapia neoadjuvante (8).
Esta capacidade diagnóstica da RM está relacionada a evidenciação da angiogênese tumoral através do estudo contrastado das mamas. É sabido que os tumores malignos promovem a formação de novos vasos sanguíneos cujas membranas basais são deficientes, de modo que apresentam fluxo sanguíneo pronunciado e por esta razão absorvem o meio de contraste endovenoso de forma mais intensa que os tecidos normais. Os tecidos acometidos apresentam-se assim com realce distinto do parênquima mamário sadio na imagens da RM, levantando a suspeita diagnóstica. A habilidade do estudo vascular diferencia o estudo das mamas por RM dos chamados métodos morfológicos, como a mamografia e ultrassonografia, ampliando a identificação e caracterização de lesões mamárias e conferindo a este método a melhor performance no diagnóstico das doenças malignas das mamas.
Entretanto, a expansão do uso da ressonância magnética das mamas é limitada pelo alto custo tanto da sua implementação quanto do valor individual de cada exame. Soma-se a este fato a necessidade de amplos espaços à disposição, longa duração do exame, a sua contra-indicação para pacientes portadoras de implantes metálicos e marca passos, a restrição da sua realização em casos de claustrofobia e de alergia ao gadolínio, meio de contraste utilizado neste método (9).
Projetando aliar o estudo morfológico proporcionado pela mamografia, com a análise da perfusão tumoral permitida pelos estudos que lançam mão de contrastes endovenosos, desenvolveu-se a mamografia com contraste ou angiomamografia, na língua inglesa recebendo as nomenclaturas de Contrast Enhanced Digital Mammography (CEDM), Contrast Enhanced Spectral Mammography (CESM) ou mesmo Contrast Enhanced Mammography (CEM). Esta tecnologia é implementada através da obtenção de um hardware que é adicionado a um mamógragfo digital, incluindo um filtro de cobre que é somado aos filtros de ródium e molibdênio, habituais nestes equipamentos (10).
A mamografia com contraste (CEM) pode ser adquirida por meio de duas técnicas distintas, utilizando-se em ambas a administração endovenosa de contraste iodado não iônico. Na chamada técnica temporal realiza-se a injeção do contraste endovenoso, com a mama a ser estudada sob compressão, após a aquisição de uma primeira imagem mamográfica, que será a máscara para posterior subtração das imagens contrastadas. Permite portanto a avaliação de apenas uma mama em uma única incidência, apresenta um viés de perfusão adequada do tecido mamário decorrente da compressão e é mais propícia a artefatos de movimento, uma vez que demanda que a paciente permaneça alguns minutos com a mama imobilizada (11).
A técnica mais explorada atualmente é a de dupla energia, na qual entre dois a sete minutos após a administração do meio de contraste, são obtidas duas imagens em cada incidência mamográfica, sendo uma de baixa energia e outra de alta energia. Utilizam se as incidências habituais do estudo mamográfico, que são incidências cranio caudais (CC) da mama direita e mama esquerda e incidências obliquas médio-laterais (OBLM) também bilaterais.
As imagens de baixa energia são equivalentes as de uma mamografia digital e disponibilizam os achados morfológicos; as de alta energia são geradas em espectro de raios X acima da camada K do iodo, utilizando o filtro de cobre, e são subtraídas e ponderadas de acordo com algoritmo específico. As imagens assim obtidas, chamadas imagens recombinadas, são estudadas no sentido de identificarem-se lesões que realçam com o contraste iodado, representando assim um estudo funcional do tecido mamário. Esta técnica permite o exame de ambas as mamas em 8 a 10 minutos, possibilita a realização de incidências adicionais, como compressões localizadas e magnificações, e evita o desconforto da compressão prolongada da mama, viabilizando uma análise rica e detalhada.
O exame a ser interpretado consiste rotineiramente de oito imagens, que compreeendem as incidências cranio-caudais e obliqua-médio laterais direita e esquerda, na versão de baixa energia (equivalente a mamografia digital) e na versão recombinada, onde são identificadas as imagens que apresentam realce anômalo pelo contraste. Sendo adquiridas imagens duplicadas de cada incidência, pode ser observado o comportamento de uma lesão vista na mamografia ao ser exposta ao meio de contraste, com exata correlação da localização dos achados nas imagens de baixa energia e recombinadas ou contrastadas. Esta análise combinada e simultânea respalda a classificação dos achados como suspeitos e portanto com recomendação de prosseguimento de sua investigação ou, ao contrário, pode reduzir ou afastar a hipótese de doença maligna. Deve-se acrescentar que o conjunto de imagens é de interpretação rápida e simples documentação. Na figura 1, um exemplo de CEM realizada ao longo deste estudo.
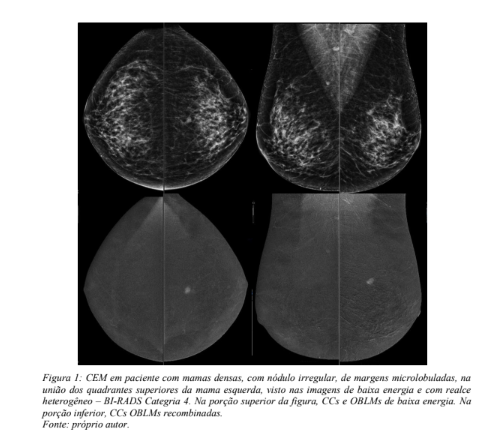
Há um variável acréscimo de 20-70% da dose de radiação na CEM em comparação com a mamografia digital, na dependência de cada fabricante e de especificidades de cada exame como espessura e densidade das mamas, mantendo-se entretanto dentro dos limites aceitos e seguros (12). Quando comparada a tomossíntese mamária, a CEM também acrescenta radiação, porém as diferenças são menos relevantes (média de 33%). As diferanças de dose entre estes dois métodos é determinada pela densidade do tecido mamário e, sobretudo, pela espessura da mama comprimida, embora esta variável não tenha efeito significativo na dose da tomossíntese. Invariavelmente, a dose glandular média na CEM mantem-se abaixo de 3mGy, limite estabelecido pelos programas de regulamentação. O benefício clínico gerado pela disponibilização das imagens de baixa energia,acrescidas do estudo funcional permitido pelas imagens recombinadas, supera o suposto malefício potencial do ganho de dose de radiação relacionado à CEM (13).
Diversos estudos vêem demonstrando resultados promissores deste método no diagnóstico das lesões malignas das mamas, evidenciando-se que a combinação das informações morfológicas e funcionais das mamas permitidas pela CEM resultam em maiores sensibilidade e especificidade que a mamografia digital no diagnóstico destas afecções (14). Não obstante, a CEM parece ter performance semelhante a RM no diagnóstico e estadiamento do câncer de mama, agregando menor custo, abreviação do tempo de realização e interpretação do exame e até a preferência das pacientes em relação a este último.
Constatando-se que a utilização da CEM ainda não ocorre em larga escala e, consequentemente, a maioria dos estudos disponíveis puderam avaliar números relativamente restritos de pacientes, faz-se necessário o interesse e estudo do método na prática clínica, objetivando-se a sua validação, aprimoramento e possibilidade de resultados progressivamente melhores no combate à mortalidade pelo câncer de mama.
2. JUSTIFICATIVA
Considerando a magnitude dos impactos do câncer de mama na população feminina, a consolidação de tecnologias que tornem o rastreio e diagnóstico precoce desta doença mais efetivo, é de fundamental importância no que tange a saúde publica. A pesquisa voltada para o melhor conhecimento desta ferramenta diagnóstica, pode gerar evidências que demonstrem tratar-se de um método eficiente que agrega baixo custo quando comparado à ressonância magnética, considerada hoje o padrão ouro no que se refere a sensibilidade para o diagnóstico das neoplasias mamárias. Este conhecimento pode estimular o seu uso, em detrimento de tecnologias que demandam mais recursos e portanto tornam-se menos acessíveis à população e dificultem a interferência na história natural desta doença frequentemente letal.
Da mesma forma, a confiabilidade de um estudo negativo tem potencial de evitar procedimentos diagnósticos desnecessários, como biópsias percutâneas ou mesmo cirúrgicas, mais uma vez evitando gastos e diminuindo o stress e ansiedade que a suspeita de doença maligna provoca nas pacientes.
3. OBJETIVOS
Avaliar a sensibilidade, especificidade, valores preditivos positivo e negativo da mamografia com contraste (CEM), observando se este é um método eficaz na detecção do câncer de mama, assim como a sua confiabilidade para descartar a presença de malignidade diante de achados negativos.
4. REVISÃO DA LITERATURA
Os primeiros estudos dedicados a CEM buscaram avaliar sua viabilidade na prática clínica. Lewin JM em 2003 apresentaram sua experiência com 26 mulheres cujos estudos radiológicos prévios descreviam lesões de aspecto suspeito, necessitando investigação histopatológica. Neste grupo, foram confirmados 13 casos de carcinomas invasivos, tendo todos apresentado realce no estudo com CEM. Um caso correspondeu a carcinoma intraductal, cujo ducto demonstrou leve realce. A factibilidade desta ferramenta diagnóstica foi observada, ressaltando-se a necessidade de novos estudos para a sua validação (15).
Jochelson et al submeteram um grupo inicial de dez mulheres à CEM na modalidade de dupla energia. Diante da constatação de sua exequibilidade, prosseguiram o estudo com 52 pacientes com neoplasia das mamas diagnosticada, entre 2010 e 2011, e compararam os resultados da CEM com a RM. Concluíram que esta modalidade foi exequível, de fácil realização e demonstraram que ambos os métodos identificaram 50 de 52 lesões índex (96%), enquanto a mamografia digital evidenciou 42 lesões (81%) (16) Em estudo publicado em 2014, Lobbes et al buscaram analisar a acurácia da CEM em população com baixa probabilidade pré teste de câncer de mama, submetendo pacientes referidas de programa de rastreio com anormalidade detectada à CEM e mamografia digital e correlacionaram com o diagnóstico histopatológico. Encontraram significativo aumento da acurácia diagnóstica com o uso da CEM em comparação com a mamografia digital, descrevendo sensibilidade de 100%, especificidade de 87,7%, valor preditivo positivo de 76,2% e valor preditivo negativo de 100% numa amostra de 113 pacientes incluídas no estudo. Relevante ressaltar que o valor preditivo negativo de 100% verificado, sugere a possibilidade de descartar-se a suspeita de neoplasia maligna das mamas diante da CEM negativa (17).
Lobbes et al também publicaram estudo que acessou a medida de 58 lesões malignas pela CEM, RM e sua validação mediante correlação com a medida final do estudo histopatológico e constataram que as medidas de ambos os métodos de imagem foram concordantes com a descrição histopatológica, não havendo vantagem qualitativa na mensuração por RM. As observações neste cenário propoem a indicação da CEM para a avaliação pré terapêutica de extensão tumoral em pacientes com diagnóstico de neoplasia. (18).
Um capítulo especial do diagnóstico por imagem de tumores mamários malignos é o estudo de lesões que se apresentam sob a forma de microcalcificações. A mamografia é sabidamente método de elevada sensibilidade na identificação de microcalcificações, sendo este um achado frequente em exames de rastreio e diagnósticos. Há significativa variabilidade do valor preditivo positivo dos achados ( 13% para calcificações BI-RADS categoria 4a; 36% para BI-RADS categoria 4b e 79% para BI-RADS categoria 4c – (19). A contribuiçao da CEM na avaliação de microcalcificações e na estimativa da extensão de tumores representados por estes achados radiológics foi abordada em estudo retrospectivo conduzido por Yun-Chung Cheung et al e incluído na literatura em 2015. A amostra identificou 59 casos de microcalcificações não associadas a massa ou a lesão palpável, dentre as quais 22 correspondiam a lesões malignas. Destas, 20 (76,9%) apresentaram realce na CEM. Dentre as lesões atípicas, 11,5% tiveram realce anômalo, mesmo percentual observado no conjunto de lesões benignas. A sensibilidade do realce na CEM foi de 90,9%, especificidade de 83,78%, valor preditivo positivo de 76,92% e valor preditivo negativo de 93,94%, sugerindo que a observação adicional sobre realce das microcalcificações com o uso da CEM acrescenta informação ao manejo diagnóstico destes achados (20).
Uma metanálise publicada em 2016 por Tagliafico et al qualificou oito artigos que estudaram a acurácia da CEM e observou um padrão de alta sensibilidade (95%) e especificidade variável nos trabalhos realizados até 2015, levantando a hipótese desta inconstância guardar relação com a relativa inexperiência com o método (21).
Estudos subsequentes apontaram maior acurácia da CEM em relação a RM na detecção do câncer de mama. A análise retrospectiva de 52 pacientes com diagnóstico recente de câncer de mama, que realizaram RM e CEM no seu processo diagnóstico foi publicada por Lee-Felker et al em 2017. Neste universo, a CEM demonstrou sensibilidade inferior a RM (94% X 99%) e valor preditivo positivo significativamente maior (93% X 60%). Dentre 11 lesões secundárias ao tumor principal, 100% foram identificadas na CEM e dez na RM. A revisão destes dados admite que a CEM seja potencialmente tão sensível quanto a RM na avaliação de extensão de tumores mamários para o planejamento terapêutico, com valor preditivo positivo superior (22).
Divulgando seus dados em 2017, Fallenberg et al também compararam a performance clínica da CEM com a RM e com a mamografia em estudo prospectivo. Esta amostra incluiu 155 mulheres, todas com ao menos uma lesão com diagnóstico comprovado de carcinoma invasivo ou carcinoma ductal in situ (CDIS), cujas três modalidades de imagem foram avaliadas ( CEM, RM e mamografia). Foram submetidas a estudo histopatológico 308 lesões presentes nesta amostra, incluindo benignas, malignas e atípicas, sendo observado um aumento de 15% na detecção de tumores com a incorporação do estudo contrastado à mamografia. As mulheres com mamas densas foram as maiores beneficiadas e cujo incremento de dose foi menor em comparação com a mamografia isoladamente. A acurácia da CEM foi comparável à da RM (8).
Diante de resultados tão expressivos em cenários diagnósticos, a utilização da CEM como método de rastreio, especialmente para população de risco alto ou intermediário, passa a ser objeto de investigação. O estudo retrospectivo de Sorin et al abrigou população de 611 mulheres, dentre as quais 48,2% com história pessoal ou familiar de câncer de mama e 93,1% como mamas densas, caracterizando grupo de risco intermediário para câncer de mama (15 a 20% de chance estimada ao longo da vida). A mamografia detectou 11 de 21 tumores malignos, ao passo que a CEM identificou 19, demonstrando sensibilidades de 52,4% e 90,5% respectivamente. 94,1% das participantes realizaram ultrassonografia complementar à CEM. Achados da ultrassonografia suscitaram o acréscimo de 54 biópsias, sendo todas negativas para malignidade. A publicação de 2018 conclui que a CEM aumenta expressivamente a sensibildade da mamografia e não se notou benefício na associação com ultrassonografia nesta amostra de mulheres de risco elevado e mamas densas (23).
Xing et al compararam a precisão diagnóstica da CEM e da RM, abordando 235 pacientes com 263 lesões. Descrevem em publicação de 2019 resultados que mostram sensibilidades equivalentes entre a CEM e a RM, entretanto maior acurácia, maior especificidade e menos falso positivos na primeiro (24). Propondo-se a apresentar uma amostra mais abrangente, Travieso-Aja et al estudaram 644 lesões em 465 pacientes, comparando a CEM com a mamografia digital e com mamografia digital associada a ultrassonografia. Esta foi uma das maiores amostras dedicadas a CEM exploradas até então e evidenciou que esta tecnologia possui elevada performance diagnóstica, superior inclusive à conjugação de dois métodos ( mamografia e ultrassonografia), salientando a relevante observação de ausência de aprimoramento na acurácia ao diagnóstico de calcificações malignas não associadas a massa pela CEM. A maior parte destas lesões não apresentou relace pelo contraste, sendo a informação diagnóstica proporcionada pela mamografia. Houve realce pelo contraste na maioria das lesões desta amostra (540/644 – 83,8%), sendo que dentre as 103 lesões sem realce, 89 eram benignas. Nestes casos, a ausência de realce permitiu o afastamento da suspeita de malignidade e abreviação do processo diagnóstico. Este notável projeto encorajou o avanço da aplicação da CEM no estudo radiológico das lesões mamárias (25).
Abordagens mais especificas têm procurado elucidar características mais sutis da CEM, como por exemplo, o trabalho de Rudnicki et al, também publicado em 2019, que demonstrou correlação significativa entre a intensidade de realce das lesões na CEM e a presença de malignidade. Examinando 195 lesões reveladas nestra amostra, propuseram que o nível de realce dos achados pode distinguir doenças invasivas de lesões benignas e intraductais (26).
Apropriando-se das robustas evidências científicas divulgadas na última década, é proposta na literatura a incorporação da CEM no processo de investigação radiológica das mamas, com definição precisa da técnica do exame, estabelecimento de padrões de interpretação e indicações clínicas. Dada sua maior sensibilidade sem perda de especificidade em relação à mamografia e performance comparável à da RM demonstrada em diversos trabalhos, algumas indicações clínicas vêem se solidificando como atuais paradigmas. Achados inconclusivos em outros métodos de imagem; avaliação de pacientes sintomáticas nas quais se incluem aquelas com massa palpável, dor localizada ou descarga papilar; mulheres com restrições à realização de RM; rastreio de mulheres de risco alto ou intermediário, albergando as mamas densas são algumas das situações de aplicação da CEM (27).
Pacientes com diagnóstico de câncer de mama frequentemente são referenciadas a realização de RM para avaliação de extensão local da doença e identificação de possíveis focos adicionais, permitindo o adequado planejamento terapêutico. Este foi um dos primeiros cenários de estudo da CEM, tendo sido observada adequada capacidade de mensuração de tumores, assim como evidenciação de tumores multifocais, multicêntricos e bilaterais, de modo a ser atualmente uma das aplicações desejáveis do método. Também por agregar estas capacidades, esta ferramenta diagnóstica é proposta para o monitoramento de resposta a quimioterapia neoadjuvante. O número de pacientes acompanhadas até os dias atuais nesta finalidade é relativamente pequeno, porém os resultados referidos mostram-se bastante promissores (28).
A consolidação da relevância da CEM como elemento da imagenologia mamária suscitou no ano vigente (2022) o lançamento de suplemento ao ACR-BI-RADS dedicado a CEM. Orienta-se a padronização dos laudos de CEM, que devem compreender os achados das imagens de baixa energia, equivalentes à mamografia, e aqueles das imagens recombinadas. Nestas últimas os descritores adotados assemelham-se aos utilizados nas interpretações das RMs das mamas, encerrando o conjunto um laudo com classificação e recomendação de conduta, característico dos exames que compoem o diagnóstico radiológico mamário (29). A disponibilidade do léxico é de fundamental importância para a formulação precisa e uniforme dos laudos de CEM, bem como o amplo entendimento e adequação de conduta frente aos resultados dos exames.
A incorporação de novos métodos traz consigo novos desafios e a observação de lesões na CEM não evidenciadas em outros métodos precipita a limitação da sua investigação histopatológica guiada por imagem, no caso de suspeição. Algumas lesões das mamas são visualizadas apenas nos métodos capazes de identificar modificações da angiogênese, nos quais se incluem a RM e a CEM. A biópsia guiada por RM não é um procedimento de larga disponibilidade, esbarrando em restrições devido ao seu alto custo e as questões individuais das pacientes, como claustrofobia, características antropométricas e presença de dispositivos metálicos no organismo. O andamento previsível, até mesmo considerando a facilidade de realização da CEM, foi o desenvolvimento de dispositivos para a implementação de biópsias guiadas por CEM.
Desde 2020 o U.S. Food and Grug Administration (FDA) aprovou a uso do equipamento de biópsia guiada por CEM produzido pela GE Healthcare (30). As primeiras casuísticas acerca desta ferramenta vêem sendo recentemente divulgadas, como no artigo de Alcantara et al publicado em 2022, que reuniu 64 pacientes com 66 lesões, obtendo sucesso na abordagem em 95,4% dos casos. O tempo médio de realização foi de 15 min, com 27% da amostra evoluindo com hematomas e 3,2% apresentando reações vaso-vagais. A biópsia orientada por CEM, neste universo, parece ser factível, com taxas de êxito e de complicações semelhantes às descritas nas amostras dedicadas à biópsia orientada pro RM (31).
5. MATERIAL E MÉTODOS
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal Fluminense sob o número 5.082.144.
Trata-se de um estudo para validação de método diagnóstico. Foram convidadas a participar da pesquisa mulheres encaminhadas ao CEPEM por seus médicos assistentes, para realização de biópsias percutâneas de lesões previamente descritas em mamografia e/ou ultrassonografia prévias. Aquelas que aceitaram participar assinaram Termo de Consentimento Livre e Esclarecido. Os critérios de exclusão foram comprometimento de função renal, alergia conhecida ao meio de contraste iodado ou compostos com iodo, gestação ou lactação, uso regular de metformina.
As participantes do estudo realizaram CEM e em seguida, na mesma data, foram submetidas às biópsias percutâneas das lesões previamente identificadas em exames de rastreio, conforme solicitação do seu médico assistente. O tipo de biópsia (core biópsia ou biópsia à vácuo) obedeceu ao referenciamento do médico assistente. O método de imagem que orientou a abordagem foi aquele que permitia a melhor visualização da(s) lesão(s), sendo o procedimento guiado por ultrassonografia o método preferencial; e por estereotaxia para as imagens com expressão apenas na mamografia. A prioridade pela realização da biópsia com orientação da ultrassonografia é conduta padronizada, uma vez que esta ferramenta prescinde de exposição à radiação ionizante, proporciona maior conforto à paciente que não permanece com a mama sob compressão e o recolhimento da amostra é observado em tempo real.
As CEMs foram analisadas e posteriormente confrontadas com o resultado histopatológico dos espécimes recolhidos nas biósias percutâneas, adotado como padrão ouro.
Para o estudo com CEM e mamografia digital foi utilizado o equipamento Senographe Essential (GE Healthcare Contraste Enhaanced Spectrum Mammography). Os exames foram realizados após a administração endovenosa de contraste iodado não iônico na dose de 1,5ml/kg (dose máxima de 150ml), através de bomba infusora em velocidade de 3ml/s, iniciando-se a aquisição das imagens 2 minutos após o início da sua administração. A janela para a finalização do exame foi de 8 minutos a partir de principiado o posicionamento no mamógrafo.
As biópsias percutâneas, guiadas por estereotaxia ou ultrassonografia, foram realizadas com os seguintes dispositivos:
• Core biópsia: pistola Magnum (Bard/BD®) com agulha de 14Gauge x 12 cm. • Biópsia a vácuo: Equipamentos Encor Enspire (Bard/BD®) com agulha 10 Gauge x 20cm ou ATEC (Hologic®) 9Gauge x 20cm.
Os equipamentos utilizados para orientação radiológica das biópsias foram: • Estereotaxia: Affirm Prone Breast Biopsy System (Hologic®).
• Ultrassonografia: Logic 7 ou Logic S8 (GE Healthcare®).
Foram observados os achados de mamografias, ultrassonografias e RMs previamente realizados pelas pacientes e disponibilizados na ocasião do atendimento. As lesões objeto de biópsia foram classificadas pelo sistema ACR – BI-RADS pelo médico responsável pelo atendimento e realização da biópsia da paciente no CEPEM.
Os exames foram realizados por 2 médicos especialistas em imagenologia mamária e com experiência superior a 15 anos em procedimentos percutâneos orientados por imagem das mamas, que analisaram individualmente os casos. Foram obedecidos critérios de classificação dos laudos bem como as rotinas de realização e avaliação de concordância dos achados de imagem e histopatológicos das amostras obtidas nas biópsias. Os laudos das CEMs contemplaram os exames completos, isto é, as imagens de baixa energia equivalentes a mamografia digital; e as imagens recombinadas, que correspondem ao estudo contrastado propriamente dito. Desta forma, os achados mamográficos foram classificados de acordo com o sistema ACR – BI-RADS nas imagens de baixa energia e a interpretação do estudo recombinado referiu a presença ou ausência de realce pelo contraste. Este estudo foi realizado antes da existência do suplemento do ACR – BI-RADS dedicado a CEM, de forma que ainda não havia padronização quanto aos achados e descritores, hoje já disponíveis para a confecção dos laudos. A figura 2 sintetiza o desenho do estudo.
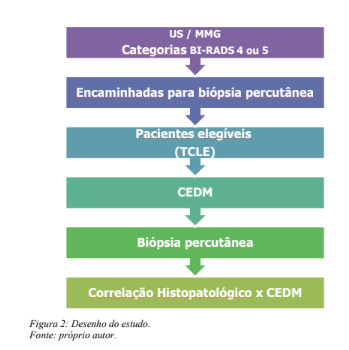
Posteriormente as conclusões dos estudos histopatológicos dos espécimes de biópsias foram correlacionadas com os achados das CEM. Esta correlação inclui a observação da compatibilidade dos achados de imagem e histopatológicos, com recomendação de conduta apropriada à patologia diagnosticada.
6. RESULTADOS
Foram incluídas no estudo 198 pacientes com 208 lesões, com idade de 22 a 86 anos (média 51 anos). Vinte e uma pacientes possuiam história familiar positiva para câncer de mama em um parente de primeiro grau (10,1%); oito tinham mais de um parente, incluindo de primeiro grau (3,9%) e 14 apresentavam história familiar positiva, porém não em parentes de primeiro grau (6,8%). Houve um total de 43 participantes com história familiar positiva para câncer de mama, correspondendo a 20,8% da amostra. Apenas uma paciente tinha história pessoal de câncer de mama (0,5%) e 52 pacientes (25%) não sabiam informar precisamente a história familiar no tocante a casos de câncer de mama.
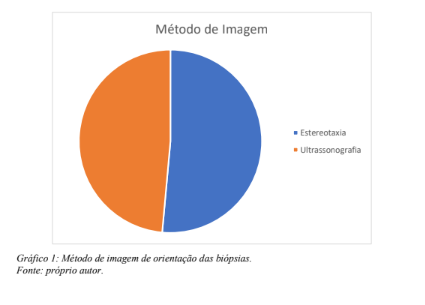
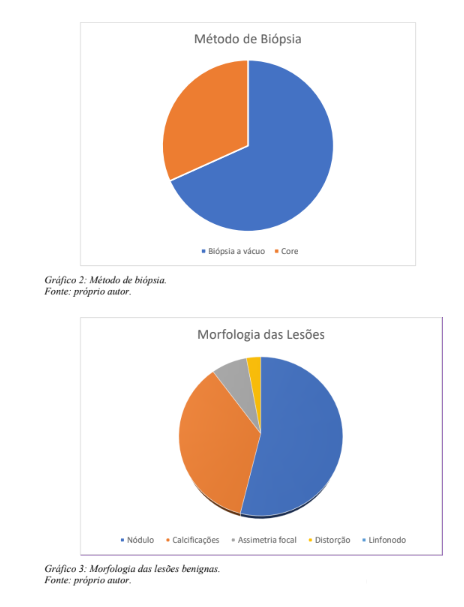
Em 107 casos (51,4%) as biópsias foram orientadas por estereotaxia e em 101 (48,6%) por ultrassonografia (gráfico 1), sendo 142 biópsias à vácuo (68,3%) e 66 core biópsias (31,7%) (gráfico 2). A morfologia das lesões abordadas compreendeu 112 nódulos (53,8%); 74 calcificações (35,6%); 15 assimetrias focais (7,2%);seis distorções arquiteturais (2,9%) e um linfonodo (0,5%). A distribuição quanto a morfologia das imagens alvo de biópsia encontra-se representada no gráfico 3.
As imagens alvos de biópsia foram reclassificadas de acordo com o léxico ACR–BI-RADS, apresentando a seguinte distribuição:
- BI-RADS 2 = 2 (1,0%)
- BI-RADS 3 = 25 (12,0%)
- BI-RADS 4 = 169 (81,2%)
- BI-RADS 5 = 12 (5,8%)
Para fins de interpretação de resultados, consideramos as categoria ACR – BI- RADS obtidas na reclassificação das imagens pela equipe médica de pesquisadores.
Trinta e uma participantes (14,9%) realizaram RM das mamas anteriormente à sua participação neste estudo, dentre as quais oito (3,8%) foram exames negativos e 23 (11,0%) destacavam achados suspeitos (categoria 4 ou 5) na RM.
Neste conjunto de 208 lesões abordadas com biópsias percutâneas orientadas por imagem, não tivemos acesso a um resultado histopatológico (0,5%), compondo portanto um conjunto de 207 resultados dos procedimentos percutâneos aferidos (99,5%). Cento e cinquenta e seis (75,4%) dos achados histopatológicos foram benignos e 51 (24,6%) dos espécimes revelaram tumores malignos (Gráfico 4). Trinta e quatro (16,4%) lesões benignas demonstraram realce pelo contraste (Gráfico 5), dentre as quais sete (3,4%) fibroadenomas, quatro (1,9%) lesões papilíferas e papilomas, quatro (1,9%) hiperplasias ductais atípicas e três (1,4%) carcinomas lobulares in situ. Os demais 16 (7,7%) achados benignos com realce abrigaram alterações fibrocísticas, adenose, hiperplasia pseudoangiomatosa estromal, hiperplasias ductais sem atipias (Gráfico 6).
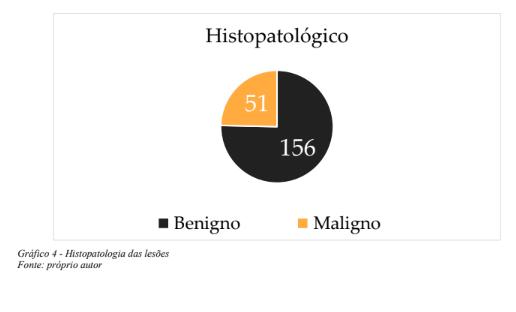
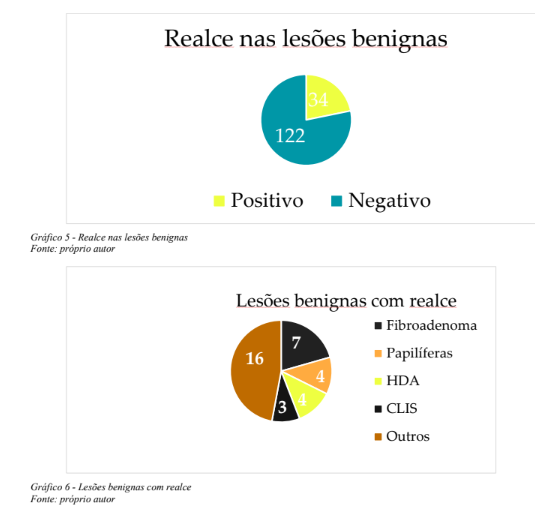
Dentre as lesões benignas porém consideradas de potencial indeterminado para malignidade(classificação histopatológica B3) que não apresentaram realce estiveram duas (0,1%) hiperplasias ductais atípicas, uma hiperplasia ductal atípica com hiperplasia lobular atípica (0,5%), uma hiperplasia lobular atípica (0,5%) e um papiloma (0,5%). As 51 (24,6%) lesões malignas diagnosticadas neste estudo dividiram-se em 35 (16,9%) tumores invasivos e 16 (7,7%) carcinomas ductais in situ (CDIS). Quarenta e três dentre estas 51 (20,8%), demonstraram realce anômalo na CEM e oito (3,8%) não realçaram, notando-se que apenas um dos 35 cânceres invasivos não apresentou realce pelo contraste na CEM, tratando-se de lesão em localização fora do campo mamográfico,evidenciada na ultrassonografia e RM (Gráfico 7). Os sete achados malignos restantes que não se manifestaram com realce relevante na CEM, compreendiam casos CDIS representados por calcificações suspeitas na mamografia. Depreende-se então que 84% (43 de 51) dos tumores malignos demonstraram realce significativo na CEM e, no estudo combinado mamografia e CEM, 98% destes cânceres foram detectados, sendo omitido exclusivamente o tumor em sítio fora da topografia alcançada pela mamografia (Gráfico 8).
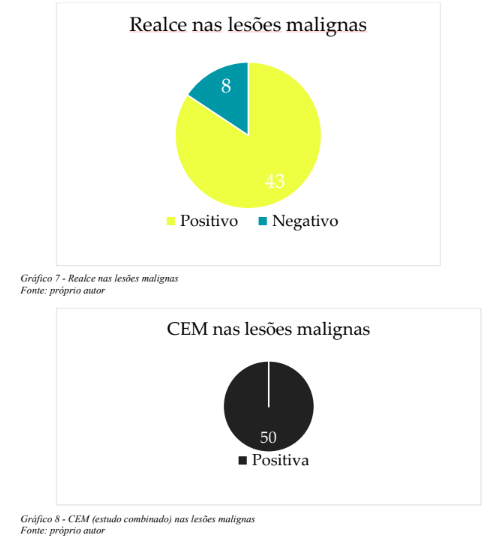
Estes números resultam em sensibilidade de 84,3%, especificidade de 78,2%, valor preditivo positivo de 55,8%, e valor preditivo negativo de 93,8% para o realce na CEM. Entretanto, como a ferramenta diagnóstica contempla o estudo mamográfico habitual associado ao estudo contrastado, considerando as lesões detectadas no estudo combinado, aferimos sensibilidade de 98%, especificidade de 78%, valor preditivo positivo de 59%, valor preditivo negativo de 99%. Estes resultados estão expressos nas tabelas 1 e 2.
Tabela 1: Correlação entre achados histopatológicos e realce na CEM.
Fonte: próprio autor.
Resultados Realce + Realce – Total Maligno 43
(20,8%)8 (*)
(3,8%)51
(24,6%)Benigno 34
(16,4%)122
(59,0%)156
(75,4%)Total 77
(37,2%)130
(62,8%)207
(*) 8 lesões sem realce, sendo um tumor invasivo fora do campo mamográfico e 7 CDIS manifestados por calcificações suspeitas nas imagens de baixa energia.
Tabela 2: Correlação entre achados histopatológicos e estudo combinado (CEM). Fonte: próprio autor.
Resultados CEM + CEM- Total Maligno 50
(24,1%)1
(0,5%)51
(24,6%)Benigno 34
(16,4%)122
(59,0%)156
(75,4%)Total 77
(37,2%)130
(62,8%)207
Acompanhando a evolução imediata das 198 mulheres participantes deste estudo, foram identificadas duas (1%) reações leves e imediatas ao contraste iodado, uma delas apresentando reação urticariforme, necessitando medicação anti-alérgica, com pronto controle clínico e a outra auto-limitada. Não houve reação alérgica grave ou retorno posterior das participantes com queixas relativas à administração do meio de contraste.
7. DISCUSSÃO
A CEM é uma técnica combinada, que agrega a informação morfológica fornecida pela mamografia, com a avaliação funcional das mamas, identificando tecidos com neoangiogênese, através do uso de meio de contraste. Esta ferramenta vem sendo elucidada, propondo-se a representar uma alternativa à RM, com performance diagnóstica semelhante a este exame, contudo reduzindo custos, melhorando a adesão das pacientes e facilitando a interpretação dos achados de imagem. Na causística aqui apresentada,observamos elevada sensibilidade da CEM na detecção de neoplasia maligna das mamas, comparável a sensibilidade da RM considerada na literatura (32, 33). Cinquenta e um dos 50 tumores malignos (98%) descritos nos fragmentos coletados em biópsias percutâneas foram visualizados no exame combinado (mamografia e estudo contrastado), exceto um tumor localizado fora do campo mamográfico. Na esfera de 35 tumores malignos invasivos, todas as lesões localizadas em topografias alcançadas pela mamografia foram identificadas na CEM e caracterizadas como achados suspeitos, inclusive tumores obscurecidos pelo parênquima mamário denso na mamografia. Um estudo recente encontrou sensibilidade da mamografia de 79,9%, variando largamente de acordo com a composição tecidual das mamas. Foram descritas sensibilidades de 100% em mamas lipossubstituídas, 83,9% naquelas com densidades fibroglandulares esparsas, 72,9% nas heterogeneamente densas e 50% nas extremamente densas (34). Podemos considerar que, na amostra abrigada neste estudo, a densidade radiológica das mamas não impactou a detecção dos tumores malignos aparentemente pelo uso da técnica contrastada, que minimiza a reconhecida limitação da mamografia no diagnóstico de lesões em mamas densas. Assim como ocorre na RM, a CEM não parece sofrer interferência da característica tecidual das mamas, mantendo sua capacidade diagnóstica mesmo quando aplicada em mamas densas.
Também em função desta qualidade da CEM, a hipótese de futuras restrições das indicações de ultrassonografia mamária no rastreio suplementar do câncer de mama pode ser imaginada. A ultrassonografia das mamas tem como fundamental papel no cenário da radiologia mamária a avaliação de mamas densas, pela possibilidade de visualização de lesões obscurecidas na mamografia pelo parênquima mamário denso. Uma vez constatando-se que a CEM é capaz de transpor essa dificuldade inerente ao estudo mamográfico, o acréscimo da ultrassonografia ao processo diagnóstico pode ser futuramente reconsiderado, abreviando o tempo e os custos despendidos para o diagnóstico das neoplasias da mamas.
É relevante salientar que os demais sete tumores que não apresentaram realce anômalo pelo contraste se manifestaram como calcificações suspeitas no exame mamográfico e portanto deve-se considerar a sua suspeição, mantendo-se a orientação de prosseguimento da sua investigação apesar da ausência de realce. Esta consideração se respalda nas diferenças de sensibilidades encontradas, sendo de 84,3% para a análise do realce e 98% para a CEM como estudo combinado, também expressas pelos valores preditivos negativos, de 93,8% e 99% respectivamente.
O espectro de alterações representadas por calcificações na mamografia é abrangente, compondo um conjunto desafiador na prática clínica. A probabilidade de doença maligna varia de acordo com a morfologia e distribuição das calcificações, sendo descrita como 7% para as grosseiramente heterogêneas, 11% para as puntiformes, 20-26% para as amorfas, 25-41% para as pleomórficas finas e maior que 80% para as lineares /ramificadas (35, 36).
A importância da RM na avaliação de calcificações não parece ser robusta. Bazzocchi et al, em estudo multicêntrico, revelaram sensibilidade de 87%, especificidade de 68%, valor preditivo positivo de 84%, valor presiditivo negativo de 71% e acurácia de 80%, procurando estabelecer se o estudo contrastado poderia auxiliar na distinção entre calcificações suspeitas benignas e malignas (37). Existe ainda certa dificuldade de correlação de realces na RM com as calcificações vistas na mamografia, por tratarem-se de métodos que posicionam as mamas de formas diferentes para a obtenção das imagens, limitando o estabelecimento de relações topográficas entre os achados dos respectivos métodos.
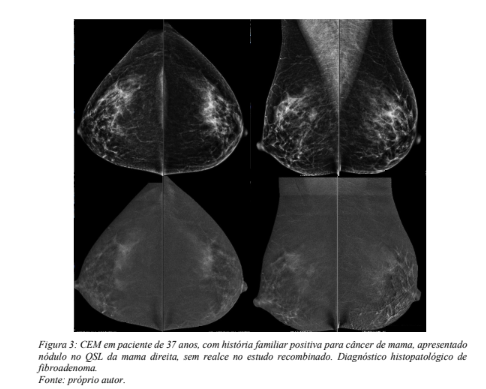
A presença de calcificações suspeitas na mamografia, independente de estarem ou não associadas a realce anômalo, deve suscitar o seu estudo histopatológico, de acordo com os dados provenientes de nosso trabalho. Esta evidência vai ao encontro de outras experiências documentadas neste sentido, chanceladas pela orientação do suplemento do ACR – BI-RADS. Yun-Chung Cheung et al admitem que a presença de realce em calcificações não associadas a massa é mais frequente em lesões malignas que em atipias e lesões benignas. Porém, em 10,1% de sua amostra de 59 sítios de calcificações houve realce em calcificações benignas, ao passo que dois CDIS não realçaram. Consideram assim que o comportamento destas lesões, quando expostas ao meio de contraste, pode contribuir para a sua caracterização e mensuração (20). Entendemos, pelos dados disponíveis na literatura e pela amostra aqui explorada, que a CEM não é capaz de afastar a possibilidade de doença maligna representada por calcificações suspeitas em casos de ausência de realce. A morfologia e distribuição de características suspeitas das calcificações nas imagens de baixa energia devem prevalecer sobre a ausência de realce significativo e o achado deve ser abordado com estudo histopatológico. Os achados histopatológicos benignos compuseram a maior parte dos espécimes analisados nesta população, na qual 156 dos 207 resultados obtidos representavam fragmentos de lesões benignas e/ ou de potencial maligno incerto. Dentre estas 156 lesões, 130 (83% destas) foram classificadas como suspeitas (BI-RADS categoria 4 ou 5) nos métodos de imagem guia para a biópsia percutânea, sendo este a mamografia ou ultrassonografia, sendo as demais 26 (17%) categorizadas como de aspecto benigno nos estudos de imagem. Entretanto, 122 ou 78% das amostras benignas, não apresentaram realce na CEM. Percebe-se então que a maioria das lesões benignas, ainda que em grande parte apresentassem características de suspeição na mamografia e/ou ultrassonografia, não reforçaram a hipótese de malignidade quando estudadas com o meio de contraste. Nenhuma lesão representada por nódulo, assimetria focal ou distorção arquitetural sem realce correspondia a tumor maligno, estando os casos de lesões malignas sem realce restritos aos casos acima referidos de calcificações como manifestação de CDIS. Este panorama está representado pelo elevado valor preditivo negativo da CEM nesta população. É razoável supormos que, com a ampliação deste conhecimento através de novos e maiores estudos, nódulos de baixa suspeição vistos na mamografia e/ou ultrassonografia poderão ter a indicação de investigação histopatológica reduzida uma vez comprovada a ausência de realce na CEM. A figura 3 exemplifica esta situação.
Trinta e quatro alvos de biópsias negativas (22% das 156) tiveram CEM com realce presente, incluindo-se aí quatro lesões papilíferas, quatro hiperplasias ductais atípicas e três carcinomas lobulares in situ. Dentre as biópsias com resultados apontando fibroadenomas, 15 (10% das lesões benignas) foram imagens sem realce, ao passo que sete (4% das amostras negativas) demonstraram realce na CEM. A apresentação variável das lesões benignas e a possibilidade de impregnarem-se de forma diferenciada por meio de contraste é bem estudada na RM (38) e, fazendo uma correlação com as manifestações na CEM, é perceptível uma similaridade no comportamento variável destes achados. O valor preditivo positivo verificado de 59% e a especificidade 78% refletem esta heterogeneidade de lesões que podem apresentar características suspeitas nos métodos de imagem e não se confirmarem como doença maligna. Todavia, acreditamos que o progressivo desenvolvimento da CEM, com estabelecimento de parâmetros e classificação das imagens aliados a curva de aprendizagem dos profissionais envolvidos na realização e interpretação do exame, potencialmente irão incrementar a capacidade diagnóstica deste instrumento. Cabe ressaltar que, ao longo da realização deste estudo, ainda não havia disponível o suplemento em CEM do ACR BI-RADS, que certamente em muito contribuirá daqui por diante para a normatização e esclarecimentos acerca da CEM.
8. CONCLUSÕES
Neste estudo, que busca estabelecer a validade da CEM na detecção de neoplasias malignas das mamas, este teste diagnóstico demonstrou elevada sensibilidade, superior ao método de rastreio populacional desta doença e semelhante à RM. Considerando tratar se de um instrumento de menor custo de implementação assim como de valor individual dos exames, de larga aceitação por parte das pacientes em virtude de pouco diferir da experiência de realização da mamografia, de agregar a avaliação morfológica e funcional das mamas através de imagens de rápida interpretação, a CEM deve progressivamente alcançar relevante papel no diagnóstico por imagem do câncer de mama, à medida que novos e maiores estudos reforcem sua importância na prática clínica.
REFERÊNCIAS BIBLIOGRÁFICAS
1. INCA Instituto Nacional do Câncer. INCA lança estimativa de casos de câncer para o triênio 2020 – 2022. Disponível em <www.gov.br/inca> Acesso em 20 de jun, 2022.
2. Sociedade Brasileira de Mastologia – O que você precisa saber sobre câncer de mama. Disponível em < sbmastologia.com.br> Acesso em 20 de jun, 2022.
3. KALAF JM. Uma história de sucesso e de entusiasmo científico. Radiol Bras 2014, jul/ago: 7-8.
4. KOCH H. Mamografia como método para diagnosticar o câncer mama. Radiol Bras 2016, nov/dez: 7.
5. JOCHELSON MS. Advanced imaging techniques for the detection of breast cancer. Am Soc Clin Oncol Educ Book 2012; 65-9.
6. PISANO ED. Diagnostic accuracyof digital vesus film mammography: exploratory analysis of selected population subgroups in DMIST. Radiology 2008; 246(2): 376-383.
7. EVANS DG. MRI screening in women with a personal history of breast cancer. J Nat Cancer Inst. 2016; 108: 2-3.
8. FALLENBERG EM. Contrast-enhanced spectral mammography vs. Mammography and MRI – clinical performance in a multi-reader evaluation. European Society of Radiology 2017; 27: 2752-2764.
9. CONVINGTON FM. The Future of Contrast-Enhanced Mammography. American Journal of Radiology 2018; 210: 292-300.
10. DROMAIN C. Angiomammography: A review of current evidences. Elsevier 2019; 100: 593-605.
11. CASTILLO-LOPEZ JP. Optimization of acquisition parameters for the detection of secondary breast lesions applying temporal contrast enhanced digital mammography. Krupinski EA, ed. 14th International Workshop os Breast Imaging (IWBI 2018). Vol 10718.
12. SENSAKOVIC WF. Contrast-enhanced mammography: how does it work? RadioGraphics 2021; 41: 829-839.
13. JAMES JR. Breast radiation dose witn CESM compared with 2D FFDM and 3D tomosynthesis mammography. American Journal of Radiology 2017. 208: 362-372.
14. BARRA FR. Novos métodos funcionais na avaliação de lesões mamárias. Radiol Bras. 2012 Nov/Dez; 45(6): 340-344.
15. LEWIN JM. Dual-energy contrast-enhanced digital subtraction mammography: feasibility. Radiology 2003; 229(1): 261-268.
16. JOCHELSON MS. Bilateral Contrast-enhanced Dual-Energy Digital Mammography: Feasibility and Comparison with Conventional Digital Mammography and MR Imaging in Women with Known Breast Carcinoma. Radiology 2013; 266: 743-751.
17. LOBBES MBI. Contrast-enhanced spectral mammography in patients referred from the breast cancer screening programme. European Society of Radiology 2014; 24: 1668- 1676.
18. LOBBES MBI. The Quality of Tumor Size Assessment by Contrast-Enhanced Spectral Mammography and the Benefit of Aditional Breast MRI. Journal of Cancer 2015; 6:144-150.
19. BENT CK. The positive predictive value of BI-RADS microcalcifications descriptors and final assessment categories. AJR Am J Roentgenol 194: 1378-1383.
20. CHEUNG YC. Clinical utility of dual-energy contraste-enhanced spectral mammography for breast microcalcifications without associate mass: a preliminary analysis. European Society of Radiology 2016; 26: 1082-1089.
21. TAGLIAFICO AS. Diagnostic performance of contrast-enhanced spectral mammography: Systematic review and meta-analysis. Elsevier, The Breast 28 2016; 13- 19.
22. LEE-FELKER SA. Newly diagnosed breast cancer: Comparison of Contrast enhanced spectral mammography and breast MR imaging in teh evaluation os extent of disease. Radiology 2017; 285- 2: 389-400.
23. SORIN V. Contrast-enhanced spectral mammography in women with intermediate breast cancer risk and dense breasts. American Journal of Radiology 2018. 211: 267-274.
24. XING D. Diagnostic Value of Contrast-Enhanced Spectral Mammography in Comparison to Magnetic Resonance Imaging in Breast Lesions. J Comput Assist Tomogr 2019; 43: 245- 251.
25. TRAVIESO-AJA. Diagnostic performance os contrast-enhanced dual-energy spectral mammography (CESM): a retrospective study involving 644 breast lesions. La radiologia medica 2019; 124: 1006-1017.
26. RUDNICKI W. Correlation between quantitative assessment of contrast enhancement in contrast-enhanced spectral mammography (CESM) and histopathology – preliminary results. European Radiology 2019; 29: 6220-6226.
27. GHADERI KF. Contrast-enhanced mammography: Current applications and future directions. RadioGraphics 2019; 39: 1907-1920.
28. JOCHELSON SJ. Contrast-enhanced mammography: State of the art. Radiology 202; 299: 36-48.
29. PHILIPS J, Contrast enhanced mammography (CEM) – A supplement to ACR BI RADS® mammography 2013. American College of Radiology 2022. 1-64.
30. GE Healthcare. GE Healthcare receives FDA Clearance od Industry´s First Contrast Enhanced Mammography Solution for Biopsy. Disponível em < www.ge.com/news/press-release/ge-healthcare-receives-fda-clearance-industry-first contrast-enhanced-mammography. > Publicado em 9jun, 2020. Acesso jun, 2022.
31. ALCANTARA R. Contrast-enhanced mammography-guided biopsy: Technical feasibility and first outcomes. European Radiology. Jul, 2022.
32. KUHL CK. Dynamic bilateral contrast-enhanced MR imaging of the breast: Trade off between spacial end temporal resolution. Radiology 2005. 236(3): 789-800.
33. SAADATMAND S. MRI versus mammography for breast cancer screening in women with familial risk (FaMRIsc): a multicentric randomised, controlled trial. Lancet Oncol 2019; 20(8): 1136-1147.
34. WEIGEL S. Digital mammography screening: sensitivity of the programme dependent on breast density. European Radiology 2017; 27 (7): 2744-2751.
35. BURNSIDE ES. Use of microcalcifications descriptors in BI-RADS 4th edition to stratify risk of malignancy. Radiology 242: 388-395.
36. BENT CK. The positive predictive value of BI-RADS microcalcifications descriptors and final assessment categories. American Journal of Radiology 194: 1378-1383.
37. BAZZOCCHI M. Contrast-enhanced breast MRI in pacients with suspicious microcalcificactions on mammography: results of a multicenter trial. American Journal of Radiology AmJ Roentgenol 2006. 186: 1723-1732.
38. BRANDÃO A. Ressonância magnética da mama: Lesões benignas. Rio de Janeiro: Revinter, 2010.
