PROPIONIBACTERIUM AGNES LIPOPOLYSACCHARIDE AND E. COLI HEXOSAMINE AS IMMUNOTHERAPY ADJUNCT TO VINCRISTINE TREATMENT IN A CASE OF EXTRAGENITAL CANINE TRANSMISSIBLE VENEREAL TUMOR
REGISTRO DOI: 10.5281/zenodo.10138475
Juliana Jurado Jimenez1
Carlos M. González Zambrano2
Fernando Carmona Dinau3
Francisco J. Pedraza Ordoñes4
Luis M. Montoya Florez5
Noeme Sousa Rocha6
RESUMO
Anamnese: Canino macho castrado com massa na face em região de arco zigomático que surgiu após lesão avulsiva causada por outro cão. Achados citológicos e clínicos: A citologia da massa correspondia a um tumor venéreo transmissível do tipo plasmocitóide, T:3/N:0/M:0 de apresentação extragenital. Além disso, canino apresentava doença hemoparasitária por Ehrlichia spp. Relação neutrófilo-linfócito (NLN): 9,47. Exames complementares: Estudo citopatológico, histopatológico e imuno-histoquímico para interleucina seis (IL-6) e TGFB-1 anteriormente ao tratamento; acompanhamento hematológico e avaliação da relação neutrófilo-linfócito semanalmente. Abordagem terapêutica: O paciente recebeu 10 mg/kg/24h de doxiciclina por 21 dias e imunomodulação com hexosamina de E. coli e Propinebacterium granulosum. Posteriormente, foi administrado semanalmente 0,7 mg/mt2 de Vincristina. Resultados: Após o controle da hemoparasitose e início da terapia oncológica combinada, a neoplasia teve resposta completa na terceira semana de tratamento. Relação neutrófilo-linfócito (NLN) ao final do tratamento: 0,17 Conclusões: A combinação da terapia oncológica com a imunomodulação neste caso pareceu diminuir o tempo de resposta ao tratamento. A utilização de terapias combinadas ou direcionadas é uma tendência atual, muito comum na oncologia humana, que vem abrindo portas para o estudo de mecanismos que possam ser alvos terapêuticos na espécie canina, bem como para o estudo de biomarcadores prognósticos como a proporção neutrófilo-linfócitos para avaliação da resposta à terapia.
Palavras-chave: Canino, imunoterapia, quimioterapia, transmissível, tumor, venéreo.
SUMMARY
Anamnesis: A castrated male canine with a neoplasia on the face in the region of the zygomatic arch that appeared following an avulsive wound caused by another canine. Diagnostic aids: Cytopathological study for initial diagnosis, histopathology, and immunohistochemistry for interleukin six (IL6) and transforming growth factor beta (TGFB-1) on the day of chemotherapy initiation; weekly hematological monitoring and assessment of the neutrophil-lymphocyte ratio. Cytological and clinical findings: The cytology of the mass corresponded to a plasmacytoid-type transmissible venereal tumor, T:3/N:0/M:0, with extragenital presentation, concomitant with Ehrlichia spp hemoparasitic disease, neutrophil-lymphocyte ratio (NLR): 9.47. Treatment approach: The patient receives 10 mg/kg/24h of doxycycline for 21 days and immunomodulation with E. coli hexosamine and Propionibacterium granulosum for 40 days. Following the use of doxycycline, weekly treatment with 0.7 mg/m^2 of Vincristine for three weeks is initiated. Results: IL6: >65%, TGFB-1: <30%. After treating the hemoparasite, the neoplasia achieved a complete response (CR) by the third week of Vincristine treatment. Neutrophil-lymphocyte ratio (NLR) at the end of treatment: 0.17. Conclusions: The combination of oncological therapy with immunomodulation in this case appears to reduce the treatment response time. The use of combined or targeted therapies is a current trend, very common in human oncology, opening the door to the study of mechanisms that may be therapeutic targets in the canine species, as well as the study of prognostic biomarkers such as NLR for the evaluation of therapy response.
Keywords: Canine, immunotherapy, chemotherapy, transmissible, venereal tumor.
INTRODUÇÃO
O tumor venéreo transmissível canino (TVTC) pode acometer qualquer cão imunocompetente. Sendo possível o tumor apresentar regressão espontânea induzida pelo próprio sistema imune do hospedeiro, enquanto em animais imunocomprometidos a progressão pode atingir tamanhos e estágios clínicos mais avançados.
O TVTC está presente em várias regiões do mundo, principalmente nas regiões tropicais e subtropicais. A transmissão ocorre por alotransplante de células neoplásicas viáveis de um indivíduo para outro; localizando-se normalmente nos órgãos reprodutivos, porém pode ocorrer em outras regiões do corpo como pele, mucosas e olhos de cães imunocomprometidos (1, 2).
O TVTC geralmente apresenta uma fase de regressão após o crescimento progressivo (fase P). Durante a progressão, os tumores secretam uma alta concentração de TGF-β, que suprime a expressão de moléculas do MHC classe I e II no parênquima tumoral, levando a uma maior capacidade de evasão imune pelas células tumorais (3, 4, 5).
O TVTC evoluiu, ao lado de suas espécies hospedeiras, por mais de 10.000 anos e parece ter alcançado um ponto de equilíbrio evolutivo em seu microambiente (no hospedeiro) e macroambiente (entre os hospedeiros). Este tumor evidencia sinais de evolução gradual, caracterizado por alterações fenotípicas rápidas e menores. Além disso, apresenta também alterações genotípicas (6, 7, 8).
O TGF-B1 é um polipeptídio multifuncional que regula vários processos celulares, incluindo crescimento, apoptose, motilidade, diferenciação e adesão, principalmente nas células B (LB), células T (LT), células T regulatórias (Treg) e natural killer (NK). (9,10,11). Por outro lado, a citocina pró-inflamatória IL-6 tem a capacidade de neutralizar a supressão imunológica.
Estudos recentes mostram que o TGF-B1 apresenta maior expressão na fase de progressão, enquanto a IL-6 é mais expressa na fase de regressão (12, 13).
Em um estudo epidemiológico realizado no Brasil por Pimentel et al., constatou-se a frequência de manifestações genitais e extragenitais do TVTC, nos quais: 1) 86% de frequência: manifestação genital; 2) 21,8% de frequência: manifestação cutânea; 3) 7,5% de frequência: manifestações nasais; 4) 4,2% de frequência: manifestação oral; 5) Frequência inferior a 4%: manifestações anal/perianal, oculares e linfonodais (14, 15).
A origem das células tumorais do TVTC ainda não foi determinada, embora vários autores sugerem que sua origem seja mieloide. Contudo, somente está claro que elas não pertencem a células mutantes caninas, pois possuem 78 pares de cromossomos e as células do TVTC contêm entre 57 e 64 pares de cromossomos (16, 17,18).
As características moleculares e genéticas, somadas ao comportamento biológico do TVTC, o levaram a ser considerado um dos mais completos modelos de estudo dos mecanismos de carcinogênese e metástase, como também é usado em modelos de pesquisa para a produção de vacinas contra neoplasias do tipo linfoma de células B, já que são células capazes de inibir a diferenciação de linfócitos.
A relação neutrófilo-linfócito (NLR) tem sido utilizada para avaliação de parâmetros como resposta patológica completa (PCR), tempo de cuidados intensivos e resposta a quimioterapias neoadjuvantes. Sendo que, proporções mais altas dessa relação são sugestivas de doenças mais agressivas e respostas imunes deficientes (19, 20, 21). As demais proporções avaliadas não possuem dados científicos que comprovem sua utilidade, já que, há pouca literatura e poucos estudos populacionais tanto na medicina humana quanto na medicina veterinária em relação a esse tema.
Além disso, a relação neutrófilo-linfócito tem sido utilizada como fator prognóstico em vários tipos de doenças crônicas, como pancreatite e sepse; e atualmente, na avaliação da resposta à quimioterapia (22, 23)
A literatura não possui relatos de casos ou estudos científicos suficientes para justificar a utilidade da avaliação da relação neutrófilo-linfócito (NLR) como ferramenta para avaliação da quimioterapia neoadjuvante. Contudo, há pesquisas como o estudo transversal retrospectivo publicado por Peralta et al., em 2020, que avaliando NLR em 342 mulheres com câncer de mama, encontrou uma relação estatisticamente significativa entre baixo NLR (<2,1) e maior sobrevida livre da doença (24).
O uso da imunomodulação combinada com a terapia clássica do câncer é uma tendência na oncologia moderna, e vem demonstrando melhores respostas relacionadas ao aumento da qualidade de vida e maior sobrevida livre de doenças.
DESCRIÇÃO DO CASO
Paciente canino, macho, 6 anos, 17,8 kg, 0,68mt2 de área de superfície corporal (BSA), condição corporal 6/9, sem raça definida (SRD). Paciente apresentava lesões cutâneas faciais, sob a pálpebra esquerda, após mordida decorrente de um confronto com outro canino, a ferida foi tratada como ferida suja-contaminada a qual não respondeu ao tratamento e simultaneamente apresentou neoformação que não correspondia a tecido reparador ou cicatrizante. Sendo assim, o animal foi encaminhado para a clínica veterinária Vetca, onde foi realizada avaliação citopatológica e coleta de sangue para hemograma, encontrando-se no exame citopatológico uma população de células neoplásicas características do TVTC do tipo plasmocitoide.
Antes de iniciar a terapia oncológica, o paciente recebeu imunoterapia com composto comercial à base de Propinebacterium acnes e lipopolissacarídeo de E. coli. Foi então realizada antibioticoterapia, antes da primeira sessão de Vincristina, com Doxiciclina 10mg/kg/VO por 21 (vinte e um) dias para controle da Erliquiose diagnosticada pelo teste sanguíneo. Posteriormente, foi feito tratamento semanal com Vincristina 0,7mg/mt2, juntamente com acompanhamento clínico, hematológico e cálculo da relação neutrófilo-linfócito (NLR) para avaliação da resposta à terapia.
O paciente apresentou remissão clínica da doença após 3 semanas de terapia oncológica neoadjuvante, que consistiu na administração diária do biológico imunomodulador na dose sugerida pelo fabricante e administração intravenosa em infusão de Vincristina. A terapia com doxiciclina teve duração total de 21 (vinte e um) dias. Sendo que os primeiros 4 dias de terapia oncológica foi feito simultaneamente com o tratamento para a hemoparasitose.
Tabela 1. Parâmetros clínicos no momento da consulta
TEMPERATURA 38,7 GRAUS CELCIUS FREQUÊNCIA CARDÍACA 71/MIN FREQUÊNCIA RESPIRATÓRIA 40/MIN PESO 16,8 KG CONDIÇÃO CORPORAL 6/9 DIETA MISTA REGIÃO RURAL PRESSÃO ARTERIAL SISTÓLICA 143 PRESSÃO ARTERIAL DIASTÓLICA 103 PRESSÃO MÉDIA 122
Tabela 2 . Histórico clínico do caso
Data Descrição Tempo em dias. 4 de outubro de 2022 1ª consulta. Início da imunoterapia e do uso da Doxiciclina. 0 21 de outubro de 2022 Início da quimioterapia. Hematologia e clínica normais. Esfregaço sanguíneo sem evidência de hemoparasitas. 17 25 de outubro de 2022 Fim do tratamento com doxiciclina. 21 29 de outubro de 2022 2a sessão de Vincristina. 25 5 de outubro de 2022 3ª sessão de Vincristina. Macroscopicamente não se observa tecido tumoral, realiza-se imprinting e raspagem. Avaliação citológica mostra poucas células TVTC. 32 12 de novembro de 2022 4ª sessão de quimioterapia. Nesta data, o paciente não apresentava alterações macroscópicas nem microscópicas. 39
AVALIAÇÃO E EVOLUÇÃO CLÍNICA E HEMATOLÓGICA.
As constantes fisiológicas analisadas do paciente foram: temperatura (°C), pressão arterial (mmhg), frequência cardíaca (bpm), peso (kg) e exames de sangue completos: Hemograma completo, esfregaço para pesquisa de parasitas no sangue, Teste de Woo, ALT, ALP, BUN, Creatinina, Glicose e Proteínas Totais. Analisador bioquímico Vetscan VS2, analisador hematológico Vetscan HM5, análise de hemoparasitas e confirmação da contagem manual de plaquetas em microscópio óptico com objetiva de 40x e 100x.
Fórmulas usadas para cálculo manual dos índices:
- NLR: neutrófilos/linfócitos.
- LMR: linfócitos/monócitos.
- PLR: plaquetas/linfócitos.
AVALIAÇÃO CITOPATOLÓGICA
Foi realizada punção aspirativa com agulha fina e swab para avaliação citopatológica pela coloração de Wright. Realizou-se também a classificação citomorfológica e avaliação dos critérios citopatológicos de malignidade.
AVALIAÇÃO HISTOPATOLÓGICA
A biópsia foi realizada 21 dias após o início da imunoterapia e anteriormente ao início do protocolo quimioterápico. O material coletado foi fixado por 30 horas em formalina tamponada e posteriormente preservada em álcool 70%. Realizou-se o processo de desidratação e posterior formação de um bloco de parafina que foi transportado em um recipiente protegido da luz, umidade e de altas temperaturas.
A confecção da lâmina histológica, corada com Hematoxilina e Eosina, foi feita no Laboratório de Patologia da Faculdade de Medicina Veterinária e Zootecnia da Universidade de Caldas.
AVALIAÇÃO DA EXPRESSÃO IMUNOHISTOQUÍMICA
O protocolo de imuno-histoquímica foi realizado no Laboratório de Patologia Investigativa Comparada da Faculdade de Medicina Veterinária e Zootecnia da UNESP, Botucatu, com o interesse de avaliar a fase tumoral no momento de inicio da quimioterapia.
Para marcação do fator transformador de crescimento beta 1 (TGFB-1) na diluição 1:400 e interleucina 6 (IL-6). na diluição 1:300, com anticorpos testados em tecido da espécie em estudo (canino) da marca Dako agilient anti-rato. A avaliação imuno-histoquímica foi feita de forma semi quantitativa, sendo os parâmetros analisados: qualidade do corte, intensidade da coloração, distribuição do antígeno, fundo e contagem da expressão imuno-histoquímica. Sendo que a contagem das células marcadas foi realizada em 4 campos de 40x em um total de 100 células por campo no microscópio óptico Carl Zeiss, Lab A1, Alemanha, usando software AxioVision 4.8 e avaliados por dois observadores, os dados foram apresentados com a média das observações.
RESULTADOS E DISCUSSÃO.
AVALIAÇÃO DA RESPOSTA AO TRATAMENTO
A relação neutrófilo-linfócito mostrou-se abaixo do ponto de corte (<2,1) estabelecido por Peralta et al. em tumores mamários. No caso em questão, essa relação demonstrou diminuição significativa conforme o avanço da terapia. Podendo essa diminuição estar relacionada ao efeito do imunomodulador biológico que contém lipopolisacarídeo (LPS) de E.coli, que ativa macrófagos, induz uma resposta proliferativa de linfócitos B e tem a capacidade de diferenciação em células plasmáticas (25).
Tabela 3 . Relações calculadas manualmente
4-oct 21-oct 29-oct 12-nov NLR 9,47 4,01 4,74 0,17 LMR 1,30 2,03 8,83 3,44 PLR 25 191,8 334 372,09
O LPS de >E. coli pode atuar por uma via inespecífica e específica, como ativador de macrófagos e produtor de citocinas (26). O outro componente biológico fornecido ao paciente foi o Propionibacterium granulosum, que tem a capacidade de induzir a imunidade celular, estimulando a produção de citocinas ainda não estabelecidas.
Em um estudo publicado em 2022 por Tang et al, foi demonstrado que um alto NLR em quimioterapias adjuvantes para carcinoma ductal pancreático teve menor RCP e menor tempo de sobrevida dos pacientes (19).
Um estudo publicado em 2021 realizado entre a Universidade Estadual Paulista de Botucatu e a Universidade de Maputo, em Moçambique, apesar de ter sido utilizado no estudo um número amostral reduzido. Este estudo mostrou que a imunomodulação inespecífica realizada com sangue autólogo pode estar relacionada a uma notável melhora na resposta e diminuição do tempo de terapia (27).
As razões LMR e PLR não são totalmente descritas na literatura, mas a utilidade delas é inferida com base em mecanismos imunológicos. O LMR apresentou aumento significativo e progressivo no início da terapia, o que pode sugerir uma resposta ao efeito do imunoestimulante. Por outro lado, apesar do PLR apresentar aumento, deve-se levar em consideração que o paciente recebeu tratamento para um hemoparasita previamente diagnosticado, levantando mais questionamentos, já que o referido aumento pode ser tanto devido a resposta à terapia imunológica quanto pelo controle do referido hemoparasita.
HEMATOLOGIA E BIOQUÍMICA SANGUÍNEA
Tabela 4 . Desvios Hematológicos
PROVA UNIDADES 4-oct 21-oct 29-oct 12-nov ALP U/L 30 93 97 72 ALT U/L 32 24 31 33 BUN mg/dl 6 5 4 6 CREATININA mg/dl 0,8 0,5 0,3 0,9 GLICOSE mg/dl 85 104 97 92 PROTEÍNA TOTAL g/dl 9 10,3 9,7 9,5 HEMATÓCRITO % 41,21 41,84 49,3 50,85 HEMOGLOBINA g/dl 10,3 9,7 10,9 11,2 VCM fl 70 71 71 70 HCM pg 17,5 16,3 15,5 15,5 CHCM g/dl 25,1 23,1 22 22 ERITRÓCITOS 10^12/l 5,92 5,92 6,99 7,21 LEUCÓCITOS 10^9/l 6,83 4,45 3,34 4,44 NEUTRÓFILOS 10^9/l 5,68 2,93 2,51 0,15 LINFÓCITOS 10^9/l 0,6 0,73 0,53 0,86 MONÓCITOS 10^9/l 0,46 0,36 0,06 0,25 EOSINÓFILOS 10^9/l 0,08 0,38 0,2 0,13 BASÓFILOS 10^9/l 0 0,05 0,04 0,04 NEUTRÓFILO HIPOSEGMENTADO 10^9/l 0 0 0 0 PLAQUETAS 15 140 177 320 VPM fl 7,5 8,5 8,2 9,5 PCT % 0,01 0,12 0,15 0,3
Estudos que avaliaram variações na bioquímica sanguínea mostraram que após 14 e 21 dias de terapia, os níveis de creatinina e uréia não apresentaram variações. No caso em questão, o paciente não apresentou variações significativas nos testes de função renal. O único biomarcador alterado de envolvimento renal relatado na literatura é o SMDA, que não foi analisado. Por outro lado, a literatura descreve variações nos níveis de ALP devido ao tratamento com Vincristina. (28, 29, 30)
As variações das linhagens de células sanguíneas foram avaliadas pelas razões NLR, MRL e PLR.
AVALIAÇÃO CITOPATOLÓGICA, HISTOPATOLÓGICA E INMUNOFENOTIPAGEM
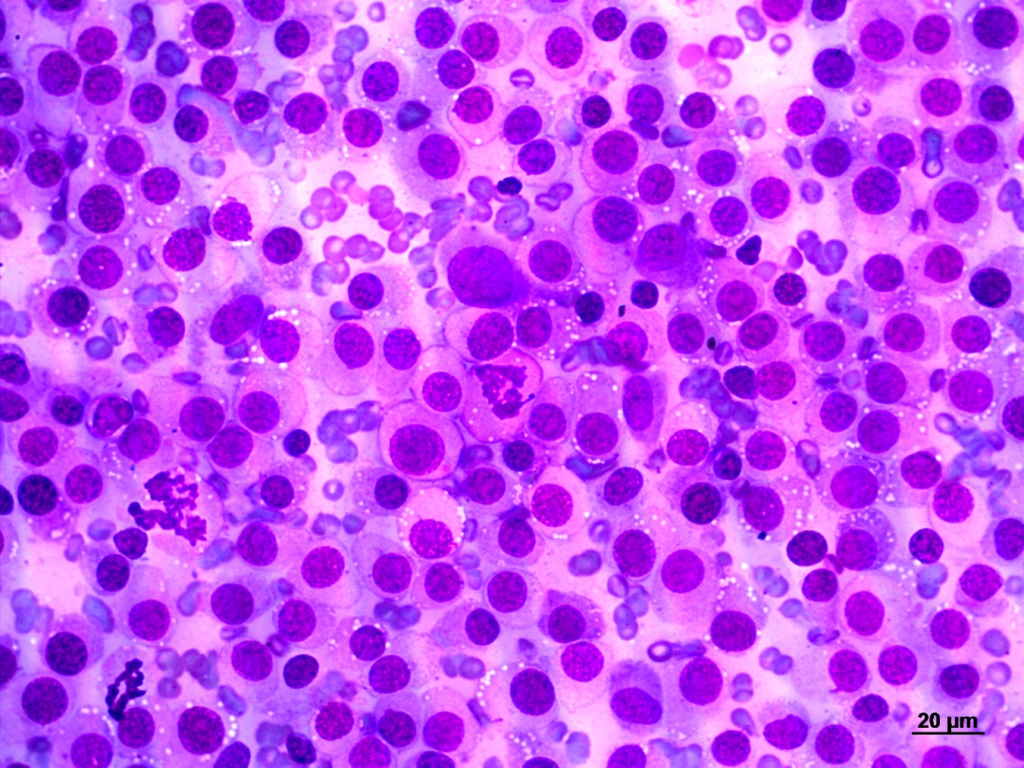
Observou-se abundante material celular, ao fundo alguns eritrócitos e neutrófilos, estes últimos apresentando sinais de picnose e cariorexe. Observaram-se poucas plaquetas e uma população de células neoplásicas redondas compatíveis com TVTC. Foi evidenciado um padrão predominantemente do tipo linfocitoide (>60%) apresentando alterações morfológicas como: anisocitose, anisocariose, pleomorfismo, Nucleos riniformes, cromatina predominantemente granular (>60%), figuras mitóticas moderadas (>2 x 400x campo), binucleações, pseudo-inclusões nucleares e algumas células em giro (campo 0-2 x 40x) e células em fuso (campo 0-2 x 40x). (Figura 01)
Figura 01 – Microscopia do TVTC 40x
A histopatologia e inmunofenotipagem indicou uma neoplasia na fase regressiva no momento da biopsia incisional, levando em conta que a amostragem do tecido foi realizada posteriormente ao tratamento da inmunoterapia inespecífica poderia indicar que essa terapia e uma opção de terapia integral previa a quimioterapia diminuendo o tempo de terapia com Vincristina (Figura 2, 3, 4)
Figura 02 – Corte histológico TVTC. Neoplasia disposta na derme, estroma fibroso em permeio. Obj 40X. Coloração H&E Nucléolos evidentes, anisocariose, pleomorfismo nuclear e figuras de mitose.
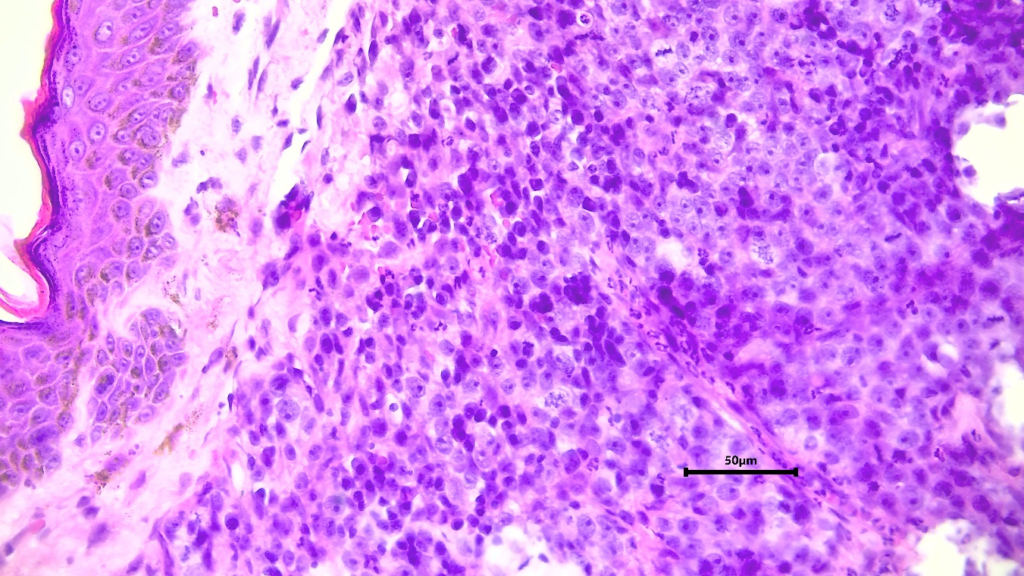
Figura 03. Células neoplásicas com intensa imunorreatividade citoplasmática para IL-6
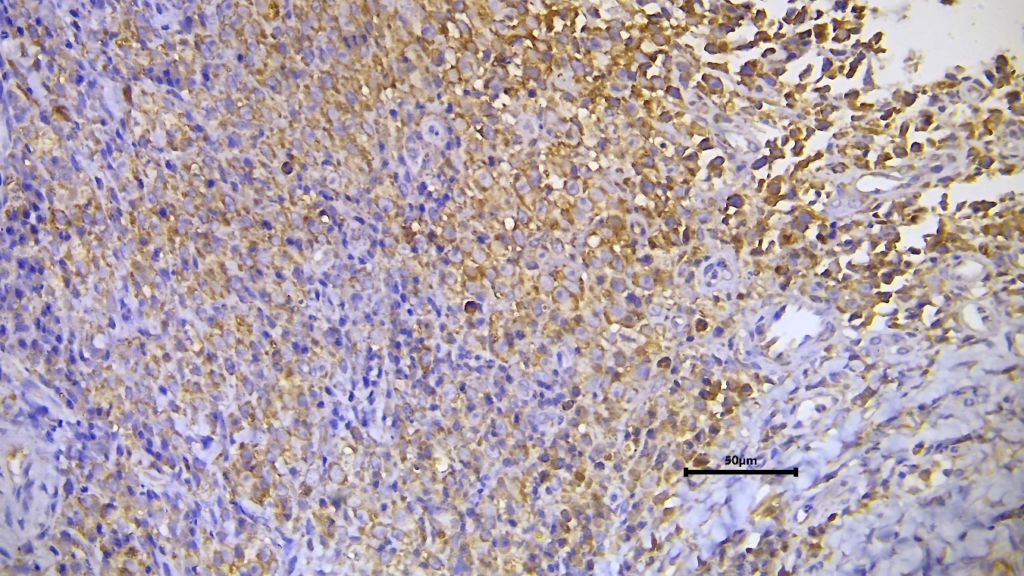
Figura 04. Menor imunorreatividade citoplasmática para TGF-B.
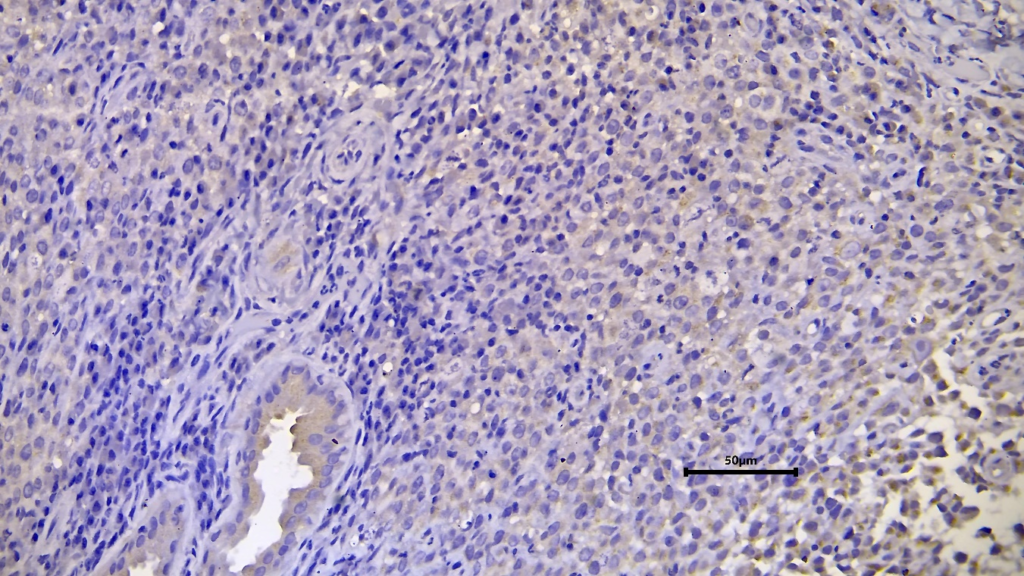
A expressão dessas citocinas está de acordo com o descrito na literatura e sua relação com a fase tumoral. No entanto, cabe questionar por que, enquanto as células tumorais apresentam imunorreatividade, as células do sistema imunológico não o fazem ao nível do microambiente tumoral. Outra limitação é que não existem registros publicados de concordância entre os níveis séricos dessas moléculas ou sua expressão. nas células, células imunes circulantes.
Conclusões
O menor tempo de resposta à terapêutica neste doente face ao relatado e aceite na literatura atualmente publicada, juntamente com a aparente indução de regressão obtida com imunoterapia prévia, sustentam a necessidade de estudos que avaliem este tipo de tratamentos.
Em relação à NLR, ela possui a mesma tendência apresentada em todos os estudos publicados na literatura atual, realizados tanto em doenças crônicas quanto em neoplasias, nos quais o seu aumento tende a ser relacionado com a piora do quadro geral do paciente. Sendo assim, este parâmetro tem como vantagem ser uma análise barata e rápida de fácil acesso ao clínico geral.
Vale ressaltar que NLR, MLR e PLR podem ser bons indicadores da resposta imune, contudo estudos mais aprofundados são necessários para estabelecer pontos de corte ou valores de referência para tais parâmetros.
Estudos que avaliem a interação de citocinas tumorais e citocinas sistêmicas são necessários para melhorar a compreensão da interação tumor-hospedeiro. Um único relato de caso não é suficiente para mecanismos tão complexos, e está claro que a TVTC e seu comportamento biológico estão intimamente ligados ao estado imunológico e individual do hospedeiro e do seu ambiente.
REFERENCIAS
1. DAS, U., A. K. Das. Review of canine transmissible venereal sarcoma. Vet. Res. Commun. 2000; 24, 545-556. DOI: 10.1023/A:1006491918910.
2. BAEZ-ORTEGA, A., et al. Somatic evolution and global expansion of an ancient transmissible cancer lineage. Science. 2019; 365(6452): eaau9923. doi: 10.1126/science.aau9923.
3. LIU, C.C., et al. Transient downregulation of monocyte-derived dendritic-cell differentiation, function, and survival during tumoral progression and regression in an in vivo canine model of transmissible venereal tumor. Cancer Immunol Immunother. 2008; 57(4): 479–91.
4. HSIAO, Y.W., et al. Interactions of host IL-6 and IFN-gamma and cancer-derived TGF-beta1 on MHC molecule expression during tumor spontaneous regression. Cancer Immunol Immunother. 2008; 57(7): 1091-1104. doi: 10.1007/s00262-007-0446-5.
5. ARCILA-VILLA, A., et al. Distribution and prevalence of transmissible venereal tumor in the Colombian canine population. Revista Colombiana De Ciencias Pecuarias, 31(3), 180–187. https://doi.org/10.17533/udea.rccp.v31n3a02.
6. JVARI B., et al. Transmissible cancers in an evolutionary context. Inside the cell. 2016; 1, 17-25. DOI: 10.1002/icl3.1020.
7. MURCHISON, E.P., et al. Transmissible dog cancer genome reveals the origin and history of an ancient cell lineage [published correction appears in Science. 2014 Feb 14;343(6172):730]. Science. 2014; 343(6169): 437-440. doi: 10.1126/science.1247167.
8. GRANDI, F., et al. Immunophenotypic and molecular profile of cancer stem-cell markers in ex vivo canine transmissible venereal tumor (CTVT). Veterinary Medicine and Science, 8, 2297–2306. https://doi.org/10.1002/vms3.828.
9. GORELIK, L., R.A. Flavell. Immune-mediated eradication of tumors through the blockade of transforming growth factor-β signaling in T cells. Nature Med. 2001; 7, 1118-1122. DOI: 10.1038/nm1001-1118.
10. RICH, J., A. Borton, X. Wang. Transforming growth factor-beta signaling in cancer. Microsc. Res. Tech. 2001; 52, 363-373.
11. PRINCIPE, D.R., et al. TGFβ Signaling in the Pancreatic Tumor Microenvironment Promotes Fibrosis and Immune Evasion to Facilitate Tumorigenesis. Cancer research, 76(9), 2525–2539. https://doi.org/10.1158/0008-5472.CAN-15-1293.
12. TIWARI, K., et al. Immune-mediated gene expression of IL-6 and TGF-β1 during progression and regression of canine transmissible venereal tumor. Veterinarski arhiv, 2021; 91 (6), 624-634. https://doi.org/10.24099/vet.arhiv.1092.
13. CHOU, P.C., et al. Effects of immunotherapy of IL-6 and IL-15 plasmids on transmissible venereal tumor in beagles. Vet Immunol Immunopathol. 2009; 130(1-2): 25-34. doi: 10.1016/j.vetimm.2009.01.002.
14. PIMENTEL, P.A.B., et al. Epidemiological study of canine transmissible venereal tumor (CTVT) in Brazil, 2000-2020. Prev Vet Med. 2021; 197: 105526. doi: 10.1016/j.prevetmed.2021.105526.
15. COSTA, T.S., et al. Epidemiological, clinical, and therapeutic aspects of canine transmissible venereal tumor in Rio de Janeiro, Brazil (2015-2020). Pesquisa Veterinária Brasileira, 43, e07189. https://doi.org/10.1590/1678-5150-PVB-7189.
16. RAMÍREZ, R.R., et al. Transmissible venereal tumor with metastasis to a spleen hemangioma in a bitch. Vet Mex. 2010; 41(4): 305-310.
17. BENDAS, A.J.R., et al. Tumor venéreo transmisible intraabdominal en un perro: reporte de un caso. Revista Brasileña de Medicina Veterinaria, 44, e001422. https://doi.org/10.29374/2527-2179.bjvm001422.
18. STRAKOVA, A., et al. Mitochondrial genetic diversity, selection and recombination in a canine transmissible cancer. eLife, 5, e14552. https://doi.org/10.7554/eLife.14552.
19. TANG, H., et al. Significance of the neutrophil-to-lymphocyte ratio in predicting the response to neoadjuvant chemotherapy in extremity osteosarcoma: a multicentre retrospective study. BMC cancer, 22(1), 33. https://doi.org/10.1186/s12885-021-09130-7.
20 MALLARDO, D., et al. CD39 and LDHA affects the prognostic role of NLR in metastatic melanoma patients treated with immunotherapy. J Transl Med 21, 610 (2023). https://doi.org/10.1186/s12967-023-04419-6.
21. JIANG, Y., & MA, W. (2017). Assessment of Neutrophil-to-Lymphocyte Ratio and Platelet-to-Lymphocyte Ratio in Atopic Dermatitis Patients. Medical science monitor: international medical journal of experimental and clinical research, 23, 1340–1346. https://doi.org/10.12659/msm.900212.
22. ZHU, H.F., et al. Combination of alpha-fetoprotein and neutrophil-to-lymphocyte ratio to predict treatment response and survival outcomes of patients with unresectable hepatocellular carcinoma treated with immune checkpoint inhibitors. BMC Cancer 23, 547 (2023). https://doi.org/10.1186/s12885-023-11003-0.
23. DUAN, X., et al. Prognostic value of preoperative hematological markers in patients with glioblastoma multiforme and construction of random survival forest model. BMC Cancer 23, 432 (2023). https://doi.org/10.1186/s12885-023-10889-0.
24. PERALTA-CASTILLO, Guillermo & MAFFUZ-AZIZ, Antonio & SIERRA, Mariana & RODRÍGUEZ-CUEVAS, Sergio. (2020). Neutrophil-lymphocyte index as prognostic factor for OVERALL survival and disease-free SURVIVAL in breast cancer patients. 10.1016/j.senol.2020.06.004.
25. ZHU, P., et al. Propionibacterium acnes envuelto con hidróxidos dobles en capas de ZnAl inhibe sinérgicamente el crecimiento tumoral y la metástasis. Adv. Función. Madre. 2023, 33, 2214105. https://doi.org/10.1002/adfm.202214105.
26. MARTÍNEZ MANRIQUE, Clara Esther. (2006). Modulación de la respuesta inmune: tendencias actuales. Revista Cubana de Investigaciones Biomédicas, 25(4). Recuperado en 03 de enero de 2023, de http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S086403002006000400009&lng=es&tlng=es.
27. CHISSICO JÚNIOR, F., et al. Combination of Autohemotherapy and Vincristine Sulfate in Treatment of Canine Transmissible Venereal Tumor in Bitches in Mozambique. Acta Scientiae Veterinariae, 49. https://doi.org/10.22456/1679-9216.111725.
28. SOUZA, J.V. de A., et al. Vincristine sulfate treatment influence on kidney function of female dogs with transmissible venereal tumor. Brazilian Journal of Veterinary Research and Animal Science, 59, e192646. https://doi.org/10.11606/issn.1678-4456.bjvras.2022.192646.
29. GANGULY, B., DAS, U., & DAS, A. K. (2016). Canine transmissible venereal tumour: a review. Veterinary and comparative oncology, 14(1), 1–12. https://doi.org/10.1111/vco.12060.
30. STRAKOVA, A., et al. Mitochondrial genetic diversity, selection and recombination in a canine transmissible cancer. eLife, 5, e14552. https://doi.org/10.7554/eLife.14552.
1, 2, 6 Laboratório de Patologia Investigativa y comparada, Universidade Estadual Paulista (UNESP), Faculdade de Medicina, Departamento de Patologia, Botocatu, Brasil.
3 Grupo de estúdio em Patologia Veterinária, Universidade Estadual Paulista (UNESP), Facultade de Medicina veterinária y zootecnia (FMVZ), Departamento de Patologia, Botocatu, Brasil.
4Laboratorio de Patologia Veterinária, Universidade de Caldas, Colômbia. Facultade de Medicina Veterinária y Zootecnia, Departamento de Patologia.
5Laboratorio de Patologia Veterinária, Universidade Nacional de Colômbia, sede Bogotá DC. Facultade de Medicina Veterinária y Zootecnia.
E-mail:1Juliana.j.jimenez@unesp.br, 2carlos.gonzalez-zambrano@unesp.br, 3fc.dinau@unesp.br, 4fpedraza@ucaldas.edu.co, 5maomontoya53@yahoo.es, 6noeme.rocha@unesp.br
