REGISTRO DOI: 10.69849/revistaft/th102410141037
André Valdivino De Moraes Souza¹
Maria Eduarda Silvestre Barbosa¹
Tárcio Peixoto Roca¹
RESUMO: A dengue é uma das arboviroses mais comum que atinge o ser humano, uma doença viral, aguda e sistêmica, com casos confirmados em todo território brasileiro. A distribuição geográfica dessa doença é desigual, influenciada por fatores sociais, econômicos e ambientais, como o rápido crescimento demográfico, urbanização desordenada e saneamento precário. O presente Trabalho de Conclusão de Curso (TCC) expõe um levantamento de dados sobre dengue durante a época da pandemia de COVID-19, de forma quantitativa, buscando entender quais as alterações visíveis e suas justificativas, com base em boletins epidemiológicos disponibilizados pela Agência de Vigilância Sanitária (AGEVISA), guiando-se por artigos, revistas científicas, juntamente com conteúdos de instituições como OMS, OPAS, Ministério da Saúde e GOV. Observou-se, com relação aos casos de dengue, que de 2021 para 2022 houve um aumento de 460% dos casos notificados e 611% dos casos confirmados. Por fim, esta pesquisa conta com uma discussão sobre a quantidade de insumos disponibilizados para o controle da dengue que aumentou significativamente em 2022, e a coinfecção entre dengue e COVID-19 que trouxe desafios significativos para o período de estudo. Além disso, as medidas de contenção da COVID-19, como lockdowns e restrições de mobilidade, tiveram efeitos ambíguos sobre as taxas de dengue, variando entre a redução dos casos em áreas urbanas e o aumento em locais com saneamento precário. A falta de investimentos em infraestrutura de saúde e a ausência de campanhas de conscientização eficazes durante a pandemia contribuíram para a subnotificação de casos de dengue e complicaram o controle de vetores.
Palavras-Chaves: Dengue; COVID-19, Coinfecção; Rondônia, Arbovirose;
ABSTRACT: Dengue is one of the most common arboviruses affecting humans, a viral, acute, and systemic disease, with confirmed cases across the entire Brazilian territory. The geographical distribution of this disease is uneven, influenced by social, economic, and environmental factors, such as rapid population growth, unplanned urbanization, and poor sanitation. This Final Course Project presents a quantitative data survey on dengue during the COVID-19 pandemic, aiming to understand the visible changes and their justifications, based on epidemiological bulletins provided by the Health Surveillance Agency (AGEVISA), guided by articles, scientific journals, and content from institutions like WHO, PAHO, the Ministry of Health, and GOV. It was observed that, regarding dengue cases, from 2021 to 2022 there was a 460% increase in reported cases and a 611% increase in confirmed cases. Finally, this research includes a discussion on the amount of supplies made available for dengue control, which increased significantly in 2022, and the co-infection between dengue and COVID-19, which posed significant challenges during the study period. Additionally, COVID-19 containment measures, such as lockdowns and mobility restrictions, had ambiguous effects on dengue rates, ranging from a reduction in cases in urban areas to an increase in places with poor sanitation. The lack of investment in health infrastructure and the absence of effective awareness campaigns during the pandemic contributed to the underreporting of dengue cases and complicated vector control efforts.
Keywords: Dengue; COVID-19; Co-infection; Rondônia; Arbovirus.
INTRODUÇÃO
A palavra arbovírus é uma denominação usada para os vírus que precisam de artrópodes hematófagos para completar seu ciclo de vida. Formada pela primeira sílaba das duas palavras “arthropode-borne” somada com a palavra “vírus”, os arbovírus fazem parte de um grupo heterogêneo quando diz respeito a suas propriedades físico-químicas, possuindo, assim, algumas características epidemiológicas em comum. (GUBLER, 1988)
A dengue é uma das arboviroses mais comum que atinge o ser humano, uma doença viral, aguda e sistêmica, com casos confirmados em todos os 26 Estados da Federação Brasileira e no Distrito Federal, no país registrando, aproximadamente, 70% das notificações mundiais. (LUCENA et al., 2011).
A Organização Mundial da Saúde (OMS) afirma que o Brasil é o país com maior número de notificações de dengue em 2024. São 6,3 milhões de casos prováveis, sendo mais de 3 milhões confirmados laboratorialmente. A Argentina vem na sequência com 420 mil casos prováveis, Paraguai, com 257 mil e Peru, 200 mil.
É causada pelos vírus da família Flaviviridae e inclui quatro sorotipos principais: DEN-1, DEN-2, DEN-3 e DEN-4. Estes agentes são responsáveis pela doença através de seus principais vetores, os mosquitos do gênero Aedes, principalmente o Aedes aegypti e o Aedes albopictus. (NEPOMUCENO, 2013)
O paciente acometido pela doença desenvolve imunidade ao subtipo viral, ou seja, o tipo sorológico ao qual foi exposto não será acometido novamente. Contudo, a reinfecção por outro subtipo viral pode levar a uma maior chance da forma hemorrágica da doença. (PAULA et al., 2023)
A mesma, pode classificar-se em três formas diferentes: Dengue clássica ou febre da dengue (FD), febre hemorrágica da dengue (FHD) com ou sem a síndrome do choque da dengue (SCD) e dengue com complicações (DCC). Os fatores que levam para a ocorrência da doença dependem boa parte das características da biologia viral, do hospedeiro e do vetor. Após a infecção, existe um período de incubação, que varia entre 3 a 14 dias. (LUCENA et al., 2011)
O diagnóstico é feito de forma clínica e laboratorial (sorologia). A dengue clássica possui duração entre 5 a 7 dias e conta com sintomas como: hipertermia, cefaleia, artralgia, astenia, mialgia, prurido cutâneo, prostração, anorexia, dor retro orbital, náuseas, exantema, hepatomegalia e insuficiência circulatória. (PAULA et al., 2023)
Como uma doença endêmica ou pandêmica reemergente, a dengue está presente em quase todas as regiões tropicais e subtropicais do mundo. Os países nessas regiões são mais vulneráveis devido a vários fatores, como mudanças globais, alterações climáticas, uso da terra, armazenamento de água e irrigação, crescimento populacional e urbanização. Esses fatores contribuem significativamente para a proliferação do Aedes aegypti, vetor do vírus da dengue. (VIANA; IGNOTTI, 2013)
A transmissão da dengue acontece por meio da picada da fêmea do mosquito, que está infectado pelo vírus. Após a picada, os sintomas geralmente aparecem entre cinco e seis dias. O diagnóstico precoce da dengue é difícil, exigindo uma análise completa dos sintomas e, posteriormente, confirmação laboratorial (SILVA et al., 2003).
De acordo com o sistema de informação de agravos de notificação, SINAN, na região das Américas, a dengue tem se disseminado com surtos cíclicos que ocorrem a cada três a cinco anos. No Brasil, entretanto, a transmissão vem ocorrendo de forma contínua desde 1986, intercalando-se com epidemias, geralmente por conta da introdução de novos sorotipos em áreas que eram indenes ou alteração do sorotipo já existente. O maior surto no Brasil ocorreu em 2013 com quase 2 milhões de casos notificados e atualmente no país, circulam todos os sorotipos da doença.
Com a dengue, infelizmente, sendo uma doença comum no Brasil, a coinfecção com outras enfermidade como Zika e Chikungunya (que possuem o mesmo vetor), entre outras situações podem ocorrer, dificultando um diagnóstico preciso. Pacientes imunocomprometidos, por exemplo, como aqueles com HIV, podem ter um risco aumentado de infecções por diversos patógenos, incluindo o vírus da dengue (PETERSEN et al., 2016) . Coinfecções em pacientes HIV positivos podem resultar em manifestações clínicas mais graves e desafios no manejo clínico devido à necessidade de considerar interações medicamentosas e o estado imunológico do paciente (WILDER-SMITH et al., 2004) .
Citando a OMS, a covid-19, causada pelo coronavírus (SARS-CoV-2), contabilizou suas primeiras vítimas no Brasil em fevereiro de 2020 e foi caracterizada como pandemia em março do mesmo ano. A partir desse momento, a implantação de medidas de enfrentamento à pandemia e o isolamento social foram importantes para a contenção do vírus. Período esse, selecionado para a avaliação dos dados deste levantamento.
Em um hospital público do Distrito Federal, por exemplo, 63% dos pacientes internados testaram positivo para covid-19. Dentre esses, 38,4% estavam coinfectados com o vírus da dengue e 44,6% possuíam anticorpos indicativos de infecção anterior por dengue. As semelhanças nos sintomas entre ambas as doenças como febre, dor muscular e náusea, podem dificultar o diagnóstico clínico. Estudos indicam que a tosse é confirmada em 25% dos pacientes com dengue, enquanto 25% dos pacientes com covid-19 podem apresentar febre e dores musculares sem sintomas respiratórios. (PAULA et al., 2023)
OBJETIVO GERAL
Avaliar os casos de dengue no Estado de Rondônia, com auxílio de órgãos de saúde estaduais e municipais, principalmente da AGEVISA, durante o período pandêmico, de 2020 a 2023.
OBJETIVOS ESPECÍFICOS
- Determinar se houve um aumento ou diminuição dos casos, comparando com os anos adjacentes do período selecionado.
- Identificar possíveis fatores que justifiquem as alterações como urbanização, negligência domiciliar e ações de controle.
- Discutir sobre os investimentos disponibilizados para a distribuição de insumos, através do LIRAa.
- Avaliar possíveis mudanças nos padrões de transmissão e notificação da dengue em função das medidas de controle da pandemia de COVID-19, como lockdowns, distanciamento social e restrições à mobilidade.
METODOLOGIA
A pesquisa, através da metodologia quantitativa com finalidade expositiva, foi realizada entre Março de 2024 até Junho do mesmo ano, no estado de Rondônia, terceiro estado mais populoso da região norte de acordo com o censo de 2022 do IBGE (Instituto Brasileiro de Geografia e Estatística). O levantamento dos dados foi feito com os boletins epidemiológicos disponibilizados virtualmente pela AGEVISA e a base de dados do site “DATASUS” sobre o período de 2020 até 2023, e seus anos adjacentes. As informações dispostas nessas duas plataformas são elaboradas com os dados epidemiológicos do sistema de informação de agravos de notificações (SINAN) que é alimentado periodicamente pelas equipes municipais e monitorados diariamente. Para análise dos dados foi utilizado estatísticas descritivas e quantitativas, que foram processadas e revisadas com a ajuda do software Microsoft Excel. As informações a respeito do tema foram retiradas de artigos e revistas científicas(os) disponibilizadas(os) pelo Google Academy, e com auxílio das seguintes plataformas: SciElo, site da Prefeitura de porto velho, GOV; Da ferramenta do sistema de saúde LIRAa (Levantamento Rápido do Índice para Aedes aegypti), e instituições como OMS, OPAS e IBGE. Para embasamento teórico, foi selecionado conteúdos de caráter informativo especificamente sobre dengue, e suas características epidemiológicas, simultaneamente com assuntos relacionados como os citados no objetivo específico.
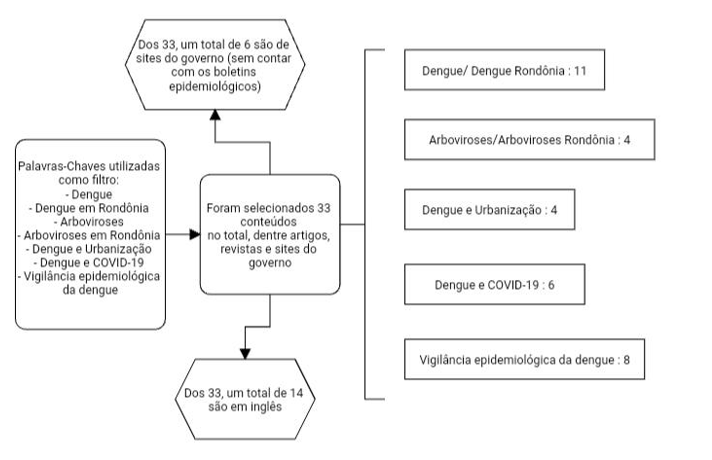
Fluxograma 1. Palavras-Chaves e filtro de pesquisa.
RESULTADOS E DISCUSSÃO
Tabela 1. Casos de dengue retirados dos boletins epidemiológicos da AGEVISA, com os dados de 2024 limitados até a semana 20.
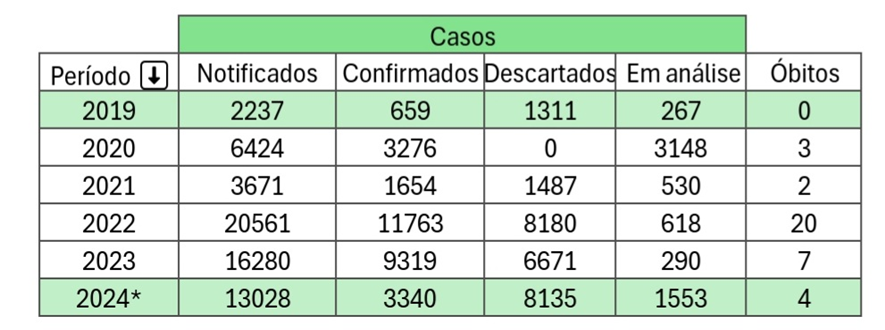
Fonte: Boletins epidemiológicos da AGEVISA, 2024.
Diante da Tabela 1 e das informações supracitadas, é nítido que em 2022 os valores de todos os tópicos subiram em relação ao ano de 2021 (460% em casos notificados e 611% em casos confirmados). Quatro hipóteses podem justificar esses dados: 1) Durante o Covid19 as pessoas deram menos atenção para o saneamento básico e para as outras doenças, criando assim, acidentalmente possíveis criadouros em seus quintais 2) O retorno da vida ativa, sem restrições de mobilidade, refletiu na exposição pelos vetores em locais públicos devido à alta circulação novamente de pessoas 3) Diante de um problema global generalizado, houve pouco investimento do governo para os cuidados contra a dengue: pesquisas, campanhas, insumos, entre outros; 4) Por fim, notou-se uma subnotificação dos casos de dengue entre os dois anos pandêmicos (2020-2021), por similaridade dos sintomas e seus diagnósticos confusos, ligados também com todo o foco e preocupação que havia em relação exclusiva ao SARS-CoV-2.
- URBANIZAÇÃO E INVESTIMENTOS
Segundo Sousa (2007), o primeiro surto de dengue em Rondônia ocorreu em junho de 1998, envolvendo o sorotipo DEN-1. A distribuição geográfica da dengue é desigual, influenciada por fatores sociais, econômicos e ambientais, como o rápido crescimento demográfico, urbanização desordenada, saneamento precário, aumento na produção de resíduos não orgânicos, e variações nos níveis de renda e escolaridade (MENDONÇA et al., 2009). Portanto, as características socioambientais específicas de cada município devem ser consideradas para entender o comportamento da epidemia (RESENDES et al., 2010).
Conforme Lucena e colaboradores (2011), entre 1999 e 2010, houve um aumento exponencial nos casos de dengue em Rondônia, passando de 969 casos notificados em 1999 para 27.910 casos em 2010, um crescimento de 2.880%. A taxa de incidência subiu de 7,63 para 365,9 por 100 mil habitantes, acompanhada por um aumento nos casos graves e óbitos. É crucial desenvolver políticas públicas para prevenir futuras epidemias, evitando formas graves da doença e, consequentemente, um maior número de óbitos.
Entre 2001 e 2012, houve momentos de surtos súbitos de dengue, com destaque para 2009 e 2010, quando os casos ultrapassaram 19 mil, enquanto nos anos anteriores não chegaram a 10 mil. Os municípios mais populosos, como Porto Velho, Vilhena, Cacoal, Jaru, Guajará-Mirim, Pimenta Bueno, Ji-Paraná, Rolim de Moura, Médici e Ariquemes, registraram o maior número de casos. Esses municípios concentraram 69% dos casos de dengue no período estudado. (SILVA, 2018)
A globalização e a mobilidade populacional facilitam a rápida disseminação do vírus entre regiões urbanas e rurais (BHATT et al., 2013). Estudos têm mostrado que a urbanização descontrolada, associada à falta de planejamento urbano e controle de vetores, está diretamente correlacionada com o aumento da incidência de dengue em muitos países (MURRAY et al., 2013).
O crescimento acelerado das áreas urbanas em cidades como Porto Velho e Ariquemes, muitas vezes de forma desordenada e sem planejamento adequado, criou ambientes propícios para a proliferação do vetor da dengue. A expansão urbana, juntamente com a falta de infraestrutura básica, como sistemas de saneamento e coleta de lixo eficientes, resulta em acúmulo de água parada em recipientes descartados, favorecendo assim, a reprodução dos mosquitos (SCANDAR, 2019).
Camasmie e Miraglia (2018) exemplificam, no seu estudo sobre a incidência de dengue e custos associados antes e depois (2000-2008 e 2009-2013) à construção das usinas hidrelétricas de Rondônia Jirau e Santo Antônio, utilizando um estudo de avaliação econômica, que a média de incidência de dengue foi maior no período posterior às construções (880,29 por 100 mil habitantes) do que no período anterior (356,34 por 100 mil habitantes). Além disso, os custos diretos foram estimados em US$ 3,47 milhões no período anterior e US$ 7,1 milhões no posterior.
Estudos regionais indicam que a densidade populacional crescente e as mudanças no uso da terra têm aumentado a vulnerabilidade da população à dengue em Rondônia (CARVALHO et al., 2018). Além disso, a mobilidade populacional entre áreas rurais e urbanas, muitas vezes motivada pela busca por melhores oportunidades econômicas, facilita a transmissão do vírus entre diferentes regiões (SILVA; CUNHA, 2017).
No controle vetorial e suporte à vigilância sanitária citados nos parágrafos acima, existe o LIRAa, uma metodologia do governo que, os agentes de controle de endemias avaliam uma amostra representativa de imóveis residenciais e comerciais de vários municípios. Determina-se que uma fração dos imóveis de cada estrato seja inspecionado, geralmente variando entre 20% a 25% dos imóveis de cada setor censitário, isso significa que se um setor tem 100 casas, aproximadamente 20 a 25 das mesmas serão inspecionadas durante o levantamento. (CÂMARA; SCHIMDT, 2006).
Imagem 1. Mapas registrando a condição dos municípios Rondonienses de acordo com o LIRAa entre os anos de 2020 – 2022.
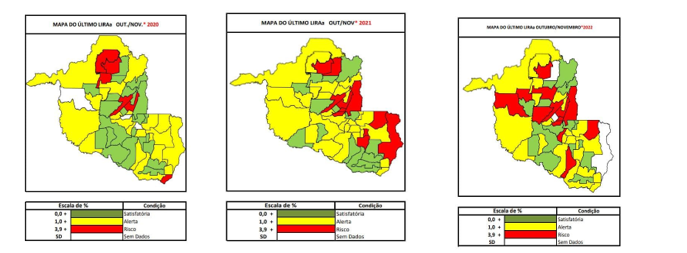
Fonte: Boletins epidemiológicos da AGEVISA, 2024.
Os dados acima são disponibilizados no final de cada boletim na forma que está na imagem 1, e conforme o Ministério da Saúde, a frequência das visitas é determinada pela necessidade de monitoramento contínuo e prevenção. O LIRAa é geralmente realizado trimestralmente, ou seja, a cada três meses, em áreas endêmicas para garantir que as autoridades de saúde possam detectar aumentos na infestação do mosquito e tomar medidas rápidas. Essa amostragem permite obter uma visão precisa e eficaz da infestação do Aedes aegypti na área, permitindo que as autoridades de saúde pública planejem e executem intervenções de controle de forma mais direcionada e eficiente.
Gráfico 1. Resumo dos dados da imagem 1 sobre os 52 municípios (RO)
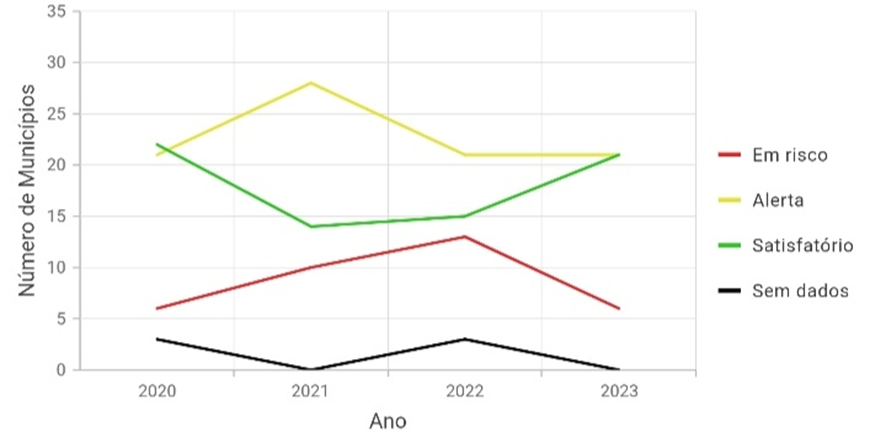
Tabela 2. Valores tabelados do gráfico acima. (M = Municípios)
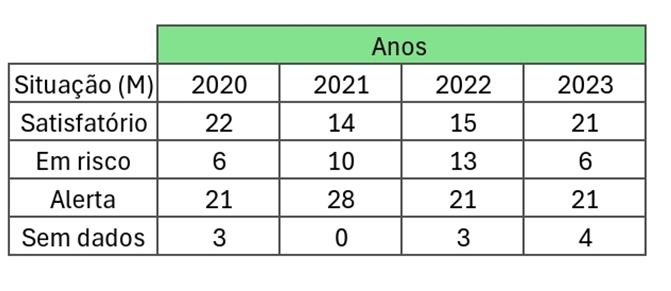
De acordo com o LIRAa, os principais criadouros dentre os dados levantados, são proporcionados nos boletins da AGEVISA da seguinte forma: A1- Caixa d’água (elevado), A2- Outros depósitos de armazenamento de água, B- Pequenos depósitos móveis, C- Depósitos fixos, D1- Pneus e outros materiais rodantes, D2- Lixo (recipientes plásticos, latas), sucatas, entulhos, E- Depósitos naturais. Com intensa maioria de municípios contendo os tópicos D1 e D2.
Tabela 3. Distribuição de insumos por GRS “pós pandemia”.
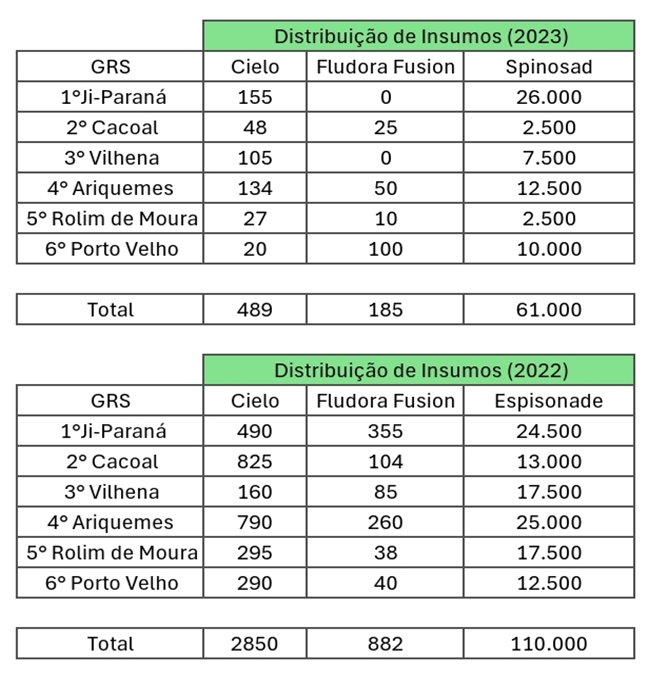
Fonte: Boletins epidemiológicos da AGEVISA, 2024.
Não podendo comparar com os anos anteriores, pois esses não se encontram nos boletins, a porcentagem foi feita com base no ano de 2023. Como medida de contenção ao crescimento exponencial de casos de 2021 para o ano posterior, 2022 teve uma distribuição muito maior de quantidade de insumos para os GRS (Gerências Regionais de Saúde) em comparação com o ano de 2023, com um aumento de 482,8% de Cielo; 376,7% de Fludora Fusion; E 80,3% de Spinosad.
Resumidamente, Cielo de acordo com o Ministério da Saúde (2021) é um larvicida utilizado no controle de larvas de mosquitos, como o Aedes aegypti, transmissor da dengue, zika e chikungunya. Ele é aplicado em recipientes de água parada onde as larvas se desenvolvem, prevenindo seu crescimento e reprodução. Fludora Fusion é um adulticida usado na nebulização espacial para combater mosquitos adultos, reduzindo a população dos mesmos (WHO, 2020);
E o Spinosad, de acordo com a Environmental Protection Agency (2021) é um larvicida biológico derivado de bactérias do solo, eficaz contra as larvas do Aedes aegypti, e é utilizado da mesma forma que o Cielo, em recipientes de água para controlar a população de mosquitos antes que eles atinjam a fase adulta e possam transmitir doenças.
2. VARIÁVEL COVID-19
Infelizmente, dados específicos de coinfecção por COVID-19 e dengue em Rondônia são limitados por ser um tema extremamente atual. No entanto, há informações disponíveis sobre o Brasil que foram trabalhadas nesse tópico, e podem ser úteis para uma análise generalizada e correlacionar com a discussão em sentidos mais amplos, como por exemplo: complicações da dupla infecção, impacto das medidas de contenção de COVID-19, dificuldades diagnósticas, interações medicamentosas, subnotificação de casos de dengue paralelamente à sobrecarga dos sistemas de saúde e respostas inflamatórias exacerbadas. Três autores se destacam a seguir: Santos (2020), Nunes (2021) e Silva (2023).
As restrições de mobilidade reduziram a movimentação das pessoas e, consequentemente, a disseminação do mosquito Aedes aegypti em algumas áreas. Em 2020, alguns estudos mostraram uma redução nos casos de dengue em cidades com medidas de lockdown rigorosas (RODRIGUES et al., 2020). Em regiões urbanas densamente povoadas, a diminuição da atividade humana ao ar livre e a maior permanência em casa reduziram os locais de proliferação do mosquito em áreas públicas.
Todavia, áreas onde o saneamento básico e a gestão de resíduos são deficientes, o acúmulo de lixo e água parada nas residências durante o lockdown aumentou os criadouros de mosquitos, elevando os casos de dengue. Em 2021, alguns municípios relataram um aumento nos casos de dengue devido a essa dinâmica (FERREIRA et al., 2022).
Gráfico 2. Total de notificação por 1° sintomas, no período de interesse.
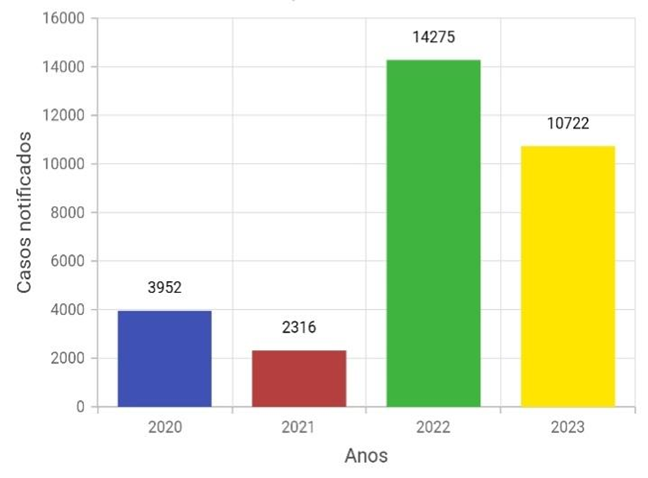
Fonte: Base de dados DATASUS, 2024.
Percebe-se, novamente, que há uma discrepância muito grande no número de notificações, mais especificamente um aumento de 516,36% de 2021 para 2022. Neste exemplo, utilizando outra base de dados, o DATASUS, um site do governo que pode ser usado para subsidiar análises objetivos sobre situações sanitárias.
Sobre a subnotificação nítida durante toda extensão deste documento, Ferreira e colaboradores (2022) argumentam que a pandemia de COVID-19 sobrecarregou os sistemas de saúde, desviando recursos e atenção de outras doenças, incluindo a dengue. Concomitantemente, Nunes e colaboradores (2021) dizem que a semelhança dos sintomas entre dengue e COVID-19 levou a diagnósticos equivocados, onde pacientes com dengue foram tratados inicialmente como casos de COVID-19. Outro fator que justifica a redução do número de notificações de dengue foi o medo de procurar atendimento médico por conta da exposição ao COVID-19, resultando em menos diagnósticos confirmados de dengue (SANTOS et al., 2020)
No Brasil, em 2020, houve um aumento de relatos de coinfecção, com cerca de 15% dos pacientes diagnosticados com dengue também testando positivo para COVID-19 em alguns estudos regionais (SANTOS et al., 2020). Posteriormente, de acordo com Silva e colaboradores (2023), em uma análise nacional feita em 2023, resultados indicaram que aproximadamente 5% dos pacientes com dengue testaram positivo para COVID-19. A coinfecção entre as duas doenças é alarmante pois a sobreposição dos sintomas entre ambas pode dificultar o diagnóstico e atrasar o tratamento adequado, aumentando o risco de complicações (SANTOS et al., 2020). A dupla infecção pode levar a uma resposta inflamatória intensa, aumentando o risco da síndrome do choque da dengue e insuficiência respiratória (NUNES et al., 2021). Por fim, segundo Silva e colaboradores, o tratamento concomitante para ambas as doenças pode resultar em interações medicamentosas adversas, complicando o manejo clínico dos pacientes.
CONSIDERAÇÕES FINAIS
Durante a pandemia, houve uma queda nos casos reportados de dengue e isso pode ser atribuído à atenção da saúde pública e dos sistemas de vigilância epidemiológica que estavam fortemente voltados para o combate contra o COVID-19, o que levou a uma possível subnotificação de casos de dengue. Os recursos, tanto humanos quanto financeiros, foram redirecionados para enfrentar a crise pandêmica, o que dificultou o monitoramento e a notificação precisa de outras doenças.
As medidas de distanciamento social é uma situação ambígua, pois ao mesmo tempo que o confinamento das populações reduziram a mobilidade e a interação humana, reduzindo a propagação do mosquito Aedes aegypti, com menos pessoas circulando em locais públicos que possuíam o vetor; Ficar mais tempo nas residências, em áreas de saneamento básico precário durante o lockdown aumentou os criadouros de mosquitos, elevando os casos de dengue.
O parágrafo anterior reforça a necessidade de investimentos em campanhas, propagandas, e distribuição de insumos para áreas sem acesso, para haver a conscientização generalizada sobre a responsabilidade não só envolvendo a saúde pessoal, como da vizinhança. Em 2022 houve um aumento exponencial de casos notificados, e uma vez que a situação da COVID-19 começou a ser mais controlada, houve um maior foco e investimento para retomar as ações de controle e prevenção da dengue, felizmente, diminuindo os casos em 2023.
Portanto, a redução dos casos durante a pandemia pode ser explicada pela combinação de subnotificação, redirecionamento de recursos e mudanças comportamentais da população, enquanto o aumento em 2022 reflete a retomada das atividades normais e negligência domiciliar com descartes de lixo, que acumulam água parada por exemplo. A colaboração entre o governo e comunidades locais é essencial para enfrentar de forma eficaz esses desafios de saúde pública. Investimentos contínuos em pesquisa, desenvolvimento de vacinas e fortalecimento dos sistemas de saúde são necessários para proteger a saúde das populações afetadas pela dengue e pela COVID-19.
REFERÊNCIAS
BATISTA, W. C. Mapeamento de arbovíroses no estado de Rondônia. 108 f. Tese (Doutorado em Biotecnologia) – Universidade Federal do Amazonas, Manaus, 2007.
BHATT, S; GETHING, P. W; BRADY, O. J; MESSINA, J. P; FARLOW, A. W; MOYES, C. L; DRAKE, J. M; BROWNSTEIN, J. S; HOEN, A. G; SANKOH, O; MYERS, M. F; GEORGE, D. B; JAENISCH, T; WINT, G. R. W; SIMMONS, C. P; SCOTT, T. W; FARRAR, J. J; HAY, S. I. The global distribution and burden of dengue. Nature, 496(7446), 504-507, 2013.
BRASIL. Ministério da Saúde. Dengue – notificações registradas no Sistema de Informação de Agravos de Notificação. Disponível em: <http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sinannet/cnv/denguebbr.def>. Acesso em: 12 jun. 2024.
CÂMARA, F. P.; SCHIMDT, S. M. O papel do LIRAa na vigilância entomológica e no controle do Aedes aegypti. Revista Brasileira de Epidemiologia, 9(1), 106-115, 2006. Disponível em: SciELO. [Acessado em 13 jun. 2024]
CAMASMIE ABE, K.; MIRAGLIA, S. G. K. Incidência de dengue e custos associados, nos períodos anterior (2000-2008) e posterior (2009-2013) à construção das usinas hidrelétricas em Rondônia. Epidemiologia e Serviços de Saúde, v. 27, p. e2017232, 2018.
CARVALHO, R. G.; HONÓRIO, N. A.; BARBOSA, G. L.; LIMA, R. A.; GONÇALVES, L. T. Urbanização e o aumento da incidência de dengue em Rondônia: análise espacial e temporal. Cadernos de Saúde Pública, 34(4), e00124317, 2018.
DE LUCENA, L. T.; AGUIAR, L. O.; BOGOEVICH, A. C. A.; DE AZEVEDO, F. S.; DOS SANTOS, A. C. P.; DO VALE, D. B. A. P.; PEREIRA, D.B.; VILLALOBOS-SALCEDO, J. M. Dengue na Amazônia: aspectos epidemiológicos no Estado de Rondônia, Brasil, de 1999 a 2010. Revista Pan-Amazônica de Saúde, 2(3), 7-7, 2011.
PAULA, F. A. P.; FERREIRA, J. Z.; JUNIOR, E. L. S.; ALVES, I. G.; NARVAES, J. V. R.; PAULA, C. A. P.; BARETTA, I. P.; PACHECO, R. B. Incidência da dengue durante a COVID-19. Brazilian Journal of Surgery & Clinical Research, v. 44, n. 2, 2023.
DE SOUZA, V. H. S.; ROCHA, F. S. P.; BRAGA, L. Q.; FERREIRA, F. A.; RAMALHO, V. G.; MORI, A. S. S.; LOPES, N. C. G.; LEITE, C. Q.; DOS SANTOS, B. F.; TERASSINI, F. A. Análise epidemiológica dos casos de dengue no município de Porto Velho–RO. Brazilian Journal of Development, v. 7, n. 3, p. 29881-29894, 2021.
FERREIRA, D. L.; COSTA, F. R.; SILVA, E. C.; MEDEIROS, M. L. Managing dual epidemics: COVID-19 and dengue in Brazil. Public Health Journal, 2022.
FIGUEIREDO, R.; PAIVA, C.; MORATO, M. Arboviroses. 2017.
FRANCA, R. R. Climatologia das chuvas em Rondônia – período 1981-2011. Geografias, artigo científico, Belo Horizonte ‐ Vol.11 n°1, 2015.
GUBLER, D. J. Arboviruses (Togaviridae and Flaviviridae). Clinical Microbiology Reviews, 1(3), 278-282, 1988.
INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. Mapa Brasil Climas, 1978, com adaptações. Disponível em: <http://www.ibge.gov.br>. Acesso em: 12 jun. 2024.
MELO, G. B. T.; ANGULO-TUESTA, A.; DA SILVA, E. N.; OBARA, M. T. Financiamento de pesquisas sobre dengue no Brasil, 2004-2020. SciElo, 2023. Disponível em: https://doi.org/10.1590/0103-1104202313817 .Acesso em: 12 jun. 2024.
MINISTÉRIO DA SAÚDE. Dengue. Disponível em: <https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/d/dengue>. Acesso em: 12 jun. 2024.
MINISTÉRIO DA SAÚDE. Diretrizes Nacionais para a Prevenção e Controle de Epidemias de Dengue. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/svsa/dengue/diretrizes_nacionais_prevencao_controle_dengue.pdf/view. Acesso em 13 jun. 2024.
MINISTÉRIO DA SAÚDE. Manual de Controle de Dengue. Disponível em: Ministério da Saúde. Acesso em 13 jun. 2024.
MINISTÉRIO DA SAÚDE. Série histórica – Casos de óbitos dengue (2000-2023). Atualização: 12/01/2024. Disponível em: <https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/edicoes/2022/boletim-epidemiologico-vol-53-no20>. Acesso em: 12 jun. 2024.
MURRAY, N. E.; QUAM, M. B.; WILDER-SMITH, A. Epidemiology of dengue: past, present and future prospects. Clinical Epidemiology, 5, 299-309, 2013.
NEPOMUCENO, T. R. Aspectos epidemiológicos da dengue no município de Ariquemes, Rondônia, no período de 2009 a 2012, 2013.
NUNES, P. C.; DE MORAES, S. L.; SANTANA, R. M.; COSTA, M. A.; ALMEIDA, A. F. Clinical outcomes of patients with COVID-19 and dengue co-infection. BMC Infectious Diseases, 2021.
PETERSEN, R.; CHIN, L.; BARRETT, A. D. T.; WEAVER, S. C. Emerging Infections in an Era of Globalization. In Emerging Infections, 2016.
RODRIGUES, P. R.; NASCIMENTO, J. F.; OLIVEIRA, L. G.; COSTA, V. S. Impact of COVID-19 on dengue response in Manaus, Brazil. Tropical Medicine & International Health, 2020.
SANTOS, M. A.; OLIVEIRA, J. B.; SILVA, A. P.; FERREIRA, C. H.; ALMEIDA, L. M. Challenges in differentiating COVID-19 from dengue: a case report. Journal of Medical Case Reports, 2020.
SCANDAR, S. A. S. Aedes aegypti em Rondônia: um estudo sobre a distribuição e o controle do vetor. Revista de Saúde Pública de Rondônia, 13(2), 124-135, 2019.
SILVA, J. R.; CAMPOS, R. E.; TEIXEIRA, T. C.; LIMA, M. S.; ALVES, F. R. Co-infection strategies for COVID-19 and dengue in endemic areas. Journal of Public Health Policy, 2023.
SILVA, L. R.; CUNHA, M. S. Mobilidade populacional e a disseminação do vírus da dengue em Rondônia. Revista Brasileira de Epidemiologia, 20(2), 253-261, 2017.
SILVA, M. A. Casos de Dengue no Estado de Rondônia: uma Análise de Correspondência e de Agrupamentos. 38 f. Trabalho de Conclusão de Curso (Graduação em Estatística)– Fundação Universidade Federal de Rondônia, Ji-Paraná, 2018.
TEIXEIRA, L. A. S.; COSTA, M. A.; OLIVEIRA, R. P.; MARTINS, J. P.; SOUZA, A. M. Persistência dos sintomas de dengue em uma população de Uberaba, Minas Gerais, Brasil. Cadernos de Saúde Pública, v. 26, n. 3, p. 624-630, 2010.
US Environmental Protection Agency. Spinosad Fact Sheet, 2021.
VALE, J. S. Rondônia, no período de 2007 a 2009, 2011.
WILDER-SMITH, A.; SCHNEIDER, J.; OYER, R.; FARNHAM, A.; SAINZ-EGUÍA, J. Dengue in travellers. New England Journal of Medicine, 2004.
WHO. Vector control interventions, 2020. Acesso em: 12 jun. 2024.
UNAMA FACULDADE DA AMAZÔNIA – Porto Velho¹
