REGISTRO DOI: 10.5281/zenodo.10882089
Romulo Halley Gonçalves de Medeiros1
Glenda Azevedo Rodrigues2
Jamily Araújo Ribeiro3
Profa. Dra. Rafaelly Maria Pinheiro Siqueira4
RESUMO
A Pentoxifilina (PTX) é uma metilxantina utilizada na clínica principalmente no tratamento de doenças venosas oclusivas, que consegue reduzir a viscosidade do sangue, na atuação como antiagregante plaquetário, resultando em uma melhor perfusão sanguínea. Além disso, atua como inibidor da atividade pró-inflamatória. Este estudo teve como objetivo realizar ensaio de atividade antioxidante da pentoxifilina e investigar a sua capacidade de neutralização de radicais livres. O estudo foi do tipo quantitativo, descritivo e experimental. A metodologia utilizada foi a de sequestro de radicais livres pelo método do DPPH (2,2-difenil-1-picril-hidrazil), por ser um teste que apresentar resultados confiáveis em um período curto de tempo. Dessa forma preparou-se algumas soluções de pentoxifilina nas cinco concentrações a seguir: 3200 ug/ml, 1600ug/ml, 800ug/ml, 400ug/ml, 200ug/ml. Para o controle positivo utilizou-se o ɑ-Tocoferol (vitamina E) nas concentrações de 50ug/ml e 5ug/ml. Já para o controle negativo, utilizou-se a adição de água destilada ao DPPH. Os testes foram realizados em triplicata e em dois momentos diferentes. A absorbância foi verificada em intervalos de 15, 30 e 60 minutos. Ao final dos testes, os resultados foram submetidos à análise estatística do software Graphpad Prism® versão 5.0 para Windows e a Análise de Variância (ANOVA) e teste de Student Newman Keuls. Os resultados encontrados apontaram que a pentoxifilina não foi capaz de neutralizar os radicais livres pelo método direto de sequestro de radicais, mas também permitiu o entendimento de que sua atividade antioxidante pode estar ligada a um mecanismo de diminuição do estresse oxidativo de modo indireto por atuar nos processos de imunomodulação.
Palavras-chaves: Pentoxifilina; Antioxidante; Estresse oxidante; Farmácia
1. INTRODUÇÃO
Em todo o decorrer da vida, o organismo humano é protagonista de processos bioquímicos, metabólicos e fisiológicos que trabalham em conjunto, objetivando manter a homeostase e o bom funcionamento do corpo. É nesse processo contínuo que ocorrem as reações biológicas e, consequentemente, ocorrem à formação de radicais livres, que funcionam como mediadores para a transferência de elétrons nas várias reações bioquímicas (SHAMI; MOREIRA, 2004).
A produção em quantidade fisiológica desses radicais é importante, pois contribui com a produção de ATP (energia), por meio da cadeia transportadora de elétrons, e ainda auxilia em processos fisiológicos como a fecundação, ativação de genes e mecanismos de defesa. Contribuem ainda para a regulação do crescimento celular e fagocitose (BARBOSA et al., 2010).
Diferentemente, quando ocorre um desequilíbrio entre os níveis de antioxidantes e as substâncias pró-oxidantes, fica condicionado o desenvolvimento do estresse oxidativo. A peroxidação lipídica desencadeada pelo excesso de radicais livres agride os lipídeos de membrana, proteínas, enzimas, carboidratos e até mesmo o DNA. Essa situação resulta no desenvolvimento de lesões oxidativas que podem causar uma disfunção em células, tecido e órgãos, acarretando uma condição patológica e prejudicial para o ser humano (OGA; CAMARGO; BATISTUZZO, 2008; KRUK, 2014).
As espécies reativas de oxigênio (EROs) e espécies reativas de nitrogênio (ERNs), são moléculas instáveis com um ou mais elétrons desemparelhados geralmente nos átomos de oxigênio ou nitrogênio. São produzidas decorrentes de problemas disfuncionais ou em decorrência do tipo de alimento ingerido. Os radicais livres em excesso no organismo participam dos mecanismos fisiopatológicos e, portanto, atuam no desenvolvimento de doenças do coração, artrite, choque hemorrágico, disfunções cognitivas, câncer e AIDS, condições essas que podem ser a causa ou a consequência do agravamento do quadro clínico geral da doença estabelecida. (HALLIWELL; GUTTERIDGE; CROSS,1992).
Nessas condições, o organismo promove o contrabalanceamento, efetuando a neutralização desses agentes através da produção de antioxidantes. Este termo é caracterizado com qualquer substância que quando em baixa concentração, em meio ao substrato oxidável, diminui ou inibe significativamente a oxidação daquele substrato. Logo, possuem ação protetora dos sistemas biológicos no processo de oxidação de macromoléculas e estruturas celulares (OGA; CAMARGO; BATISTUZZO, 2008).
Além das substâncias antioxidantes endógenas, existem também as exógenas como, por exemplo, o alfa-tocoferol (vitamina E), o ácido ascórbico (vitamina C), os bioflavonóides, o betacaroteno, zinco (PIETTA, 2000; PRASAD et al., 2007).
Um estudo feito em 2001 por Sudha, Rao e Rao, considera que os radicais livres podem estar ligados ao desenvolvimento de epilepsia. Em um processo inflamatório crônico, o estresse oxidativo causado pela formação dos radicais livres sugere que a ação dos mesmos pode levar ao envelhecimento progressivo e acelerado do cérebro, dado que o aumento da resposta inflamatória está associada a alterações cerebrais, como perda da substância branca, diminuição do tamanho neuronal, entre outras que culminam com a perda de capacidade cognitiva e da memória, levando ao desenvolvimento de doenças como a epilepsia.
O estresse oxidativo está envolvido no desenvolvimento de doenças neurodegenerativas como Alzheimer, Parkinson, além de epilepsia e depressão. À falta de soluções inovadoras que possam promover a diminuição da incidência destas patologias é uma situação que está relacionada a prejuízos para a sociedade no setor da saúde, na condição ocupacional e no setor econômico.
É nesse cenário que ressalta-se a importância de se realizarem estudos sobre a Pentoxifilina, uma xantina que pode carregar em sua estrutura um potencial antioxidante, baseado em estudos recentes desta classe. Portanto, Justifica-se que os resultados deste estudo, contribuirão de forma satisfatória de modo que a sociedade possa se beneficiar com uma droga que tenha um potencial antioxidante e, deste modo, diminuir o desenvolvimento de doenças neurológicas, cardiovasculares e sistêmicas de um modo geral.
2 OBJETIVOS
2.1 Objetivo Geral
Avaliar a atividade antioxidante da pentoxifilina pelo método in vitro.
2.2 Objetivos Específicos
Avaliar a capacidade da substância Pentoxifilina em neutralizar o radical livre sintético DPPH [2,2 difenil-1-picril-hidrazil (C18H12N5O6)] em diferentes concentrações 3200 ug/ml, 1600ug/ml, 800ug/ml, 400ug/ml, 200ug/ml.
3 REFERENCIAL TEÓRICO
3.1 A Pentoxifilina e a associação com o efeito antioxidante
A pentoxifilina (PTX), 1-(5-oxohexil)-3,7-(dimetilxantina), é uma metilxantina inibidora da fosfodiesterase (PDE) que é usada no tratamento de doenças venosas oclusivas. Atua aumentando a perfusão sanguínea em tecidos pouco vascularizados, graças à redução da viscosidade sanguínea consequente da diminuição do fibrinogênio plasmático e inibição da agregação plaquetária e eritrocítica. (KOROLKOVAS; FRANÇA; CUNHA, 2010).
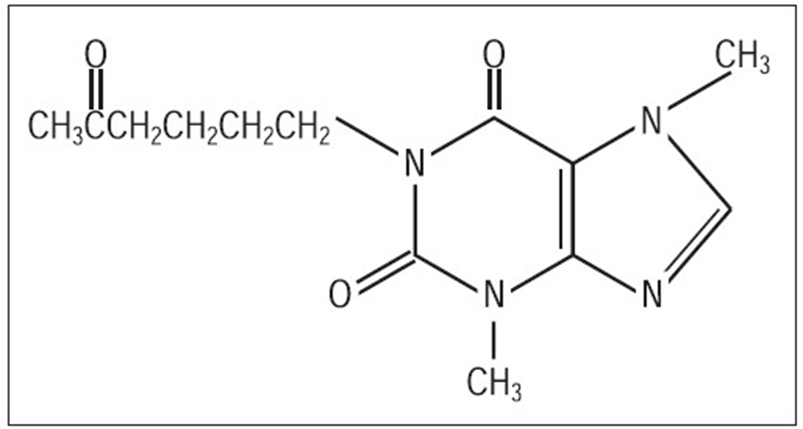
Figura 1: Estrutura química da Pentoxifilina. Fonte: Méndes, 2003.
Além disso, estudos indicam que ela inibe vários mecanismos inflamatórios incluindo a cascata do complemento, a aderência dos neutrófilos, controla a produção do Fator de Necrose Tumoral Alfa (TNF-α) e de outras citocinas, inibe angiogenese e eleva os níveis de Adenosina Mono Fosfato cíclico (AMPc) nas células imunoreguladoras (CARNEIRO et al., 2005).
Estudos mostram que a pentoxifilina (PTX) inibe o TNF-α (GOICOECHEA et al, 2012; RIENECK, 1993; LIN et al., 2004), a IL-1 (SULLIVAN et al., 1988), a IL-2, IFNγ (RIENECK, 1993) e proteína C reativa (GOICOECHEA et al, 2012). Também é conhecida a atividade das metilxantinas sobre o Sistema Nervoso Central (SNC), aumentando o estado de alerta (RANG et al., 2007).
Fernandes (2006) realizou um estudo de avaliação da atividade antiinflamatória da pentoxifilina em pacientes com síndromes coronárias agudas. Através deste estudo clínico constatou que a pentoxifilina utilizada de forma prolongada, neste caso por seis meses, reduziu a atividade pró-inflamatória e aumentou a atividade anti-inflamatória nos pacientes do estudo, quando comparou os resultados obtidos com um placebo.
Entretanto, são formadas várias espécies reativas de oxigênio e nitrogênio no processo inflamatório intenso. Nessa circunstância, pode-se sugerir que ao diminuir a atividade inflamatória e pró-inflamatória, correlaciona-se esse efeito à diminuição de produção ERO’s e ERN’s produzidas durante este processo. Logo, por consequência, a condição do estresse oxidativo na região cerebral que pode culminar com estados de TDM (Transtorno de Depressão Maior), não seria um fator que pudesse desenvolver a doença (OGA; CAMARGO; BATISTUZZO, 2008).
3.2 Estresse oxidativo, radicais livres e espécies pró-oxidantes
O Estresse oxidativo é uma condição resultante de desbalanceamento entre substâncias pró-oxidantes e antioxidantes. Este desbalanceamento possibilita o desenvolvimento da formação de espécies reativas, também conhecidas como radicais livres, oriundas do metabolismo do oxigênio. Podemos elencar como alguns dos principais processos de formação do estresse oxidativo a produção de ATP (Trifosfato de Adenosina) pelas mitocôndrias por meio da cadeia transportadora de elétrons, a atividade imunológica exercida pelo organismo e a radiação ionizante (DJORDJEVIC, 2004; BARBOSA et al., 2010).
As reações de óxido-redução que resultam na formação de Espécies Reativas de Oxigênio (ERO’S) são facilitadas na presença de ferro e cobre, pois estes íons interagem direto com espécies oxidantes ocasionando a produção de radicais livres.
Normalmente, a formação dessas ERO’S acontecem na mitocôndria quando o oxigênio molecular (O2) sofre redução, ao aceitar quatro elétrons, formando água (Figura 2). A enzima que catalisa essa reação é a citocromo oxidase. Quando esta enzima oxida quatro moléculas de citocromo C, removendo um elétron de cada uma delas, eles são adicionados ao oxigênio molecular para formação de água. Porém de 2 a 5 % do oxigênio utilizado pelas mitocôndrias desviam-se para outra via de metabolização e são reduzidos com apenas um elétron, dando origem ao que chamamos radicais livres (FERREIRA; MATSUBARA, 1997; KOURY; DONANGELO, 2003; SCHNEIDER; OLIVEIRA, 2004).
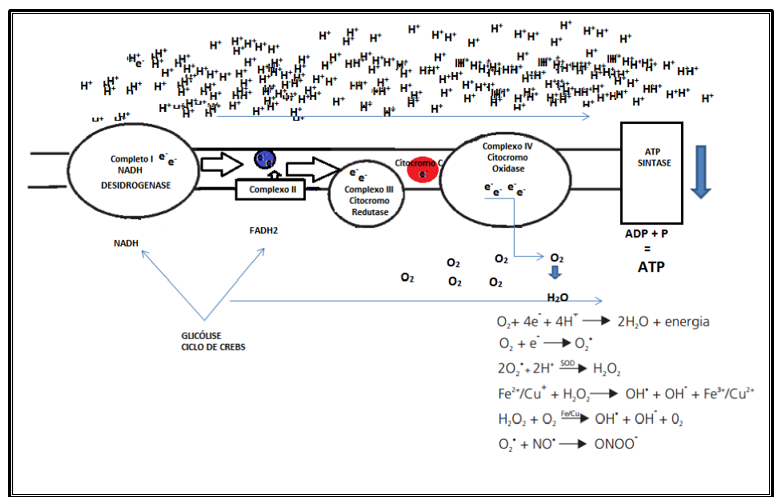
Figura 2: Formação de radicais livres na cadeia transportadora de elétrons. Fonte: Original
Nessa circunstância, com a geração de oxigênio molecular contendo um elétron desemparelhado, são geradas espécies reativas, como por exemplo: superóxido (O2•–), peróxido de hidrogênio (H2O2), hidroxil (OH•) e peroxinitritos
(ONOO−). A participação do oxigênio na geração de OH• acontece na presença dos íons cobre e ferro, fortemente ativos nas reações de óxido-redução. As reações de Fenton (Figura 3) e Haber-Weiss (Figura 4) são responsáveis pela geração desta espécie. A primeira reação gera OH• através da reação do peróxido de hidrogênio com os referidos íons, a segunda ocorre com a reação catalisadora desses íons na interação do peróxido de hidrogênio com o superóxido (O2•–) (KOURY; DONANGELO, 2003; SCHNEIDER; OLIVEIRA, 2004).
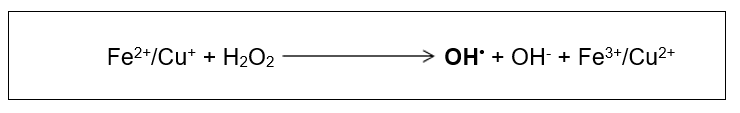
Figura 3: Reação de Fenton demonstrando a interação dos íons de Ferro ou de Cobre com o peróxido de hidrogênio produzindo radical hidroxil (OH•). Fonte: Barp, J., 2007.
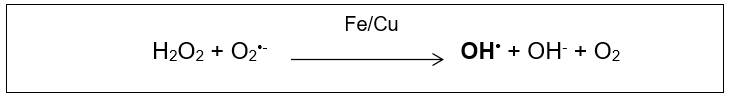
Figura 4: Reação de Haber-Weiss envolvendo a catálise íons de Ferro e Cobre na reação entre peróxido e superóxido produzindo radical hidroxil (OH•). Fonte: Barp, J., 2007.
O radical livre OH• é o mais lesivo e reativo radical, do qual o organismo não pode se defender. Contribui ativamente na lipoperoxidação (LPO), por meio da retirada de um átomo de hidrogênio dos ácidos graxos que compõem a membrana celular, como o ácido linoleico, por exemplo, contribuindo para o estresse oxidativo, podendo gerar danos a proteínas e ao Ácido Desoxirribonucléico (DNA). Nesta condição, o íon ferro tem participação no processo lesivo convertendo hidroperóxidos lipídicos (LOOH) em radicais LO• e LO2, que são muito reativos (SCHNEIDER; OLIVEIRA, 2004; DAVID; BARREIRO, 2006).
O peróxido de hidrogênio, estando em sua conformação química H2O2, é bastante estável, porém, detentor de um relevante potencial reativo, já que tem vida longa e pode ultrapassar membranas celulares, tendo seu potencial deletério aumentando em dez mil vezes na presença de ferro (FERREIRA; MATSUBARA, 1997; SCHNEIDER; OLIVEIRA, 2004, VASCONCELOS et al., 2007).
O superóxido é gerado no momento da aceitação de elétrons pelo oxigênio molecular. Quando, por exemplo, a enzima intermediadora de energia NADPH oxidase (Nicotinamide Adenine Dinucleotide Phospate) efetua a transferência de seus pares de elétrons, gerando o radical superóxido (O2•–). Fisiologicamente, a NADPH produz o superóxido como sinalizador intracelular para que neutrófilos realizem mielopexidase (MPO), que culmina na conversão de H2O2 em ácido hipocloroso (VOLLARD; SHEARMAN; COOPER, 2005; BEDARD; KRAUSE, 2007).
Além disso, também existem outras espécies reativas como, por exemplo, o oxigênio singlete (1O2*) na forma de estado excitado. Esta forma reativa é produzida através de reações fotoquímicas ou por radiações. O oxigênio singlete tem ação deletéria sobre um elevado numero de moléculas biológicas, como os lipídeos de membrana, logo participa dos processos de lipoperoxidação. O 1O2* é gerado através de um sensibilizador no estado tripleto (3S• – riboflavina, clorofila, porfirinas) através de um processo de transferência de energia destes componentes para o oxigênio. Há também o ozônio (O3), que é produzido no ambiente atmosférico poluído ou por fonte de luz forte de algumas fotocopiadoras, podendo causar danos ao pulmão, oxidar proteínas, DNA e lipídeos (VASCONCELOS et al., 2007).
Além das espécies reativas de oxigênio, existem também aquelas espécies que são reativas derivadas de nitrogênio (ERN’s) e cloro, como por exemplo o ácido hipocloroso (HOCl) que tem por característica a oxidação de compostos biológicos como os tio éteres, fenóis, aminas, tióis e ligações insaturadas e de forma mais seletiva que o radical hidroxila, participa da oxidação de ferro e proteínas. Sua participação nos processos fagocíticos está em reagir com O2•– para formar radicais hidroxila (HALLIWELL, 2006).
Há também aquelas espécies derivadas do enxofre, como o radical tiíla (RS•), que são radicais com o elétron desemparelhado residindo no enxofre. E também, os miscelânios e metais, cuja função é de catalisar as reações de radicais livres (VASCONCELOS et al., 2007).
3.3 Fatores que interferem no estresse oxidativo
No processo que compreende o acontecimento das reações de óxido-redução que culminam com a formação de radicais livres, existem fatores que contribuem com a modulação destas reações, aumentando ou diminuindo o estresse oxidativo. Pode-se destacar como fatores modulatórios: a dieta, atividade física, tabagismo, álcool, as radiações ionizantes e o acúmulo de metais pesados (MAYNE, 2003; VASCONCELOS et al., 2007).
Sabe-se que uma dieta rica em nutrientes essenciais é importante para o bem estar fisiológico, principalmente quando for rico em alimentos em propriedades antioxidantes. Podemos tomar como exemplo, uma dieta rica em carotenoides, como o licopeno, vitamina C, vitamina E, zinco, compostos fenólicos (SHAMI; MOREIRA, 2004; CERQUEIRA; MEDEIROS; AUGUSTO, 2007).
O estresse oxidativo é evidenciado também em alguns casos nos quais ocorre o aumento da geração de espécies oxidantes, como por exemplo, na cardiomiopatia derivada da deficiência de selênio, conhecida como síndrome de Keshan, em que se deflagra a diminuição dos níveis de glutationa que, desta forma, não neutraliza por completo as espécies de peróxido de hidrogênio e peróxidos lipídicos culminando com a lesão de fibras cardíacas. Condições patológicas ligadas à carcinogênese, atividade inflamatória intensa, resultando na infiltração massiva de neutrófilos gera altos níveis de superóxido e peróxido de hidrogênio, gerando uma condição de estresse oxidativo local, com consequente lesão tecidual em resposta à inflamação. Outras patologias como aterosclerose, lesão por isquemia e reperfusão, doenças auto-imunes e inflamação crônica também podem ser fatores modulatórios para o estresse oxidativo (OGA; CAMARGO; BATISTUZZO, 2008).
3.4 Enzimas antioxidantes endógenas
As espécies reativas de oxigênio são neutralizadas endogenamente graças a enzimas antioxidantes. Destacam-se as principais: superóxido dismutase (SOD), glutationa peroxidase (GPx) e catalase (CAT). Estas macromoléculas fazem parte do sistema enzimático endógeno de proteção e têm a função de minimizar os danos causados aos tecidos pelos radicais livres, impedir a formação ou ação destes em favorecimento aos sistemas de reparo (CLARKSON; THOMPSON, 2000; OGA;CAMARGO;BATISTUZZO, 2008; KOURY; DONANGELO, 2003).
A descoberta da função da SOD por McCord e Fridovich em 1969, proporcionou um grande avanço nos estudos sobre a reatividade do oxigênio. São conhecidas três formas de SOD: SOD dependente de cobre e zinco (CuZnSOD), SOD dependente de Manganês (MnSOD) e SOD extracelular (ECSOD) (SILVA;GONÇALVES, 2010).
A SOD dependente de cobre e zinco está presente principalmente no citoplasma e nos peroxissomos. Esta enzima cataliza a reação de dismutação de O2•– em H2O2. É composta por duas subunidades, cada uma com um átomo de Cobre e um átomo de zinco. A MnSOD é uma enzima mitocondrial com atividade antitumoral e sua quantidade depende do número de mitocôndrias que compõem cada tipo de célula (VALKO et al., 2006).
A ECSOD também possui em sua composição cobre e zinco e uma glicoproteína de alta especificidade para determinados glicosaminoglicanos, como a heparina por exemplo. É caracterizada como a principal SOD extracelular, sendo encontrada entre os espaços intersticiais dos tecidos e nos fluidos extracelulares como linfa, liquido sinovial e plasma; possui síntese intercelular e migração para a matriz extracelular (OGA; CAMARGO; BATISTUZZO, 2008; SILVA; GONÇALVES, 2010).
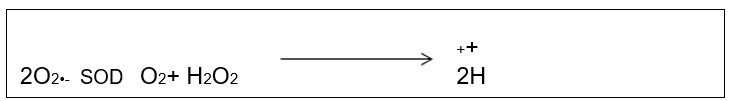
Figura 5: Reação de dismutação do radical superóxido pela SOD. Fonte: Barp, J., 2007.
Outra enzima antioxidante endógena conhecida como catalase (CAT) está localizada nos peroxissomos do rim e do fígado e em microperoxissomos de outras células. Trata-se de uma hemeproteína com especificidade para o peróxido de hidrogênio. Sua função é reduzir o peróxido de hidrogênio a oxigênio e água (BABIOR, 1997; OGA;CAMARGO;BATISTUZZO, 2008).
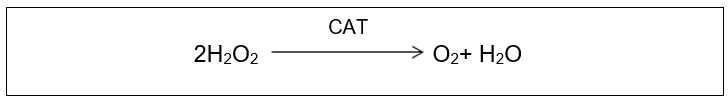
Figura 6: Reação de redução do peróxido de hidrogênio a oxigênio e água pela CATALASE. Fonte: Barp, J., 2007.
Além dessas citadas anteriormente, também é conhecida a ação antioxidante da glutationa peroxidase (GPx), uma importante peroxidase que é responsável pelos processos de redução de hidroperóxidos (R-OOH) graças ao grupo sulfidril (-SH) presente em sua estrutura química. Esses agrupamentos podem doar dois hidrogênios para a formação de uma ligação dissulfeto que transforma o hidroperóxido em um álcool (R-OH), ou no caso do peróxido de hidrogênio, em água. A glutationa na forma oxidada, pode ser regenerada através da interação da forma oxidada (GSSH) com o NADPH pela enzima glutationa redutase (GR) (HALLIWEL, GUTTERIDGE, 1999 apud BERRA, MENCK E MASCIO, 2006).
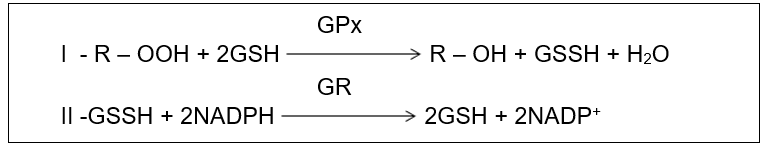
Figura 7: (I) Reação de redução de hidroperóxidos pela glutationa peroxidase; (II) – Reação de regeneração da glutationa oxidada à sua forma reduzida (GSH). Fonte: Barp, J., 2007.
3.5 Espécies antioxidantes exógenas
Também chamado de sistema de defesa não enzimático, ou dietético, podese considerar como espécies antioxidantes àquelas que contêm em sua composição fénois (compostos fenólicos), além das vitaminas e minerais. Os precursores de vitamina A (beta-caroteno), vitamina C (ácido ascórbico) e E (tocoferóis) possuem potencial altamente antioxidante. Os minerais que mais se destacam nesta função são, magnésio, zinco, cobre e selênio (PRASAD et al., 2007).
Os compostos fenólicos são substâncias oriundas de fontes vegetais, como verduras e frutas, por exemplo. São sintetizadas em função de defesa da planta na ação antioxidante. A produção dos flavonoides é catalisada em concentrações adequadas de luz, principalmente luz ultravioleta B. A ação antioxidante dessa espécie esta direcionada à atuação direta sobre os radicais livres, transferindo-lhe um elétron tornando-o estável. Esses compostos também estão associados ao envolvimento com a quelação de metais de transição como ferro e cobre que podem interagir ou catalisar reações formadoras de radicais livres (AHERNE; O’BRIEN, 2002; OGA; CAMARGO; BATISTUZZO, 2008).
O beta-caroteno como precursor de vitamina A, faz parte do grupo dos carotenoides, que podem ser classificados como pigmentos dos tecidos fotossintéticos de vegetais. Eles são adquiridos através da dieta pela ingesta de frutas e legumes. Eles atuam como agentes redutores, desativando a espécie reativa denominada de oxigênio singlete, ou interferindo como sequestrador de radicais peroxila, que foram gerados na peroxidação lipídica, efetuando assim a proteção das membranas celulares e as lipoproteínas. Esse processo reduz a oxidação do DNA e de lipídeos que esta associada a doenças degenerativas, como doenças cardíacas e carcinogênicas (PALACE et. al., 1999; OGA; CAMARGO; BATISTUZZO, 2008).
A vitamina C (ácido ascórbico) é essencial para o organismo porque não é sintetizada pelo metabolismo da glicose fisiologicamente, diferente do que ocorre em plantas e em animais. Sua forma antioxidante encontra-se nos sistemas biológicos sob a forma de íon ascorbato (Asc–), podendo doar um H+ ou um H+ + e– para radicais como superóxido, peróxido de hidrogênio, hipoclorito, radicais hidroxila e peroxila. Atua impedindo que o processo de peroxidação lipídica se inicie, protegendo as membranas celulares, melhorando o poder antioxidante da vitamina E e do selênio. Vale salientar que a presença de ferro propicia uma ação pro-oxidante para a vitamina C, capacitando-a a produzir espécies radicais e não radicais, respectivamente, OH• e H2O2 (BIANCHI; ANTUNES, 1999; HALLIWELL;GUTTERIDGE, 2007 apud VASCONCELOS et al., 2007; RODRIGO; GUICHARD; CHARLES, 2007).
O potencial antioxidante do tocoferol é reconhecido graças a sua ação inibidora da peroxidação lipídica e seu caráter lipossolúvel que lhes confere a capacidade de se acumular dentro da célula. Assim como os flavonoides, a espécie alfa-tocoferol age como doador de H+ para o radical peroxila, interrompendo a ação em cadeia. Cada tocoferol atua em no máximo dois radicais peroxila, tornando-se irreversivelmente inativado. Também reage com oxigênio singlete, sequestra radicais superóxido e hidroxila, impedindo o início da peroxidação lipídica por estas espécies (THERIAULT et al., 1999; .OGA;CAMARGO;BATISTUZZO, 2008). Contribuindo para a ação antioxidante, Vincent, Innes e Vincent, 2007, destacaram que os metais cobre, zinco, manganês e selênio são importantes precursores de enzimas antioxidantes já mencionadas nesta pesquisa, SOD-Cu/Zn, SOD-Mn e GSH. Vale salientar que estudos in vivo indicam que o zinco tem participação efetiva em várias funções do organismo como, por exemplo, espermatogênese, estoque e liberação de insulina, resposta e regulação do sistema imune, além da ação de proteção antioxidante. Estudos in vitro em modelos bioquímicos e celulares, confirmam que o seu antagonismo induz à formação de radicais livres (KING; SHAMES; WOODHOUSE, 2000; POWER, 2000).
3.6 Estresse oxidativo e principais patologias envolvidas.
As ERO’s interferem gradativamente na homeostase fisiológica, tendo participação do desenvolvimento de várias doenças. Indistintamente, o cérebro também se torna susceptível a efeitos oxidantes promovidos por estas espécies. Pesquisas confirmam que o estresse oxidativo tem participação no desenvolvimento de transtornos neurológicos como, por exemplo, o transtorno bipolar, a esquizofrenia, o Alzheimer além de outros processos demenciais, já que as ERO’s incentivam o processo de apoptose de forma mais efetiva (FREY et al., 2006a; FREY et al., 2006b; GACKOWSKI et al., 2008).
O cérebro metaboliza 20% do oxigênio total do corpo e sua capacidade antioxidante é limitada a ação das enzimas SOD e CAT, importantes eliminadoras de radicais livres gerados dentro das células. Nos casos em que a SOD tem menor concentração, ocorre o acúmulo de superóxido, promovendo o estresse oxidativo. No caso da CAT em menores concentrações, o estresse oxidativo ocorre pela conversão do peróxido de hidrogênio em hidroxila, que é altamente reativo e citotóxico. Se a produção de radicais livres é maior que a concentração de espécies antioxidantes, ocorre degradação de membranas, disfunções celulares, danos ao DNA e apoptose (FREY et al., 2006a; FREY et al., 2006b; GACKOWSKI et al., 2008).
Testes realizados em ratos com modelo de Estresse Crônico Leve Variado (ECLV), utilizam a venlafaxina, que tem ação sobre a serotonina e a noradrenalina, e ressaltam a redução dos níveis de peroxidação lipídica e de óxido nítrico (NO) no cérebro e nos eritrócitos de ratos tratados. Diferentemente, ocorre o contrário nos não tratados, estes parâmetros aumentam, corroborando a presença de estresse oxidativo em ratos em estado de anedonia (FOKSINSKI et al., 2007 e EREN; NAZIROGLU; DEMIRDAS, 2007).
Um estudo realizado por Lucca, 2008, o qual avaliou os efeitos comportamentais e neuroquímicos, utilizando-se do modelo de experimentação de ECLV, mostrou evidências de que houve aumento de peroxidação lipídica na região do cerebelo e estriado e peroxidação proteica na região pré-frontal, hipocampo e estriado. Foram notados ainda um aumento da atividade da CAT no cerebelo, hipocampo e estriado e redução da atividade de SOD na região pré-frontal, no hipocampo e estriado, nos ratos condicionados ao estresse oxidativo. Confirmou-se também um aumento na geração de TBARS (Substâncias Reativas Derivadas do Ácido Tiobarbitúrico) na região do córtex. Esse estudo confirmou, portanto, que as alterações causadas pela condição oxidativa, contribuiu para o desenvolvimento da depressão.
Neste mesmo seguimento, o uso de antioxidantes como, por exemplo, a Nacetil-cisteína, zinco e análogos da GSH, em modelos animais de depressão, tem sido utilizados com sucesso ao exibirem seus efeitos antidepressivos. Vários estudos procuram estabelecer a confirmação de que o exercício físico possui valor primordial no efeito antioxidante nos casos de Transtorno Depressivo Maior (TDM), mas os resultados são variados (MAES, et al., 2011).
4 METODOLOGIA
4.1 Tipo de estudo
Trata-se de um estudo quantitativo, descritivo e experimental onde foi investigado o efeito da Pentoxifilina in vitro de forma direta, com a utilização de radical livre sintético.
4.2 Local do estudo
O ensaio experimental foi realizado no Laboratório do Núcleo de Bioprospecção e Experimentação Molecular Aplicada (NUBEM) das Faculdades INTA, e no laboratório de Bioquímica, situados na Rua Coronel Antônio Rodrigues Magalhães, nº 359, no bairro Dom Expedito, Sobral-CE.
4.3 Análise crítica dos riscos e benefícios
Os riscos existentes na realização deste estudo são os mais comuns em estudos dessa natureza. Logo, podemos citar como riscos físicos ferimentos ocasionados por material perfuro cortante; riscos biológicos e tóxicos em caso de entrar em contato com material toxicante, riscos psicológicos associados ao estresse relacionado à execução do projeto, riscos econômicos relacionados à eminência do pesquisador em arcar com custos específicos que não estejam programados. Em meio a essas condições, todos os procedimentos serão realizados atentando-se para valorizar os princípios de biossegurança na execução deste projeto.
Os benefícios esperados com o desenvolvimento deste estudo constituem uma importante contribuição ao conhecimento, no intuito de fortalecer a ciência como um todo e proporcionar à sociedade resultados precursores para inovação farmacológica.
4.4 Protocolo experimental
4.4.1 Protocolos de preparação das drogas
4.4.1.1 Pentoxifilina:
Para o preparo inicial da pentoxifilina, foi necessário a pesagem de 640mg de Pentoxifilina que foram diluídos em 5ml de água destilada, tendo, portanto, a concentração de 128mg/ml. Com o preparo desta solução mãe na concentração de 3200ug/ml foram retirados os seguintes volumes: 500ul, 250ul, 125ul, 62,5ul e adicionados em frascos âmbar separadamente. Em seguida foram adicionados respectivamente os seguintes volumes de água destilada: 500ul, 750ul, 875ul, 937,5ul. Suas respectivas concentrações finais foram: 3200 ug/ml, 1600ug/ml, 800ug/ml, 400ug/ml, 200ug/ml.
4.4.1.2 2,2-difenil-1-picrilhidrazil (DPPH)
A metodologia de captura de radical livre através do DPPH proposta por Blois (1958) adaptada por Brand-Williams, Cuvelier, Berset (1995) possibilitou a determinação da atividade antioxidante de compostos, evidenciando a presença da ação antioxidante através da alteração organolética da cor através de análise de absorbância lida sob filtros do intervalo de 515 – 520 nm (SÁNCHEZ-MORENO; LARRAURI; SAURA-CALIXTO, 1998).
Por se tratar de um radical livre, durante todo o experimento, o processo de manipulação foi realizado em ambiente escuro ao abrigo da luz. Neste método, a substância antioxidante sequestra os radicais livres causando diminuição da coloração conforme ocorre a reação com a espécie antioxidante (RUFINO et al, 2007).
Para o preparo, pesou-se 22 mg de DPPH e diluído em 200ml na proporção de 100ml de etanol + 100ml de metanol, e reservado em frasco âmbar coberto com papel alumínio.
4.4.1.3 ɑ-Tocoferol (vitamina E)
Inicialmente se fez necessário a preparação de uma solução mãe. Pesou-se 20 mg de tocoferol diluído em 1 ml de Tween, em seguida foi sendo adicionado mais 4ml lentamente utilizando um banho de ultrassom para facilitar a homogeneização. Logo após foram pipetados 500ul e 50 ul desta solução e aliquotados em frascos âmbar separados, n°1 e n° 2. O próximo passo foi acrescentar respectivamente mais 500ul de água destilada no frasco 1 e mais 950 ul de água destilada no frasco 2, obtendo-se suas respectivas concentrações de 50ug/ml e 5ug/ml.
4.4.1.4 Controle positivo
Para o controle positivo do teste utilizou-se o tocoferol nas duas concentrações acima descritas.
4.4.1.5 Controle negativo
Para o controle negativo, utilizou-se 1950ul de DPPH mais 50ul de água destilada.
4.5.2 Protocolo para o ensaio de atividade antioxidante
O ensaio foi realizado em triplicata conforme descrito no esquema abaixo em que apresenta a disposição dos tubos durante as reações:
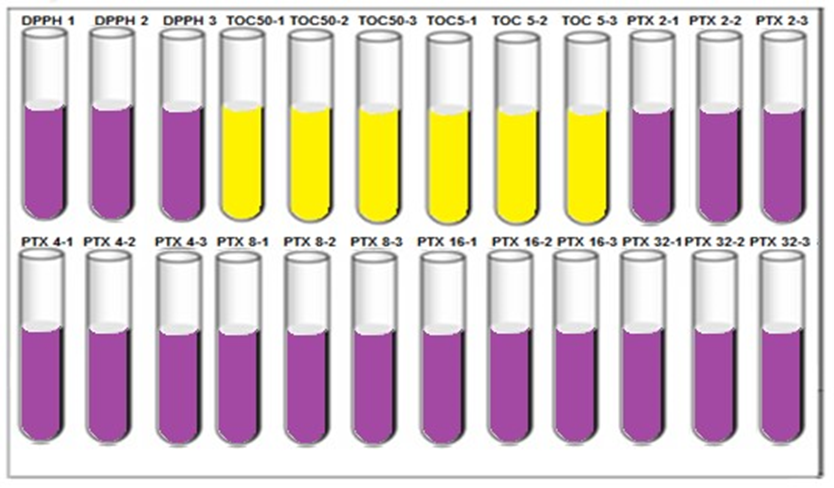
Figura 8: Disposição dos tubos de ensaio para o ensaio da atividade antioxidante- DPPH (2,2-difenil-1-picrilhidrazil); TOC: Tocoferol; PTX: Pentoxifilina. Fonte: original.
O volume final estabelecido para cada tubo foi de 2ml. Logo, para cada tubo foram pipetados 1950ul de DPPH adicionando 50ul de seus respectivos reagentes nas suas devidas concentrações. Posteriormente, procedeu-se com as leituras em espectrofotômetro utilizando-se cubetas de Quartzo com capacidade de 2 ml. As leituras foram realizadas sob filtro de 517nm, efetuando uma nova leitura em intervalos de tempo definidos em 15 minutos, 30 minutos e 60 minutos.
O procedimento foi repetido em dia posterior para dar confiabilidade aos resultados encontrados e analisar o potencial de aumento ou diminuição da atividade antioxidante da droga em teste.
4.6 Cálculo do percentual de atividade antioxidante (%AA)
Para o cálculo da atividade antioxidante foi utilizada a metodologia adaptada de Rufino et al. (2007) e Sousa et al. (2007). A técnica baseia-se na redução do radical livre DPPH por uma espécie antioxidante, neste caso da pentoxifilina. Se a pentoxifilina apresentar capacidade de reduzir a espécie oxidante, ocorre a alteração de cor do mesmo da cor púrpura para a coloração amarela, ocasionada pela formação de difenil-picril-hidrazina, resultante da reação de redução.
Para o cálculo propriamente foi utilizada a seguinte equação:

Em que:
Acontrole(-) = Absorbância da solução de DPPH sem a amostra.
Aamostra = absorbância da amostra com o DPPH.
4.7 Análise e apresentação dos dados
A análise estatística dos dados será realizada através do software GraphPad Prism versão 5.0 para Windows (GraphPad Software, San Diego California EUA). Os resultados que obedecem a uma distribuição paramétrica serão analisados por Análise de Variância (ANOVA) seguido pelo teste de Student Newman Keuls (post hoc), sendo os valores representados pela Média ± Erro Padrão da Média (EPM). Os dados não-paramétricos serão analisados pelo mesmo programa utilizando o teste Kruskal-Wallis seguido pelo teste de Dunns (post hoc), sendo os valores representados como mediana + valor mínimo – valor máximo. O critério de significância a ser utilizado será p < 0,05.
5 RESULTADOS
5.1 Resultados da análise da primeira análise
Os resultados encontrados foram obtidos através de duas análises realizadas em dois dias diferentes obedecendo à uma ordem de leituras de absorbâncias em intervalos de 15 minutos, 30 minutos e 60 minutos, correspondente à atividade antioxidante da Pentoxifilina sobre o DPPH. Para a primeira análise, os resultados obtidos foram os seguintes:
Tabela 1: Valores de absorbância obtidos nas análises em triplicata nos primeiros 15 minutos.
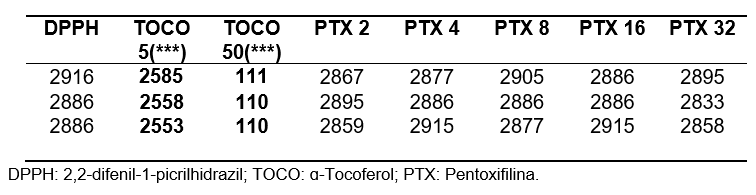
Tabela 2: Análise estatística pela média, desvio padrão, erro padrão e %AA para etapa de 15 minutos.
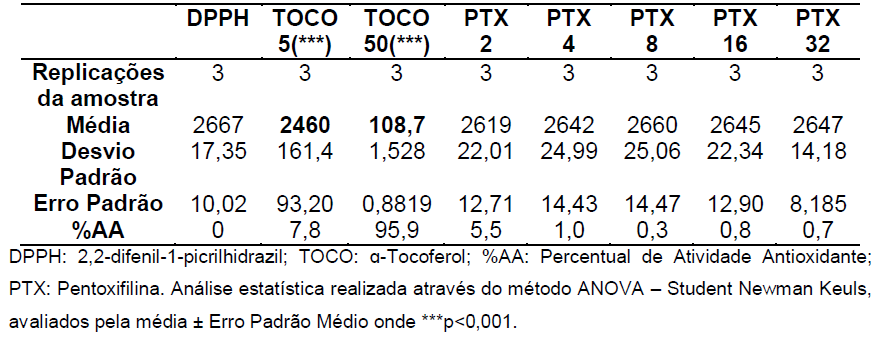
Gráfico 01: Análise da atividade antioxidante da Pentoxifilina após 15 minutos.
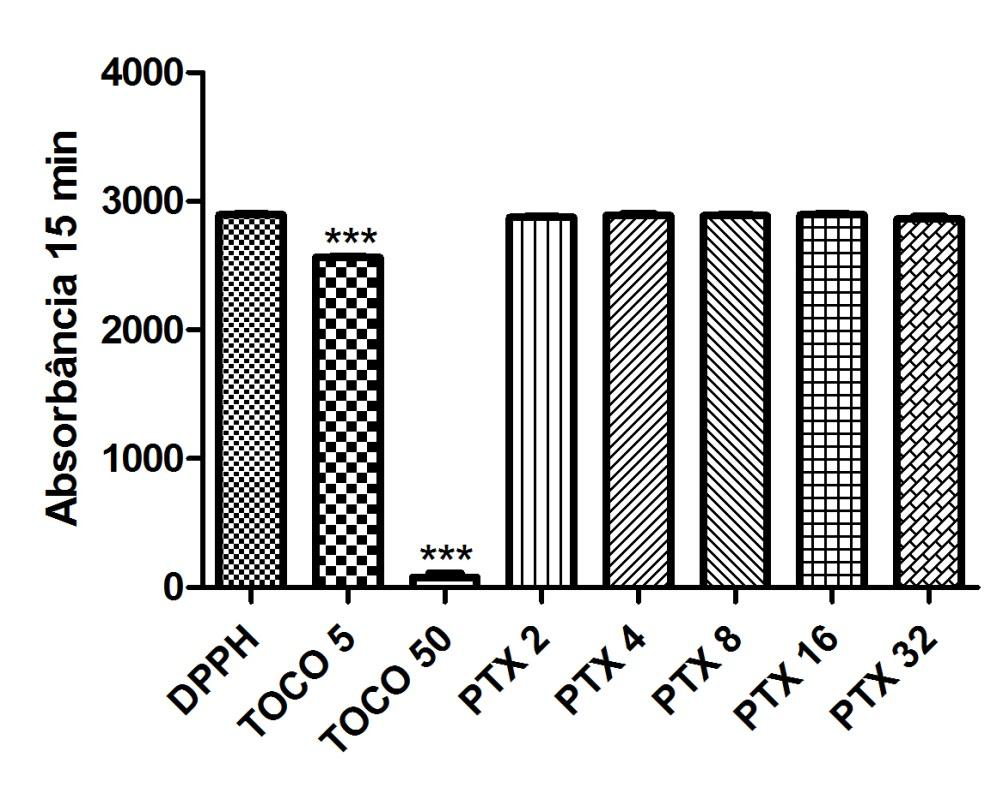
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
Gráfico 02: Percentual Antioxidante da Pentoxifilina após 15 minutos.
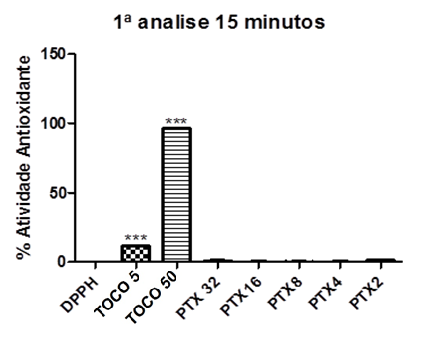
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
Os resultados obtidos da análise com 30 minutos de interação da Pentoxifilina sobre o DPPH foram os seguintes:
Tabela 3: Valores de absorbância obtidos nas análises em triplicata após 30 minutos.
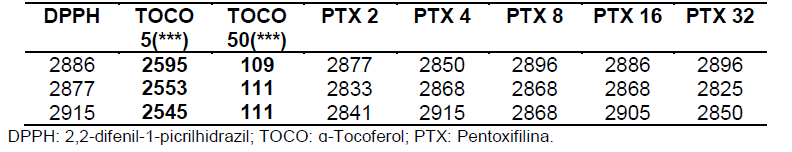
Tabela 4 etapa de 30 minutos.
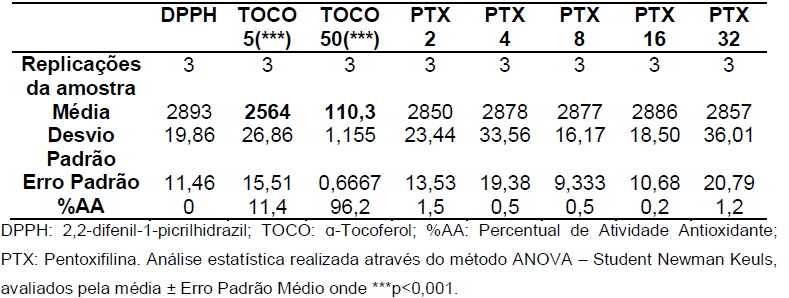
Gráfico 03: Análise da atividade antioxidante da Pentoxifilina após 30 minutos.
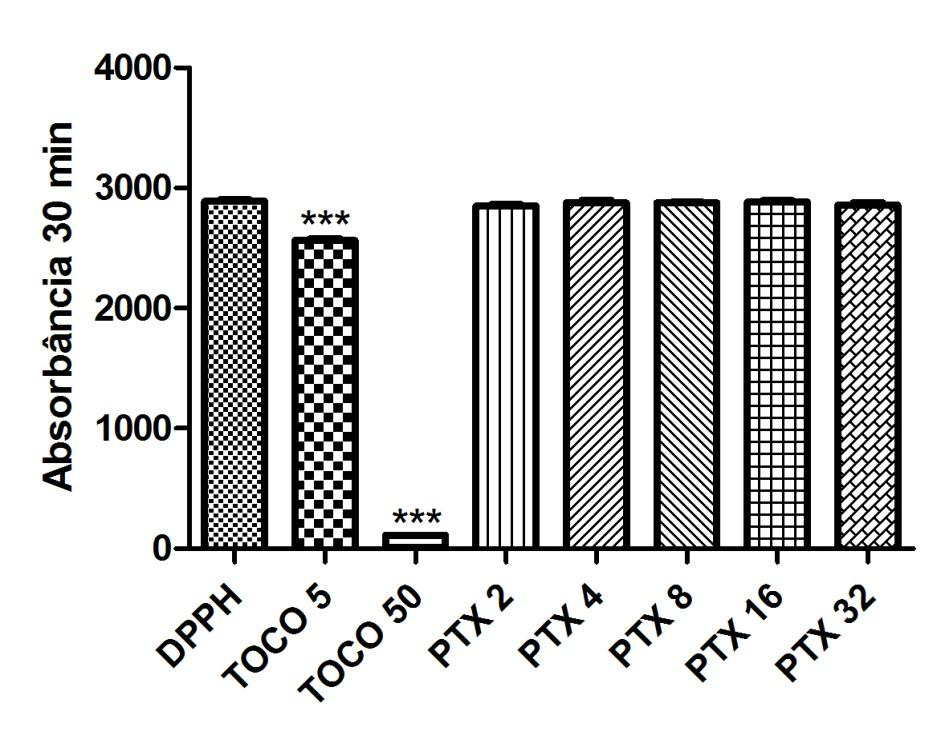
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
Gráfico 04: Percentual Antioxidante da Pentoxifilina após 30 minutos.
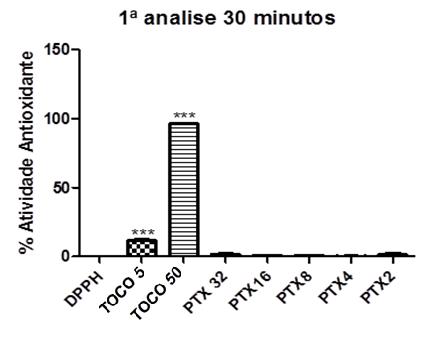
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
Os resultados obtidos da análise com 60 minutos de interação da Pentoxifilina sobre o DPPH foram os seguintes:
Tabela 5: Valores de absorbância obtidos nas análises em triplicata após 60 minutos.
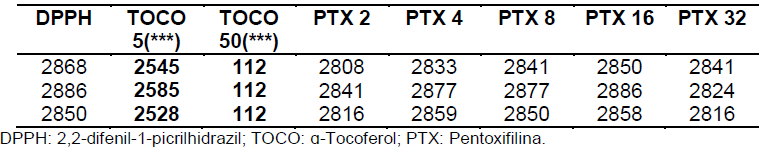
Tabela 6 etapa de 60 minutos.
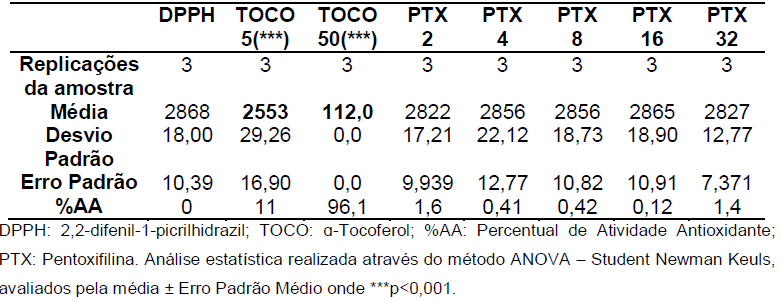
Gráfico 05: Análise da atividade antioxidante da Pentoxifilina após 60 minutos.
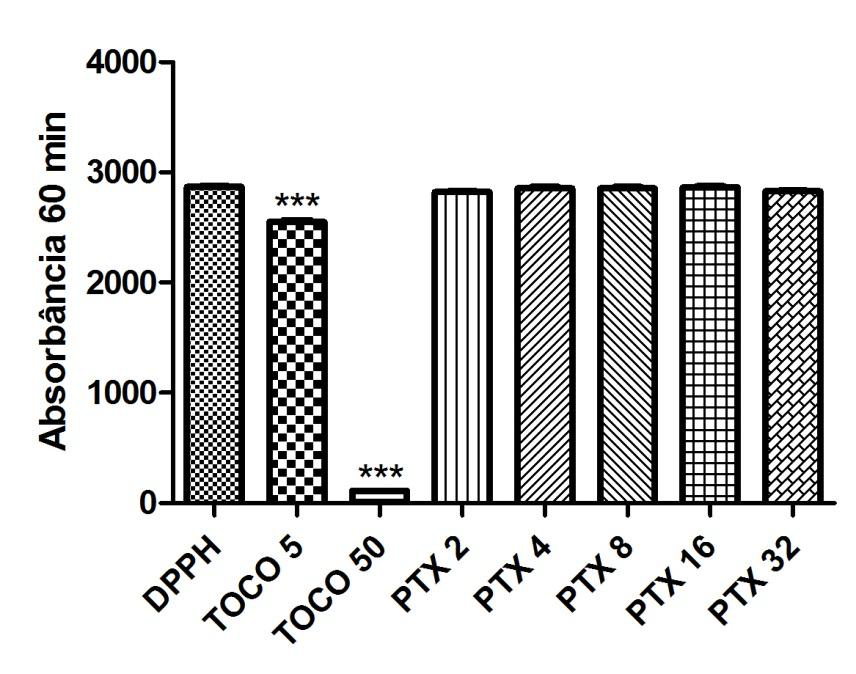
Gráfico 06: Percentual Antioxidante da Pentoxifilina após 60 minutos.
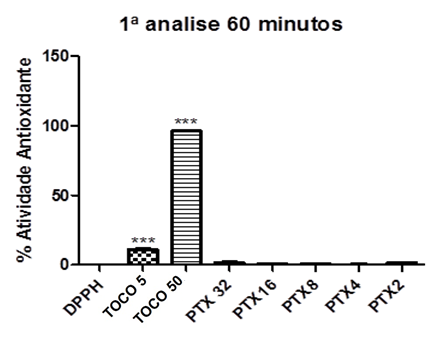
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
5.2 Resultados da segunda análise
Os resultados encontrados para a segunda análise foram obtidos também obedecendo às leituras efetuadas em 15 minutos, 30 minutos e 60 minutos, correspondente à atividade antioxidante da Pentoxifilina sobre o DPPH. Para as análises do segundo momento, os resultados obtidos foram os seguintes:
Tabela 7: Valores de absorbância obtidos nas análises em triplicata após 15 minutos (segundo dia).
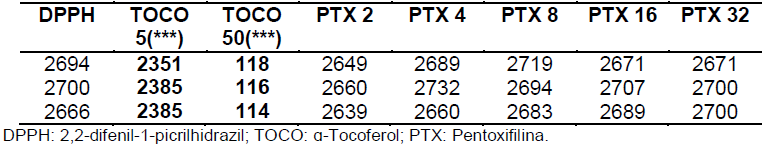
Tabela 8 etapa de 15 minutos (segundo dia).

Gráfico 07: Análise da atividade antioxidante da Pentoxifilina no segundo dia após 15 minutos.
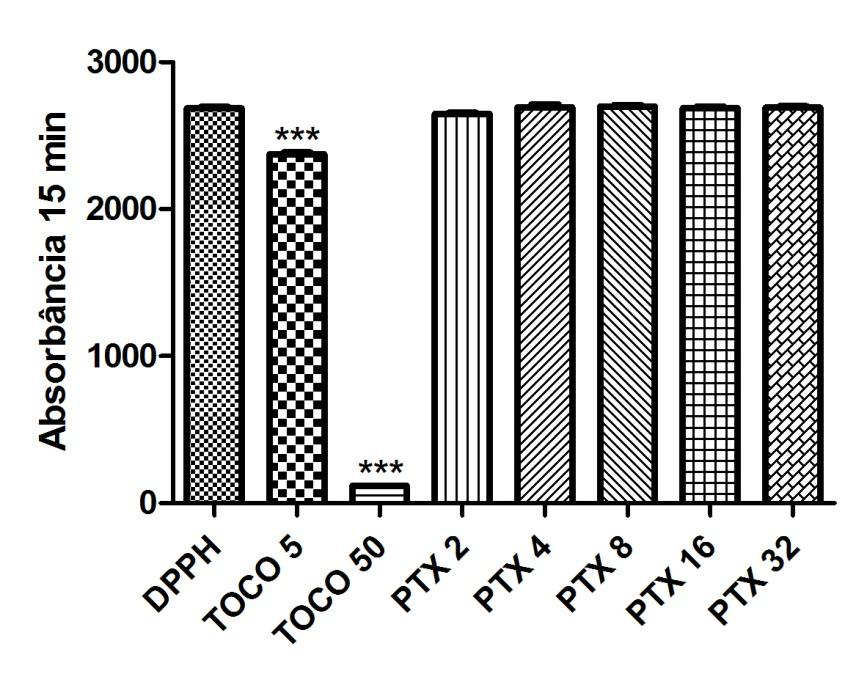
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
Gráfico 08: Percentual Antioxidante da Pentoxifilina após 15 minutos (segundo
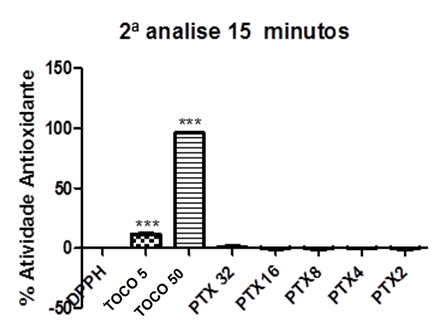
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
Os resultados obtidos da segunda análise no segundo momento, com 30 minutos de interação da Pentoxifilina sobre o DPPH foram os seguintes:
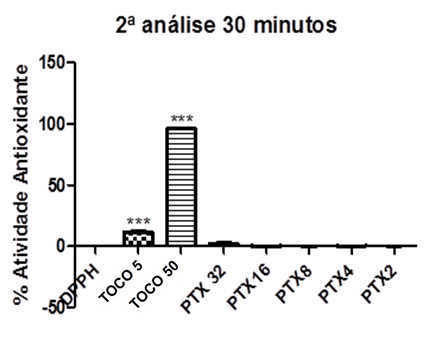
Tabela 9: Valores de absorbância obtidos nas análises em triplicata após 30 minutos (segundo dia).
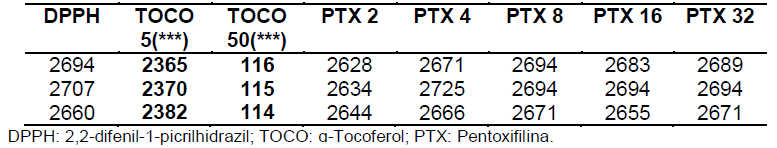
Tabela 10: Análise estatística pela média, desvio padrão, erro padrão e %AA para a etapa de 30 minutos (segundo dia).
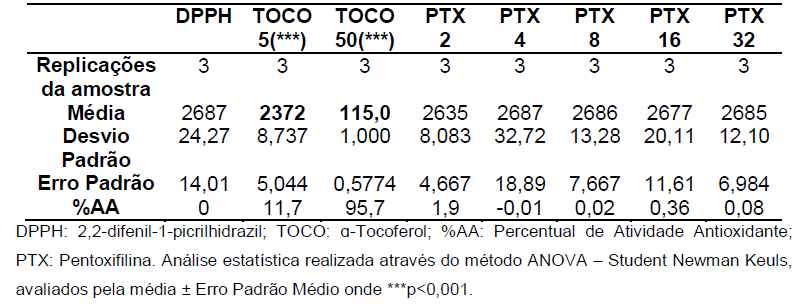
Gráfico 09: Análise da atividade antioxidante da Pentoxifilina no segundo dia após 30 minutos.
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
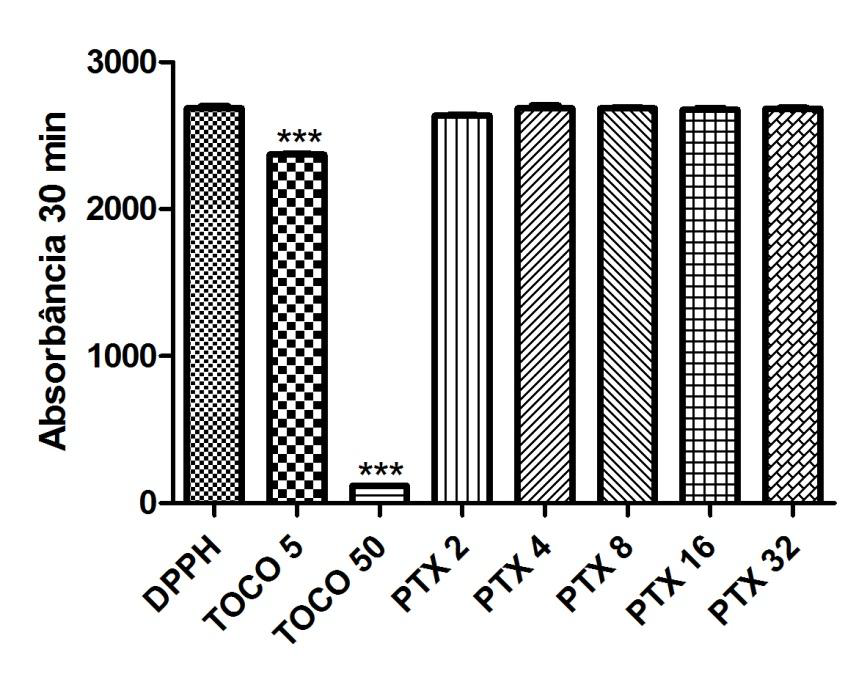
Gráfico 10: Percentual Antioxidante da Pentoxifilina após 30 minutos (segundo
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
Os resultados obtidos da terceira análise no segundo momento, com 60 minutos de interação da Pentoxifilina sobre o DPPH foram os seguintes:
Tabela 11: Valores de absorbância obtidos nas análises em triplicata após 60 minutos (segundo dia).
Tabela 12: Análise estatística pela média, desvio padrão, erro padrão e %AA para a etapa de 60 minutos (segundo dia).
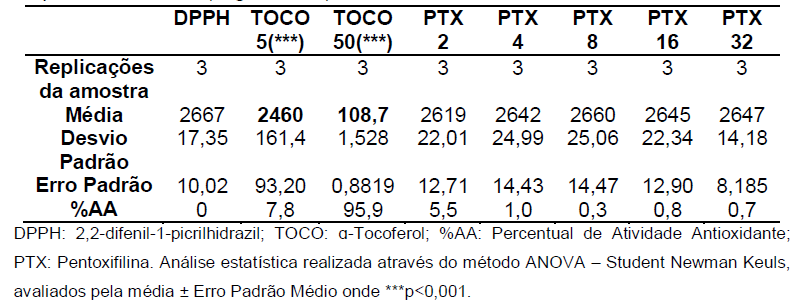
Gráfico 11: Análise da atividade antioxidante da Pentoxifilina no segundo dia após 60 minutos.
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
Gráfico 12: Percentual Antioxidante da Pentoxifilina após 60 minutos (segundo
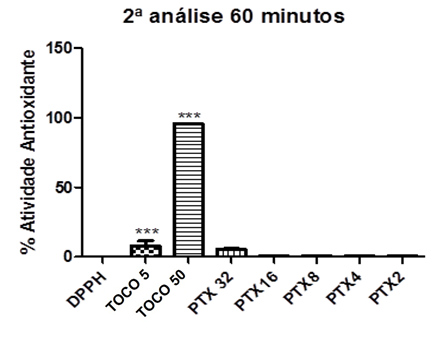
Controle negativo: solução de DPPH com água destilada; Controle positivo: Tocoferol 5µg/ml e Tocoferol 50µg/ml; (Pentoxifilina) concentrações analisadas: 200, 400, 800, 1600, 3200µg/ml. Análise estatística realizada através do método ANOVA – Student Newman Keuls, avaliados pela média ± Erro Padrão Médio onde ***p<0,001.
6 DISCUSSÃO
Analisando os resultados é possível verificar que a presença de atividade antioxidante só foi evidenciada nas soluções contendo ɑ-tocoferol (5 e 50 ug/ml) que foi usado no experimento como controle positivo por já se ter o conhecimento de sua capacidade de neutralizar radicais livres (IGIELSKA K. J.; GOŚCIAŃSKA, J.; NOWAK, I., 2015 ).
Na etapa de análise de percentual de atividade antioxidante (%AA), verificou-se que alguns valores apresentaram-se negativos. Em estudos que avaliam o potencial antioxidante de extratos como o de RABELO et al. (2014), sugere-se que quando o %AA fica negativo este efeito pode estar relacionado a substâncias contidas no extrato que possam ter uma possível atividade pró-oxidante. Como a Pentoxifilina não se trata de um extrato e o resultado negativo não se repete nas duas análises e nem na triplicata, suspeita-se que este efeito seja atribuído a erros de pipetagem.
A pentoxifilina (droga teste), nas variadas concentrações testadas, não apresentou atividade significativa para o efeito antioxidante investigado. Por mais que as leituras tenham sido realizadas em dois momentos diferentes, com o propósito de confirmar o resultado obtido durante a primeira análise experimental. Dessa forma, Mickalad et al. (2000), analisou as propriedades antioxidantes de Antiinflamatórios não esteroidais (AINES) através de um estudo in vitro, e concluiu que os AINES possuem níveis variáveis de atividade antioxidante que estão relacionados à sua capacidade de interação com o ácido hipocloroso (HOCl), na peroxidação lipídica ou na reação com peroxinitritos (ONOO-).
Nesse contexto, pode-se enfatizar que nesta modalidade de neutralização de espécies reativas, ou seja, de forma direta, a pentoxifilina não demonstrou ação antioxidante, talvez por não ser capaz de neutralizá-las diretamente. Logo, sugerese que sua ação antioxidante deve ser investigada através de outros métodos indiretos, já que a mesma possui atividade anti-inflamatória por inibir citocinas e fatores inflamatórias como Fator de Necrose Tumoral Alfa (TNF-ɑ), proteína C reativa, aderência de neutrófilos e atuação na elevação dos níveis de AMPc (Adenosina Monofosfato cíclica) em células imunoreguladoras (HEN-I, et al., 2004; CARNEIRO et al., 2005; GOICOECHEA et al, 2012; SCHWAB, S. et al., 2015).
Neste sentido, Bah (2011) realizou um estudo do potencial antidepressivo da pentoxifilina em um modelo de infarto agudo do miocárdio e concluiu que a pentoxifilina reduziu as concentrações plasmáticas de Interleucina 1 beta nos ratos tratados, revertendo significativamente o comportamento depressivo ocasionado em ratos após a indução de infarto agudo do miocárdio.
Por se tratar de um fármaco derivado das xantinas, correlacionamos outros estudos que pesquisam o potencial antioxidante desta classe, como o de CHEN et al., (2014), que estudou os efeitos antioxidantes de uma substância, o 1-hidroxil-4oxociclohexil (HOEC) – acetato de cafeína. O referido estudo evidenciou que o derivado caféico possui atividade antioxidante, por ter aumentado a viabilidade celular e inibir apoptose. Além disso, o éster caféico, reduziu o acúmulo intracelular de radicais livres e malonaldeído (MDA), restaurando as funções das enzimas antioxidantes Superóxido Dismutase (SOD) e Glutationa Redutase (GR).
Existem outros estudos que investigaram o potencial antioxidante dessa classe (SENCHINA, et al. 2014; ZHAO et al., 2015). Em outro deles, cientistas pesquisaram a ação adjuvante da cafeína, que também é uma xantina, sobre o tratamento de transtorno depressivo, submetendo ratos a modelos de nado forçado, por se tratar de uma das metodologia de geração de estresse oxidativo conforme Smith e Mukkadan, (2014). Após a geração de estresse nos animais, os mesmos foram tratados com cafeína como um adjuvante de um fármaco antidepressivo e outro grupo apenas com a cafeína. O melhor resultado foi referenciado ao grupo que foi tratado de forma combinada utilizando a cafeína juntamente com a duloxetina, aumentando significativamente as monoaminas serotoninérgicas na região do córtex ao fazer uma comparação com o grupo tratado apenas com o antidepressivo sem a cafeína (KALE; ADDEPALLI, 2015).
Nessas circunstâncias, na avaliação da pentoxifilina (PTX) em isquemia hepática de reperfusão realizada por Santos, et al. (2015), investigaram a adição da PTX à Solução Salina Hipertônica (SSH), com a finalidade de avaliar se na prevenção de lesões hepáticas de reperfusão, SSH teria atividade profilática sozinha, superior a da PTX, ou se a adição da mesma apresentaria melhores resultados. Os resultados obtidos fizeram concluir que a adição da PTX a SSH, diminuiu significativamente TNF-ɑ, 30 minutos após a reperfusão, além de diminuir ALT (alanina aminotransferase), AST (aspartato aminotransferase), IL-6 (interleucina), disfunção mitocondrial e mieloperoxidase pulmonar, tudo isso pela inibição do estresse oxidativo.
A pentoxifilina possui efeito neuroprotetor em modelos animais de convulsão induzido por pilocarpina. Neste modelo foi possível verificar morte neuronal em importantes áreas cerebrais e foi possível encontrar aumento nos níveis de TNF-ɑ no hipocampo através de ensaio de imunohistoquímica. Os grupos previamente tratados com pentoxifilina tiveram uma redução nos níveis de TNF-ɑ e culminou com redução dos níveis de lesão celular ocasionado pela redução do estresse oxidativo, consequentemente, um efeito antioxidante de forma indireta, pelo impedimento da depleção de dopamina e serotonina no corpo estriado e hipocampo, ocasionados nas crises convulsivas (CUNHA et al., 2000; TARIQ et al., 2008; SIQUEIRA, 2011).
Dessa forma, as funções do TNF-ɑ sobre o organismo seguem resumidamente de promover resposta imunológica e inflamatória, explicada pelo estímulo para a secreção de quimiocinas, ocasionando o recrutamento de monócitos e neutrófilos para o local da inflamação estimulando degranulação leucocitária, além de ativar os mecanismos de apoptose, e consequentemente a formação de radicais livres (VITALE; RIBEIRO, 2007; CRUVINEL et al., 2010).
Com a inibição do TNF-ɑ promovida pela pentoxifilina, o processo inflamatório é inibido por esta via, inibindo a formação de radicais livres e diminuindo os efeitos dessas espécies reativas sobre os tecidos. Logo, deve ser levada em conta a hipótese da capacidade antioxidante da Pentoxifilina de forma indireta, mas que necessita de uma melhor investigação por outros métodos in vitro ou in vivo que confirmem esta hipótese.
7 CONSIDERAÇÕES FINAIS
A busca por drogas com potencial antioxidantes tem sido cada vez mais investigada no mundo, dado a sua correlação com várias patologias existentes. A capacidade de lesionar os mais variados tecidos do organismo, atribuída aos radicais livres é uma condição que pode causar o desenvolvimento de doenças crônicas que podem diminuir a qualidade de vida da população.
A capacidade da pentoxifilina em inibir o TNF-ɑ, pela via imunológica, fortalece a premissa de que esta substância possa ter um potencial antioxidante, mas carece de estudos mais aprofundados que confirmem a hipótese.
É por interferir na imunomodulação que a pentoxifilina pode atuar na redução da geração de radicais livres, o que leva indiretamente a um menor consumo de enzimas antioxidantes endógenas ou exógenas, causando um aumento nos níveis e na estabilidade da atividade destas espécies antioxidantes.
Nessas circunstâncias, observa-se que a pentoxifilina na modalidade de experimento deste trabalho, não foi capaz de neutralizar os radicais livres. Neste caso, não se pode fazer uma análise conclusiva sobre a atividade investigada. Nessas condições, não se pode, também, dizer que a pentoxifilina tem atividade prooxidante porque o %AA negativo se repete poucas vezes e não coincide nas duas análises, atribuindo-se este efeito mais a um erro humano.
Dessa forma, por ser um fármaco de uso relativamente seguro e já ser utilizado em humanos, podemos elencar como a próxima etapa deste estudo com melhor aprofundamento na modalidade in vivo, determinando as concentrações de algumas enzimas antioxidantes endógenas como, por exemplo, superóxido dismutase, catalase, glutationa peroxidase, após o tratamento com o uso deste fármaco.
REFERÊNCIAS
AHERNE, S. A.; O’BRIEN, N. M. Dietery flavonols: chemistry, food content, and, metabolism. Nutrition, v. 18, n. 1, p. 75-87, 2002.
BABIOR, B. M. Superoxide: a two-edged sword. Brazilian Journal Of Medical and Biological Research, v. 30, n. 2, p. 141-155, 1997.
BARBOSA, K. B. F. et al. Estresse oxidativo: conceito, implicações e fatores modulatórios. Revista de Nutrição, v. 23, n. 4, p. 629-643, 2010.
BARP, J. Avaliação do dano oxidativo e função cardiovascular em diferentes modelos de hiperhomocisteinemia: papel protetor do folato e do estrogênio. 2007. 131 f. Tese (Doutorado em Ciências Biológicas) Programa de Pós-Graduação em Ciências Biológicas, Universidade Federal do Rio Grande do Sul, Porto Alegre, 2007.
BAH,T.M. et al. Pretreatment with pentoxifylline has antidepressant-like effects in a rat model of ocute myocardial infarction. Behavioural Pharmacology. v. 22, n. 8, p. 779-84, 2011.
BEDARD, K.; KRAUSE, K.H. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology. Physiological Reviews, v. 87, n. 1, p. 245-313, 2007.
BERRA, C. M., MENCK, C. F. M., MASCIO, P. D. Estresse oxidativo, lesões no genoma e processos de sinalização no controle do ciclo celular. Química Nova, v. 29, n. 6, p. 1340-1344, 2006.
BIANCHI, M. L. P.; ANTUNES, L. M. G. Radicais livres e os principais antioxidants da dieta. Revista de Nutrição, v. 12, n. 12, p. 123-130, 1999.
BRAND-WILLIAMS, W.; CUVELIER, N. E.; BERSET, C. Use of a free radical method to evaluate antioxidant activity. Food Science and Technology LebensmittelWissenschaft & Technologie, v. 28, n.1, p. 25-30, 1995.
CARNEIRO, S.C.S. et al. Ação da pentoxifilina nos dendrócitos FXIIIA de placas de psoríase. Anais Brasileiros de Dermatologia, v. 80, n. 3, p. S314-322, 2005.
CERQUEIRA, F. M.; MEDEIROS, M. H. G.; AUGUSTO, O. Antioxidantes dietéticos: controvérsias e perspectivas. Química Nova, v. 30, n. 2, p. 441-119, 2007.
CHEN, B. et al. Protective effects of (E)-2-2(1-hydroxyl-4-oxocyclohexyl) ethyl caffeine against hydrogen peroxide-induced injury in PC12 cells. Neurochemical Research, v. 40, n. 3, p. 531-541, 2014.
CLARCKSON, P. M.; THOMPSON, H. S. Antioxidants: what role do they play in physical activity and health? The American Journal of Clinical Nutrition, v. 72, n. 2, p. 637-646, 2000.
CRUVINEL, W. M. et al. Sistema imunitário – parte I. Fundamentos da imunidade inata com ênfase nos mecanismos moleculares e celulares da resposta inflamatória.Revista Brasileira de Reumatologia, v. 50, n. 4, p. 116-130, 2010.
DJORDJEVIC, V. B. Free radicals in cell biology. International Review of Citology, v.237, n. 1, p. 57-89, 2004.
EREN, I.; NAZIROGLU, M.; DEMIRDAS, A. Protective effects of lamotrigine, aripiprazole andescitalopram on depression-induced oxidative stress in rat brain. Neurochemical Research, v. 32, n. 1, p. 1188-1195, 2007.
FERNANDES, J. L. Pentoxifilina reduz a atividade pró-inflamatória e aumenta a atividade anti-inflamatória em pacientes com doença arterial coronária: um estudo duplo cego, randomizado e controlado por placebo. 2006. 68 f. Tese (Doutorado em Ciências) Faculdade de Medicina, Universidade de São Paulo, São Paulo, 2006.
FREY, B.N. et al. Effects oflithium and valproate on amphetamine-induced oxidative stress generation in an animalmodel of mania. Journal of PsychiatryNeuroscience, v. 31, n. 1, p. 326-332, 2006a.
FREY B. N. et al. Increased oxidative stress in submitochondrial particles after chronic amphetamineexposure. Brain Research, v. 1097, n. 1, p. 224-229, 2006b.
FERREIRA, A. L. A.; MATSUBARA, L. S. Radicais livres: conceitos, doenças relacionadas, sistema de defesa e estresse oxidativo. Revista da Associação Médica do Brasil, v. 43, n. 1, p. 61-68, 1997.
FOKSINSKI, M. et al. Effects of basal level of antioxidants on oxidative DNA damage in humans. European Journal of Nutrition, v. 46, n. 1, p. 174-180, 2007.
GACKOWSKI, D. et al. Oxidative stress and oxidativeDNA damage is characteristic for mixed Alzheimer disease/vascular dementia. Journal of the Neurological Sciences, v. 266, n. 1-2, p. 57-62, 2008.
GOICOECHEA,M. et al. Effects of pentoxifylline on inflammatory parameters in chronic kidney disease patients: a randomized trial. Journal of Nephrology, v. 25, n. 6, p. 969-975, 2012.
HALLIWELL, B.; GUTTERIDGE, J. M. C.; CROSS, C. E.; Free radicals, antioxidants and human disease: where are we now?Journal of Laboratory and Clinical Medicine, v. 119, n. 6, p. 598-620, 1992.
HEN-I, L.et al. Pharmacological modulation of TNF production in macrophages. Journal of Microbiology Immunology and Infection. v. 37, p. 8-15, 2004.
IGIELSKA, K. J.; GOSCIANSKA, J.; NOWAK, I. Carotenoids as natural antioxidants. Postępy Higieny i Medycyny Doświadczalnej (on line), v. 69, n. 0, p. 418-428.
KALE, P. P.; ADDEPALLI, V. Enhancement of nootropic effect of duloxetine and bupropion by caffeine in mice. Indian Journal of Physiology and Pharmacology, v. 47, n. 2, p. 199-201, 2015.
KING, J. C.; SHAMES, D. M.; WOODHOUSE, L. Zinc homeostasis in humans. The Journal of Nutrition, v. 130, n. 5, p. 1360S-1366S, 2000.
KOROLKOVAS, A.; FRANÇA, F. F. A. C.; CUNHA, B. C. A. Dicionário Terapêutico Guanabara. 17 ed. Rio de Janeiro: Guanabara Koogan, 2010.
KOURY, J. C.; DONANGELO, C. M. Zinco, estresse oxidativo e atividade física. Revista de Nutrição, v. 16, n. 4, p. 433 – 441, 2003.
KRUK, I. et al. Studies on the antioxidant activity of some chromonylrhodanine derivatives. Luminescence, v. 10, n. 1002, 2014.
LIN, H. et al. Pharmacological modulation of TNF production in macrophages.
Journal of Microbiology, Immunology and Infection, v.37, n. 1, p. 8-15, 2004.
LUCCA, G. Estudo dos efeitos comportamentais e neuroquímicos do modelo animal de depressão baseado no paradigma do estresse crônico leve e variado. 2008. 117 f. Dissertação (Mestrado em Ciências da Saúde) Programa de Pós-graduação em Ciências da Saúde. Universidade do Extremo Sul Catarinense, Criciúma, 2008.
MAES, M. et al. A review on the oxidative and nitrosative stress (O&NS) pathways in major depression and their possible contribution to the (neuro)degenerative processes in that illness.Progress in Neuro-Psychopharmacology & Biological Psychiatry, v. 35, n. 3, p. 676-692, 2011.
MAYNE, S. T. Antioxidant nutrients and chronic disease: use of biomarkers of exposure and oxidative stress status. Epidemiologic Research, v. 133, n. suppl 3, p. 933-940, 2007.
MÉNDEZ, B. M. Pentoxifilina en dermatologia. Dermatología Peruana, v. 13, n. 3, 2003.
MCCORD, J. M.; FRIDOVICH, I. Superoxide dismutase: an enzymic function for erythrocuprein (hemocuprein). The Journal of Biological Chemistry, v. 244, n. 22, p. 6049-6055, 1969.
OGA, S.; CAMARGO, M. M. A.; BATISTUZZO, J. A. O. Fundamentos de Toxicologia. 3.ed. São Paulo: Atheneu Editora, 2008. 677p.
PALACE, V. P. et al. Antioxidant potentials of vitamin A and carotenoids and their relevance to heart disease. Free Radical Biology & Medicine, v. 26, n. 5-6, p. 746761, 1999.
PIETTA, P. Flavonoids as antioxidants. Journal of Natural Products, v. 63, n. 7, p. 1035-1042, 2000.
POWER, S. R. The antioxidant properties of zinc. The Journal of Nutrition, v. 130, n. 5, p. 1447S-1454S, 2000.
PRASAD, A. S. et al. Zinc supplementation decreases incidence of infections in the elderly: effect of zinc on generation of cytokines and oxidative stress. The American Journal of Clinical Nutrition,v. 85, n. 3, p. 837-844, 2007.
RABELO, S. V. et al. Atividade antioxidante e antimicrobiana de extratos de atemoia (Annona cherimola Mill. X A. squamosa L.). Revista Brasileira de Fruticultura, v.
36, n. edição especial, p. 265-271, 2014.
RANG, H.P. et al. Farmacologia. 6. Ed. Rio de Janeiro: Elsevier, 2007.
RIENECK,K. et al.In vitro immunomodulatory effectsof pentoxifylline.Immunology Letters, v.37, n. 2-3, p. 131-138, 1993.
RODRIGO, R.; GUICHARD, C.; CHARLES, R. Clinical pharmacology and therapeutic use of antioxidant vitamins. Fundamental & Clinical Pharmacology, v. 21, n. 2, p. 111-127, 2007.
RUFINO, M. S.M. et al. Metodologia científica: determinação da atividade antioxidante total em frutas pela captura do radical livre DPPH. Comunicado Técnico On Line, p. 1679-6535, 2007.
SANTOS, R. V. et al. Pentoxifylline enhances the protective effects of hypertonic saline solution on liver ischemia reperfusion injury through inhibition of oxidative stress. Hepatobiliary & Pancreatic Diseases International, v.14, n. 2, p. 194-200, 2015
SÁNCHES-MORENO, C; LARRAURI, J.A.; SAURA-CALIXTO, F. A procedure to measure the antiradical efficiency of polyphenols. Journal of the Science of Food and Agriculture, v. 76, p. 270-276, 1998.
SCHNEIDER C. D.; OLIVEIRA A. R. Radicais livres de oxigênio e exercício:
mecanismos de formação e adaptação ao treinamento físico. Revista Brasileira de Medicina do Esporte, v. 10, n. 10, p. 308-313, 2004.
SCHWAB, S. et al. Vitamin E supplementation is associated with lower of C-reactive protein only in higher dosages and combined with other antioxidants: The cooperative health research in the region of Augsburg (KORA) F4 study. Brazilian Journal of Nutrition, v.21, n. 1, p. 1-10, 2015.
SENCHINA, D. S. et al. Alkaloids and athlete immune function: caffeine, theophylline, gingerol, ephedrine, and their congeners, Exercise Immunology, v. 20, n.1, p. 6893, 2014.
SHAMI, N. J. I. E.; MOREIRA, E. A. M. Licopeno como agente antioxidante. Revista de Nutrição,v. 17, n. 2, p. 227-236, 2004.
SILVA, R. C.; GONÇALVES, A. A. Espécies reativas do oxigênio e as doenças respiratórias em grandes animais. Ciência Rural, v. 40, n. 1, p. 994-1002, 2010.
SMITHA, K. K., MUKKADAN, J. K. Effect of different forms of acute stress in the generation of reactive oxygen species in albino Wistar rats. Indian Journal of Physiology and Pharmacology, v. 58, n. 3, p. 229-232, 2014.
SIQUEIRA, R. M. P. Avaliação do efeito neuroprotetor da pentoxifilina em modelos de convulsão induzidos por pilocarpina e pentilenotetrazol em ratos. 2011. 173 fl. Dissertação (Mestrado em Farmacologia) Programa de Pós-graduação em Farmacologia. Universidade Federal do Ceará, Fortaleza, 2011.
SOUSA, C. M. M. et al.. Fenóis totais e atividade antioxidante de cinco plantas medicinais. Química Nova,v. 30, n. 2, p. 351-355, 2007.
SUDHA, K.; RAO, A.V.; RAO, A. Oxidative stress and antioxidants in epilepsy. Clinica Chimica Acta, v. 303, n. 1-2, p. 19-24, 2001.
SULLIVAN, G. W. et al. Inhibition of the inflammatory action of interleukin-1 and tumor necrosis factor (alpha) on neutrophil function by pentoxifylline. Infection and Immunity,v.56, n.7, p. 1722-1729, 1988.
TARIQ, M. et al. Pentoxifylline ameliorates lithium-pilocarpine induced status apilepticus in Young rats. Epilepsy & Behavior, v.12, n. 3, p. 354-65, 2008.
THERIAULT, A. et al. Tocotrienol: a review of its therapeutic potential. Clinical Biochemistry, v. 32, n. 5, p. 309-319, 1999.
VALKO, M. et al. Free radicals, metals and antioxidants in oxidative stress-induced cancer. Chemico-Biological Interactions, v. 160, n. 1, p. 1-40, 2006.
VASCONCELOS, S. M. L. et al. Espécies reativas de oxigênio e de nitrogênio, antioxidantes e marcadores de dano oxidativo em sangue humano: principais métodos analíticos para sua determinação. Química Nova, v. 30, n. 5, p. 1323-1338, 2007.
VINCENT, H. K.; INNES, K. E.; VINCENT, K. R. Oxidative stress and potential interventions to reduce oxidative stress in overweight and obesity. Diabetes, Obesity and Metabolism, v. 9, n. 6, p. 813-839, 2007.
VITALE, R. F.; RIBEIRO, F. A. Q. O papel do fator de necrose tumoral alfa (TNF-ɑ) no processo de erosão óssea presente no colesteatoma adquirida da orelha média. Revista Brasileira de Otorrinolaringologia, v. 73, n. 1, p. 37-56, 2007.
VOLLARD, N. B. J.; SHEARMAN, J. P.; COOPER, C. E. Exercise-induced oxidative stress. Myths, realities and physiological relevance. Sports Medicine, v. 35, n. 12, p. 1045-1062, 2005.
ZHAO, E. H.; ERGUL, B.; ZHAO, W. Caffeine’s Antioxidant Potency Optically Sensed with Double-Stranded DNA-Encased Single-Walled Carbon Nanotubes. Journal Physiology Chemical, v. 119, n. 10, p. 4068-1075, 2015.
1Farmacêutico Clínico Mestrando em Gestão de Cuidados de Saúde – MUST University
2 Doutorado em Farmacologia
3Farmacêutica Clínica
4Doutorado em Farmacologia – UNIVERSIDADE FEDERAL DO CEARÁ
