INFLUENCE OF OBESITY AND CHANGES IN THE INTESTINAL MICROBIOTA ON THE DEVELOPMENT OF COLORECTAL CANCER
REGISTRO DOI:10.5281/zenodo.8423648
Alexandre Pereira Brás Abreu
Artur Conti Burigo
RESUMO
Este trabalho busca apresentar as intersecções entre a tríade obesidade, microbiota intestinal e câncer colorretal. Com isso, foi traçada a partir de uma extensa revisão na literatura científica dos últimos 10 anos nas bases de dados PubMed e SciELO. Foi utilizado como norteadoras as seguintes palavras-chaves: disbiose, carcinogênese colorretal, estado obeso, metabolismo, fatores de proteção, fatores de risco. Também foram aplicados os operadores booleanos and, or e not para auxílio e ampliação de resultados. Serão discutidos os pontos em comum mais importantes entre as três variáveis em questão, inclusive apresentando os principais resultados sintetizados em tabelas e figuras. Sendo assim, a obesidade tem relações diretas e indiretas com a carcinogênese colorretal, podendo ser por intermédio de alterações no microbioma intestinal (os principais micróbios e os mecanismos pelos quais eles levam à formação do câncer). Além disso, o estudo tem como objetivo oferecer insights para novas pesquisas e que o tema seja mais aprofundado para que no futuro possa servir de base ao desenvolvimento de intervenções práticas ao câncer colorretal e à obesidade.
Palavras-chave: Disbiose, carcinogênese colorretal, estado obeso, metabolismo, fatores de proteção, fatores de risco
ABSTRACT
This work aims to present the intersections between the obesity, intestinal microbiota, and colorectal cancer triad. To do so, an extensive review of the scientific literature from the past 10 years was conducted using the PubMed and SciELO databases. The following keywords were used as guiding principles: dysbiosis, colorectal carcinogenesis, obese state, metabolism, protective factors, risk factors. Boolean operators such as and, or, and not were also applied to aid in the expansion of results. The most important common points among the three variables will be discussed, including the presentation of key findings synthesized in tables and figures. Therefore, obesity has direct and indirect relationships with colorectal carcinogenesis, potentially through alterations in the intestinal microbiome (the key microbes and the mechanisms by which they contribute to cancer formation). Furthermore, this study aims to provide insights for further research and encourages a more in-depth exploration of the topic, with the hope that it may serve as a foundation for the development of practical interventions for colorectal cancer and obesity in the future.
Keywords: Dysbiosis, Colorectal Carcinogenesis, Obesity Status, Metabolism, Protective Factors, Risk Factors
1 INTRODUÇÃO
Segundo o INCA, 2023, com exceção dos tumores de pele não melanoma, o câncer colorretal (CCR) é o terceiro tipo mais frequente no Brasil. A partir desta alta prevalência, alta morbidade, bem como ser passível de potencial prevenção e cura, ergue-se o interesse para maiores pesquisas de forma a aumentar o conhecimento e a possibilidade de impactar positivamente na saúde de milhões de pessoas mediante conhecimento para prover melhor acesso à saúde.
Embora a incidência desse tipo de câncer varie consideravelmente em diferentes regiões geográficas e grupos étnicos, a sua prevalência tem aumentado significativamente nas últimas décadas. A complexidade multifatorial do CCR torna fundamental a investigação das interações entre diversos fatores de risco, tais como a obesidade e a microbiota intestinal.
Com a popularização do modelo de vida de sociedades industrializadas, há um descuido quanto aos hábitos alimentares e o compromisso com a saúde. A partir disso, constata-se taxas de obesidade cada vez maiores por todo o mundo. Neste prisma, observa-se os dados de 2023 do Ministério da Saúde quanto à obesidade em território brasileiro, onde 6,7 milhões de pessoas são atingidas no Brasil por obesidade leve, moderada ou mórbida, sendo necessário abordagem desta como um problema de saúde pública.
A obesidade é um problema global de saúde pública, afetando indivíduos de todas as idades, gêneros e grupos étnicos. Além de estar associada a várias doenças crônicas, como diabetes tipo 2, doenças cardiovasculares e hipertensão, estudos epidemiológicos têm sugerido que a obesidade também desempenha um papel significativo no desenvolvimento do câncer colorretal. Apesar da obesidade ser reconhecidamente um fator de risco modificável ao desenvolvimento do câncer colorretal, esta relação é complexa e envolve mecanismos biológicos ainda pouco compreendidos, destacando a necessidade de uma análise mais aprofundada dessa relação em nível molecular.
Pesquisas recentes têm demonstrado o papel da microbiota intestinal na saúde e nas doenças humanas e dentre as alterações relevantes da obesidade, apontam-se as alterações na microbiota intestinal, que também parece estar relacionado ao desenvolvimento do câncer colorretal. Desta forma, pode-se questionar a intersecção entre obesidade, alterações na microbiota e desenvolvimento do câncer colorretal.
A microbiota intestinal é um ecossistema complexo de microrganismos que coexistem no trato gastrointestinal humano. Sua composição e função desempenham um papel crucial na manutenção da homeostase do organismo, incluindo a regulação do sistema imunológico, metabolismo de nutrientes e proteção contra patógenos. No entanto, alterações na composição da microbiota intestinal, conhecidas como disbiose, têm sido associadas a várias condições patológicas, incluindo o câncer colorretal.
O estado pró inflamatório presente na obesidade, marcado pela secreção de fatores inflamatórios e metabólicos, como: fator de crescimento semelhante à insulina, hormônios sexuais e adipocinas pode gerar mudanças na microbiota intestinal, aumentando a suscetibilidade à gênese do câncer colorretal. Estas mudanças acontecem a partir de uma perda na modulação das moléculas pró inflamatórias, como interleucinas e o Fator de Necrose Tumoral Alfa (TNF-α). É percebido também uma desregulação na presença dos metabólitos intestinais. Ilustra-se com isto o aumento local na mucosa intestinal do acetato relacionada à carcinogênese bem como a uma diminuição do butirato que é protetor a este evento.
Considerando que muitos dos mecanismos subjacentes às inter-relações da tríade obesidade, microbiota intestinal e câncer colorretal ainda permanecem pouco elucidados, justifica-se analisar a integração destes fatores a fim de contribuir para um maior entendimento e fornecer subsídios para estratégias de prevenção e tratamento mais eficazes.
Através de uma revisão abrangente da literatura científica atualizada e da análise de estudos experimentais relevantes, este trabalho visa trazer à tona as evidências mais recentes sobre o papel desses fatores no desenvolvimento do câncer colorretal, oferecendo uma perspectiva multidisciplinar e integrativa para compreender melhor os mecanismos envolvidos. Ao final, espera-se que esta pesquisa possa contribuir para o avanço do conhecimento científico nessa área crucial da oncologia e fornecer insights para a implementação de estratégias preventivas e terapêuticas direcionadas a pacientes em risco de câncer colorretal
2. INTERSECÇÃO ENTRE OBESIDADE, ALTERAÇÕES NA MICROBIOTA INTESTINAL E CÂNCER COLORRETAL
A intersecção entre o estado obeso, o microbioma intestinal e a carcinogênese colorretal envolve diversos fatores e uma complexa gama de alterações moleculares, bioquímicas e imunológicas. A priori, faz-se mister o conhecimento das possíveis convergências entre estas variáveis para a tumorigênese intestinal, entendendo esta como um processo dinâmico complexo e sistêmico que requer cada vez mais conhecimento (SINGH et al., 2023).
2.1 Papel dos fatores inflamatórios e metabólicos locais nas alterações da tríade interseccional obesidade, microbiota e CCR.
O intestino humano é um sistema que depende da microbiota e de diversos fatores endógenos produzidos por esta microbiota e também pelos diversos órgãos do corpo humano. Este sistema é muito complexo e de difícil compreensão pois envolve diversas vias que se iniciam desde a vida intra útero, continuando como um processo dinâmico que perdura por toda a vida. A homeostase deste tubo digestivo é dependente de uma série de fatores aos quais o desbalanço pode levar à patologias, como inflamação e até mesmo câncer. Por isso, tenta-se decifrar as principais vias e suas relações com os hábitos de vida (SINGH et al., 2023).
Ao delimitarmos o ocidente para análise, percebe-se forte relação entre a dieta ocidental e a potencialidade desta dieta em alterar a homeostase intestinal. A exemplo disso, estuda-se o N-óxido de trimetilamina (TMAO), que é um produto da colina e da L-carnitina, ambas obtidas da degradação da carne vermelha e de outros alimentos de origem animal. Tal metabólito é associado a um risco mais elevado de desenvolvimento de câncer colorretal e obesidade. No entanto, as vias que explicam a intersecção entre a obesidade, as alterações da microbiota e o TMAO no desenvolvimento do câncer colorretal ainda não são bem estabelecidas, sugere-se que seja a partir da inflamação, do estresse oxidativo, do dobramento de proteínas ou dos danos ao DNA. No entanto, é bem estabelecida a necessidade de micróbios do trato gastro intestinal para a metabolização da carne ao TMAO (SÁNCHEZ-ALCOHOLADO et al., 2020).
Descobriu-se que o TMAO promove a expressão de genes ligados a processos inflamatórios em células endoteliais e musculares lisas. Isso, mediante a ativação da sinalização do fator nuclear-κB (NF-κB), do fator de necrose tumoral alfa (TNF-α) e seus receptores solúveis, todos estes associados a processos chave da cascata inflamatória. Em adição, o TMAO também pode ativar o inflamassoma NLRP3 e a produção de espécies reativas de oxigênio (ROS) em células fetais do cólon humano, inibindo a autofagia induzida por Autofagia Relacionado a 16-like (ATG16L1), um processo que é vital para a regulação da inflamação. Isto é, todas as vias determinam aumento na predisposição à carcinogênese, esta predisposição inclusive é ampliado com o estado pró-inflamatório da obesidade (LOKE et al., 2020).
A capacidade de integrar cascatas relacionadas à tumorigênese colorretal vai além da inflamação local e sistêmica. Os adipócitos que rodeiam o tumor são capazes de prover energia ou nutrientes para as células neoplásicas. Estudos in vitro já apontam os adipócitos primários, pré adipócitos e tecidos adiposos como promotores de proliferação e migração das células do câncer colorretal. Esse mecanismo no evento é a lipólise nos adipócitos e seguido por β-oxidação nas células tumorais, resultando na rápida proliferação de células tumorais (Figura 1) (YE et al., 2020).
A plena compreensão do papel dos adipócitos no metabolismo das células tumorais é de fundamental importância, pois, é responsável pela descoberta de novas terapias no tratamento do CCR. Além disso, é necessário entender como a obesidade pode ser considerada um risco em múltiplas esferas para o desenvolvimento e prognóstico do CCR. Com isso, o papel dos adipócitos na progressão do câncer colorretal se tem este tecido como secretor de vários hormônios e adipocinas, tais como estrogénios, insulina, fatores de crescimento semelhantes à insulina (IGFs), leptina, adiponectina e algumas citocinas inflamatórias (fator de necrose tumoral alfa (TNF-α), quimiocinas, inibidor do ativador do plasminogénio-1 (PAI-1), e as famílias das interleucinas (por exemplo, IL-1β, IL-6, IL-8, IL-10, IL-27 e IL-31) (YE et al., 2020).
Nesse sentido, uma das principais vias envolvidas na patogênese do CCR é a da insulina e dos fatores de crescimento ligados à insulina (IGFs). O sobrepeso e a obesidade aumentam os níveis séricos de insulina e IGF e diminuem as proteínas ligadoras de IGF (IGFBP) no sangue, isto corrobora para o aumento dos dois primeiros no líquido sérico. A insulina e os IGFs são fatores endógenos que ao se ligarem em receptores na mucosa colônica ativam a via de sinalização fosfoinositídeo 3-quinase (PI3K)/Akt o que culmina na proliferação de células de câncer de cólon, atrelando novamente obesidade e vias pró proliferativas que induzem a carcinogênese (Figura 1) (YE et al., 2020).
Portanto, infere-se esta seguinte via de progressão à suscetibilidade ao CCR: quanto maior quantidade de adipócitos no organismo humano, especialmente em indivíduos obesos, maior a secreção de insulina e IGFs que por sua vez ativam a via de sinalização fosfoinositídeo 3-quinase (PI3K)/Akt. Em última análise, esta via promove a fosforilação de proteínas alvo que culmina na tradução de RNA mensageiros relacionados, seguindo-se o crescimento e a proliferação celular, neste caso desenfreada e anômala, gerando o câncer. Isto associado aos oncogenes bacterianos da microbiota alterada amplia o potencial carcinogênico destas novas células (YE et al., 2020).
Ao contrário, percebe-se a atividade física como protetora aos eventos supracitados (Figura 1), responsáveis pela redução dos mediadores hormonais e inflamatórios, principalmente a insulina, leptina, esteróides sexuais, citocinas, quimiocinas e os fatores de crescimento. Com isso, temos a redução na aquisição de mutações oncogênicas, reduzindo a chance de desenvolvimento do CCR (VANEGAS et al., 2020).
Figura 1: Relação entre obesidade e o metabolismo tumoral no CCR, atividade física como protetora
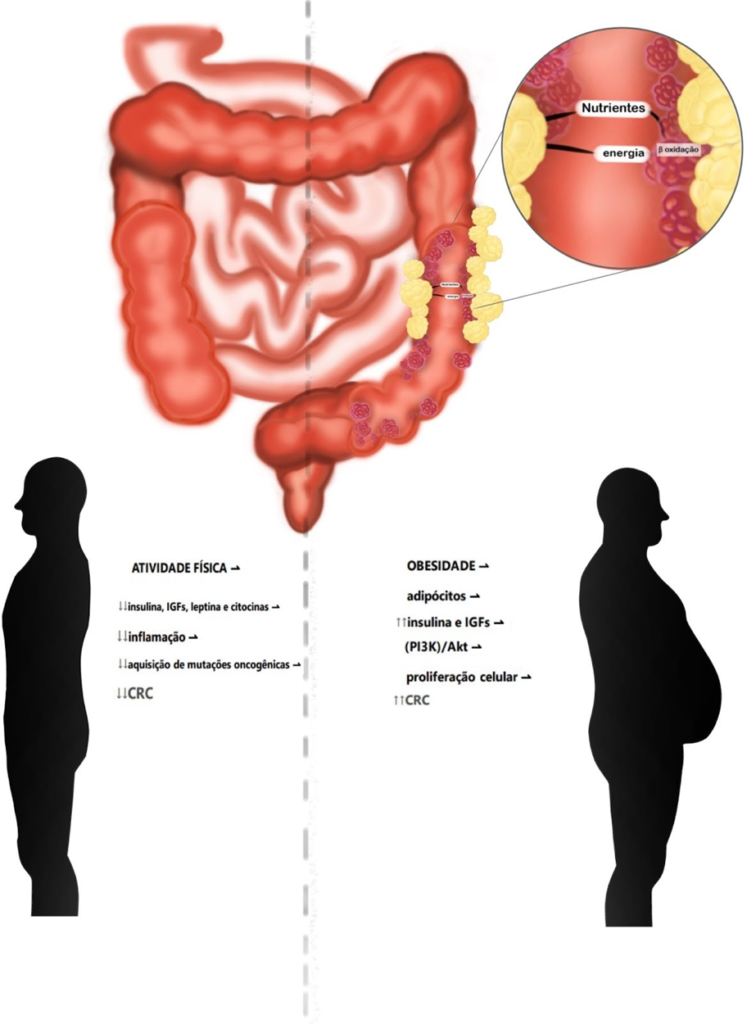
Fonte: Esquema autoral baseado em YE et al., 2020
IBRAHIM et al., 2019, evidência em seu estudo os esteróides sexuais, como o estrogênio, considerado como fator protetivo para o desenvolvimento de CCR através dos receptores de beta estrogênio (ERβ/ESR2), influenciando positivamente a integridade da mucosa do cólon e a reduzir fatores inflamatórios. No entanto, é importante notar que os efeitos do estrogênio do câncer colorretal podem variar de acordo com o contexto hormonal das mulheres, como a menopausa ou a terapia de reposição hormonal (TRH).
ISLAM et al., 2022, postula acerca da obesidade produzindo alterações na microbiota que levam às doenças inflamatórias intestinais, a exemplo, doença de Crohn e retocolite ulcerativa. A exposição à inflamação crônica na mucosa intestinal eleva as chances do desenvolvimento de cânceres do trato gastrointestinal. Este risco aumentado advém da inflamação crônica, alterações genéticas e mutações nos genes TP53 (Tumor Protein 53) e KRAS (Kirsten rat sarcoma viral oncogene homolog).
Com a perda desta relação simbiótica entre microbiota e hospedeiro há prejuízo no desenvolvimento do sistema imune pois as bactérias contidas neste ecossistema são responsáveis pela produção de bacteriocinas e peptídeos microbianos. Também há perda na capacidade absortiva de nutrientes o que susceptibiliza à infecções por bactérias patogênicas, reforçando a relação obesidade e microbiota levando à inflamação por intermédio imunológico. Além disso, o sobrepeso e a obesidade levam a redução da diversidade nesse ecossistema colônico, gerando um importante desbalanço na síntese de ácidos graxos de cadeia curta, vitamina B12, Vitamina K, diminuindo a proteção endógena à barreira intestinal (ISLAM et al., 2022).
É de conhecimento que a obesidade é multifatorial, um desses fatores é decorrente de uma dieta rica em gorduras e colesterol. Estes hábitos alimentares são responsáveis por um aumento da secreção de ácidos biliares primários, tais compostos são produzidos pelo fígado a partir do colesterol e secretado pelo sistema hepatobiliar no duodeno. A maior parte destes é reabsorvido, entretanto uma parte chega ao cólon e é biotransformado em ácidos biliares secundários por microbiota do gênero clostridium (LOKE et al., 2020).
Com isso, ocorre uma inflamação secundária ao acúmulo destes ácidos biliares secundários, o que pode explicar a relação da dieta rica em gordura com o desenvolvimento de CCR, sobretudo em pacientes com maior composição corpórea de gordura. Estendendo para estudos com populações humanas, percebe-se os afroamericanos com um risco mais elevado de CCR relativamente aos africanos nativos. Sendo assim, poderia ser explicado pelos primeiros terem uma dieta rica em gordura comprovada com nível 4 vezes mais elevado de ácidos biliares bem como maiores IMC quando comparados aos africanos nativos (LOKE et al., 2020).
O mecanismo de como os ácidos biliares levam a lesões pré cancerosas nos colonócitos ainda não é totalmente compreendido. Acredita-se que em virtude das altas concentrações destes na mucosa colônica ocorra inflamação e dano, o que acarretaria em mecanismos compensatórios de hiperproliferação e por consequência ampliaria a chance de proliferação de células indiferenciadas, isto é, células com maior potencialidade à malignidade (LOKE et al., 2020).
2.2 DESREGULAÇÃO LOCAL DOS METABÓLITOS
O intestino grosso alberga trilhões de micróbios, formando um vasto e complexo ecossistema e pode contribuir para a inflamação precursora do CCR. Este microambiente é moldado por fatores ambientais, sobretudo a dieta e o estilo de vida. Por isso, traça-se a relação da obesidade como fator de risco à carcinogênese colorretal, tangenciada por alterações na diversidade desta microbiota. A literatura atual evidencia que tal tríade possui inúmeras relações, uma vez que a obesidade é o resultado de uma dieta hipercalórica, gordurosa, rica em alimentos ultraprocessados e carne vermelha bem como pobre em alimentos in natura e fibras. Isso tudo gera inflamação sistêmica e colônica que pode ser ampliada pelos micróbios existentes neste cólon (SONG, 2019).
Embora limitada epidemiologicamente, dados relativamente consistentes indicam que Fusobacterium nucleatum e Bacteroides fragilis são enriquecidos na microbiota de indivíduos com câncer colorretal, enquanto as bactérias produtoras de butirato estão empobrecidas nestes doentes. Em outros termos, em pessoas com CCR, a microbiota protetora encontra-se diminuída enquanto a de risco está aumentada (SONG, 2019).
Ácidos graxos de cadeia curta (AGCC) são produtos da oxidação de carboidratos pelas bactérias anaeróbicas. Estes micróbios, sobretudo dos filos Firmicutes e Bacteroidetes hidrolisam carboidratos não digeríveis tais como amido resistente e fibras, fermentando estes compostos o que gera os ácidos graxos de cadeia curta como o acetato, propionato e o butirato. As células epiteliais intestinais, imunológicas e adipócitos apresentam receptores para os AGCC o que colabora para os diversos processos fisiológicos do trato gastrointestinal (HILLS et al., 2019).
Desse modo, a niacina e o butirato ativam o receptor GPR109A, o que suprime a inflamação e por consequência suprime o desenvolvimento do câncer de cólon. Infere-se, portanto, que os AGCC promovem a descontinuação da convergência entre a alteração na microbiota intestinal promovida entre outros fatores pela obesidade levando à tumorigênese colorretal (HILLS et al., 2019).
O butirato atua em vários processos anti-proliferativos. Primeiramente, o butirato diminui a expressão da neuropilina-1, um receptor do fator de crescimento endotelial vascular (VEGF) que é normalmente regulado positivamente nas células cancerígenas do cólon e promove angiogênese. Além disso, o butirato favorece a apoptose e inibe a proliferação e a invasão das células do CCR, regulando a expressão de microRNA. De forma extra, o butirato ainda reduz a motilidade das células do CCR. (LOKE et al., 2020).
Somado a isso, o butirato modula negativamente a Salmonella entérica patogênica e reduz o Ph do lúmen intestinal dificultando a sobrevivência dos patobiontes como a Escherichia coli. Com isso, temos o butirato como potencial protetor e alvo terapêutico para o CCR em perspectivas futuras (ISLAM et al., 2022).
Pode-se considerar uma interação bidirecional entre a obesidade e microbiota intestinal alterada, sendo estas duas variáveis retroalimentadas uma pela outra. Ilustra-se esta realidade com os efeitos desencadeados pela ligação dos ácidos graxos de cadeia curta no receptor GRP1, que leva a um aumento do gasto energético e expressão do hormônio leptina que leva à diminuição da ingesta de alimentos. Portanto, alterações na microbiota que diminuam a quantidade de AGCC leva a alterações moleculares que induzem uma maior ingestão de alimentos que colaboram para a obesidade e este processo sem intervenção forma um ciclo vicioso (HILLS et al., 2019).
Entretanto, em estudos com ratos observa-se forte dependência da idade para a desregulação dessas vias pró proliferativas. Em ratos jovens é percebido desvios celulares que favorecem a oxidação de ácidos graxos de cadeia longa o que pode aumentar as células tronco intestinais (caracterizando-se como protetor ao desenvolvimento tumoral), enquanto que em ratos idosos a obesidade é associada a uma diminuição da expressão de genes supressores tumorais e de reguladores das vias pró proliferativas (contribuindo para a progressão da carcinogênese do cólon) (HILLS et al., 2019).
2.3 DISBIOSE, MICRÓBIOS ESPECÍFICOS E SEUS POSSÍVEIS MECANISMOS MOLECULARES ASSOCIADOS À CARCINOGÊNESE COLORRETAL OU PROTEÇÃO DESTA.
O papel da obesidade na disbiose da microbiota intestinal ainda é pouco compreendido. Apesar das inúmeras evidências apontando para uma correlação favorável entre estas três variáveis, as vias moleculares subjacentes à carcinogênese colorretal ainda permanecem pouco entendidas, denotando mister necessidade de mais estudos acerca da temática para o desenvolvimento de possíveis intervenções para o CCR (SINGH et al., 2023).
É sabido que a obesidade em humanos é responsável por um declínio na diversidade microbiana intestinal, isso desregula o metabolismo colônico levando a uma alteração nos processos que antes aconteciam de forma fisiológica no trato gastrointestinal distal. O número de espécies bacterianas no cólon é um milhão de vezes maior que a população microbiana do intestino delgado. E curiosamente, o primeiro tem uma incidência 12 vezes maior de tumores malignos, reiterando a relação favorável entre obesidade, microbiota e carcinogênese colorretal (SINGH et al., 2023).
Estilos de vida inapropriados levam a Ìndices de Massa Corpórea (IMC) mais elevados, podendo em casos críticos ser determinantes para a obesidade. Estes IMC maiores, sobretudo acima de 30 kg/m2 vêm sendo associados a níveis séricos mais elevados de Lipopolissacarídeos (LPS) e proteína ligadora de lipopolissacarídeos (LBP), o que evidencia ineficácia no clearance de endotoxinas bacterianas deflagradoras do sistema imune em pessoas obesas (SONG, M.; CHAN, A. T.; SUN, 2019).
Apesar das variações geográficas na microbiota intestinal, a presença de sete núcleos bacterianos são evidentemente enriquecidas em pacientes com câncer colorretal (CCR), são elas: B. fragilis, F. nucleatum, Porphyromonas asaccharolytica, Parvimonas micra, Prevotella intermedia, Alistipes finegoldii e Thermanaerovibrio acidaminovorans. Esses achados foram confirmados através de uma meta-análise de 526 amostras fecais, dados de metagenoma shotgun (QU et al., 2023).
É importante salientar que a composição do microbioma intestinal varia consideravelmente nas diferentes localizações anatômicas e isto tem implicância no sítio anatômico de desenvolvimento do CCR. Os biofilmes bacterianos da mucosa se relacionam ao câncer colorretal proximal, além disso, verificou-se uma maior abundância de F. nucleatum nos casos de CCR proximal. O metabolismo destes micróbios induzem a carcinógenos, inflamação e maior suscetibilidade à mutações que paralelamente corroboram para a tumorigênese no cólon proximal (QU et al., 2023).
Quanto ao câncer colorretal distal, percebe-se maior acúmulo de bactérias no cólon distal nos casos de alterações no ambiente local, como em casos de infecção e cirurgia. Também, há maior presença de oncogenes bacterianos nas fezes dos indivíduos com câncer em sítios distais. Estas diferenças corroboram o fato de que o sub-sítio anatômico de câncer pode ser dependente de bactérias específicas desta localização e algumas bactérias desenvolvem papéis diferentes no desenvolvimento de CCR proximal ou distal (QU et al., 2023).
Bacteroides fragilis e Escherichia coli são as bactérias intestinais frequentemente relatadas relacionadas com o CCR de início tardio. Em outro viés de análise, o F. Nucleatum está relacionado a piores prognósticos. Este micróbio contribui para a carcinogênese ao se ligar e causar danos ao DNA da célula hospedeira mediante seus diversos fatores de virulência como as proteínas FadA, Fap2 e MORN2. Além disso, a Fap2 também está envolvida na indução das citocinas IL-8 atuante como quimiocina que promove a migração e a progressão do CCR (QU et al., 2023).
Sequências elevadas de DNA e RNA de F. nucleatum são obtidas em amostras fecais de doentes com câncer colorretal quando comparadas a controles sadios. Tal constatação se amplia para associação que os indivíduos com esta disbiose tem mais recorrência de CCR e baixas taxas de sobrevivência (ALASIRI, 2022).
Esta associação entre F. nucleatum e pior prognóstico pode ser explicada por particularidades moleculares deste micróbio no tecido tumoral do cólon. Sendo estas: mutações do proto-oncogene B-Raf, serina/treonina quinase, hipermutação com instabilidade de microssatélites. Além disso, o FadA (um fator de virulência do F. nucleatum) pode ligar-se ao domínio extracelular das E-caderinas e induzir a proliferação e migração de células cancerígenas (ALASIRI, 2022).
Ademais, é estabelecido papel imunológico do F. nucleatum no CCR. Este micróbio inibe a infiltração das células T no tecido doente, perdendo o clearance imunológico das células alteradas. Então, a resposta imune nos indivíduos com CCR é desbalanceada para células da linhagem mielóide, a exemplo os macrófagos que por sua vez secretam IL-10 e prostaglandina E2, ambas pró inflamatórias, o que culmina na supressão das vias anti tumorais (ALASIRI, 2022).
Por outro lado, existem bactérias simbiontes como o Enterococcus faecalis que produzem ânions superóxido que impede o crescimento de cepas de bactérias patogênicas. Além da modulação negativa promovida pela competição bactéria-bactéria e pela produção de peptídeos de defesa do hospedeiro pela microbiota e pelas células intestinais, ambas promovendo modulação negativa dos patobiontes (ISLAM et al., 2022).
Também, existe as bactérias filamentosas segmentadas (SFB) promovem a diferenciação de T helper 17 (Th17) levando a produção de IL-22 e Imunoglobulina A que controlam a proliferação de bactérias comensais e patogênicas, contribuindo para a homeostase intestinal (ISLAM et al., 2022).
Como visto anteriormente, a produção de TMAO é dependente da microbiota intestinal. Num estudo envolvendo homens jovens saudáveis, aqueles com a composição da microbiota mais levada de Firmicutes e Bacteroidetes demonstraram uma maior resposta ao TMAO dietético, o que implica a influência da composição da microbiota intestinal na produção de TMAO e por conseguinte aumentando o risco de lesões colônicas. Pelo contrário, Eubacterium limosum demonstrou ser capaz de reduzir os níveis de TMAO no intestino (LOKE et al., 2020).
Uma dieta rica em carne vermelha gera muito heme e mioglobina. Estes dois compostos alteram a microbiota reduzindo Firmicutes e Deferribacteres, além de aumentar Proteobacteria ou Bacteroidetes. Esta disbiose leva a uma diminuição de butirato e de AGCC a nível colônico, causando prejuízo à saúde intestinal e favorecendo a formação de adenomas, lesões precursoras do CCR (LOKE et al., 2020).
Carboidratos são os macronutrientes mais relacionados à obesidade e são modificados pela microbiota intestinal. A adesão a longo prazo a alimentos ricos em fibras leva à abundância de Prevotella, enquanto a adesão à dieta ocidental pobre em fibras resulta na abundância de Bacteroides. Essa última é associada às neoplasias colorretais ao promover danos ao DNA e produção de espécies reativas de oxigênio, sendo estas prevalentes na mucosa colônica dos pacientes com CCR (LOKE et al., 2020).
Ainda na perspectiva dos carboidratos somada também a alta ingesta de gordura, MARTINEZ-MEDINA et al., 2014, relataram a partir de estudos em ratos alimentados com dieta rica em gordura e açúcar um aumento da colonização intestinal por E. coli aderente-invasiva e da bactéria degradadora de mucina Ruminococcus torques. Esta alteração sujeitou os ratos a maiores níveis de inflamação e de liberação de citocinas pró-inflamatórias, além da diminuição da espessura do muco. Tal estudo tem como fator limitante a inabilidade de concluir a disbiose sendo causada ou pela açúcar, ou pela gordura ou por ambas em conjunto (LOKE et al., 2020).
Isolando a variável de gordura alimentar e seu impacto na microbiota, tem-se uma mudança na proporção relativa de Firmicutes e Bacteroidetes. Em que os primeiros dominam às custas do segundo. Esta alteração na razão entre estes dois microbios é fortemente associados ao estado obeso, entretanto, apenas uma dieta rica em gorduras pode levar a tal disbiose. Concluindo que tanto a obesidade quanto os hábitos alimentares ricos em gordura podem ser responsáveis pela disbiose (LOKE et al., 2020).
Além disso, uma dieta rica em gordura pode aumentar a proporção de Actinobacteria na microbiota intestinal. Estas bactérias são responsáveis por degradar o muco e por isso comprometem a barreira intestinal, levando a inflamação mediada por aumento de citocinas pró-inflamatórias e uma diminuição nas proteínas da junção. Este efeito danoso associado a uma diminuição da microbiota benéfica como, Bifidobacterium, Lactobacillus e Akkermansia, leva a uma desregulação da homeostase intestinal o que possivelmente aumenta a suscetibilidade à inflamação, facilitando a progressão neoplásica subsequente (LOKE et al., 2020).
Em pacientes com doenças inflamatórias intestinais, os quais têm mais inflamação local que os controles realizou-se uma análise metagenômica, detectando-se menor abundância de genes de Firmicutes metabolizadores de bile. Reiterando a disbiose microbiana ao estado de doenças ligadas à inflamação, podendo mais uma vez associar maior suscetibilidade ao CCR em indivíduos com menor colonização por Firmicutes (DAS et al., 2019).
NGUYEN et al. (2020) relataram que a adesão de longo prazo a um padrão alimentar associado a bactérias metabolizadoras de enxofre nas fezes foi associada a um risco aumentado de CRC distal em homens, mas como essa bactéria contribui para a patogênese do CRC ainda não é completamente compreendido (NGUYEN et al., 2020)
Acredita-se que o Bilophila wadsworthia, um micróbio metabolizador de enxofre que transforma o enxofre da dieta em sulfeto de hidrogênio genotóxico (H2S), seja relacionado com o desenvolvimento de CCR. Tal relação se dá pelo excesso de H2S na mucosa do cólon, o que quebra as ligações dissulfeto do muco, expondo o epitélio intestinal a micróbios imunogênicos, bem como aumenta as chances de dano ao DNA, podendo promover alterações celulares e inflamação associados ao CCR (NGUYEN et al., 2020).
A infecção de colonócitos por B. fragilis enterotoxigênico pode induzir à inflamação colônica através de polimorfonucleares imaturos. Peptostreptococcus anaerobius interage com as células do cólon através da integrina α2/β1, este receptor é comumente superexpresso no CCR para promover o estado pró inflamatório. Ou seja, ambas bactérias são capazes de desenvolver inflamação responsável por CCR mediante complexas vias imunológicas, sobretudo em indivíduos com suscetibilidade genética (LOKE et al., 2020).
Embora o supracitado apenas relacione a microbiota do estado obeso aos efeitos prejudiciais, ainda assim, existe o Parabacteroides distasonis, um organismo comensal, responsável por um efeito anti-inflamatório. Reduzindo a colite bem como a inflamação intestinal, o P. distasonis tem papel benéfico na atenuação da tumorigênese colorretal (KOH et al., 2020).
Por fim, postula-se a seguinte relação tridirecional entre microbiota, obesidade e CCR: disbiose na microbiota intestinal pode gerar metabólitos desregulados para a corrente sanguínea do indivíduo, tais metabólitos podem afetar o apetite ao permear a barreira hemato encefálica, em soma pode afetar a síntese, decomposição e diminuir o acastanhamento do tecido adiposo, o que retroalimenta a obesidade, paralelamente, a flora intestinal alterada muda a permeabilidade, causando inflamação intestinal. Isto, somado à inflamação sistêmica promovida pela obesidade, mantida e retroalimentada pelo microbioma disbiótico converge para uma maior suscetibilidade à carcinogênese colorretal (LIN; ZHU; YANG, 2022).
Acerca de perspectivas futuras, pode-se pensar em utilização de exames de bactérias fecais para rastreamento e diagnóstico precoce do CCR, uma vez que diagnosticar e tratar o CCR cedo é a chave para redução da mortalidade por esta doença. No entanto, ainda existem algumas limitações no que tange a proporção de estudos e amostras para determinar significância epidemiológica e estatística para implementação desta realidade (PAN et al., 2022).
2.4 Inflamação Sistêmica
A inflamação sistêmica é caracterizada por um aumento da infiltração de células imunológicas no tecido do hospedeiro. Este panorama está fortemente ligado à obesidade e à deficiência na barreira intestinal e ambas variáveis podem ter relação com a microbiota intestinal. O estado inflamatório crônico é marcado por níveis séricos elevados de LPS(lipopolissacarídeos) o que corrobora com relação supracitada das três variáveis objetos principais desta pesquisa (LIN; ZHU; YANG, 2022).
É sabido que a obesidade gera uma inflamação sistêmica, crônica e de baixo grau. Este estado gera consequências ao organismo humano que somam-se no decorrer dos anos. O aumento do índice de massa corporal (IMC) é associado ao aumento de duas citocinas pró-inflamatórias do cólon, nomeadamente TNF-α e interleucina 6 (IL6). Ademais, IMC maiores que 30 kg/m2 caracterizam obesidade e coincidem com alterações pré-cancerosas no transcriptoma (PFALZER et al., 2018). Denota-se que esta descoberta implica que a inflamação pode ser um dos mecanismos de como a disbiose associada à obesidade contribui para o aumento do risco de CCR (LOKE et al., 2020).
A obesidade contribui para a inflamação sistêmica mediante alterações na barreira intestinal ao aumentar sua permeabilidade. Para além destas alterações histológicas, cada vez mais estuda-se as alterações epigenéticas induzidas por uma dieta rica em gordura. Esta dieta rotineiramente associada à obesidade leva a uma remodelação generalizada de acetilação e metilação que possivelmente influenciam respostas transcricionais que participam da progressão do câncer colorretal. Embora acredita-se que as alterações no microbioma intestinal tenham forte ligação com estas consequências epigenéticas, seu papel ainda não é claramente elucidado (SONG, 2019).
Ademais, a inflamação do tecido adiposo somado a perturbação na permeabilidade da mucosa intestinal sinergiza para o desenvolvimento de inflamação sistêmica. Isto se dá através de uma indução de endotoxemia metabólica que em paralelo a inflamação tecidual pré-existente contribui para a produção de citocinas pró inflamatórias que em última análise favorece o desenvolvimento de tumores (SONG, 2019).
ASADI et al., 2021, apoiam correlação favorável entre os níveis sistêmicos baixos de grelina à resistência à insulina na suscetibilidade ao CCR. É relatado que estas variáveis em conjunto são associadas aos níveis circulantes de grelina embora estudos posteriores sejam necessários. Este peptídeo é produzido majoritariamente pelo estômago e tem como funções regulação do apetite, homeostase energética, modulação da insulina e da indução à apoptose, esbarrando novamente em relações entre obesidade e câncer colorretal(ASADI et al., 2021).
Apesar de ainda desconhecido o papel da grelina na proteção à patogênese do CCR, sugere-se que seja através de mecanismos sistêmicos como obesidade, resistência à insulina ou inflamação. Nesse ínterim, nota-se a grelina com atividade anti inflamatória, antioxidante e de apoptose de células do carcinoma colorretal humano (células HCT116) através da inibição do sistema ubiquitina-proteassoma e da indução da autofagia (ASADI et al., 2021).
Em contrapartida, a grelina pode ter papéis ambíguos quanto à proliferação e à anti proliferação. Isto é, este peptídeo pode desempenhar um papel na proliferação de células cancerosas do intestino e do cólon através das vias de sinalização PI3K/Akt e ERK ½ e em outras vias a grelina pode funcionar de forma a inibir a proliferação. Ou seja, ainda é incerto o papel da grelina na tumorigênese ou proteção desta (ASADI et al., 2021).
Portanto, compreende-se a inflamação sistêmica como um ente comum em diversas patologias e agravos de saúde. Esta tem íntima relação com o câncer colorretal bem como com a alteração de diversidade da microbiota intestinal. No entanto, mais estudos são necessários para melhor compreensão desta relação interseccional entre estas variáveis e tantas outras envolvidas na carcinogênese colorretal (LOKE et al., 2020).
3 APRESENTAÇÃO DOS DADOS (RESULTADOS)
Como exposto neste trabalho, inúmeras variáveis funcionam paralelamente para manter a homeostase do intestino, o desbalanço nesta fisiologia pode desencadear o desenvolvimento de doenças neste órgão, como por exemplo o CCR. Vários processos complexos ocorrem de forma anômala para juntos contribuírem para a fisiopatologia do CCR. Delimita-se os principais metabólitos notadamente envolvidos no CCR e tenta-se traçar sua relação com a obesidade e com a microbiota intestinal. Apesar das vias as quais determinam este processo não serem totalmente esclarecidas, já se pode concluir algumas relações interdependentes, algumas diretas outras indiretas, tais como expressas no Quadro 1:
Quadro 1 – Principais metabólitos oncogênicos ou protetores à carcinogênese que se relacionam com a obesidade e a microbiota
AUTORES METABÓLITO INTERSECÇÃO ENTRE OBESIDADE, ALTERAÇÕES NA MICROBIOTA INTESTINAL E CÂNCER COLORRETAL SÁNCHEZ-ALCO HOLADO et al., 2020 N-óxido de trimetilamina (TMAO) Metabólico associado a um risco mais elevado de desenvolvimento de câncer colorretal e obesidade, porém não se sabe a via. YE et al., 2020 Insulina e fatores de crescimento ligados à insulina (IGFs) A obesidade aumenta os níveis séricos de insulina e IGF, se ligando a receptores na mucosa ativando a via de sinalização de fosfoinositídeo 3-quinase (PI3K)/Akt levando a uma proliferação de câncer no cólon IBRAHIM et al., 2019 Hormônios Sexuais Esteróides como estrogênio tem sido considerados como fatores protetivos para a mucosa, reduzindo processos inflamatórios HILLS et al., 2019 Quimiocinas Resultado da liberação de citocinas pró-inflamatórias, como fator de necrose tumoral alfa (TNF-alfa) e a interleucina-6 (IL-6), podem promover um ambiente propício para o desenvolvimento do CCR. Estão aumentadas em indivíduos obesos. ISLAM, et al., 2022 Ácidos Graxos de Cadeia Curta (AGCC) Originado da fermentação de fibras dietéticas pela microbiota sadia, produzindo por exemplo o butirato, tendo propriedades anti-inflamatórias e pode proteger a mucosa intestinal contra danos inflamatórios. YE et al., 2020 Adipocinas Obesidade está relacionada a níveis reduzidos de adiponectina, uma adipocina com propriedades anti-inflamatórias e protetoras contra o câncer. Enquanto que a leptina está aumentada na obesidade, sendo ela um pró-inflamatório
No que tange a microbiota, algumas disbioses desbalanceadas para os micróbios patogênicos estão relacionadas à tumorigênese colorretal. No quadro 2 é possível observar as bactérias que são protetoras bem como as que são de risco ao desenvolvimento do CCR. Essa relação bidirecional entre microbiota e CCR se amplia quando adicionamos a obesidade para análise, pois esta tem relação direta e indireta com a microbiota alterada além de sinergizar com as repercursões sistêmicas do estado obeso, notavelmente com os níveis mais elevados de fatores inflamatórios, das espécies reativas de oxigênio e das possibilidade de danos ao DNA aumentadas, o que posteriormente aumenta a chance de desenvolvimento do CCR.
Ademais, entende-se esta subdivisão em fatores de risco e fatores protetores como benéficos ao delimitarmos patologias para estudo, pois assim podemos analisar de forma mais prática como a doença se relaciona com as outras variáveis em questão, e isto possibilita melhor visualização para potenciais intervenções.
Este ecossistema colônico é de difícil compreensão por sua amplitude e complexidade quanto às vias moleculares, metabólicas e imunológicas subjacentes e tangentes à tumorigênese colorretal. Delimitando-se o CCR e seus fatores protetivos e de risco, podemos chegar a algumas conclusões concernentes ao papel da microbiota nesses processos. Apesar das inúmeras relações já traçadas, é preciso reiterar que o conhecimento referente a essas alterações, suas relações com a obesidade, com o estilo de vida e com o CCR ainda são muito aquém do necessário, apontando a necessidade urgente de novas pesquisas e maiores conhecimentos acerca do tema.
Além disso, apesar de não ser o objeto deste estudo, o sistema imune está sempre tangencial quando analisamos a tríade obesidade, microbiota intestinal e carcinogênese colorretal, denotando potencial necessidade de ampliar os estudos também para a área da imunologia para que possamos estabelecer relações práticas mais palpáveis para desenvolvimentos futuros.
Quadro 2 – Síntese dos fatores de risco e de proteção ao CCR em decorrência da microbiota.
AUTORES MICROBIOTA FATORES DE PROTEÇÃO FATORES DE RISCO QU et al., 2023 Bacteroides fragilis e Escherichia coli – CCR de início tardio ALASIRI, 2022 F. nucleatum – Danos ao DNA e indução de IL-8, maior migração ISLAM et al., 2022 Enterococcus faecalis Ânions superóxidos que impede crescimento de bactérias patogênicas – ISLAM et al., 2022 Bactérias Filamentosas Th17, IL-22 e IgA, contribui para homeostase intestinal – LOKE et al., 2020 Eubacterium limosum Redução dos níveis de TMAO – LOKE et al., 2020 Proteobacteria e/ou Bacteroidetes – Diminuição nível de butirato e AGCC LOKE et al., 2020 Bacteroides – Danos ao DNA LOKE et al., 2020 Ruminococcus torques – Citocinas pró-inflamató rias e diminuição da mucosa LOKE et al., 2020 Actinobacteria – Degradação do muco intestinal LOKE et al., 2020 B. fragilis Redução inflamação por polimorfonucleares imaturos – KOH et al., 2020 Parabacteroides distasonis Efeito anti-inflamatório –
Como frisado anteriormente, não é bidirecional a relação microbiota-CCR, esta tumorigênese envolve uma relação multifatorial complexa muitas vezes não totalmente compreendida. Entretanto, algumas relações entre a tríade microbiota, obesidade e CCR já são bem entendidas e ilustradas por intersecções. Exemplifica-se com a capacidade do tecido adiposo em secretar diversos hormônios e citocinas inflamatórias, que em conjunto corroboram para uma inflamação sistêmica que soma-se e amplia a inflamação intestinal promovida por uma microbiota alterada, propiciando eventos que se atrelam à carcinogênese deste tecido, principalmente se dada a exposição por muitos anos. Os principais hormônios e citocinas pró inflamatórias envolvidas neste processo são insulina, fatores de crescimento semelhantes à insulina (IGFs), leptina, adiponectina, fator de necrose tumoral alfa (TNF-α) e as famílias das interleucinas ( IL-1β, IL-6, IL-8, IL-10, IL-27 e IL-31).
Além disso, pontua-se que quanto maior quantidade de adipócitos no estado obeso, maior será a secreção de insulina e IGFs que em resumo ativam vias próproliferativas ((PI3K)/Akt) levando à proliferação celular anomâla característica do CCR. Isto, aliado a seleção da microbiota promovida pela inflamação sistêmica, ou seja, esta inflamação diminui a diversidade de bactérias o que amplia a concentração de bactérias patogênicas aumenta o risco para doenças. Por exemplo, estes micróbios podem secretar fatores oncogênicos tais como o TMAO advindo da metabolização da carne vermelha, a IL-8 pelo F. nucleatum e ácidos graxos secundários pelo clostridium. Esta realidade corrobora ao fato da obesidade, microbiota e CCR se interseccionam e muitas vezes quando analisados paralelamente percebe-se sinergismos entre as três variáveis.
Pode-se pensar também de forma reversa, pois algumas populações da microbiota são responsáveis pela secreção de fatores de proteção à mucosa colônica da carcinogênese. Principalmente os filos Firmicutes e Bacteroidetes que metabolizam os carboidratos em ácidos graxos de cadeia curta (AGCC), este metabólito consagra-se como protetor pelos seus diversos efeitos anti-inflamatórios e anti-proliferativos.
Os principais mecanismos protetores e de risco que se associam à tríade obesidade, microbiota e CRC e suas principais vias causadoras são ilustrados na Figura 2. Pode-se perceber que de uma forma geral a obesidade e a microbiota alterada de formas interdependentes, independentes ou em conjunto levam à inflamação sistêmica ou local, a danos ao DNA e a mecanismos pró proliferativos anômalos que se associam a uma diminuição dos fatores que protegem a carcinogênese colorretal. Logo, a predisposição ao CCR é mais associada a indivíduos obesos e com microbiota alterada.
Figura 2. Fatores de proteção e risco ao CCR relacionados à obesidade e à microbiota.
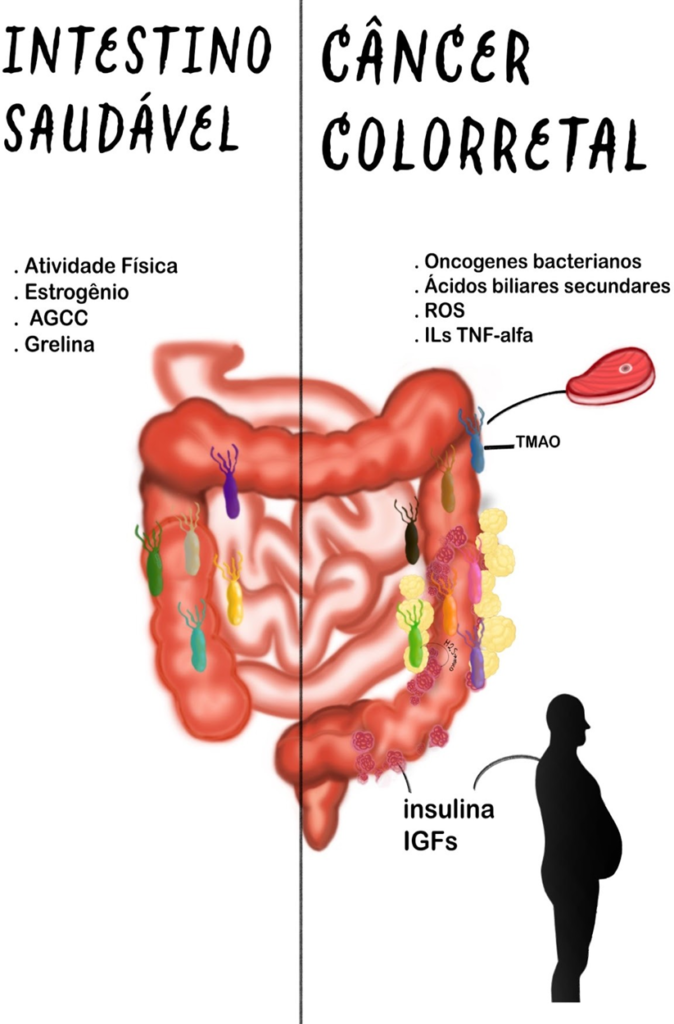
Fonte: Esquema autoral baseado em LOKE et al., 2020
5 CONCLUSÃO
Em conclusão, este trabalho examinou uma tríade correlacionando a obesidade com a alteração na microbiota intestinal gerando um CCR. Ao longo desta investigação, foram abordados diversos tópicos, incluindo fatores inflamatórios e metabólicos, a desregulação dos metabólitos, a disbiose e seus possíveis mecanismos moleculares e a inflamação sistêmica como fatores predisponentes de CCR. A partir da revisão na literatura atualizada, nota-se que existem interseções nessa tríade, onde a obesidade pode contribuir de forma local à carcinogênese, alterando a microbiota em um desbalanço para espécies patológicas ao diminuir a diversidade do ecossistema total. Além de contribuir para o CCR de forma independente ao promover inflamação sistêmica.
Foi possível verificar que mesmo sendo multifatorial, a obesidade possui grande importância para o desenvolvimento do CCR. Esta é um problema global de saúde pública que, ao afetar todas as faixas etárias, vem contribuindo como um dos multifatores de diversas doenças, incluindo o CCR, e por ser um fator de risco modificável por mudanças no estilo de vida, é importante cada vez mais disseminação de informação para combatê-la.
Em sentido oposto, este estudo também encontrou fatores protetores que se interseccionam ou tangenciam a tríade, tais mecanismos ainda não são bem esclarecidos dentro de uma ótica molecular, mas rotineiramente são estabelecidos e pontuados nos estudos. Portanto, entende-se a pluralidade e multifatoriedade para o desenvolvimento de doenças complexas como o câncer colorretal, onde o seu entendimento é de suma importância, embora difícil e complexo.
Em última análise, espera-se que este trabalho contribua para o conhecimento na relação obesidade com a microbiota e desenvolvimento de CCR e destaca-se a importância de continuar a pesquisa nesta área. Espera-se que as conclusões e insights aqui apresentados sejam valiosos para pesquisadores ou estudiosos futuros, fornecendo uma base sólida para investigações e ações interventivas práticas.
6 REFERÊNCIAS
SONG, M.; CHAN, A. T. Environmental Factors, Gut Microbiota, and Colorectal Cancer Prevention. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association, v. 17, n. 2, p. 275–289, 2019.
SONG, M.; CHAN, A. T.; SUN, J. Influence of the Gut Microbiome, Diet, and Environment on Risk of Colorectal Cancer. Gastroenterology, v. 158, n. 2, out. 2019.
HILLS, R. D. et al. Gut Microbiome: Profound Implications for Diet and Disease. Nutrients,
v. 11, n. 7, p. 1613, 16 jul. 2019.
SÁNCHEZ-ALCOHOLADO, L. et al. Gut Microbiota-Mediated Inflammation and Gut Permeability in Patients with Obesity and Colorectal Cancer. International Journal of Molecular Sciences, v. 21, n. 18, p. 6782, 16 set. 2020.
QU, R. et al. Role of the Gut Microbiota and Its Metabolites in Tumorigenesis or Development of Colorectal Cancer. 1 jun. 2023.
YE, P. et al. Linking Obesity with Colorectal Cancer: Epidemiology and Mechanistic Insights.
Cancers, v. 12, n. 6, p. 1408, 29 maio 2020.
VANEGAS, D. P. et al. Revisión: Factores asociados a cáncer colorrectal. Revista Médica de Risaralda, v. 26, n. 1, 30 jun. 2020.
ASADI, A. et al. CIRCULATING GHRELIN LEVELS AND SUSCEPTIBILITY TO
COLORECTAL CÂNCER. Arquivos de Gastroenterologia, v. 58, n. 3, p. 316–321, set. 2021.
ISLAM, M. R. et al. The Role of Gut Microbiota and Metabolites in Obesity-Associated Chronic Gastrointestinal Disorders. Nutrients, v. 14, n. 3, p. 624, 31 jan. 2022.
LOKE, Y. L. et al. Colon Carcinogenesis: The Interplay Between Diet and Gut Microbiota.
Frontiers in Cellular and Infection Microbiology, v. 10, 8 dez. 2020.
MARTINEZ-MEDINA, M. et al. Western diet induces dysbiosis with increasedE coliin
CEABAC10 mice,alters host barrier function favouring AIEC colonisation. Gut, v. 63, n. 1, p. 116–124, 18 abr. 2013.
KIM, K.-A. et al. High Fat Diet-Induced Gut Microbiota Exacerbates Inflammation and
Obesity in Mice via the TLR4 Signaling Pathway. PLoS ONE, v. 7, n. 10, p. e47713, 16 out. 2012.
LECOMTE, V. et al. Changes in Gut Microbiota in Rats Fed a High Fat Diet Correlate with Obesity-Associated Metabolic Parameters. PLOS ONE, v. 10, n. 5, p. e0126931, 18 maio 2015.
DAS, P. et al. Metagenomic analysis of bile salt biotransformation in the human gut microbiome. BMC Genomics, v. 20, n. 1, 25 jun. 2019.
KOH, G. Y. et al. Parabacteroides distasonis attenuates tumorigenesis, modulates inflammatory markers and promotes intestinal barrier integrity in azoxymethane-treated A/J mice. Carcinogenesis, v. 41, n. 7, p. 909–917, 2 mar. 2020.
PFALZER, A. C. et al. Incremental Elevations in TNFα and IL6 in the Human Colon and Procancerous Changes in the Mucosal Transcriptome Accompany Adiposity. Cancer
Epidemiology, Biomarkers & Prevention, v. 27, n. 12, p. 1416–1423, 1 dez. 2018.
LIN, K.; ZHU, L.; YANG, L. Gut and obesity/metabolic disease: Focus on microbiota metabolites. MedComm, v. 3, n. 3, set. 2022.
PAN, S. et al. Therapeutic potential of melatonin in colorectal cancer: Focus on lipid metabolism and gut microbiota. Biochimica et Biophysica Acta (BBA) – Molecular Basis of Disease, v. 1868, n. 1, p. 166281, jan. 2022.
IBRAHIM, A. et al. Colitis‐induced colorectal cancer and intestinal epithelial estrogen receptor beta impact gut microbiota diversity. International Journal of Cancer, v. 144, n. 12, p. 3086–3098, 11 jan. 2019.
NGUYEN, L. H. et al. Association Between Sulfur-Metabolizing Bacterial Communities in Stool and Risk of Distal Colorectal Cancer in Men. Gastroenterology, v. 158, n. 5, p.
1313–1325, abr. 2020.
DAVID, L. A. et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature,
v. 505, n. 7484, p. 559–563, 11 dez. 2013.
