REGISTRO DOI: 10.5281/zenodo.8076174
Camila Belfort Piantino Faria
Helen Alves da Silva
Ludmila Aparecida Guimaraes
Nicole Blanco Bernardes
Thalita Grazielly Santos
Thatiane Danielly Santos
Rosane Andrade Mercês
Renata Dellalibera Joviliano
Nayara Izabel Viana
Beatriz Dutra Brazao Lelis
RESUMO
O Câncer de mama é uma patologia agressiva cuja incidência tem aumentado nos últimos anos, sendo considerado um problema de saúde pública. Devido a sua alta incidência, pesquisas e estudos vêm sendo realizados com o intuito de abranger procedimentos confiáveis e capazes de proporcionar especificidade em tratamentos de pacientes diagnosticadas com diferentes tipos de câncer de mama. Por esta razão, o presente estudo tem como objetivo realizar uma revisão bibliográfica do tipo integrativa sobre as estratégias terapêuticas da imunoterapia, direcionada para o câncer de mama triplo negativo, a fim de obter conhecimentos que contribuam para uma compreensão acadêmica mais aprofundada do assunto, porém sem nenhuma aplicação prática.
Palavras-Chave: Neoplasias de mama triplo negativas. Bloqueio de PD-1 e PD-L1. Inibidor de PARP.
ABSTRACT
Breast cancer is an aggressive pathology whose incidence has increased in recent years and is considered a public health problem. Due to its high incidence, research and studies have been carried out with the aim of covering reliable procedures capable of providing specificity in treatments for patients diagnosed with breast cancer. For this reason, this study aims to present an integrative review of therapeutic strategies for immunotherapy, aimed at triple negative breast cancer, with the aim of obtaining knowledge that contributes to a deeper academic understanding of the subject, but without any practical application.
Keywords: Triple negative breast neoplasms. Blocking of PD-1 and PD-L1. PARP inhibitor.
1 INTRODUÇÃO
O sistema imunológico refere-se ao conjunto de células, moléculas e tecidos que atuam como intermediários na resistência contra infecções. A ação coordenada destes componentes é denominada resposta imunológica. Entretanto, o impacto da imunologia vai além das infecções sendo este mecanismo reconhecido e estudado na área oncológica (ABBAS et al., 2019).
O câncer de mama é uma patologia que possui diversas apresentações clínicas e subtipos moleculares e que se comporta de maneira altamente heterogênea. O subtipo molecular que será abordado nesse trabalho é o “triplo-negativo”, responsável pelo maior número de óbitos entre as mulheres, e que não apresenta nenhum dos três biomarcadores existentes empregados na classificação do câncer de mama. São eles: receptor de estrógeno, receptor de progesterona e proteína HER-2 (TAVARES, 2021).
Estimativas brasileiras para o câncer de mama em 2020 revelaram aproximadamente 66.280 novos casos, equivalente a uma taxa de 61,61% a cada 100 mil mulheres (TAVARES, 2021).
O câncer de mama triplo-negativo (TNBC) é responsável por 15 a 20% dos casos de câncer de mama. Esse tipo de neoplasia é diagnosticado com mais frequência em mulheres jovens, faixa etária de 18 a 34 anos e de etnia afrodescendente, e também em mulheres com sobrepeso durante os anos perimenopausa entre aquelas com alta paridade e menor tempo de amamentação (PINTO, 2019).
Compreendendo o sistema imunológico e sua atuação para o controle de células neoplásicas, é possível entender a importância da imunoterapia diante dessa patologia, ela tem como finalidade aumentar a capacidade do sistema imune no combate às células cancerígenas. Alguns tipos de imunoterapias serão descritos: o uso de inibidores de ponto de verificação imunológica (ICIs) e o uso de inibidores de PARP (Enzima reparadora de danos ao DNA). Embora os avanços da imunoterapia contra o câncer de mama triplo negativo sejam significativos, à medida que esta técnica avança, vão surgindo novos desafios.
Diante disso, questiona-se como o uso da imunoterapia induzirá uma resposta imunológica contra as células tumorais (FENG et al, 2021, SCHNEBLE et al., 2014).
2 JUSTIFICATIVA
Baseando-se na alarmante incidência dos avanços de novos casos de câncer de mama, tem sido proposta novas opções de tratamento para substituir os tratamentos convencionais (MIGOWSKI et al., 2018). De acordo com o levantamento bibliográfico realizado para esse estudo, nota-se que o câncer de mama triplo-negativo é um grupo heterogêneo e agressivo em relação aos outros subtipos, pois apresenta taxas metastáticas elevadas e menor sobrevida global. Assim, o uso da imunoterapia tem se tornado cada vez mais promissor, por se tratar de uma terapia celular adotiva que redireciona a resposta imune para o combate das células tumorais, isento da restrição ao complexo principal de histocompatibilidade (MHC). Diante disso, propõe-se a revisão integrativa a fim de verificar a imunoterapia como estratégia terapêutica diante do câncer de mama triplo-negativo (ENGELHARD et al., 2020).
3 OBJETIVOS
3.1 Objetivo geral
Realizar uma revisão bibliográfica integrativa sobre o uso de inibidores de ponto de verificação imunológica (ICIs) e o uso de inibidores de PARP (Enzima reparadora de danos ao DNA) utilizados para o tratamento do câncer de mama triplo-negativo.
3.2 Objetivo específico
Analisar os desfechos clínicos quando do uso de ICIs e de PARP para o tratamento do câncer de mama triplo-negativo.
4 REFERENCIAL TEÓRICO
4.1 Câncer de mama de triplo negativo: origem e diagnóstico
O câncer de mama surge em decorrência do crescimento descontrolado de células da mama que possuem características anormais (HARBECK,2019). O diagnóstico do câncer de mama é pautado por exames clínicos ginecológicos, incluindo o auto exame físico das mamas, além de exames complementares como mamografia e ultrassonografia de mama. Alguns sinais e sintomas iniciais são percebidos e requerem avaliação médica, como tumoração que não causa dor, retração e prurido no mamilo e linfonodos axilares aumentados (SARTORI, et al., 2019).
O câncer de mama triplo negativo (TNBC) é um tumor que não possui receptores de estrogênio, progesterona e a proteína HER2 (Figura 1) e representa de 15% a 20% de todos os cânceres de mama. Por apresentar comportamento agressivo a imunoterapia tem propiciado melhora da sobrevida tendo sido uma estratégia promissora para o tratamento do TNBC (KEENAN, 2020).
Figura 1: Histologia do TNBC
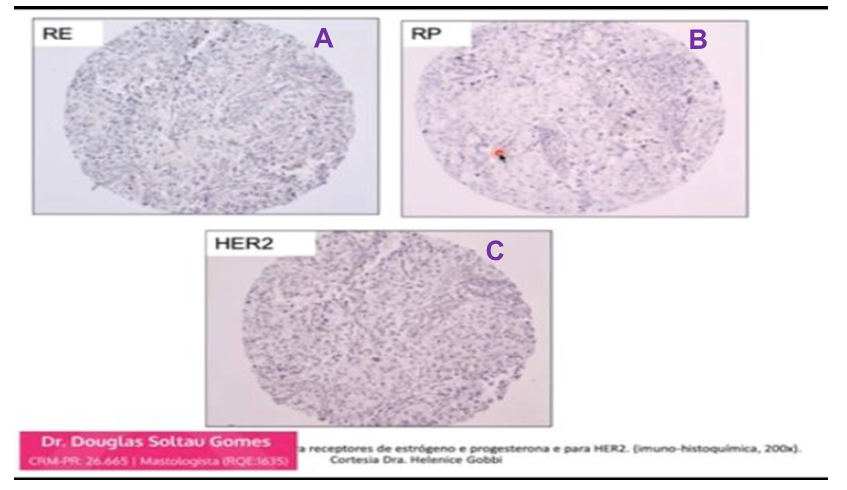
Legenda: A imagem mostra três tipos de lâminas diferentes do câncer de mama triplo-negativo: em (A) está representado a negatividade para os receptores de estrogênio, em (B) a negatividade para os receptores de progesterona e em (C) mostra a ausência de receptores para a proteína HER-2. Fonte: Dr. Douglas Gomes. Disponível em: https://www.youtube.com/watch?v=pXkL0dvO99o. Acesso em: 28 de julho de 2021.
Diferente dos outros subtipos de cânceres de mama, o TNBC possui uma dinâmica diferente, e apresenta maiores chances de recidiva e padrões de metástase, associados a um risco quatro vezes maior, e a uma sobrevida significativamente menor, quando comparado com outros subtipos (MASOUD, et al., 2017).
4.2 Imunoterapia
A imunoterapia tem como objetivo ativar a resposta imune para reconhecer tumores como corpos estranhos e eventualmente matar as células tumorais com a utilização de elementos do sistema imunológico com a finalidade de eliminar ou neutralizar essas células. Baseando-se nos tipos de imunidade o organismo dispõe da imunidade inata e adaptativa. A imunidade inata, refere-se ao tipo de imunidade presente desde o nascimento, não é capaz de gerar memória, reconhece estruturas comuns aos patógenos por meio de receptores de reconhecimento padrão, não requer exposição prévia ao organismo, dispõe de componentes celulares e barreiras físicas e químicas como a pele, mucosas, pH. A imunidade adaptativa, ou seja, aquela gerada ao longo da vida, é capaz de gerar memória imunológica contra os patógenos, sendo específica para cada antígeno e é subdividida em celular e humoral. Reconhecendo as características dos tipos de respostas nota-se que há vários meios de estimular respostas imunes antitumorais, como a inibição da supressão imune, utilização de determinadas citocinas que ativam células da imunidade inata dentre outros (RIETHER, et al., 2013, MITTENDORF, 2017).
Várias estratégias terapêuticas com capacidade de identificar células tumorais exploram os componentes da imunidade inata. Uma das estratégias é o uso de interferons e interleucinas, que são potentes agentes moduladores envolvidos na homeostasia imunológica (AROSA et al., 2012).
Com base na imunidade adquirida do tipo humoral, há outra opção de imunoterapia, que consiste na utilização de anticorpos monoclonais, também chamada de imunoterapia passiva. Este modelo de terapia conta com a produção de anticorpos específicos para antígenos expressos por células tumorais. Eles ligam-se às membranas dos antígenos das células tumorais, ativando sua lise mediante o transporte de substâncias citotóxicas ou pelo bloqueio de moléculas essenciais para viabilidade e proliferação das células tumorais (RIETHER et al., 2013).
Essas estratégias que fazem uso da imunidade humoral, também podem ser consideradas imunoterapias ativas, já que tem a finalidade de mobilizar e estimular as células que medeiam às respostas imunes específicas antitumorais. (HAMDY et al., 2011).
Outra técnica que se baseia na mobilização de células do sistema imunológico e na amplificação de respostas imunes, que reconhecem o tumor e procedem para sua eliminação, é a vacinação tumoral. Existem alguns tipos de vacinas para o tratamento do câncer de mama triplo negativo, as de células tumorais totais, de proteínas, de peptídeos e de citocinas (AROSA et al., 2012; RIETHER et al., 2013).
4.3 Imunoterapias utilizadas no câncer de mama triplo negativo
4.3.1 Inibidores de ponto de verificação imunológica
Uma das opções de imunoterapia no tratamento do TNBC, trata-se de inibidores de ponto de verificação imunológica (ICIs) também conhecidos como Inibidores imunes de checkpoint. Uma terapia bloqueadora dos checkpoints imunológicos que remove os sinais inibitórios da ativação de células T e possibilitam as células tumorais superarem os mecanismos reguladores do sistema imune. Em condições normais, os checkpoints imunológicos funcionam como sinais negativos para regular respostas inflamatórias que se seguem à ativação das células T. O PD-1, foi clonado em 1992, com a subsequente caracterização do seu ligante, o PDL-1, este ligante PDL-1 está expresso na superfície de alguns tumores, sendo importantes na função normal do sistema imune. Inibidores do PD-1 impedem o acoplamento deste ligante com o seu receptor, permitindo que o sistema imune reconheça as células tumorais (REIS et al., 2020).
Muitos tumores atualmente são conhecidos por utilizar este mecanismo para evitar o ataque das células T e sua morte celular, e anticorpos inibidores dirigidos contra a interação do PD-1 e seus ligantes demonstraram resposta antitumoral (Figura 2) (REIS et al., 2020).
Figura 2: Resposta antitumoral por linfócitos T e Inibidores de checkpoint imunológico CTLA-4 e PD-1.
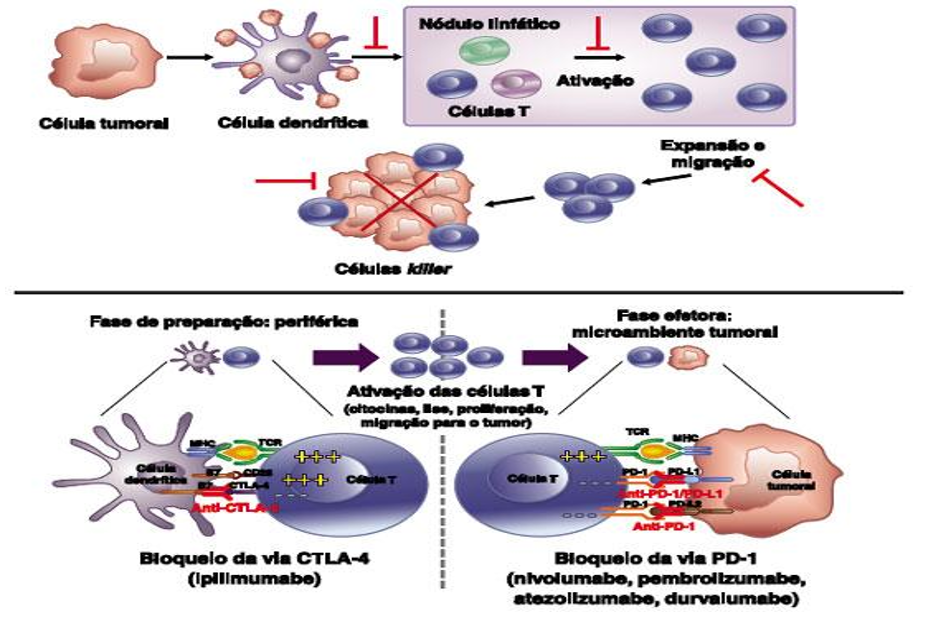
Fonte: ASBAI, 2021. Disponível em: http://aaai-asbai.org.br/detalhe_artigo.asp?id=1062. Acesso em: 13/10/2021.
A imunoterapia com inibidores de ponto de verificação imunológica restaura e normaliza através de uma seleção de respostas imunes do corpo, interrompendo os sinais imuno inibitórios mediados por PD-1, PD-L1 e proteína citotóxica associada ao linfócito T4 (CTLA-4), proteína presente em algumas células T, que atua impedindo a liberação de linfócitos para atacarem o microambiente tumoral. A resposta à imunoterapia com inibidores de ponto de verificação é bastante limitada e em termos de eficácia, não há comparações entre PD-1 e PD-L1, o que pode afetar o potencial antitumoral são os diferentes alvos e interações imunológicas dos inibidores PD-1 e PD-L1 (FENG et al., 2021).
Com o intuito de evitar o reconhecimento ou a destruição tumoral pelo sistema imunológico, os tumores exploram vários mecanismos. Em sua superfície existem dois receptores celulares chave, o PD-L1 e a CTLA-4, que se ligam a PD-1, receptor expresso na superfície da célula T, assim disfarçando o sistema imunológico para que não seja atacado. Para PD-1 a expressão ligante é PD-L1, que ocorre frequentemente em células tumorais, causando de imediato a morte das células T. O mecanismo de ação da imunoterapia, irá bloquear esses pontos de verificação imunológico, envolvendo CTLA-4, PD-L1 e PD-1, ou seja, bloqueando essa ligação de PD-L1 com PD-1, o tumor não consegue se disfarçar e o sistema imunológico passa a reconhecer e atacar a célula tumoral (KITAGAWA, 2020).
A ativação da sinalização PD-1 e PD-L1 refere-se ao mecanismo principal pelo qual os tumores escapam às respostas imunológicas das células T específicas do antígeno (Figura 3). O uso de anticorpos bloqueadores de PD-1 ou PD-L1 reverte esse processo e melhora a atividade imune antitumoral (WILSON, 2021).
Figura 3: Ativação da Sinalização PD-1 à PD-L1
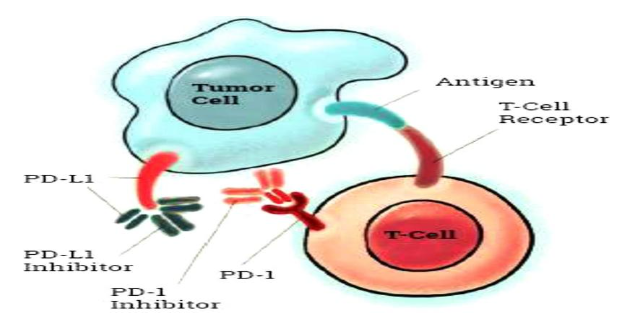
Legenda: A célula do sistema imune possui a proteína PD-1 conjunta com anti-PDL1, a célula tumoral possui PD-L1 assim elas se ligam e o tumor consegue escapar da resposta imunológica.
Fonte: Parthymos, 2020.
Os anticorpos monoclonais que têm como alvo PD-1 ou PD-L1 podem bloquear essa ligação e estimular a resposta imunológica contra as células cancerígenas. Esses medicamentos se mostraram úteis no tratamento de vários tipos de câncer (REIS; MACHADO, 2021).
Exemplos de medicamentos que têm como alvo a PD-1 incluem: Pembrolizumab, Nivolumab. Como inhibidores de PD-L1 cita-se o Atezolizumab, Avelumab e Durvalumab.
Dentre esses, destaca-se o uso do Atezolizumab e Pembrolizumab no TNBC, como os principais bloqueadores de ponto de verificação imunológica (KWAPISZ, 2020).
4.3.2 Inibidores de PARP
Outra alternativa para o tratamento do TNBC, são os inibidores PARP. As isoenzimas PARP referem-se às vias de reparo para excisão de bases no DNA. No caso de mutações do câncer de mama, os inibidores de PARP, direcionam e bloqueiam o único sistema de reparo do DNA em funcionamento, favorecendo a morte de células tumorais de forma alvo específica, evitando dano às células saudáveis e limitando a toxicidade para a paciente (BANERJEE, et al., 2013).
Como exemplo deste tipo de imunoterapia alvo cita-se o anticorpo monoclonal Cetuximabe (BANERJEE, et al., 2013). Os inibidores PARP é um exemplo de escolha terapêutica quando genes que realizam o reparo do DNA encontra-se defeituoso, os genes BRCA 1 e BRCA 2, são genes que codificam proteínas nucleares expressas que são conservadas com integridade genômica por regular o reparo de DNA, sua função é impedir a formação de tumores por meio do reparo no DNA alterado. Sendo assim, quando esses genes já não conseguem mais realizar o reparo do dano causado ao DNA, PARP é a única via de reparo restante e quando ela é inibida ocorre a morte celular (LAJUS, 2010).
5 MATERIAIS E MÉTODOS
Trata-se de uma revisão bibliográfica integrativa cujo tema é “Imunoterapia no tratamento do câncer de mama triplo negativo”. Para as buscas científicas desta revisão partimos da seguinte pergunta norteadora: “Qual o desfecho clínico de pacientes portadoras de TNBC submetidas a imunoterapia? Foram selecionados artigos das bases de dados eletrônicos: Scielo (Scientific Eletronic Library Online – Biblioteca Científica Online), PubMed (Público/Editora Medline), Medline (Medical Literature Analysis and Retrieval System Online), LILACS (Literatura Latino-Americana e do Caribe em Ciências da Saúde).
Após consulta aos Descritores em Ciências da Saúde (DeCS), elegeram-se os seguintes descritores: “TNBC”, “Inibidores de Check-point” e “Inibidor de PARP” para realização da busca nas bases de dados SciELO e LILACS. Após consulta aos Medical Subject Headings (MeSH), escolheram-se os seguintes descritores: “Triple negative breast neoplasms”, “Blocking of PD-1 and PD-L1”, “PARP inhibitor”.
Os critérios de inclusão foram artigos de 2016 a 2021; em idiomas português ou inglês; considerou-se apenas estudos clínicos, independente da metodologia, com utilização de imunoterapia em pacientes com idade igual ou superior a 18 anos; com diagnóstico de câncer de mama triplo-negativo com confirmação anatomopatológica e por imuno-histoquímica. Foram excluídos artigos de opinião, editoriais, relatos de casos e/ou experiência, cartas ao editor, comentários e revisão bibliográfica. A partir da seleção final dos artigos, foram extraídas as seguintes informações: classificação do tipo de câncer, fármacos utilizados, fase clínica, associações entre imunoterapia e outras terapias já existentes, mecanismo de ação e desfecho clínico
6 RESULTADOS E DISCUSSÃO
A partir da análise realizada, optou-se por produzir um fluxograma que possibilitou apresentar todos os artigos escolhidos de maneira sintética para uma visão mais ampla (Figura 4).
Figura 4: Representação Esquemática Metodológica
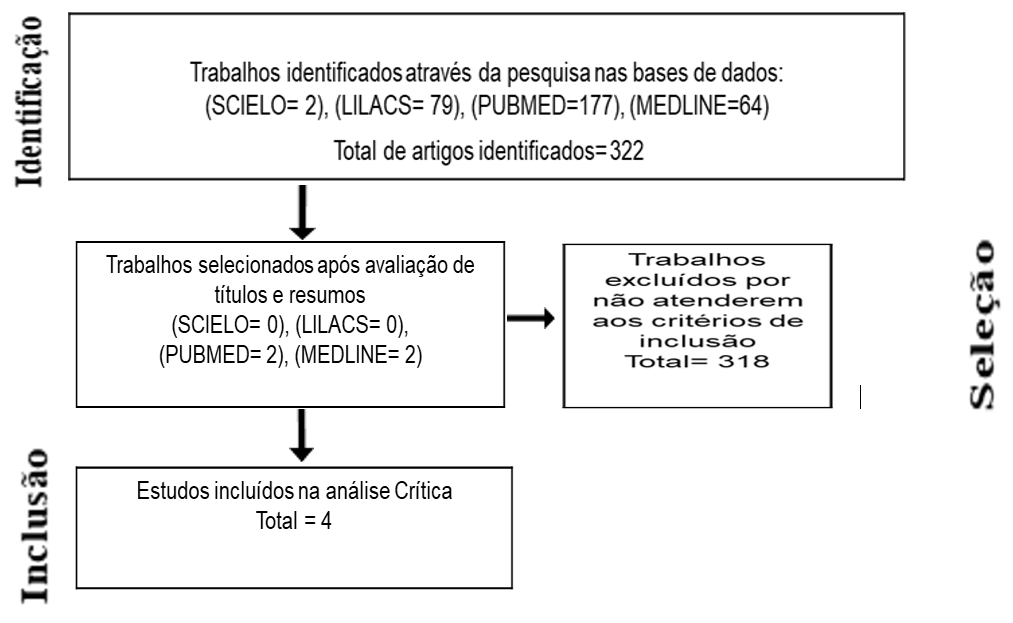
Legenda: Representação Esquemática dos métodos de identificação, seleção e inclusão de artigos na revisão de acordo com o PRISMA Flow Diagram.
Fonte: Elaborada pelas autoras, 2021.
Nas tabelas abaixo 1, 2 e 3 temos as informações retiradas dos artigos selecionados, vale ressaltar que essas informações descritas nas tabelas tratam-se dos mesmos artigos, embora esteja dividida nas tabelas. Para a construção da tabela 1, houve primeiramente a distribuição dos estudos clínicos selecionados para essa revisão, considerando-se o título, os autores, o periódico, o ano e o país, através das buscas científicas nas bases de dados: LILCAS, MEDLINE, PUBMED e SCIELO. No que diz respeito ao ano, os artigos foram publicados de 2016 a 2021.
Tabela 1 – Distribuição dos estudos selecionados de acordo com a ordem na tabela, título, autores, periódico, ano de publicação e o país.
N° Título Autores Periódico Ano País
1 Checkpoint inhibitor therapy for metastic triple-negative breast câncer
(HEEKE, Arielle et al., 2021)
Revista Cancer and Metastasis
2021
USA
2 Immunohistochermical comparison of theree programmed death-ligant 1 (PD-L1) assays in triple-negative breast câncer
(YOSHIKAWA, Katsuhiro et al., 2021)
Plos One
2021
Japão 3 Immnune checkpoint blockade in triple negative breast câncer influenced by B cells through myeloid-derived supressor cells
(VITO, Alyssa et al., 2021)
Communications biology
2021
USA 4 Long-term clinical outcomes and biomarker analyses of atezolizumab therapy for patients with metastic triple-negative
(EMENS, Leisha et al., 2018)
Jama Oncology
2018
USA
Fonte: Elaborado pelas autoras, 2021.
Na tabela 2, estão representados os resultados cuja organização se deu conforme: autor, características do tumor, alvo farmacológico, fase clínica.
Tabela 2: Análise prévia documental dos dados obtidos na pesquisa na base de dados.
Autor Características do tumor
Alvo farmacológicoFase clínica
(HEEKE, Arielle et al., 2021)Negativo para receptores hormonais (estrógeno, progesterona, Hers2 – receptor epidérmico humano2).Alteração nos genes BRCA 1/2. Para o anticorpo anti CTLA-4 ipilimumabe, anticorpos anti-PD1 pembrolizumabe, nivolumabe e cemiplimabe e anticorpos anti-PD-L1 atezolizumabe, avelumabe e durvalumabe.Quimioterapia – nab-paclitaxel, paclitaxel, gencitabina / carboplatina.
Fase clínica II(YOSHIKAWA, Katsuhiro et al., 2021) Alterado pela ausência de receptores de estrogênio e progesterona e do receptor 2 do fator de crescimento epidérmico humano (HER2) Agente anti-PD-L1 (atezolizumabe) mais nab-paclitaxel
Fase II
VITO, Alyssa et al., 2021)Doença agressiva por conta da ausência de receptores hormonais e HER2 positivo FEC (fluorouracil, epirrubicina e ciclofosfamida) e(oHSV-1) virus oncolítico
Fase I
(EMENS, Leisha et al., 2019)Prognóstico pior do que aqueles com outros subtipos de câncer de mama, por ser negativo para receptores hormonais que seria alvo em tratamentos.
Atezolizumab
Fase I
Fonte: Elaborado pelas autoras, 2021.
Na tabela 3, estão descritas as seguintes informações: associações entre imunoterapia e outras terapias já existentes, mecanismo de ação e desfecho clínico.
Tabela 3: Análise prévia documental dos dados obtidos na pesquisa na base de dados.
Autor
Imunoterapia e outras terapias já existentes
Mecanismo de ação
Desfecho clínico
(HEEKE, Arielle et al., 2021)Monoterapia com anticorpos específicosTerapias existentes como a quimioterapia. Pacientes com câncer de mama triplo negativos através do tratamento com inibidores de ponto de verificação imunológica, diminui a ligação de PD-1 e PD-L1, reduzindo a inatividade de células imunes de reconhecer o tumor juntamente com medicamentos da quimioterapia, auxiliando na morte de células tumorais. Combinação de inibidores PD1 / PD-L1 com quimioterapia têm mostrado resultados promissores em TNBC metastático, localmente avançado e em estágio inicial
(YOSHIKAWA, Katsuhiro et al., 2021)Imunoterapia anti- PD-L1Outras terapias existentes não foram citadas. A junção de atezolizumab e nab-palictaxel, favoreceu o reconhecimento da célula tumoral pelo sistema imunológico. Atezolizumab mais nab-paclitaxel prolongou a sobrevida livre de progressão em pacientes TNBC PD-L1 avançado ou metastático
(VITO, Alyssa et al., 2021)Imunoterapia com o intuito de regular positivamente as vias de sinalização do receptor de células B, fazendo com que os tumores de TNBC, pudessem responder positivamente ao ICIssofrendo morte celular permitindo que os tumores de mama imunogenicamente frios respondam melhor ao bloqueio de ponto de verificação imunológico. FEC + oHSV-1 é capaz de sensibilizar tumores ao bloqueio de ponto de verificação imunológica, transformando um tumor de frio imune em imunogênico aumentando os linfócitos infiltrantes no tumor. Houve o atraso do crescimento do tumor em alguns camundongos e sobrevida significativamente estendida, com 10% dos camundongos resultando em regressão tumoral durável.
(EMENS, Leisha et al., 2019)Monoterapia utilizando o atezolizumab Atezolizumabe é um anticorpo monoclonal humanizado projetado que inibe seletivamente a interação de PD-L1 com seus receptores PD-1 revigorando assim a imunidade tumoral. O atezolizumabe como agente único foi bem tolerado e proporcionou benefício clínico durável em pacientes com TNBC com doença estável.
Fonte: Elaborado pelas autoras, 2021.
Os resultados demonstram estudos de HEEKE, Arielle et al., 2021, YOSHIKAWA, Katsuhiro et al., 2021, VITO, Alyssa et al., 2021 e EMENS, Leisha et al., 2018 associados ao de ICIs e nenhum dos estudos utilizou PARP como tratamento imunoterápico. Vale ressaltar que a ação de ICIs consiste em uma terapia bloqueadora dos checkpoints imunológicos que remove os sinais inibitórios da ativação de células T e possibilitam as células tumorais superarem os mecanismos reguladores do sistema imune enquanto que, no caso de mutações do câncer de mama, os inibidores de PARP, direcionam e bloqueiam o único sistema de reparo do DNA em funcionamento, favorecendo a morte de células tumorais de forma alvo específica, evitando dano às células saudáveis e limitando a toxicidade para a paciente.
O estudo de HEEKE e colaboradores destaca que o bloqueio de checkpoint imunológico, que limita as vias inibitórias na infiltração tumoral CD8+ e CD4+ linfócitos (TILs), tem demonstrado sucesso clínico em uma ampla variedade de tipos de câncer. Esses anticorpos visam o bloqueio de PDL1 com PD1, garantindo assim que o sistema imunológico elimine essas células tumorais (HEEKE, Arielle et al., 2021).
O estudo ainda reporta quando da comparação do uso de PARP e ICIs no tratamento do TNBC que os ICIs foram mais efetivos (HEEKE, Arielle et al., 2021).
Verificamos também que o estudo de YOSHIKAWA, Katsuhiro et al., 2021 relata que, a taxa de sucesso de ICIs em pacientes TNBC se dá pela indução do medicamento atezolizumab juntamente com outros fármacos imunoterapicos e/ou quimioterápicos como o nab-paclitaxel que foi capaz de prolongar a sobrevida beneficiando pacientes diagnosticadas com TNBC.
Foi evidenciado por VITO, Alyssa et al., 2021 a utilização dos fármacos quimioterápicos como o fluorouracil, epirrubicina e ciclofosfamida (FEC) e vírus oncolítico (oHSV-1) com o intuito de regular positivamente as vias de sinalização do receptor de células B, o que contribuiu para boa resposta de TNBC quando da associação com os ICIs, tendo sido observado o aumento da sobrevida e regressão tumoral.
Outro estudo destacou que o atezolizumab visa direcionar a inibição de forma seletiva, interagindo com o PD-L1, sendo um ICIs bastante eficaz para desencadear respostas anti tumorais em pacientes TNBC, demonstrando clinicamente um benefício a longo prazo e uma tolerabilidade acentuada (EMENS, Leisha et al., 2019).
NANDA, Rita et al., 2016 explica que o medicamento pembrolizumab – anticorpo monoclonal e também um ICIs tem como afinidade a seleção de PD-1. Durante a investigação de segurança do medicamento como agente único para o TNBC foi evidenciado que o pembrolizumab apresentou uma tolerância aceitável e benefício clínico, porém com uma alta incidência de reações adversas relacionadas ao tratamento levando a uma considerável toxicidade ao paciente, sendo demonstrado no estudo que as doses que antes eram aplicadas a cada duas semanas, foram alteradas para uma vez a cada três semanas.
EMENS, Leisha et al.,2021 relatou o mesmo achado dos estudos discutidos anteriormente em relação a inibição de PD-L1, que representa um tratamento eficaz contra o câncer de mama em pacientes triplo negativo. Relativamente, o estudo a longo prazo com os medicamentos atezolizumab e nab-paclitaxel, evidencia que não houve grande proporção de eventos adversos e toxicidade tardia, sobrevida de três anos melhora extremamente relevante dos pacientes, salientando que o PD-L1 é favorável para utilização do atezolizumab e nab-paclitaxel.
As fases clínicas descritas perante os trabalhos discutidos, relatam estudos com procedência de análises, sendo que a cada avanço é classificado uma fase de acordo com a situação e andamento da pesquisa conforme objetivo. Os estudos pré-clínicos exibem o que está sendo discutido, passando de uma evidência teórica partindo para a prática, verificando a sua eficiência em células humanas ou em animais. Já o estudo de fase I reporta a possibilidade de um certo grupo limitado de participantes perante um determinado tempo, para uma avaliação preliminar e segurança naquela prática. O estudo de fase II entra em um período de tempo maior, onde é analisado a definição e eficácia da droga utilizada em pacientes portadores da doença investigada, seguindo-se ao estudo de fase III que promove uma experiência comparativa, riscos como reações adversas, benefícios e intenção de incorporação do medicamento ao tratamento examinado.
Vale ressaltar que apesar da revisão integrativa permitir a inclusão de estudos experimentais e não-experimentais para uma compreensão completa do fenômeno analisado neste trabalho optou-se apenas pela análise de estudos clínicos visando a interpretação dos dados oriundos de pesquisa o que limitou o número dos artigos selecionados.
8 CONCLUSÃO
O câncer de mama triplo negativo e as estratégias terapêuticas para seu tratamento, ainda representa um grande desafio, requerendo novos estudos em torno da descoberta de novos biomarcadores prognósticos e de novas abordagens para o tratamento.
A imunoterapia contra o câncer já é uma alternativa bem estabelecida e mostra-se satisfatória em muitos tipos de tumores malignos, inclusive em tipos refratários ao tratamento convencional. Embora seja recente, os resultados com anticorpos inibidores de PARP, PD-1 e PD-L1 é promissor. Tratando-se de ICIs, este mostra-se mais satisfatório, pois a taxa de sobrevida e sucesso no tratamento tem sido maior. Sendo assim, ainda se faz necessário ensaios de acordo com o biomarcador tumoral específico, a fim de avaliar se algum subgrupo tem maior benefício ao tratamento.
Novas pesquisas estão em andamento, com o objetivo de otimizar e criar novas estratégias de tratamento, bem como a identificação de biomarcadores, pois o TNBC ainda carece de estratégias terapêuticas viáveis na prática clínica. Com o avanço destes estudos, espera-se que a imunoterapia contra o câncer seja popularizada e beneficie cada vez mais pacientes.
REFERÊNCIAS
ABBAS, Abul.K; LICHTMAN, Andrew. H. Imunologia Celular e Molecular. 9º ed. Rio de Janeiro: Lidel, 2019.
ALVES, Daniela Celestino et al. Atezolizumabe como Abordagem Imunoterapêutica para o Manejo Clínico do Câncer de Mama Triplo Negativo – Revisão da Literatura. Revista Farmácia Generalista. v.3, n.1, p. 1-16. Junho, 2021. Disponível em: ˂https://publicacoes.unifal-mg.edu.br/revistas/index.php/revistafarmaciageneralista/article/view/1328˃. Acesso em: 27 de agosto de 2021.
AROSA, Fernando et al. Fundamentos de Imunologia. 2ª ed. Lisboa: Lidel, 2012.
BANERJEE, Susana; KAYE, Stanley B. New strategies in the treatment of ovarian cancer: current clinical perspectives and future potential. Final Version. v.19. p. 1-9. Março, 2013. Disponível em:<https://clincancerres.aacrjournals.org/content/19/5/961.long>. Acesso em: 27 de agosto de 2021.
CHICK, Connor R et al. Subgroup analysis of nelipepimut-S plus GM-CSF combined with trastuzumab versus trastuzumab alone to prevent recurrences in patients with high-risk, HER2 low-expressing breast cancer. Elsevier. v. 225. Abril, 2021. Disponível em: <https://www.sciencedirect.com/science/article/abs/pii/S1521661621000164?via%3Dihub>. Acesso em: 28 de agosto de 2021.
CRUZ, Cristina et al. Long-term Clinical Outcomes and Biomarker Analyses of Atezolizumab Therapy for Patients With Metastatic Triple-Negative Breast Cancer. JAMA Oncology. p.1-9. doi: 10.1001/jamaoncol.2018.4224. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6439773/. Acesso em: 20 de janeiro de 2022.
EMENS, L. A. et al. First-line atezolizumab plus nab-paclitaxel for unresectable, locally advanced, or metastatic triple-negative breast cancer: IMpassion130 final overall survival analysis. Elsevier. v.32. p. 1-11. Julio, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34272041/. Acesso em 20 de janeiro de 2022.
ENGELHARD, Vitor H et al. MHC-restricted phosphopeptide antigens: preclinical validation and first-in-humans clinical trial in participants with high-risk melanoma. PubMed Central. v.8. doi. 10.1136/jitc-2019-000262. Maio, 2020. Disponível em:< https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7228659/>.Acesso em: 03/11/2021.
FENG, Dongfeng et al. Excellent Response to Atezolizumab After Clinically Defined Hyperprogression Upon Previous Treatment With Pembrolizumab in Metastatic Triple-Negative Breast Cancer: A Case Report and Review of the Literature. PubMed Central. v. 12. p. 1-9. Maio, 2021. Disponível em: ˂https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8201609/˃. Acesso em: 28 de agosto de 2021.
HAMDY, Samar, HADDADI, Azita, HUNG, Ryan. W, LAVASSANIFAR, Afsaneh. Targeting dendritic cells with nano-particulate PLGA cancer vaccine formulations. Elsevier. v.63. Setembro, 2011. Disponível em: < https://pubmed.ncbi.nlm.nih.gov/21679733/>. Acesso em: 29 de agosto de 2021.
HARBECK, Nadia et al. Breast Cancer. Nature Rewies v.5, n.66. Setembro, 2019. Disponível:< https://www.nature.com/articles/s41572-019-0111-2>. Acesso em: 29 de agosto de 2021.
HEEKE, L. Arielle et al. Checkpoint inhibitor therapy for metastatic triple-negative breast cancer. Nature Public Health Emergency Collection. doi: 10.1007/s10555-021-09972-4. p. 1-11. Junho, 2021. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8184866/#:~:text=Taken%20together%2C%20checkpoint%20inhibitors%20as,and%20in%20immune%20enriched%20tumors. Acesso em 20 de janeiro de 2022.
HIGGINS, Michaela J; BASELGA, José. Targeted therapies for breast cancer. PubMed Central. v.12, p.1-7. Outubro, 2011. Disponível em: ˂https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3195649/pdf/JCI57152.pdf˃. Acesso em: 30 de agosto de 2021.
KEENAN, Tanya. E, TOLANEY, Sara. M. Role of immunotherapy in triple-negative beast cancer. Journal of the National Comprehensive Cancer Network. v.8, p. 1-11. Abril, 2020. Disponível em: < https://jnccn.org/view/journals/jnccn/18/4/articlep479.xml?ArticleBodyColorStyles=Inline%20PDF>. Acesso em: 30 de agosto de 2021.
KITAGAWA, Shingo et al. Switching administration of anti‐PD‐1 and anti‐PD‐L1 antibodies as immune checkpoint inhibitor rechallenge in individuals with advanced non‐small cell lung cancer: Case series and literature review. PubMed Central. v.11, p. 1-7. Julho, 2020. Disponível em: ˂https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7327670/pdf/TCA-11-1927.pdf˃. Acesso em: 30 de agosto de 2021.
KWAPISZ, Dorota. Pembrolizumab and Atezolizumab in triple negative breast cancer. Springer Link. doi. 10.1007/s00262-020-02736-z. Outubro, 2020. Disponível em: https://link.springer.com/article/10.1007%2Fs00262-020-02736-z. Acesso em: 13 de outubro de 2021.
LAJUS, Tirzah Braz Petta. A utilização de inibidores de PARP na profilaxia e no tratamento no câncer de mama deficiente no gene BRCA 1. Revista de Ciências Médicas e Biológicas. v.9, n.3, p. 1-5. Janeiro, 2010. Disponível em: ˂https://periodicos.ufba.br/index.php/cmbio/article/view/5167/3733˃. Acesso em: 03 de setembro de 2021.
MASOUD, Viviana et al. Targeted therapies in breast cancer: New challenges to fight against resistance. World Journal of Clinical Oncology. v. 8, p. 1-16. Abril, 2017. Disponível em: ˂https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5385433/pdf/WJCO-8-120.pdf˃. Acesso em: 03 de setembro de 2021.
MIGOWISK, Arn et al. Diretrizes para detecção precoce do câncer de mama no Brasil. II- Novas recomendações nacionais, principais evidencias e controvérsias. Cadernos de Saúde Pública. v.8. Junho, 2018. Disponível em:< https://www.scielo.br/j/csp/a/8gGyb5s9Nt3nSsw5GFnnPQb/?lang=pt&format=pdf. Acesso em: 03/11/2021.
MITTENDORF, Elizabeth A et al. Injecting Hope-A Review of Breast Cancer Vaccines. PubMed Central. v.8. Abril, 2017. Disponível em: < https://www.cancernetwork.com/view/injecting-hope-review-breast-cancer-vaccines>. Acesso em: 03 de setembro de 2021.
MITTENDORF, Elizabeth A et al. PD-L1 expression in triple-negative breast câncer. PubMed Central. p.1-17. Abril, 2014. Disponível em: < https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4000553/pdf/nihms555953.pdf>. Acesso em: 10 de setembro de 2021.
NANDA, Rita et al. Pembrolizumab in Patients With Advanced Triple-Negative Breast Cancer: Phase Ib KEYNOTE-012 Study. Journal of clinical oncology. p.1-10. v.34. n.21. Julio, 2016. Disponível em: https://pubmed.ncbi.nlm.nih.gov/27138582/. Acesso em: 20 de Janeiro de 2022.
PINTO, Micheli Baggio. Carcinoma de Mama Triplo-Negativo: Correlações e Terapêutica. Trabalho de Conclusão de Curso, Graduação em Medicina. Universidade Federal de Santa Catarina. Florianópolis, 17 p, 2019.
REIS, Ataualpa Pereira, MACHADO, José Augusto Nogueira. Imunoterapia no câncer – inibidores do checkpoint imunológico. Arquivos de Asma, Alergia e Imunologia (ASBAI). v.4, n.1. Janeiro, 2020. Disponível em: < http://aaai-asbai.org.br/detalhe_artigo.asp?id=1062>. Acesso em 13 de outubro de 2021.
RIETHER, Carsten, SCHÜRCH, Christian, OCHSENBEIN, Adrian. F. From “magic bullets” to specific cancer immunotherapy. Swiss Medical Weekly. p.1-12. Janeiro, 2013. Disponível em: ˂file:///C:/Users/Usu%C3%A1rio/Downloads/smw_2013_13734.pdf˃. Acesso em: 10 de setembro de 2021.
SARTORI, Ana Clara N; BASSO, Caroline s. Breast Cancer: a brief review of the literature. Perspectiva. v.43, n.161. Março, 2019. Disponível em: < https://www.uricer.edu.br/site/pdfs/perspectiva/161_742.pdf>. Acesso em: 10 de setembro de 2021.
SCHNEBLE, Erika J et al. The HER2 peptide nelipepimut-S (E75) vaccine (NeuVax™) in breast cancer patients at risk for recurrence: correlation of immunologic data with clinical response. Future Medicine. v. 6, n 5. Junho, 2014. Disponível em: ˂https://www.futuremedicine.com/doi/epub/10.2217/imt.14.22˃. Acesso em: 10 de setembro de 2021.
TAVARES, Dione Fernandes et al. O estado da Arte da Imunoterapia no Tratamento do Câncer de Mama Triplo-Negativo: Principais drogas, Associações, Mecanismo de Ação e Perspectivas Futuras. Revista Brasileira de Cancerologia (RBC). v. 67, n.2, p.1-10. Março, 2021. Disponível em: < https://rbc.inca.gov.br/revista/index.php/revista/article/view/1014>. Acesso em 10 de setembro de 2021.
VITO, Alyssa et al. Immune checkpoint blockade in triple negative breast cancer influenced by B cells through myeloid-derived suppressor cells. Communications Biology. p. 1-19. n.859. Julho, 2021. Disponível em: https://www.nature.com/articles/s42003-021-02375-9. Acesso em: 20 de janeiro de 2022.
WILSON, Damien Jonas. Proteína Programada 1 da Morte Celular (PD1). News Medical Life Sciences. Maio, 2021. Disponível em: ˂https://www.news-medical.net/health/Programmed-Cell-Death-Protein-1-(PD1)-(Portuguese).aspx˃. Acesso em: 10 de setembro de 2021.
YOSHIKAWA, Katsuhiro et al. Immunohistochemical comparison of three programmed death-ligand 1 (PD-L1) assays in triple-negative breast cancer. Plos One. p. 1-20. v.8. n. 6. doi: 10.1371. Setembro, 2021. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8462691/. Acesso em: 20 de janeiro de 2022.
