REGISTRO DOI: 10.69849/revistaft/th102412011117
Júlia Beatriz Machado Viana
Orientador: Prof. Dr. Aldo Francisco A. Neto
RESUMO
O sistema imunológico possui mecanismos avançados para combater entretanto, certos patógenos conseguem evadir as defesas deste sistema. A imunossupressão provocada por infecções transmitidas pelo carrapato marrom (Rhipicephalus sanguineus) reduz a eficácia da resposta imune, aumentando os riscos de progressão tumoral e de falhas no tratamento em pacientes oncológicos. Essa condição torna ainda mais essencial o monitoramento e a avaliação constante, permitindo um manejo mais adequado e preventivo para esses pacientes. O desenvolvimento do câncer pode estar associado a fatores etiológicos como agentes químicos, físicos e genéticos. Entre eles, os agentes químicos e físicos desempenham um papel significativo, uma vez que sua identificação e controle podem ser essenciais na prevenção do câncer em animais. No Brasil, o carrapato marrom do cão ainda apresenta alta prevalência, o que expõe os animais a um risco constante de infecção e aumenta a possibilidade de que hemoparasitoses fiquem incubadas em seu organismo e ressurgindo quando o sistema imunológico é suprimido como em pacientes oncológicos. É evidente a necessidade de mais pesquisas relacionadas a doenças concomitantes em pacientes oncológicos, a fim de reduzir intercorrências no tratamento e melhorar a qualidade de vida desses animais. O aprofundamento no entendimento de como essas doenças afetam o sistema imunológico podem contribuir para estratégias de tratamento mais eficazes em casos isolados e de co-infecções.
Palavras–chave: Imunossupressão. Hemoparasitas. Neoplasias. Monitoramento. Saúde animal.
ABSTRACT
The immune system has advanced mechanisms to combat invaders; however, certain pathogens are able to evade these defenses. Immunosuppression caused by infections transmitted by the brown dog tick (Rhipicephalus sanguineus) reduces the effectiveness of the immune response, increasing the risks of tumor progression and treatment failures in cancer patients. This condition makes continuous monitoring and evaluation even more essential, allowing for more appropriate and preventive management for these patients. Cancer development can be associated with etiological factors such as chemical, physical, and genetic agents. Among them, chemical and physical agents play a significant role, as their identification and control can be crucial in cancer prevention in animals. In Brazil, the brown dog tick still has a high prevalence, which exposes animals to a constant risk of infection and increases the likelihood that hemoparasites will be incubated in their bodies and reappear when the immune system is suppressed, as in cancer patients. There is a clear need for more research related to concomitant diseases in cancer patients to reduce complications in treatment and improve the quality of life of these animals. A deeper understanding of how these diseases affect the immune system can contribute to more effective treatment strategies in isolated cases and co-infections.”
Keywords: Immunosuppression. Hemoparasites. Neoplasms. Monitoring. Animal health.
INTRODUÇÃO
O sistema imunológico é um conjunto integrado de mecanismos de defesa, cuja função é proteger o organismo, eliminando ou controlando a maior parte dos microrganismos invasores (Tizard, 2014). No entanto, quando esse sistema é atacado por patógenos ou células anormais e não consegue combatê-los de maneira eficaz, ele entra em um estado de imunossupressão. Nessa condição, o sistema imunológico encontra-se enfraquecido, o que aumenta a vulnerabilidade a infecções, doenças e outras complicações graves. A imunossupressão pode ser desencadeada por diversas causas, entre elas, a infecção por hemoparasitas.
Uma pesquisa sobre hemoparasitoses em cães e gatos, fundamentada em uma revisão de artigos e estudos científicos nacionais entre 2010 e 2020, revelou elevados índices de infecção por parasitas do gênero Babesia spp. em cães. Outro hemoparasita importante para a imunossupressão é o Ehrlichia canis, sendo ambos transmitidos por carrapatos da espécie Rhipicephalus sanguineus (Pereira, 2021).
Além disso, a imunossupressão também pode ser provocada por doenças crônicas, como o câncer, que apresenta uma dinâmica diferente em relação ao sistema imunológico. Ainda que o sistema imunológico seja primariamente direcionado contra microrganismos invasores, ele também é capaz de destruir células hospedeiras anormais. O câncer, caracterizado pelo crescimento desordenado de células, pode originar tumores malignos ou benignos, e essas células anormais podem ser reconhecidas pelo sistema imune como diferentes das células normais, desencadeando uma resposta imunológica, ainda que nem sempre eficiente segundo (Tizard, 2014).
OBJETIVOS
Objetivos gerais
Este estudo tem como objetivo enfatizar a relevância do monitoramento contínuo de coinfecções em pacientes oncológicos imunossuprimidos, com foco na compreensão das alterações imunológicas que ocorrem nesses pacientes. O estudo também visa identificar os riscos associados à ausência de acompanhamento de infecções parasitárias, em especial aquelas transmitidas pelo carrapato marrom, e destacar a importância de medidas preventivas para minimizar complicações causadas por infecções e reinfecções, sublinhando a necessidade de uma investigação detalhada desde o início do tratamento oncológico.
Objetivos específicos
Este estudo tem como objetivos específicos realizar uma revisão bibliográfica buscando as principais alterações imunológicas em pacientes imunossuprimidos por hemoparasitoses e doença oncológica, além de investigar o papel dos parasitas transmitidos pelo carrapato marrom (Rhipicephalus sanguineus) na ocorrência de coinfecções em cães com câncer. Busca-se demonstrar a relevância do acompanhamento contínuo de pacientes imunossuprimidos com objetivo de reduzir os danos nestes pacientes monitorando-os desde o princípio do tratamento.
REVISÃO DE LITERATURA
3.1. Imunidade aos parasitas
É importante destacar que os parasitas conseguem escapar da resposta imunológica do hospedeiro por tempo suficiente para se multiplicarem. Como mencionado, uma característica comum a todas as infestações parasitárias é sua habilidade de bloquear ou retardar de forma significativa as defesas inatas e adaptativas do hospedeiro (Tizard,1998)
Diferente das infecções agudas, que são as que possuem curta duração, as infecções causadas por agentes parasitários costumam ser crônicas, ou seja, de longa duração,esses parasitas em sua maioria possuem mecanismos evoluídos para escapar das consequências das respostas imunes.(Tizard, 1998). Pode-se concluir que por possuírem esse fator, conseguem persistir por longos períodos de tempo em um hospedeiro.
Os parasitas desenvolveram-se tanto, que são capazes de sobreviver em meio a resposta imunológica do organismo. Além disso, os protozoários parasitas, em busca de escapar das respostas imunes, muitas vezes, parasitam indivíduos imunossuprimidos. (Tizard; 1998)
Os parasitas protozoários possuem técnicas de evasão ao organismo do hospedeiro que são muito eficientes, entre essas técnicas pode-se citar que alguns desses protozoários tornam-se não antigênicos, e que desenvolvem a capacidade de alterar os antígenos superficiais das células repetidamente e de forma rápida (Tizard; Oliveira, 1998).
Os antígenos possuem duas características principais: imunogenicidade, que é a capacidade de induzir uma resposta imunológica específica, e antigenicidade, que corresponde à habilidade de se ligar a linfócitos T ou B que já foram sensibilizados anteriormente.(Teva et al.,2009). É importante o fato de que quando os parasitas protozoários invasores se tornam não antigênicos, eles mascaram a si próprios, e esse é considerado um passo definitivo no processo de invasão destes parasitas. (Tizard; Oliveira,1998)
Pesquisadores concluíram que parasitas bem-sucedidos apresentam baixa imunogenicidade, ou seja, induzem uma resposta imune muito fraca no hospedeiro. Além disso, foi observado que a maioria dos parasitas é antigênica, possuindo substâncias que podem ser reconhecidas pelo sistema imunológico, desencadeando uma reação imune. Contudo, esses parasitas desenvolveram, ao longo do tempo, mecanismos que permitem sua sobrevivência, mesmo frente às respostas do sistema imunológico (Tizard; Oliveira,1998).
Imunologia relacionada a Babesiose canis
Como descrito, a imunidade contra o parasita protozoário Babesia é mediada por mecanismos imunológicos inatos e adaptativos. Além disso, a patogenia da Babesia está diretamente ligada à hemólise, ou seja, à quebra das hemácias, causada pela multiplicação do parasita no interior dos eritrócitos, o que provoca o rompimento dessas células (Ahmed, 2002; Dias; Ferreira, 2016).
A invasão dos microrganismos ocorre nas hemácias, e, assim, a defesa do sistema imunológico começa com as hemácias infectadas pelos parasitas. Essas células englobam em suas membranas os antígenos da Babesia, que são as substâncias responsáveis por induzir as respostas imunológicas. Após o início desse processo ocorre uma opsonização, processo imunológico em que anticorpos se ligam a patógenos, como a Babesia canis, marcando-os para destruição por células do sistema imunológico, como macrófagos e neutrófilos. No caso das hemácias infectadas pela Babesia canis, os anticorpos se ligam à superfície dessas células, facilitando o reconhecimento e a eliminação pelas células do sistema imunológico (Tizard; Oliveira,1998).
Imunidade a bactérias
As bactérias podem causar doenças de diferentes maneiras, geralmente por meio da liberação de toxinas ou pela destruição das células hospedeiras. Elas podem ser classificadas em dois grupos distintos, de acordo com as toxinas que produzem: as endotoxinas, que são liberadas das paredes celulares de bactérias gram-negativas, e as exotoxinas, que são substâncias liberadas do interior das bactérias (Tizard; Oliveira, 1998).
Imagem 1 – Comparação das propriedades das exotoxinas e endotoxinas.

Fonte: (Tizard; Oliveira, 1998).
A ação do sistema imune frente às infecções bacterianas consiste em uma resposta inata inicial seguida de uma resposta adaptativa mais prolongada. As células do sistema imunológico reconhecem as bactérias através de receptores do tipo Toll (TLRs) que fazem o reconhecimento de padrões patológicos, ativam o sistema complemento e promovem a eliminação das bactérias (Tizard, 2014).
O sistema complemento é uma via essencial da defesa inata, sendo formado por uma série de proteínas que se ligam às superfícies bacterianas, promovendo sua opsonização e a lise das células invasoras (Murphy; Weaver, 2016).
Caso a resposta inata não seja o suficiente, há a ativação da resposta adaptativa acionada para tentar eliminar a infecção. A resposta adaptativa está relacionada à ativação dos linfócitos T e B, que são linfócitos essenciais na destruição de bactérias remanescentes, podendo ser por meio da produção de anticorpos específicos, que neutralizam os patógenos ou pela ativação de células fagocíticas (Abbas; Lichtman, 2021).
Imunologia relacionada a Ehrlichia canis
A Ehrlichia infecta células hematopoiéticas, tanto maduras quanto imaturas, principalmente aquelas do sistema fagocitário mononuclear, como monócitos e macrófagos. Quando essas células são parasitadas, há uma interferência direta em sua função, afetando o desempenho do sistema imunológico (Souza; Silva, 2022).
O comportamento das células imunes na erliquiose canina é discutível, algumas linhas de pesquisa sugerem que as infecções com microorganismos erliquiais despertam no hospedeiro uma resposta imune mediada por células TCD4+ que resulta na produção de IFN-γ que induz a morte dos patógenos intracelulares, como por exemplo a Ehrlichia ssp. Além disso, autores sugerem que seriam as células B e não as células T, as responsáveis pela resposta imunológica contra a Ehrlichia spp, contribuindo de forma efetiva na eliminação da bactéria. Estudos posteriores demonstraram que a resposta imunológica varia com amostra infectante (Faria, 2010).
A Ehrlichia é um parasita bacteriano intracelular classificado como gram-negativo. As bactérias gram-negativas são conhecidas por causarem infecções que podem deixar os animais gravemente debilitados. Elas se apresentam em duas formas: a lisa, que é totalmente virulenta devido à natureza de suas colônias, e a rugosa, que tende a ser avirulenta e é frequentemente utilizada em vacinas (Tizard; Oliveira, 1998; Marques; Gomes, 2020).
Imunidade aos tumores
A proliferação anormal das células pode ser benigna ou maligna, dependendo das características do crescimento e do potencial invasivo das células. Se as células que sofreram crescimento descontrolado se agruparem em um só local, diz-se que o tumor é benigno, já quando as células tumorais se soltam do tumor e ganham a corrente sanguínea e a linfa, se alojam e começam a crescer e criar tumores secundários chamados de metástases (Tizard, 1998).
As células tumorais se diferenciam antigenicamente das células normais por meio da perda ou ganho de moléculas de membrana. Essa diferença é crucial para a imunidade, pois as células tumorais, ao serem apresentadas de forma antigenicamente distinta, são consideradas estranhas pelo organismo e passam a ser atacadas. Um dos principais mecanismos de resposta às células tumorais envolve as células exterminadoras naturais, que não se classificam nem como linfócitos B nem T, mas têm a capacidade de eliminar células tumorais (Tizard; Oliveira, 1998).
Imagem 2 – Variedade de antígenos novos que podem surgir na superfície das células temorais e provocar respos imune.
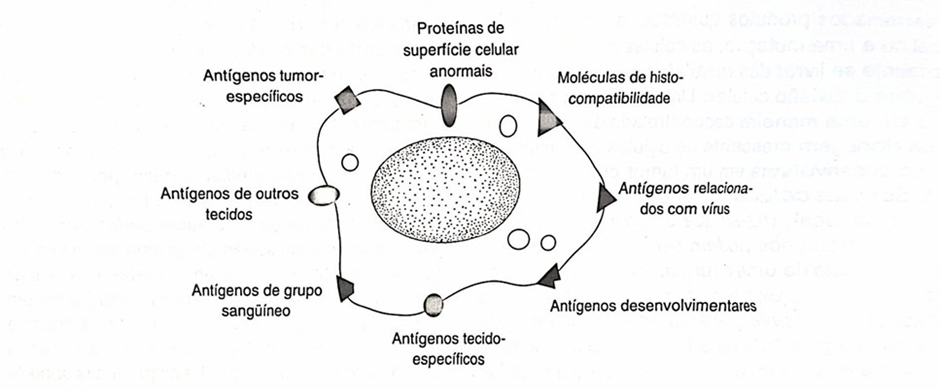
Fonte: (Tizard; Oliveira, 1998).
Além das células exterminadoras naturais (NK), há outros importantes mecanismos de defesa celular contra as células tumorais, entre eles, destacam-se a imunidade mediada por linfócitos T, a imunidade mediada por macrófagos e a imunidade mediada por anticorpos. Cada uma dessas respostas tem maior eficácia dependendo do tipo de tumor e do microambiente tumoral. A imunidade celular, principalmente através dos linfócitos T citotóxicos, desempenha um papel essencial na destruição direta de células tumorais, porém, acredita-se que sua resposta seja mais efetiva em casos de tumores induzidos por vírus (Tizard; Oliveira,1998).
Já os macrófagos ativados podem reconhecer e eliminar células cancerosas agindo de maneira específica ou inespecífica, sua ação pode liberar fatores citotóxicos assim como um efeito citostático no caso de alguns tumores, além disso, possuem uma ativação subsequente de atividades de célula T, enquanto os anticorpos, através da resposta imune humoral, podem marcar as células tumorais causando sua lise, ou seja, sua destruição, apesar disso, os anticorpos não são efetivos na destruição das células neoplásicas sólidas. Esses diferentes mecanismos agem de forma coordenada e adaptativa para controlar e eliminar o desenvolvimento de neoplasias, sendo mais eficazes em determinados contextos de resposta tumoral (Tizard; Oliveira, 1998).
HEMOPARASITOSES
As hemoparasitoses são doenças causadas por microrganismos patogênicos que infectam as células sanguíneas dos animais. Esses parasitas são transmitidos por artrópodos hematófagos, com os carrapatos da espécie Rhipicephalus sanguineus sendo o principal vetor (Araújo et al.,2022).
R. sanguineus tem como hospedeiro preferencial o cão doméstico e canídeos silvestres, possuindo ampla distribuição por todo o território brasileiro (Caetano, 2016).
Diversas doenças transmitidas por carrapatos afetam as células sanguíneas dos hospedeiros. Entre essas doenças, destacam-se a Anaplasmose Trombocitotrópica Canina (ATC) e a Erliquiose Monocíclica Canina (EMC), que são causadas por bactérias, além da Babesiose e Hepatozoonose, que são provocadas por protozoários (Araújo et al., 2022).
Este trabalho dará ênfase em duas hemoparasitoses: uma causada por protozoários, Babesia canis, e outra causada por bactérias, Ehrlichia canis.
Prevalência no Brasil
No Brasil, até 2013, a principal espécie de carrapato encontrada em cães em áreas urbanas foi o R. sanguineus. Nesse período, a fauna ixodídica brasileira era composta por 65 espécies de carrapatos. As espécies mais comuns incluíam Rhipicephalus (Boophilus) microplus, R. sanguineus, Amblyomma cajennense, Dermacentor nitens, Argas miniatus e Ornithodoros brasiliensis (Andreotti; Koller, 2013). O Rhipicephalus sanguineus, conhecido como “carrapato vermelho do cão”, é um carrapato trioxeno que se alimenta principalmente de cães, mas pode parasitar ocasionalmente outros hospedeiros, incluindo humanos. Originário da África, onde há cerca de 79 espécies do gênero Rhipicephalus, incluindo cinco que foram reclassificadas do gênero Boophilus para o subgênero Rhipicephalus (Boophilus). O R. sanguineus é uma espécie cosmopolita com ampla distribuição geográfica (Andreotti; Koller, 2013).
O conhecimento sobre o Rhipicephalus sanguineus é fundamental, pois esse carrapato pode transmitir patógenos como Babesia canis para cães, Rickettsia conorii para humanos e Ehrlichia canis, que afeta tanto cães quanto humanos. A Erliquiose Monocítica Canina (EMC) é considerada uma doença zoonótica desde 1992 (Andreotti; Koller, 2013).
Patogenia da Babesiose no sistema imunológico
O tempo de incubação do agente causador da doença pode variar entre 10 e 21 dias, e a doença pode se manifestar de forma hiperaguda, aguda ou crônica. Além disso, o animal pode ser um portador assintomático, com sinais clínicos aparecendo em situações de estresse ou em decorrência de doenças concomitantes, sendo este um fator importante a ser considerado (Araújo et al., 2022).
A patogenia do protozoário Babesia canis provoca hemólise (quebra de hemácias) devido à multiplicação e à presença do parasita dentro das hemácias, o que gera fragilidade osmótica e leva à ruptura celular por lesão oxidativa na membrana. A destruição das hemácias parasitadas resulta em anemia e liberação de hemoglobina, ocasionando hemoglobinúria e bilirrubinemia. A alta concentração de bilirrubina no sangue causa sobrecarga hepática, resultando em icterícia, congestão do fígado e do baço, culminando em hepatoesplenomegalia (Kotaki; Rosa, 2020).
A babesiose é caracterizada pela sepse protozoária, acompanhada por uma resposta inflamatória generalizada do hospedeiro. Além da destruição direta dos eritrócitos pela replicação intracelular dos parasitas, ocorre destruição citotóxica mediada por anticorpos, que reconhecem as células infectadas como anormais. Os anticorpos se ligam aos antígenos nas hemácias infectadas, ativando o sistema complemento e recrutando células imunológicas, como macrófagos e células NK, que promovem a destruição das células marcadas. A destruição significativa de eritrócitos pode levar à anemia hemolítica e trombocitopenia, frequentemente correlacionadas ao nível de parasitemia (Araújo et al., 2022).
Os sinais e sintomas da doença variam de acordo com suas fases. Na fase hiperaguda, podem ocorrer acidose metabólica, síndrome da resposta inflamatória sistêmica e estase vascular. Durante a fase aguda, os animais apresentam anemia hemolítica, febre, trombocitopenia, esplenomegalia, vômitos e icterícia. Já na fase crônica, os sinais podem incluir febre intermitente, hiporexia ou anorexia, perda de peso, linfadenopatia e esplenomegalia. Os sinais e sintomas da doença variam de acordo com suas fases. Na fase hiperaguda, podem ocorrer acidose metabólica, síndrome da resposta inflamatória sistêmica e estase vascular. Durante a fase aguda, os animais apresentam anemia hemolítica, febre, trombocitopenia, esplenomegalia, vômitos e icterícia. Já na fase crônica, os sinais podem incluir febre intermitente, hiporexia ou anorexia, perda de peso, linfadenopatia e esplenomegalia. Infecções concomitantes com outros hemoparasitas podem agravar o quadro clínico do animal (Araújo et al., 2022).
Diagnóstico Babesia canis
O diagnóstico da babesiose canina pode ser realizado através da anamnese e do exame físico e clínico do animal. Além disso, exames laboratoriais são essenciais, pois possibilitam a diferenciação entre as diversas espécies de Babesia spp (Araújo et. al., 2022) .
Pode-se ter um diagnóstico presuntivo que pode ser concluído com achados de anamnese, exame físico e detecção de anemia regenerativa, hiperbilirrubinemia, bilirrubina e trombocitopenia por meio de exames laboratoriais, já o diagnóstico definitivo é o parasitológico, fundamentado por identificação do protozoário em eritrócitos por microscópio, através dos esfregaços sanguíneos nas lâminas de microscopia (Kotaki; Rosa, 2020).
Além disso, existem os testes sorológico e molecular sendo o método de eleição o PCR que é um teste molecular, extremamente sensível capaz de detectar inclusive baixos níveis de parasitemia (Kotaki; Rosa, 2020).
Tratamento Babesia canis
O tratamento de cães com sintomas de babesiose canina é voltado para o controle da disseminação do parasita, o manejo da resposta imunológica do hospedeiro e o alívio dos sintomas (Barbosa, 2017).
Para o tratamento da Babesiose é necessário usar babecisidas efetivos, como exemplo pode ser citado: Aceturato de Diminazeno que é um medicamento pertence à classe dos antiparasitários, especificamente aos antiprotozoários. Dipropionato de Imidocarb que também é um antiparasitário, mas, é classificado como um antiprotozoário e antibacteriano e Isetionato de Fenamidina, que é um medicamento antiparasitário da classe dos antiprotozoários (Kotaki; Rosa, 2020).
Patogenia da Erliquiose no sistema imunológico
O vetor da Erliquiose monocítica canina não necessita de muito tempo para transmitir a infecção, estudos recentes comprovaram que apenas três horas de fixação são suficientes para os animais parasitados se tornarem infectados. A doença em cães pode se apresentar de forma aguda, subclínica ou crônica. No entanto, a fase crônica está associada a uma elevada taxa de mortalidade, mesmo com a administração de antibióticos (Caxito et al., 2018).
Alterações no sangue periférico podem ser observadas entre 5 e 18 dias pós-infecção. Em média, 10 dias pós-infecção já são suficientes para o estabelecimento da trombocitopenia, que é a principal característica da EMC (Caxito et al., 2018).
Durante a fase aguda da doença, há hiperplasia dos linfócitos T e um aumento acentuado dos linfócitos B, resultando em níveis elevados de anticorpos por meses ou até anos. As células B se transformam em plasmócitos que produzem imunoglobulinas, essenciais para o sistema imunológico. A hipergamaglobulinemia é comum em cães infectados com Ehrlichia, refletindo uma resposta humoral intensificada e inflamação em órgãos como fígado, baço e linfonodos, o que causa sintomas variados e graves. A fase aguda é marcada por sinais clínicos e inflamação intensa (Caxito et al., 2018).
Diagnóstico Ehrlichia canis
O diagnóstico da enfermidade, como ocorre em outras hemoparasitoses, requer anamnese, sinais clínicos e exames laboratoriais. O hemograma completo é essencial para a avaliação inicial, enquanto o esfregaço sanguíneo é crucial para confirmar a trombocitopenia verdadeira, um sinal significativo da doença. Neste esfregaço, também pode ser observada leucopenia, importante para a definição da enfermidade. Embora as alterações clínicas e hematológicas não confirmem o diagnóstico de Erliquiose, elas ajudam a determinar a fase da doença, permitindo um tratamento mais adequado e um prognóstico confiável (Santarém, 2003).
A redução da contagem de plaquetas é observada em todas as fases da doença, servindo como um indicativo clínico para a suspeita de Erliquiose. O diagnóstico definitivo é estabelecido pela identificação de agrupamentos intracitoplasmáticos (mórulas) nos monócitos circulantes em esfregaços sanguíneos, pela presença de altos níveis de anticorpos contra E. canis, pela detecção do DNA da bactéria por meio de PCR, ou ainda pelo isolamento do agente em cultivos celulares. O PCR é uma técnica sensível e específica, podendo ser empregada no diagnóstico a partir de amostras de sangue, necropsia ou material de biópsia (Caxito et al, 2018).
Tratamento Ehrlichia canis
O tratamento da Erliquiose se faz com o uso de antibióticos, sendo a doxiciclina o fármaco de eleição. Após uma pesquisa de diversos protocolos terapêuticos concluiu-se que uma boa alternativa seria utilizar doxiciclina na dose de 20mg/kg (VO SID) por 28 dias visando melhorar o manejo com uma única administração ou, como mais comumente encontrado no tratamento de Ehrlichia canis no Brasil, o regime de 10mg/kg (VO BID). Outro protocolo também eficaz comprovado por meio de pesquisa é a oxitetraciclina de longa ação 10mg/Kg (IM) em intervalos de sete dias por 28 dias (Azevedo, 2012).
Além disso, terapia de suporte, o que inclui reposição do equilíbrio hidroeletrolítico e energético, corticoides, transfusão sanguínea,imunomoduladores e estimulantes da hematopoiese (Marques; Gomes, 2022).
ETIOLOGIA DO CÂNCER
O câncer é uma doença multifatorial; seu desenvolvimento depende de fatores genéticos (mutações hereditárias ou esporádicas) e ambientais (agentes carcinogênicos (Nardi; Deleck, 2016).
Fatores genéticos
Para compreender a etiologia do câncer é necessário citar que diferente das doenças que resultam de alterações em um único gene, o câncer é uma patologia complexa e envolve múltiplos genes (Vail; Thamm; Liptak, 2007).
O conceito de genes do câncer pode ser estruturado em um modelo que abrange iniciação, promoção e progressão. Nesse modelo, a iniciação ocorre quando uma mutação genética confere a uma célula somática um potencial replicativo ilimitado ou outra vantagem em relação a outras células do ambiente. Após essa fase inicial, uma segunda mutação ou uma série de mutações é necessária, pois a iniciação sozinha não é suficiente para originar um tumor, dada a limitação pelos fatores ambientais. Essa segunda fase, chamada promoção, envolve o aumento da capacidade celular, permitindo a formação de uma massa tumoral. Por fim, na fase de progressão, as mutações conferem às células um potencial maligno, levando à invasão tecidual, destruição e metástase, além dos aspectos clínicos da doença (Vail; Thamm; Liptak, 2007).
A predisposição hereditária para neoplasias é influenciada por fatores genéticos, sendo observada em algumas raças específicas. A raça Boxer está frequentemente associada ao desenvolvimento de mastocitomas e linfomas. Cães da raça Bernese Mountain Dog apresentam alta propensão à histiocitose maligna, enquanto Scottish Terriers têm um risco 18 vezes maior de desenvolver carcinomas vesicais. Além disso, cães de grande porte são mais suscetíveis ao osteossarcoma (Nardi; Deleck, 2016).
Um estudo revelou que Cocker Spaniels Americanos têm um risco elevado de desenvolver neoplasias benignas (1,42 vezes) e malignas (1,81 vezes) em comparação a cães sem raça definida. Os Golden Retrievers demonstram um aumento no risco de neoplasias malignas (2,30 vezes), enquanto os Bichon Frises têm maior probabilidade de desenvolver neoplasias benignas (0,51). (Nardi; Deleck, 2016).
Uma análise mais abrangente do risco relativo das raças mais afetadas por diversos tipos de neoplasia identificou as seguintes raças em risco: Boxer (linfomas), Flat-Coated Retriever (histiocitose maligna), Schnauzer Gigante (linfomas), Cocker Spaniel Inglês (tumores mamários), Rottweiler (osteossarcomas), Setter Inglês (tumores mamários), Bernese Mountain Dog (histiocitose maligna), Dobermann (osteossarcomas), Labrador (linfomas) e Pastor Alemão (tumores mamários). (Nardi; Deleck, 2016).
Imagem 3 – Incidência de neoplasias em cães, diagnosticadas no Hospital Veterinário da Universidade Federal do Paraná, campus de Curitiba, no período de janeiro de 1998 a novembro de 2006, distribuída conforme a raça.
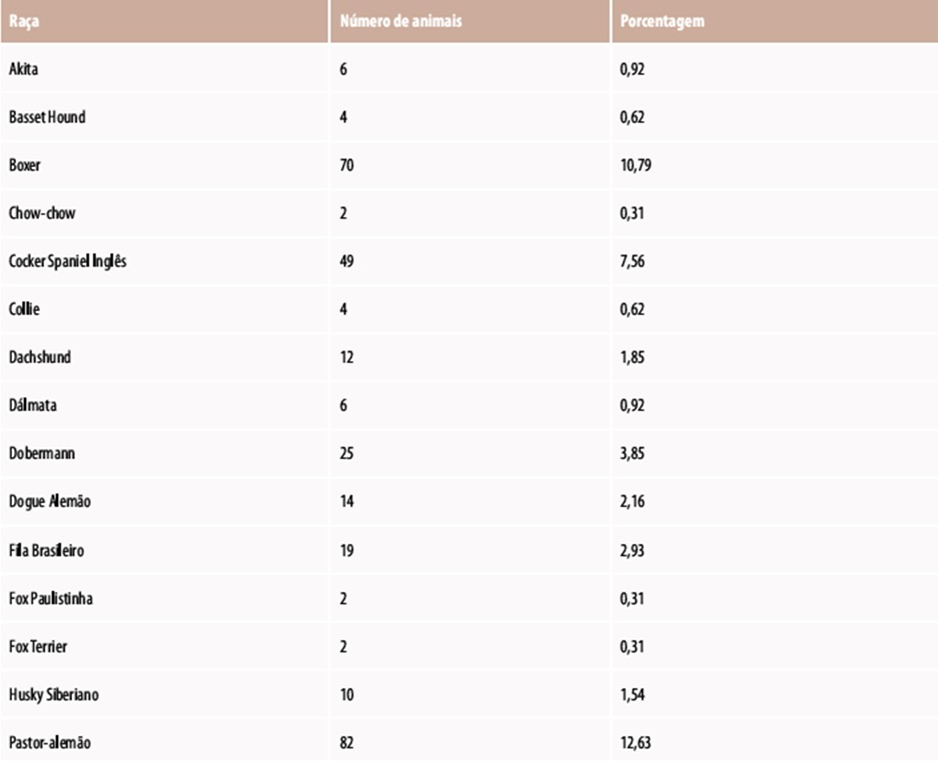
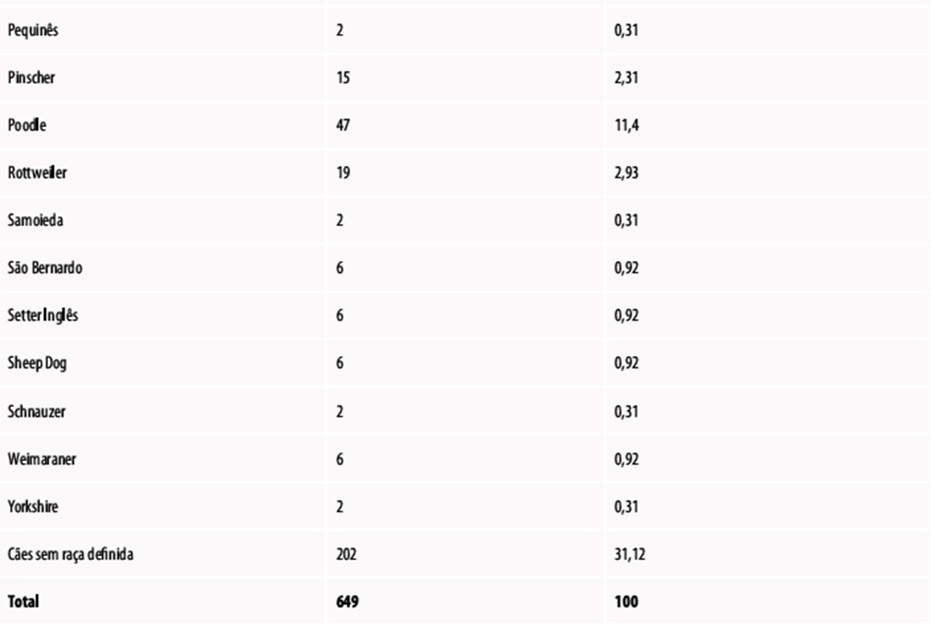
Fonte: (Nardi; Deleck, 2016)
Fatores ambientais
Fatores químicos
Entre 1993 e 2000, foi realizado um estudo de caso-controle na Faculdade de Medicina Veterinária da Universidade de Tufts, que incluiu 80 gatos com linfoma maligno e 114 gatos com controle de doença renal. Os resultados mostraram que os gatos expostos à fumaça de tabaco ambiental (ETS) em seus lares apresentaram um risco 2,4 vezes maior de desenvolver linfoma em comparação aos gatos não expostos (Vail; Thamm; Liptak, 2007).
De maneira semelhante ao observado em homens fumantes, o risco de linfoma nos gatos aumentou conforme o tempo de exposição e a intensidade do contato com a fumaça do tabaco se prolongavam. Isso sugere uma correlação direta entre a quantidade e a duração da exposição à fumaça e o aumento da probabilidade de desenvolvimento de linfoma (Vail; Thamm; Liptak, 2007).
Fatores físicos
A luz solar é um exemplo de fator físico relacionado à indução de carcinoma espinocelular em humanos e também em animais domésticos. Essa associação é reforçada por uma clara relação dose-resposta demonstrada em estudos epidemiológicos e experimentais. A exposição cumulativa e prolongada à radiação UV-B pode causar tumores de pele diretamente por meio de mutações genéticas, como as que ocorrem no gene p53, e indiretamente, comprometendo a resposta imunológica do organismo a antígenos tumorais. Animais de estimação, especialmente os de pelagem clara, devem ser protegidos da exposição ao UV-B, especialmente durante o meio-dia (Vail; Thamm; Liptak, 2007).
Há outros fatores físicos como: a inflamação crônica que pode levar a mutações que resultam em transformação neoplásica, além disso, outro tipo de malignidade em pequenos animais possivelmente associada à inflamação é o sarcoma associado à vacina em felinos (Vail; Thamm; Liptak, 2007).
Existem ainda alguns outros estudos sobre mais fatores físicos relacionados ao câncer em pequenos animais, mas que ainda precisam ser aprofundados.
Fatores hormonais
Os tumores mamários são a neoplasia mais prevalente em cadelas não castradas, por esse motivo, é citado o fato de que está bem estabelecido que a castração de cadelas antes do primeiro ciclo estral reduz significativamente o risco de desenvolvimento de câncer de mama, essa redução de risco é devido à ausência de estímulos hormonais que impulsionam o crescimento mamário e o desenvolvimento de tumores nessa área, evitando a exposição repetida dos tecidos mamários aos hormônios sexuais. As glândulas mamárias das fêmeas são expostas a altos níveis de estrogênio e progesterona, hormônios que desempenham um papel crucial no risco de desenvolvimento de tumores mamários. Esses hormônios podem estimular o crescimento de células com potencial cancerígeno, elevando gradualmente o risco de formação de tumores malignos ao longo do tempo (Vail; Thamm; Liptak, 2007).
Para iniciar a discussão sobre os fatores hormonais relacionados ao câncer em cães, é importante considerar tanto o papel dos hormônios em fêmeas quanto em machos. Estudos mostram que tumores como o adenoma perianal e o câncer de próstata estão associados a hormônios específicos. Os adenomas perianais, que dependem de andrógenos, ocorrem principalmente em cães machos não castrados, embora também possam aparecer em fêmeas devido à secreção de testosterona. A castração em machos pode reduzir a ocorrência desses tumores, sugerindo que os andrógenos influenciam sua origem. No entanto, o adenocarcinoma prostático não é mais frequente em cães não castrados. Estudos indicam um possível aumento do risco de câncer de próstata em cães castrados, o que sugere que a castração pode favorecer a progressão do tumor. Por fim, a relação entre a idade de castração e o risco de adenocarcinoma prostático ainda carece de esclarecimentos (Vail; Thamm; Liptak, 2007).
OS MECANISMOS DA IMUNOSSUPRESSÃO INDUZIDA PELO CÂNCER
A transformação de uma célula normal em uma célula maligna requer mudanças moleculares, bioquímicas e celulares, consideradas capacidades adquiridas. Apesar da diversidade de tipos de câncer, essas capacidades são comuns a todos eles. Os autores destacam que todas as células normais compartilham mecanismos moleculares que regulam a divisão celular, diferenciação, envelhecimento e apoptose. O processo de tumorigênese, descrito como multifásico, reflete alterações genéticas que levam à progressão de células normais para cancerígenas, com genomas tumorais frequentemente alterados em múltiplos locais, variando de mutações pontuais a alterações cromossômicas (Vail; Thamm; Liptak, 2007).
Um modelo foi proposto que sugere que a vasta gama de anomalias genéticas associadas ao câncer é uma manifestação de seis alterações na fisiologia celular que contribuem coletivamente para o crescimento maligno (Vail; Thamm; Liptak, 2007).
As seis características que envolvem o mecanismo de desenvolvimento do câncer são (Vail; Thamm; Liptak, 2007):
Crescimento auto-suficiente das células: O ponto principal na transformação das células para um estado canceroso é a capacidade de se dividir constantemente e crescer de forma contínua. As células saudáveis possuem citocinas que funcionam como mensageiros que orientam as células quando devem se dividir, migrar ou realizar outras funções, as células saudáveis em suas divisões são controladas pelos sinais externos, que são as citocinas. As citocinas se ligam aos receptores da célula formando uma cascata de sinalização que altera o comportamento da célula para responder ao ambiente. Em células cancerosas se houver alguma mutação, seja em uma proteína envolvida nesse processo, podem fazer com que a célula continue recebendo sinais de crescimento apesar da ação das citocinas externas. (Vail; Thamm; Liptak, 2007)
Insensibilidade a sinais de inibição de crescimento: Para as células cancerosas se multiplicam elas também precisam driblar os mecanismos que freiam a proliferação celular. Tais freios são controlados principalmente por genes supressores do tumor que possuem a função de impedir o crescimento descontrolado das células. Além disso, em condições normais as células também recebem sinais do ambiente para regular o crescimento, como pelo que se chama de inibição por contato, que é quando as células não-hematopoiéticas são impedidas de se multiplicarem quando estão muito próximas uma das outras. Já as células hematopoiéticas, que são as ligadas à imunidade e ao sangue, usam o contato direto entre as células para organizar processos como produção de células sanguíneas, imunidade e a inflamação. Os sinais de inibição de crescimento vêm das proteínas produzidas pelos genes supressores de tumor, chamados assim pois, quando inativos por mutações, as células podem se tornar cancerosas. Essas proteínas trabalham junto, em equilíbrio, com os genes que promovem o crescimento (proto-oncogenes). (Vail; Thamm; Liptak, 2007)
Evasão da morte celular programada (apoptose): A evasão da apoptose é uma característica essencial que todas as células cancerosas adquirem. Isso pode ocorrer devido à perda de genes supressores de tumor pró-apoptóticos, ou ao ganho de função de genes antiapoptóticos, a evasão da apoptose pode ser um mecanismo importante na patogênese de tumores de crescimento lento mais comuns em animais domésticos. As células cancerosas também precisam evitar a morte por anoikis, que é um processo de morte programada que ocorre quando a célula se desprende da matriz celular. Na ausência das vias fisiológicas de morte celular o corpo frequentemente reage direcionando a destruição por vias inflamatórias. Ainda é necessário mais descobertas acerca de como a evasão, ou indução, dos mecanismos de morte celular podem contribuir para a progressão tumoral. (Vail; Thamm; Liptak, 2007)
Potencial replicativo ilimitado: Às células normalmente possuem um número de vezes limitado que podem se dividir chamado de limite de Hayflick, quando esse limite é alcançado, ocorre a senescência replicativa que é um processo em que não há a morte das células e sim, que elas continuam mantendo o equilíbrio genético e funcional mas, passam por mudanças genéticas significativas, como a erosão os telômeros. Para continuar se dividindo sem parar, as células cancerosas precisam proteger seus telômeros, essa proteção é feita por alguns tumores ativando a telomerase, uma enzima que repara e mantém os telômeros intactos. Apesar dessas informações, é necessário dizer que estudar animais de companhia pode ajudar a trazer novas respostas de como a imortalidade celular ocorre no câncer. (Vail; Thamm; Liptak, 2007)
Angiogênese sustentada: A angiogênese, que é o processo de formação de novos vasos sanguíneos, é essencial para o crescimento de tumores. O processo de angiogênese envolve a coordenação de vários fatores de crescimento e moléculas que ajudam as células dos vasos sanguíneos e do tecido de suporte a trabalharem juntas. Um dos principais fatores nesse processo é o Fator de crescimento endotelial vascular (VEGF) que se liga a receptores específicos nas células, como VEGFR-1 e VEGFR-2. O VEGFR-2 é o principal responsável por ativar a formação de novos vasos, enquanto o VEGFR-1 pode ajudar no crescimento do tumor ao enviar sinais para atraí-lo. O corpo aumenta a produção de VEGF quando o tumor enfrenta hipóxia há um processo controlado por certas proteínas que faz com que estimule o VEGF a formar novos vasos para alimentar o tumor. Outros fatores, como o PDGF-β (Fator de Crescimento Derivado de Plaquetas), também são importantes porque ajudam a estabilizar e amadurecer esses novos vasos sanguíneos. dados sugerem que terapias antiangiogênicas podem beneficiar pacientes ao normalizar os vasos sanguíneos, corrigir disfunções causadas pelo microambiente tumoral, eliminar vantagens intrínsecas das células cancerosas e melhorar a penetração de medicamentos. (Vail; Thamm; Liptak, 2007)
Invasão tecidual e metástase: Os eventos genéticos que levam à invasão e metástase do câncer ainda não são completamente compreendidos. O modelo tradicional de metástase, desenvolvido por Fidler, propõe que as células cancerígenas ganham gradualmente capacidades que permitem: sair do tumor original, circular pelo sangue ou sistema linfático, invadir tecidos em locais propícios e se fixar em regiões distantes. Pesquisas mais recentes mostram que a maioria dos tumores já tem a habilidade de liberar células que se deslocam para outros lugares, sendo a capacidade dessas células de sobreviver nos capilares possivelmente o passo mais crucial no processo de metástase. As células derivadas da medula óssea têm propriedades intrínsecas, essas características permitem que essas células se desloquem por todo o corpo, atravessem órgãos importantes e se fixem em áreas inflamadas, por esse motivo pode-se dizer que tumores originados da medula óssea sejam naturalmente metastáticos. No entanto, tumores hematopoiéticos com características citológicas semelhantes podem apresentar diferentes distribuições nos tecidos. Ainda não foi compreendido o motivo do porque algumas células leucêmicas permanecem na circulação periférica. Há cada vez mais evidências de que as células cancerosas, células-tronco mesenquimais, fibroblastos do tumor, células inflamatórias e células envolvidas na formação de vasos sanguíneos interagem entre si e essa interação pode afetar o comportamento invasivo do tumor e a capacidade dessas células cancerosas sobreviverem em ambientes hostis presentes em locais distantes. (Vail; Thamm; Liptak, 2007).
Conclui-se que a imunossupressão induzida pelo câncer em animais ocorre por vários mecanismos que interferem na resposta imune do organismo.
CO-OCORRÊNCIA DO CÂNCER COM AS HEMOPARASITOSES
Como visto, o câncer pode agravar condições preexistentes. As condições, por sua vez, podem afetar o curso do câncer e suas respostas ao tratamento por conta da grande imunossupressão ao paciente. Em casos de co-infecção com dois ou mais agentes é muito difícil atribuir os sinais clínicos e anormalidades hematológicas e bioquímicas a um único agente (Rauber, 2011; Al Izzi et al., 2013).
Os exames complementares, como o hemograma, análises bioquímicas e urinálise, são imprescindíveis para o estadiamento clínico das neoplasias (Núñez et al., 2022).
Em uma pesquisa realizada com 60 fichas de pacientes caninos diagnosticados com neoplasia, foi avaliado o hemograma desses animais. Observou-se que 75% (45/60) apresentaram eritropenia, 70% (42/60) mostraram níveis de hemoglobina abaixo do normal e 70% (42/60) exibiram hematócrito inferior aos valores de referência. A anemia, caracterizada pela diminuição da massa eritrocitária, foi identificada em 80% (48/60) dos exames analisados, refletida na redução dos índices de hemoglobina, contagem de eritrócitos ou hematócrito (Núñez et al., 2022).
Em um estudo sobre alterações hematológicas em cães diagnosticados com Erliquiose, observou-se alta incidência de trombocitopenia, anemia normocítica normocrômica e neutropenia com desvio à esquerda. A literatura científica aponta que alterações como redução na contagem de eritrócitos, plaquetas e neutrófilos são comuns nos exames de sangue de pacientes com Ehrlichia canis, sendo indicativas de alterações hematológicas frequentes na doença (Matos; Rocha-Lima, 2021).
Em um estudo sobre as espécies de Babesia, foi observado que, entre os 33 animais positivos para Babesia canis, 31,4% apresentaram anemia, 25,7% leucopenia e 37,1% trombocitopenia. Já nos 24 animais positivos para Babesia gibsoni, 22,9% tinham anemia, 9,5% leucopenia e 21% trombocitopenia. Esses achados revelam as alterações hematológicas frequentes em infecções por Babesia em cães (Silva, 2014).
A partir disso, ao fazer uma análise comparativa das alterações hematológicas em casos de câncer, erliquiose e babesiose em cães percebe-se que há semelhanças relevantes, especialmente quanto à presença de anemia, trombocitopenia e leucopenia. Essas condições indicam uma resposta sistêmica comum a infecções e processos neoplásicos, principalmente devido à imunossupressão e ao comprometimento da produção e manutenção celular.
CONCLUSÃO
Pode-se observar os diferentes mecanismos de respostas do sistema imunológico diante da invasão bacteriana por Ehrlichia canis, da infecção pelo protozoário Babesia canis e frente ao desenvolvimento de neoplasias. O sistema imunológico possui uma rede complexa de mecanismos de defesa, embora alguns patógenos e células tumorais consigam escapar dessas respostas, essa análise reforça a necessidade de que os profissionais veterinários adquiram conhecimento aprofundado sobre imunologia e parasitologia para interpretar as alterações imunológicas de seus pacientes, especialmente em condições complexas que combinam infecções e processos neoplásicos.
Destaca-se a relevância do conhecimento dos profissionais da área na hora de realizarem diagnósticos e monitoramento de hemoparasitoses, evidenciando sua importância para uma avaliação mais precisa e acompanhamento eficaz.
O presente estudo abordou questões sobre os fatores predisponentes ao câncer, destacando sua relevância para a prática veterinária e a importância de disseminá-los, a fim de auxiliar na prevenção de doenças oncológicas.
Além disso, concluiu-se que os achados laboratoriais em casos de hemoparasitoses e neoplasias podem apresentar semelhanças significativas, como anemia, trombocitopenia e alterações no hematócrito, o que reforça a necessidade de uma abordagem minuciosa por parte do médico veterinário. Ao receber um paciente oncológico, é essencial que o veterinário realize uma investigação detalhada sobre o histórico do animal, considerando o potencial contato prévio com os hemoparasitas. Tal precaução contribui para evitar complicações e otimizar o manejo clínico. Exames confirmatórios de hemoparasitoses devem ser solicitados antes do início de qualquer tratamento oncológico, possibilitando a melhor adaptação do plano terapêutico de acordo com o quadro específico do paciente e reduzindo o risco de intercorrências durante o tratamento.
O presente estudo conclui então que, ainda existem lacunas significativas na literatura atual sobre o manejo de doenças concomitantes em animais, especialmente em relação às possibilidades de co-infecção em pacientes oncológicos. Esta é uma área que necessita de mais estudos para o desenvolvimento de protocolos de tratamento mais seguros e eficazes para esses casos complexos.
REFERÊNCIAS
ABBAS, Abul K.; LICHTMAN, Andrew H.; PILLAI, Shiv. Cellular and Molecular Immunology. 9. ed. Elsevier, 2021.
AHMED, J. S. The role of cytokines in immunity and immunopathogenesis of pirolasmoses. Parasitology Research, v. 88, n. 13, p. 48–50, 2002. Disponível em: https://doi.org/10.1007/s00436-001-0573-4.
AL IZZI, S.; MARTIN, D. S.; CHAN, R. Y.; LEUTENEGGER, C. M. Babesia canis vogeli, Ehrlichia canis, and Anaplasma platys infection in a dog. Veterinary Clinical Pathology, v. 42, p. 471-475, 2013.
ANDRADE, Gisele Maria de. Erliquiose canina: eficácia da doxiciclina comprimido no tratamento de cães naturalmente infectados. Vet Smart, 2020. Disponível em: https://vetsmart.com.br/cg/estudo/13408/erliquiose-canina-eficacia-da-doxiciclina-compri mido-no-tratamento-de-caes-naturalmente-infectados.
ANDREOTTI, Renato; KOLLER, Wilson Werner (Ed.). Carrapatos no Brasil: biologia, controle e doenças transmitidas. Brasília: Embrapa, 2013. 187 p. : il. color. ; 24 cm. Inclui bibliografia.
ARAÚJO, Roniuza Reneuda de et al. Avaliação diagnóstica das hemoparasitoses em cães: Revisão. Pubvet, [S. l.], v. 16, n. 10, 2022. Disponível em: https://ojs.pubvet.com.br/index.php/revista/article/view/2918.
AZEVEDO, Felipe Delorme. Protocolos terapêuticos no tratamento da erliquiose monocitica canina. 2012. 63 f. Tese (Doutorado em Ciências Veterinárias) – Instituto de Veterinária, Universidade Federal Rural do Rio de Janeiro, Seropédica, 2012.
BARBOSA, Daniela Filipa Nunes. Babesiose canina: revisão da literatura científica e apresentação de casos clínicos. 2017. Dissertação (Mestrado em Medicina
Veterinária) – Universidade de Trás-os-Montes e Alto Douro, Vila Real, 2017. Orientador: Professor Doutor Luís Cardoso.
DIAS, Viviane Cassinoni Araujo Cassinoni Moreira; FERREIRA, Fernanda Lúcia Alves. Babesiose canina: Revisão. Pubvet, [S. l.], v. 10, n. 12, 2016. Disponível em: https://ojs.pubvet.com.br/index.php/revista/article/view/1396.
CAETANO, Rebecca Leal. Diversidade morfológica e genética de Rhipicephalus sanguineus (LATREILLE, 1806) em diferentes regiões do Brasil. 2016. 106 f. Dissertação (Mestrado em Biodiversidade e Saúde)-Instituto Oswaldo Cruz, Fundação Oswaldo Cruz, Rio de Janeiro, RJ, 2016.
CAXITO, M. S.; RODRIGUES, F. P.; TAQUES, I. I. G. G.; AGUIAR, D. M. de;TAKAHIRA, R. K.; PAES, A. C. Alterações da medula óssea e a importancia do mielograma no diagnóstico da ehrlichiose monocítica canina: Revisão. Veterinária e Zootecnia, Botucatu, v. 25, n. 1, p. 61–66, 2018. DOI: 10.35172/rvz.2018.v25.37. Disponível em: https://rvz.emnuvens.com.br/rvz/article/view/37.
FARIA, Joice Lara Maia. Estudo clínico e imunopatológico da infecção experimental em cães com a amostra Jaboticabal de Ehrlichia canis na fase aguda e após o tratamento: expressão de citocinas no baço e sangue e de subpopulações de células imunes no baço. 2010. Dissertação (Mestrado) – Universidade Estadual Paulista “Júlio Mesquita Filho”, Faculdade de Ciências Agrárias e Veterinárias, Jaboticabal, São Paulo, 2010.
KOTAKI, Igor Gabriel Dourado; ROSA, Patricia Raquel Basso. Considerações Sobre Babesiose Canina: Revisão De Literatura. Doenças Parasitárias, v. 2, n. 3, 2020.
MARQUES, Danilo; GOMES, Deriane Elias. Erliquiose canina. Revista Científica Unilago, v. 1, n. 1, p. 1-9, 2022. Disponível em: https://revistas.unilago.edu.br/index.php/revista-cientifica/article/view/333.
SANTAREM, Vamilton Álvares. Achados epidemiológicos, clínicos e hematológicos e comparação de técnicas para diagnóstico de Ehrlichia canis. 2003. 130 f. Tese (doutorado) – Universidade Estadual Paulista, Faculdade de Medicina Veterinária de Botucatu, 2003.
SILVA, Vanessa Carla Lima da. Avaliação clínica, epidemiológica e laboratorial de cães (Canis familiaris, Linnaeus, 1758) com cinomose, erliquiose e babesiose no Hospital Veterinário da UFRPE. 2014. 160 f. Tese (Doutorado em Ciência Veterinária)– Universidade Federal Rural de Pernambuco, Recife, 2014.
MATOS, Rafanye Wagner; ROCHA-LIMA, Ana Beatriz Carollo. Alterações hematológicas em cães diagnosticados com Erliquiose Monocítica Canina. Journal of Health Science Institute, v. 39, n. 1, p. 24-28, 2021.
NÚÑEZ, Montiel; et al. Principais alterações hematológicas em pacientes caninos com diagnóstico de neoplasias. In: XXXI Cic – Congresso de Iniciação Científica, 2022.
MURPHY, Kenneth; WEAVER, Casey. Janeway’s Immunobiology. 9. ed. Garland Science, 2016.
RAUBER, Daiana. Controle da dor no paciente oncológico. 2012. Trabalho de Conclusão de Graduação – Universidade Federal do Rio Grande do Sul, Faculdade de Veterinária, Curso de Medicina Veterinária, Porto Alegre, 2012.
SAINZ, Á.; ROURA, X.; MIRÓ, G.; ESTRADA-PEÑA, A.; KOHN, B.; HARRUS, S.;SOLANO-GALLEGO, L. Guideline for veterinary practitioners on canine ehrlichiosis and anaplasmosis in Europe. Parasites & Vectors, v. 8, p. 75, 2015. Disponível em: https://doi.org/10.1186/s13071-015-0649-0.
SOUZA, Gabrielle Maria Barbosa de; SILVA, Sheila Nogueira Saraiva da. Aspectos imunológicos da coinfecção de leishmaniose visceral e erliquiose monocítica canina. In: Conexão Unifametro 2022 – Fortaleza – CE, 2022. Disponível em: https://doity.com.br/anais/conexaounifametro2022/trabalho/261374.
TIZARD, Ian R. Imunologia Veterinária. 9 ed. Rio de Janeiro: Elsevier, 2014.
TIZARD, Ian R. ; OLIVEIRA, Paulo Marcos Agria de. Imunologia veterinária: uma introdução. 5. ed. São Paulo: Roca, 1998.
VAIL, David M.; THAMM, Douglas H.; LIPTAK, Julius M. (Ed.). Withrow and MacEwen’s small animal clinical oncology. Saunders, 2007.
